-
Medical journals
- Career
Recidivující arytmie po katetrové ablaci původně paroxyzmální fibrilace síní a výsledky opakované ablace
: M. Fiala; J. Chovančík; R. Moravec; D. Wojnarová; H. Szymeczek; R. Neuwirth; R. Nevřalová; O. Jiravský; J. Januška; L. Škňouřil; M. Dorda; J. Indrák; J. Černý; I. Nykl; M. Branny
: Oddělení kardiologie, Kardiocentrum, Nemocnice Podlesí, a. s., Třinec, přednosta prim. MUDr. Marian Branny
: Vnitř Lék 2007; 53(12): 1248-1254
: Original Contributions
Cíl:
Cílem práce je popis arytmií recidivujících po předchozí ablaci pro paroxysmální fibrilaci síní (FS) a výsledků opakované katetrové ablace.Metodika:
Opakovanou ablaci podstoupilo 76 pacientů (18 žen, 54 ± 11 let) v 96 výkonech, což bylo 21 % z 362 pacientů, u nichž byla provedena první ablace pro paroxysmální FS. Cílovým momentem opakované ablace byla reizolace plicních žil (PŽ), ukončení spontánně běžící nebo indukované arytmie a obnovení stabilního sinusového rytmu (SR), případně dosažení nevyvolatelnosti jakékoli arytmie.Výsledky:
Klinicky byla přítomna levosíňová tachykardie (LST) u 10 (13 %) pacientů před první a u 5 (25 %) pacientů před druhou opakovanou ablací. Arytmie vycházející z arytmogenní PŽ v důsledku zotaveného vedení do levé síně (LS) byla nalezena u 50 (66 %) pacientů při první a u 7 (35 %) pacientů při druhé opakované ablaci. Arytmie převážně reentry mechanizmu vycházející většinou z volné stěny LS byla zjištěna ve 26 (34 %), respektive v 13 (65 %) při první, respektive při druhé opakované ablaci. Všechny arytmie z PŽ se ukončily obkružující ablací PŽ. Arytmie na substrátu závislé se ablací ukončily s výjimkou 2 (3 %) pacientů při prvním a 3 (15 %) pacientů při druhém opakovaném výkonu. U perzistentní FS dominovalo ukončení přes konverzi do LST. Místa ablace vedoucí k obnovení SR byla v těchto případech, stejně jako u primární LST, lokalizována převážně na přední stěně LS. Po dobu 22 ± 13 měsíců sledování je 68 (89 %) pacientů bez FS, konkrétně 54 (71 %) bez antiarytmické léčby a 14 (18 %) pacientů při léčbě antiarytmiky I. nebo III. třídy.Závěr:
Před první opakovanou ablací dominuje FS závislá na zotavení spojení arytmogenní PŽ s LS, pak se již zvyšuje zastoupení arytmií závislých na reentry arytmogenním substrátu z volné stěny LS. Klinická účinnost opakované ablace je vysoká.Klíčová slova:
fibrilace síní - katetrová ablace - recidivující arytmie - opakovaná ablaceÚvod
Katetrová ablace je v současnosti standardní metodou léčby paroxyzmální fibrilace síní (FS) u pacientů, u nichž není léčba antiarytmiky účinná nebo není z jiných důvodů vhodná [4,9,14,19,20]. Na rozdíl od jiných tachyarytmií, u nichž je riziko recidivy malé, je po ablaci FS výskyt recidivující FS nebo příbuzných arytmií a potřeba opakovaných ablací stále poměrně vysoká. Nejčastější příčinou recidivující arytmie je prosté zotavení myokardiální tkáně poškozené aplikací radiofrekvenční (RF) energie [1,17,18]. Mezi jiné důvody patří přítomnost vzácnějších zdrojů ektopické aktivity uložených mimo plicní žíly (PŽ) [12,13,16,23] nebo následný vznik arytmogenního substrátu ve volné stěně levé síně (LS) jako důsledek proarytmického účinku předchozího ablačního zákroku [3,7,8,21].
Cílem tohoto sdělení je charakteristika recidivujících tachyarytmií a jejich zdrojů a výsledků opakovaných ablací u pacientů, kteří dříve podstoupili ablaci paroxyzmální FS.
Soubor nemocných a metodika
Soubor nemocných
Z 362 pacientů, u nichž byla provedena první ablace pro paroxyzmální FS, podstoupilo opakovanou ablaci 76 (21 %) pacientů (18 žen), průměrného věku 54 ± 11 (26-79; medián 53) let v 96 výkonech. První opakovaná ablace se prováděla po 14 ± 11 (1-60; medián 10) měsících, druhá opakovaná ablace po 14 ± 6 (4-24; medián 13) měsících a jeden třetí opakovaný výkon v odstupu 4 měsíců od předchozího výkonu. Před opakovanou ablací užívalo 41 (54 %) pacientů amiodaron, 18 (24 %) pacientů sotalol a 17 (22 %) pacientů propafenon. Pacienti byli informováni o podstatě výkonu a podepsali informovaný souhlas.
První ablační výkon
Metodika elektrofyziologického vyšetření a katetrové ablace byla popsána v předchozích publikacích [4,5]. Stručně, k výkonu byl zaveden jeden 10polární katétr (Daig, St. Jude Medical, Minnetonka, MN, USA) do koronárního sinu (KS) a dva katétry po dvojité transseptální punkci do levé síně (LS) - jeden mapovací/ablační 4polární katétr se 4 mm standardní koncovou elektrodou, resp. 3,5mm chlazenou koncovou elektrodou (NaviStar nebo NaviStar ThermoCool, Biosense Webster, Diamond Bar, CA, USA) a jeden 10polární cirkulární katétr (Lasso, Biosense,Webster, Diamond Bar, CA, USA) k mapování PŽ. Po zavedení katétrů do LS se provedla angiografie PŽ a následně elektroanatomická rekonstrukce LS a PŽ. Povrchové 12svodové EKG a intrakardiální EKG signály byly zaznamenávány na zařízení Cardiolab System (Prucka Engineering, Sugar Land, TX, USA) a elektroanatomické mapování a navigace se provedly pomocí systému CARTO (Biosense Webster, Diamond Bar, CA, USA). Po provedení transseptální punkce se podal bolus heparinu s následnou kontinuální infuzí s udržováním ACT 250-400 s.
Ablační strategie sestávala z širších souvislých obkružujících lézí kolem anter PŽ spojených s úplnou izolací všech PŽ. V menšině případů byly doplněny lineární léze napříč tzv. laterálním mitrálním istmem a napříč stropem LS mezi obkružujícími lézemi. V ojedinělých případech strukturálních změn ve volné stěně LS byly provedeny další lineární léze na zadní a přední stěně LS.
Příprava pacienta před ablací a řízení léčby po ablaci
Warfarin se vysadil 5 dní před výkonem a každý den se aplikoval nízkomolekulární (LMW) heparin v léčebné dávce. Před výkonem se provedlo jícnové echokardiografické vyšetření (TEE) k vyloučení trombů v síních a zhodnocení LS a PŽ. Po výkonu se infuze heparinu ukončila a ihned se začal podávat LMW heparin až do dosažení účinné hladiny INR (2-3) při léčbě warfarinem, který byl nasazen druhý den. Antiarytmika I. nebo III. třídy se před opakovanou ablací většinou vysazovala na dobu 5 poločasů s výjimkou amiodaronu.
Opakovaný ablační výkon
K opakovanému výkonu byly zavedeny stejné katétry, takže u každého pacienta byla snímána a hodnocena elektrická aktivita 10polárním cirkulárním katétrem postupně ve všech PŽ. Součástí ablační strategie bylo, až na výjimky organizovaných selektivně mapovaných tachyarytmií, vytvoření nových širších obkružujících lézí s reizolací anter PŽ. Jinak byla strategie opakovaného výkonu šita pacientům individuálně na míru a přitom byly postupně plněny všechny cílové momenty výkonu.
Cílové momenty jednotlivých ablačních kroků
Cílový moment reizolace PŽ spočíval v eliminaci vedení mezi LS a PŽ. Ta se projeví při běžící FS úplnou eliminací vysokofrekvenční elektrické aktivity v PŽ, přičemž FS v LS pokračuje; nebo naopak pokračuje izolovaná tachykardie v PŽ při současném obnovení SR v LS (obr. 1). Izolace PŽ byla vždy na konci výkonu hodnocena při SR nebo stimulaci KS resp. ouška LS jako vymizení elektrické aktivity v PŽ a byla dále podporována přítomností izolované ektopické aktivity v PŽ.
1. Ukončení recidivující perzistentní FS udržované tachykardií z PŽ. 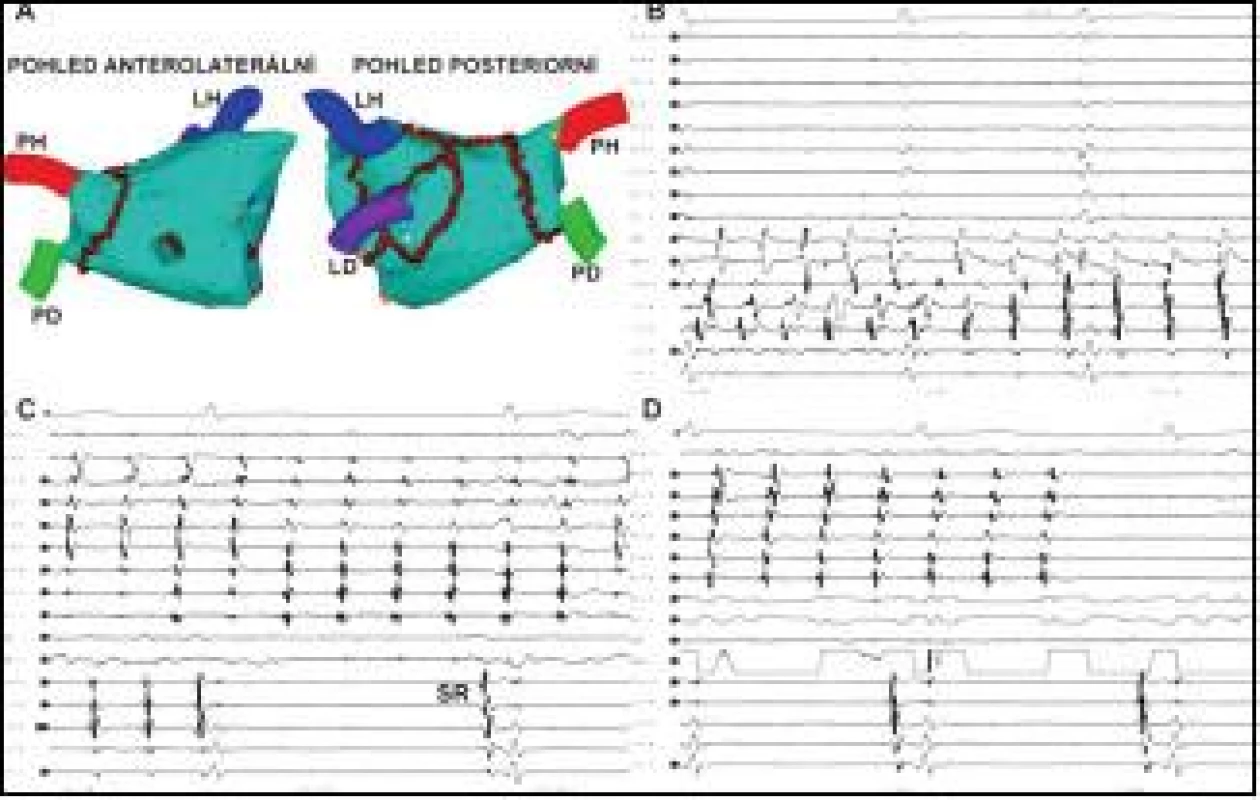
Na obrázku A je trojrozměrná elektroanatomická rekonstrukce LS, v níž jsou hnědými body značeny jednotlivé aplikace RF energie řazené do souvislých obkružujících lézí kolem anter jednostranných PŽ, doplněné o lineární léze ve stropě LS a napříč tzv. laterálním mitrálním isthmem v prevenci LST. Na obrázku B je po plné elektrické izolaci levostranných PŽ (PV 1–2 – PV 9–10) snímána neorganizovaná fibrilatorní aktivita v koronárním sinu (CS 1,2 – CS 9,10) a v ablačním katétru (ABL, ABL d). Na obrázku C je zachycen moment dosažení úplné izolace arytmogenní pravé horní PŽ, v níž pokračuje reziduální vcelku organizovaná tachykardie (PV 1–2 – PV 9–10), zatímco v LS došlo k restauraci SR (viz aktivita v CS 1,2 – CS 9,10). Na obrázku D je zobrazen okamžik ukončení tachykardie v PŽ šetrnou aplikací RF energie v antru PŽ. LH, LD, PH, PD – levá horní a dolní a pravá horní a dolní plicní žíla, MP – mitrální prstenec, SR – sinusový rytmus. Posun EKG je 200 mm/s. Cílovým momentem individuální RF aplikace při vytváření lineární léze byla eliminace nebo zmenšení lokálního elektrického potenciálu o 80 %. Výsledně po dokončení lineární léze byla cílem úplná eliminace elektrických potenciálů, resp. přítomnost dvojitého potenciálu odděleného dlouhým intervalem podél celé ablační linie, případně absence elektrické aktivity v kompartmentu ohraničeném lineárními lézemi.
Cílovým momentem ablace v KS byla buď eliminace lokálních potenciálů v části KS, obrácení aktivační sekvence v KS při SR nebo rozštěp s oddělením sousedních potenciálů v KS dlouhým časovým intervalem [4,5].
Cílový moment ablačního výkonu
Cílovým momentem výkonu bylo ukončení spontánní nebo vyvolatelné arytmie a obnovení SR aplikacemi RF energie. Pokud se nedařilo FS ukončit, byla snaha ji alespoň zorganizovat do monomorfní LS tachykardie (LST). Jestliže se nepodařilo obnovit SR, podal se intravenózně propafenon a provedla se elektrická kardioverze. Ve většině případů paroxyzmální FS a paroxyzmální i perzistentní LST byla na konci výkonu testována (a většinou dosažena) nevyvolatelnost arytmie stimulací síní do 300-350/min, tento manévr ale nebyl prováděn konzistentně.
Postup u paroxyzmální FS
V případě běžící FS resp. incesantních repetitivních běhů FS s jasnou ektopickou aktivitou v jedné nebo více PŽ byla provedena reizolace PŽ a pokud se při ní ektopická aktivita izolovala, respektive eliminovala a případně nebyla následně stimulací síní do 300-350/min vyvolána žádná tachyarytmie, výkon byl ukončen.
V případě, že běžící FS přetrvávala i po reizolaci PŽ, byly připojeny první 2-3 standardní lineární léze napříč laterálním mitrálním istmem a stropem LS a následně případně další lineární léze napříč posteroseptálním mitrálním istmem, na přepážce od pravé horní PŽ k foramen ovale, resp. na přední stěně LS od horního okraje mitrálního prstence do stropu LS kolem septálního okraje ouška LS [5]. V případě přetrvávající organizované FS nebo monomorfní LST se provedly selektivní fokální léze ve volné stěně LS a případně v KS až do eventuálního dosažení SR.
V případě SR byla vždy snaha vyvolat FS stimulací síní a pak pokračovat jako v případě běžící FS. Pokud nebyla vyvolatelná setrvalá FS, provedly se širší obkružující léze s reizolací PŽ a doplnily se 2-3 standardní lineární léze.
Paroxyzmální LST
U pacientů s dokumentovanou LST se vždy tato vyvolala stimulací síní. Pokud byla LST stabilní, mapovala se selektivně elektroanatomicky a provedla se cílená ablace kritického istmu reentry okruhu nebo fokálního zdroje (obr. 3). Následně byla připojena ev. reizolace PŽ a ověřena nevyvolatelnost tachyarytmie stimulací síní do 300-350/min. V případě mnohočetných střídajících se nemapovatelných LST byla provedena substrátová ablace s obkružujícími lézemi s reizolací PŽ a lineárními lézemi s cílem obnovit SR.
2. Recidivující levosíňová makroreentry tachykardie rotující kolem PŽ. 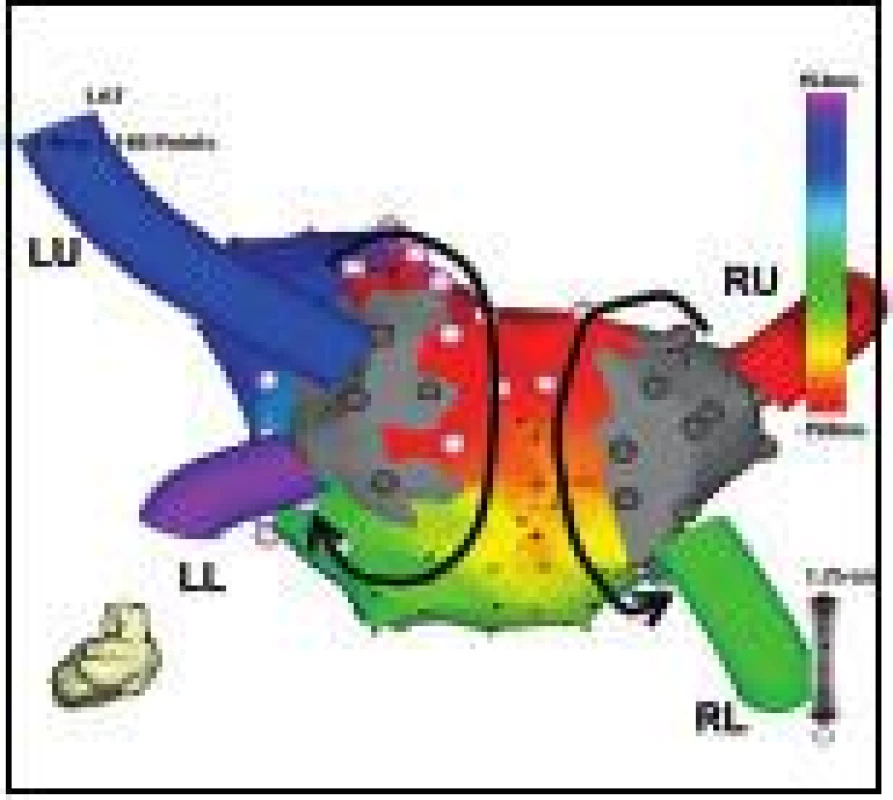
Pohled na zadní stěnu LS zrekonstruované elektroanatomicky při běžící tachykardii. Po předchozí ablaci jsou plně izolovány obě stejnostranné dvojice PŽ (elektricky němá antra PŽ jsou kódována šedou barvou) a vytvářejí elektricky neaktivní bariéry, kolem nichž rotuje elektrická aktivace ve formě dvojitého makroreentry okruhu (schématicky znázorněno šipkami. Ablace napříč stropem LS spojující horní PŽ eliminovala tuto tachykardii. Zkratky jako na obr. 1. Perzistentní LST
Při ablaci perzistentní LST se postupovalo stejně jako při vyvolané paroxyzmální LST. Cílem výkonu bylo ukončení arytmie a nastolení SR samotnou ablací a zvláště při druhé opakované ablaci se často ověřovala nevyvolatelnost arytmie stimulací síní.
Perzistentní FS
Ablace perzistentní FS sestávala z obkružujících lézí s reizolací anter PŽ a obvykle komplexních lineárních lézí popsaných výše s cílem ukončit arytmii a nastolit SR. Nevyvolatelnost arytmie stimulací síní se většinou neověřovala.
Incesantní síňová extrasystolie
Incesantní síňová extrasystolie (SES) byla mapována pomocí cirkulárního katétru a případně elektroanatomicky (obr. 2) a cílena selektivní ablací, respektive v případě lokalizace v antru PŽ byla fokální ablace doplněna o obkružující lézi kolem dotyčného antra PŽ.
3. Recidivující incesantní bigeminická síňová extrasystolie. 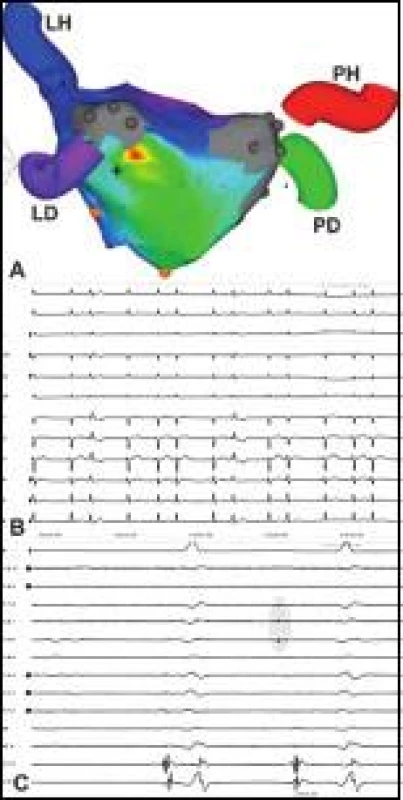
Pacient v minulosti podstoupil komplexní opakovanou ablaci FS, což zřejmě bránilo spuštění skutečné FS, nicméně neodstranilo symptomatickou trvale bigeminickou extrasystolii (B). Aktivační elektroanatomická mapa LS (pohled na zadní stěnu) vytvořená mapováním extrasystolie odhaluje ektopické ložisko na rozhraní antra levých PŽ a inferolaterální stěny LS – časná aktivace je v barevném spektru kódována červeně (A). Cirkulární katétr přesunutý z nitra PŽ (všechny PŽ byly plně izolovány) do oblasti ektopického ložiska snímá při extrasystole v místě jejího vzniku časné miniaturní ektopické potenciály (PV 5–6 až PV 7–8) označeny šedou zónou) (C). Fokální ablace ektopického ložiska, nejpravděpodobněji vycházející z epikardiální Marshallovy žíly (či ligamenta), trvale odstranila arytmii a nastolila stabilní SR. Ostatní zkratky jako na obr. 1. Péče o pacienta po ablaci
Po ablaci se standardně prováděla transtorakální echokardiografie na vyloučení výpotku v perikardu. Léčba warfarinem, která se vracela druhý den po výkonu, pokračovala nejméně 6 týdnů až 3 měsíce a poté se vysadila v případě trvalého SR. Antiarytmika I. či III. třídy, pokud nebyla vysazena před výkonem, se ponechala v dosavadní nebo snížené dávce a podle klinického výsledku se jejich podávání ukončilo po 6 týdnech až 3 měsících po ablaci.
Sledování
Pacienti byli pravidelně sledováni ambulantně, a to v 1. roce po 6 týdnech a po 3, 6, 9 a 12 měsících a následně jednou za 6 měsíců. Kontroly byly zaměřeny na arytmické příznaky, hodnocení 12svodového EKG a pravidelného 24hodinového Holterova EKG záznamu. Podle potřeby se provedlo transtelefonní monitorování EKG. Hodnotily se také údaje a EKG dokumentace z kontrol u místních kardiologů a internistů. Klinická účinnost výkonu se začala hodnotit po uplynutí prvních 6 týdnů po ablaci. Podle potřeby se po 3-6 měsících provádělo kontrolní TEE vyšetření zaměřené na vyloučení stenózy PŽ a na zhodnocení funkce síní a levé komory.
Statistické hodnocení
Číselné hodnoty byly vyjádřeny jako průměr ± směrodatná odchylka, respektive medián. Hodnota p ≤ 0,05 byla považována za statisticky významnou.
Výsledky
První opakovaný výkon
Arytmie spojená s aktivitou PŽ
Jedna nebo více jasně nebo suspektně arytmogenních PŽ se obnoveným vedením mezi PŽ a LS byla nalezena u 50 (66 %) pacientů. FS vyvolaná nebo přítomná při vyšetření ve formě incesantních přerušovaných epizod nebo v setrvalé formě byla ukončena a eliminována u všech pacientů (obr. 1). K ukončení a trvalému odstranění arytmie došlo u 31 pacientů při ablaci levostranných PŽ a u 19 pacientů při ablaci pravostranných PŽ. Formy arytmie, při nichž byla ablace prováděna, jsou uvedeny v tab. 1.
1. Arytmie při první opakované ablaci. 
Arytmie spojená s arytmogenním substrátem ve volné stěně LS
Arytmie závislá na substrátu ve volné stěně LS byla nalezena u 26 pacientů. U 4 z těchto pacientů byla přítomno i zjevné obnovení vedení mezi PŽ a LS, ale reizolace neměla vliv na běžící spontánní (n = 3) nebo indukovanou (n = 1) arytmii. U 2 pacientů s perzistentní FS se nepodařilo obnovit SR a FS byla pouze zkonvertována do LST, která musela být na konci výkonu ukončena elektrickou kardioverzí. U jiných 2 pacientů nebyla indukovatelná žádná setrvalá arytmie, nebyla přítomna ani zjevná ektopie ani elektrická aktivita v PŽ a substrátová ablace byla provedena při SR (tab. 1).
Ze 4 spontánních (n = 1) nebo indukovaných (n = 3) epizod PFS byly 3 ukončeny přímo z FS při ablaci posteroseptálního mitrálního istmu a 1 byla ukončena přes konverzi do LST v oblasti Bachmannova svazku.
Z 9 ukončených perzistentních FS ve všech případech došlo nejprve ke konverzi do LST, která byla zastavena ablací septálně od ouška LS (n = 4), v oblasti Bachmannova svazku (n = 2), na laterálním mitrálním ismu (n = 1), v KS (n = 1), obr. 4, a v jizevnaté laterální stěně pravé síně (n = 1).
4. Reziduální reentry tachykardie vycházející z myokardu koronárního sinu. 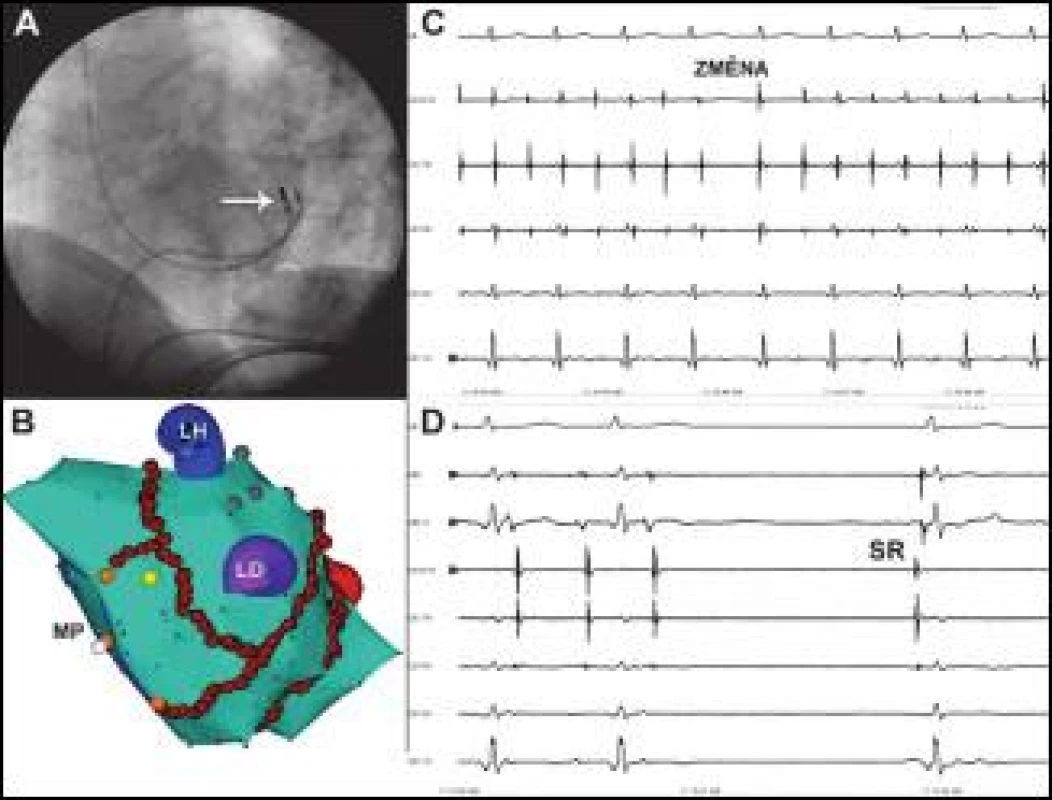
Na obr. C je zobrazen stav po organizaci recidivující FS do monomorfní tachykardie a okamžik přechodu (ZMĚNA) jedné tachykardie se septo-laterální aktivační sekvencí v KS do druhé tachykardie o stejné frekvenci s aktivační sekvencí latero-septální (CS 1,2 – CS 9,10) při manipulaci katétrem v KS. Jedná se o perzistentní pár střídajících se reentry tachykardií rotujících koronárním sinem v opačném směru. Na obrázku D je moment, kdy aplikace RF energie ukončuje tachykardii a nastoluje sinusový rytmus (SR). Místo podání je v hluboko v žilním systému ve velké srdeční žíle, skiaskopická poloha katétru (označená šipkou) je na obrázku C a korespondující místo na elektroanatomické mapě (ale epikardiálně) je vyznačeno žlutým bodem na obrázku D. ABL a ABL d jsou záznamy z proximálního a distálního bipólu ablačního katétru, MP – mitrální prstenec, ostatní zkratky jako na obr. 1. Posun EKG na obrázku C je 100 mm/s a na obrázku D 200 mm/s. Perzistentní (n = 6), respektive indukovaná epizoda paroxyzmální (n = 3) LST byla ukončena v oblasti Bachmannova svazku (n = 6), ve stropě LS (n = 1), obr. 3, septálně od ústí ouška LS (n = 1), nad ústím ouška LS (n = 1), ablací posteroseptálního mitrálního istmu (n = 1) a laterálního mitrálního istmu (n = 1).
Druhý opakovaný výkon
Arytmie spojená aktivitou PŽ
Druhý výkon podstoupilo 20 (6 %) pacientů. Formy arytmie, při nichž byla ablace prováděna, jsou uvedeny v tab. 2. Arytmie závislá na zotavení spojení mezi arytmogenní PŽ a LS byla nalezena u 7 (35 %) pacientů. Spontánní, respektive indukovaná epizoda paroxyzmální FS byla ukončena při reizolaci levé společné PŽ u 1 pacienta, levé dolní PŽ u 1 pacienta, pravé horní PŽ u 1 pacienta a pravé dolní PŽ u 2 pacientů. Kromě toho byla u dvou pacientů odstraněna incesantní ektopická aktivita vycházející ze zadní dolní části antra levých PŽ, jejímž zdrojem bylo pravděpodobně Marshallovo ligamentum (obr. 2).
2. Arytmie při druhé opakované ablaci. 
Arytmie spojená s arytmogenním substrátem ve volné stěně LS
U všech 5 pacientů se spontánní nebo indukovanou epizodou paroxyzmální FS došlo při ablaci nejprve ke konverzi FS na LST, která pak byla u 4 pacientů ukončena při ablaci; ve stropě LS (n = 2), na levé straně přepážky (n = 1) a na septálním okraji ústí do ouška LS (n = 1). U 1 pacienta byla LST ukončena podáním propafenonu.
U 2 pacientů s perzistentní FS byla FS zkonvertována do LST a následně byl obnoven SR ablací v KS u 1 pacienta, zatímco u druhého byla provedena elektrická kardioverze.
Perzistentní (n = 4) nebo indukovaná (n = 1) LST byla ve 4 případech ukončena ablací nad ústím ouška LS (n = 2), v KS (n = 1) a v oblasti Bachmannova svazku (n = 1), a u 1 pacienta byla ukončena elektrickou kardioverzí.
Ve třetí opakované ablaci u 1 pacienta byla úspěšně ukončena perzistentní LST ablací nad ouškem LS.
Dlouhodobé výsledky
Doba sledování od posledního ablačního výkonu je 22 ± 13 (2-52) měsíců. 54 (71 %) pacientů je bez symptomů a bez dokumentované recidivy arytmie bez antiarytmické léčby. Dalších 14 (18 %) pacientů je bez arytmie při léčbě antiarytmiky I. nebo III. třídy, přičemž tato léčba byla nasazena pro reziduální, vesměs sporadické krátkodobé arytmie nebo pro subjektivně vnímanou síňovou extrasystolii. Celkem tak zůstává bez recidiv síňové tachyarytmie 68 (89 %) pacientů. Dalších 6 (8 %) pacientů zaznamenalo redukci výskytu arytmie, svůj klinický stav považují za výrazně zlepšený a opakovanou ablaci zatím nepovažují za nutnou. Klinické zlepšení nezaznamenali 2 (3 %) pacienti, u kterých se nakonec rozvinula permanentní forma FS nebo LST. Antiarytmika I. nebo III. třídy užívá 22 (29 %) pacientů, přičemž amiodaron byl ponechán u 8 (11 %) pacientů.
Diskuse
Analýza příčin recidiv síňové tachyarytmie po předchozí první ablaci paroxyzmální FS přinesla tyto hlavní výsledky:
- hlavním mechanizmem recidivy FS po jednom výkonu je zotavení myokardu a obnovené vedení mezi arytmogenní PŽ a LS;
- v mechanizmu recidiv po dvou ablačních výkonech již převažuje závislost na tzv. arytmogenním substrátu z volné stěny LS;
- klinickou recidivující tachyarytmií je převážně FS, zastoupení LST vzrůstá s počtem opakovaných výkonů a jejich mechanizmem je až na výjimky reentry z volné stěny LS;
- cílový moment ukončení běžící tachyarytmie lze docílit ve většině případů;
- většina na substrátu závislých FS se ukončí při stupňované ablaci přes přechodnou monomorfní LST;
- LST, ať už primární nebo do níž se při ablaci FS konvertuje, se ve většině případů ukončí ablací na přední stěně LS.
Obnovené spojení arytmogenní PŽ a LS
V předchozích studiích byla prokázána poměrně vysoká incidence obnoveného vedení mezi PŽ a LS [1]. Byla nalezena souvislost mezi zotaveným vedením PŽ-LS a recidivou arytmií až u 80 % pacientů podstupujících opakovanou ablaci pro recidivující paroxyzmální FS [17,18]. Jen u menší části pacientů byla příčinou mimožilní ektopická aktivita a reentry tachykardie.
Také tato práce ukázala, že dominantním mechanizmem recidivující FS u pacientů s paroxyzmální FS po jedné ablaci je zotavení myokardu v místě obkružujících lézí kolem anter PŽ a obnovení vedení elektrického potenciálu, respektive obnovení průniku ektopické aktivity z PŽ do LS. Patofyziologické příčiny a zdrojová místa arytmie byla v tomto případě shodná s příčinami původními a léčba spočívala v prosté reizolaci arytmogenní PŽ. Význam PŽ v mechanizmu recidivující arytmie s počtem opakovaných výkonů klesal, zotavené vedení mezi PŽ a LS bylo při 1. opakované ablaci nalezeno v příčinné souvislosti s recidivou tachyarytmie u 66 % pacientů, při 2. opakované ablaci již jen u 35 % pacientů.
Arytmogenní substrát mimo PŽ
Jako zdroj recidivující arytmie z volné stěny LS dominuje reentry mechanizmus. Může existovat již před 1. ablací jako produkt přestavby myokardu LS vazivem nebo ukládání amyloidu, častěji je však nechtěným následkem předchozí ablační strategie. Tyto arytmie se často projevují již nikoli jako neorganizovaná fibrilatorní aktivace síní, ale jako monomorfní LST. Vzácněji je zdrojem tachykardie svalovina KS nebo pravá síň. Tyto monomorfní tachykardie byly popsány ve 3-25 % případů recidivující arytmie. Jejich mechanizmem může být mikroreentry, lokalizované reentry a makroreentry využívající převodní mezery v ablačních liniích, které vznikly v důsledku zotavení myokardu [3,7,8,11,21]. Výskyt těchto LST narůstá u pacientů s ablací permanentní FS, kde je ablační strategie složitější a riziko převodních mezer větší [5,11]. Některé makroreentry okruhy vyžadují k odstranění lineární léze, zdroj jiných je poměrně lokalizovaný a je odstranitelný i fokální ablací [10,22]. Uložení kritických míst reentry okruhů je různé, lze je nalézt i na přední stěně LS nebo v KS [2,5,15].
V této práci byla již při 1. výkonu poměrně často (ve 34 %) prokázána efektivní izolace PŽ a závislost arytmie na tzv. arytmogenním substrátu z LS. Zastoupení arytmií vznikajících mimo PŽ vzrostl na 65 % při 2. opakované ablaci. Mimožilní ektopická ložiska byla nalezena vzácně. Nejčastější byl mechanizmus makroreentry nebo lokálního reentry s kritickým místem reentry okruhu lokalizovaným na přední stěně LS, vzácněji v KS nebo v pravé síni změněné idiopatickým vazivovým procesem [6].
Účinnost, mechanizmus a místa ukončení běžící arytmie
Běžící FS závislá na aktivitě PŽ se prakticky bez výjimky ukončí při účinné izolaci arytmogenní PŽ. V tomto případě se FS ukončí zpravidla přímo bez přechodné LST. Někdy lze těsně před dokončením izolace PŽ pozorovat pokračující více či měně pravidelnou ektopickou tachykardii, která může po dosažení úplné izolace přetrvávat v disociaci od SR v síních. Recidivující FS reentry vycházející z volné stěny LS je ukončitelná také s vysokou úspěšností. Typickým fenoménem je konverze FS do přechodné LST, která předchází obnovení SR. Dosažení tohoto cílového momentu vyžaduje poměrně rozsáhlou ablační strategii. Místa ablace vedoucí k obnovení SR jsou podobná pro přechodné LST, do nichž se FS konvertuje, stejně jako pro LST, které jsou přítomny primárně. Jsou často na přední stěně LS kolem ouška, v oblasti Bachmannova svazku a dokonce i uvnitř KS. Jedná se o místa, která byla popsána i při úspěšném ukončení perzistentní FS [5,11].
Závěr
Recidivy arytmie po předchozí ablaci paroxyzmální FS jsou poměrně časté. Nejčastějším mechanizmem je prosté zotavení ablační linie obkružující arytmogenní PŽ a její obnovené spojení s myokardem LS. Tento mechanizmus dominuje při prvním opakovaném výkonu. U recidiv arytmie po již opakované ablaci dominuje reentry z volné stěny LS, jehož odstranění vyžaduje komplexní ablaci LS respektive i dalších struktur jako KS nebo pravé síně. Úspěšnost opakovaných ablací j vysoká, nálezy při nich obohacují naše informace o patofyziologii FS a do budoucna společně s rozvojem technologií pomáhají dále zvyšovat efektivitu již první ablace a snížit potřebu opakovaných ablací.
MUDr. Martin Fiala, Ph.D.
www.nempodlesi.cz
e-mail: martin.fiala@nempodlesi.cz
Doručeno do redakce: 31. 5. 2007
Přijato po recenzi: 9. 8. 2007
Sources
1. Cappato R, Negroni S, Pecora D et al. Prospective assessment of late conduction recurrence across radiofrequency lesions producing electrical disconnection at the pulmonary vein ostium in patients with atrial fibrillation. Circulation 2003; 108 : 1599-1604.
2. Chung A, Oral H, Good E et al. Catheter ablation of atypical atrial flutter and atrial tachycardia within the coronary sinus after left atrial ablation for atrial fibrillation. J Am Coll Cardiol 2005; 46 : 83-91.
3. Daoud EG, Weiss R, Augostini R et al. Proarrhythmia of circumferential left atrial lesion for management of atrial fibrillation. J Cardiovasc Electrophysiol 2006; 17 : 157-165.
4. Fiala M, Chovančík J, Heinc P et al. Léčba symptomatické intermitentní fibrilace síní katetrovou ablací v levé srdeční síni: bezprostřední a dlouhodobé výsledky u 150 pacientů. Vnitř Lék 2005; 51 : 971-983
5. Fiala M, Chovančík J, Neuwirth R et al. Katetrová ablace pro chronickou fibrilaci síní metodou obkružujících a komplexních lineárních lézí v levé srdeční síni: ukončení arytmie při ablaci a dlouhodobé klinické výsledky. Vnitř Lék 2007; 3 : 231-241.
6. Fiala M, Chovančík J, Neuwirth R et al. Atrial macroreentry tachycardia in patients without obvious structural heart disease or previous cardiac surgical or catheter intervention: characterization of arrhythmogenic substrates, reentry circuits, and results of catheter ablation. J Cardiovasc Electrophysiol 2007; 18 : 824-832.
7. Gerstenfeld EP, Callans DJ, Dixit S et al. Mechanism of organized left atrial tachycardias occurring after pulmonary vein isolation. Circulation 2004; 110 : 1351-1357.
8. Gerstenfeld EP, Marchlinski FE Mapping and ablation of left atrial tachycardias occurring after atrial fibrillation ablation. Heart Rhythm. 2007; 4(Suppl.): S65-S72.
9. Haïssaguerre M, Jaïs P, Shah DC et al. Electrophysiological endpoint for catheter ablation of atrial fibrillation initiated from multiple pulmonary venous foci. Circulation 2000; 101 : 1409-1417.
10. Haïssaguerre M, Hocini M, Sanders P et al. Localized sources maintaining atrial fibrillation organized by prior ablation. Circulation 2006; 113 : 616-625.
11. Haïsssaguerre M, Sanders P, Hocini M et al. Catheter ablation of long-lasting persistent atrial fibrillation: critical structures for termination. J Cardiovasc Electrophysiol 2005; 16 : 1125-1137.
12. Hsieh MH, Tai CT, Tsai CF et al. Clinical outcome of very late recurrence of atrial fibrillation after catheter ablation of paroxysmal atrial fibrillation. J Cardiovasc Electrophysiol 2003; 14 : 598-601.
13. Hsu LF, Jaïs P, Keane D et al. Atrial fibrillation originating from the persistent left superior vena cava. Circulation 2004; 109; 828-832.
14. Jaïs P, Hocini M, Sanders P et al. Long-term evaluation of atrial fibrillation ablation guided by noninducibility. Heart Rhythm 2006; 3 : 140-145.
15. Jaïs P, Sanders P, Hsu LF et al. Flutter localized to the anterior left atrium after catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol 2006; 17 : 279-285.
16. Kamanu S, Tan AY, Peter CT et al. Vein of Marshall activity during sustained atrial fibrillation. J Cardiovasc Electrophysiol 2006; 17 : 839-846.
17. Lemola K, Hall B, Cheung P et al. Mechanisms of recurrent atrial fibrillation after pulmonary vein isolation by segmental ostial ablation. Heart Rhythm 2004; 1 : 197-202.
18. Ouyang F, Antz M, Ernst S et al. Recovered pulmonary vein conduction as a dominant factor for recurrent atrial tachyarrhythmias after complete circular isolation of the pulmonary veins: lessons form the double Lasso technique. Circulation 2005; 111 : 127-135.
19. Ouyang F, Bänsch D, Ernst S et al. Complete isolation of the left atrium surrounding the pulmonary veins: new insights from the double-lasso technique in paroxysmal atrial fibrillation. Circulation 2004; 110 : 2090-2096.
20. Pappone C, Oreto G, Rosanio S et al. Atrial electroanatomic remodelling after circumferential radiofrequency pulmonary vein ablation. Efficacy of an anatomic approach in a large cohort of patients with atrial fibrillation. Circulation 2001; 104 : 2539-2544.
21. Pappone C, Manguso F, Vicedomini G et al. Prevention of iatrogenic atrial tachycardia after ablation of atrial fibrillation. Circulation 2004; 110 : 3036-3042.
22. Shah DC, Sunthorn H, Burri H et al. Narrow, slow-conducting isthmus dependent left atrial reentry developing after ablation of atrial fibrillation: ECG characterization and elimination by focal ablation. J Cardiovasc Electrophysiol 2006; 17 : 508-515.
23. Tsai CF, Tai CT, Hsieh MH et al. Initiation of atrial fibrillation by ectopic beats originating from the superior vena cava. Circulation 2000; 102 : 67-74.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2007 Issue 12-
All articles in this issue
- Recurrent arrhythmias after catheter ablation of originally paroxysmal atrial fibrillation and results of repeat ablation
- Bacterial infection and its relation to the genesis and course of varicose hemorrhage
- Prolactine response to stress in patients with systemic lupus erythematodes (SLE), rheumatoid arthritis (RA) and in healthy controls
- The treatment of hyperglycaemia in critically ill patients: comparison of standard protocol and computer algorithm
- The etiology of upper gastrointestinal bleeding in patients with liver cirrhosis
- Differences in Ulcer Location in Diabetic Foot Syndrome
- Monitoring functional disorders of microcirculation using laser Doppler flowmetry in patients with chronic venous insufficiency class 2 according to CEAP classification before and after varicose veins surgery
- Celiac disease – a frequent cause of „idiopathic osteoporosis“ in premenopausal and early postmenopausal women
- Dobutamin exercise echocardiography versus SPECT in diagnosing ischemic heart disease
- Diabetes mellitus and microalbuminuria
- Current view on the risks of artificial pulmonary ventilation
- Waldenström macroglobulinemia – clinical manifestations and differential diagnosis and prognosis of the disease
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Current view on the risks of artificial pulmonary ventilation
- Recurrent arrhythmias after catheter ablation of originally paroxysmal atrial fibrillation and results of repeat ablation
- Waldenström macroglobulinemia – clinical manifestations and differential diagnosis and prognosis of the disease
- Diabetes mellitus and microalbuminuria
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

