-
Medical journals
- Career
Hladina kortizolu souvisí s depresivitou a jinými psychopatologiemi více než hladiny katecholaminů
Authors: Z. Hess 1; J. Podlipný 2; H. Rosolová 1; O. Topolčan 3; B. Petrlová 1
Authors‘ workplace: II. interní klinika Lékařské fakulty UK a FN Plzeň, přednosta doc. MUDr. Jan Filipovský, CSc. 1; Psychiatrická klinika Lékařské fakulty UK a Plzeň, přednosta doc. MUDr. Jiří Beran, CSc. 2; Oddělení imunoanalýzy Lékařské fakulty UK a FN Plzeň, přednosta prof. MUDr. Ondřej Topolčan, CSc. 3
Published in: Vnitř Lék 2007; 53(10): 1040-1046
Category: Original Contributions
Overview
Cíl:
Kvantifikovat změny v hladinách uvedených hormonů, tzn. kortizolu, adrenalinu, noradrenalinu a dopaminu, v závislosti na přítomnosti depresivních symptomů a jiných psychopatologických symptomů.Soubor:
259 náhodně vybraných jedinců z plzeňské populace.Metodika:
K posouzení depresivity a dalších psychopatologií byla použita Zungova sebeposuzovací škála deprese a dotazník SCL-90. Byl stanoven kortizol v séru a dále kortizol a katecholaminy (adrenalin, noradrenalin a dopamin) ve sběru moči za 24 hod. Sledovaný soubor byl rozdělen na skupinu s vyšším a nižším vylučováním sledovaných hormonů dle arbitrárně stanovené hranice.Výsledky:
Skupina s vylučováním kortizolu nad 300 nmol/24 hod skóruje signifikantně výše v dimenzích interpersonální senzitivity, deprese, úzkosti, fobie, paranoidity a psychoticizmu dotazníku SCL-90 v porovnání se skupinou s vylučováním kortizolu pod 300 nmol/24 hod (p < 0,05). Skupina s vylučováním kortizolu nad 300 nmol/24 hod skóruje rovněž signifikantně výše v Zungově sebeposuzovací škále deprese v porovnání se skupinou s vylučováním kortizolu pod 300 nmol/24 hod (p < 0,05). Při rozdělení souboru podle skóre v Zungově sebeposuzovací škále deprese (SDS index ≥ 50) mají ženy s přítomností depresivních symptomů statisticky významně vyšší vylučování kortizolu do moči za 24 hod (průměr 219,40 oproti 191,64 nmol/24, p = 0,02). U skupiny mužů s depresivními symptomy podle dosaženého skóre v Zungově sebeposuzovací škále deprese byl nalezen pouze trend k vyššímu vylučování noradrenalinu do moči za 24 hodin (průměr 69,77 oproti 63,84 µg/24 hod, p = 0,17).Závěr:
Na základě výše uvedených výsledků souvisí vylučování kortizolu do moči za 24 hodin se sledovanými parametry psychického stavu.Klíčová slova:
deprese - kortizol - katecholaminyÚvod
Depresivní porucha neboli patologický smutek má různou intenzitu, a proto je dělena na mírnou, střední a těžkou. Projevuje se více než 2 týdny trvajícími příznaky, mezi které patří: smutek po většinu dne, snížení zájmu ve většině denních aktivit, insomnie nebo hypersomnie, psychomotorická retardace nebo agitovanost, změny chutě k jídlu, neúmyslný úbytek nebo přírůstek hmotnosti, únava nebo ztráta energie po většinu dne, pocit bezcennosti nebo viny, problémy s koncentrací a snížená schopnost myslet nebo nerozhodnost, myšlenky na smrt nebo sebevražedné tendence [1].
Existuje několik patofyziologických teorií vzniku deprese. Základ k monoaminové teorii byl položen v roce 1952, kdy byla prokázána schopnost iproniazidu inhibovat monoaminooxidázu (MAO) [2]. Monoaminooxidáza se účastní vnitrobuněčné degradace monoaminergních transmiterů, její inhibicí by tedy mělo docházet ke zvýšení koncentrace monoaminů. Tento enzym má dvě izoformy: A a B. Izoforma A preferenčně odbourává serotonin, noradrenalin a adrenalin, izoforma B pak beta-fenyletylamin a benzylamin [3]. Obě formy potom degradují dopamin, tyramin a tryptamin. V lidském mozku je více přítomna izoforma B (75 %) [4]. Inhibitory monoaminooxidázy A jsou používány jako antidepresiva. Inhibitory izoformy B jsou užívány v léčbě parkinsonizmu.
Z monoaminů se největší role v etiologii deprese připisuje noradrenalinu a 5-hydroxytryptaminu (neboli serotoninu) [5]. „Serotoninová“ teorie je podepřena antidepresivním působením inhibitorů zpětného vychytávání (reuptake) serotoninu (tzv. SSRI preparáty), „noradrenalinová“ pak antidepresivním působením inhibitorů zpětného vychytávání noradrenalinu (NRI - reboxetin). Konečně pak existují farmakologické preparáty, které kombinují účinky na více neurotransmiterových a receptorových systémů, např. TCA (tricyklická antidepresiva s blokádou reuptake noradrenalinu, ale současně s mohutným anticholinergním a antihistaminovým efektem), SNRI (serotonin and noradrenalin reuptake inhibitors), NDRI (noradrenalin dopamin reuptake inhibitors), NaSSA (noradrenalin and specific serotonergic antidepressants) a další.
Narušení metabolizmu serotoninu, který má modulační funkce, může vést k úzkosti, hostilitě, iritabilitě, impulzivitě, agitovanosti, suicidialitě a dalším změnám. Poruchy na úrovni noradrenalinu, který má aktivační funkce, mohou vést k únavě, apatii, nedostatku iniciativy, anhedonii, nevýkonnosti, nesoustředěnosti. Poruchy v systému dopaminu, čili v systému odměny, vedou k poruchám chuti k jídlu, poruchám libida, poklesu nálady, zájmu, motivace a pozornosti.
S depresí je také spojena alterace funkce hormonální osy hypotalamus-hypofýza-nadledvinky (HPA osy) [6]. Ta vykazuje zvýšenou aktivitu u osob vystavených stresu a u některých depresivních pacientů [7]. Sekrece kortizolu je kontrolována hypofyzárním adrenokortikotropním hormonem (ACTH), ten zase kortikotropin-releasing hormonem (CRH) produkovaným hypotalamem. Je důležité zmínit, že do řízení sekrece CRH je zapojen centrální serotonin. Působí zde účinný mechanizmus zpětné vazby, jehož výsledkem by měla být víceméně ustálená hladina kortizolu v periferní krvi. Tato hladina vykazuje během 24hodinového cyklu výkyvy (vyšších hodnot dosahuje v dopoledních hodinách) [8]. Sledování množství kortizolu vyloučeného do moči za 24 hod odpovídá aktivitě HPA osy.
Cílem naší studie bylo najít souvislost mezi vylučováním kortizolu a katecholaminů do moči a depresivitou měřenou sebeposuzovacími škálami, resp. s jinými psychopatologiemi hodnocenými dle dotazníků v populačním vzorku. Snahou bylo také najít vhodný biologický marker, měřitelný dostupným laboratorním vyšetřením, který by mohl odhalit změnu psychického stavu pacienta.
Soubor a metodika
Sledovaný soubor tvořilo 259 relativně zdravých jedinců náhodně vybraných z plzeňské populace na základě databáze epidemiologické studie MONICA [9]. Vybranému vzorku populace byla poštou zaslána Zungova sebeposuzovací škála deprese (ZSDS) a dotazník SCL-90 (Symptom Check List-90).
Jako kritérium pro konstatování deprese jsme zvolili Zungovu sebeposuzovací škálu s hodnotou SDS indexu ≥ 50 [10]. SDS (Self Depression Scale) index je výstupem ZSDS a vyjadřuje v podstatě míru depresivity (čím vyšší je hodnota SDS indexu, tím vyšší je depresivita daného subjektu). Dotazník se skládá z 20 otázek, které jsou zaměřeny na symptomy typické pro depresivní poruchu. Otázky jsou v 10 případech formulovány symptomaticky pozitivně a v 10 negativně a dle toho pak probíhá škálování na stupnici 1 - 4, kdy 1 znamená odpověď „nikdy nebo zřídka“, 2 „někdy“, 3 „dosti často“ a 4 „velmi často“. Např. otázka č. 1.: „Jsem smutný, skleslý a zkroušený“ se při odpovědi „nikdy, nebo zřídka“ započítává jako 1, zatímco otázka č. 2: „Ráno se cítím nejlépe“ je při stejné odpovědi skórována jako 4. Tímto způsobem méně „depresivní“ v ZSDS skórují níže. SDS index se získá vydělením sumy dosaženého skóre 80, což je maximální možné skóre, kterého lze dosáhnout, a vynásobením 100.
Dotazník SCL-90 obsahuje 90 otázek rozdělených do 9 dimenzí: somatizace (tedy zpracování psychických prožitků na úrovni tělesného prožívání), obsese-kompulze (výskyt vtíravých myšlenek a nutkavých činů), interpersonální senzitivita (míra citlivosti a vztahovačnosti), deprese, úzkost, vztek - hostilita (nesnášenlivost), fobie (strach), paranoidita (sklon k podezřívavosti, souvisí s interpersonální senzitivitou), psychoticizmus (sklon reagovat desintegrací psychických funkcí) [11]. Odpovědi se hodnotí počtem bodů dle následujícího schématu: 0 - vůbec ne, 1 - trochu, 2 - středně, 3 - dosti silně, 4 - velmi silně. Pro každou dimenzi se sečtou dosažené body a podělí se sumou dané dimenze, čímž dostaneme skóre jednotlivých subškál. Dalším výstupem tohoto dotazníku jsou transformované skóry GSI (Global Severity Index = celkový skór/90), PST (Positive Symptom Total = počet položek s nenulovými skóry) a PSDI (Positive Symptom Distress Index = celkový skór/PST).
Respondenti, tj. osoby, které nám zaslaly vyplněné dotazníky, byli pozváni na ambulanci Centra preventivní kardiologie k celkovému internímu vyšetření zaměřenému na rizikové faktory kardiovaskulárních chorob.
Probandům byla v dopoledních hodinách při vyšetření (mezi 8 : 00-10 : 00 hod) odebrána krev nalačno ke stanovení kortizolu v séru a dále byli požádáni o sběr moči za 24 hodin. Kortizol v séru a kortizol ve 24 hodinovém sběru moči byly stanoveny chemiluminiscenční metodou na analyzátoru UniCel DxI 800 firmy Beckman. Adrenalin, noradrenalin a dopamin byly stanoveny radioimunoanalýzou setem Ria Cat (Immunotech).
Adrenalin byl zvýšen nad referenční rozmezí pouze v jednom případě, proto jako „vyšší hladina“ adrenalinu byla arbitrárně zvolena hodnota odpovídající minimálně 50 % referenčního rozmezí stanoveného výrobcem laboratornch kitů (tj. 10 µg/24 hod). Dopamin byl zvýšen nad referenční rozmezí pouze ve dvou případech a jako „vyšší hladina“ byla rovněž arbitrárně zvolena hodnota odpovídající minimálně 50 % referenčního rozmezí (tj. 300 µg/24 hod). Hraniční hodnoty hladin katecholaminů, dle kterých jsme rozdělovali soubor, sloužily především k účelu statistického zpracování.
Ke statistickému zpracování byly použity standardní statistické metody (Wilcoxonův test pro nepárové hodnoty a vícečetná regrese) s využitím statistického softwaru Stata firmy Stata Corporation. Výsledky jsou adjustovány na věk, pohlaví, antihypertenzní a hypolipidemickou léčbu a body mass index (BMI).
Výsledky
Dotazníky obdrželo poštou celkem 1 050 probandů, vyplněné dotazníky zaslalo zpět 550 osob. Screeningového vyšetření se zúčastnilo 350 probandů. Vyloučeni byli ti, kteří odmítli střádat moč nebo neúplně vyplnili dotazníky (91 osob). Ke konečnému zpracování jsme tedy zařadili data 259 osob - 148 žen a 111 mužů. Základní charakteristiku sledovaného souboru udává tab. 1. Dle SDS indexu Zungova dotazníku trpí zvýšenou depresivitou 34 % souboru (resp. 38 % žen a 31 % mužů).
Table 1. Vybrané hodnoty u sledovaného souboru (n = 259). 
Pokud rozdělíme sledovaný soubor podle hladiny kortizolu v moči dle hraniční hodnoty 300 nmol/24 hod - arbitrárně zvoleného prahu (cut off; nad hranicí hodnoty 38 osob, pod nebo rovno hodnotě 221 osob), pak téměř všechny okruhy symptomů dotazníků SCL-90 vykazují vyšší hodnoty u skupiny s hladinou kortizolu nad touto cut off (hraniční hodnotou). Signifikantní rozdíl vidíme v dimenzích interpersonální senzitivity, deprese, úzkosti, fobie, paranoidity a psychoticizmu (p < 0,05; provedeno vícečetnou regresí). Totéž platí i o skórování v ZSDS. Přehledová tab. 2 ukazuje vztah mezi hladinou hormonů v odpadu moči za 24 hodin zvýšenou nad arbitrárně stanovenou cut off a skórováním v jednotlivých dimenzích dotazníku SCL-90 a ZSDS (provedeno vícečetnou regresí).
Table 2. Dimenze SCL-90 a depresivita podle Zungovy sebeposuzovací škály deprese (ZSDS) v závislosti na hladinách měřených hormonů. 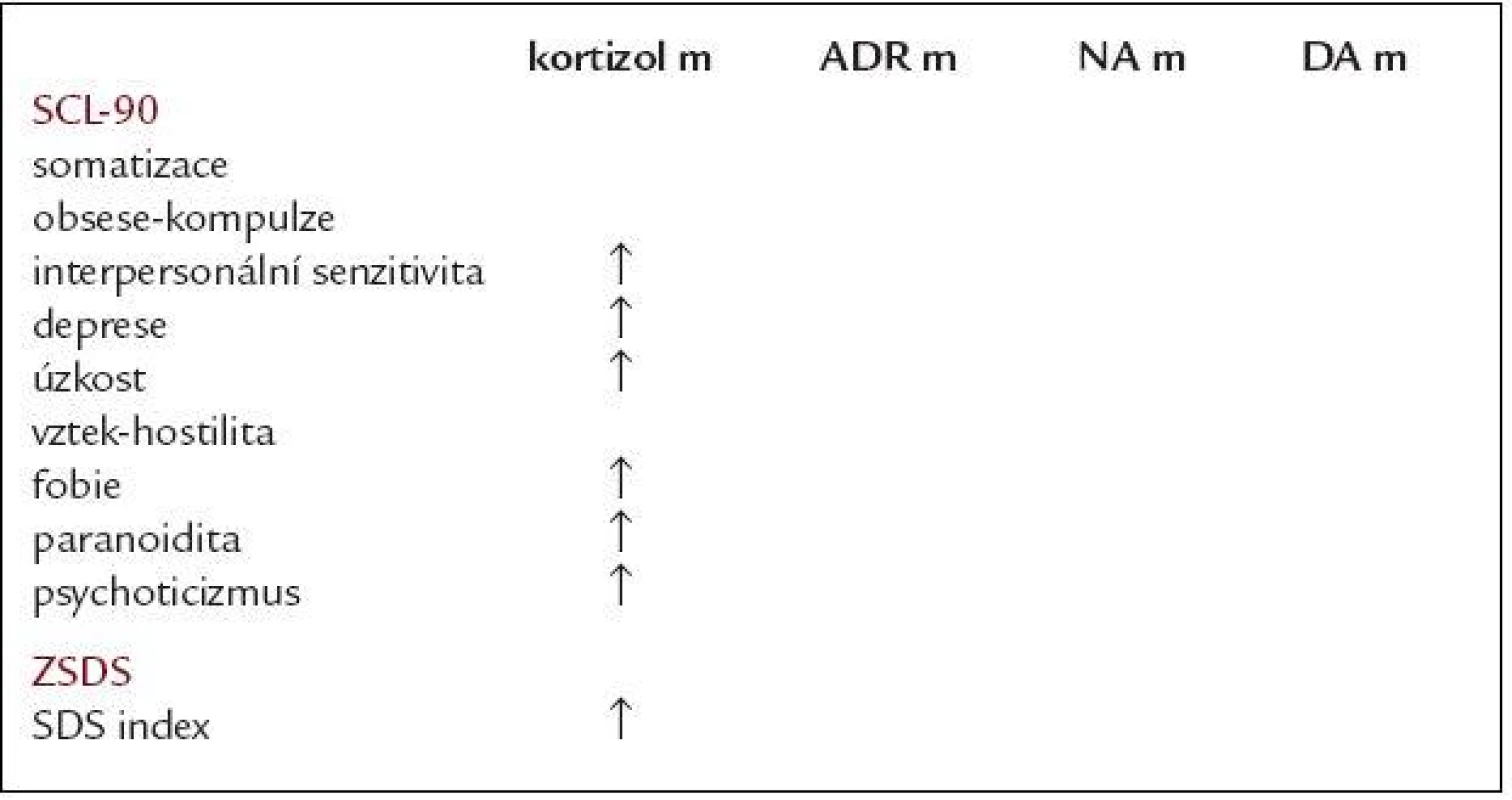
kortizol m – kortizol ve sběru moči/24 hod, ADR m – adrenalin ve sběru moči/24 hod, NA m – noradrenalin ve sběru moči/24 hod, DA m – dopamin ve sběru moči/24 hod, SCL-90 – Symptom Check List-90, ZSDS – Zungova sebeposuzovací škála deprese ↑ – zvýšení se statistickou významností na hladině p < 0,05, provedeno vícečetnou regresí Při provedení opačného postupu a rozdělení souboru dle pohlaví a SDS indexu ZSDS na skupinu „depresivní“ a „nedepresivní“ mají ženy s přítomností depresivních symptomů statisticky významně vyšší vylučování kortizolu do moči ve 24hodinovém období (průměr 219,40 oproti 191,64 nmol/24 hodin, p = 0,02) a trend k nižší hladině kortizolu v séru v dopoledních hodinách v porovnání s ženami bez depresivních symptomů (průměr 413,99 oproti 462,84 nmol/l, p = 0,09), tab. 3. U skupiny mužů s depresivními symptomy byl nalezen pouze trend vyššímu vylučování noradrenalinu do moči za 24 hodin (průměr 69,77 oproti 63,84 µg/24 hod, p = 0,17), tab. 4.
Table 3. Srovnání některých hormonů v séru a ve sběru moči podle depresivity u žen. 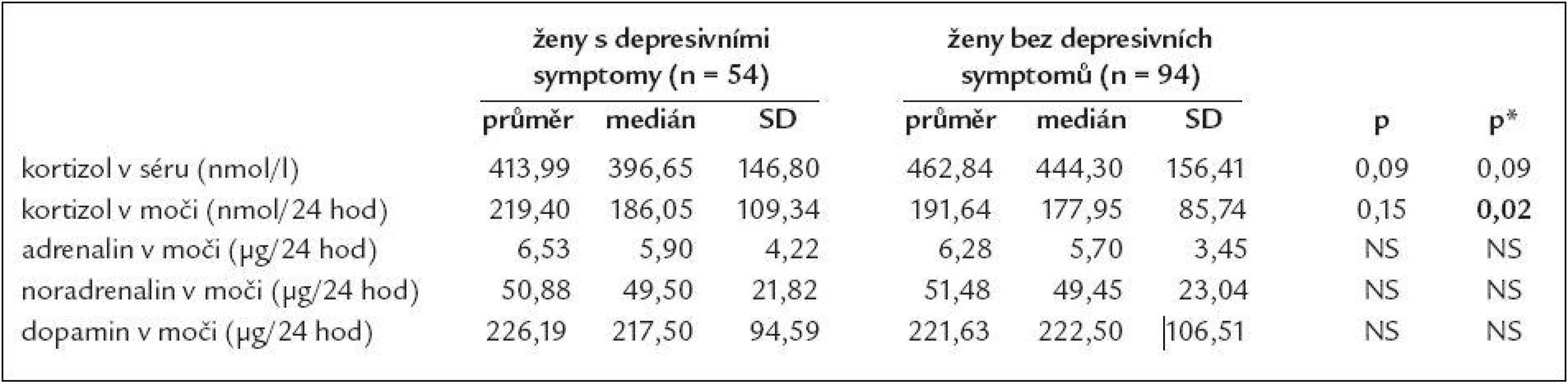
p – provedeno Wilcoxonovým testem, p* – provedeno vícečetnou regresí, adjustováno na věk Table 4. Srovnání některých hormonů v séru a ve sběru moči podle depresivity u mužů. 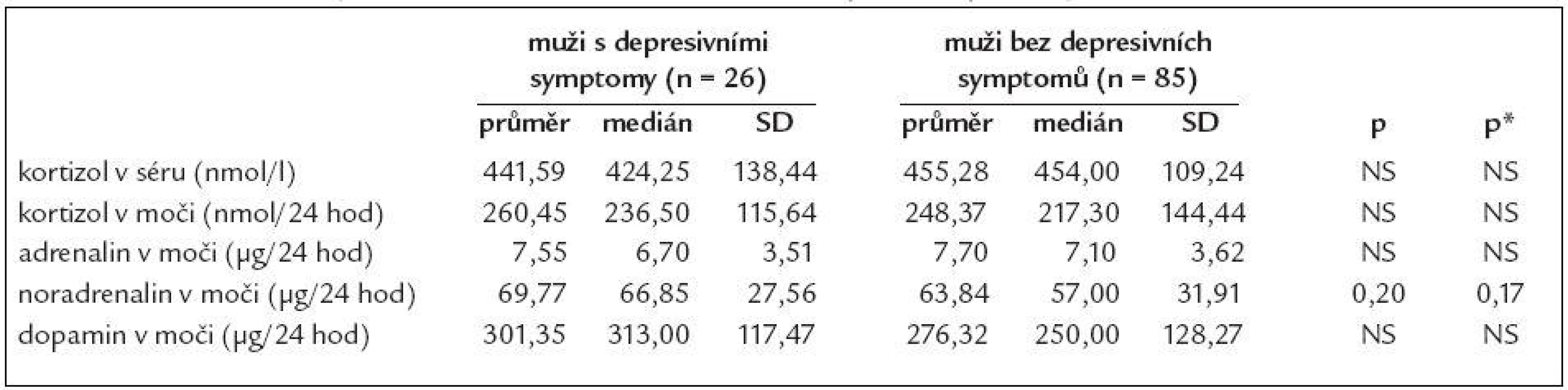
p – provedeno Wilcoxonovým testem, p* – provedeno vícečetnou regresí, adjustováno na věk Diskuse
Prevalence příznaků deprese určené dle SDS indexu ZSDS je v našem populačním souboru vyšší než jsou běžně udávané literární údaje [12]. Je tomu tak pravděpodobně proto, že tento sebeposuzovací dotazník je určen k hodnocení i mírného stupně depresivity. Relativně vysoká prevalence námi zjištěných depresivních symptomů může být také ovlivněna skutečností, že ke studii adherovali především ti probandi, kteří se více zajímají o svůj zdravotní stav a případně se také více pozorují. Domníváme se, že tyto osoby mohou být úzkostnější a mohou mít větší sklon k depresivnímu prožívání. Větší depresivita žen je ve shodě s literárními údaji, které ji často potvrzují hlavně u žen ve středním a vyšším věku [13]. V literatuře nacházíme pouze jednu studii, která zjistila rovnocenný výskyt deprese u mužů a žen, byla však provedena na homogenní skupině vysokoškolských studentů [14].
Prokázaný je vliv kortizolu na centrální nervovou soustavu. To platí jak pro endogenní kortizol, tak i pro kortizol podávaný exogenně [15]. Sekrece kortizolu podléhá regulaci v rámci HPA osy. Zatím není jasné, zda jsou vyšší hladiny endogenního kortizolu způsobeny primárně vyšším vylučováním kortizolu v kůře nadledvinek za normálně fungující HPA osy, nebo dysregulací této osy. Stejně tak jako v případě monoaminů může být i kortizol cílem farmakologické intervence ve snaze léčit depresivní stavy. Podávání antiglukokortikoidních látek (ketokonazolu) může být využito při léčbě deprese [16].
V naší práci prokazujeme souvislost elevace hladiny kortizolu ve 24hodinovém sběru moči s depresivitou a dalšími psychickými abnormalitami.
O nalezení vztahu mezi hladinou kortizolu a psychikou člověka se pokoušeli autoři četných studií. Schweiger porovnává 15 pacientů trpících středně těžkou a těžkou depresí dle kritérií DSM-IV (Diagnostic and Statistical Manual of Mental Disorders, 4th Edition) s 22 zdravými dobrovolníky a zjišťuje vyšší vylučování kortizolu v depresivní skupině [17]. Podobné výsledky obdržela i Weberová na srovnatelném vzorku [18]. Tito autoři však měřili kortizol získaný z periferní krve odebírané několikrát v průběhu 24 hodin.
Další doklad o zvýšené hladině kortizolu v plasmě podává Gold et al, který srovnával hladiny kortizolemie měřené po 30 min u těžce depresivních pacientů se srdečním selháním a u kontrolní skupiny. Průměrná hladina kortizolu v plazmě i analýza cirkadiánního rytmu potvrdila signifikantně vyšší hladiny kortizolu u depresivních osob (p < 0,02). Limitací této studie byl malý vzorek 11 depresivních osob, které splňovaly kritéria melancholické deprese (dle revidované verze DSM-III; dle MKN-10 se jedná o depresi se somatickým syndromem) a sami autoři předpokládají, že získané výsledky nemohou být relevantní i pro jiné formy depresivní poruchy [19]. Výrazný rozdíl uvádí Rao na malém souboru 5 pacientů, kde byl kortizol stanovován v nočním sběru moči (mezi 23 : 00-7 : 00 hod) [20]. V období deprese byly hladiny několikanásobně vyšší než v období remise. Ve follow up studii pak tentýž autor na větším vzorku mladých osob uvádí rozdíly v plazmatických hladinách kortizolu v době usínání (procento z celkové 24hodinové sekrece), kdy oproti kontrolní skupině zdravých osob mají vyšší sekreci kortizolu osoby, u kterých je v anamnéze jedna ataka depresivní poruchy, ještě vyšší ti, u kterých se v budoucnu depresivní epizoda rozvine a nejvyšší sekreci osoby trpící rekurentní depresivní poruchou [21]. Zvýšení kortizolu spolu s CRH v náběru periferní krve mezi 8 : 00-8 : 30 hod ranní u depresivních probandů uvádí např. Catalán, který porovnává 36 depresivních ambulantních pacientů se 17 zdravými kontrolami. Uvádí rovněž, že pacienti s těžkou depresí mají vyšší hladiny i oproti pacientům s mírnou a střední depresí [22].
Dle našich výsledků mají ženy projevující více depresivních příznaků (dle ZSDS) vyšší odpad kortizolu do moči ve 24hodinovém období. Ke stejnému výsledku dospěl Hughes et al, který zkoumal na souboru 91 žen vztah mezi depresivními symptomy, anxietou a 24hodinovým odpadem kortizolu a katecholaminů do moči. Autoři dále zaznamenali signifikantně vyšší vylučování noradrenalinu ve skupině zmíněných žen. Vztah mezi anxietou a vylučováním kortizolu a noradrenalinu byl rovněž statisticky významný. Výsledky studie naznačují, že deprese a anxieta je asociována se zvýšenou aktivitou sympatického nervového systému [23].
Naše výsledky ukazují signifikantní vztah mezi výstupy SCL-90 a hladinou kortizolu v moči. Tento úspěch může být dán použitou metodikou. Stanovení kortizolu v moči je totiž mnohem senzitivnější a specifičtější než jeho stanovení v plazmě, např. i při diagnostice Cushingova syndromu [24]. Je to tím, že při stanovování kortizolu v moči je reaktantem pouze jeho volná složka. Kortizol ve 24hodinovém sběru moči může být jakýmsi „zprůměrováním“ hladin kortizolu, které se vyskytují u jedince během dne. Zdá se nám lepším markerem dlouhodobého stavu člověka (tedy i např. nálady a úzkosti) než ranní kortizol, resp. kortizol stanovovaný v určitou denní dobu. Zajímavé výsledky na toto téma obdržel Maes, který porovnával ranní kortizol mezi depresivními hospitalizovanými pacienty, depresivními ambulantními pacienty a kontrolní skupinou. Bylo zjištěno, že depresivními hospitalizovaní pacienti mají signifikantně vyšší hladinu ranního kortizolu (měřenou v 9 : 00 hod), ale že v průběhu dvou hodin nejsou mezi uvedenými skupinami rozdíly v ploše pod křivkou hladin (Area Unde Curve = AUC) hodnot kortizolu měřených v čase. Z uvedeného sledování autoři vyvozují, že ranní hyperkortizolemie není znakem samotné deprese, ale vyplývá z interakce mezi onemocněním a hospitalizací [25]. Lepší výsledky měření odpadu kortizolu do moči jsou i oproti stanovení kortizolu v plazmě metodou více náběrů prováděných během jednoho dne a výpočtem sklonu křivky charakterizující průběh hladiny. Lupienová ve studii na 51 dobrovolnících ve věku 60-90 let prokazuje pouze jedinou pozitivní korelaci (na hladině významnosti p = 0,05) mezi sklonem křivky hladin kortizolu u jednotlivých osob v průběhu 6letého sledování a dimenzí pro obsesi-kompulzi dotazníku SCL-90. Nezjišťuje však žádný vztah mezi průměrnou 24hodinovou sekrecí kortizolu a kteroukoli dimenzí SCL-90 [26].
Naše studie neprokázala statisticky významné souvislosti mezi hladinami adrenalinu, noradrenalinu a dopaminu a výsledky administrovaných sebeposuzovacích škál. V literatuře však nacházíme doklady o zvýšeném vylučování noradrenalinu v souvislosti s depresí. Kromě již citované práce Hughese et al uvedeme studii, která zkoumala vztah mezi depresivními symptomy a katecholaminy ve sběru moči u 598 pacientů s anamnézou kardiovaskulárního onemocnění. Depresivní symptomy byly asociovány s vyšším vylučováním noradrenalinu, u dopaminu se statistická významnost ztrácí po adjustaci a ve vylučování adrenalinu nebyly mezi oběma skupinami shledány statisticky významné rozdíly [27]. Vyšší hladina noradrenalinu je považována za významný rizikový faktor kardiovaskulární mortality [28-31]. Noradrenalin se podílí na zvýšení mortality několikerým mechanizmem: působí toxicky na kardiocyty [32], spouští tachyarytmie [33,34] a podporuje agregaci krevních destiček a utváření trombu [35]. Podobně koncipovanou studii jako Otte provedl Carney et al, který srovnával hladinu noradrenalinu v plazmě u 50 depresivních a 39 nedepresivních pacientů s onemocněním srdečních cév. V tomto případě nebyl v hladině noradrenalinu mezi oběma skupinami shledán statisticky významný rozdíl, což autoři přičítají malému počtu osob s těžkou depresí [36].
Je možné také uvažovat o větší senzitivitě stanovení odpadu noradrenalinu do moči v porovnání s jeho měřením v plazmě.
Limitace studie
Námi použité referenční hodnoty byly v případě adrenalinu a dopaminu pouze orientační a sloužily k rozdělení souboru pro statistické účely. Problematikou zvýšené hladiny zkoumaných hormonů nad hodnoty obvyklé v populaci se autoři pro stručnost tohoto sdělení nezabývají.
Závěr
U probandů vykazujících vyšší depresivitu či jiné psychopatologie v sebeposuzovacích škálách jsme nalezli významně vyšší hladiny kortizolu ve 24hodinovém sběru moči. Z uvedeného tedy vyplývá, že pokud bude u pacienta zjištěna zvýšená hladina kortizolu ve sběru moči, může být tento pacient vystaven chronickému stresu, trpět úzkostí, depresí, ev. jinými psychopatologiemi. Takovýto pacient pak má zvýšené riziko např. metabolického syndromu inzulinové rezistence a dalších somatických onemocnění, které se sdružují s úzkostí a depresí.
S vyššími hladinami kortizolu pozorujeme řadu somatických příznaků, které odpovídají častým steskům nemocných docházejících k praktickým lékařům, ev. do specializovaných ambulancí. Jelikož řada těchto pacientů není ochotna si psychický původ svých potíží připustit, může být hladina kortizolu ve sběru moči za 24 hodin jistým „objektivním“ ukazatelem. Z tohoto laboratorního vyšetření se pak může odvíjet další spolupráce s pacientem, na které bude participovat psychiatr.
Studie byla podpořena grantem IGA MZ ČR NA 7434-3 (2003-2005).
MUDr. Zdeněk Hess
www.fnplzen.cz
e-mail: hessz@fnplzen.cz
Doručeno do redakce: 17. 6. 2005
Přijato po recenzi: 16. 4. 2007
Sources
1. Diagnostic and Statistical Manual of Mental Disorders: DSM-IV. 4th ed. Washington (DC): American Psychiatric Association 1994.
2. Delay J, Lainé B, Buisson JF. Note concernant l’action de l’isonicotinylhydrazide dans le traitement des etats dépressifs. Ann Med Psychol (Paris) 1952; 110 : 689-692.
3. Yamada M, Yasuhara H. Clinical pharmacology of MAO inhibitors: safety and future. Neurotoxicology 2004; 25 : 215-221.
4. Saura JM, Kettler R, Da Prada M et al. Molecular neuroanatomy of MAO-A and MAO-B. J Neural Transm 1990; 32 : 49-53.
5. Ehlwuegi AS. Central monoamines and their role in major depression. Prog Neuropsychopharmacol Biol Psychiatry 2004; 28 : 435-451.
6. Varghese FP, Brown ES. The hypothalamic-pituitary-adrenal axis in major depressive disorder: a brief primer for primary care physicians. Prim Care Companion J Clin Psychiatry 2001; 3 : 151-155.
7. Stokes PE. The potencial role of excessive cortisol induced by HPA hyperfunction in the pathogenesis of depression. Eur Neuropsychopharmacol 1995; 5(Suppl 1): 77-82.
8. Thomas L (ed). Labor und Diagnose. 4. ed. Marburg: Die Medizinische Verlagsgesellschaft 1995.
9. The World Health Organization MONICA Project (monitoring trends and determinants in cardiovascular disease): a major international collaboration. WHO MONICA Project Principal Investigators. J Clin Epidemiol 1988; 41 : 105-114.
10. Zung WW. A Self-Rating Depression Scale. Arch Gen Psychiatry 1965; 12 : 63-70.
11. Derogatis LR, Lipman RS, Covi L. SCL-90: an outpatient psychiatric rating scale-preliminary report. Psychopharmacol Bull 1973; 9 : 13-28.
12. Kessler RC, McGonagle KA, Zhao S et al. Lifetime and 12-month prevalence of DSM-III-R psychiatric disorders in the United States: Results from the National Comorbidity Survey. Arch Gen Psychiatry 1994; 51 : 8-19.
13. Harris T. Depression in women and its sequelae. J Psychosom Res 2003; 54 : 103-112.
14. Makaremi A. Sex differences in depression of Iranian adolescents. Psychol Rep 1992; 71 : 939-943.
15. Young AH, Sahakian BJ, Robbins TW et al. The effects of chronic administration of hydrocortisone on cognitive function in normal male volunteers. Psychopharmacology (Berl) 1999; 145 : 260-266.
16. Wolkowitz OM, Reus VI, Chan T et al. Antiglucocorticoid treatment of depression: double blind ketoconazole. Biol Psychiatry 1999; 45 : 1070-1074.
17. Schweiger U, Deuschle M, Webber B et al. Testosterone, gonadotropin, and cortisol secretion in male patients with major depression. Psychosom Med 1999; 61 : 292-296.
18. Weber B, Lewicka S, Deuschle M et al. Increased diurnal plasma concentrations of cortisone in depressed patients. J Clin Endocrinol Metab 2000; 85 : 1133-1136.
19. Gold PW, Wong ML, Goldstein DS et al. Cardiac implications of increased arterial entry and reversible 24-h central and peripheral norepinephrine levels in melancholia. Proc Natl Acad Sci USA 2005; 102 : 8303-8308.
20. Rao U, McCracken J, Lutchmansingh P et al. Electroencephalographic sleep and urinary free cortisol in adolescent depression: a preliminary report of changes from episode to recovery. Biol Psychiatry 1997; 41 : 369-373.
21. Rao U, Dahl RE, Ryan ND et al. The relationship between longitudinal clinical course and sleep and cortisol changes in adolescent depression. Biol Psychiatry 1996; 40 : 474-484.
22. Catalán R, Gallart JM, Castellanos JM et al. Plasma corticotropin-releasing factor in depressive disorders. Biol Psychiatry 1998; 44 : 15-20.
23. Hughes JW, Watkins L, Blumenthal JA et al. Depression and anxiety symptoms are related to increased 24-hour urinary norepinephrine excretion among healthy middle-aged women. J Psychosom Res 2004; 57 : 353-358.
24. Fujita H, Hata K, Ogata E et al. Spot determinations of urinary cortisol for the screening of Cushing’s syndrome. Endocrinol Jpn 1991; 38 : 441-444.
25. Maes M, Calabrese J, Meltzer HY. The relevance of the in - versus outpatient status for studies on HPA-axis in depression: spontaneous hypercortisolism is a feature of major depressed inpatients and not of major depression per se. Prog Neuropsychopharmacol Biol Psychiatry 1994; 18 : 503-517.
26. Lupien S, Lecours AR, Schwartz G et al. Longitudinal study of basal cortisol levels in healthy elderly subjects: evidence for subgroups. Neurobiol Aging 1996; 17 : 95-105.
27. Otte C, Neylan TC, Pipkin SS et al. Depressive symptoms and 24-hour urinary norepinephrine excretion levels in patients with coronary disease: findings from the Heart and Soul Study. Am J Psychiatry 2005; 162 : 2139-2145.
28. Reuben DB, Talvi SL, Rowe JW et al. High urinary catecholamine excretion predicts mortality and functional decline in high-functioning, community-dwelling older persons: MacArthur Studies of Successful Aging. J Gerontol A Biol Sci Med Sci 2000; 55: M618-M624.
29. Cohn JN, Levine TB, Olivari MT et al. Plasma norepinephrine as a guide to prognosis in patients with chronic congestive heart failure. N Engl J Med 1984; 311 : 819-823.
30. Christensen NJ, Schultz-Larsen K. Resting venous plasma adrenalin in 70-year-old men correlated positively to survival in a population study: the significance of the physical working capacity. J Intern Med 1994; 235 : 229-232.
31. Anand IS, Fisher LD, Chiang YT et al. Changes in brain natriuretic peptide and norepinephrine over time and mortality and morbidity in the Valsartan Heart Failure Trial (Val-HeFT). Circulation 2003; 107 : 1278-1283.
32. Mann DL, Kent RL, Parsons B et al. Adrenergic effects on the biology of the adult mammalian cardiocyte. Circulation 1992; 85 : 790-804.
33. Meredith IT, Broughton A, Jennings GL et al. Evidence of a selective increase in cardiac sympathetic activity in patients with sustained ventricular arrhythmias. N Engl J Med 1990; 325 : 618-624.
34. Podrid PJ, Fuchs T, Candinas R Role of the sympathetic nervous system in the genesis of ventricular arrhythmia. Circulation 1990; 82: I103-I113.
35. Benedict CR Neurohumoral aspects of heart failure. Cardiol Clin 1994; 12 : 9-23.
36. Carney RM, Freedland KE, Veith RC et al. Major depression, heart rate, and plasma norepinephrine in patients with coronary heart disease. Biol Psychiatry 1999; 45 : 458-463.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2007 Issue 10-
All articles in this issue
- Změny metabolizmu lipidů u pacientů v aktivní fázi Crohnovy choroby
- Hladina kortizolu souvisí s depresivitou a jinými psychopatologiemi více než hladiny katecholaminů
- Naše zkušenosti s kontinuálním podáváním inzulinu pomocí infuzního dávkovače na jednotce intenzivní metabolické péče (JIMP)
- Endoskopické změny sliznice žaludku a dvanáctníku při léčbě minidávkou acetylsalicylové kyseliny a jejich prevence
- Dosažení Bcl-2/IgH negativity v periferní krvi/kostní dřeni po léčbě je u nemocných s folikulárním lymfomem spojeno s lepší prognózou onemocnění
- Vliv terapie statiny na změny kostní denzity postmenopauzálních žen
- Analýza vlivu cirkadiánního rytmu na turbulenci srdeční frekvence u pacientů bez průkazu organického onemocnění srdce
- Plicní alveolární proteinóza
- Pozdní trombóza koronárního stentu a klopidogrel
- Syndróm MIAC (malnutrition, inflammation, atherosclerosis, calcification)
- Pseudomembranózní kolitida
- Inkretinová strategie léčby diabetes mellitus 2. typu - inhibitor DPP-IV sitagliptin
- Přínos ibandronátu pro léčbu postmenopauzální osteoporózy
- Chronická exsudativní benigní perikarditida - popis familiárního výskytu: kazuistiky
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hladina kortizolu souvisí s depresivitou a jinými psychopatologiemi více než hladiny katecholaminů
- Pseudomembranózní kolitida
- Plicní alveolární proteinóza
- Naše zkušenosti s kontinuálním podáváním inzulinu pomocí infuzního dávkovače na jednotce intenzivní metabolické péče (JIMP)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

