-
Medical journals
- Career
Metodické pokyny pro farmakoterapii akutní a chronické nenádorové bolesti
: T. Doležal 1; M. Hakl 2; J. Kozák 3; M. Kršiak 1; J. Lejčko 4; B. Skála 5; O. Sláma 6; P. Ševčík 7; J. Vorlíček (v Abecedním Pořadí) 6
: Ústav farmakologie 3. lékařské fakulty UK, Praha, přednosta prof. MUDr. Miloslav Kršiak, DrSc. 1; Anesteziologicko-resuscitační klinika LF MU a FN u sv. Anny, Brno, přednosta doc. MUDr. Vladimír Šrámek, Ph. D. 2; Centrum pro léčbu bolestivých stavů FN v Motole, Praha, přednosta prim. MUDr. Jiří Kozák 3; Anesteziologicko-resuscitační klinika Lékařské fakulty UK a FN Plzeň, přednosta doc. MUDr. Eduard Kasal, CSc. 4; Ordinace praktického lékaře pro dospělé, Lanškroun 5; Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Vorlíček, CSc. 6; Klinika anesteziologie, resuscitace a intenzivní medicíny Lékařské fakulty MU a FN Brno, pracoviště Bohunice přednosta prof. MUDr. Pavel Ševčík, CSc. 7
: Vnitř Lék 2007; 53(1): 79-90
: Guidelines
Metodické pokyny v tomto znění byly schváleny výbory Společnosti pro studium a léčbu bolesti České lékařské společnosti J.E. Purkyně, České onkologické společnosti České lékařské společnosti J.E.Purkyně a Společnosti všeobecného lékařství České lékařské společnosti J.E. Purkyně, České společnosti anesteziologie, resuscitace a intenzivní medicíny České lékařské společnosti J.E. Purkyně a České společnosti pro experimentální a klinickou farmakologii a toxikologii České lékařské společnosti J.E. Purkyně
Úvod
Definice bolesti
Bolest je nepříjemný senzorický a emocionální prožitek spojený se skutečným či potencionálním poškozením tkání, nebo je popisována výrazy takového poškození. Bolest je vždy subjektivní. Rozdíly mezi akutní a chronickou bolestí ukazuje tab. 2.
1. Tabulka rozdílů mezi akutní a chronickou bolestí. 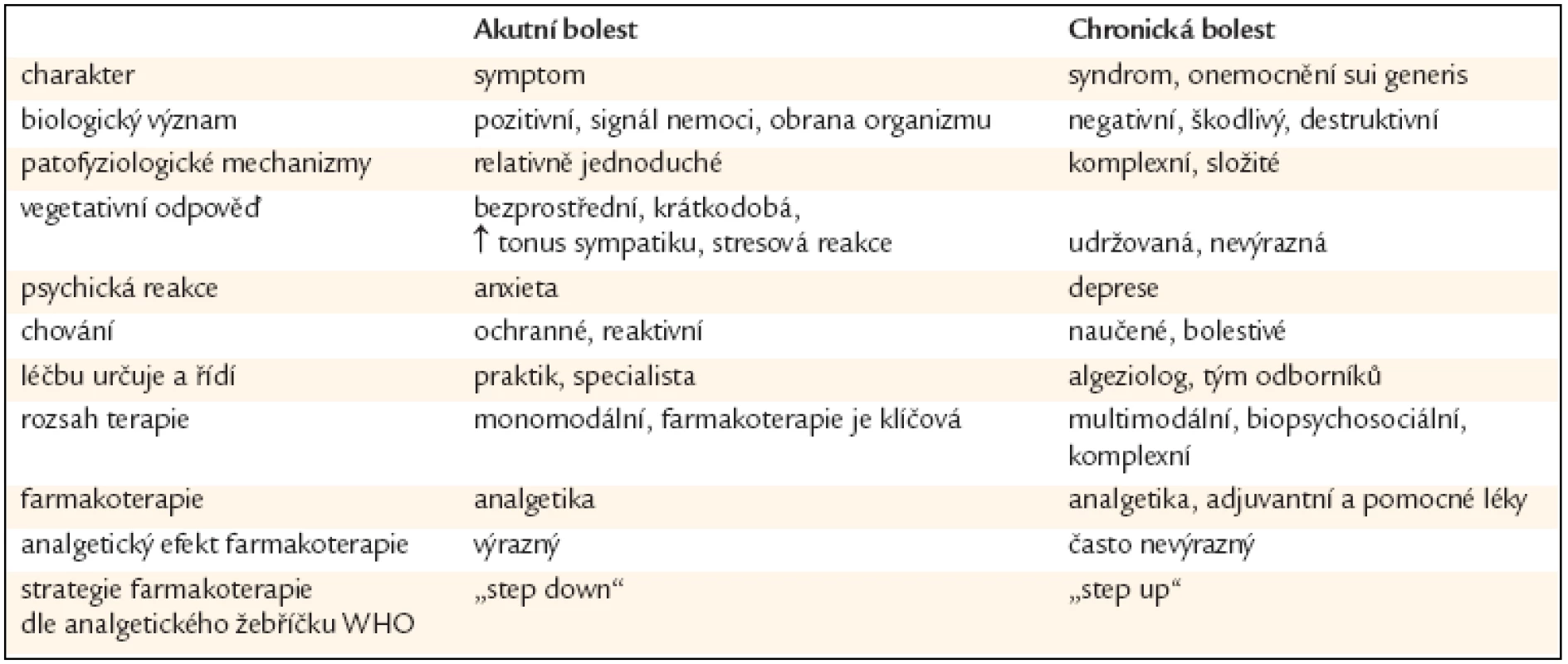
Akutní bolest
V akutních fázích poruchy zdraví má bolest význam signálu nemoci, nebezpečí a ukazuje na narušení integrity organizmu. Akutní bolest (AB) trvá krátkodobě (řádově dny a týdny) a je z biologického hlediska účelná. Léčení prvotní příčiny základního onemocnění je zásadním a logickým medicínským krokem. Ani v této fázi onemocnění by však nemocný neměl trpět bolestí, a to nejen z hlediska lékařské etiky. Symptomatická léčba má hluboký smysl a AB je nutno razantně léčit. Jinak dochází k rozvoji nepříznivých patofyziologických změn a prohloubení stresu se všemi důsledky. Efektivně vedená léčba AB má přechodu do chronické bolesti („paměť bolesti“, neuroplasticita). Rozhodující roli v pohotovém ovlivnění bolesti má farmakoterapie. Pro AB ve srovnání s chronickou bolestí je typické, že je relativně dobře ovlivnitelná. Často lze vystačit s jednou léčebnou modalitou. Racionálně vedená farmakoterapie má klíčový význam. I u AB jsou však v některých případech zásadní nefarmakologické postupy. Cílem léčby AB je dosažení komfortní analgezie při současném kauzálním postupu.
Chronická bolest
Deklarace EFIC (European Federation of IASP Chapters) o chronické bolesti (CHB) jako důležitém problému zdravotnictví a samostatném onemocnění ve vlastním slova smyslu: „Bolest je v Evropě důležitým zdravotnickým problémem. Akutní bolest může být považována za symptom onemocnění či úrazu, chronická a opakující se bolest je specifickým onemocněním.“
Syndrom chronické nenádorové bolesti (CHNNB) se vyznačuje stížností na bolest tělesnou nebo útrobní trvající déle než 3–6 měsíců. Za chronickou je však třeba považovat i bolest krátkodobější, pokud přesahuje dobu obvyklou pro dané onemocnění či poruchu. Chronická, dlouhotrvající bolest nemá žádnou biologicky užitečnou funkci a je zdrojem tělesných, duševních i sociálních útrap. Cílem léčebných postupů u chronické bolesti nemusí být nutně úplné uzdravení jedince, ale úprava a eventuální obnovení funkční zdatnosti v dosažitelné míře v oblasti fyzické, psychické i sociální (D. Vondráčková, F. Neradilek, 2001). Důležitým principem, který zvyšuje efektivitu léčby CHNNB, je použití postupů farmakologických i nefarmakologických.
Terapeutické postupy v léčbě CHNNB:
- farmakoterapie
- rehabilitační postupy
- psychoterapeutické metody
- sociální podpora
- invazivní analgetické metody
- postupy alternativní medicíny (akupunktura atd)
Cíl léčby CHNNB:
- dosažení úlevy bolesti
- zvýšení funkční kapacity a zlepšení kvality života
Diagnostika a hodnocení bolesti
Dle původu se bolest dělí na nociceptivní (nociceptorová) a neurogenní (neuropatickou).
Nociceptivní bolest (NCB), někdy nazývaná periferní, vzniká stimulací nervových zakončení mechanickými, termickými a chemickými (zánětlivými) inzulty. Je výrazem normální funkce nervového systému. Jsou 2 typy NCB: somatická a viscerální. NCB bývá popisována jako tupá, škubavá, ostrá, bolestivý tlak nebo jako „bolení“, somatická NB je dobře lokalizovatelná. NCB většinou dobře reaguje na analgetika.
Neuropatická bolest (NPB) je způsobena postižením nervového systému a je výrazem poruchy jeho funkce. Dle topického postižení se rozlišuje NPB periferní a centrální. Poruchu nervového systému způsobují metabolické choroby, trauma, infekce, ischemie. NPB má 2 základní charakteristiky. Je prožívána buď jako konstantní pálivá, palčivá bolest, nebo jako paroxyzmální bolest popisovaná jako bodání, píchání, vystřelování, může se projevit i kombinací obou charakteristik. U NPB bývá přítomna motorická a senzitivní porucha (hypestezie, hyperalgezie, alodynie apod). NPB reaguje většinou lépe na adjuvantní než na vlastní analgetika.
Toto orientační dělení a rozlišení bolestivého stavu na akutní a chronický je rozhodující pro nasazení správné analgetické medikace a stanovení správné strategie léčby.
Bolestivý stav je nutno podrobně vyhodnocovat se zaměřením na:
• anamnézu a dobu trvání bolesti
• charakter bolesti a její časový průběh
• faktory ovlivňující průběh bolesti
• topografii bolesti – schématický grafický záznam (pain figure)
• intenzitu bolesti a její charakterLéčba musí být pravidelně monitorována. Standardem je hodnocení intenzity bolesti dle vizuálně analogové škály (VAS 0–10), na níž je bod 0 stav bez bolesti a 10 je nejsilnější bolest, jakou si pacient dokáže představit. Důležitou pomůckou, zejména při zahájení analgetické léčby, je deník bolesti smožností zachycení spotřeby „záchranné“ léčby, vedlejších účinků, denních aktivit a kvality spánku.
Vlastní farmakoterapie bolesti
Obecné schéma farmakoterapie bolesti
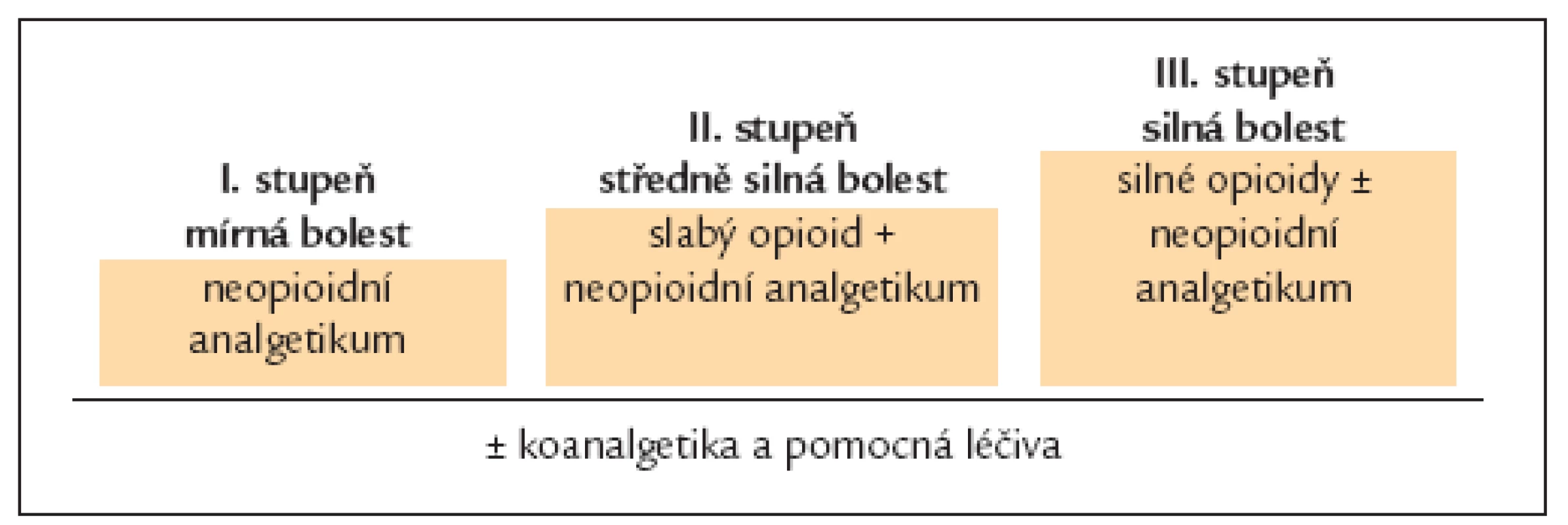
Klasickým a již dost vžitým vodítkem pro farmakoterapii bolesti je 3stupňové analgetické kritérion WHO pro nádorové bolesti (schéma 1). Podle 3stupňového kritéria WHO se u mírných bolestí doporučuje začínat s neopioidními analgetiky (1. krok nebo stupeň). Pokud je tato terapie nedostačující (středně silná bolest), mají se přidat slabá opioidní analgetika (2. krok, stupeň) a pokud není ani tato terapie dostačující (silná bolest), mají se slabé opioidy zaměnit za silné (3. krok, stupeň). Dále se počítá s uplatněním tzv. adjuvantních analgetik (koanalgetika), která mohou tlumit některé typy bolestí a pomocných léků, určených k léčbě vedlejších účinků analgetik.
Analgetika, adjuvantní analgetika a pomocná léčiva jsou podrobněji uvedena v příloze.
WHO žebříček byl koncipován pro chronickou terapii nádorové bolesti, u níž se postupuje „zdola nahoru“, tj. od slabších analgetik k silnějším. Naproti tomu u akutní bolesti se uplatňuje opačný postup, tj. „shora dolu“, tedy iniciálně se spíše volí silnější a rychleji působící farmakoterapie. Kromě toho kritéria WHO budí často dojem, že slabé opioidy jsou analgeticky silnější než neopioidní analgetika, což u akutních bolestí nepotvrdily (vlastně vyvrátily) metaanalýzy četných klinických studií. Dalším důležitým vodítkem, zejména pro farmakoterapii akutní bolesti, je tzv. Oxfordská liga analgetik sestavovaná na základě výsledků metaanalýz mnoha klinických studií zaměřených na akutní bolesti z hledisek medicíny založené na důkazech. Podle Oxfordské ligy analgetik mají u akutní bolesti nejvyšší pravděpodobnost analgetického účinku nejen silné opioidy jako morfin, ale i nesteroidní antiflogistika/antirevmatika (např. ibuprofen, diklofenak), kombinace paracetamolu s opioidy podané ve vysokých (ale ještě přípustných) dávkách a metamizol. V algoritmu farmakoterapie bolestí, který zde doporučujeme, bereme v úvahu obě tato významná vodítka.
Doporučení, zde uváděná, vycházejí především z výsledků metaanalýz kontrolovaných klinických studií účinků léčiv u akutní nebo chronické nenádorové bolesti, přihlížejí však i k osvědčeným klinickým zkušenostem tuzemských algeziologů, odborných a praktických lékařů. Podobně v indikacích, dávkování a aplikačních cestách jednotlivých léčiv vycházíme především ze souhrnů údajů o přípravku (SPC), i když někdy zmiňujeme i některé zkušenosti neuváděné v SPC (tzv. „off label“). Závazné jsou ovšem pouze údaje uváděné v SPC.
Obecné zásady farmakoterapie bolesti
- Volba a vedení analgetické léčby vychází z pacientova údaje o intenzitě a charakteru bolesti a z konkrétního klinického stavu. Nerozhoduje biologický původ bolesti (nádorová, nenádorová), ale její intenzita.
- Při výběru léčiva z analgetického žebříčku se u AB uplatňuje postup „shora dolů“ (step down), u CHNNB postup „zdola nahoru“ (step up).
- U intenzivní AB je na místě parenterální podání analgetika, eventuálně i opioidu (např. anginózní bolest při AIM, renální a žlučníková kolika). Jinak má jednoznačnou přednost neinvazivní podávání analgetik – perorálně, transdermálně nebo rektálně.
- Z hlediska časového faktoru jsou u AB nejvýhodnější analgetika s rychlým nástupem účinku, u CHB se analgetika podávají podle časového,plánu, a předchází se tak rozvoji bolesti.
- Analgetika titrujeme podle udávané míry bolesti a přitom se užívá nejnižší analgeticky efektivní dávka.
- Kombinace neopioidních a opioidních analgetik má aditivní účinek. Aditivní efekt má i kombinace analgetik s adjuvantními analgetiky a paracetamolu s NSA. Zásadně se nekombinují jednotlivá NSA (zvýšení riziko vedlejších účinků).
- Analgetickou léčbu je nutno individualizovat z hlediska volby i dávky analgetika.
- Od počátku je nutná monitorace účinnosti léčby a vedlejších účinků analgetik, které je nutno razantně léčit. U některých typů CHNNB je na místě pacienta vybavit záchrannou medikací k řešení průlomové a incidentální bolesti.
- Prospěšnost analgetické léčby by měla zřetelně převyšovat její vedlejší projevy.
Speciální část – návrh farmakoterapie pro vybrané bolestivé stavy
Akutní bolestivé stavy
Nejčastější klinické stavy spojené s AB:
- pooperační bolest (včetně AB po „one day surgery“)
- bolest v souvislosti s terapeutickými a diagnostickými procedurami
- traumatická bolest (včetně běžných a sportovních razů)
- bolest při popáleninovém úrazu
- AB na hrudi
- zubní bolest
- některé specifické akutní bolestivé stavy:
a) akutní herpes zoster
b) některá neurologická onemocnění (roztroušená skleróza, Guillainův - Barréův syndrom)
c) akutní a rekurentní břišní bolest (renální a biliární kolika, syndrom dráždivého střeva/irritable bowel syndrome – IBS a další)
d) AB u některých hematologických onemocnění (hemofilie, srpkovitá anémie) - bolest v průběhu gravidity 9.bolesti v oblasti myoskeletálního systému rozličné etiologiebolesti v oblasti myoskeletálního
- bolesti v oblasti myoskeletálního systému rozličné etiologie
- bolesti dolních zad (lumbago, lumboischialgický syndrom atd)
- bolesti hlavy
- bolesti gynekologického původu
- AB u dětí
AB ve vyšším věku
Některé typy akutních bolestí (např. bolesti s neuropatickou komponentou, migréna, pooperační a úrazová bolest, nádorová bolest, anginózní bolest, bolest při náhlých příhodách břišních atd) vyžadují své specifické farmakoterapeutické postupy a léčbu v některých případech určuje lékař příslušné odbornosti.
Základním vodítkem pro racionální farmakoterapii AB však zůstává výběr analgetika dle intenzity bolesti, jejího charakteru a dle analgetického žebříčku.
Častým problémem je léčba krátkodobých, tzv. běžných bolestí. Jde o bolesti zad (lumbago, akutní lumboischialgický syndrom, cervikobrachiální syndrom apod), některé typy bolestí hlavy, bolesti v oblasti pohybového systému, bolesti při infekčních chorobách, dysmenorea, bolesti zubního původu atd. Pro ně je určen algoritmus léčby tzv. běžných bolestí.
Algoritmus léčby tzv. běžných, krátkodobých bolestí
Podrobnosti jsou ve schématu 2.
Algoritmus léčby tzv. běžných, krátkodobých bolestí*. 
Některé akutní bolestivé stavy vyžadují ještě další farmakoterapeutická opatření podle povahy onemocnění, zde uvádíme jako příklad algoritmus léčby bolesti při akutním herpes zoster.
Algoritmus léčby bolesti při akutním herpes zoster
Úspěšnost léčby bolesti při akutním herpes zoster (AHZ) koreluje i s prevencí postherpetické neuralgie (PHN). Jakákoliv léčba snižující intenzitu a trvání akutní bolesti má význam pro prevenci a tíži PHN. Tento postup je do určité míry specifický, teoreticky a klinicky ověřený, a proto je v rámci farmakoterapie AB vyčleněn jako doporučený postup zvlášť.
- Antivirová léčba – acyklovir, valaciklovir a famciklovir, jsou-li podány v průběhu prvních 3 dní od vzniku kožních projevů, snižují tíži klinických projevů AHZ, redukují neurologické projevy a trvání bolesti v souvislosti s herpetickým onemocněním.
- Antidepresiva – amitriptylin podaný v časné fázi AHZ (počátek kožních projevů) redukuje incidenci PHN. V dávce 25–50 mg denně je doporučeno pokračovat 3 měsíce. Není-li amitriptylin tolerován, či je kontraindikován, je možno podat klomipramin či nortriptylin.
- Antikonvulziva – jsou indikovaná v případě paroxyzmální, vystřelující, bodavé a neuralgiformní bolesti. Možno podat karbamazepin, gabapentin, klonazepam titračním způsobem ve stoupajících dávkách.
- Analgetika – dle 3stupňového žebříčku a intenzity bolesti včetně silných opioidů. Při neztišitelné formě akutní bolesti je možno podat silný opioid i parenterálně, např. i.v. titračně (alfentanil po 0,250 mg, piritramid
po 2,5 mg, morfin po 2 mg) do dosažení efektu a pak navázat formou s postupným uvolňováním.
V jednotlivých případech mohou být prospěšné: kortikosteroidy celkově i lokálně (ale nelze je užít paušálně); topicky krém s kapsaicinem; aplikace roztoku ASA/chloroform; lidokain místně (náplast).
Farmakoterapie je v popředí léčby celého klinického průběhu AHZ. Nedaří - li se bolest ovlivnit, je nutno pacienta odeslat na pracoviště léčby bolesti (sympatické blokády, epidurální analgezie apod).
Chronické bolestivé stavy
Základní dělení dle etiologie:
1. bolest nociceptivního původu
2. bolest neuropatického původu
3. bolest psychogenní
4. bolest dysautonomní
5. bolest smíšená1. Bolest nociceptivní
Vzniká podrážděním nociceptorů,
které se nalézají v oblasti tkání (měkké
tkáně, kůže, sliznice a periost).Příklady typických syndromů:
• vertebrogenní bolesti zad
• osteoartrózy a osteoartritidy různé etiologie
• fibromyalgické poruchyFarmakoterapie:
• aplikace 3stupňového analgetického žebříčku, dle klinického obrazu adjuvantní a pomocná léčiva
2. Bolest neuropatická
Vzniká postižením nervového systému periferního či centrálního.Příklady periferních neuropatických bolestivých stavů:
• postherpetická neuralgie
• polyneuropatické poškození různé etiologie (infekční, metabolické, toxické, poradiační aj)
• traumatické poškození periferních nervůPříklady centrálních neuropatických bolestivých stavů:
• talamická bolest
• bolest při postižení centrálního nervového systému během neurologickém onemocnění (syringomyelie, stp. CMP různé etiologie, zánětlivá a nádorová onemocnění v centrálním nervovém systému aj)
• fantomová bolest (zvláštní forma)Farmakoterapie
- základem terapie je použití antidepresiv a antikonvulziv (AA) dle charakteru bolesti:
Konstantní pálivá, palčivá bolest – první volbou jsou antidepresiva I. generace (amitriptylin, klomipramin, dosulepin). Antidepresiva ze skupiny SSRI (selektivní inhibitory zpětného vychytávání serotoninu) jsou méně účinná. U nejnovějších antidepresiv typu SNRI (selektivní inhibitory zpětného vychytávání serotoninu a noradrenalinu) – venlafaxin, duloxetin se účinnost blíží tricyklickým antidepresivům. Dávky se podávají nižší než v psychiatrických indikacích, nástup analgetického účinku je po 7 až 14 dnech, dříve než účinek antidepresivní. Nedosáhne-li se postupnou titrací klinického efektu, přidává se antikonvulzivum.
Paroxyzmální, neuralgiformní, vystřelující a bodavá bolest – primárně jsou indikovaná antikonvulziva (karbamazepin, kyselina valproová, pregabalin, gabapentin, klonazepam, fenytoin, topiramát, lamotrigin). Antidepresivum se přidává následně při nedostatečném klinickém účinku.
Třetí skupinou léčiv k terapii neuropatické bolesti s prokázanou účinností jsou opioidní analgetika. Nedávné klinické studie a metaanalýzy ukázaly, že jejich účinnost je srovnatelná s antidepresivy a antiepileptiky.
- analgetika ze 3stupňového žebříčku rovněž připadají v úvahu, nejsou však léky první volby. Užití silných opioidů se řídí doporučeným postupem (viz níže). Antagonisté NMDA receptorů (ketamin, amantadin), lokální anestetika (mezokain, lidokain), centrální myorelaxancia, α-agonisté (klonidin, tizanidin), GABA agonisté (baklofen) mohou být efektivní, nejsou však léky první volby.
3. Bolest psychogenní
Jedná se o typ chronické bolesti, u které převažuje nebo dominuje psychická komponenta. Např. u depresivních poruch a některých neuróz je bolest somatickou projekcí primárních psychických obtíží. Dle Holmgrena aWise nejčastějšími psychiatrickými poruchami, které mohou způsobit, zhoršit či doprovázet bolest jsou:
- somatoformní poruchy, hypochondrie a simulace
- předstíraná (faktitivní) porucha
- disociační a psychotická porucha
- poruchy osobnosti
Farmakoterapie
- Základ terapie tvoří psychofarmaka, která jsou indikována po podrobném vyšetření pacienta a stanovení druhu psychogenního postižení. Základní chybou je nasazení analgetické léčby u dominující psychogenní bolesti. Terapie je neúčinná, a to i při opakovaných záměnách samostatných analgetik včetně opioidů. Použití tricyklických antidepresiv (TCA) ze škály psychofarmak zde není imperativem, uplatní se i další druhy psychofarmak (SSRI, SNRI), jejichž sporný samostatný analgetický efekt zde není klíčový.
4. Bolest dysautonomní
Jedná se o typ bolesti, u níž má zásadní podíl na intenzitě, resp. chronifikaci příznaků autonomní vegetativní systém, zejména sympatikus. Při akutní bolesti se podílí na typické reakci typu „fright, fight or flight“(úlek, příprava na boj a útěk), u bolesti¨chronické má potom významný podíl na udržování patologického stavu organizmu a bolesti samotné. Typickým příkladem je komplexní regionální bolestivý syndrom (KRBS)typu I. (reflexní sympatická dystrofie, algodystrofie) a typu II. (kauzalgie).
Farmakoterapie
- je založena na dominující etiologii onemocnění a ovlivnění jeho vegetativních příznaků. V počátcích u typu I. se používá tzv. Mikešova směs (Prothiaden, Secatoxin, Xanidil, Plegomazin), při typu II. se využívá i strategie léčby bolesti neuropatické (viz výše). Analgetická terapie se řídí obecnými zásadami 3stupňové škály dle WHO, včetně indikace opioidů. Farmakoterapie u KRBS může sloužit jako model analgetické terapie i u chronických stavů, u nichž je významný podíl vegetativních příznaků.
5. Bolest smíšená
Jedná se o stavy, na kterých se podílí více předchozích typů bolesti. Velmi častá je kombinace bolesti neuropatické s nociceptivní (např. failed back surgery syndrome). Asi u 40 % pacientů s chronickou bolestí je prokazatelná psychogenní složka bolesti.
Farmakoterapie
- Odvíjí se od převažujícího podílu jednotlivých složek, které se podílí na bolestivém stavu.
Pravidla pro léčbu opioidy u chronické nenádorové bolesti (CHNNB)
Kritéria pro zahájení léčby opioidy
- Léčba opioidy je indikována u nemocných, u kterých v léčbě chronické bolesti selhaly standardní léčebné postupy. Rozhodující je intenzita bolesti, ne její původ. Léčba opioidy, zejména ve vybraných případech (např. abúzus alkoholu a psychotropních látek, nejistá sociální anamnéza, poruchy chování, nejasná příčina bolesti) by měla být zahájena, či alespoň konzultována, na specializovaném pracovišti pro léčení chronické bolesti. K léčbě opioidy je indikován nemocný, jehož kvalita života je chronickou bolestí výrazně alterována. Další terapie, která přispívá k dosažení úlevy od bolesti, by měla být ponechána (TENS, antidepresiva, léčebná rehabilitace, psychoterapie apod).
- Bolest musí být opioid-senzitivní. K tomu může sloužit intravenózní test s morfinem či fentanylem provedený ambulantně. Prediktivní hodnota negativního výsledku intravenózního testu je dobrá, pozitivního výsledku testu je nízká. Jako přínosnější pro určení citlivosti chronické bolesti na opioidy se ukazuje pomalá perorální titrace např. morfinem IR (immediate release).
- Indikující lékař by měl být dobře seznámen s psychosociální situací nemocného. Významná je anamnéza abúzu alkoholu, psychotropních látek a léků (benzodiazepiny, barbituráty apod), kouření cigaret. Pozitivní anamnéza abúzu je relativní kontraindikací pro léčbu opioidy.
- Dlouhodobá léčba opioidy je možná jen tehdy, je-li navozena vzájemná důvěra mezi lékařem a pacientem. Léčba opioidy není právem ani privilegiem nemocného. Nemocný musí být dobře informován o možných vedlejších účincích a potenciálním riziku této léčby. Je doporučeno získání informovaného souhlasu s podpisem pacienta. Nemocný se tak podílí na rozhodování o typu léčby, více akceptuje faktická rizika spojená s podáváním opioidů a lépe dodržuje pravidla terapie.
- Důležité je stanovení reálných cílů léčby.
- Léčba musí být analgeticky efektivní a měla by vést ke zvýšení funkční kapacity nemocného a rozsahu jeho denních aktivit. V průběhu léčby je nutno opakovaně hodnotit, zda jsou naplňovány dva základní cíle léčby CHNNB: úleva od bolesti a zlepšení funkce. Izolované navození psychického komfortu se zhoršením funkčního stavu (funkce psychické, fyzické, sociální) je důvodem k přerušení léčby opioidy. V některých případech však nelze při limitujícím somatickém postižení očekávat zlepšení fyzických funkcí.
- Pravidelné kontroly jsou pro adekvátní monitoraci stavu pacienta a dodržování léčebného režimu nezbytné. Po celou dobu léčení musí být vedena přesná a odpovídající dokumentace.
- Za předpis opioidů musí být zodpovědný jeden lékař (jedno pracoviště) a léky vydává jedna lékárna.
Kritéria pro přerušení léčby opioidy
- Nedosažení efektivní analgezie. U nemocného s chronickou bolestí však může být i nevelký pokles ve VAS (vizuální analogová stupnice 0–10; např. z 8 na 6), neuspokojivý pro léčení akutní bolesti, pro tohoto nemocného přínosný.
- Nedostatečné zvýšení rozsahu aktivit a izolované ovlivnění psychiky v euforizujícím smyslu.
- Nekontrolované zvyšování dávky, užívání nepředepsaných léků, nedodržení léčebného režimu.
- Střídání lékařů a snaha sehnat opioidy jinde. Ad 3 a 4 koresponduje se známkami psychické závislosti – jde o projevy adiktivního chování.
Praktické poznámky k dlouhodobé léčbě opioidy u CHNNB
Volba opioidu
Přednost mají μ agonisté (morfin, fentanyl, oxykodon, hydromorfon) a některé jiné opioidy (buprenorfin). Po pozitivním testu na opioid-senzitivitu jsou jednoznačně preferovány lékové formy s postupným uvolňováním(morfin SR, fentanyl TTS, buprenorfin TDS, oxykodon CR). Parenterální formy opioidů nejsou v léčbě chronické bolesti vhodné. O volbě vlastního opioidu rozhoduje zkušenost lékaře a individuální kontext celkového zdravotního stavu pacienta. Skupina agonistů-antagonistů není pro léčbu CHNNB vhodná (stropový efekt, psychomimetické účinky). Pro léčbu CHNNB jsou zcela nevhodné intermitentní intramuskulární injekce opioidů. Zvláště nevhodný je petidin (psychomimetické účinky, toxické metabolity) a pentazocin.
Zahájení léčby
Zásadně titrujeme od nejnižších dávek, např. rychle se uvolňující morfin (IR) či morfin magistraliter 5 mg po 6–12 hod, morfin SR 10 mg po 12 hod, fentanyl TTS 12–25 μg/h, buprenorfin TDS 35 μg/h (ev. 1/4 až 1/2 náplasti) tak, abychom zachytili nežádoucí účinky léčby (nauzea, zvracení, sedace, deprese kognitivních funkcí, útlum dechu z předávkování) a mohli jim předejít podáním adjuvantních léků (metoklopramid apod). Jsou-li přítomny pozitivní anamnestické známky intolerance opioidů (nevolnost, zvracení), je vhodné antiemetické zajištění od počátku léčby, např. metoklopramid 3krát 10 mg či thietylperazin 2krát 6,5 mg, ev. čípek. Hledání účinné dávky opioidu může trvat i několik týdnů. Při přechodu i z relativně vysokých dávek slabých opioidů (dihydrokodein, tramadol) začínáme zásadně s nejnižší možnou dávkou silného opioidu. Neuvážlivé zahájení léčby neadekvátně vysokou dávkou je pro pacienta nebezpečné a může diskreditovat jeho cílový analgetický efekt.
Udržování léčby
Neexistuje maximální dávka silného opioidu. Optimální denní dávka je taková, při které je dosaženo uspokojivé analgezie při minimu vedlejších účinků opioidů (terapeutická odezva na opioidy – opioid responsiveness). I zdánlivě malý pokles v intenzitě bolesti může být pro pacienta s CHNNB přínosný a může vést ke zvýšení denních aktivit, funkčních schopností a kvality života. Ztrácí-li léčba na účinnosti nebo dominantními se stávají vedlejší účinky, je doporučována tzv. rotace opioidů. V této situaci je vhodné dávku nového opioidu zpočátku redukovat o 30 až 50 % bez ohledu na ekvianalgetické dávky (viz tab. 1 – ekvianalgetické dávky opioidů doporučované SSLB).
2. Ekvianalgetické dávky opioidů. 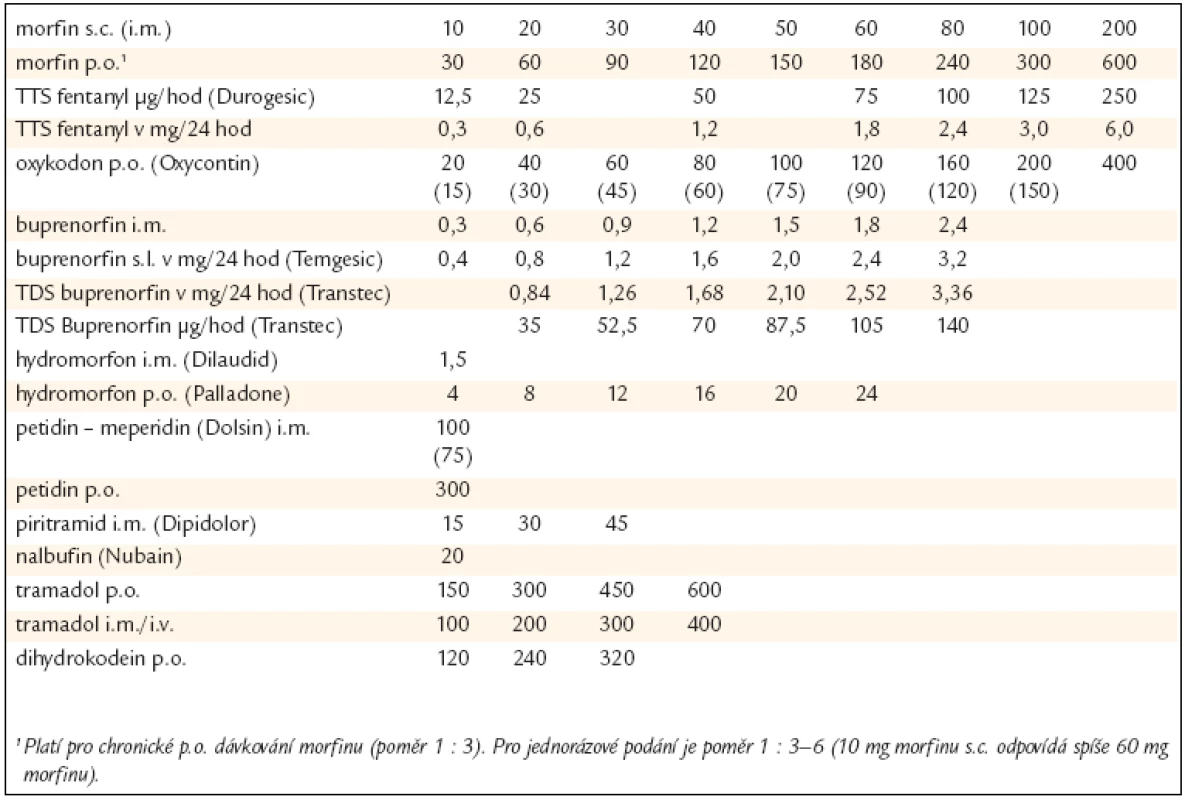
Záchranná analgetická léčba
Na rozdíl od bolesti nádorového původu není poskytována paušálně, ale přísně individuálně. Podle charakteru bolesti může být vhodný buď silný opioid (IR forma) nebo některá z rozepsaných forem morfinu připraveného magistraliter, vhodný opioid jiného typu (tramadol) či analgetikum z 1. stupně analgetického žebříčku. Je-li indikován jako „záchranné“ analgetikum silný opioid, velikost jednotlivé dávky se rovná 10–15 % celkové denní dávky základního opioidu. Předepisuje se omezené množství opioidu a užití záchranného analgetika by měl pacient zaznamenat (deník bolesti).
Ukončení léčby
Postup závisí na denní dávce, trvání léčby a spočívá v postupném snižování dávky v rozmezí dnů až týdnů. Je nutno důsledně uplatnit individuální přístup. Prospěšné mohou být v této fázi i adjuvantní léky: klonidin 2krát 0,150 mg, β-lytika (např. metipranol 2krát 5 mg), neuroleptika (např. tiaprid 3krát 100 mg), trankvilizéry a antidepresiva. Náhlé odnětí opioidu může vést k rozvoji abstinenčního syndromu jako projevu fyzické závislosti. Každého pacienta léčeného opioidy je nutno považovat za jedince s fyzickou závislostí, proto je nezbytné provádět vysazovaní léčby zásadně dle instrukcí a pod kontrolou lékaře.
Přílohy
Srovnání analgetické účinnosti analgetik
Nedávno byl sestaven žebříček analgetik na základě metaanalýz četných klinických zkoušení analgetik určených pro akutní bolest podle zásad medicíny založené na důkazech (tzv. oxfordská liga analgetik). Tyto metaanalýzy používají jako kritérium analgetické účinnosti tzv. NNT hodnotu (The Number Needed to Treat), udávající počet pacientů (nereagujících na placebo), který musí být léčen určitým analgetikem, aby alespoň u jednoho z nich došlo nejméně k 50% poklesu intenzity bolesti. Např. NNT 2 udává, že analgetikum má tento efekt u 1 ze 2 pacientů (nereagujících na placebo). Čím nižší je hodnota NNT, tím vyšší je pravděpodobnost, že léčivo bude tlumit bolest. Výhodou NNT hodnoty (mimo jiné) je, že připomíná interindividuální rozdíly v účincích analgetik, což je velmi důležité mít na zřeteli právě při volbě analgetik v lékařské praxi. Výsledky zveřejněné v oxfordské lize analgetik svědčí pro to, že nejvyšší pravděpodobnost analgetického účinku mají u akutních (pooperačních) bolestí nesteroidní antirevmatika - antiflogistika (NSA), kombinace paracetamolu s opioidy podané ve vysokých (ale ještě přípustných) dávkách a metamizol (schéma 3, skupina 1).
Samotná kyselina acetylsalicylová nebo paracetamol tlumily bolest s menší pravděpodobností než výše uvedená léčiva, a to i v nejvyšších jednotlivých dávkách (1 000 mg, schéma 3, skupina 2).
Nejhůře se v oxfordské lize analgetik umístily samotné slabé opioidy, tramadol se dostal do skupiny s NNT 4,1–6 (schéma 3, skupina 3), a to až v dávce 100 mg, samotný kodein (60 mg) se podle metaanalýz, nelišil od placeba.
Oxfordská liga tak upřesňuje některé dosavadní vžité představy o účinnosti analgetik. I když má své meze (měří spíše pravděpodobnost, než intenzitu analgetického účinku, vychází z účinků jednorázové aplikace analgetik u pooperační bolesti), stává se (spolu s 3stupňovým analgetickým žebříčkem WHO) určitým vodítkem pro volbu analgetik při farmakoterapii akutní bolesti. Dle klinických zkušeností však je zřejmé, že mnohá analgetika s nízkou účinností u bolesti akutní dle NNT mají dobrý analgetický efekt u bolesti chronické (slabé opioidy). Vzhledem k menší pravděpodobnosti analgetického působení samotných slabých opioidů podle oxfordské ligy analgetik, řadíme zde samotné slabé opioidy do 1. stupně (vedle neopioidních analgetik). Protože pravděpodobnost analgetického působení slabých opioidů se podle metaanalýz významně zvyšuje při jejich kombinaci s neopioidními analgetiky, uvádíme tyto kombinace ve druhém stupni – tak jak to bylo v původním (i pozdějších) analgetických žebříčcích WHO.
Neopioidní analgetika
Analgetika-antipyretika
- Paracetamol/acetaminofen – v terapeutických dávkách (tj. max. 1 000 mg nejdříve po 4 h, max. 4 g denně) patří mezi relativně nejbezpečnější analgetika. Je také nejlevnějším a gastrointestinálně šetrným analgetikem. Důležité je ho však podat v dostatečné dávce, tj. 650 až 1 000 mg pro dosi u dospělého (u dětí až 15 mg/kg pro dosi). Paracetamol je jen vzácně přísně kontraindikován a lze jej využít i v průběhu gravidity.
- Kyselina acetylsalicylová – jako analgetikum již byla většinou překonána jinými účinnějšími a někdy i bezpečnějšími NSA, zejména ibuprofenem. Maximální denní dávka z indikace léčby bolesti je 3 000 mg.
- Bazické (nekyselé) pyrazolony – např. metamizol (500–1 000 mg pro dosi u dospělého, 4 000 až 6 000 mg pro die) nebo propyfenazon. Pyrazolony mají velmi dobrou analgetickou účinnost bez závažných gastrointestinálních rizik. Vzácně mohou způsobit nebezpečné poruchy krvetvorby nebo anafylaktické šokové reakce. Jejich používání nebývá doporučováno. Jde spíše analgetika poslední volby a zejména nejsou vhodná pro chronickou bolest.
Nesteroidní antiflogistika a antirevmatika (NSA)
NSA tlumí bolest podle metaanalýz se stejnou pravděpodobností jako morfin. NSA lze považovat za velmi účinná analgetika. Dosavadní poznatky svědčí pro to, že analgetická účinnost četných NSA se v průměru příliš neliší (u jednotlivých pacientů se však může značně lišit). Analgetický efekt NSA je závislý na velikosti dávky. Další výhodnou vlastností u NSA je minimální tolerance i při dlouhodobém používání a neexistence fyzické závislosti.
Jednou z hlavních nevýhod NSA je riziko závažných nežádoucích gastrointestinálních účinků, zejména krvácení do trávícího traktu. To je zvýšeno nejen u vředové choroby a po vyšších dávkách, ale i u starších osob (nad 65 let), při současném podávání kortikoidů, antikoagulancií nebo dalších NSA. Kromě toho zvyšují NSA u seniorů poněkud riziko závažných nežádoucích kardiovaskulárních účinků (infarktu myokardu, iktu, hypertenze) a poškození ledvin. Proto se doporučuje dávat u seniorů přednost paracetamolu, opioidům, případně jejich kombinaci před NSA. Relativní riziko závažných gastrointestinálních nežádoucích účinků je u různých NSA různé (může být minimální až vysoké). Je minimální u nejnovějších NSA, selektivních inhibitorů COX-2 (koxiby, např. rofekoxib, parekoxib) a největší u starších, klasických NSA, které tlumí COX-1 i COX-2 (neselektivní inhibitory COX), i když i mezi nimi jsou značné rozdíly (nejmenší riziko má ibuprofen). U tzv. přednostních (preferenčních, částečně selektivních) inhibitorů COX-2, které tlumí COX-2 mnohem více než COX-1 (např. nimesulid), se předpokládá menší riziko nežádoucích gastrointestinálních účinků než u starších NSA neselektivních inhibitorů COX. Při indikaci NSA je třeba vždy zvážit gastrointestinální a kardiovaskulární rizika a případně přidat k terapii gastroprotektivní (omeprazol) nebo kardioprotektivní léčbu. Neselektivní inhibitory COX (starší, klasická NSA)
- Ibuprofen – je gastrointestinálně nejšetrnějším klasickým NSA (v dávkách do 1 200 mg/den). Relativní,riziko GI krvácení po nejméně 3měsíčním, podávání ibuprofenu bylo 2,0. Tlumí bolest s vysokou pravděpodobností, a to již ve volně prodejné dávce 200 mg. Dosis maxima pro die – 2 400 mg.
- Diklofenak – je někdy považován za analgeticky účinnější než ibuprofen. To však platí spíše pro určitého konkrétního pacienta, než obecně: v lize analgetik (schéma 3) byly nejčastěji používané dávky ibuprofenu (400 mg) a diklofenaku (50 mg) stejně účinné. Diklofenak patří mezi klasická NSA s menším rizikem krvácení z peptického vředu (relativní riziko 4,2). Důležité je rozlišovat, zda se jedná o přípravky s normálním,
bezprostředním úplným uvolněním účinné látky (IR forma), které mají rychlý nástup účinku, ale tlumí bolest jen několik hodin, nebo o retardované přípravky s postupným (řízeným) uvolňováním účinné látky (SR a CR formy). Perorální přípravky s postupným uvolňováním mívají (až na výjimky) pomalejší nástup účinku. Jsou dostupné i farmaceutické formule se složkou IR (25 mg) i SR (50 mg), kde se uplatňuje jak rychlý nástup, tak i dostatečně dlouhé trvání (až 24 h) analgetického účinku. Přípravky s řízeným uvolňováním diklofenaku die – 150 mg. - Piroxikam – má na rozdíl od ostatních NSA velmi dlouhý poločas eliminace (průměrně 50 h), což sice umožňuje delší trvání účinku, ale je také spojeno s pomalejším nástupem hladin a účinku a delší trváním dosažení ustálených hladin (několik dní). Komplex piroxikamu s beta-cyklodextrinem má rychlejší disoluci. Piroxikam je více GI rizikový (relativní riziko GI krvácení bylo 13,7). Dos. max. pro die – 20 mg.
- Kyselina tiaprofenová – analgetický efektivní, dos. max. pro die – 900 mg.
- Naproxen – má poněkud delší poločas (13 h) než většina ostatních klasických NSA a patří v některých zemích k nejpoužívanějším NSA. Má střední riziko GI krvácení (relativní riziko 9,1). Dos. max. pro die – 1 000 mg.
- Ketoprofen – účinný je pravotočivý dexketoprofen, má rychlejší nástup účinku. Ketoprofen bývá analgeticky účinný, má však i vysoké riziko GI krvácení (relativní riziko 23,7). Dos. max. pro die – 300mg.
- Indometacin – silný analgetický účinek, vysoké riziko GIT krvácení, nevhodný pro chronické užívání, dos. max. pro die – 200 mg krátkodobě.
Přednostní COX-2 inhibitory
- Nimesulid – dobrý analgetický efekt (jeho NNT není známo), není však prostý GI nežádoucích účinků. Hepatotoxicita nebyla potvrzena.Dos. max. pro die – 200 mg.
- Meloxikam – dle SPC (Souhrnu údajů o přípravku) určen pouze pro revmatické choroby, v zahraničí se však používá i u dalších bolestí. Dos. max. pro die – 15 mg. Výhodou je dlouhý poločas umožňující dávkování 1krát denně, nevýhodou pomalý nástup účinku.
Selektivní COX-2 inhibitory
Selektivní inhibitory cyklooxygenázy 2 (COX-2) – koxiby – tlumí bolest s podobně vysokou pravděpodobností jako neselektivní klasická NSA, avšak na rozdíl od nich mají nižší gastrointestinální toxicitu, která se někdy téměř neliší od placeba. Nicméně koxiby jsou kontraindikovány u pacientů s aktivní peptickou vředovou chorobou. V poslední době je poměr terapeutického prospěchu a rizika koxibů přehodnocován. Pro závažné nežádoucí účinky (kardiovaskulární nebo kožní) byly z trhu staženy rofekoxib a valdekoxib. V současné době jsou na trhu 3 koxiby – celekoxib, parekoxib a etorikoxib. Celekoxib a etorikoxib jsou určeny pro léčbu revmatoidní artritidy a osteoartrózy.
- Parekoxib – je zatím jediným injekčním koxibem. Je určen pro léčbu pooperační bolesti.
- Etorikoxib – nejrychlejší nástup účinku ze skupiny COX-2 inhibitorů, indikovaný u akutního dnavého záchvatu.
Opioidní analgetika
Farmakologický účinek opioidních analgetik se rozvíjí obsazením opioidních receptorů. Nejvýznamnější je analgetický účinek, ale opioidy mají na lidský organizmus komplexní vliv.
U lidí se uplatňují 3 druhy opioidních receptorů: μ, κ a δ, přičemž ještě mohou existovat jejich podtypy (např. μ1 a μ2). Opioidní analgetika se liší ve své afinitě a vnitřní aktivitě vůči těmto receptorům, a samozřejmě i ve svých farmakokinetických vlastnostech.
To může být příčinou vysoké variability v individuální odpovědi na opioidy a zároveň podkladem pro provedení tzv. rotace (záměny jednoho opioidu druhým pro nesnášenlivost nebo nedostatečnou účinnost prvního). Opioidní analgetika patří podobně jako paracetamol mezi nejbezpečnější analgetika. Opioidy nejsou toxické pro parenchymatózní orgány a hematopoezi. Mohou sice způsobit různé nežádoucí účinky (nevolnost, zvracení, sed ce, dezorientace, pruritus, obstipace), ale téměř žádný z nich při adekvátním terapeutickém postupu neohrožuje život pacienta. Riziko vzniku psychické závislosti (léková, chemická závislost, toxikomanie) u pacientů bez anamnézy abúzu (alkohol, psychofarmaka, jiná závislost) je nízké. Každý pacient dlouhodobě léčený opioidy však musí být považován za fyzicky závislého.Tzn. při náhlém vysazení je riziko vzniku abstinenčního syndromu. Vznik tolerance na analgetický účinek není vážný problém léčby opioidy. Opioidy lze při intenzivní bolesti podávat i v průběhu gravidity. Pro plod je rizikové perinatální období, v němž existuje nebezpečí útlumu dechového centra. Dalším rizikem pro plod je dlouhodobé užívání opioidů matkou (jako u toxikomanie), při němž je nutno počítat s fyzickou závislostí novorozence.
Slabé opioidy
Ve srovnání se silnými opioidy mají sice slabší analgetický efekt, ale s jejich vedlejšími účinky (nevolnost, obstipace, ovlivnění kognitivních funkcí atd) je nutno rovněž počítat. Farmakologicky jde o slabé μ agonisty (tramadol, kodein, dihydrokodein) nebo smíšené agonisty-antagonisty s parciální aktivitou na μ - a κ-receptorech (pentazocin, butorfanol, nalbufin). Použití agonistů-antagonistů a parciálních agonistů může být limitováno stropovým efektem. V České republice jsou v současné době k dispozici tyto slabé opioidy:
- Tramadol – jeho hlavní výhodou je relativně nízké riziko zácpy, vzniku závislosti, dobrá biologická dostupnost po perorální aplikaci a velký počet lékových forem. Někteří pacienti však po něm mívají závratě nebo nauzeu, vzácněji i jiné nežádoucí účinky. Bohužel analgetická aktivita samotného tramadolu může být mnohdy nedostatečná. Jak ukázal poslední výzkum, analgetický účinek tramadolu se však dá podstatně zvýšit současným podáváním paracetamolu. Kombinace paracetamolu (650 mg) s tramadolem (75 mg) se výborně umístila v lize analgetik (schéma 3, skupina 1). Dos. max pro die – 600 mg.
- Kodein – je analgeticky poměrně slabý, a proto se používá prakticky jen v kombinacích, nejlépe s paracetamolem. Dostatečnou dávkou u dospělého je alespoň 650 mg paracetamolu + 60 mg kodeinu (viz oxfordská liga analgetik – schéma 3, skupina 2). Kombinace 1 000 mg paracetamolu + 60 mg kodeinu se dostala dokonce na přední místa ligy analgetik schéma 3, skupina 1). Dos. max. pro die – 240 mg.
- Dihydrokodein – jeho analgetická účinnost je však po perorální aplikaci obdobná jako u samotného kodeinu. Maximální racionální dos. pro die – 360 mg.
- Pentazocin, butorfanol a nalbufin – jsou určeny pro akutní nebo krátkodobou bolest, nejsou vhodné pro chronickou bolest. Patří mezi tzv. smíšené agonisty-antagonisty (aktivují κ-receptory, ale antagonizují μ-receptory) a mají malou biologickou dostupnost per os, takže se musí podávat parenterálně s výjimkou pentazocinu. U této skupiny se uplatňuje stropový efekt (další zvyšování dávek nezvýší analgetický efekt, pouze nežádoucí účinky).
Silné opioidy
Silné opioidy jsou plnými agonisty na μ receptorech a jsou určeny pro silné, neztišitelné bolesti, které nelze dostatečně zmírnit neopioidními analgetiky nebo slabými opioidy. Maximální denní dávky silných opioidů nejsou určeny a nejsou limitovány stropovým efektem. Postup určují pravidla pro léčbu opioidy u CHNNB (viz výše). V České republice jsou v současné době k dispozici tyto opioidy:
- Morfin – je klasickým standardem v léčbě silné bolesti. Injekční forma je vhodná pro léčbu silné akutní bolesti, per os SR formy s postupným uvolňováním působící 12 h nebo až 24 h jsou určeny pro chronickou
bolest. Pro léčbu průlomové bolesti je vhodný morfin s bezprostředním uvolňováním (IR forma). - Fentanyl v transdermálním terapeutickém systému – vhodný pro léčbu silné chronické bolesti. Transdermální aplikace prostřednictvím depa (rezervoáru) umístěného v náplasti, nebo přímo, z modernější, bezpečnější a terapeuticky výhodnější matrixové náplasti, zajišťuje 3denní působení. Výhodou léčby fentanylem v TTS je velmi stabilní plazmatická koncentrace fentanylu. Ve srovnání s jinými opioidy byl u fentanylu v této lékové formě zaznamenán nižší výskyt obstipace. • Hydromorfon – efektivní μ-agonista, v perorální formě je určen pro léčbu NB, lze jej uplatnit obecně v rámci rotace opioidů.
- Oxykodon – systém s řízeným uvolňováním, další silný opioid pro léčbu silné CHNNB a v některých případech i AB.
- Buprenorfin – z farmakologického hlediska se jedná o parciálního agonistu na μ-receptorech a antagonistu na κ-receptorech. Přesto je řazen do skupiny silných opioidů, neboť vyšší dávky jsou ekvianalgetické
jiným silným opioidům. Trvání účinku je 6–8 h (injekční a sublingvální forma). Preskripce buprenorfinu je nyní vázána na recepty s modrým pruhem. V transdermální formě (systém TDS) se aplikuje na 72 hod. Sublingvální forma je při léčbě TDS buprenorfinem vhodná pro průlomovou bolest. Tento opioid lze užít i v rámci rotace silných opioidů (pokud nejde o režim s vysokou denní dávkou opioidu). Dos. max. dle SPC je 140 μg/h, ale tato dávka má význam doporučení.Není zcela jasné,jaký je klinický význam stropového efektu. - Petidin/meperidin – má ve srovnání s morfinem nižší spazmogenní efekt, je tudíž vhodnější u akutní kolikovité bolesti. Petidin však má kratší trvání účinku (2 h), a navíc není vhodný pro chronickou léčbu, protože se při ní může hromadit toxický metabolit norpetidin způsobující třes, myoklony, neklid až křeče. Je také třeba se vyvarovat interakce pethidinu s inhibitory monoaminooxydázy, při níž hrozí nebezpečné poruchy CNS (koma nebo excitace), výrazné změny krevního tlaku a činnosti srdce a hyperpyrexie.
- Piritramid – v injekční formě vhodný pro silnou akutní bolesti (pooperační analgezie). Jeho účinek trvá poněkud déle (4–6 h) než u pethidinu, snášenlivost je statisticky podobná jako u jiných opioidů, snad způsobuje méně často zvracení.
Adjuvantní analgetika (AA)
Jedná se o skupinu léků, primárně určenou pro jinou indikaci než je bolest (epilepsie, deprese atd). AA se užívají pro svůj analgetický efekt samostatně nebo jako doplněk při základní analgetické medikaci. Portenoy dělí adjuvantní analgetika na 4 základní velké skupiny:
Víceúčelová AA – působí adjuvantně u většiny typů chronické bolesti
- Antidepresiva (AD) I. generace – amitriptylin, titrační podávání, maximálně do 100 mg denně, riziko anticholinergních projevů, kontraindikace – glaukom, hypertrofie prostaty, arytmie. Klomipramin, nižší anticholinergní projevy, stejné dávkování. Dosulepin, dobře snášen, do 150 mg denně. AD II. a III. generace – maprotilin, fluoxetin, paroxetin, citalopram – jsou indikována v případě zvýšeného rizika AD I.generace. AD III. generace (SSRI) nižší vlastní analgetický efekt než AD I. generace. AD typu SNRI – venlafaxin, je analgeticky účinnější než AD typu SSRI, podává se v jedné denní dávce 75–150 mg. Pro indikaci „algická forma diabetické polyneuropatie“ je možno použít duloxetin.
- α2-adrenergní agonisté – klonidin, tizanidin mohou být účinné u chronické refrakterní bolesti s dysfunkcí sympatiku. Klonidin potlačuje projevy abstinenčního syndromu.
- Kortikosteroidy – mívají podpůrný efekt u některých typů chronické refrakterní bolesti – metylprednizolon, dexametazon v ekvivalentních dávkách v počáteční nárazové dávce a následné udržovací. Riziko iritace GIT, poruchy tolerance glukózy, koagulopatie, osteoporózy atd.
AA pro neuropatickou bolest
- Antikonvulziva a GABA agonisté – karbamazepin do 1 600 mg pro die, kyselina valproová do 1 000 mg pro die, gabapentin do 3 600 mg pro die, pregabalin 150–300 mg pro die (výhodný bezpečnostní profil, nízký výskyt lékových interakcí a efektivita jsou faktory, pro které jsou gabapentin a pregabalin uváděny jako antikonvulziva první volby pro neuropatickou bolest), klonazepam do 3 mg pro die.
- Lokální anestetika – mexiletin, mezokain v pomalé infuzi.
- Alcitonin – bývá efektivní u bolesti udržované sympatikem a u bolestí při osteoporóze.
- Sympatolytika – prazosin, fenoxybenzamin – při dysfunkci sympatiku.
AA pro muskuloskeletánní bolest
Centrální myorelaxancia mohou mít analgetický efekt zejména u některých typů akutních bolestí zad.
AA pro nádorovou bolest
Viz doporučený postup pro farmakoterapii nádorové bolesti.
Pomocná léčiva
Jsou to léčiva používaná k prevenci a léčbě nežádoucích účinků analgetik.
Antiemetika
Zahájení léčby opioidy bývá u vnímavých jedinců spojeno s výskytem nauzey a zvracení. Pacient, u kterého je zahajována léčba opioidy, by měl mít k dispozici antiemetikum. V případech, v nichž je pozitivní anamnéza nevolnosti v souvislosti s opioidy či výskyt kinetózy, by podání antiemetik mělo být zahájeno současně s opioidy. Vhodný je metoklopramid 3krát 1 tbl a` 10 mg, haloperidol 2krát 5 kapek (0,5 mg), thiethylperazin 2krát 6,5 mg, ev. 2krát čípek. Při nedostatečném efektu a nutnosti podávat opioidy připadají v úvahu i inhibitory 5-HT3 receptorů – ondansetron, tropisetron, granisetron.
Laxativa
Pravidelný problém léčby opioidy představuje obstipace, zpravidla výraznější u perorálních opioidů. Vedle úpravy diety (dostatek zeleniny, ovoce, kompoty, kysané mléčné produkty, tekutiny) jsou často nutná laxativa. Nejvhodnější jsou osmotická laxativa – laktulóza 3krát 1 až 2 lžíce. Další možností jsou stimulační laxativa – sena, bisakodyl, dále pikosulfát sodný, parafinové projímadlo, glycerinový čípek. Je vhodné laxativa střídat.
Gastroprotektiva
Riziko vzniku ulcerogenních defektů a závažného krvácení do GIT v souvislosti s podáváním NSA může snížit současné podání antagonistů H2-receptorů, ale především inhibitorů protonové pumpy. Při chronickém podávání NSA a při zvýšeném riziku gastropatie (pozitivní anamnéza, kortikoidy, antikoagulancia) je vhodné současné podávání omeprazolu 1krát až 2krát denně 20 mg. U podávání antagonistů H2-receptorů není tento protektivní účinek tak spolehlivý (ranitidin, famotidin).
Psychostimulancia
U některých jedinců nelze dosáhnout efektivní analgezie opioidy, jelikož dříve nastupuje sedativní efekt a deprese kognitivních funkcí. Určitým řešením může být užití psychostimulancií – kofein (šálek kávy), ev. metylfenidát 2krát 1 tbl.
Antipruriginóza
Při svědivce v souvislosti s podáváním opioidů může být přínosné podání redukované dávky antihistaminika – např. bisulepin 2krát 1/2 tbl.
Ekvianalgetické dávky opioidů
Základním porovnávacím parametrem je analgezie navozená 10 mg morfinu s.c. Přepočet má orientační hodnotu a je nutno brát v úvahu četné interindividuální diference (věk, aktuální bolest, vedlejší efekty, vnímavost na opioidy, cestu podání, opioid na který se rotuje – viz metadon – apod). Podle toho je vhodné vypočtenou dávku ještě přizpůsobit. Podrobnosti ukazuje tab. 1.
Otištěno s laskavým svolením autorů a se svolením redakční rady časopisu Farmakoterapie, publikováno v časopise Farmakoterapie 2006; 3 : 287–299.
MUDr. Tomáš Doležel
www.farmakoterapie.cz
e-mail: dolezal@farmakoterapie.cz
Doručeno do redakce: 25. 6. 2006
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2007 Issue 1-
All articles in this issue
- Metabolic syndrome and adipose tissue: are really adipocyts responsible for everything? – editorial
- Intermediary stadium of Hodgkin’s lymphoma – citius, altius, or fortius? – editorial
- The FEVER (Felodipine EVEnt Reduction) trial; a randomised, double-blind, placebo-controlled trial in Chinese hypertensive patients
- The FEVER (Felodipine EVEnt Reduction) trial; a randomised, double-blind, placebo-controlled trial in Chinese hypertensive patients
- Pulmonary hypertension in Takayasu arteritis
- Guidelines for pharmacotherapy of acute and chronic non-oncological pain
- Guidelines for pharmacotherapy of oncological pain
- Healthy persons versus pacients with diabetes mellitus type 2 – choosen parameters in serum and subcutaneous abdominal adipose tissue
- Disorder of glucose metabolism regulation in patients with multiple myeloma treated with high doses of corticosteroids at our clinic in 2004
- The smoothness index of betaxolol hydrochloride in patients with newly diagnosed hypertension
- Chemotherapy of BOVAPEC in the primary treatment of Hodgkin´s lymphoma intermediate stages
- The importance of determination of Nt-proBNP and big endothelin in diagnosing chronic heart failure in patients on regular haemodialysis treatment
- Epilepsy and disorders of reproduction
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- The FEVER (Felodipine EVEnt Reduction) trial; a randomised, double-blind, placebo-controlled trial in Chinese hypertensive patients
- Guidelines for pharmacotherapy of acute and chronic non-oncological pain
- Epilepsy and disorders of reproduction
- The importance of determination of Nt-proBNP and big endothelin in diagnosing chronic heart failure in patients on regular haemodialysis treatment
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career