-
Medical journals
- Career
Profylaxe žilních tromboembolických komplikací v interních oborech - rozpor mezi teorií a praxí
Authors: J. Hirmerová
Authors‘ workplace: II. interní klinika Lékařské fakulty UK a FN, Plzeň, přednosta doc. MUDr. Jan Filipovský, CSc.
Published in: Vnitř Lék 2006; 52(4): 379-388
Category: Review
Overview
Ačkoli je tromboembolická nemoc v interní medicíně významnou příčinou morbidity i mortality, antitrombotická profylaxe není ve srovnání s chirurgickými obory stále ještě dostatečně uplatňována. U interních nemocných je celá řada rizikových faktorů, často dochází ke kumulaci jejich vlivu a celkový odhad rizika tromboembolie je komplikovaný. Nejdůležitějšími prostředky farmakologické tromboprofylaxe jsou hepariny - nefrakcionovaný a nízkomolekulární. Metaanalýza randomizovaných studií, srovnávajících nefrakcionovaný či nízkomolekulární heparin v profylaktických dávkách oproti kontrole (placebo či aspirin) u interních nemocných potvrdila signifikantní snížení rizika hluboké žilní trombózy (o 56 %) i plicní embolie (o 58 %). Nízkomolekulární heparin je stejně účinný jako nefrakcionovaný v redukci mortality i tromboembolických komplikací, jeho výhodou je však signifikantní snížení krvácivých komplikací. Z nových antitrombotik byl v tromboprofylaxi u interních nemocných úspěšně vyzkoušen syntetický pentasacharid fondaparinux. Ve většině studií byla farmakologická profylaxe podávána po dobu maximálně 2 týdnů, zatím není jasné, zdali by bylo prospěšné její prodloužení. Specifickými skupinami jsou pacienti na jednotkách intenzivní péče; velmi staří nemocní pro své vyšší riziko tromboembolie, ale i pro krvácení a pro značnou komorbiditu; nemocní po akutní ischemické cévní mozkové příhodě, u nichž je riziko tromboembolie velmi vysoké, ale zároveň existují i obavy z hemoragické transformace iktu. Podle studií zaměřených na cenovou efektivitu („cost-effectiveness“) je podávání nízkomolekulárního heparinu v profylaktické dávce u pacientů s akutním interním onemocněním výhodnou strategií.
Klíčová slova:
hluboká žilní trombóza - plicní embolie - profylaxe - heparinyÚvod
Otázkou prevence tromboembolické nemoci (TEN) v různých lékařských oborech se zabývalo již mnoho autorů. Jako preventivní opatření u pacientů na interních odděleních bylo např. v 50. letech minulého století doporučováno provádět aktivní pohyby končetin, dechová cvičení, kompresivní bandáže, úpravu krevních a humorálních poměrů spolu s účinnou léčbou základního onemocnění [1].
Počátky farmakologické profylaxe TEN sahají do 70. let minulého století. Nízkodávkovaný nefrakcionovaný heparin - unfractionated heparin (UFH) byl zprvu používán zejména v souvislosti s ortopedickými operacemi. Postupně se zvyšovalo povědomí lékařské veřejnosti o riziku TEN v souvislosti s různými operačními výkony, od 90. let minulého století byl akceptován nízkomolekulární heparin - low-molecular-weight heparin (LMWH) jako alternativa UFH [2]. Riziko TEN u „nechirurgických“ pacientů je stále poněkud podceňováno. V anglicky psané literatuře se obvykle hovoří o „medical patiens“. Jsou sem zařazovány různorodé skupiny (pacienti intenzivní, standardní i následné péče; různého věku; z různých oborů, např. kardiologie, nefrologie, pulmologie, hematologie, onkologie, neurologie a dalších), z čehož vyplývají i ne zcela jednotné údaje o incidenci TEN u těchto nemocných a o účinnosti profylaxe. Přestože byly provedeny randomizované klinické studie potvrzující prospěšnost farmakologické tromboprofylaxe u „nechirurgických“ pacientů a zásady této profylaxe se staly i součástí mezinárodních doporučených postupů (např. od roku 2001 jsou součástí tzv. Konsenzu antitrombotické léčby ACCP - American College of Chest Physicians) [3], stále ještě nejsou tato doporučení v praxi vždy důsledně uplatňována.
Epidemiologická data
Ve starší retrospektivní studii bylo zjištěno, že příčinou úmrtí u hospitalizovaných pacientů byla v 10 % plicní embolie (PE), avšak jen v 24 % se jednalo o následek operačního výkonu [4]. Novější retrospektivní studie prokázala fatální PE jen u 2,5 % zemřelých interních pacientů, avšak vzhledem k poměrně malému poměru provedených pitev („autopsy rate“) v této studii - jen 45 % - lze odhadovat, že skutečná incidence fatální PE byla 5,5 % [5]. Ve framinghamské studii bylo zjištěno, že z fatálních PE jich 18 % nastalo u chirurgických a 82 % u nechirurgických pacientů, přičemž před smrtí bylo podezření na PE vyjádřeno u 64 % chirurgických, ale jen u 26 % interních pacientů [6]. Údaje z randomizovaných studií uvádějí mortalitu na TEN u chirurgických pacientů 4 % [7], u interních nemocných včetně pacientů s akutním infarktem myokardu (IM) 10 % [8] a u nemocných s cévní mozkovou příhodou (CMP) 19 % [9].
Incidence TEN u „obecně interních“ pacientů je podle starších epidemiologických studií 10-26 % [10,11]. V novější studii MEDENOX, randomizované klinické studii zahrnující 1 102 hospitalizovaných interních pacientů, byla u těch nemocných, kteří nedostávali profylaxi, zjištěna incidence TEN 15 % [12]. V menší studii bylo provedeno ultrazvukové vyšetření žil dolních končetin u 100 pacientů přijímaných na interní jednotku intenzivní péče. Hluboká žilní trombóza byla zjištěna u 33 % z nich [13].
Epidemiologická data tedy dokazují, že TEN je významnou příčinou morbidity i mortality u hospitalizovaných nemocných s akutní „interní“ chorobou [14].
Rizikové faktory
V literatuře je uváděna celá řada rizikových faktorů TEN u interních pacientů [14-18]. Lze je rozdělit na 2 skupiny - jednak na ty, které souvisí s příslušným interním onemocněním, jednak obecné rizikové faktory.
Interní onemocnění a stavy zvyšující riziko TEN
- CMP znamená vysoké riziko TEN, incidence hluboké žilní trombózy (HŽT) je udávána kolem 56 % [19] a ještě vyšší je při paréze dolních končetin [20].
- Akutní IM je spojen s incidencí HŽT kolem 22 % [18], z toho k 50 % z nich dojde do 3 dnů po příhodě a více jsou ohroženy ženy [21].
- Městnavé srdeční selhání - závažnost srdečního selhání koreluje s tromboembolickým rizikem, u nemocných se stupněm IV dle klasifikace New York Heart Association (NYHA) byla zjištěna incidence TEN 21,7 % [22]. Hodnota ejekční frakce < 20 % je spojena s 38krát vyšším rizikem TEN [23].
- Chronická obstrukční plicní nemoc.
- Akutní infekční nemoci - ve studii SIRIUS, studii případů a kontrol, byly akutní infekční choroby spojeny s 2krát vyšším rizikem TEN [24], ve studii MEDENOX bylo zjištěno „odds ratio“ (OR) 1,74 (95 % konfidenční interval CI 1,12-2,75) [12].
- Malignity - zde se uplatňuje celá řada faktorů, jednak změny související se základním onemocněním (hyperkoagulační stav, endoteliální dysfunkce, stáza krve, změny viskozity) [25], jednak i vliv léčby - chemoterapie, radioterapie, operace, zavedení centrálního žilního katétru (CŽK). Výskyt TEN je zejména vysoký u zhoubných nádorů prsu, plic, mozku, pánve, pankreatu, zažívacího traktu.
- Zánětlivá systémová onemocnění, např. systémový lupus erytematodes.
- Revmatologické choroby - pacienti s revmatoidní artritidou mají asi o 50 % vyšší incidenci TEN [26].
- Diabetická ketoacidóza.
- Kóma.
- Nefrotický syndrom.
- Zánětlivé střevní nemoci - riziko TEN je zvýšeno 4krát [16].
- Chemoterapie.
- Některé invazivní výkony, např. zavedení CŽK či filtru dolní duté žíly.
- Dehydrace.
- Myeloproliferativní choroby.
Obecné rizikové faktory
- Věk - s rostoucím věkem nastává posun k prokoagulačnímu stavu. K signifikantnímu zvýšení rizika TEN dochází po 40. roce věku, prudký nárůst je udáván kolem 70 let věku, přičemž mezi 20 a 80 lety věku narůstá riziko 200krát [15,27,28].
- Anamnéza TEN je poměrně významným rizikovým faktorem. Ve studii SIRIUS měli jedinci s anamnézou prodělané TEN 8krát vyšší riziko nové tromboembolické příhody v rizikové situaci [24].
- Imobilizace - delší imobilizace je považována za silný rizikový faktor. Ve starší studii byla HŽT zjištěna při pitvě u 15 % pacientů, kteří byli imobilizováni po dobu kratší než 1 týden, ale u 80 % těch, kteří byli imobilizováni déle [29]. Ve studii hemiplegických pacientů s cévní mozkovou příhodou byla asymptomatická HŽT nalezena na 60 % plegických končetin, ale jen na 7 % hybných končetin [30].
- Obezita je považována spíše za slabý rizikový faktor [15].
- Varixy - jejich význam jako nezávislého rizikového faktoru TEN je kontroverzní, neboť k dispozici je poměrně málo studií a hodnocení závažnosti varixů bývá subjektivní. V populačně založené studii případů a kontrol bylo zjištěno, že riziko s nimi spojené klesá s věkem: OR 4,2 ve 45 letech, 1,9 v 60 letech a 0,9 v 75 letech [31].
- Hormonální léčba: hormonální antikoncepce - nízkodávkovaná 3. generace zvyšuje riziko TEN 4krát, 2. generace 3krát [32]; hormonální substituční léčba znamená 2-4krát vyšší riziko idiopatické HŽT [33]; zvýšené riziko TEN je i u mužů s estrogenní léčbou pro karcinom prostaty [15].
- Získaný či vrozený trombofilní stav [15,18]: antifosfolipidový syndrom; deficit antitrombinu; rezistence na aktivovaný protein C - její nejčastější příčinou je Leidenská mutace v genu pro faktor V; mutace v genu pro protrombin G20210A; deficit proteinu C; deficit proteinu S; vysoká hladina faktoru VIII; vysoká hladina faktorů IX, XI; hyperfibrinogenemie, dysfibrinogenemie; hyperhomocysteinemie.
Metody profylaxe
V míře používání či nepoužívání tromboprofylaxe a v jejích metodách existují geografické i místní odlišnosti [2]. K dispozici jsou mechanické a farmakologické metody.
Mechanické metody - elastické kompresní punčochy či intermitentní pneumatická komprese slouží ke zvýšení žilního toku a snížení stázy v žilách, intermitentní pneumatická komprese navíc stimuluje endogenní fibrinolytickou aktivitu a příznivě ovlivňuje reologické poměry a perfuzní tlak [34]. Pouze mechanické metody samotné lze však doporučit jen při kontraindikaci antiakogulancií (např. při vysokém riziku krvácení), jinak samy o sobě nejsou považovány za dostatečnou tromboprofylaxi [35]. Kompresní punčochy nejsou vhodné u pacientů se závažnou končetinovou ischemií [36].
Farmakologické metody - v porovnání s chirurgickými obory bylo provedeno poměrně málo randomizovaných klinických studií sledujících účinnost u interních pacientů [37]. Hlavními prostředky jsou zde UFH a LMWH. Kyselina acetylsalicylová (ASA) má své místo v prevenci arteriálních příhod, není však standardním lékem v prevenci žilního tromboembolizmu [34]. Bylo provedeno několik studií s warfarinem, ten lze doporučit např. při kontraindikaci heparinu, nízké dávky byly úspěšně použity v prevenci TEN v menších studiích u pacientů s centrálním žilním katétrem [38,39] a warfarinizace s cílovým INR 2-3 byla také účinnou a dobře tolerovanou tromboprofylaxí v jedné studii u nemocných s malignitami [40].
Studie sledující účinnost UFH ve srovnání s placebem jsou uvedeny v tab. 1. Většina studií prokázala redukci výskytu HŽT po UFH [10,11,41,42], jedna studie snížení mortality [43] a ve studii pacientů s infekčními nemocemi (UFH zde byl podáván do propuštění či po maximální dobu 3 týdnů) došlo k signifikantnímu prodloužení doby od přijetí do fatální plicní embolie a k signifikantnímu snížení výskytu nefatální plicní embolie [44].
Table 1. Studie srovnávající UFH s placebem v profylaxi TEN u interních pacientů. 
UFH byl ve studiích použit v dávce 5 000 j. subkutánně (s.c.) po 12 hodinách či po 8 hodinách. Lze předpokládat, že častější dávkování by mohlo být účinnější v prevenci TEN, zároveň však existují obavy z možnosti krvácivých komplikací [17]. Riziko krvácení u interních pacientů není tak jasně stanoveno jako u chirurgických - u těch byla metaanalýzou 49 studií při srovnání UFH 5000 j. 3krát denně versus 2krát denně zjištěna redukce incidence HŽT (7,5 % vs 11,8 %), ale také vzestup incidence závažného krvácení (1,8 % vs 0,9 %) [45].
Tab. 2 uvádí přehled studií srovnávajících tromboprofylaxi LMWH ve srovnání s placebem. Nejvýznamnější jsou 2 velké randomizované dvojitě slepé studie MEDENOX a PREVENT.
Table 2. Studie srovnávající LMWH s placebem v profylaxi TEN u interních pacientů. 
Studie MEDENOX (The Prophylaxis in Medical Patients with Enoxaparin Study) měla za cíl objasnit riziko TEN u jasně definované populace interních pacientů a zhodnotit poměr prospěchu a rizika dvou dávkovacích režimů enoxaparinu (20 mg denně a 40 mg denně s.c.) po dobu 6-14 dnů oproti placebu [12]. Bylo zahrnuto 1 102 pacientů v 60 centrech v 9 zemích. Byl sledován výskyt TEN mezi 1. a 14.dnem - HŽT potvrzená RTG-kontrastní flebografií či kompresní ultrasonografií (USG), PE potvrzená plicní angiografií, plicní scintigrafií či fatální PE. Vstupními kritérii byl věk nad 40 let, plánovaná doba hospitalizace alespoň 6 dní, imobilizace před přijetím 3 dny či méně, jako příčina hospitalizace akutní srdeční selhání NYHA III či IV, akutní respirační insuficience bez nutnosti ventilační podpory či 1 ze 3 dále uvedených (akutní infekční choroba bez septického šoku, akutní revmatické onemocnění či akutní epizoda zánětlivé střevní choroby) spolu s alespoň jedním předem definovaným rizikovým faktorem TEN (věk > 75 let, malignita, anamnéza TEN, BMI ≥ 30 kg/m2 u mužů a ≥ 28,6 kg/m2 u žen, varixy, hormonální léčba, chronická kardiální či respirační insuficience, neschopnost samostatné chůze více než 10 metrů). Bylo prokázáno signifikantní snížení incidence TEN po enoxaparinu 40 mg, nikoli však po 20 mg denně (5,5 % po dávce 40 mg denně, 15 % po 20 mg denně, 14,9 % po placebu). Riziko TEN bylo ve skupině užívající 40mg enoxaparinu významně sníženo i po 3 měsících dalšího sledování. Výskyt nežádoucích účinků včetně krvácení byl obdobný ve všech 3 skupinách nemocných. Byla provedena i analýza účinnosti profylaxe enoxaparinem 40 mg denně v jednotlivých podskupinách pacientů. Redukce relativního rizika (RR) byla celkově 63 %, z jednotlivých podskupin nejvíce profitovali nemocní s akutním srdečním selháním (redukce RR 72 %), s akutní respirační insuficiencí (75 %), pacienti nad 75 let věku (78 %), s varixy (76 %), s chronickou srdeční nedostatečností (74 %) či s chronickou respirační insuficiencí (74 %) [50].
Do studie PREVENT (Prospective Evaluation of Dalteparin Efficacy for Prevention of VTE in Immobilized Patients Trial) bylo zahrnuto 3 706 hospitalizovaných interních pacientů na základě následujících kritérií: městnavé srdeční selhání, akutní respirační insuficience, infekční choroba bez septického šoku, akutní revmatologické onemocnění či zánětlivé střevní onemocnění se současnou přítomností alespoň 1 z dále uvedených faktorů: věk ≥ 75 let, malignita, anamnéza TEN, obezita, varixy, hormonální substituční léčba, anamnéza chronické kardiální či respirační insuficience nebo myeloproliferativní syndrom. Pacienti dostávali dalteparin 5000 j. s.c. denně či placebo po dobu 14 dní. Byl hodnocen výskyt symptomatické TEN potvrzené zobrazovací metodou nebo pitvou nebo náhlé smrti nebo asymptomatické proximální HŽT zjištěné na USG (USG vyšetření bylo provedeno u všech pacientů, kteří neměli symptomatickou TEN mezi 21. a 24. dnem). Výsledkem byla 45% redukce RR (výskyt TEN do 21. dne byl 2,77 % po dalteparinu a 4,96 % po placebu). Ke 2 fatálním PE došlo po placebu, k žádné po dalteparinu. Výskyt závažného krvácení byl 0,49 % v léčené skupině a 0,16 % v placebové [49].
Ke srovnání účinnosti a bezpečnosti UFH a LMWH v tromboprofylaxi u interních pacientů byla provedena rovněž řada randomizovaných studií - jejich přehled přináší tab. 3.
Table 3. Studie srovnávající LMWH s UFH v profylaxi TEN u interních pacientů. 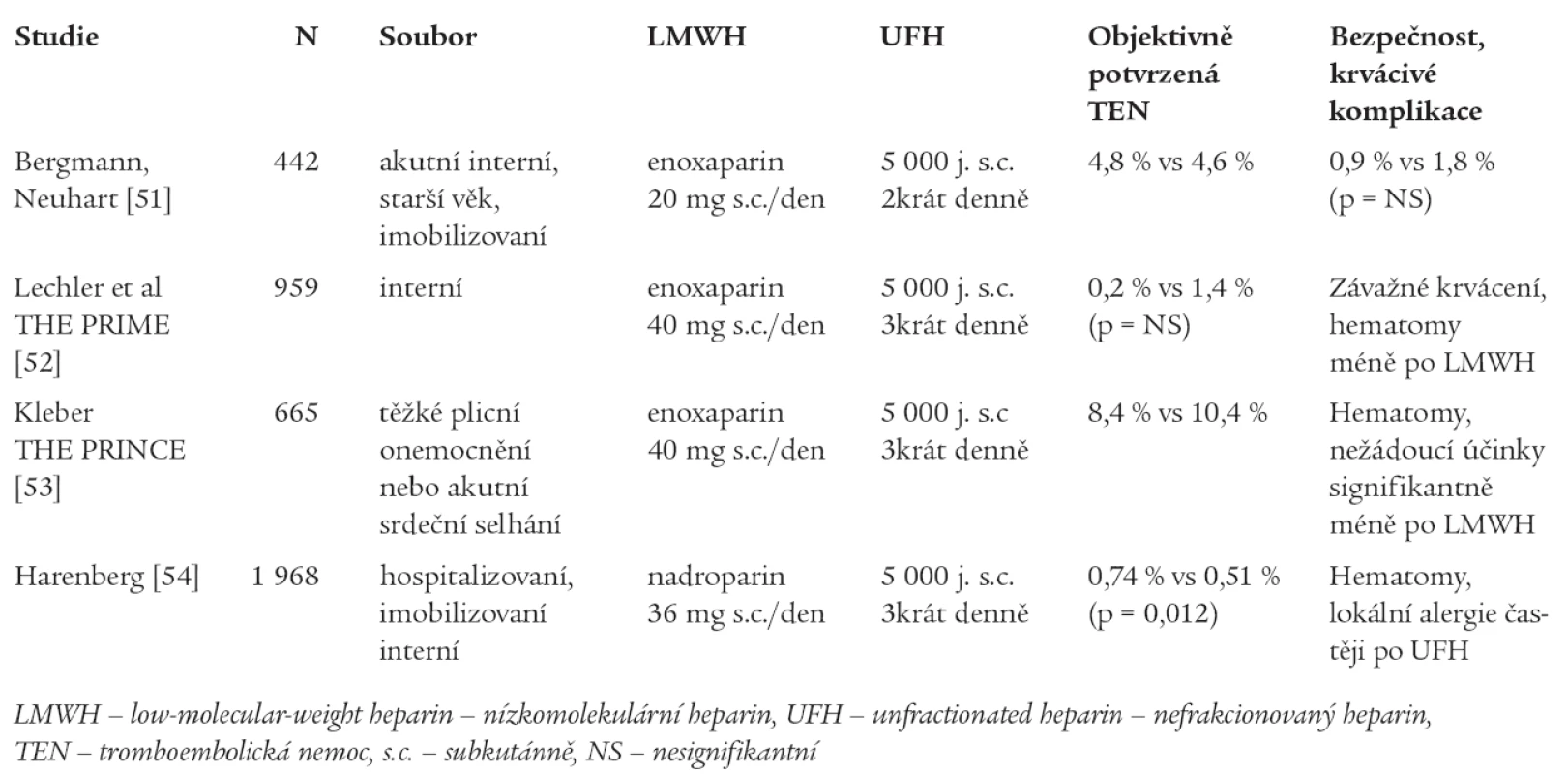
Metaanalýzou randomizovaných studií srovnávající hepariny (UFH či LMWH) s kontrolou (placebo či ASA) bylo zjištěno signifikantní snížení rizika TEN: HŽT o 56 % (p < 0,001) a PE o 58 % (p < 0,001) bez signifikantního ovlivnění incidence závažného krvácení či úmrtí. Metaanalýza studií porovnávajících LMWH a UFH došla k závěru, že LMWH je stejně účinný jako UFH v ovlivnění mortality, výskytu HŽT i PE, jeho výhodou je však signifikantní snížení krvácivých komplikací (redukce závažného krvácení o 52 % ve srovnání s UFH, p = 0,049) [55].
Uplatnění v prevenci TEN v interních oborech by mohla najít i některá nová antitrombotika. Lze uvést syntetický pentasacharid fondaparinux, inhibitor faktoru Xa. Ten je v některých zemích schválen pro profylaxi TEN po operaci pro frakturu kyčle, náhradě kyčelního či kolenního kloubu, pro prodlouženou profylaxi po náhradě kyčelního kloubu i pro léčbu TEN. Jeho účinnost v tromboprofylaxi u interních nemocných byla zjišťována ve studii ARTEMIS (Arixtra for Thromboembolism Prevention in a Medical Indications Study). Do této mezinárodní randomizované dvojitě slepé studie bylo zařazeno 849 pacientů s akutním interním onemocněním, nad 60 let věku, s předpokládanou dobou pobytu na lůžku ≥ 4 dny, s městnavým srdečním selháním, akutním či chronickým plicním onemocněním nebo akutní infekční či zánětlivou chorobou. Nemocní dostávali 2,5 mg fondaparinuxu denně nebo placebo po dobu 6-14 dní. Sledován byl výskyt symptomatické i asymptomatické HŽT, fatální či nefatální PE. U všech pacientů byla provedena bilaterální rtg kontrastní flebografie mezi 6. a 15. dnem. Incidence TEN do 15. dne po fondaparinuxu ve srovnání s placebem byla 5,6 % vs 10,5 % (p = 0,029), fatální PE 0 vs 1,2 % a úmrtí do 32. dne 3,3 % vs 6 %. Výskyt závažného krvácení (tj. s poklesem hemoglobinu o ≥ 20 g/l či nutností podání transfuzí ≥ transfuzní jednotky) byl v obou skupinách 0,2 % [56].
Délka profylaxe
Výše uvedené studie snad nalezly odpověď na otázky týkající se účinnosti tromboprofylaxe i volby léku a dávky. Otázkou zůstává délka podávání. Většina studií byla provedena u „akutních“ pacientů a profylaxe byla obvykle podávána maximálně do 2 týdnů. Rizikové faktory TEN však mohou být přítomny i u pacientů v subakutním stadiu choroby či dlouhodobě nemocných.
Poměrně velká multicentrická průřezová studie byla provedena v „subakutních“ odděleních 36 francouzských nemocnic (jednalo se pacienty nikoli „akutní“, ale vyžadující vyšší úroveň péče než dlouhodobě nemocní). Bylo zařazeno 852 pacientů nad 64 let věku, nemocní na dlouhodobé antikoagulační léčbě byli předem vyřazeni. U všech zařazených bylo zjišťováno provádění tromboprofylaxe, výskyt rizikových faktorů TEN a provedeno USG vyšetření. Farmakologickou profylaxi dostávalo 56,1 % pacientů, z toho 30,6 % vysokou dávku LMWH, 24,3 % nízkou dávku LMWH, 0,7 % UFH a 0,5 % warfarin. Průměrná doba profylaxe byla 33,8 dne (1-268 dní). Mezi jednotlivými nemocnicemi byly zjištěny velké rozdíly, užívání profylaxe se pohybovalo od 20 % do 86,9 % pacientů. Prevalence HŽT byla celkově 15,8 % (proximální HŽT 10,0 %), u nemocných bez jakékoli profylaxe 20,8 %, při použití kompresních punčoch 17,1 %, při antikoagulační léčbě 13,8 % a při kombinaci antikoagulancií a kompresních punčoch 10,4 %. Z rizikových faktorů byla nejvýznamnější akutní imobilizace (méně než 30 dní) (OR 2,59) a cévní mozková příhoda (OR 2,29) [57].
Otázkou nutnosti tromboprofylaxe u chronicky imobilizovaných nemocných se zabývali izraelští autoři. Ti provedli historickou kohortovou studii, zkoumající výskyt symptomatické TEN v průběhu 10 let u obyvatel pečovatelského domu. Hodnotili 1 137 pacientských roků ve skupině mobilních jedinců a 573 pacientských roků ve skupině chronicky imobilních (tj. déle než 3 měsíce). Výsledky nepotvrdily asociaci protrahované imobilizace a symptomatické TEN. Autoři uzavírají, že prodloužená primární profylaxe TEN u dlouhodobě imobilizovaných pacientů není nutná. Vysvětlují to postupnou úpravou protrombotických změn, nastávajících při akutní imobilizaci (např. zvýšení krevní viskozity se normalizuje po 30 dnech, snížená fibrinolytická aktivita se po 10 dnech zvyšuje) [58].
Odpověď na vhodnost prodloužené tromboprofylaxe u interních pacientů by mohla přinést studie EXCLAIM (Extended Prophylaxis with Enoxaparin in Acutely Medical Patients with Restricted Mobility Trial). Jedná se o multicentrickou randomizovanou dvojitě slepou studii, v níž je zařazeno 5 800 pacientů s akutním interním onemocněním, s omezenou pohyblivostí. Všem je podáváno 40 mg enoxaparinu s.c. denně po dobu přibližně 10 dní, poté po dalších 28 dní buď placebo nebo nadále enoxaparin 40 mg s.c. denně. Výsledky dosud nejsou k dispozici [59].
Profylaxe u nemocných vyššího věku
V interních oborech se běžně setkáváme s pacienty vyššího i velmi pokročilého věku. Ti tvoří zvláště rizikovou skupinu, neboť, jak uvedeno výše, riziko TEN s věkem výrazně stoupá. S věkem však stoupá i riziko krvácení a právě obavy z komplikací mohou být příčinou nepodání farmakologické tromboprofylaxe u těchto nemocných. Z protrombotických vlivů lze uvést hyperkoagulabilitu (vysoká hladina fibrinogenu, faktoru VII, VIII, fibrinopeptidu A, PAI-1 - inhibitor aktivátoru plazminogenu, zvýšená aktivace destiček), častou imobilitu, obezitu. Riziko krvácení zase zvyšují cévní fragilita, jaterní choroby, demence, častější pády a úrazy. Situace je komplikována výraznou komorbiditou, možností interakcí s dalšími užívanými léky, změnami farmakokinetiky např. při renální insuficienci apod [60].
Řada studií však prokázala účinnost i bezpečnost farmakologické profylaxe též u starších nemocných. Např. ze studií uvedených v tab. 2 a 3 - ve studii Dahana et al byli pacienti nad 65 let věku [47]; průměrný věk pacientů ve studii MEDENOX byl 73 ± 10 let [12]; ve studii Bergmanna a Neuharta dokonce 83 let [51] a do studie Harenberga et al byli zařazeni pacienti nad 60 let věku [54].
Profylaxe u akutní ischemické CMP
Nemocní po akutní ischemické CMP tvoří samostatnou skupinu, mají vysoké riziko TEN, srovnatelné s ortopedickými pacienty po náhradě kyčelního či kolenního kloubu. Údaje o incidenci TEN v této skupině jsou rozdílné, studie provedené v 70. a 80. letech minulého století u nemocných bez profylaxe zjistily výskyt HŽT 30-80 %, PE nad 10 % [61]. Nedávná prospektivní studie u 102 pacientů s akutní ischemickou CMP užívajících ASA a kompresní punčochy zjistila za 21 dní výskyt proximální HŽT u 17,7 % a PE u 11,8 % pacientů (jako diagnostická metoda byla použita magnetická rezonance) [62]. Fatální PE není častá během 1. týdne, nejčastěji k ní dochází ve 2.-4. týdnu s vrcholem na konci 2. týdne, ve většině studií však bylo trvání tromboprofylaxe jen 14 dní [61].
Výsledky studií s UFH u nemocných po akutní ischemické CMP nejsou zcela jednoznačné. Ve studii Mc Carthyho a Turnera bylo po UFH 5000 j. s.c. 3krát denně oproti placebu pozorováno signifikantní snížení incidence HŽT (22 % vs 73 %) i PE (9,9 % vs 46 %) [63]. Pambianco et al však nezjistili rozdíl mezi UFH v uvedené dávce a placebem [64]. Ve studii IST (International Stroke Study) byl použit UFH s.c. v dávce 12 500 j. či 5 000 j. 2krát denně (společně či bez ASA). Nebyla prokázána prospěšnost UFH a navíc došlo k téměř 4násobnému zvýšení rizika závažného krvácení [65].
Metaanalýza studií s LMWH u pacientů s akutní ischemickou CMP prokázala snížení rizika HŽT (OR 0,27, 95 % CI 0,08-0,96) i PE (OR 0,34, 95 % CI 0,17-0,69), nesignifikantní zvýšení rizika symptomatického intrakraniálního krvácení (OR 1,77, 95 % CI 0,95-3,31) a zvýšení rizika závažného extrakraniálního krvácení (OR 2,17, 95 % CI 1,10-4,28) [66]. Ve studiích TOPAS a FISS bis byla zjištěna závislost krvácivých komplikací na dávce LMWH [67,68]. Proto je v tromboprofylaxi po akutní CMP vhodnější malá dávka LMWH, otázkou je však zahájení aplikace. Časné zahájení (do 48 hodin) je zřejmě nutné k účinné prevenci TEN, zároveň však může zvýšit riziko mozkového krvácení. Někteří autoři vyjadřují obavy ze zvýšeného rizika intrakraniálního krvácení, je-li tromboprofylaxe zahájena během 24 hodin po CMP [66]. Co do délky profylaxe, vzhledem k vyšší incidenci PE během 2-4 týdnů po CMP se zdá výhodnější prodloužená profylaxe. Prospěšná je zřejmě i kombinace farmakologické a mechanické profylaxe [61].
Profylaxe v intenzivní péči
Pacienti na jednotkách intenzivní péče tvoří skupinu s velmi vysokým rizikem TEN. Dochází zde ke kumulaci mnoha rizikových faktorů - sepse, imobilizace, CMP, pokročilý věk, srdeční či respirační selhání, CŽK, mechanická ventilace, užití vazopresorických látek, dialýza, deficit přirozených inhibitorů koagulace aj. U každého nemocného by měla být pečlivě zvážena vhodnost tromboprofylaxe - u většiny z nich je indikována a vzhledem k lepšímu bezpečnostnímu profilu je preferován LMWH. U některých nemocných však nemusí být obvyklá profylaktická dávka LMWH dostatečná (například u pacientů se sepsí či extrémně obézních či na vazopresorické léčbě - ta může snižovat účinnost LMWH, respektive hladiny antiXa) [35]. Naopak u nemocných s renální insuficiencí nebo kachektických hrozí předávkování a krvácivé komplikace. Proto je někdy vhodné kontrolovat hladinu antiXa - za 4-5 hodin po s.c. aplikaci s cílovou hodnotou 0,2-0,4 IU/ml [69].
V nedávno publikované studii byl sledován výskyt plicní embolie u 198 pacientů koronární jednotky intenzivní péče se srdeční dekompenzací. 55 % nemocných mělo stupeň NYHA III-IV a 40 % nemocných ejekční frakci < 30 %. Incidence plicní embolie během hospitalizace byla 9,1 %, přičemž nebylo rozdílu v incidenci mezi pacienty s tromboprofylaxí LMWH (enoxaparin 40 mg denně) a pacienty bez tromboprofylaxe (8,7 % vs 10 %, p = 0,769). Nezávislými prediktory plicní embolie byly malignity, anamnéza TEN a abnormality pravé komory srdeční (dilatace či dysfunkce). Autoři v diskusi otevírají otázku vhodnosti agresivnější tromboprofylaxe u takto vysoce rizikových skupin nemocných [70].
Stratifikace rizika
Odhad individuálního rizika TEN není jednoduchý. Většina pacientů má více rizikových faktorů s kumulativním dopadem. Bylo navrženo několik modelů stratifikace rizika TEN, využívajících klasifikace rizikových faktorů na vysoce, středně a mírně významné. V nedávné studii případů a kontrol však byly hodnoceny 3 z těchto modelů a žádný z nich nebyl zcela spolehlivý v rozlišení pacientů na ty, u nichž měla být tromboprofylaxe indikována, a ty, jejichž riziko bylo nízké [14]. Zdá se, že než bude k dispozici komplexní, spolehlivý a přitom jednoduchý model odhadu rizika, bude nejjednodušším řešením použít tromboprofylaxi u všech pacientů s akutním interním onemocněním, nemají-li kontraindikace [18]. Podle 7. konsenzu antitrombotické léčby ACCP je doporučována profylaxe UFH či LMWH u nemocných s akutním interním onemocněním - městnavým srdečním selháním; těžkou respirační chorobou; upoutaných na lůžko a majícím alespoň 1 z následujících faktorů: aktivní malignita, TEN v anamnéze, sepse, akutní neurologické onemocnění, zánětlivé střevní onemocnění [35].
(Ne)používání tromboprofylaxe v praxi
Ačkoli existují jasné důkazy o vysoké incidenci TEN u interních pacientů i o prospěšnosti tromboprofylaxe, její uplatnění v praxi je nedostatečné.
Např. IMPROVE (The International Medical Prevention Registry on Venous Thromboembolism), prospektivní kohortová studie, zjišťovala použití profylaxe u 1 595 pacientů s akutním interním onemocněním v 21 nemocnicích z 8 zemí. Jen 37 % z nich dostávalo tromboprofylaxi (38 % v Evropě, 44 % v USA) [71].
Retrospektivní studie hodnotila tromboprofylaxi na základě lékařské dokumentace u 756 interních pacientů ve 2 univerzitních nemocnicích McMaster University v Hamiltonu. 310 z nemocných bylo antikoagulačně léčeno pro svou primární diagnózu a z hodnocení bylo vyřazeno. Ze zbylých 446 jen 33 % dostávalo nějakou formu tromboprofylaxe. Byla sem však započítána i časná mobilizace (4 %), kompresní punčochy (9 %) a intermitentní pneumatická komprese (1 %). UFH dostávalo 23 % pacientů a jen 3 % LMWH. Přitom u 46 % nemocných byl zjištěn alespoň 1 rizikový faktor TEN a u 14 % 2 a více rizikové faktory [72].
Dalším příkladem je DVT FREE, prospektivní registr pacientů s HŽT ze 183 nemocnic v USA. Z celkového počtu 5 451 nemocných jich 2 726 bylo v době stanovení diagnózy HŽT hospitalizováno, 71 % nedostávalo tromboprofylaxi a z toho bylo 59 % nechirurgických [73].
Používání tromboprofylaxe na interním oddělení na tuzemském pracovišti bylo analyzováno v poměrně nedávno publikované práci [74]. Ze 411 hospitalizovaných nemocných byla farmakologická profylaxe indikována u 200 pacientů, použita byla u 51 % z nich, z toho v adekvátních dávkách v 60 %.
Důvodů nedostatečného použití tromboprofylaxe v praxi přichází v úvahu několik. Může se jednat o nedostatečnou znalost doporučených postupů nebo nesouhlas s těmito doporučeními, obavy z krvácivých komplikací, finanční důvody, nedostatek času, případně nemusí být TEN vždy vnímána jako významný klinický problém [2]. Doporučené postupy se mohou zdát příliš rozsáhlé, složité či matoucí. Specifickými problémy u interních pacientů pak může být jejich vyšší věk, komorbidita a riziko interakce s dalšími užívanými léky [17].
Studie cenové efektivity („cost-effectiveness“)
Byly provedeny 3 studie zaměřené na cenovou efektivitu tromboprofylaxe u pacientů s akutním interním onemocněním, všechny vycházely z dat získaných v rámci studie MEDENOX. Výsledkem bylo potvrzení, že enoxaparin v dávce 40 mg denně je z hlediska cenové efektivity výhodnou strategií [18]. Francouzská studie zjistila, že tato profylaxe po dobu 6-14 dní zabrání 1-10 úmrtím a 60-127 případům TEN na 1000 hospitalizovaných interních pacientů [75].
Závěr
TEN může být klinicky němá či obtížně diagnostikovatelná a jejím prvním projevem může být fatální PE. Nelze tedy spoléhat na její časnou diagnózu. Vzhledem k tomu, že se u interních nemocných jedná o poměrně častou a potenciálně závažnou, ale zároveň preventabilní komplikaci, měl by se odhad rizika TEN a zavedení profylaktických opatření stát rutinní součástí léčby pacientů na interních odděleních.
Seznam použitých zkratek
ACCP - American College of Chest Physicians
ASA - kyselina acetylsalicylová (acetylsalicylic acid)
BMI - body mass index
CI - konfidenční interval
CMP - cévní mozková příhoda
CŽK - centrální žilní katétr
HŽT - hluboká žilní trombóza
IM - infarkt myokardu
INR - international normalized ratio
LMWH - nízkomolekulární heparin (low-molecular-weight heparin)
NYHA - New York Heart Association
OR - poměr šancí (odds ratio)
PAI - inhibitor aktivátoru plazminogenu (plasminogen activator inhibitor)
PE - plicní embolie
RR - relativní riziko
TEN - tromboembolická nemoc
UFH - nefrakcionovaný heparin (unfractionated heparin)
USG . ultrasonografie
MUDr. Jana Hirmerová
www.fnplzen.cz
e-mail: hirmerova@fnplzen.cz
Doručeno do redakce: 4. 11. 2005
Přijato po recenzi: 26. 1. 2006
Sources
1. Bobek K, Čepelák V. Prevence tromboembolické nemoci. In: Tromboembolická nemoc žilního původu. Praha: Státní zdravotnické nakladatelství 1959.
2. Kakkar AK, Davidson BL, Haas SK. Compliance with recommended prophylaxis for venous thromboembolism: improving the use and rate of uptake of clinical practical guidelines. J Thromb Haemost 2004; 2 : 221-227.
3. Geerts WH, Heit JA, Pineo GF et al. Prevention of venous thromboembolism. The Sixth Consensus Conference of Antithrombotic Therapy. Chest 2001; 119 : 132S-175S.
4. Sandler DA, Martin JF. Autopsy proven pulmonary embolism in hospital patients: are we detecting enough deep vein thrombosis? J R Soc Med 1989; 82 : 203-205.
5. Baglin TP, White K, Charles A. Fatal pulmonary embolism in hospitalized medical patients. J Clin Pathol 1997; 50 : 609-610.
6. Goldhaber SZ, Savage DD, Garrison RJ et al. Risk factors for pulmonary embolism. The Framingham Study. Am J Med 1983; 74 : 1023-1028.
7. Collins R, Scrimgeour A, Yusuf A et al. Reduction in fatal pulmonary embolism and venous thrombosis by perioperative administration of subcutaneous heparin. Overview of results of randomised trials in general, orthopedic and urologic surgery. N Engl J Med 1988; 318 : 1162-1173.
8. The SCATI (Studio sulla Calciparina nell´Angina e nella Trombosi Ventricolare nell´Infarto) Group. Randomised controlled trial of subcutaneous calcium-heparin in acute myocardial infarction. Lancet 1989; 2 : 182-186.
9. Sandercock PAG, van den Belt AGM, Lindley RI et al. Antithrombotic therapy in acute ischaemic stroke: an overview of the completed randomised trials. J Neurol Neurosurg Psychiatry 1993; 56 : 17-25.
10. Belch JJ, Lowe GD, Ward AG et al. Prevention of deep vein thrombosis in medical patients by low-dose heparin. Scott Med J 1981; 26 : 115-117.
11. Cade JF. High risk of the critically ill for venous thromboembolism. Crit Care Med 1982; 10 : 448-450.
12. Samama MM, Cohen AT, Darmon JY et al. A comparison of enoxaparin with placebo for the prevention of venous thromboembolism in acutely medical ill patients: Prophylaxis in Medical Patients with Enoxaparin Study Group. N Engl J Med 1999; 341 : 793-800.
13. Hirsch DR, Ingenito EP, Goldhaber SZ. Prevalence of deep venous thrombosis among patients in medical intensive care. JAMA 1995; 274 : 335-337.
14. Zakai NA, Wright J, Cushman M. Risk factors for venous thrombosis in medical inpatients: validation of a thrombosis risk score. J Thromb Haemost 2004; 2 : 2156-2161.
15. Anderson FA, Spencer FA. Risk factors for venous thromboembolism. Circulation 2003; 107: I9-I16.
16. Cohen AT, Alikhan R, Arcelus JI et al. Assessment of venous thromboembolism risk and the benefits of thromboprophylaxis in medical patients. Thromb Haemost 2005; 94 : 750-759.
17. Spyropoulos AC. Emerging strategies in the prevention of venous thromboembolism in hospitalized medical patients. Chest 2005; 128 : 958-969.
18. Turpie AGG, Norris TN. Thromboprophylaxis in medical patients: the role of low-molecular-weight heparin. Thromb Haemost 2004; 92 : 3-12.
19. Nicolaides AN, Breddin HK, Fareed J et al. Prevention of venous thromboembolism. International Consensus Statement. Guidelines compiled in accordance with the scientific evidence. Int Angiol 2001; 20 : 1-37.
20. Warlow C, Ogston D, Douglas AS. Deep venous thrombosis of the legs after stroke. Br Med J 1976; 1 : 1178-1183.
21. Gensini GF, Prisco D, Falciani M et al. Identification of candidates for prevention of venous thromboembolism. Semin Thromb Hemost 1997; 23 : 55-67.
22. Alikhan R, Cohen AT, Combe S et al. Risk factors for venous thromboembolism in hospitalized patients with acute medical illness. Arch Intern Med 2004; 164 : 963-968.
23. Howell MD, Geraci JM, Knowlton AA. Congestive heart failure and outpatient risk of venous thromboembolism: a retrospective case-control study. J Clin Epidemiol 2001; 54 : 810-816.
24. Samama MM. Epidemiology of risk factors of deep venous thrombosis of the lower limbs in community practice: the SIRIUS study. Thromb Haemost 1993; 69 : 763.
25. Lip GY, Chin BS, Blann AD. Cancer and the prothrombotic state. Lancet Oncol 2002; 3 : 27-34.
26. DeMaria AN. Relative risk of cardiovascular events in patients with rheumatoid artritis. Am J Cardiol 2002; 89 : 33D-38D.
27. Silverstein MD, Heit JA, Mohr DN et al. Trends in the incidence of deep vein thrombosis and pulmonary embolism. Arch Intern Med 1998; 158 : 585-593.
28. White RH. The epidemiology of venous thromboembolism. Circulation 2003; 107(Suppl): I4-I8.
29. Gibbs NM. Venous thrombosis of the lower limbs with particular reference to bedrest. Br J Surg 1957; 45 : 209-236.
30. Warlow C, Ogston D, Douglas AS. Venous thrombosis following strokes. Lancet 1972; 1 : 1305-1306.
31. Heit JA, Silverstein MD, Mohr DN et al. Risk factors for deep vein thrombosis and pulmonary embolism: a population-based case-control study. Arch Intern Med 2000; 160 : 809-815.
32. Lidegaard O, Edstrom B, Kreiner S. Oral contraceptives and venous thromboembolism: a five-year national case-control study. Contraception 2002; 65 : 187-196.
33. Daly E, Vessey MP, Hawkins MM et al. Risk of venous thromboembolism in users of hormone replacement therapy. Lancet 1996; 348 : 977-980.
34. Goldhaber SZ, Turpie AGG. Prevention of venous thromboembolism among hospitalized medical patients. Circulation 2005; 111(Suppl): e1-e3.
35. Geerts WH, Pineo GF, Heit JA et al. Prevention of venous thromboembolism: the Seventh ACCP Conference on Antithrombotic Therapy. Chest 2004; 126(Suppl): 338S-400S.
36. Verstraete M. Fortnightly review: Prophylaxis of venous thromboembolism. BMJ 1997; 314 : 123-131.
37. Imberti D, Prisco D. Venous thromboembolism prophylaxis in medical patients: future perspectives. Thromb Res 2005; 116 : 365-375.
38. Bern MM, Bothe A Jr, Bistrian B et al. Prophylaxis against central vein thrombosis with low-dose warfarin. Surgery 1986; 99 : 216-221.
39. Bern MM, Lokich JJ, Wallach SR et al. Very low doses of warfarin can prevent thrombosis in central venous catheters. A randomized prospective trial. Ann Intern Med 1990; 112 : 423-428.
40. Bona RD, Sivjee KY, Hickey AD et al. The efficacy and safety of oral anticoagulation in patients with cancer. Thromb Haemost.1995; 74 : 1055-1058.
41. Gallus AS, Hirsch J, Tuttle RJ et al. Small subcutaneous doses of heparin in prevention of venous thrombosis. N Engl J Med 1973; 288 : 545-551.
42. Ibarra-Pérez C, Lau-Cortés E, Colmenero-Zubiate S et al. Prevalence and prevention of deep vein thrombosis of the lower extremities in high-risk pulmonary patients. Angiology 1988; 39 : 505-513.
43. Halkin H, Goldberg J, Modan M et al. Reduction of mortality in general medical inpatients by low-dose heparin prophylaxis. Ann Intern Med 1982; 96 : 561-565.
44. Gårdlund B Randomised, controlled trial of low-dose heparin for prevention of fatal pulmonary embolism in patients with infectious diseases. The Heparin Prophylaxis Study Group. Lancet 1996; 347 : 1357-1361.
45. Clagett GP, Reisch JS. Prevention of venous thromboembolism in general surgical patients: results of meta-analysis. Ann Surg 1988; 208 : 227-240.
46. Bergmann JF, Caulin C. Heparin prophylaxis in bedridden patients. Lancet 1996; 348 : 205-206.
47. Dahan R, Houlbert D, Caulin CE et al. Prevention of deep vein thrombosis in elderly medical in-patients by a low molecular weight heparin: a randomized double-blind trial. Haemostasis 1986; 16 : 159-164.
48. Fraisse F, Holzapfel L, Couland JM et al. Nadroparin in the prevention of deep vein thrombosis in acute decompensated COPD. The Association of Non-University Affiliated Intensive Care Specialist Physicians of France. Am J Respir Care Med 2000; 161 : 1109-1114.
49. Leizorovitz A, Cohen AT, Turpie AGG et al. Randomized placebo controlled trial of dalteparin for the prevention of venous thromboembolism in acutely ill medical patients. Circulation 2004; 110 : 874-879.
50. Alikhan R, Cohen AT, Combe S et al. Prevention of venous thromboembolism in medical patients with enoxaparin: a subgroup analysis of the MEDENOX study. Blood Coagul Fibrinolysis 2003; 14 : 341-346.
51. Bergmann JF, Neuhart E. A multicenter randomized double-blind study of enoxaparin compared with unfractionated heparin in the prevention of venous thromboembolic disease in elderly in-patients bedridden for an acute medical illness. The Enoxaparin in Medicine Study Group. Thromb Haemost 1996; 76 : 529-534.
52. Lechler E, Schramm W, Flosbach CW. The venous thrombotic risk in non-surgical patients: epidemiological data and efficacy/safety profile of a low-molecular-weight heparin (enoxaparin). The Prime Study Group. Haemostasis 1996; 26(Suppl 2): 49-56.
53. Kleber FX, Witt C, Vogel G et al. Randomized comparison of enoxaparin with unfractionated heparin for the prevention of venous thromboembolism in medical patients with heart failure or severe respiratory disease. Am Heart J 2003; 145 : 614-621.
54. Harenberg J, Roebruck P, Heene DL. Subcutaneous low-molecular-weight heparin versus standard heparin and the prevention of thromboembolism in medical inpatients. The Heparin Study in Internal Medicine Group. Haemostasis 1996; 26 : 127-139.
55. Mismetti P, Laporte-Simitsidis S, Tardy B et al. Prevention of venous thromboembolism in internal medicine with unfractionated or low-molecular-weight heparins: a meta-analysis of randomised clinical trials. Thromb Haemost 2000; 28(Suppl. 3): 51-55.
56. Cohen AT, Gallus AS, Lassen MR et al. Fondaparinux vs. placebo for the prevention of venous thromboembolism in acutely ill medical patients (ARTEMIS). J Thromb Haemost 2003; 1(Suppl 1): P2046.
57. Bosson JL, Labarere J, Sevestre MA et al. Deep vein thrombosis in elderly patients hospitalized in subacute care facilities. Arch Intern Med 2003; 63 : 2613-2618.
58. Gatt ME, Paltiel O, Bursztyn M. Is prolonged immobilization a risk factor for symptomatic venous thromboembolism in elderly bedridden patients? Results of a historical-cohort study. Thromb Haemost 2004; 91 : 538-543.
59. Hull R, Tapson VF, Schellong S et al. The EXCLAIM Study: Extended Prophylaxis with Enoxaparin in Acutely Ill Medical Patients with Restricted Mobility (abstract). Blood 2003; 102(11): abstract 4208.
60. Di Minno G, Tufano A. Challenges in the prevention of venous thromboembolism in the elderly. J Thromb Haemost 2004; 2 : 1292-1298.
61. Kamphuisen PW, Agnelli G, Sebastianelli M. Prevention of venous thromboembolism after acute ischemic stroke. J Thromb Haemost 2005; 3 : 1187-1194.
62. Kelly J, Rudd A, Lewis RR et al. Venous thromboembolism after acute ischemic stroke: a prospective study using magnetic resonance direct thrombus imaging. Stroke 2004; 35 : 2320-2325.
63. McCarthy ST, Turner J. Low dose subcutaneous heparin in the prevention of deep-vein thrombosis and pulmonary emboli following acute stroke. Age Ageing 1986; 15 : 84-88.
64. Pambianco G, Orchard T, Landau P. Deep vein thrombosis: prevention in stroke patients in stroke during rehabilitation. Arch Phys Med Rehabil 1995; 76 : 324-330.
65. International Stroke Trial Collaborative Group. The International Stroke Trial (IST): a randomised trial of aspirin, subcutaneous heparin, both, or neither among 19435 patients with acute ischaemic stroke. Lancet 1997; 349 : 1569-1581.
66. Bath PM, Iddenden R, Bath FJ. Low-molecular-weight heparins and heparinoids in acute ischemic stroke: a meta-analysis of randomized controlled trials. Stroke 2000; 31 : 1770-1778.
67. Diener HC, Ringelstein EB, Kummer R et al. Treatment of acute ischemic stroke with the low-molecular weight heparin certoparin: results of the TOPAS trial. Therapy of Patients with Acute Stroke (TOPAS) Investigators. Stroke 2001; 32 : 22-29.
68. Hommel M for the FISS bis Investigators Group. Fraxiparine in ischaemic stroke study (FISS bis). Cerebrovasc Dis 1998; 279 : 1265-1272.
69. Kvasnička J. Primární antitrombotická prevence žilní trombózy ve vnitřním lékařství. Vnitř Lék 2005; 51 : 781-789.
70. Darze ES, Latado AL, Guimarães AG et al. Incidence and clinical predictors of pulmonary embolism in severe heart failure patients admitted to a coronary care unit. Chest 2005; 128 : 2576-2580.
71. Tapson VF, Decousus H, Piovella F et al for the IMPROVE investigators. A multinational observational study in acutely ill medical patients of practices in prevention of venous thromboembolism: findings of the International Medical Prevention Registry on Venous Thromboembolism (IMPROVE). Blood 2003; 102: Abstract number 1154.
72. Rahim SA, Panju A, Menaka P et al. Venous thromboembolism prophylaxis in medical inpatients: a retrospective chart review. Thromb Res 2003; 111 : 215-219.
73. Goldhaber SZ, Tapson VF. DVT FREE Steering Comittee. A prospective registry of 5451 patients with ultrasound-confirmed deep vein thrombosis. Am J Cardiol 2004; 93 : 259-262.
74. Spáčil J, Spáčilová J. Prevence žilní trombózy a plicní embolie na interním oddělení. Vnitř Lék 2005; 51 : 518-522.
75. Pechevis M, Detournay B, Pribil C et al. Economic evaluation of enoxaparin vs. placebo for the prevention of venous thromboembolism in acutely ill medical patients. Value Health 2000; 3 : 389-396.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2006 Issue 4-
All articles in this issue
- Jsou chronická onemocnění ledvin a poruchy ledvinné funkce na standardním lůžku interních oborů dostatečně diagnostikovány?
- Nefarmakologická léčba hypertrofické obstrukční kardiomyopatie - srovnání výsledků léčby metodami perkutánní transluminální septální myokardiální ablace a 2dutinové kardiostimulace
- Videotorakoskopie v lokální anestezii v diagnostice a léčbě pohrudničních výpotků
- Pozdní kardiotoxicita u nemocných léčených pro maligní lymfomy chemoterapií s doxorubicinem
- Primární prevence ischemické choroby srdeční u mužů středního věku v Praze: výsledky dvacetiletého sledování
- Polymorfizmus v promotorové oblasti genu pro MMP-2 u revmatoidní artritidy
- Histiocytóza z Langerhansových buněk u osob dospělého věku - zkušenosti jednoho pracoviště a přehled léčebných možností
- Ubikvitiny, proteazomy, sumoylace a použití dnes a zítra v terapii nádorů i jiných chorob I. Ubikvitin-proteazomový systém a transkripční faktor NF-κB
- Profylaxe žilních tromboembolických komplikací v interních oborech - rozpor mezi teorií a praxí
- Problémy s interpretací nízkých hladin tyreoidálních hormonů podmíněné změnami v transportních proteinech
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Videotorakoskopie v lokální anestezii v diagnostice a léčbě pohrudničních výpotků
- Primární prevence ischemické choroby srdeční u mužů středního věku v Praze: výsledky dvacetiletého sledování
- Ubikvitiny, proteazomy, sumoylace a použití dnes a zítra v terapii nádorů i jiných chorob I. Ubikvitin-proteazomový systém a transkripční faktor NF-κB
- Profylaxe žilních tromboembolických komplikací v interních oborech - rozpor mezi teorií a praxí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

