-
Medical journals
- Career
18F-FDG PET v diagnostice vaskulitid velkých cév
Authors: Z. Řehák 1; Z. Fojtík 2; J. Staníček 1; K. Bolčák 1; L. Fryšáková 3
Authors‘ workplace: Oddělení nukleární medicíny Masarykova onkologického ústavu, Brno, přednosta prim. MUDr. Karol Bolčák 1; Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Vorlíček, CSc. 2; III. interní klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MUDr. Vlastimil Ščudla, CSc. 3
Published in: Vnitř Lék 2006; 52(11): 1037-1044
Category: Original Contributions
Overview
Úvod:
Pozitronová emisní tomografie (PET) je neinvazivní diagnostická metoda zobrazující biodistribuci radiofarmak značených pozitronovým zářičem v těle. Vzhledem k tomu, že nejen nádorové, ale za určitých podmínek i některé buňky zánětu mohou vykazovat zvýšenou akumulaci 18F-FDG, lze 18F-FDG PET využít nejen k diagnostice nádorů, ale i některých typů zánětů.Cíl:
Cílem práce je posouzení přínosu 18F-FDG PET u nemocných indikovaných k vyšetření pro horečky neznámého původu, u kterých bylo na základě tohoto vyšetření vysloveno podezření na vaskulitidu velkých tepen.Soubor a metoda:
V letech 2003 a 2004 bylo na pracovišti pozitronové emisní tomografie MOÚ v Brně vyšetřeno 35 nemocných z důvodu objasnění febrilií pomocí 18F-FDG PET. Podezření na vaskulitidu velkých cév bylo vysloveno na základě nálezu vysoké akumulace radiofarmaka ve stěnách velkých cév (v aortě a ve větších odstupujících tepenných větvích). U nemocných byla prováděna další standardní zobrazovací vyšetření k diagnostice vaskulitid, a to CT angiografie (CTA) u 4 nemocných, MR angiografie (MRA) u 3 nemocných a duplexní ultrasonografie (USG) u 7 nemocných. Definitivní diagnóza primární autoimunitní vaskulitidy velkých cév byla ověřována histologicky nebo na základě terapeutického testu, efektem kortikoterapie v imunosupresivních dávkách.Výsledky:
Pozitivní PET nález byl zaznamenán u 23 z 35 nemocných (65,7 %). U 11 nemocných z 23 PET pozitivních pacientů (47,8 % z PET pozitivních osob a 31,4% ze všech nemocných s febriliemi) bylo na základě PET vyšetření vysloveno podezření na aktivní vaskulitidu velkých cév. U 10 z těchto 11 nemocných bylo možno doplnit vyšetření potřebná k ověření diagnózy: v jednom případě bylo provedeno histologické vyšetření a. temporalis, ve všech 10 případech byl použit terapeutický test kortikoterapií. U všech 10 osob (2 muži a 8 žen ve věku 53 - 66 let, medián 62 let) byla diagnóza vaskulitidy velkých tepen potvrzena. Žádné z CTA, MRA i USG vyšetření ani v jednom případě nedetekovalo přímé a jasné známky vaskulitidy, ale 3 CTA a 1 MRA vyšetření bylo možno považovat za abnormální. Nález temporální (obrovskobuněčné) arteriitidy z excize a. temporalis superficialis ukazuje na limitaci PET vyšetření, které není schopno hodnotit cévy s průměrem menším než 5 mm, na druhé straně dokumentuje možnost průkazu extrakraniálního postižení u této diagnózy pomocí PET vyšetření. U 7 z 10 nemocných byl prováděn kontrolní PET scan při kortikoterapii. Na něm byl zaznamenán pokles akumulace radiofarmaka, a tím i pokles metabolické aktivity zánětu ve stěnách velkých cév, který byl v souladu s poklesem laboratorních parametrů zánětu (FW, CRP).Závěr:
Pozitronovou emisní tomografií pomocí 18F-FDG lze u nemocných vyšetřených z indikace horečky neznámého původu detekovat aktivní vaskulitidu velkých cév. Přitom je zřejmé, že PET je schopna detekovat vaskulitidy velkých tepen u nemocných, u kterých ostatní zobrazovací metody selhávají, a že pomocí PET je také možné sledovat vývoj aktivity vaskulitidy během terapie.Klíčová slova:
vaskulitida velkých cév - FDG PET - pozitronová emisní tomografie - arteriitis temporalis - obrovskobuněčná arteriitis - horečka neznámého původuÚvod
Pozitronová emisní tomografie
Pozitronová emisní tomografie (PET) je relativně nová neinvazivní diagnostická metoda. V současné době (duben 2006) jsou v České republice 2 PET kamery a 3 hybridní PET/CT scanery. PET umožňuje zobrazit biodistribuci radiofarmak značených pozitronovým zářičem v těle. Jediné rutinně používané radiofarmakum pro PET v ČR je 2-deoxy-2-[18F]-fluoro-D-glukóza, zkráceně označovaná jako 18F-fluorodeoxyglukóza nebo 18F-FDG. V molekule FDG glukóza slouží jako „nosič“, který vstupuje různými transportními systémy do buněk. FDG je hexokinázou fosforylována na 2-FDG-6-fosfát, který již není dále metabolizován a hromadí se v buňce. Zvýšenou kumulaci FDG pozorujeme ve většině maligních nádorových buněk, a hlavní indikační oblastí pro toto vyšetření jsou tedy onkologická onemocnění. Hypermetabolizmus glukózy však vykazují i některé buňky zánětu - hlavně makrofágy, histiocyty, fibroblasty, ale za určitých podmínek také lymfocyty a neutrofilní granulocyty [14,18]. Nověji se proto objevují data i o vyšetření různých forem zánětů, např. sarkoidózy, tuberkulózy, aktinomykózy, abscesů a granulomů, aterosklerózy [3,4,19,26]. Tyto nálezy jsou zpravidla zjišťovány u nemocných s diagnózou horečky neznámého původu (fever of unknown origin - FUO) [5,7,10,15] nebo náhodně u onkologických nemocných vyšetřovaných z jiných důvodů [29].
Cíl
Cílem práce bylo posouzení přínosu 18F-FDG PET u nemocných vyšetřených z indikace horečky neznámého původu, u kterých bylo na základě tohoto vyšetření vysloveno podezření na vaskulitidu velkých tepen. Přitom bylo snahou porovnat význam PET a jiných diagnostických metod, které nemocní podstoupili. Posuzováno bylo také to, zda pomocí PET vyšetření lze monitorovat efekt terapie i další vývoj onemocnění.
Soubor a metodika
Charakteristika souboru
Od ledna roku 2004 do prosince roku 2005 bylo na oddělení nukleární medicíny MOÚ v Brně vyšetřeno pozitronovou emisní tomografií celkem 35 nemocných indikovaných k vyšetření pro horečky neznámého původu [25]. Věk těchto nemocných byl v rozmezí 18 - 66 let, s mediánem 40 let. PET byla ve všech případech prováděna až jako doplňující vyšetření, pokud stále nebyla příčina febrilního stavu objasněna předchozím konvenčním vyšetřováním. Podezření na vaskulitidu velkých cév bylo vysloveno na základě nálezu vysoké akumulace radiofarmaka ve stěnách velkých cév (v aortě a ve větších odstupujících tepenných větvích). U nemocných byla prováděna další standardní zobrazovací vyšetření k diagnostice vaskulitid, a to CT angiografie (CTA) u 4 nemocných, MR angiografie (MRA) u 3 nemocných a duplexní ultrasonografie (USG) u 7 nemocných. Definitivní diagnóza primární autoimunitní vaskulitidy velkých cév byla ověřována histologicky nebo na základě terapeutického testu, efektem kortikoterapie v imunosupresivních dávkách.
Vlastní vyšetření PET
Iniciální, diagnostická vyšetření byla prováděna po 6hodinovém lačnění v euglykemii (rozmezí hodnot glykemie z kapilární krve 4,0 - 5,8 mmol/l, medián 5,1 mmol/l). Aplikovaná aktivita byla v rozmezí 286 - 408 MBq (medián 339 MBq) 18F-FDG i.v. Po akumulační fázi v délce 60 minut následovala akvizice PET scanerem ECAT ACCEL firmy SIEMENS ve 3D modu v rozsahu od proximálních stehen k bázi lební. Výsledkem akvizičního procesu byla rekonstruovaná (iterativní metoda s korekcí absorpce) tomografická data. Jednotlivé PET studie byly hodnoceny vizuálně a semikvantitativně se stanovením indexu SUVmax (maximum standardised uptake value - množství radioaktivity v zájmové oblasti vztažené k celotělovému rozložení) v ložisku vysoké akumulace radiofarmaka. V případě nálezu vysoké akumulace radiofarmaka v cévách bylo hodnoceno 7 cévních oblastí, a to ascendentní, descendentní, abdominální aorta, truncus brachiocephalicus, podklíčkové, ilické a femorální tepny, a dále jaterní parenchym. Metabolická aktivita stěny velkých cév byla hodnocena jako vysoká, pokud dosahovala nebo převyšovala metabolickou aktivitu jater, naopak byla hodnocena jako nízká, pokud nedosahovala metabolické aktivity jater. Za vaskulitidu velkých cév jsme považovali případ, kdy nejméně ve 3 cévních oblastech ze 7 hodnocených byla zaznamenána vysoká konzumpce radiofarmaka. V případech, kdy jsme měli dostupná data CT a CT angiografie (CTA) nebo MR angiografie (MRA) ve formátu DICOM 3, jsme provedli dodatečně fúzi PET/CT, PET/CTA a PET/MRA. Výsledným PET obrazem pro fotodokumentaci je takový snímek z MIP (Maximum Intensity Projection), na kterém se pro větší názornost nepřekrývá vzestupná a sestupná aorta.
Výsledky
Celkem jsme vyšetřili 35 nemocných z důvodu febrilního stavu pomocí 18F-FDG PET. U 12 nemocných byl PET nález negativní (34,3 %) a metoda byla hodnocena jako nepřínosná ke stanovení diagnózy. Negativní nálezy nebyly dále u odesílajících lékařů ověřovány. Ve skupině 23 nemocných PET pozitivních (65,7 %) jsme detekovali malignitu (8krát), ložisko zánětu - absces (2krát), zánět cévní protézy (1krát), nespecifický střevní zánět (1krát) a vaskulitidu (11krát). Z 11 případů (47,8 % ze všech PET pozitivních a 31,4 % ze všech nemocných s febriliemi), u kterých bylo vysloveno podezření na vaskulitidu velkých tepen, jsme na základě dobré spolupráce s kliniky mohli v 10 případech sledovat další osud nemocných, došetřování i jejich léčbu. Podrobněji se v práci věnujeme jen této skupině 10 nemocných (43,5 % ze všech PET pozitivních a 28,6 % ze všech nemocných s febriliemi). Věk těchto nemocných byl v rozmezí 53 - 66 let (medián 62 let), jednalo se o 2 muže a 8 žen. U všech 10 nemocných byly společné příznaky jako slabost, váhový úbytek, únava, horečnatý stav. V laboratorním obraze dominovala vysoká sedimentace erytrocytů (FW) a vysoké hodnoty C-reaktivního proteinu (CRP) jako nespecifické známky zánětlivého procesu (tab. 1). Další odchylky byly zaznamenány především v krevním obraze, v němž byla zachycena trombocytóza a anémie. Počet leukocytů byl většinou v normě nebo lehce zvýšen nad normu.
Table 1. Iniciální vyšetření a kontrolní vyšetření při kortikoterapii. 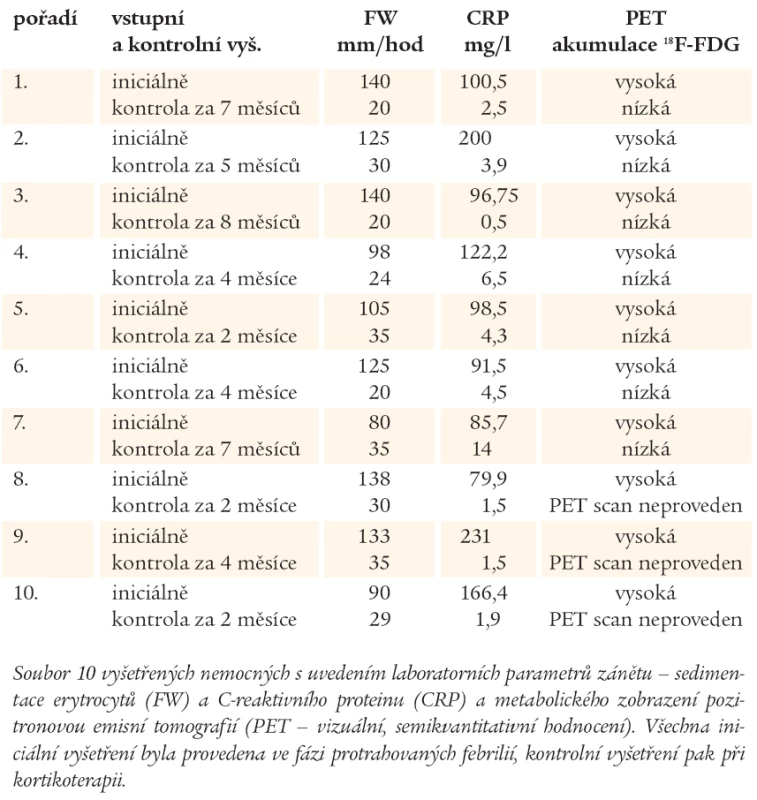
Nálezy na PET vyšetření a srovnání s dalšími metodami
V době provedení PET scanu u žádného nemocného nebyla příčina febrilií objasněna. U 3 nemocných byla scintigrafická vyšetření 99mTc-HMPAO (hexamethyl-propylen-amino-oxim) značenými leukocyty se snahou lokalizovat fokus zánětu negativní, u 2 nemocných, u kterých bylo provedeno echokardiografické vyšetření srdce, byl popsán malý a nevýznamný perikardiální výpotek.
Iniciálním, diagnostickým PET vyšetřením byla prokázána vysoká kumulace FDG, a tím hypermetabolizmus glukózy ve stěnách velkých tepen. K hlavním arteriálním kmenům, které byly zachyceny, patřila hrudní i břišní část aorty, truncus brachiocephalicus, a. carotis communis, a. subclavia, a. axilaris, a. iliaca communis a a. femoralis communis bilaterálně (obr. 1, 2). Na základě PET vyšetření tak bylo vysloveno podezření na aktivní vaskulitidu velkých cév.
Image 1. Kazuistika, muž 65 let s histologicky ověřenou temporální arteriitidou. 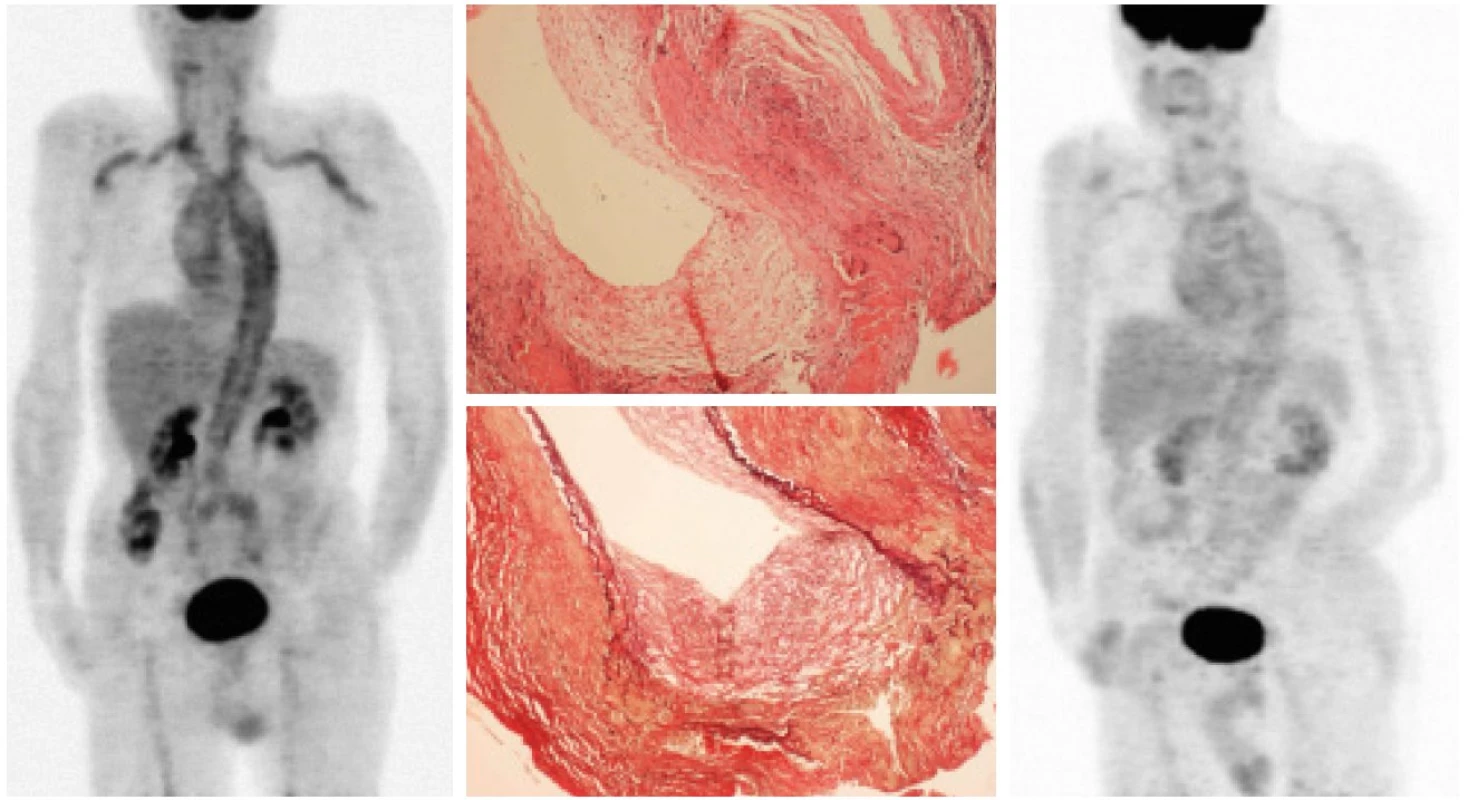
Vlevo: iniciální PET scan trupu – difuzní zvýšení konzumpce glukózy v hrudní i břišní aortě, hlavních tepenných větvích (tr. brachiocephalicus, a. subclavia, a. carotis comm., méně i v a. iliaca comm., a. femoralis.) Aktivní moč v ledvinných pánvičkách a močovém měchýři. Za variantu fyziologického zobrazení je možné považovat zvýšení konzumpce glukózy v céku a ve vzestupném tračníku. Uprostřed: histologický preparát potvrzující diagnózu temporální arteriitidy. Nahoře jsou patrny vícejaderné buňky ve stěně tepny, barvení hematoxylin – eozin, zvětšeno 100×, dole v barvení na elastická vlákna při zvětšení 100× patrné přerušení lamina elastica interna ve stěně cévy (se svolením Ústavu patologie FN Olomouc). Vpravo: PET scan trupu při kortikoterapii dokumentující pokles metabolické aktivity ve stěnách hlavních tepenných kmenů. Image 2. Kazuistika, žena 66 let. 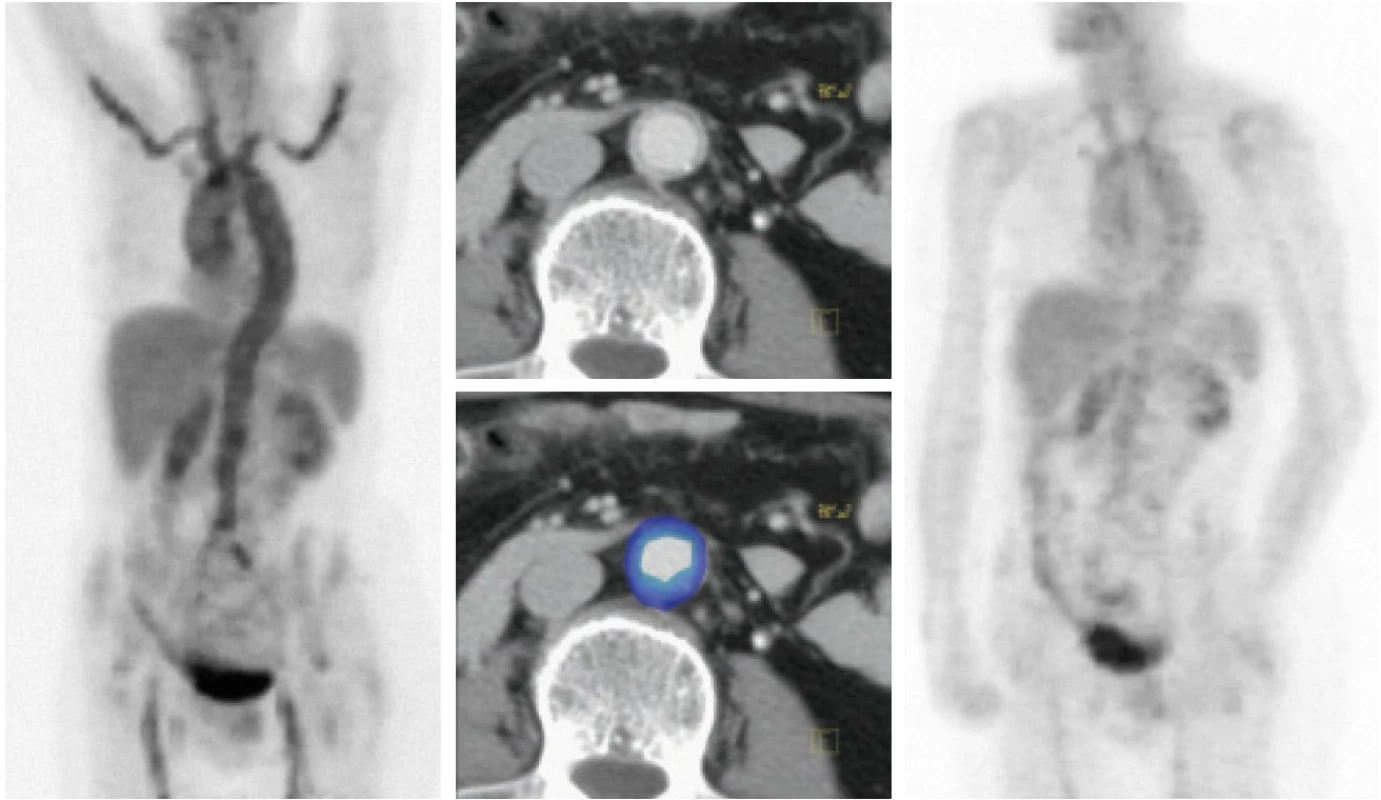
Vlevo: iniciální PET scan trupu s nálezem vysoké akumulace radiofarmaka ve stěnách velkých tepen. Uprostřed fúze PET/CTA hrudní a břišní aorty představuje spojení funkční (PET) a morfologické (CTA) zobrazovací modality. Korelace CT nálezu měkkotkáňového lemu ve stěně aorty a hypermetabolizmu glukózy ve stěně aorty (modrý prstenec). Vpravo: výrazný pokles metabolické aktivity ve stěnách tepen při kortikoterapii. Na podkladě nálezu na PET vyšetření byly prováděny u nemocných další standardní vyšetřovací metody pro vaskulitidy, ke kterým patří duplexní ultrasonografie, CT angiografie či MR angiografie (tab. 2). Těmito metodami nebyly zjištěny přímé a jasné známky vaskulitid, ale 3 CTA a 1 MRA vyšetření lze považovat za abnormální. Stěna aorty byla většinou hodnocena nespecificky - jako zesílená, s měkkotkáňovým lemem, s možnou nástěnnou trombózou, s paraaneuryzmatickým rozšířením, s lehkou dilatací.
Table 2. Přehled vybraných zobrazovacích vyšetření a jejich nálezů. 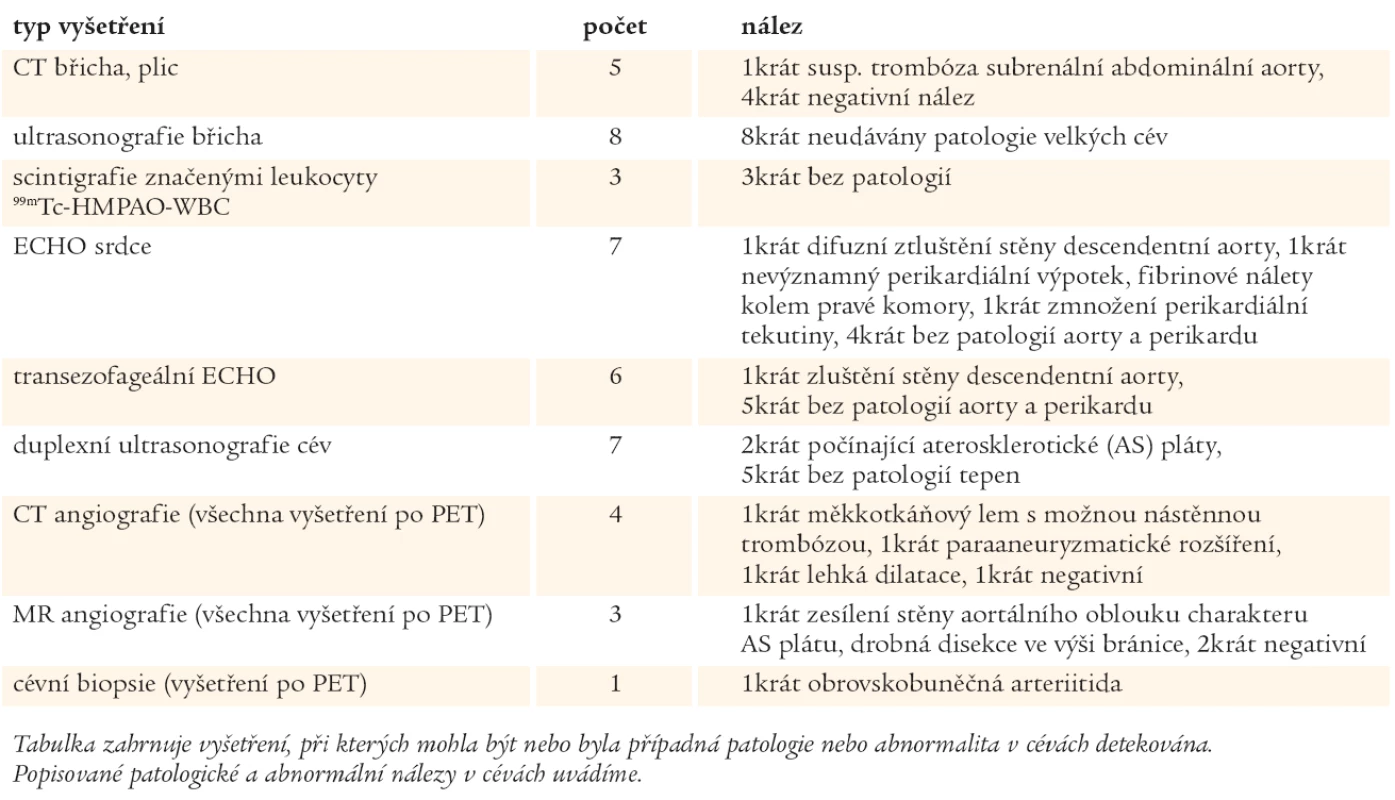
V jediném případě nemocný podstoupil excizi temporální arterie s histologickým ověřením obrovskobuněčné temporální arteriitidy, i klinický stav s cefaleou a palpační citlivostí spánkové tepny mohl odpovídat této diagnóze. U tohoto nemocného PET ani MRA nedetekovaly zánět přímo v a. temporalis superficialis, PET však detekoval extrakraniální postižení velkých cév.
U všech 10 nemocných léčených kortikoterapií (prednison, medrol, prednison a metotrexát) došlo alespoň k částečné úpravě subjektivních obtíží, úpravě laboratorních parametrů, tedy normalizaci FW, CRP (tab. 1), dále i trombocytózy a anémie. Ověření diagnózy primární vaskulitidy velkých cév tak bylo provedeno ve všech 10 případech terapeutickým testem.
U 7 nemocných bylo provedeno v rozmezí 2 - 8 měsíců (medián 5 měsíců) od diagnostického PET vyšetření další, kontrolní PET vyšetření. Při něm bylo zaznamenáno vymizení nebo snížení míry kumulace radiofarmaka, a tedy i snížení hypermetabolizmu glukózy ve stěnách cév, což bylo považováno za projev metabolické odezvy na terapii (obr. 1, 2). Klinickými lékaři (revmatology a internisty) byl stav hodnocen jako temporální arteriitida (2 nemocní), revmatická polymyalgie (4 nemocní), v dalších případech (4 nemocní) nebyl stav specifikován a byl hodnocen jako arteriitida/vaskulitida velkých cév.
Diskuse
Vaskulitidy tvoří heterogenní skupinu onemocnění charakterizovanou nekrotizujícím zánětem cév, který vede k poruše prokrvení oblasti zásobované příslušnými cévami. Klinickým korelátem bývá různý stupeň ischemie dle postiženého orgánu. Jedna z nejnovějších klasifikací vaskulitid pochází z konference v Chapel Hill z roku 1993, a dle této lze vaskulitidy dělit podle velikosti postiženého cévního systému na vaskulitidy velkých, středních a malých cév [16]. K vaskulitidám velkých cév jsou řazeny Takayasuova a obrovskobuněčná (temporální) arteriitida, které postihují stěny aorty, hlavních jejích větví a větší arterie. Zatímco Takayasouva arteriitida postihuje typicky ženy mladší 40 let, temporální arteriitida je naopak onemocnění starších osob nad 50-60 let. U nemocných s temporální arteriitidou se často vyskytuje syndrom revmatické polymyalgie [24]. Prvním projevem vaskulitid velkých cév mohou být celkové příznaky jako horečka, slabost, hubnutí se vzestupem nespecifických laboratorních markerů zánětu (FW, CRP), dysproteinemií.
V literatuře je problematice neinvazivního vyšetření vaskulitid a arteriitid věnována řada publikací. Hlavní zájem se soustředí na dopplerovskou (duplexní) ultrasonografii, CT angiografii (CTA), MR angiografii (MRA) a v posledním období i na pozitronovou emisní tomografii (PET).
PET a detekce arteriitis temporalis, PET a detekce polymyalgia rheumatica
První zprávy o možnosti vyšetření nemocných s temporální arteriitidou pomocí 18F-FDG PET jsou z roku 1999, kdy Blockmansem et al publikovali kazuistiky 6 případů temporální arteriitidy a 5 případů revmatické polymyalgie. U 8 z celkového počtu 11 nemocných byla prokázána výrazná kumulace radiofarmaka v hrudních cévách, u 8/11 i v cévách horních končetin a u 6/11 i v cévách dolních končetin [8]. V roce 2006 stejní autoři publikovali dosud největší soubor nemocných, a to 35 [6]. Výsledky těchto studií potvrdily dřívější předpoklady, že zánětlivé postižení stěny tepen v případě temporální arteriitidy nepostihuje jen oblast temporálních arterií, ale také hrudní aortu i s obloukem, abdominální aortu, podklíčkové a femorální tepny. Tato skutečnost byla potvrzena i jinými autory v rámci jednotlivých kazuistik nemocných vyšetřených pro febrilní stavy [11,12,27,30].
V našem souboru 10 nemocných jsme rovněž pozorovali vysokou kumulaci radiofarmaka v oblasti velkých tepen a na podkladě těchto nálezů bylo vysloveno podezření na arteriitidu velkých tepen. Nálezy na PET vyšetření a klinické projevy tak jistě odpovídaly primárním autoimunitním vaskulitidám velkých cév. Vzhledem k vyššímu věku nemocných (v rozmezí 53 - 66 let, medián 62 let) lze konstatovat, že se s velkou pravděpodobností nejedná o Takayasuovy arteriitidy. Klinický obraz většinou svědčil pro revmatickou polymyalgii (4 nemocní), temporální arteriitidu (2 nemocní) nebo pro „zánětlivý syndrom“ tepen, který nebyl blíže určen (4 nemocní). Za vhodné obecné označení pro uvedené stavy lze považovat termín arteriitida velkých tepen. V případech, v nichž byl obraz revmatické polymyalgie nebo temporální arteriitidy jednoznačný, lze jistě postižení velkých cév blíže specifikovat jako vaskulární postižení u revmatické polymyalgie nebo extrakraniální postižení při temporální arteriitidě. Vysoká konzumpce glukózy v cévách u pacientů s polymyalgia rheumatica tak ukazuje, že i tato forma tzv. mimokloubního revmatizmu může být pravděpodobně spíše vaskulitidou, nebo že výskyt revmatické polymyalgie v kombinaci s vaskulitidou je velmi častý [8,22].
PET a postižení a. temporalis superficialis
Skutečnost, že u nemocných s histologicky ověřenou temporální arteriitidou 18F-FDG PET vyšetření nedetekuje hypermetabolizmus glukózy ve stěnách této tepny, je dáno jen rozlišením dnešních PET scanerů, které neklesá pod 5 mm. Obvyklý průměr temporálních arterií je totiž udáván kolem 1 mm, v případě zánětu i s edémem a s infiltrací stěny pak kolem 2 - 3 mm. Tuto zkušenost popisují Brodman et al, kteří vyšetřili celkem 22 nemocných s temporální arteriitidou (7 s histologicky ověřenou) a u všech prokazovali PET jen extrakraniální postižení, v žádném případě nedetekovali postižení a. temporalis superficialis [9]. Z těchto důvodu nelze doporučit přímé vyšetření temporálních tepen pomocí PET vyšetření. U našich PET studií jsme vysokou kumulaci radiofarmaka prokazovali v a. carotis communis jen do výšky její bifurkace, v případě horních končetin jen v a. subclavia a a. axilaris, u dolních končetin v a. femoralis communis, profunda, tedy v cévách jejichž průměr je 6 - 10 mm [23].
PET a hodnocení efektu terapie
Údaje o největším souboru nemocných (celkem 35) byly v roce 2006 publikovány Blockmansem et al. V této prospektivní studii, která probíhala v letech 2000-2005, byl každý nemocný s revmatickou polymyalgií nebo obrovskobuněčnou arteriitidou vyšetřen 18F-FDG PET celkem 3krát. První scan byl iniciální, diagnostický, další pak kontrolní ve 3. a 6. měsíci kortikoterapie. Při kontrolních vyšetřeních je popsán výrazný pokles až vymizení metabolické aktivity ve velkých cévách [6]. Pokles metabolické aktivity ve velkých cévách po kortikoterapii je popisován i jinými autory [22,27,28,31,32]. Rovněž byla ověřena korelace mezi metabolickou aktivitou při PET vyšetření a zvýšením zánětlivých parametrů (CRP, FW) a trombocytózou [22,28,31], ale také inverzní korelace s hemoglobinem [22]. V rámci našeho souboru jsme zaznamenali při kontrolním vyšetření vždy pokles kumulace radiofarmaka, které odpovídalo poklesu v zánětlivých laboratorních parametrech a výraznému zlepšení klinického stavu nemocných (tab. 1).
PET a Takayasuova arteriitis
První detekce Takayasuovy arteriitidy pomocí 18F-FDG PET byla popsána v již v roce 1999 a i v tomto případě byla zaznamenána kumulace radiofarmaka v aortě a větších odstupujících větvích [13]. Obdobné nálezy popisují i větší studie [2,15,17]. I u této diagnózy imunosuprese vede k poklesu metabolické aktivity, a tím nižší kumulaci FDG patrné na PET scanu [2]. Jsou popsány případy detekce pomocí pozitronové emisní tomografie při negativních nálezech na CT [13] a MRA [20]. Žádného ze souboru našich 10 pacientů nepovažujeme za případ Takayasuovy arteriitidy.
Zajímavá je skutečnost, že obraz PET vyšetření je prakticky velmi podobný v případech, kdy je popisována kazuistika nemocných s revmatickou polymyalgií, temporální arteriitidou nebo Takayasuovou arteriitidou. Zpravidla se jedná o hypermetabolizmus glukózy ve stěnách oblouku aorty, vzestupné, sestupné i břišní aorty a hlavních větví. Z tohoto důvodu řada autorů volí místo těchto jednotlivých diagnóz obecné termíny: Large Vessel Arteritis [32], Large Vessel Vasculitis [1,31,33], aortitis [21,28], panaortitis [34].
Závěr
Jak literární údaje, tak i naše zkušenosti ukazují, že je možné 18F-FDG PET vyšetřením u nemocných s diagnózou horečky neznámého původu (FUO) odhalit mimo jiné i autoimunitní vaskulitidy velkých cév. Hlavní výhodou PET v této indikaci zřejmě bude fakt, že může stanovit diagnózu v době, kdy nejsou rozvinuty strukturální změny podmiňující typický angiografický obraz. Jedná se totiž o metabolické, funkční zobrazení, které detekuje aktuální metabolickou aktivitu zánětlivého procesu v cévní stěně. Vyšetření pro diagnostiku vaskulitidy má význam jen před nasazením imunosupresivní léčby. Naopak detekci změny metabolické aktivity ve stěnách cév při kontrolním PET vyšetření lze využít k hodnocení efektu imunosupresivní léčby. Ukazuje se, že útlum metabolické aktivity ve stěně cévy koreluje i s klinickými a laboratorními parametry aktivity choroby. Další výhodou PET vyšetření je možnost určení rozsahu postižení aorty a hlavních arteriálních kmenů. Určitou limitací tohoto vyšetření je nemožnost hodnotit arterie s menším průměrem než 4-5 mm. Tedy pro přímé posouzení zánětlivé aktivity a. temporalis superficialis je PET vyšetření nevhodné. Nálezy difuzně zvýšené konzumpce glukózy ve stěnách velkých cév se nacházejí u starších nemocných s ověřenou obrovskobuněčnou arteriitidou, revmatickou polymyalgií, ale i u mladších jedinců s arteriitidou Takayasuova typu. PET obraz těchto klinických jednotek je prakticky velmi podobný a odráží pravděpodobně již časnou fázi generalizovaného fibroproliferativního zánětu ve stěnách tepen. Role PET vyšetření však v diagnostice zánětů a zvláště vaskulitid velkých cév není zatím stanovena a bude jistě předmětem dalších studií a zkoumání.
MUDr. Zdeněk Řehák
Oddělení nukleární medicíny MOÚ
www.mou.cz
e-mail: rehak@mou.cz
Doručeno do redakce: 12. 4. 2006
Přijato po recenzi: 19. 7. 2006
Sources
1. Amberger CC, Dittman H, Overkamp D et al. Large vessel vasculitis as cause of fever (FUO) or systemic inflammation of unknown origin. Value of F-18 fluorodeoxyglucose positron emission tomography (18F-FDG-PET). Z Rheumatol 2005; 64 : 32-39.
2. Andrews J, Al-Nahhas A, Pennel DJ et al. Non-invasive imaging in the diagnosis and management of Takayasu´s arteritis. Ann Rheum Dis 2004; 63 : 995-1000.
3. Bakheet SM, Powel J, Ezzat A et al. F-18-FDG uptake in tuberculosis. Clin Nucl Med 1998; 23 : 739-742.
4. Belhocine T, Blockmans D, Hustinx R et al. Imaging of large vessel vasculitis with 18FDG PET illusion or reality?: A critical revuve of literature data. Eur J Nucl Med Mol Imaging 2003; 30 : 1305-1315.
5. Bleeker-Rovers CP, de Kleijn EM, Corstens FH et al. Clinical value of FDG PET in patients with fever of unknown origin and patients suspected of focal infection or inflammation. Eur J Nucl Med Mol Imaging 2004; 31 : 29-37.
6. Blockmans D, De Ceuninck L, Vanderschueren S et al. Repetitive 18F-Fluorodeoxyglucose positron emission tomography in giant cell arteritis: a prospective study of 35 patients. Arthritis Rheum 2006; 55 : 131-137.
7. Blockmans D, Knockaert D, Maes A et al. Clinical value of (18F)fluoro-deoxyglucose positron emission tomography for patients with fever of unknown origin. Clin Infect Dis 2001; 32 : 191-196.
8. Blockmans D, Maes A, Stroobants S et al. New arguments for a vasculitic nature of polymyalgia rheumatica using positron emission tomography. Rheumatology (Oxford) 1999; 38 : 444-447.
9. Brodmann M, Lipp RW, Passath A et al. The role of 2-18F-fluoro-2-deoxy-D-glucose positron emission tomography in the diagnosis of giant cell arteritis of the temporal arteries. Rheumatology (Oxford) 2004; 43 : 241-242.
10. Buysschaert I, Vanderschueren S, Blockmans D et al. Contribution of 18fluoro-deoxyglucose positron emission tomography to the work-up of patients with fever of unknown origin. Eur J Intern Med 2004; 15 : 151-156.
11. De Winter F, Petrovic M, Van De Wiele C et al. Imaging of giant cell arteritis. Evidence of splenic involvement using FDG positron emission tomography. Clin Nucl Med 2000; 25 : 633-634.
12. Fletcher TM, Espinola D. Positron emission tomography in the diagnosis of giant cell arteritis. Clin Nucl Med 2004; 29 : 617-619.
13. Hara M, Goodman PC, Leder RA. FDG-PET finding in early-phase Takayasu arteritis. J Comput Assist Tomogr1999; 23 : 16-18.
14. Ishimori T, Saga T, Mamede M et al. Increased 18F-FDG uptake in a model of inflammation: concanavalin A-mediated lymphocyte activation. J Nucl Med 2002; 43 : 6586-6563.
15. Jarůšková M, Bělohlávek O. Role of FDG-PET and PET/CT in the diagnosis of prolonged febrile states. Eur J Nucl Med Mol Imaging 2006; 33 (8): 913-918.
16. Jennette JC, Falk RJ, Andrassy K et al. Nomenclature of systemic vasculitides: proposal of an international consensus conference. Arthritis Rheum 1994; 37 : 187-192.
17. Kobayshi Y, Ishii K, Oda K et al. Aortic wall inflammation due to Takayasu Arteritis imaged with 18F-FDG PET coregistered with enhanced CT. J Nucl Med 2005; 46 : 917-922.
18. Kubota R, Yamada S, Kubota K et al. Intratumoral distribution of fluorine-18-fluorodeoxyglucose in vivo: high accumulation in macrophages and granulation tissues studied by microautoradiography. J Nucl Med 1992; 33 : 1972-1980.
19. Lewis PJ, Salama A. Uptake of fluorine-18-fluorodeoxyglucose in sarcoidosis. J Nucl Med 1994; 35 : 1647-1649.
20. Meller J, Grabe E, Becker W et al. Value of 18-FDG hybrid camera PET and MRI in early Takayasu aortitis. Eur Radiol 2003; 13 : 400-405.
21. Meller J, Strutz F, Siefker U et al. Early diagnosis and follow-up of aortitis with 18-FDGPET and MRI. Eur J Nucl Med 2003; 30 : 730-736.
22. Moosig F, Czech N, Mehl C et al. Correlation between 18-fluorodeoxyglucose accumulation in large vessels and serological markers of inflammation in polymyalgia rheumatica: a quantitative PET study. Ann Rheum Dis 2004; 63 : 870-873.
23. Neuwirth J. Kompendium diagnostického zobrazování. Praha: Triton 1998, 516-551.
24. Pavelka K. Polymyalgia rheumatica a temporální arteriitida: přehledný referát. Čes Revmatol 2001; 3 : 129-136.
25. Petersdorf RG, Beeson PB. Fever of unexplained origin: report on 100 cases. Medicine 1961; 40 : 1-30.
26. Rudd JH, Warburton EA, Fryer TD et al. Imaging atherosclerotic plaque inflammation with [18F]-fluorodeoxyglucose positron emission tomography. Circulation 2002; 105 : 2708-2711.
27. Řehák Z, Fryšáková L, Tichý T et al. Detekce temporální arteritidy pomocí 18F-FDG PET. Čes Radiol 2006; 60 : 234-238.
28. Scheel AK, Meller J, Vosshenrich R et al. Diagnosis and follow up of aortitis in the elderly. Ann Rheum Dis 2004; 63 : 1507-1510.
29. Shreve PD, Anzai Y, Wahl RL. Pitfalls in oncologic diagnosis with FDG-PET imaging: physiologic and artifactual fluorodeoxyglucose accumulation. J Nucl Med 1996; 36 : 441-446.
30. Turlakow A, Yeung HWD, Pui J et al. Fluorodeoxyglucose positron emission tomography in the diagnosis of giant cell arteritis. Arch Intern Med 2001; 161 : 1003-1007.
31. Walter MA, Mlezer RA, Schindler CH The value of [18F]FDG PET in the diagnosis of large vessel vasculitis and the assessment of activity and extent of disease. Eur J Nucl Med Mol Imaging 2005; 32 : 674-681.
32. Wenger M, Gasser R, Donnemiller E et al. Generalized large vessel arteritis visualised by 18fluoroglucose-positron emission tomography. Circulation 2003; 107 : 923.
33. Wiest R, Glück T, Schönberger J et al. Clinical image: occult large vessel vasculitis diagnosed by PET imaging. Rheumatol Int 2001; 20 : 250.
34. Zalts R, Hamoud S, Bar-Shalom R Panaortitis: diagnosis via fluorodeoxyglucose positron emission tomography. Am J Med Sci 2005; 330 : 247-249.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2006 Issue 11-
All articles in this issue
- Riziková medikace a kontrastní látkou indukovaná nefropatie u pacientů s diabetem a hypertenzí
- Tako tsubo syndrom - nový přírůstek do rodiny akutních stavů v kardiologii: aktuální sdělení
- Pozdní komplikace chronických zánětů respiračního traktu u nemocných s běžnou variabilní imunodeficiencí
- Význam anamnézy v diferenciálnej diagnostike reflexných a kardiogénnych synkopálnych stavov
- 18F-FDG PET v diagnostice vaskulitid velkých cév
- Prevalence hladin C−reaktivního proteinu u dospělé populace dvou regionů České republiky a jejich vztah k tělesnému složení
- Dyslipidemie u nemocných léčených peritoneální dialýzou
- Mitrální regurgitace: umíme správně načasovat chirurgické řešení?
- Postihnutie kardiovaskulárneho systému u diabetikov so súčasne prítomnou poruchou funkcie štítnej žľazy
- Mužská hormonální antikoncepce
- Transfúziou navodená imunomodulácia a infekčné komplikácie
- Masivní plicní embolizace – pokus o embolektomii po selhání trombolytické léčby
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Mužská hormonální antikoncepce
- Transfúziou navodená imunomodulácia a infekčné komplikácie
- Mitrální regurgitace: umíme správně načasovat chirurgické řešení?
- Masivní plicní embolizace – pokus o embolektomii po selhání trombolytické léčby
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

