-
Medical journals
- Career
Erytropoetin v léčbě nemocných s myelodysplastickým syndromem
Authors: J. Čermák
Authors‘ workplace: Ústav hematologie a krevní transfuze, Praha, ředitel prof. MUDr. Pavel Klener, DrSc.
Published in: Vnitř Lék 2005; 51(10): 1102-1107
Category: Original Contributions
Overview
Cíl práce:
Cílem studie bylo posoudit indikaci podávání erytropoetinu (EPO) u nemocných s myelodysplastickým syndromem (MDS).Metodika:
Rekombinantní lidský erytropoetin (rHuEPO) byl podáván 20 nemocným s MDS typu RA či RARS dle FAB klasifikace v dávce 150 IU/kg 3krát týdně po dobu 12 týdnů, u 1 nemocné s těžkou granulocytopenií byl rHuEPO kombinován s G-CSF v dávce 300 μg 3krát týdně. Jako kompletní odpověď (CR) byl hodnocen vzestup hodnot Hb na ≥ 115 g/l a nezávislost na podávání transfuzí, jako parciální odpověď (PR) byl hodnocen vzestup hodnot Hb ≥ 15 g/l spolu s nezávislostí na podávání transfuzí erytrocytů.Výsledky:
CR bylo dosaženo u 4 nemocných (20 %), 4 nemocní (20 %) dosáhli PR. Pokud nebyli hodnoceni 3 nemocní, u nichž mohla být příznivá odpověď na rHuEPO ovlivněna přítomností chronické renální insuficience mírného stupně, činil počet CR + PR 25 %. U 16 nemocných, kteří odpověděli na léčbu alespoň vzestupem Hb ≥ 5 g/l či poklesem počtu podávaných transfuzí, bylo v léčbě pokračováno stejnou dávkou rHuEPO po dobu dalších 12 týdnů, ale u žádného dalšího nemocného nebylo během této doby dosaženo CR či PR. Současné podávání perorálního chelátoru deferipronu v dávce 2–3 g denně 5 nemocným s hodnotami feritinu v séru > 2000 μg/l vedlo u 1 nemocné s PR na podávání rHuEPO k signifikantnímu poklesu hodnot feritinu v séru a zvýšení odpadu železa močí, u 3 dalších nemocných bylo dosaženo stabilizace hodnot feritinu v séru i při pokračujícím přívodu železa transfuzemi při nedostatečné odpovědi na rHuEPO.Závěr:
Prediktivními hodnotami pro příznivou odpověď na podávání rHuEPO byly: iniciální hodnota EPO v séru < 100 IU/l, hodnota Hb > 85 g/l a závislost na podávání ≤ 2 TU erytrocytární masy měsíčně před zahájením léčby rHuEPO. U nemocných s kombinací těchto parametrů bylo dosaženo CR + PR v 89 %, což ukazuje na indikovanost podávání rHuEPO u této podskupiny nemocných s MDS typu RA. Podávání kombinace rHuEPO s G-CSF představuje finančně nákladnou léčbu a mělo by být vyhrazeno pro nemocné s MDS typu RARS a hladinou EPO v séru < 500 IU/l při současné závislosti na podávání ≤ 2 TU erytrocytární masy měsíčně.Klíčová slova:
myelodysplastický syndrom – anémie – růstové faktory – erytropoetin – přetížení železem – chelataceÚvod
Pro většinu nemocných s myelodysplastickým syndromem (MDS) je charakteristický různý stupeň cytopenie v periferní krvi kontrastující s buněčně bohatou kostní dření s dysplastickými rysy. Anémie je v době diagnózy přítomna u více než 50 % nemocných a téměř 80 % nemocných potřebuje během průběhu onemocnění transfuzi erytrocytární masy [4]. Zejména u nemocných s časnými formami choroby vzniká anémie jako důsledek inefektivní erytropoézy při současně vystupňované proliferaci a zvýšeném zániku (apoptóze) prekurzorů červené krevní řady náležejících k patologickému klonu. Erytropoetin (EPO) je glykoprotein o molekulární hmotnosti 30 400 D produkovaný z velké části ledvinami, jenž prostřednictvím vazby se specifickým receptorem na povrchu cílových buněk ovlivňuje produkci erytrocytů zejména cestou stimulace proliferace a inhibice apoptózy pozdních prekurzorů erytropoézy (tzv. CFU-E buněk) [21]. U nemocných s MDS je podávání EPO odůvodňováno jeho relativním nedostatkem při vystupňované erytropoéze, kdy farmakologická dávka hormonu může podporovat jak diferenciaci prekurzorů náležejících k patologickému klonu směrem ke zralým erytrocytům, tak proliferaci reziduální populace normálních prekurzorů červené řady [1,27]. Krom toho se předpokládá u časných forem choroby i tlumivý efekt EPO na zvýšený stupeň apoptózy progenitorových buněk. Příznivý efekt podávání rekombinantního lidského erytropoetinu (rHuEPO) však byl popsán pouze u 15-20 % nemocných s méně pokročilými formami MDS (RA - refrakterní anémie, RARS - refrakterní anémie se zmnožením prsténčitých sideroblastů, RAEB - refrakterní anémie s nadbytkem blastů) [16]. Řada studií se proto pokouší vzhledem k nákladnosti léčby přesněji charakterizovat nemocné, u nichž lze předpokládat efektivní léčbu rHuEPO, ať již v monoterapii, či v kombinaci s jinými růstovými faktory [5,19,23]. Ukazuje se, že prediktivní význam mají zejména stupeň anémie, hladina EPO v séru a frekvence podaných transfuzí erytrocytů nutných ke korekci anémie [17,18,26]. V naší práci uvádíme zkušenosti s podáváním rHuEPO nemocným s časnými stadii MDS, jež jsou sledováni v Ústavu hematologie a krevní transfuze v Praze.
Soubor nemocných a metodika
Do studie bylo zařazeno 20 nemocných s časnými stadii MDS s hodnotami Hb < 100 g/l, u 18 nemocných se jednalo o primární MDS, u 2 nemocných šlo o sekundární MDS vzniklý po předchozí léčbě karcinomu kombinací chemo - a radioterapie. Klasifikace nemocných byla provedena na základě morfologického vyšetření punktátu a bioptického vzorku kostní dřeně a na základě cytogenetického vyšetření pomocí rutinních metodik a molekulárně biologických technik (FISH - fluorescenční in situ hybridizace) detailně popsaných v souhrnné studii [11]. Hodnocení karyotypu bylo provedeno podle prognostických kritérií daných Mezinárodním prognostickým skórovacím systémem (IPSS) [13]. Při hodnocení nemocných podle francouzsko-americko-britské klasifikace (FAB) [2] bylo 18 nemocných klasifikováno jako RA a 2 nemocní jako RARS. Podle tzv. WHO klasifikace [15] splňovalo kritéria pro RA 11 nemocných, 4 nemocní byli zařazení do skupiny RCMD (refrakterní cytopenie s dysplazií ve více řadách), 4 nemocné splňovaly kritéria pro tzv. 5q-syndrom, 1 nemocná byla klasifikována jako RARS a 1 nemocná byla hodnocena jako RCMDs (refrakterní cytopenie s dysplazií ve více řadách se zmnožením prsténčitých sideroblastů). U všech nemocných byly před zahájením léčby a v intervalu 2 týdnů během léčby sledovány hodnoty krevního obrazu, hladiny železa v séru a feritinu v séru byly vyšetřovány před zahájením léčby a poté kontrolovány každé 4 týdny, hladiny EPO, vitaminu B12 a kyseliny listové v séru byly stanoveny před léčbou a po 12, resp. 24 týdnech léčby. U všech nemocných byly monitorovány základní biochemické parametry (jaterní testy, urea, kreatinin, kyselina močová, minerály v séru, glykemie) a hodnocen měsíční počet podaných transfuzí erytrocytů před zahájením léčby a v průběhu léčby rHuEPO. U všech nemocných byla sérologicky vyloučena spoluúčast imunní hemolytické anémie.
Rekombinantní lidský erytropoetin (přípravky Eprex, Cilag AG, Švýcarsko u 10 nemocných a NeoRecormon, Roche Diagnostic, SRN u 10 nemocných) byl podáván v dávce 150 IU/kg hmotnosti 3krát týdně po dobu 12 týdnů. U nemocné s RCMDs bylo vzhledem k těžké granulocytopenii podávání rHuEPO kombinováno s aplikací granulocytární kolonie stimulujícího faktoru (G-CSF, Neupogen, Amgen Europe, Nizozemí) v dávce 300 µg 3krát týdně. Odpověď na léčbu byla posuzována podle kritérií stanovených Hellströmovou [16] a Chesonem [8], jež jsou uvedena v tab. 1. U nemocných, kteří dosáhli kompletní (CR) či částečné odpovědi (PR), byl nadále podáván rHuEPO v udržovací dávce 150 IU/kg 1-3krát týdně. U nemocných s minimální odpovědí (MR) a u nemocných, kde došlo alespoň k vzestupu Hb o 5 g/l či ke snížení počtu podávaných transfuzí, bylo pokračováno v léčbě dávkou rHuEPO 150 IU/kg 3krát týdně po dobu dalších 12 týdnů a poté znovu hodnocen efekt léčby. U nemocných bez odpovědi na léčbu nebylo v podávání rHuEPO po 12 týdnech pokračováno.
Table 1. Hodnocení odpovědi nemocných na podávání rHuEPO. 
U 5 nemocných s iniciální hladinou feritinu v séru vyšší než 2 000 µg/l byl současně podáván perorální chelátor deferiprone (Ferriprox, Apotex, Kanada) v dávce 2-3 g denně. Čtyři nemocné byly dlouhodobě léčeny malými dávkami kortikosteroidů (Prednison, Zentiva, ČR v dávce od 2,5 mg 2krát týdně do 10 mg denně).
Výsledky
Laboratorní nálezy u nemocných spolu s hodnocením odpovědi na léčbu rHuEPO po 12 týdnech jsou shrnuty v tab. 2. Kompletní odpověď (CR) byla pozorována u 4 nemocných (20 %), parciální odpověď (PR) byla přítomna u dalších 4 nemocných (20 %). Minimální odpověď (MR) hodnocená snížením počtu podávaných transfuzí o více než 50 % byla nalezena u 2 nemocných (10 %), u těchto nemocných a u dalších 6 nemocných, kde po léčbě došlo k vzestupu hodnot Hb ≥ 5 g/l či alespoň ke snížení počtu podávaných transfuzí erytrocytů, bylo pokračováno v podávání rHuEPO po dobu dalších 12 týdnů, ale u žádného z těchto nemocných nebyla po prolongovaném podávání léku pozorována CR či PR. U 4 nemocných nebyl pozorován žádný efekt podávání rHuEPO a léčba byla po 12 týdnech ukončena. U 1 nemocného (č. 10) byl dokonce po podávání rHuEPO pozorován výrazný pokles hodnot Hb, při sérologickém vyšetření se však u tohoto pacienta nepotvrdilo podezření na vznik protilátek proti EPO [6]. U nemocné s RCMDs (č. 4) vedlo kombinované podávání rHuEPO a G-CSF k trvalému vzestupu počtu neutrofilů nad 0,8 x 109/l, ale v červené řadě byla pozorována pouze minimální odpověď.
Table 2. Laboratorní nálezy u nemocných před zahájením léčby a po 12 týdnech léčby rHuEPO společně s hodnocením odpovědi na rHuEPO. Hodnoty feritinu v séru označené * znamenají, že nemocní dostávali současně s podáváním rHuEPO chelatační léčbu. 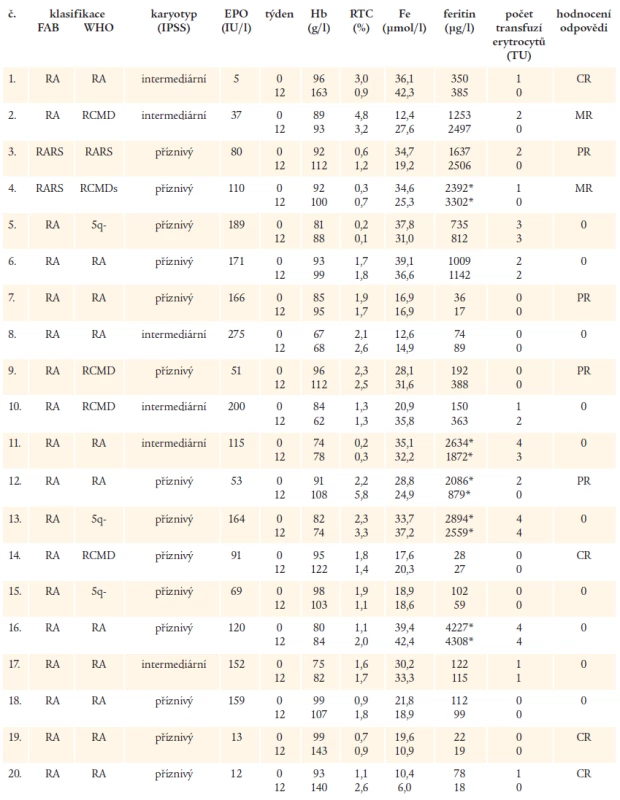
Při podrobnějším rozboru jednotlivých laboratorních parametrů bylo zjištěno, že u všech nemocných, kteří dosáhli CR či PR, byla iniciální hodnota Hb ≥ 85 g/l, naopak, u 8 z 12 nemocných s MR či bez odpovědi na léčbu mělo před léčbou hodnotu Hb < 85 g/l. Žádný z nemocných s CR či PR nepotřeboval před léčbou více než 2 TU erytrocytární masy měsíčně a 3 ze 4 nemocných s CR nebyli závislí na podávání transfuzí erytrocytů. Na druhé straně, u 4 nemocných transfundovaných 3-4 TU erytrocytární masy měsíčně nebyla přítomna ani MR na rHuEPO, pouze u 1 nemocné (č. 11) došlo ke snížení počtu transfuzí a u další nemocné k vzestupu Hb o 7 g/l (č. 5). Všech 8 nemocných s CR či PR mělo hodnotu EPO v séru před léčbou < 200 IU/l, z toho u 7 z nich byla iniciální hodnota EPO < 100 IU/l. Naopak, u 7 z 10 nemocných, kteří nedosáhli MR, byla vstupní hodnota EPO v séru > 150 IU/l a u 2 ze 4 nemocných, kteří vůbec neodpověděli na léčbu, byla hladina EPO v séru před léčbou ≥ 200 IU/l. U nemocné č. 12 s PR na podávání EPO došlo při současném podávání Ferriproxu k významnému poklesu hodnoty feritinu v séru a zvýšení odpadu železa močí, kromě toho, u dalších 3 nemocných byla při kombinovaném podávání rHuEPO a perorálního chelátoru pozorována stabilizace hodnot feritinu v séru i při trvajícím zatížení železem v důsledku opakovaných transfuzí malé odpovědi na EPO, u nemocné č. 4 musela být chelatační léčba přerušena pro nesnášenlivost přípravku.
Diskuze
Rekombinantní lidský erytropoetin je používán ke korekci anémie u nemocných s MDS od počátku 90. let minulého století [3]. V roce 1995 provedla Hellström-Lindbergová [16] metaanalýzu výsledků léčby v 17 studiích publikovaných do té doby, jako kritérium odpovědi na podávání rHuEPO byl hodnocen vzestup Hb ≥ 15 g/l či dosažení nezávislosti na podávání transfuzí erytrocytů. Při užití těchto kritérií byl efekt rHuEPO přítomen u 16 % nemocných, přičemž byl pozorován výrazný rozdíl mezi jednotlivými podskupinami (21,7 % u nemocných s RA a 22,7 % u nemocných s RAEB oproti 7,5 % nemocných s RARS). Nejdůležitějším faktorem ovlivňujícím odpověď na podávání EPO byla nezávislost na podávání transfuzí před léčbou, na léčbu odpovědělo příznivě více než 50 % těchto nemocných s jinou formou MDS než RARS. U nemocných nezávislých na podávání transfuzí a s hladinou EPO v séru < 200 IU/l byla pravděpodobnost příznivé odpovědi na podání EPO 44 % vs 10 % u ostatních nemocných. Naopak, nemocní s RARS závislí na transfuzích a s hladinou EPO v séru > 200 IU/l neodpověděli na léčbu EPO vůbec. Průměrná dávka rHuEPO se pohybovala okolo 450 IU/kg týdně a nebyly pozorovány výraznější rozdíly mezi efektem těchto dávek a stoupajícími dávkami až do 3 000 IU/kg týdně, největší procento odpovědí na léčbu bylo přítomno během prvých 8 týdnů podávání rHuEPO. Analýza německých autorů [12] hodnotící výsledky podávání rHuEPO 423 nemocným ve 27 studiích došla k podobným závěrům, efekt léčby byl přítomen u 24 % nemocných. V randomizované italské studii [20] mělo podávání rHuEPO v dávce 150 IU/kg/den signifikantní efekt na vzestup hodnot Hb oproti placebu, ale podle výše uvedených kritérií byl po 8 týdnech léčby účinek přítomen pouze u 13 % nemocných. Prediktivní význam pro odpověď na podávání EPO měla hladina EPO v séru < 200 IU/l a nárůst hladiny cirkulujících transferinových receptorů v séru o více než 18 % během prvých 4 týdnů léčby, nejlepší efekt byl pozorován u nemocných s RA. Při hledání cest vedoucích ke zlepšení účinku EPO bylo určitého úspěchu dosažení při podávání 300 IU místo 150 IU/kg/den (13 % vs 24 % odpovědí) [20], slibnější výsledky přinesla kombinace rHuEPO s G-CSF využívající synergistický efekt obou růstových faktorů na erytropoézu. Skandinávská studie [17] kombinující podávání rHuEPO v dávce 5 000 či 10 000 IU/den s G-CSF v dávce 30, 75 či 150 µg/den po dobu 12 týdnů prokázala efekt při hodnocení CR či PR dle identických kritérií jako v naší studii u 38 % nemocných, nejvýraznější efekt oproti monoterapii EPO byl přítomen u nemocných s RARS (odpověď u 46 % nemocných), méně u nemocných s RA (efekt u 20 % pacientů), obdobné výsledky přinesla studie Negrina et al (19 % CR u RA a 37,5 % CR u RARS) [25]. V recentní francouzské studii [7] odpovědělo 50 % nemocných s RA (17 % CR a 33 % PR) a 46 % nemocných s RARS (8 % CR a 38 % PR) na podávání rHUEPO (20 000 IU 3krát týdně + G-CSF 105 µg 3krát týdně po dobu 12 týdnů). Někteří autoři zdůrazňují význam prolongovaného podávání EPO, v řecké studii [28] vedlo podávání rHuEPO v dávce 150 IU/kg 3krát týdně po 26 týdnů k odpovědi u 30 % nemocných s RA v porovnání s 13 % odpovídajících po 12 týdnech léčby, ještě výraznější byl rozdíl u nemocných s RARS (42 % vs 4 %).
Výsledky naší studie prokazující účinek EPO (hodnocený dosažením CR či PR) u 40 % nemocných s časnými stadii MDS jsou ve shodě se závěry výše uvedených studií. Pro přesnější interpretaci výsledků je však nutno uvést, že u 2 nemocných s CR a u 1 nemocné s PR byly při podrobnějším klinickém a laboratorním vyšetření prokázány známky chronické ledvinné nedostatečnosti mírného stupně, tento nález může potencovat příznivý efekt exogenně dodaného EPO na krvetvorbu, i když snížená hladina EPO v séru byla přítomna pouze u nemocné č. 1. Při korekci hodnocení léčby o výše uvedené nemocné byl tedy efekt podávání rHuEPO pozorován u 25 % nemocných. Iniciální hodnota Hb, hladina EPO v séru a závislost či nezávislost na podávání transfuzí erytrocytů byly u našich nemocných důležitými faktory ovlivňujícími odpověď na podání EPO. Tyto nálezy se shodují se závěry analýzy dlouhodobého studia léčby anémie u MDS erytropoetinem v monoterapii či v kombinaci s G-CSF provedeného skandinávskou skupinou [18,19], na jejímž podkladě byla navržena jako indikační kritéria pro podávání kombinace EPO s G-CSF nemocným s méně rizikovými podtypy MDS (RA, RARS, RAEB < 10 % blastů) hodnota EPO v séru < 500 IU/l a potřeba méně než 2 TU erytrocytární masy měsíčně, přičemž nejlepší efekt je v této skupině předpokládán u nemocných s hladinou EPO v séru < 100 U/l, kde bylo CR dosaženo u 61 % nemocných [19]. Bowen et al [5] doporučují podávat rHuEPO u nemocných s RA a hodnotami EPO v séru < 200 IU/l při potřebě < 2 TU erytrocytární masy měsíčně v monoterapii, a teprve při nedostatečné odpovědi po 6 týdnech zvážit zdvojnásobení dávky EPO či přidání G-CSF, jenž je od počátku podáván pouze nemocným s RARS a hodnotou EPO v séru < 500 IU/l. Při takto zvolených kritériích nebyl u RA pozorován výrazný rozdíl v procentu CR mezi monoterapií rHuEPO a jeho kombinací s G-CSF, což je nutno brát v úvahu zejména vzhledem k finanční nákladnosti kombinované léčby, jež je více než 3krát dražší než podpůrná léčba [7]. Prolongované podávání stejné dávky EPO nezvýšilo u našich nemocných na rozdíl od jiných studií [28] procento odpovědí na léčbu, z ekonomických důvodů nebylo možno nemocným podávat dvojnásobnou dávku rHuEPO při nedostatečné odpovědi na iniciální léčbu, nicméně, řada autorů poukazuje na to, že pro efekt léčby je u nemocných s MDS rozhodující spíše hladina EPO v séru a závislost na transfuzích než výše podané dávky [12,16,18] a že u odpovídajících nemocných stačí k dlouhodobé stabilizaci hodnot Hb nižší udržovací dávky než při iniciální léčbě [19,24]. Vzhledem k tomu, že žádný z nemocných v naší skupině neměl prognosticky nepříznivé změny karyotypu, nebylo možno ověřit případné negativní ovlivnění odpovědi na EPO přítomností vícečetných chromozomálních aberací [26]. Naše studie pouze potvrdila již dříve pozorovaný malý efekt rHuEPO u nemocných s tzv. 5q-syndromem [19].
Mobilizační efekt podávání EPO na zásoby železa byl opakovaně popsán u nemocných s chronickou renální insuficiencí léčených rHuEPO [9] a je vysvětlován stimulací proliferace erytropoézy a stimulací tvorby a exprese transferinových receptorů na povrchu erytroidních prekurzorů [29]. Významná potenciace účinku chelátorů na nadbytečné zásoby současně podávaným EPO i při trvající závislosti na transfuzích již byla pozorována u nemocné s thalasemia maior [10], obdobný efekt byl přítomen i u nemocné č. 12 v současné studii, kde podávání Ferriproxu sice umožnilo stabilizaci hodnot feritinu v séru mezi 1800-2000 µg/l, avšak kombinace chelátoru s rHuEPO, jenž měl příznivý efekt na četnost podávaných transfuzí, vedla ke snížení hodnoty feritinu na 879 µg/l a k výraznému zvýšení odpadu železa močí potvrzujícímu synergizmus účinku obou léků na mobilizaci zásobního železa. Tento efekt na exkreci železa byl do určité míry vyjádřen i u ostatních nemocných léčených současně s rHuEPO perorálním chelátorem a může vysvětlovat pozorovanou stabilizaci hodnot feritinu v séru i při trvající zátěži transfuzemi erytrocytů.
Závěrem možno shrnout, že naše studie potvrdila oprávněnost podávání erytropoetinu vybraným nemocným s RA, u nichž lze příznivý efekt této nákladné léčby předvídat z hladiny EPO v séru < 200 IU/l při současné potřebě 2 či méně transfuzí erytrocytů za měsíc, na léčbu odpovědělo 57 % nemocných v této skupině. Z našich nálezů vyplývá, že nejlepší odpověď je možno očekávat u nemocných s RA nezávislých na podávání transfuzí, s hladinou EPO v séru < 100 IU/l a hodnotou Hb ≥ 85 g/l. U nemocných s kombinací těchto parametrů bylo CR či PR dosaženo v 89 %. Podávání kombinace rHuEPO s G-CSF představuje velmi nákladnou léčbu, jež by v současné době měla být zřejmě vyhrazena pro nemocné s RARS a hladinou EPO v séru < 500 IU při současné potřebě 2 či méně transfuzí erytrocytů za měsíc. V poslední době se ukazuje u nemocných s MDS jako perspektivní i podávání darbopoetinu [22] a čekáme na zhodnocení efektu podávání dlouhodobých stimulátorů exprese receptoru pro erytropoetin [14].
Práce vznikla v rámci grantového projektu NK/7713-3 Interní grantové agentury ministerstva zdravotnictví České republiky.
prim. MUDr. Jaroslav Čermák, CSc.
www.uhkt.cz
e-mail: cermak@uhkt.cz
Doručeno do redakce: 17. 1. 2005
Přijato po recenzi: 15. 3. 2005
Sources
1. Asano H, Ohashi H, Ichibara M et al. Evidence for nonclonal hematopoietic progenitor cell populations in bone marrow of patients with myelodysplastic syndromes. Blood 1994; 84 : 588-594.
2. Bennett JM, Catovsky D, Daniel MT et al. Proposals for the classification of the myelodysplastic syndromes. Br J Haematol 1982; 51 : 189-199.
3. Bowen D, Culligan D, Jacobs A. The treatment of anaemia in the myelodysplastic syndromes with recombinant human erythropoietin. Br J Haematol 1991; 77 : 419-423.
4. Bowen DT, Hellström-Lindberg E. Best supportive care for the anaemia of myelodysplasia: inclusion of recombinant erythropoietin therapy? Leuk Res 2001; 25 : 19-21.
5. Bowen D, Culligan D, Jowitt S et al. Guidelines for the diagnosis and therapy of adult myelodysplastic syndromes. Br J Haematol 2003; 120 : 187-200.
6. Casadevall N, Nataf J, Viron B et al. Pure red-cell aplasia and antierythropoietin antibodies in patients treated with recombinant erythropoietin. N Engl J Med 2002; 346 : 469-475.
7. Casadevall N, Durieux P, Dubois S et al. Health, economic, and quality-of-life effects of erythropoietin and granulocyte colony-stimulating factor for the treatment of myelodysplastic syndromes: a randomized, controlled trial. Blood 2004; 104 : 321-327.
8. Cheson BD, Bennett JM, Kantarjian H et al. Report of an international working group to standardize response criteria for myelodysplastic syndrome. Blood 2000; 96 : 3671-3674.
9. Čermák J, Brabec V, Indrák K. Combination of recombinant human erythropoietin and iron chelator L1 (deferiprone) in the treatment of iron overload in a patient with inherited hemoglobin disorder. Int J Hematol 1996; 64: S 35 (abstr).
10. Čermák J, Gregora E, Lachmanová J et al. Sledování zásob železa u nemocných s chronickým selháním ledvin léčených rekombinantním lidským erytropoetinem. Vnitř Lék 1994; 40 : 174-178.
11. Čermák J, Vítek A, Michalová K et al. Myelodysplastický syndrom v novém tisíciletí. Jak klasifikovat a léčit nemocné? Vnitř Lék 2005; 51 : 20-30.
12. Ganser A, Hoelzer D. Clinical use of hematopoietic growth factors in the myelodysplastic syndromes. Semin Hematol 1996; 33 : 186-195.
13. Greenberg P, Cox C, Le Beau MM et al. International scoring system for evaluation prognosis in myelodysplastic syndromes. Blood 1997; 89 : 2079-2088.
14. Haselbeck A, Bailon P, Pahlke W et al. The discovery and characterization of CERA, an innovative agent for the treatment of anemia. Blood 2002; 100 : 227a (abstr).
15. Harris NL, Jaffe ES, Diebold J et al. World Health Organization classification of neoplastic diseases of the hematopoietic and lymphoid tissues: report of the Clinical Advisory Committee Meeting - Airlie House, Virginia, November 1997. J Clin Oncol 1999; 17 : 3835-3849.
16. Hellström-Lindberg E. Efficacy of erythropoietin in the myelodysplastic syndromes: a meta-analysis of 205 patients from 17 studies. Br J Haematol 1995; 89 : 67-71.
17. Hellström-Lindberg E, Ahlgren T, Beguin Y et al. Treatment of anemia in myelodysplastic syndromes with granulocyte colony-stimulating factor plus erythropoietin: results from a randomized phase II study and long-term follow-up of 71 patients. Blood 1998; 92 : 68-75.
18. Hellström-Lindberg E, Negrin R, Stein R et al. Erythroid response to treatment with G-CSF plus erythropoietin for the anaemia of patients with myelodysplastic syndromes: proposal for a predictive model. Br J Haematol 1997; 99 : 344-351.
19. Hellström-Lindberg E, Gulbrandsen N, Lindberg G et al. A validated decision model for treating the anaemia of myelodysplastic syndromes with erythropoietin + granulocyte colony-stimulating factor: significant effects on quality of life. Br J Haematol 2003; 120 : 1037-1046.
20. Italian Cooperative Study for rHuEpo in myelodysplastic syndromes: A randomized double-blind placebo-controlled study with subcutaneous recombinant human erythropoietin in patients with low-risk myelodysplastic syndromes. Br J Haematol 1998; 103 : 1070-1074.
21. Koury MJ, Bondurant MC. Erythropoietin retards DNA breakdown and prevents programmed death in erythroid progenitor cells. Science 1990; 248 : 378-381.
22. Mannone L, Gardin G, Quarre MC et al. High response rate to darbopoietin alfa in “low risk” MDS: results of a phase II study. Blood 2004; 104 : 24a (abstr).
23. Miller AM, Noyes WE, Taetle R et al. Limited erythropoietic response to combined treatment with recombinant human interleukin 3 and erythropoietin in myelodysplastic syndrome. Leuk Res 1999; 23 : 77-83.
24. Musto P, Falcone A, Sanpaolo G et al. Efficacy of a single, weekly dose of recombinant erythropoietin in myelodysplastic syndromes. Br J Haematol 2003; 122 : 269-271.
25. Negrin RS, Stein R, Vardiman J et al. Treatment of the anemia of myelodysplastic syndromes using recombinant human granulocyte colony-stimulating factor in combination with erythropoietin. Blood 1993; 82 : 737-743.
26. Seipelt G, Ottmann OG, Hoelzer D. Cytokine therapy for myelodysplastic syndrome. Curr Opin Hematol 2000; 7 : 156-160.
27. Stein RS, Abels RI, Krantz SB. Pharmacologic doses of recombinant human erythropoietin in the treatment of myelodysplastic syndromes. Blood 1991; 78 : 1658-1663.
28. Terpos E, Mougiou A, Kouraklis A et al. Prolonged administration of erythropoietin increases erythroid response rate in myelodysplastic syndromes: a phase II trial in 281 patients. Br J Haematol 2002; 118 : 174-180.
29. Weiss G, Houston T, Kastner S et al. Regulation of cellular iron metabolism by erythropoietin: activation of iron-regulatory protein and upregulation of transferring receptor expression in erythroid cells. Blood 1997; 89 : 680-687.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2005 Issue 10-
All articles in this issue
-
Fokální síňová tachykardie
Klinické projevy, místa vzniku a výsledky katetrové ablace - Srovnání katetrizační a chirurgické léčby defektu septa síní typu ostium secundum u dospělých pacientů
- Vysoká prevalence a špatná kontrola hypertenze v ordinacích praktických lékařů
- Prevalence a možné rizikové faktory rozvoje samoléčení antibiotiky v České republice
- Erytropoetin v léčbě nemocných s myelodysplastickým syndromem
- Význam L-karnitinu u pacientů s chronickým renálním selháním léčených hemodialýzou
- Úloha apoptózy u kardiovaskulárních onemocnění
- Protrombotický stav ako súčasť metabolického syndrómu
- Infekční endokarditida umělé mitrální chlopně
-
Diagnostika a léčba chronické hepatitidy B
Doporučený postup České hepatologické společnosti a Společnosti infekčního lékařství České lékařské společnosti J. E. Purkyně
-
Fokální síňová tachykardie
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue-
Fokální síňová tachykardie
Klinické projevy, místa vzniku a výsledky katetrové ablace - Infekční endokarditida umělé mitrální chlopně
- Srovnání katetrizační a chirurgické léčby defektu septa síní typu ostium secundum u dospělých pacientů
- Protrombotický stav ako súčasť metabolického syndrómu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

