-
Medical journals
- Career
Pleurální výpotky – přehled současných znalostí
Authors: K. Brat
Authors‘ workplace: Klinika nemocí plicních a TBC LF MU a FN Brno
Published in: Geriatrie a Gerontologie 2018, 7, č. 4: 156-161
Category: Review Article
Overview
Pleurální výpotky jsou častým zdravotním problémem s incidencí až 100 tisíc případů ročně v České republice. Diferenciální diagnóza pleurálních výpotků zahrnuje několik desítek různých příčin a u řady pacientů představuje opravdový diagnostický problém. Terapie pleurálních výpotků zahrnuje obecně metody sloužící k evakuaci výpotku a zastavení jeho tvorby (včetně paliativních úkonů), tak i metody řešící kauzalitu konkrétních diagnóz/příčin výpotků. V tomto článku je uveden přehled současných znalostí a v praxi nejčastěji používaných diagnosticko-terapeutických možností v rámci péče o pacienty s pleurálními výpotky.
Klíčová slova:
pleurální výpotek – exsudát – drenáž hrudníku – sonografie hrudníku – pleuroskopie
Úvod
Pleurální (pohrudniční) dutina je za fyziologických okolností virtuální prostor vymezený viscerální pleurou (poplicnicí) a parietální pleurou (pohrudnicí). V pleurální dutině je fyziologicky přítomno kolem 0,26 ml/kg tekutiny (10–15 ml/dospělá osoba) a její denní produkce dosahuje kolem 15–20 ml/den (dle zvířecích modelů) [1]. Tloušťka tekutinového filmu mezi oběma listy pleury je cca 10 um a tato tekutina není detekovatelná žádným v klinické praxi používaným zobrazovacím vyšetřením [1]. Větší část tekutiny je produkována z kraniální oblasti parietální pleury za pomoci tlakového gradientu arteriální řečiště – intersticiální prostor – pleurální dutina [1]. Tekutina je vstřebávána na základě osmózy, a to zejména cestou pleurálních stomat (napojených na lymfatické cévy) v diafragmatických a mediastinálních plochách pleury [1]. Resorpční kapacita pleury se může zvýšit až na 30násobek bazální potřeby (= cca 500 ml/den) [2].
O pleurálním výpotku mluvíme, pokud dojde k akumulaci patologického množství tekutiny v pohrudniční dutině. Toto množství není striktně definováno, proto za pleurální výpotek považujeme jakoukoli tekutinu, která se v pleurální dutině zobrazuje pomocí skiagramu hrudníku, CT hrudníku či ultrazvuku hrudníku. Přítomnost pleurálního výpotku může mít pro pacienta tři zásadní výstupy. Zaprvé, pleurální výpotek může signalizovat přítomnost jiného závažného onemocnění, např. malignity, tuberkulózy, ledvinného či srdečního selhání, systémového onemocnění. Zadruhé, pleurální výpotek se sám o sobě může stát nemocí, zejména u recidivujících výpotků či rozsáhlých pleurálních výpotků s významným vlivem na ventilaci a na hrudní hemodynamiku. A zatřetí, v případě traumatického (či vzácného spontánního) hemotoraxu je přítomnost/objevení se výpotku možným signálem ohrožení života – pleurální prostor je totiž kapacitní a pacient do něj může exsangvinovat.
Etiologie, epidemiologie a dělení pleurálních výtoků
Společným jmenovatelem vzniku pleurálních výpotků je nerovnováha mezi tvorbou a zpětnou resorpcí pleurální tekutiny. Zvýšenou produkci pleurální tekutiny umožňuje mimo jiné zvýšený hydrostatický tlak v plicním kapilárním řečišti (u srdečního selhání), zvýšená permeabilita plicních kapilár (u pneumonie), snížení intrapleurálního tlaku (atelektáza, „uvězněná plíce“) či pokles onkotického tlaku (hypalbuminemie) [1, 3]. Pokles resorpce pleurální tekutiny může být důsledkem obstrukce či obturace pleurálních lymfatik (malignity, hemotorax, purulentní infekce) [1, 3]. Za jistých okolností může též docházet k akumulaci jiné tekutiny v pleurální dutině (chylotorax, hemotorax, urinotorax) [1].
Podle stranové lokalizace rozdělujeme pleurální výpotky na jednostranné či oboustranné, podle rozsahu na malé, střední a velké (objemné). Podle biochemických charakteristik dělíme pleurální výpotky na exsudáty a transudáty [1,3].
Diferenciálně diagnosticky přítomnost oboustranného výpotku obvykle znamená extrapulmonální onemocnění (kardiální či renální selhání, cirhóza jater, hypalbuminemie, systémové onemocnění), kde se biochemicky nejčastěji jedná o transudát [4, 5]. Přítomnost objemného jednostranného výpotku je alarmující kvůli vysokému riziku přítomnosti malignity nebo pleurální infekce; biochemicky jsou tyto výpotky obvykle charakteru exsudátu [6–8].
Incidence pleurálních výpotků v České republice (ČR) se odhaduje na cca 100 tisíc případů za rok [9]. Dle dodnes nepřekonané epidemiologické práce Marela a kolektivu z 80. let 20. století jsou pěti nejčastějšími příčinami pleurálních výpotků v ČR (v sestupném pořadí): levostranné srdeční selhání, infekční (pleuritický a parapneumonický) výpotek, malignity, embolizace do plicnice a hemotorax [10]. Rozeznáváme ale dalších několik desítek možných příčin vzniku pleurálního výpotku [5, 7, 8]. Kolem 10–15 % výpotků zůstává idiopatických [7]. Podrobný seznam možných příčin vzniku pleurálního výpotku je uveden ve specializované literatuře [5, 7, 8].
Pleurální výpotky dělíme dle makroskopického vzhledu na serózní, hnisavé (zkalené až empyém hrudníku), krvavé (sangvinolentní, hemoragické, hemotorax), chylotorax a některé další [8]. Dle biochemických charakteristik rozeznáváme transudáty a exsudáty. Dělení dle etiologie diferencuje mezi cca 70 příčinami pleurálních výpotků.
Pokročilé až konečné stavy se liší dle typu pleurálního výpotku. U maligního výpotku může při rychlé akumulaci dojít k těžké restrikci a rozvoji šokového stavu nebo při chronickém průběhu k vyčerpání organismu. U parapneumonické a tuberkulózní pleuritidy může dojít ke vzniku fibrózy pleurálního prostoru – v případě fibrózy parietální pleury mluvíme o fibrokortexu a v případě fibrózy viscerální pleury vzniká uvězněná plíce („trapped lung“) [11, 12]. Obě tyto entity vedou ke značné restrikci a trvalým potížím pacienta, léčba je výhradně chirurgická (nebo symptomatická) [11]. U hemotoraxu může dojít při neadekvátní léčbě ke vzniku šokového stavu z vykrvácení [13].
Diagnostika pleurálních výpotků
Diagnostika pohrudničních výpotků má dvě roviny. Přítomnost pleurálního výpotku jako takového zjistíme pomocí některé ze zobrazovacích metod. Prvním krokem je samozřejmě „získat“ podezření na přítomnost pohrudničního výpotku dle anamnestických dat, klinického vyšetření, subjektivních i objektivních symptomů. Základní konfirmační metodou zůstává skiagram hrudníku, přičemž senzitivnější je boční projekce (díky zobrazení i menších výpotků v dorzobazálních partiích pleurální dutiny). Vyšší senzitivitu vykazují výpočetní tomografie (CT) a sonografie hrudníku, které jsou schopny zobrazit i výpotky o objemu pouhých několika desítek mililitrů [7, 14].
Druhou rovinou diagnostiky je hledání příčiny vzniku pleurálního výpotku. K etiologii pleurálního výpotku lze dospět obvykle kombinací vyšetřovacích metod, z nichž jednu – jako nezbytné minimum – tvoří zobrazovací metoda a druhou invazivní procedura k získání vzorku pleurálního výpotku či patologické pleurální tkáně.
Laboratorní metody vyšetření plurálních výpotků
Velmi důležité jsou laboratorní charakteristiky pleurálních výpotků, které mohou být pro některé nemoci poměrně specifické. V základním panelu obvykle vyšetřujeme biochemické charakteristiky, cytologii a bakteriologii výpotku.
Z biochemických vyšetření má největší význam stanovení indexů výpotek/sérum pro celkovou bílkovinu (CB) a laktát dehydrogenázu (LD) (tzv. Lightova kritéria), hodnoty indexu pod 0.5 pro CB a 0.6 pro LD svědčí pro transudát, hodnoty vyšší naopak pro exsudát [1]. Rozdělení nejčastějších příčin pleurálních výpotků dle „příslušnosti“ k transudátu či exsudátu je uvedeno v tabulkách 1a a 1b [5, 6]. U parapneumonických výpotků je kromě LD a CB důležitým ukazatelem též hodnota glukózy a pH výpotku [15]. Nízké hladiny glukózy značí její konzumpci bakteriemi a leukocyty, pH pod 7,2 je významným markerem přítomnosti komplikovaného parapneumonického výpotku [16], kde je v rámci terapie doporučena drenáž hrudníku [7]. Hladina triacylglycerolů (TAG) 1,24 mmol/l je diagnostickým kritériem chylotoraxu [7]. Vyšetření hladiny amylázy má význam u diagnostiky transdiafragmaticky indukovaných pankreatogenních pleurálních výpotků nebo u ruptury jícnu – zde má ale větší význam vyšetření hladiny izoenzymu slinné amylázy [5, 7]. Z ostatních biochemických charakteristik lze vyšetřovat celou řadu specifických parametrů, omezený klinický význam má ale jen několik z nich. Vyšetření těchto markerů je již doménou speciálních laboratoří pracovišť terciárního či univerzitního typu. U tuberkulózní pleuritidy má poměrně vysokou senzitivitu a specificitu adenosin deamináza (ADA), zvlášť izoenzym ADA-2 [7]. U maligního mezoteliomu pleury se jako pomocné vyšetření používá stanovení hladiny mezotelinu ve výpotku [17].
Table 1. a Přehled nejčastějších příčin transudátů dle 2 zdrojů [5, 6] ![a Přehled nejčastějších příčin transudátů dle 2 zdrojů [5, 6]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/3e528d7e5818e297cb7175d0f5a12e9c.png)
* podle Lighta řazeno k exsudátům
** podle Lighta řazeno jak k transudátům, tak exsudátůmTab. 1. b Přehled nejčastějších příčin transudátů podle 2 zdrojů [5, 6] ![Tab. 1. b Přehled nejčastějších příčin transudátů podle 2 zdrojů [5, 6]](https://pl-master.mdcdn.cz/media/image_pdf/cf3f161836a7a8c62014889c96e2fd25.png?version=1563967558)
Hematologické vyšetření má význam u podezření na hemotorax, kdy za jeho diagnostické kritérium považujeme hodnotu indexu hematokritu výpotek/periferní krev větší než 0,5 [13].
Kultivační vyšetření výpotku má význam především u výpotků infekční etiologie, kdy umožňuje lépe vymezit léčebnou strategii a volbu cílené antibiotické léčby. Tento význam dále stoupá u nozokomiálních infekcí pleurální dutiny, které jsou často způsobené oportunními patogeny s různou měrou antimikrobiální rezistence. U výpotků infekční etiologie rozeznáváme několik stadií/stupňů infekce, které jsou charakterizovány barvou výpotku, mírou neutrofilní buněčnosti, obsahem LD a také pH výpotku. Infekční výpotky nutno vnímat jako vývojové kontinuum, na jehož jednom pólu stojí prostý čirý serózní výpotek charakteru exsudátu (podle Lightových kritérií) a na druhém konci stojí na makroskopický pohled purulentní a páchnoucí empyém hrudníku (tab. 2) [7,16]. Od míry pokročilosti procesu exsudace pak závisí i volba adekvátní léčebné modality.
Table 2. Přehled charakteristik pleurálních výpotků u 3 základních stupňů infekční pleuritidy. Modifikováno podle Lighta a Rahmana [7, 15, 16] ![Přehled charakteristik pleurálních výpotků u 3 základních stupňů infekční pleuritidy. Modifikováno podle Lighta a Rahmana [7, 15, 16]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/dcac3b7f6b70003a2df124552df4a41d.png)
Cytologické vyšetření výpotku má význam především z hlediska vyloučení či potvrzení malignity (primární či sekundární), ale konfirmační charakter má také u výpotků infekčního typu. Vzácnější formy zmnožené buněčnosti představují výpotky s lymfocytární predominancí a výpotky s převahou eozinofilů. Přehled možných příčin lymfocytárních a eozinofilních typů výpotků je uveden v tabulce 3 [7]. Flowcytometrii výpotku můžeme použít při podezření na lymfoproliferativní onemocnění. U většiny pacientů je přínosem kombinovat výsledky vyšetření výpotku několika modalitami, samozřejmě i s klinickými daty, což umožňuje komplexnější pohled na patofyziologii procesu. Například, v regionech světa s vysokou incidencí a prevalencí tuberkulózy (např. jihovýchodní Asie, jižní Afrika) znamená výskyt unilaterálního lymfocytárně predominantního výpotku s pozitivitou ADA téměř jistou diagnózu TBC pleuritidy (s pozitivní prediktivní hodnotou až 98 %) [18].
Table 3. Přehled nejčastějších příčin pleurálního výpotku dle cytologického charakteru – lymfocytární a eozinofilní výpotky [7] ![Přehled nejčastějších příčin pleurálního výpotku dle cytologického
charakteru – lymfocytární a eozinofilní výpotky [7]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b1499bb833e9195af3cbc25e55604638.png)
Role zobrazovacích metod v diagnostice pleurálních výpotků
Jak bylo uvedeno výše, základní zobrazovací metodou z hlediska čas/cena/dostupnost a zkušenost s metodou má zadopřední skiagram hrudníku. Tímto vyšetřením detekujeme výpotky od objemu cca 200 ml [7]. Senzitivnější metodou je boční skiagram hrudníku, který může zobrazit výpotky objemu již od cca 50 ml [7]. Nejcitlivějšími metodami jsou CT a sonografie hrudníku s možností detekce výpotku o objemu několika málo desítek mililitrů, přičemž je ale nutno pamatovat na limitace obou metod. U sonografie se jedná o dostupnost metody, erudici a zkušenost vyšetřujícího lékaře a také fakt, že jakákoli přítomnost vzduchu v pleurální dutině (např. u fluidopneumotoraxu) výrazně znehodnocuje vyšetřitelnost pleurální dutiny. Další nevýhodou je, že díky fyzikálním vlastnostem ultrazvuku nelze prohlédnout hlubší vrstvy plicní tkáně; efektivně dokážeme vyšetřit víceméně pouze hrudní stěnu a vlastní pleurální dutinu. Výhodou CT vyšetření je zobrazení všech intratorakálních struktur, což u maligních afekcí představuje i jednu součást v rámci stagingu onemocnění. Klasickou nevýhodou CT vyšetření je radiační zátěž. Využití ostatních metod je spíše okrajové a má své specifické indikace (pozitronová emisní tomografie/CT či pozitronová emisní tomografie/magnetická rezonance). Výhodným rysem sonografie je možnost zobrazení tenkých sept v časné fázi exsudace u výpotků infekčního typu (ale též maligních výpotků), která nemusí být patrná jinými zobrazovacími metodami (skiagrafií ani CT) [3, 19]. Tenká (nezralá) septa jsou tvořena převážně vysráženým fibrinem a jsou terapeuticky dobře ovlivnitelná drenáží hrudníku a intrapleurálním podáním fibrinolytik a alteplázy [20]. Důsledkem inadekvátní léčby septovaných výpotků může být vznik fibrotoraxu nebo uvězněné plíce (tzv. trapped lung), jež pokládáme za pozdní a poměrně závažné komplikace exsudativních pleurálních procesů [11, 12]. Tyto komplikace lze předvídat i za pomocí zobrazovacích technik [21].
Invazivní diagnostické procedury
Pleurální punkce se provádí v lokální anestezii naslepo, resp. dle charakteru RTG nálezu, ideálně však pod sonografickou kontrolou, pomocí které lze nejen odlišit stavy, které dle RTG hrudníku mohou imitovat přítomnost výpotku (např. atelektáza), nýbrž umožňují i bezpečnou navigaci před pleurální punkcí nalezením nejvhodnějšího místa k punkci (největší akumulace tekutiny) a lokalizací podbráničních struktur (játra, slezina). Výkon se provádí z diagnostických i terapeutických indikací.
Biopsie pleury (necílená či cílená se sonografickou navigací) má význam v diagnostice maligních a tuberkulózních výpotků. Senzitivita této metody v kombinaci se speciální kultivací na Mycobacterium tuberculosis se blíží 80 procentům [22].
Pleuroskopie (synonymum medicínská torakoskopie) je invazivní metoda prováděná v lokální anestezii nebo analgosedaci. První pleuroskopie byla provedena již v roce 1910 švédským internistou Hansem Christianem Jacobaeusem, posléze byla metoda opuštěna a od 90. let 20. století nastává její renesance [3, 23, 24]. Metoda je nyní rozšířená hlavně v zemích západní Evropy, postupně ale získává pozici i v České republice. Na Klinice nemocí plicních a TBC LF MU a FN Brno byla metoda zavedena v květnu 2017. Pleuroskopie umožňuje vizualizaci pleurálního prostoru, odběr kvalitních a mnohočetných bioptických vzorků, rozrušení sept, kompletní evakuaci výpotku a zavedení talkáže pleurální dutiny [25]. Diagnostická výtěžnost pleuroskopie pro TBC pleuritidu je udávána 94 až 98% [25].
Skiagramy hrudníku před výkonem, po pleuroskopii s provedenou talkáží a pleuroskopický obraz pacienta s lymfomem pleury jsou prezentovány jako obr.1–3 (z vlastního archivu autora).
Image 1. Skiagram hrudníku pacienta s rozsáhlým pravostranným pleurálním výpotkem. Je patrný posun mediastinálních struktur doleva tlakem tekutinové kolekce. Základní diagnózou byl lymfom pleury, histologická diagnóza byla získána biopticky při pleuroskopii. Během výkonu bylo evakuováno 5000 ml hemoragického výpotku. 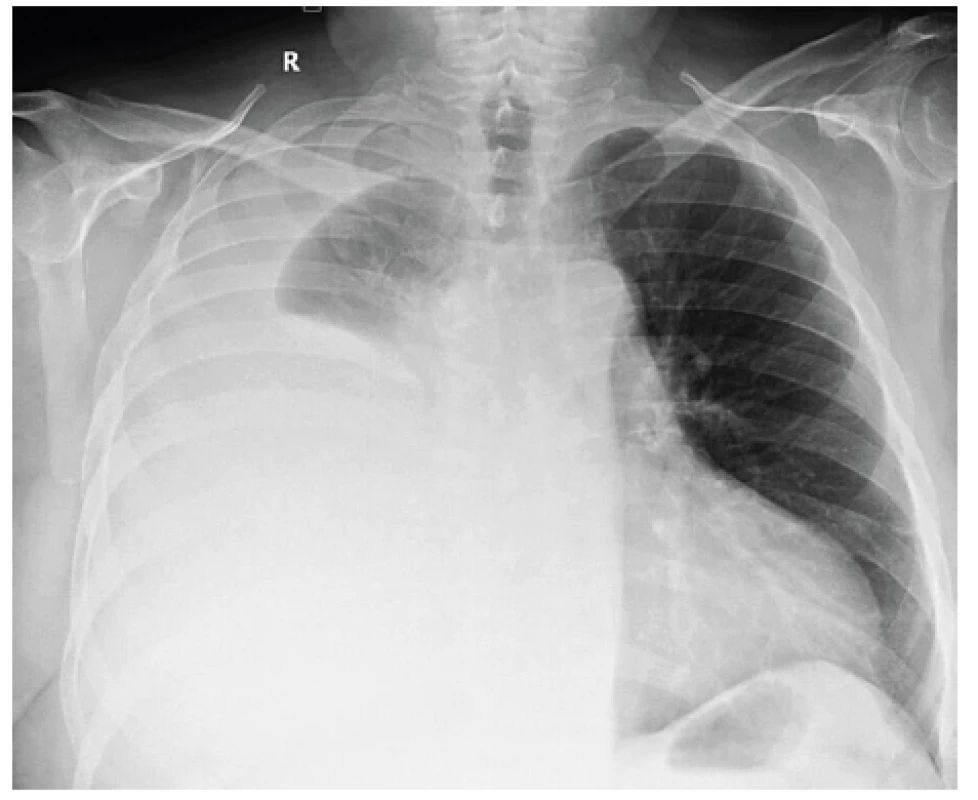
Image 2. Skiagram hrudníku stejného pacienta vleže po evakuaci 5000 ml výpotku a po provedení pleuroskopické talkáže pravostranné pleurální dutiny 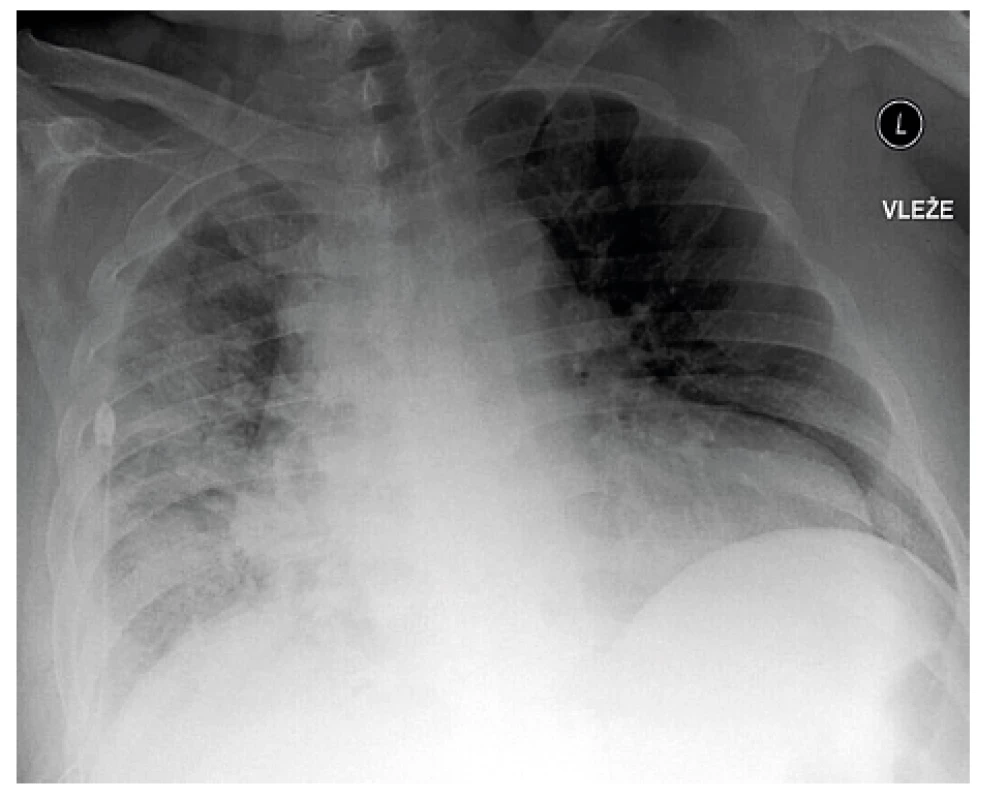
Image 3. Pleuroskopický obraz stejného pacienta zobrazující masivní postižení parietální pleury nodulárním procesem, v tomto případě lymfomem pleury. Patrny bioptické kleště při odběru vzorku na histologické vyšetření. 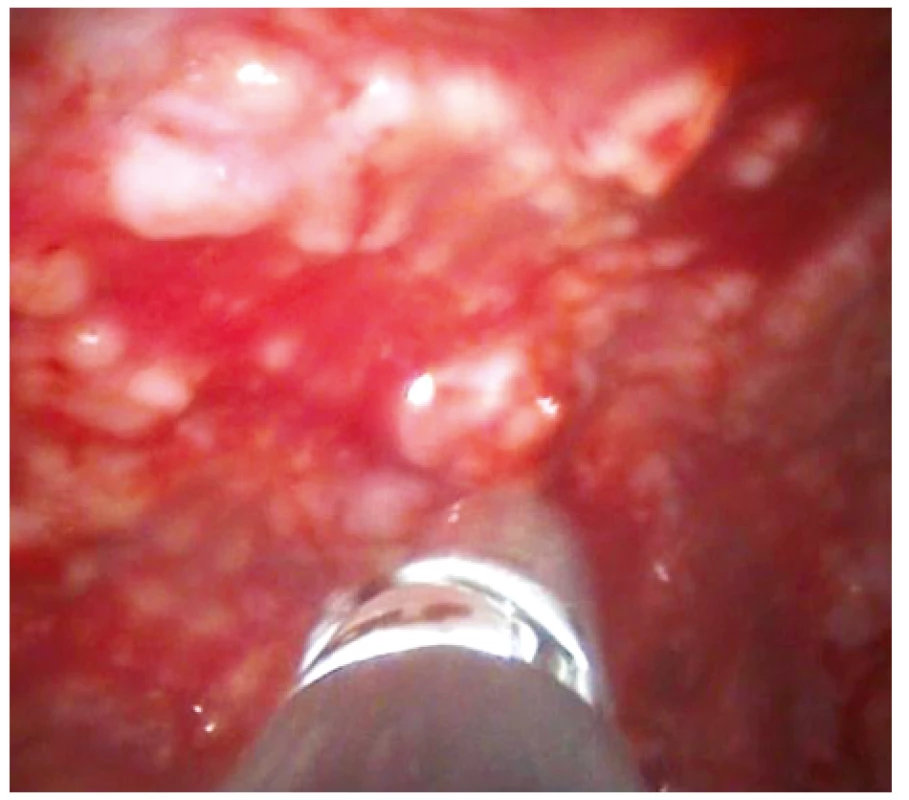
Chirurgické metody zahrnují videoasistovanou torakoskopii (VATS), minitorakotomii a klasickou otevřenou torakotomii, v případě souběhu přítomnosti mediastinálního infiltrátu a pleurálního výpotku zvažovat mediastinoskopii [3].
Terapie pleurálních výpotků
Pokud je to možné, snažíme se o kauzální léčbu pohrudničních výpotků. Pro některé typy je kauzální léčba v širším slova smyslu možná (např. parapneumonické výpotky, hemotoraxy, výpotky komplikující embolizaci do plicnice, některé typy transudátů a další), pro jiné volíme léčbu základního onemocnění se sekundárním vlivem na pleurální výpotek (např. srdeční selhání, hypalbuminemie u renálních nemocí či jaterního selhání a další), mnohdy jsou ale terapeutické metody symptomatického či vysloveně paliativního charakteru (např. maligní/paramaligní výpotky, netraumatické chylotoraxy a další).
Volba léčebné metody se odvíjí od konkrétní diagnózy, proto je – v ideálním případě – naší snahou co nejpřesnější stanovení etiologie pohrudničního výpotku. Speciální metody léčby – zejména u recidivujících maligních/paramaligních výpotků a idiopatických výpotků – zahrnují pleurální punkci (torakocentézu), drenáž hrudníku, farmakologickou a nefarmakologickou pleurodézu, zavedení tunelizovaného hrudního drénu a chirurgickou léčbu. Léčebná strategie kromě konkrétní diagnózy reflektuje i celkový stav pacienta, jeho dlouhodobou prognózu a obecně možnosti pečujícího zdravotnického zařízení. U drenáže hrudníku nutno zmínit, že dle studií terapeutický úspěch nezáleží na kalibru použitého drénu [26] s výjimkou hemotoraxu, kde je při potvrzení indikováno urgentní zavedení hrudního drénu silného kalibru [13]. Novinkou je používání tunelizovaného pleurálního drénu (katétru) hlavně z indikace recidivujících maligních výpotků a v šetrnější léčbě „trapped lung“ (ve srovnání s chirurgickou léčbou) [27]. V tabulce 4 jsou uvedeny léčebné možnosti pěti nejčastějších klinických typů pleurálních výpotků [1, 3, 4, 7, 13, 15, 20, 27, 28]. Obdobně jako v jiných oborech medicíny i u pleurálních výpotků je obecně naší snahou řešit problém co nejméně invazivními metodami, pokud ale tyto selhávají, přistupujeme k pokročilejším terapeutickým procedurám. V tabulce 5 je uveden základní přehled dostupnosti speciálních léčebných metod na pneumologických pracovištích v České republice.
Table 4. Přehled léčebných modalit pěti nejčastějších klinických typů pleurálních výpotků [1, 3, 4, 7, 13, 15, 20, 27, 28]. Invazivnější metody jsou v tabulce řazeny sestupně. ![Přehled léčebných modalit pěti nejčastějších klinických typů pleurálních výpotků [1, 3, 4, 7, 13, 15, 20, 27, 28]. Invazivnější metody jsou v tabulce
řazeny sestupně.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/e309c104e79783f57169c983a951959d.png)
Table 5. Přehled dostupnosti speciálních léčebných metod v léčbě pleurálních výpotků v ČR 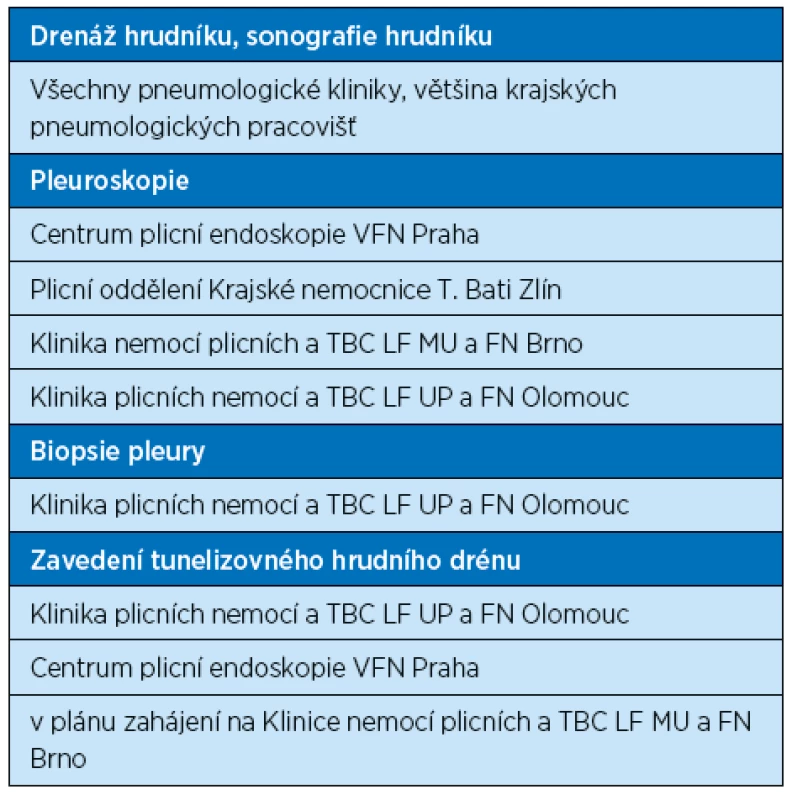
Konkrétní epidemiologická data pro incidenci jednotlivých pleurálních výpotků neexistují. Pleurální výpotky jsou nicméně onemocněním spíše staršího věku, a to jak pro maligní [29], tak pro non-maligní typy pleurálních výpotků [30]. Lze tak usuzovat, že v geriatrickém věku je distribuce nejčastějších typů výpotků obdobná jako obecně populaci – nejčastějším typem je jistě kardiogenní výpotek, velmi frekventní jsou také výpotky provázející malignity, parapneumonické a pleuritické výpotky. S ohledem na výskyt rizik v geriatrické populaci se můžeme potkat i s výpotky provázejícími embolizaci do plicnice či hemotoraxy – při vyšší prevalenci užívání antikoagulancií a dalších hemoaktivních léků a zvýšeném riziku pádů a úrazů provázejícím starší věk.
Závěr
„Pleurologie“ jako jeden z mnoha směrů pneumologie je velmi zajímavou profesní zájmovou oblastí. Diferenciální diagnostika plurálních nemocí je někdy velmi složitá a u minoritního podílu pacientů se i přes pečlivou diagnostiku příčinu výpotku nepodaří odhalit. Používání speciálních diagnostických a terapeutických procedur (sonografie hrudníku, drenáž hrudníku, pleuroskopie, zavedení tunelizovaného hrudního drénu, talkáž pleurální dutiny) vyžaduje manuální zručnost, významné klinické zkušenosti a dobrou erudici ošetřujícího personálu.
MUDr. Kristián Brat, Ph.D.
e-mail: kristian.brat@fnbrno.cz
Pracuje na Klinice nemocí plicních a TBC LF MU a FN Brno. Od roku 2017 působil jako vedoucí lékař JIP KNPT FN Brno, v roce 2018 byl jmenován přednostou KNPT LF MU a FN Brno. V roce 2018 obhájil doktorát na LF MU v oboru Vnitřní nemoci; název disertační práce: „Vliv pobytu v polárních podmínkách na lidský organizmus“. Profesně se věnuje především problematice pleurálních nemocí, pneumotoraxu, CHOPN, intenzivní pneumologické péče a vlivu extrémních podmínek na lidský organismus. Je autorem řady publikací v zahraničních i domácích periodicích a řešitelem řady výzkumných témat.
Sources
1. Light RW. Pleural effusion. N Engl J Med 2002; 346(25): 1971–1977.
2. Broaddus VC. Physiology: fluid and solute exchange in normal physiological states. In: Light RW, Lee GYC. Textbook of Pleural Diseases, 2nd ed. London: Hodder et Stoughton Ltd 2008 : 43–47.
3. Brat K, Čundrle I, Jr. Diagnostika a léčba septovaných pleurálních výpotků. Stud Pneumol Phthiseol 2017; 77(4): 160–168.
4. Davies HE, Davies RJ, Davies CW. BTS Pleural Disease Guideline Group: Management of pleural infection in adults: British Thoracic Society Pleural Disease Guideline 2010. Thorax 2010; 65 Suppl 2 : 41–53.
5. Sahn AS, Heffner JE. Pleural fluid analysis. In: Light RW, Lee GYC. Textbook of Pleural Diseases, 2nd ed. London: Hodder et Stoughton Ltd 2008 : 209–223.
6. Hooper C, LeeYC, Maskell N. BTS Pleural Guideline Group: Investigation of a unilateral pleural effusion in adults: British Thoracic Society Pleural Disease Guideline 2010. Thorax 2010; 65 Suppl 2 : 4–17.
7. Rahman NM, Chapman SJ, Davies RJ. Pleural effusion: a structured approach to care. Br Med Bull 2004; 72 : 31–47.
8. Marel M, Fila L, Červená M. Diferenciální diagnostika pleurálních výpotků. Vnitř Lék 2016; 62(7–8): 598–604.
9. Koblížek V. Pleurální výpotek. In: Kolek V, Kašák V, Vašáková M, eds. Pneumologie. 2nd ed. Praha: Maxdorf 2014 : 350–356.
10. Marel M, Stastny B, Melinova L, et al. Diagnosis of pleural effusions. Experience with clinical studies, 1986 to 1990. Chest 1995; 107(6): 1598–1603.
11. Huggins JT, Sahn SA. Causes and management of pleural fibrosis. Respirology. 2004 9 : 441–447.
12. Alemán C, Alegre J, Monasterio J, et al. Association between inflammatory mediators and the fibrinolysis system in infectious pleural effusions. Clin Sci (Lond) 2003; 105 : 601–607.
13. Boersma WG, Stigt JA, Smith J. Treatment of haemothorax. Respir Med 2010; 104 : 1583–1587.
14. Kurian J, Levin TL, Han BK, et al. Comparison of ultrasound and CT in the evaluation of pneumonia complicated by parapneumonic effusion in children. AJR Am J Roentgenol 2009; 193(6): 1648–1654.
15. Light RW. Parapneumonic effusions and empyema. Proc Am Thorac Soc 2006; 3(1): 75–80.
16. Light RW. A new classification of parapneumonic effusions and empyema. Chest 1995; 108(2): 299–301.
17. Jakubec P, Pelclova D, Smolkova P, et al. Significance of serum mesothelin in an asbestos-exposed population in the Czech Republic. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2015; 159(3): 472–479.
18. Shaw JA, Irusen EM, Diacon AH, Koegelenberg CF. Pleural tuberculosis: A concise clinical review. Clin Respir J 2018; 12(5): 1779–1786.
19. Esmadi M, Lone N, Ahmad DS, et al. Multiloculated pleural effusion detected by ultrasound only in a critically-ill patient. Am J Case Rep 2013; 14 : 63–66.
20. Thommi G, Shehan JC, Robison KL, et al. A double blind randomized cross over trial comparing rate of decortication and efficacy of intrapleural instillation of alteplase vs placebo in patients with empyemas and complicated parapneumonic effusions. Respir Med 2012; 106 : 716–723.
21. Lai YF, Su MC, Weng HH, et al. Sonographic septation: a predictor of sequelae of tuberculous pleurisy after treatment. Thorax 2009; 64(9): 806–809.
22. Epstein DM, Kline LR, Albelda SM, Miller WT. Tuberculous pleural effusions. Chest 1987; 91(1): 106–109.
23. Tassi GR, Marchetti GP. Pleural disease: historic perspective. In: Light RW, Lee GYC. Textbook of Pleural Diseases, 2nd ed. London: Hodder et Stoughton Ltd 2008 : 1–13.
24. Votruba J, Šimovič J, Košatová K. Klinická pleuroskopie. Stud Pneumol Phthiseol 2009; 69(6): 212–215.
25. Lee P. Thoracoscopy. In: Herth FJF, Shah PL, Gompelmann D, eds. Interventional Pulmonology (ERS Monograph). Sheffield, European Respiratory Society 2017 : 176–190.
26. Rahman NM, Maskell NA, Davies CW, et al. The relationship between chest tube size and clinical outcome in pleural infection. Chest 2010; 137(3): 536–543.
27. Votruba J, Zemanová P, Bartáková H, Šimovič J. Tunelizovaný pleurální katétr – nová možnost paliace pleurálních výpotků. Stud Pneumol Phthiseol 2016; 76(1): 26–29.
28. Kastelik JA. Management of malignant pleural effusion. Lung 2013; 191(2): 165–175.
29. Saha, K, Maikap, MK, Maji, et al. Demographic, clinical, biochemical, radiological and etiological characteristics of malignant pleural effusions from Eastern India. Indian J Cancer 2017; 54(1): 257–261.
30. Walker SP, Morley AJ, Stadon L, et al. Nonmalignant pleural effusions: a prospective study of 356 consecutive unselected patients. Chest 2017; 151(5): 1099–1105.
Labels
Geriatrics General practitioner for adults Orthopaedic prosthetics
Article was published inGeriatrics and Gerontology

2018 Issue 4-
All articles in this issue
- Zhodnocení rizika malnutrice u seniorů– používáme správný screeningový nástroj?
- Plicní embolie ve stáří – představuje diabetes mellitus riziko?
- Edukuje lékař seniora dostatečně o ovlivnitelných rizicích kardiovaskulárních onemocnění?
- Stárnutí staré společnosti (seniorizace) a geriatrizace medicíny
- Pleurální výpotky – přehled současných znalostí
- Vertebrogenní algický syndrom ve stáří
- Farmakologická podpora kloubní chrupavky
- Dyspepsie jako první příznak Addisonovy choroby u geriatrické pacientky
- Akutní intoxikace lithiem u geriatrické pacientky
- Moje stáří: projekt prevence kardiovaskulárního rizika a demence
- Geriatrics and Gerontology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vertebrogenní algický syndrom ve stáří
- Akutní intoxikace lithiem u geriatrické pacientky
- Pleurální výpotky – přehled současných znalostí
- Zhodnocení rizika malnutrice u seniorů– používáme správný screeningový nástroj?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

