-
Medical journals
- Career
Hluboká žilní trombóza a její léčba v otázkách a odpovědích
Authors: M. Berková; Z. Berka; E. Topinková
Published in: Geriatrie a Gerontologie 2016, 5, č. 1: 19-27
Category: Review Article
Overview
Hluboká žilní trombóza (HŽT) postihuje 1–2 osoby/1000 obyvatel za rok. U osob v seniorském věku je 10x častější než u mladých do 30 let věku. Hlubokou žilní trombózou jsou nejčastěji postiženy distální partie hlubokého žilního systému (lýtka a podkolení). Diagnostickou metodou HŽT první volby zůstává ultrazvukové vyšetření. Farmakologická terapie HŽT se opírá o antikoagulační terapii: heparin, nízkomolekulární hepariny, pentasacharidy (t. č. nedostupné v ČR v léčebné dávce); pro chronickou léčbu jsou dostupné warfarin a nová perorální antikoagulancia. Léky hirudinového typu a argatroban zůstávají vymezeny pro specifické stavy – např. heparinem indukovanou trombocytopenii typu II (HIT II). V indikovaných případech hluboké žilní trombózy se využívá intervenční léčba (lokální trombolýza, endovaskulární výkony se speciálními katétry k fragmentaci a aspiraci trombů či implantaci stentů). V léčbě HŽT jsou nezbytná nefarmakologická opatření – u hemodynamicky stabilních pacientů časná mobilizace pacienta ihned po odeznění bolestí, bandáže, kompresivní punčochy, u nemocných upoutaných na lůžko plantární flexe. Při léčbě warfarinem nedoporučujeme tzv. „warfarinovou dietu“, ale potravu s konstantním složením živin. Délka farmakoterapie se odvíjí od etiologie onemocnění – při sekundární HŽT léčíme nejméně 3 měsíce, při idiopatické alespoň 6 měsíců a u pacientů s přetrvávajícím protrombotickým stavem, a zejména opakovanými HŽT trvale. Přes účinnou antikoagulační terapii se vyvíjí, především po proximální HŽT, chronický posttrombotický syndrom až u 50 % pacientů. Specifickou problematiku představuje HIT II, vyvolaná protilátkami proti komplexu heparinu s destičkovým faktorem 4, které se tvoří od 4. dne podávání heparinu a vedou k závažným intravaskulárním trombózám. Vyskytuje se u 1–3 % pacientů léčených nefrakcionovaným heparinem a méně než u 0,1 % osob léčených nízkomolekulárními hepariny. Příznačný je pokles trombocytů nejméně o 30 %. Proto jsou při podávání heparinu nutné kontroly počtu trombocytů 4. až 14. den (prováděné obden). Idiopatická flebotrombóza může být prvním projevem skryté malignity až u téměř 10 % starších osob. Při pátrání po malignitě při neprovokované HŽT se zaměříme na důkladně odebranou anamnézu, fyzikální vyšetření, základní hematologické a biochemické vyšetření a rtg hrudníku. Další vyšetření urogenitálu a koloskopie jsou již součástí doporučených preventivních vyšetření po dosažení stanovené věkové hranice a doporučíme je, pokud je pacient již neabsolvoval v rámci prevence nebo pokud je suspekce na maligní onemocnění na základě výsledků základních vyšetření. K nejčastěji neodhaleným malignitám patří leukemie, tumory urogenitálu a gastrointestinálního traktu.
KLÍČOVÁ SLOVA:
hluboká žilní trombóza – diagnostika – léčba – vyšší věkÚvod
Hluboká žilní trombóza (HŽT) patří k relativně častým onemocněním; incidence se odhaduje na 1–2 případy na 1000 obyvatel za rok. U osob v seniorském věku je 10x častější než u mladých do 30 let věku(1, 2). S rizikem tromboembolie se setkáváme téměř denně v ambulancích a na lůžkových odděleních u závažně interně nemocných pacientů, i po traumatech nebo operacích. Hluboká žilní trombóza (HŽT) a tromboembolická nemoc (TEN) zůstávají obávané pro svůj leckdy zákeřně skrytý průběh, jehož prvním projevem může být náhlá a neočekávaná smrt pacienta(3). Proto je tomuto onemocnění neustále věnována velká pozornost, která ještě vzrostla po zavedení nových perorálních antikoagulancií do praxe. V roce 2014 byl zveřejněn nový doporučený postup v prevenci, diagnostice a léčbě akutní žilní trombózy České angiologické společnosti ČLS JEP, který se detailně zabývá všemi aspekty této choroby. Přesto se v praxi stále setkáváme s problémy, které diagnostika a léčba této choroby přináší vzhledem k variabilitě a časté klinické nenápadnosti flebotrombózy, takže zdroj tromboembolie zůstává neodhalen. Následující text ve formě otázek a odpovědí se zaměřuje na časté klinické dotazy zaměřené na diagnostiku a léčbu HŽT.
OTÁZKY A ODPOVĚDI
V jaké lokalizaci je výskyt HŽT nejčastější?
Hlubokou žilní trombózou jsou nejčastěji postiženy distální partie hlubokého žilního systému dolních končetin, čím distálnější část venózního řečiště, tím je výskyt flebotrombózy častější(4, 5). Výskyt hluboké žilní trombózy podle lokalizace uvádí tabulka 1. V případě povrchové žilní trombózy je nejčastěji postižena v. saphena magna a její větve (60–80 %) a v. saphena parva (10–20 %).
Table 1. Hluboká žilní trombóza podle lokalizace(4, 5) 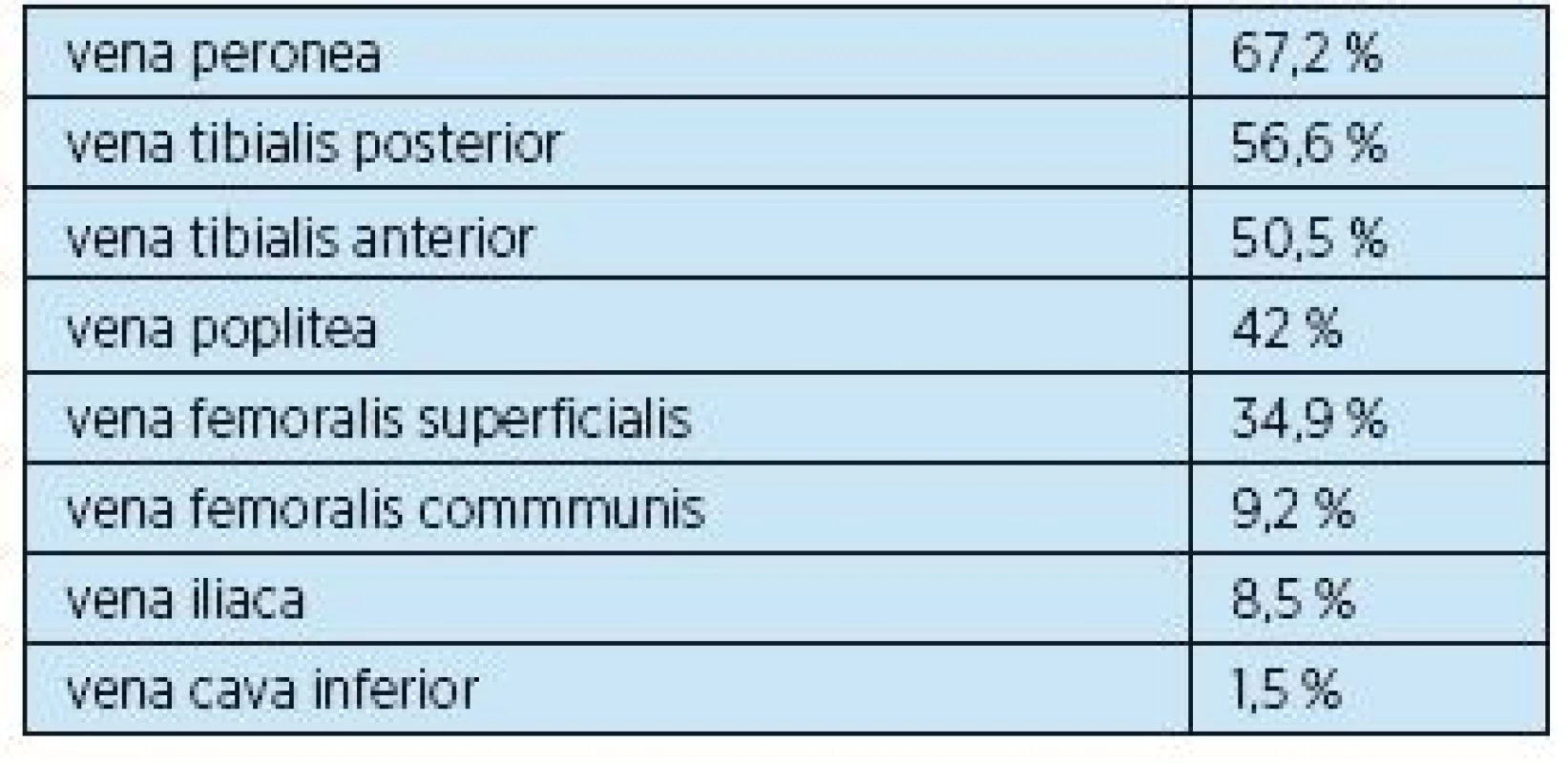
Proč je flebotrombózou častěji postižena levostranná končetina?
Levostranné postižení je o 30 % častější než postižení pravostranného žilního systému. Stranový rozdíl ve prospěch levostranné HŽT se týká především postižení proximálního žilního systému nad inquinou, kde trombóza postihuje pánevní část řečiště s anatomickým křížením cévních svazků (pravá a. iliaca comm. kříží a utlačuje levou v. iliaca comm.), zatímco pokud flebotrombóza postihuje žilní řečiště jen distálně, stranový rozdíl v prevalenci HŽT není tak markantní(4). Etiologii hluboké žilní trombózy dolních končetin shrnuje tabulka 2.
Table 2. Příčiny HŽT dolních končetin 
Jak častá je flebotrombóza na horních končetinách?
Flebotrombóza na horních končetinách je nepoměrně méně častá, představuje 2 % všech flebotrombóz . Nejčastěji je postižena a. axillaris, méně často distální oblast žilního řečiště horních končetin. Její nejčastější vyvolávající faktory jsou shrnuty v tabulce 3.
Table 3. Etiologie flebotrombózy horních končetin 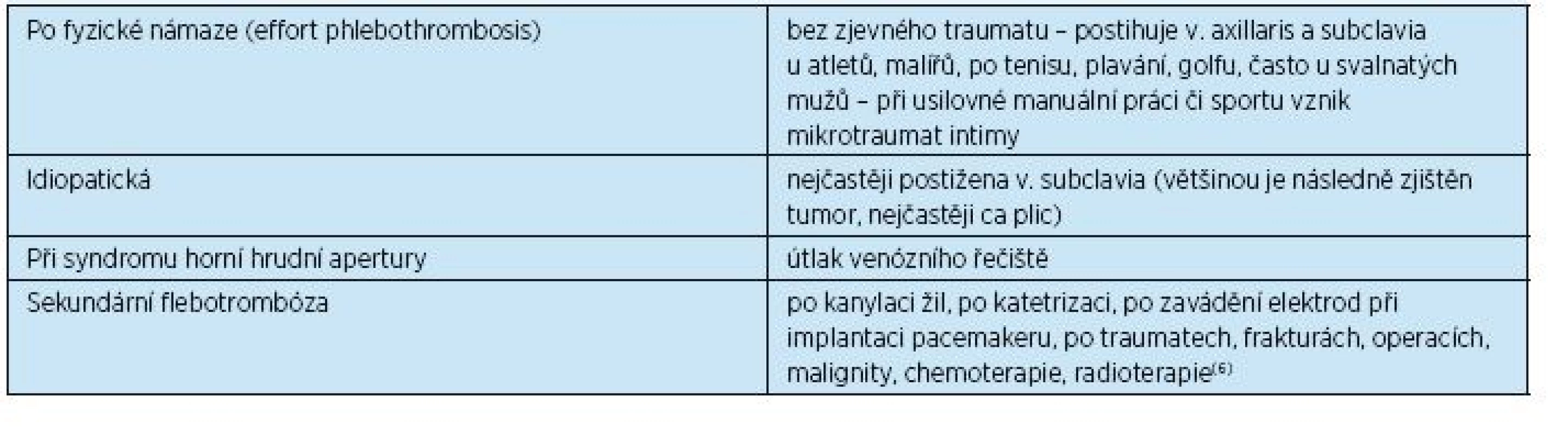
Ke vzniku trombózy predisponují trombofilní stavy. Na které se zaměřit a kdy provádět vyšetření na trombofilii?
Laboratorně prokazatelné trombofilní stavy mohou být vrozené i získané. Pacienti s vrozeným významným trombofilním stavem obvykle prodělají flebotrombózu, někdy i opakovaně, ještě mnohem dříve než dosáhnou seniorského věku, proto se setkáváme se seniory, u nichž byla trombofilie již dříve prokázána. Někdy se však jedná o trombofilii získanou v pozdějším věku (např. antifosfolipidový syndrom). Přehled trombofilních stavů a indikace k vyšetření na trombofilii ukazují tabulky 4 a 5.
Table 4. Laboratorně prokazatelné trombofilní stavy 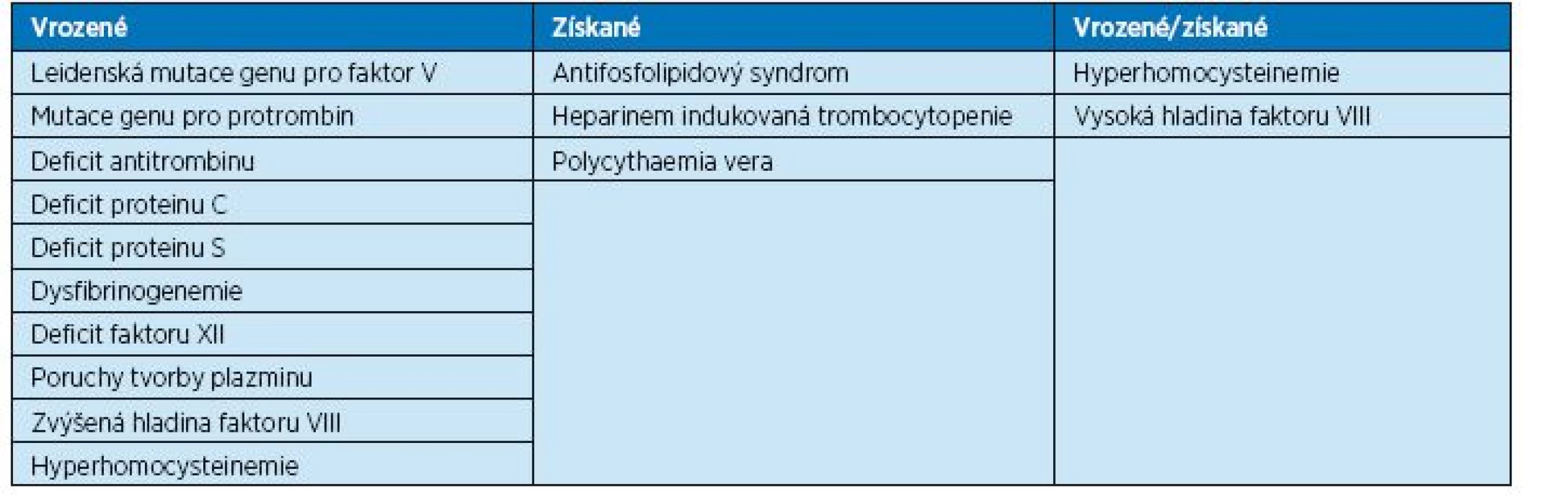
Table 5. Indikace k vyšetření na trombofilii 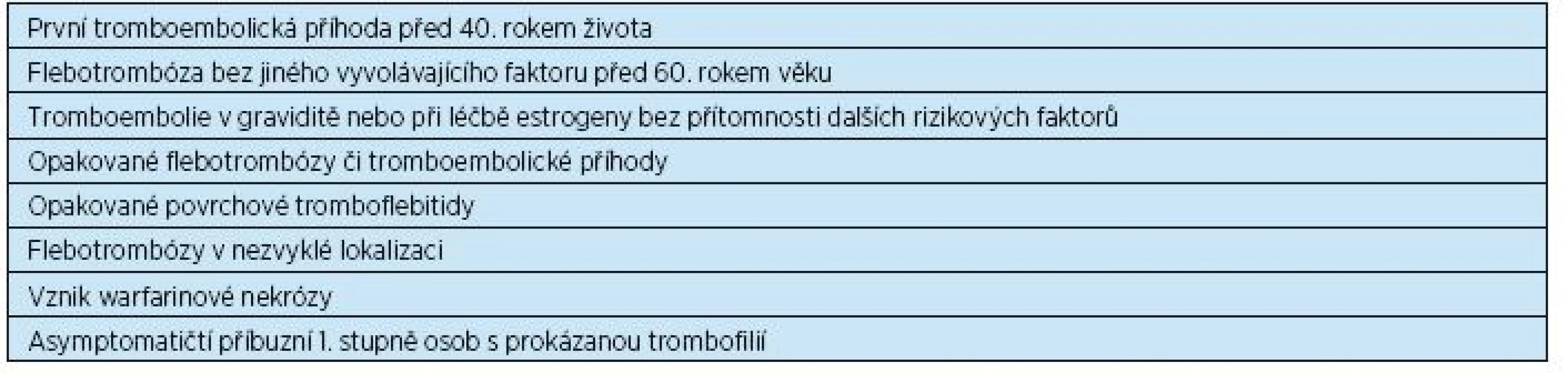
Jak postupovat v diagnostice HŽT?
Diagnostika HŽT stojí na 3 důležitých pilířích:
- 1. Anamnéza a fyzikální vyšetření. V anamnéze pátráme po rizikových faktorech. Klinicky na vznik flebotrombózy upozorní subjektivní obtíže pacienta (tlak, bolest v lýtku při došlápnutí); imobilní dlouhodobě ležící pacienti však často vznik flebotrombózy nevnímají nebo nesignalizují. Fyzikálně je typický otok se zvětšením obvodu končetiny, dilatace podkožních žil a v pokročilých případech i barevné kožní změny (phlegmasia coerulea dolens, phlegmasia coerulea alba). Často jsou však fyzikální příznaky málo zřetelné, a proto je nutno vždy diagnózu ověřit pomocným vyšetřením.
- 2. Pomocné vyšetřovací metody. Zcela zásadní roli hraje duplexní ultrasonografie (UZ). Metodou druhé volby je magnetická rezonance/magnetická rezonanční venografie, která prakticky nahradila kontrastní flebografii(7,8). Nevýhodou magnetické rezonance je přístrojová a cenová náročnost.
- 3. D-dimery. Negativní D-dimery mají vysokou negativní prediktivní hodnotu (prakticky vylučují hlubokou žilní trombózu), patologicky zvýšené hodnoty jsou však nejen u HŽT a TEN, ale také u mnoha dalších chorob (záněty, tumory, operace, traumata, gravidita).
Jak odlišíme starou trombózu od čerstvé a jak určíme stáří trombu v žilním systému?
Na to nám odpoví ultrazvukové vyšetření. Pokud je žilní tok nepřítomen a žíla nekompresibilní, je to známka flebotrombózy. Pokud je trombus nezobrazitelný, tj. anechogenní, jedná se o čerstvý trombus, pokud je echogenní, jedná se již o trombus organizovaný (větší množství fibrinu) v subakutní či chronické fázi trombózy.
Jaké jsou současné terapeutické přístupy u hluboké žilní trombózy a tromboembolismu?
Současné léčebné možnosti hluboké žilní trombózy a tromboembolismu shrnuje tabulka 6. V léčbě tromboembolické nemoci se objevila řada nových farmak, z nichž velká část je dostupná i v ČR, a další jsou ve fázi výzkumu. Působení jednotlivých skupin antitrombotik na různých úrovních koagulačního systému a jednotlivé zástupce antikoagulancií uvádí graf 1 a tabulky 7 a 8.
Graph 1. Koagulační systém a působení jednotlivých skupin antitrombotik na různých úrovních systému 
Table 6. Léčba hluboké žilní trombózy a tromboembolismu 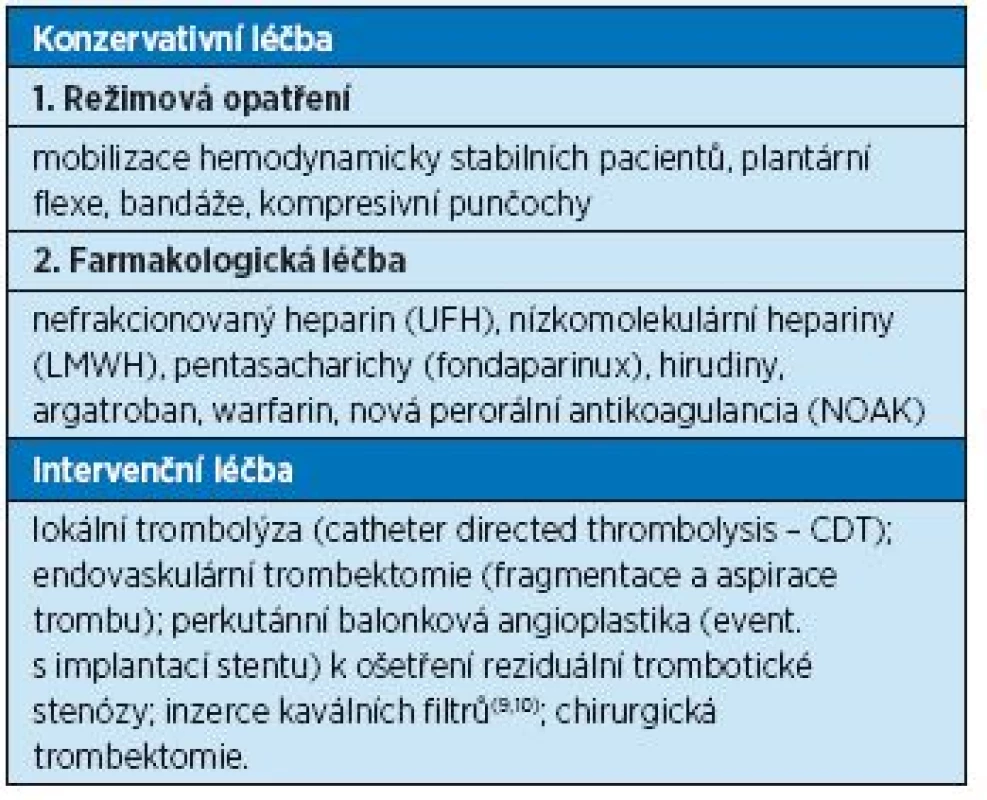
Table 7. Rozdělení antikoagulancií 
Table 8. Zástupci jednotlivých skupin antikoagulancií 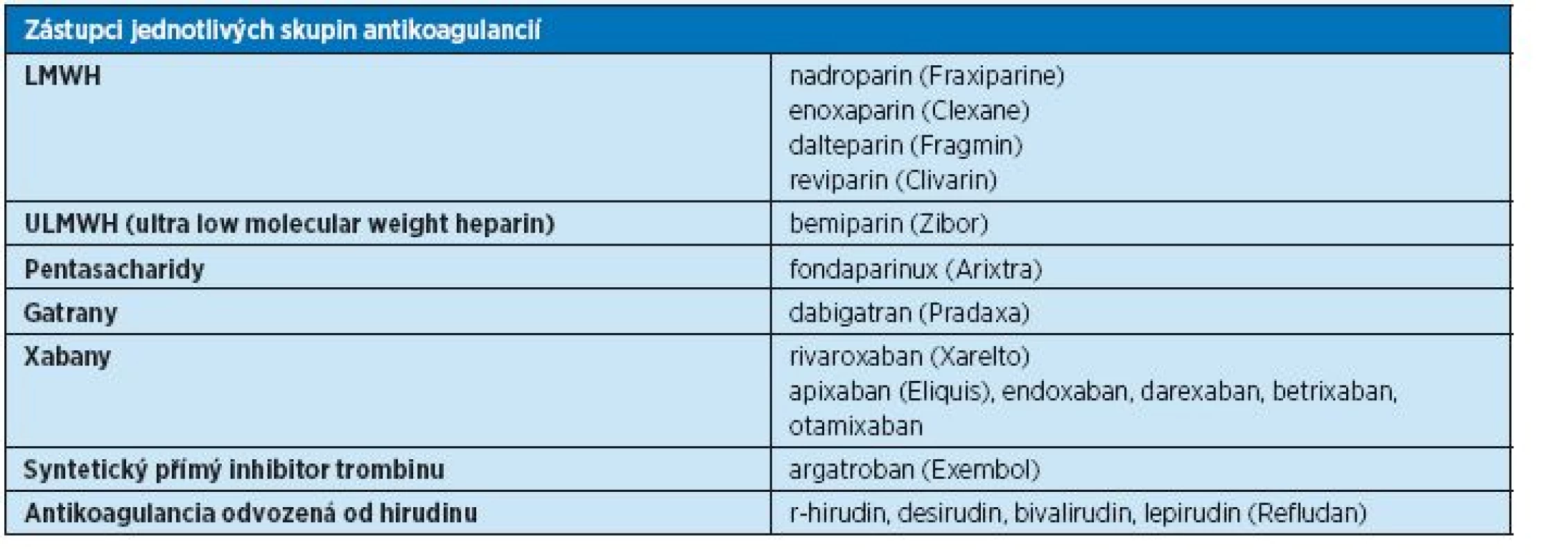
Přestože se v klinické praxi již běžně setkáváme s novými perorálními antikoagulancii (gatrany a xabany), zůstávají zatím pořád nejčastějšími léky v léčbě HŽT nízkomolekulární hepariny a warfarin.
Nízkomolekulární hepariny vytlačily svými výhodnými vlastnostmi v mnoha indikacích nefrakcionovaný heparin (UFH = unfractioned heparin). Ten se podává s iniciálním bolusem 5000–10 000 IU i. v. a poté se pokračuje infuzí 1000 IU/hod. s úpravou dávky podle aPTT. Jinou možností výpočtu dávky UFH pro kontinuální i. v. podání je bolus 80 IU/kg hmotnosti a poté 18 IU/kg hmotnosti/hod.(5). Terapeutická hladina aPTT by měla být prodloužena 1,5–2,5x.
Nízkomolekulární hepariny podáváme u hospitalizovaných geriatrických pacientů z léčebné indikace, ale i v preventivní indikaci u imobilních polymorbidních pacientů se závažnými interními diagnózami nebo po traumatech či operacích. Na LMWH nejvíce oceňujeme (při srovnání s warfarinem) relativně rychlý nástup účinku, krátký poločas (i když existují i preparáty Forte, které pokryjí účinkem celých 24 hodin) a poměrně stabilní hladinu. Mezi nejčastěji používané LMWH patří Fraxiparine a Clexane. Dávkovací schémata těchto dvou preparátů nejsou úplně totožná a uvádí je tabulka 9.
Table 9. Dávkovací schéma preparátu Fraxiparine a Clexane podle tělesné hmotnosti 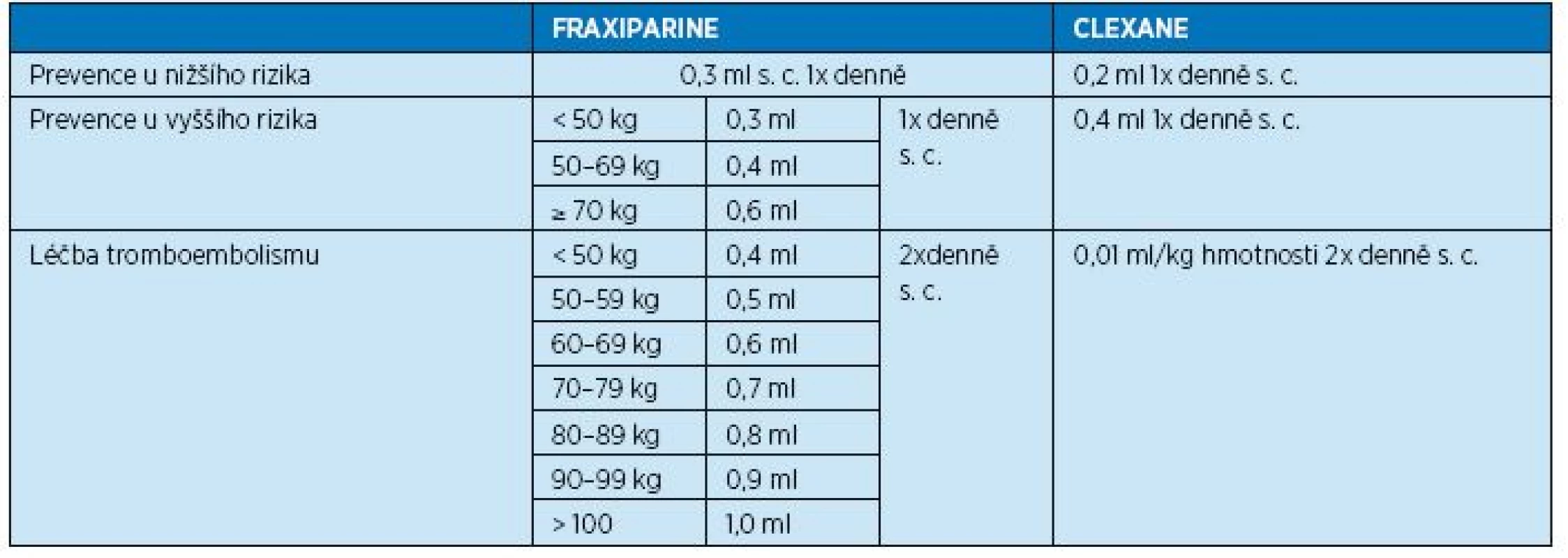
Jak a kdy monitorovat účinek LMWH?
Při podávání LMWH není třeba rutinně laboratorně sledovat hladinu jeho účinku. Laboratorní kontrola se provádí u pacientů s podezřením na předávkování, s významnou renální insuficiencí, léčených terapeutickými dávkami či u nemocných v kritických stavech na podpoře vazopresory. Při hodnocení renálních funkcí si je třeba uvědomit, že samotná urea a kreatinin nejsou přesné ukazatele funkce ledvin, k jejich nárůstu dochází až při velmi podstatném poklesu funkce ledvin (ledviny mají fyziologicky značnou rezervu) a přesnějším vodítkem je glomerulární filtrace.
Těžké poškození funkce ledvin (ClCr < 30 ml/min.) vyžaduje snížení dávkování LMWH až o polovinu nebo prodloužení dávkovacího intervalu na dvojnásobek. Laboratorním ukazatelem účinnosti LMWH je hladina anti-Xa. Odběr krve se provádí 3–4 hodiny po aplikaci dávky. Hladina anti-Xa by se měla při preventivním podávání LMWH pohybovat v rozmezí 0,20–0,40 aXaIU/ml a při terapeutických dávkách 0,6–1,2 aXaIU/ml. Při závažném krvácení při předávkování lze užít k eliminaci účinku LMWH protaminsulfát (1 mg protaminu na 100 IU LMWH). Jeho podání však není tak efektní jako při předávkování UFH.
Jaké je riziko heparinem indukované trombocytopenie?
Heparinem indukovaná trombocytopenie typu I (HIT I) je klinicky nevýznamná komplikace. Je způsobena tím, že molekula heparinu je schopna vyvolat lehkou aglutinaci trombocytů. Nejedná se o tvorbu protilátek. Projeví se nevelkým poklesem trombocytů již druhý den po podání heparinu. Heparinem indukovaná trombocytopenie typu II (HIT II) je však velmi závažná komplikace léčby heparinem(11,12). Podle literárních údajů se vyskytuje asi u 1–3 % pacientů léčených UFH a méně než u 0,1 % pacientů léčených LMWH. Po aplikaci heparinu se tvoří protilátky proti komplexu heparinu s destičkovým faktorem 4, které vedou k intravazální agregaci trombocytů a aktivaci koagulační kaskády se vznikem až život ohrožujícího trombotického stavu. Protilátky se tvoří od čtvrtého dne podávání heparinu a udržují se v oběhu 50–80 dní. Po vysazení heparinu vytvořené protilátky postupně zanikají (novotvorbu by vyvolalo znovunasazení heparinu). Na HIT IIukazuje pokles trombocytů o 30–50 %, progrese stávající nebo rozvoj další trombózy při léčbě heparinem nebo vznik kožní nekrózy, často v místě vpichu kanyly. Proto je důležité u pacientů, u kterých je aplikován UFH a kteří již během posledních 100 dní dostávali heparin, zkontrolovat počet trombocytů před podáním UFH a po 24 hodinách, u ostatních pacientů bez předchozí aplikace UFH v posledních 100 dnech se doporučuje kontrola počtu trombocytů před prvním podáním heparinu a pak obden od čtvrtého do 14. dne aplikace (pokud terapie trvá kratší dobu než 14 dní, pak do jejího ukončení). Počet trombocytů není třeba monitorovat u pacientů, kde se UFH používá pouze k proplachům kanyl a u léčby LMWH. V případě HIT II je nutné heparin vysadit, a pokud je třeba pokračovat v intenzivní antikoagulační terapii, lze použít hirudinové preparáty (lepirudin) nebo byl v praxi odzkoušen i fondaparinux, který však nemá pro tuto indikaci schválení. V zahraničí se používá argatroban.
Co patří mezi nejčastější problémy při nasazování antikoagulační terapie warfarinem?
U warfarinu se přes dlouholeté zkušenosti stále potýkáme s riziky jeho nežádoucích účinků, způsobenými úzkým terapeutickým rozmezím. Každý pacient reaguje velmi individuálně na antikoagulační terapii, což souvisí především s jeho věkem, somatickou konstitucí, renálními a jaterními funkcemi(13). Proto odhadnout v začátku potřebnou dávku warfarinu pro chronickou léčbu bývá obtížné a dávka vhodná pro jednoho pacienta může být pro druhého nedostatečná a jiný pacient potřebuje naopak jen dávku poloviční. Často se stává, že při přechodu z léčby LMWH je iniciálně zvolena vyšší dávka warfarinu, která by byla tolerovaná jinak zdravými osobami mladého či středního věku, ale u starých polymorbidních pacientů může rychle vést k přestřelení INR (International Normalized Ratio) do vysokých hodnot nad terapeutickou mez a ohrozit seniora krvácením. Naopak někdy jen po několika málo dnech při iniciálně nižší sytící dávce warfarinu, kdy se ještě nedostavil plný antikoagulační efekt, netrpělivě dávku zvýšíme s představou, že počáteční dávka byla nedostatečná, a následně docílíme nežádoucího efektu nadměrně zvýšeného INR.
Pro ilustraci zcela běžný příklad z praxe:
83letý muž s diagnostikovanou nekomplikovanou femoropopliteální flebotrombózou levé dolní končetiny: výška pacienta 173 cm, hmotnost 68 kg, kreatinin 120, clearance kreatitinu 0,8 ml/sekundu; normální jaterní testy. Vstupní INR je 1,0 a aPTT 30 sekund. Po úvodní léčbě nízkomolekulárním heparinem je pacient převáděn na léčbu warfarinem. Za současného překrytí Clexanem Forte 0,7ml s. c. 1x denně je ordinován warfarin 3 mg tbl. 1–0–0 po čtyři dny. Čtvrtý den je provedeno kontrolní INR, které je 1,5 a warfarin 3 mg tbl. je proto zvýšen na dvojnásobnou dávku (2–0–0). Při kontrolním vyšetření INR za další 4 dny je INR 4,8. A to už je hodnota nad terapeutickou hranicí, která by mohla pacienta ohrozit krvácením. Doba 4 dnů k dosažení plného efektu dávkou warfarinu 3 mg tbl. 1–0–0, která je spíše udržovací než sytící, je většinou nedostatečná. To ale neznamená, že není možno začít pacienta sytit podáváním nižších dávek, ale musíme si být vědomi, že sycení může trvat delší dobu a během celého tohoto sytícího období je nutno pacienta překrýt LMWH, než je dosaženo plného efektu warfarinu. Pokud však dávku warfarinu náhle zdvojnásobíme, abychom dosáhli terapeutické hladiny dříve, je nutno provést kontrolní vyšetření INR dříve než za 4 dny. Je známo, že warfarin blokuje účinek vitaminu K v játrech a tím zamezuje tvorbě dostatečného množství koagulačních faktorů II, VII, IX, X a zároveň brání také dostatečné tvorbě proteinů C a S, jejichž tvorba je rovněž závislá na vitaminu K. Poločas proteinu S je nepoměrně kratší oproti poločasu na vitaminu K závislých faktorů vnitřního koagulačního systému, a zejména počáteční vysoké dávky warfarinu bez dostatečného překrytí LMWH mohou vést k protrombotickému stavu (tab. 10). Ten se může manifestovat kumarinovou nekrózou i závažnější tromboembolií.
Table 10. Koagulační faktory závislé na vitaminu K a jejich poločas 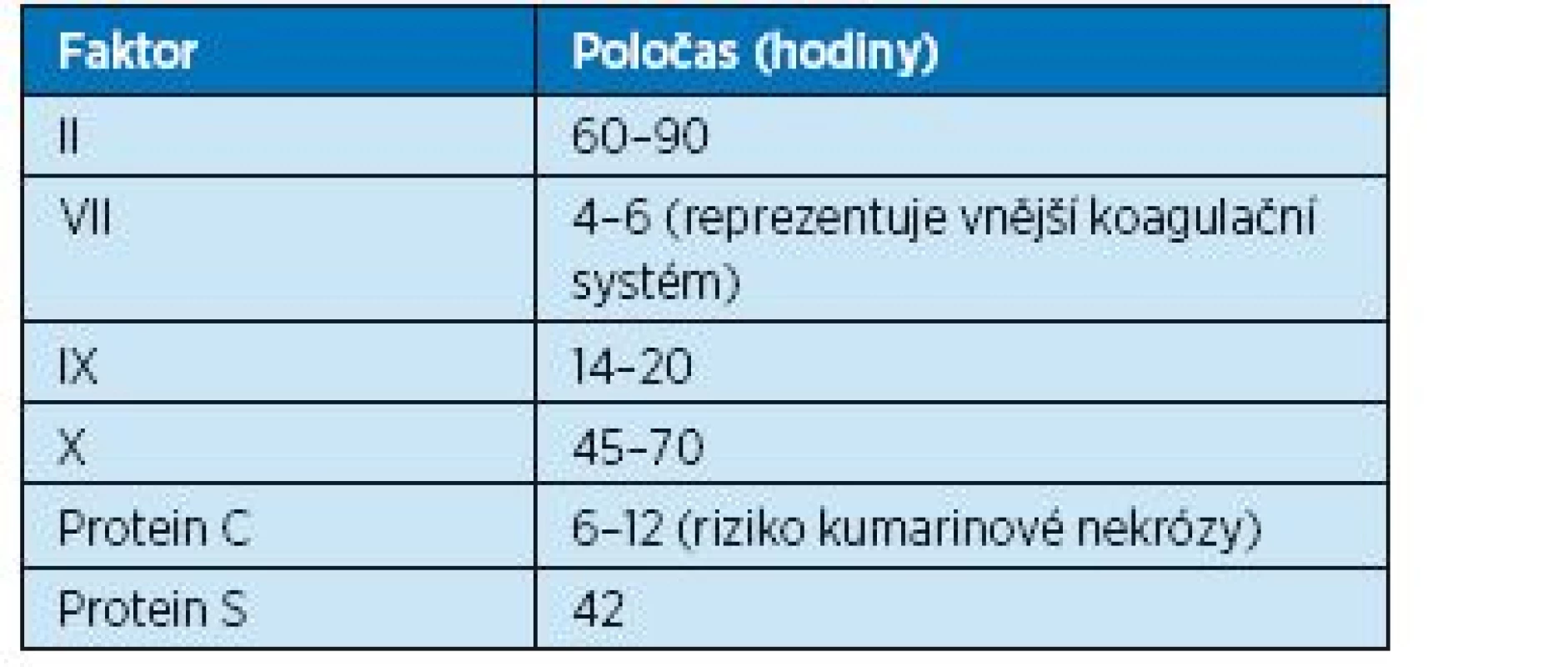
Jaké je riziko interakce warfarinu s jinými léky?
Jsou známy stovky léků, které ovlivňují hladinu warfarinu. Přehled nejznámějších léků, které zvyšují hladinu warfarinu, přináší tabulka 11. Kromě uvedených léků je řada dalších, u nichž výsledek interakce není znám, a proto je třeba dbát při jejich aplikaci zvýšené pozornosti a provést kontrolní INR s odstupem několika dní po nasazení nového léčiva a pátrat po krvácivých komplikacích.
Table 11. Léky ovlivňující hladinu warfarinu 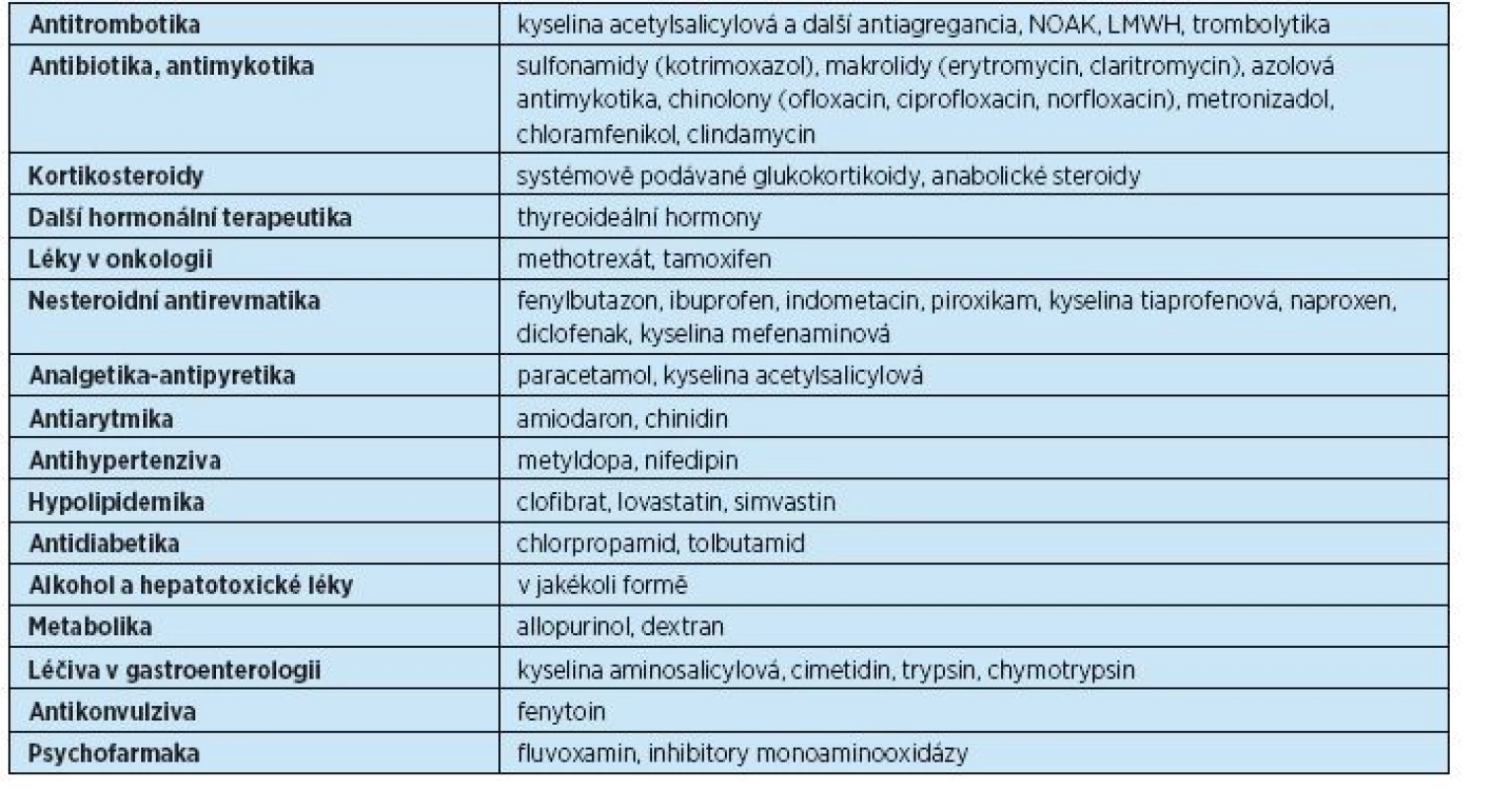
Je nutné držet speciální „warfarinovou dietu“ při léčbě warfarinem?
Přestože existuje řada potravin, které mohou ovlivňovat hladinu warfarinu, žádná speciální warfarinová dieta se nedoporučuje. Jsou sice potraviny, jež obsahují vyšší množství vitaminu K, zejména listová zelenina, ale ani tu nelze zcela z jídelníčku vyřadit, protože zelenina obsahuje mnohé další součásti potravy, které jsou pro nás důležité (zejména vláknina). Proto se nedoporučuje zcela vyloučit tyto složky potravy, ale přijímat je pokud možno v konstantním množství a ordinovanou dávku warfarinu nastavit tak, aby se INR drželo v požadovaném rozmezí 2,0–3,0 při této neměnné dietě. Potravinové interakce warfarinu ukazuje tabulka 12.
Table 12. Potravinové interakce warfarinu 
Jak je to s fondaparinuxem v léčbě tromboembolismu?
Fondaparinux (Arixtra) je zástupce skupiny pentasacharidů a lze jej rovněž použít při léčbě hluboké žilní trombózy. Fondaparinux se podává subkutánně, terapeutická dávka je 7,5 mg s. c. 1x denně. Problém je v tom, že v ČR jsou dostupné pouze injekce á 2,5 mg (preventivní dávka).
Která z nových perorálních antikoagulancií lze použít při léčbě flebotrombózy?
V nynější době jsou schválena k léčbě flebotrombózy a tromboembolické nemoci všechna tři dostupná nová perorální antikoagulancia (NOAC: přímý inhibitor trombinu dabigatran a preparáty ze skupiny selektivních inhibitorů faktoru Xa rivaroxaban a apixaban). Dabigatran se však může nasadit až po 5denním předléčení nízkomolekulárním heparinem. Při užívání NOAC hraje významnou roli funkce ledvin. Chronická renální insuficience představuje významný rizikový faktor, neboť gatrany i xabany jsou vylučovány z velké části ledvinami. Proto před nasazením NOAC je nutno vždy zhodnotit renální funkce a funkci ledvin sledovat i v průběhu léčby. Dávkování NOAC je uvedeno v tabulce 13.
Table 13. Dávkování novějších orálních antikoagulancií v léčbě tromboembolismu 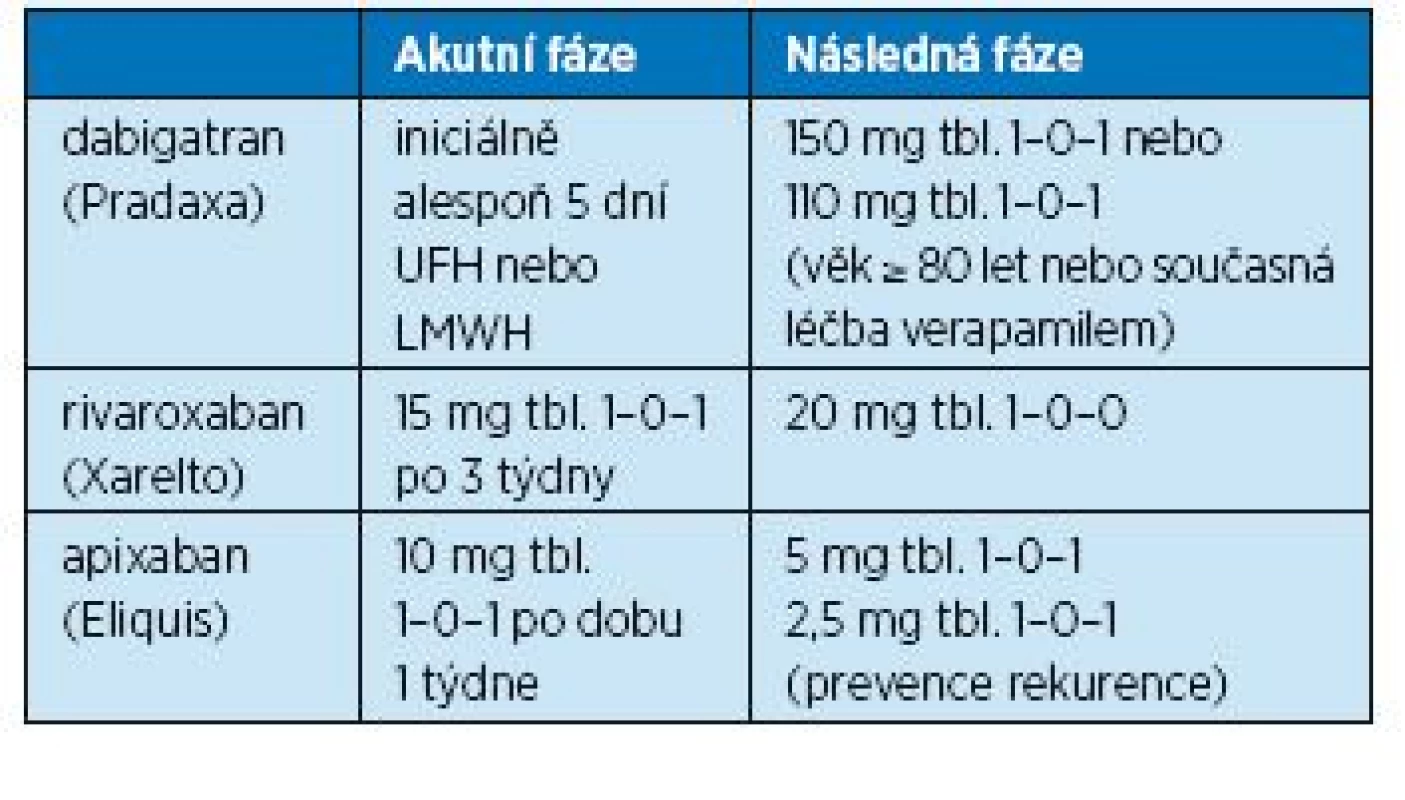
Dabigatran
Pozitivní efekt dabigatranu v léčbě HŽT a TEN byl ověřen ve studiích RECOVER I a II, RE-SONATE a RE-MEDY(14). Dabigatran je vylučován ledvinami dokonce z 80 %, a proto je nutná kontrola funkce ledvin před nasazením a potom nejméně 1x za rok (při snížení renálních funkcí 1x za 3–6 měsíců). Je kontraindikován u pacientů s těžkou poruchou ledvin (CrCl < 30 ml/min). Pro pacienty se středně těžkou poruchou funkce ledvin (CrCl 30–50 ml/min) se doporučuje dávka 2x 150 mg denně, ale u pacientů s vysokým rizikem krvácení je třeba zvážit snížení dávky na 2x 110 mg denně. Užívanou dávku je třeba také snížit na 2x 110 mg tbl. při současné léčbě verapamilem.
Individuální rozvahu (zda nasadit dabigatran 300 mg, nebo 220 mg denně) vyžadují pacienti:
- ve věku ≥ 75let
- se středně těžkou poruchou funkce ledvin (CrCl 30–50 ml/min)
- s gastritidou, ezofagitidou nebo gastroezofageálním refluxem
- ostatní pacienti se zvýšeným rizikem krvácení.
Aplikace dabigatranu je kontraindikována rovněž při těžké poruše funkce jater, při současném podávání silných inhibitorů glykoproteinu P (ketokonazol, cyklosporin, itrakonazol, dronedaron). Nedoporučuje se ani souběžná léčba s takrolimem.
Rivaroxaban a apixaban
Účinek rivaroxabanu a apixabanu byl testován v řadě studií, např. EINSTEIN DVT, EINSTEIN PE, AMPLIFY(15, 16, 17). Rivaroxaban a apixaban jsou kontraindikovány při těžké poruše funkce ledvin, a těžších jaterních onemocněních s rizikem krvácení. Je kontraindikováno současné podávání xabanů s antimykotiky a ritonavirem, které hladinu xabanů zvyšují. Vzestup účinku mohou způsobit i erytromycin a claritromycin.
Jaké testy lze použít ke sledování účinku NOAC?
Výhodou NOAC je, že léčba se nemusí rutinně laboratorně monitorovat a ke kontrole přistupujeme jen ve speciálních případech, např. při výskytu krvácivé komplikace nebo před operací. INR a aPTT není určeno a nedoporučuje se ke sledování efektu léčby xabany a gatrany. K ověření účinku dabigatranu se provádí ecarinový test (ECT) nebo diluční trombinový test (Hemoclot). Dabigatran však přece jen významně ovlivňuje hodnotu aPTT. Toho lze využít alespoň orientačně.
O účinné léčbě svědčí 1,5x prodloužené aPTT ve vzorku krve odebrané před podáním další dávky dabigatranu. Dvojnásobné prodloužení aPTT nad horní hranici normy při léčbě dabigatranem před podáním další dávky svědčí o nadměrném antikoagulačním efektu. Xabany způsobují většinou malé a variabilní změny aPTT, které se nehodí k hodnocení jejich účinku. K posouzení účinnosti léčby rivaroxabanem lze použít v indikovaných případech speciální testy Neoplastin (hodnocení PT) a test inhibice faktoru Xa, používaný také k hodnocení efektu terapie LMWH, ale hodnoty získané při léčbě xabany jsou podstatně vyšší než hodnoty získané při léčbě LMWH (test se tedy musí překalibrovat). Lze použít i test ke stanovení koncentrace rivaroxabanu v plazmě Biophen DiXal. Pro kontrolu léčby apixabanem se doporučuje test Rotachrom anti-Xa(18).
Jak dlouho flebotrombózu a tromboembolii léčit?
Délka léčby se odvíjí od toho, co ke vzniku flebotrombózy a tromboembolie vedlo. Sekundární HŽT a TEN se známou přechodnou příčinou (operace, úraz) léčíme nejméně 3 měsíce. Idiopatickou flebotrombózu, u které se nepodařilo příčinu odhalit, léčíme nejméně po dobu 6 měsíců. TEN s přetrvávajícím významným protrombotickým stavem (trombofilní stavy), zejména s rekurencí HŽT je indikací k trvalé léčbě.
Jak postupovat při povrchové tromboflebitidě?
I při povrchové tromboflebitidě je důležité provedení ultrazvukového vyšetření, které ozřejmí rozsah postižení, jež může být větší, než ukazuje klinický obraz. Povrchová tromboflebitida představuje v oblastech junkce povrchového žilního systému s hlubokým a v oblasti perforátorů riziko přechodu onemocnění na hluboký žilní systém. Jako projev celkového protrombotického stavu organismu může být povrchová tromboflebitida provázena asymptomatickou hlubokou flebotrombózou na stejné i druhostranné končetině. Proto se při povrchové tromboflebitidě doporučuje ultrazvukové vyšetření obou dolních končetin.
V léčbě povrchové tromboflebitidy je důležitá mobilizace pacienta (chůze, cvičení nohou u pacientů upoutaných na lůžko), bandáže, lokální léčba – protizánětlivé masti, hepariny, heparoidy; u flebitid varikózních žil na bércích nevelkého rozsahu – nesteroidní antirevmatika. U rozsáhlého postižení, zejména v místech, kde hrozí přestup na hluboký žilní systém, se doporučuje antikoagulace (nejčastěji LMWH s převodem na warfarin) po dobu 6 týdnů s kontrolním UZ vyšetřením.
Jak často dochází ke vzniku posttrombotického syndromu?
Posttrombotický syndrom vzniká kombinací přetrvávající žilní obstrukce a insuficience žilních chlopní.
Posttrombotický syndrom je příčinou 10 % všech chronických žilních insuficiencí(5). Etiologii je nutno vždy ověřit UZ, aby se vyloučily otoky a kožní změny jiné etiologie.
Co se týká incidence posttrombotického syndromu, nejsou data z klinických studií konzistentní z důvodů metodické nejednotnosti (různá diagnostická kritéria, odlišné terapeutické postupy). Z dostupných informací vyplývá, že až u 50 % pacientů s prodělanou proximální HŽT se i přes optimální antikoagulační terapii vyvine posttrombotický syndrom(19, 20, 21).
Pokud dojde ke vzniku idiopatické flebotrombózy, jak detailně pátrat po možné přítomnosti maligního onemocnění?
Jedna pětina TEN se vyskytuje u pacientů se známým maligním onemocnění, ale zánět žil může být také téměř u 10 % pacientů s HŽT první manifestací zhoubného onemocnění, které je diagnostikováno do 1 roku po prodělané idiopatické flebotrombóze(22, 23). Nejčastějšími malignitami, které jsou provázeny flebotrombózami či migrujícími flebitidami, jsou adenokarcinomy urogenitálu a gastrointestinálního traktu a hematologické malignity. Pacienti s okultní malignitou jsou většinou starší 70 let. Příčina zvýšeného výskytu TEN u malignit je multifaktoriální, účastní se jí prokoagulanty exprimované na maligních buňkách i uvolňování cytokinů. Bývají zvýšeny koagulační faktory, fibrinogen a další markery hyperkoagulability (fibrinopeptid A, fragmenty protrombinu a trombin-antitrombinový komplex, někdy trombocytóza)(24, 25).
Pacient s idiopatickou hlubokou žilní trombózou by měl mít provedeno základní vyšetření:
- důkladně odebranou anamnézu (bolesti, změny ve vyprazdňování, krvácivé projevy, úbytek hmotnosti, zvracení, poruchy polykání, teploty atd.)
- fyzikální vyšetření (včetně vyšetření uzlin, vyšetření per rectum)
- základní hematologické vyšetření (krevní obraz a diferenciální rozpočet)
- biochemické vyšetření
- a rtg hrudníku.
Co se týká dalších vyšetření, je pro pacienta nezatěžující ultrazvuk břicha a ledvin, i když není zařazen do základních vyšetření. Ostatní vyšetření k vyhledávání malignit jsou zahrnuta již do preventivních vyšetření, která by měl v pravidelných doporučených intervalech podstupovat každý pacient, zvláště vstupující do seniorského věku, bez ohledu na to, zda prodělal TEN – tj. mammografie, pravidelné gynekologické vyšetření s cytologickým stěrem, u mužů vyšetření prostaty a PSA-f (volný prostatický antigen).
Součástí doporučených vyšetření je po 50. roce věku bez ohledu na prodělanou TEN i koloskopie. Tato vyšetření doporučíme doplnit, pokud je pacient nepodstoupil v rámci pravidelného preventivního sledování a v případě, že základní vyšetření ukazuje indicie malignity, provedeme kontrolu bez ohledu na dřívější vyšetření v rámci rutinní prevence. Některá doporučení pro screening malignit u idiopatické TEN uváděla zvážení provedení CT břicha a pánve(26), nicméně studie nepotvrdily, že by rutinní provádění CT břicha a pánve bylo přínosné pro odhalení vyššího počtu malignit.
V roce 2015 byly zveřejněny výsledky kanadské studie SOME, která zkoumala více než 850 pacientů průměrného věku 54 let s první idiopatickou flebotrombózou. Pacienti byli rozděleni do dvou skupin. První skupina podstoupila po vstupu do studie iniciální limitovaný screening k vyloučení malignity (KO+ diferenciál, iontogram, kreatinin, jaterní testy, rtg hrudníku a byla doplněna i mammografie, gynekologické vyšetření u žen a urologické vyšetření včetně vyšetření PSA-f u mužů, pokud tato urogenitální vyšetření nebyla provedena v rámci prevence v předchozím roce). Druhá skupina měla navíc provedeno CT vyšetření břicha a pánve včetně virtuální koloskopie a gastroskopie. Kromě toho byl u více než 8 % do studie zařazených pacientů vyšetřen test na okultní krvácení nebo koloskopie. Během jednoročního sledování celé studijní populace byl zjištěn zhoubný tumor u 3,9 % osob (tj. relativně nízký počet malignit, ovšem také relativně „nízký“ průměrný věk pacientů z pohledu geriatra).
Z celkového počtu malignit se však z nich nepodařilo odhalit při vstupním screeningovém vyšetření více než jednu čtvrtinu, a to i tehdy, pokud bylo provedeno CT vyšetření (29 % neodhalených tumorů ve skupině bez CT vyšetření a 26 % ve skupině s provedeným CT vyšetřením – mezi oběma skupinami nebyl statisticky významný rozdíl). Nejčastější neodhalené malignity v obou skupinách byly leukemie, gynekologické a kolorektální tumory bez rozdílu, zda bylo provedeno CT vyšetření.
K podobným závěrům došla i italská studie se staršími pacienty průměrného věku 69 let (jen s tím rozdílem, že během dvou let se zhoubné bujení objevilo téměř u 9 % osob této vyšší věkové kategorie)(27, 28). Z těchto výzkumů vyplývá, že rutinní provádění CT břicha a pánve nepřináší signifikantní benefit.
Autoři prohlašují, že v souvislosti s publikací článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny farmaceutickou firmou.
MUDr. Marie Berková, Ph.D.1, 2
MUDr. Zdeněk Berka3
prof. MUDr. Eva Topinková, CSc.2
1LDN FNKV Praha
2Geriatrická klinika 1. LF a VFN Praha
3LF UP a FN Olomouc
MUDr. Marie Berková, Ph.D.
e-mail: marie.berkova@lf1.cuni.cz
Pracuje na Geriatrické klinice 1. LF UK a VFN a v Léčebně dlouhodobě nemocných FNKV v Praze.
Sources
1. Skalická L. Hluboká žilní trombóza – klinická manifestace a diagnostika. Postgrad Med 2006; 8(4): 415–421.
2. Silverstein MD, Heit JA, Mohr DN, et al. Trends in the incidence of deep vein thrombosis and pulmonary embolism: a 25-year population-based study. Arch Intern Med 1998; 23(6): 585–593.
3. Tagalakis V, Patenaude V, Kahn SR, Suissa S. Incidence and mortality from venous thromboembolism in a real-world population: the Q–VTE Study Cohort. Am J Med 2013; 126(9): 832 : 13–21.
4. Ouriel K, Green RM, Greenberg RK, Clair DG. The anatomy of deep venous thrombosis of the lower extremity. J Vasc Surg 2000; 31 : 895-900.
5. Hirmerová J, Karetová D, Malý R a kol. Akutní žilní trombóza 2014: současný stav prevence, diagnostiky a léčby. Doporučený postup České angiologické společnosti ČLS JEP. Dostupné z: http://www.angiology.cz/intro
6. Joffe HV, Goldhaber SZ. Upper extremity vein thrombosis. Circulation 2002; 106 : 1874–1880.
7. Musil D. Diagnostika a léčba tromboembolické nemoci v ambulanci praktického lékaře. Med praxi 2011; 8(5): 238–241.
8. Herman Jiří, Musil D. Žilní onemocnění v klinické praxi. Praha: Grada Publishing 2011 : 113–137
9. Štverák P, Matoška P, Stolařová I a kol. Naše zkušenosti s implantací kaválního filtru Trapease. Interv Akut Kardiol 2004; 3 : 177–180.
10. Čížek V, Kučera D, Válka M, a kol. Kavální filtry. Postgrad med 2010; 10(1): 83–91.
11. Riegerová B, Malý R, Lojík M, a kol. Heparinem indukovaná trombocytopenie II. typu u komplikované ileofemorální flembotrombózy léčené katétrem řízenou trombolýzou. Interní Med 2008; 10 (7 a 8): 358–360.
12. Holotňáková I, Branny P, Nevřalová R, a kol. Masivní intrakardiální trombóza jako projev heparinem indukované trombocytopenie II. typu po léčbě nadroparinem po kardiochirurgické operaci. XX. výroční sjezd ČKS, 13.–16. 5. 2012, Brno.
13. Jun M, James MT Manns BJ, et al. The association between kidney function and major bleeding in older adults with atrial fibrillation starting warfarin treatment: population based observational study. BMJ 2015; 350 : 246.
14. Schulman S; RE-MEDY; RE-SONATE trial Iivestigators. Extended use of dabigatran, warfarin, or placebo in venous thromboembolism. N Engl J Med 2013; 368 : 709–718.
15. Buller HR, Prins MH, et al. Oral rivaroxaban for the treatment of symptomatic pulmonary embolism. N Engl J Med 2012; 366 : 1287–1297.
16. Eriksson BI, Borris LC, Friedman RJ, et al. Rivaroxaban versus enoxaparin for thromboprophylaxis after hip arthroplasty. N Engl J Med 2008; 358 : 2765–2775, 2776–8276.
17. Bauersachs R, Berkowitz SD, Brenner B, et al. Oral rivaroxaban for symptomatic venous thromboembolism. N Engl J Med 2010; 363(26): 2499–2510.
18. Kvasnička T. Nová perorální antikoagulancia – vliv na koagulační testy. Medicína po promoci 2014; 4 : 16.
19. Roumen-Klappe EM, Heijer M, Janssen MC, et al. The post-thrombotic syndrome: incidence and prognostic value of non-invasive venous examinations in a six-year follow-up study. Thromb Haemost 2005; 94(4): 825–830.
20. Baldwin MJ, Moore HM, Rudarakanchana N. Post-thrombotic syndrome: a clinical review. J Thromb Haemost 2013; 11(5): 795–805.
21. Kahn SR. The post-thrombotic syndrome: progress and pitfalls. Br J Haematol 2006; 134(4): 357.
22. Hettiarachchi RJ, Lok J, Prins MH, et al. Undiagnosed malignancy in patiens with deep venous thrombosis. Cancer 1998; 83 : 180–185.
23. Carrier M, Lazo-Langner A, Shivakumar S, et al. Screening for Occult Cancer in Unprovoked Venous Thromboembolism. N Engl J Med 2015; 373 : 697–704.
24. Kelly J, Rudd T, Lewis R,et al. Occult cancer in older patiens presenting with venous thromboembolism. Age and Ageing 2002; 31 : 101–104.
25. Prandoni P, Picciolo A, Girolami A. Cancer and venous thromboembolism: an overview. Haematologica 1999; 84 : 437–445.
26. NICE guidelines 2012 [CG144]. Venous thromboembolic diseases: diagnosis, management and thrombophilia testing. Dostupné z: https://www.nice.org.uk/guidance/cg144/chapter/guidance
27. Piccioli A, Bernardi E, Dalla Valle F, et al. The value of CT-scanning for detection of occult cancer in patients with unprovoked venous thromboembolism. J Thromb Haemost 2013; 11: Suppl 2: AS 34.1–AS 34.1
28. Piccioli A, Bernardi E, Prandoni P. Cancer Screening in Unprovoked Venous Thromboembolism. N Engl J Med 2015; 373 : 2473–2475.
Labels
Geriatrics General practitioner for adults Orthopaedic prosthetics
Article was published inGeriatrics and Gerontology

2016 Issue 1-
All articles in this issue
- Specializace v geriatrii a kompetence geriatra
- Krvácivé komplikace antikoagulační léčby u geriatrických pacientů
- Vliv reminiscenční terapie na depresivitu a kognitivní funkce u seniorů v dlouhodobé péči
- Hluboká žilní trombóza a její léčba v otázkách a odpovědích
- Onemocnění štítné žlázy se zaměřením na seniorský věk
- Role nutrice v prevenci kognitivních poruch ve vyšším věku
- Transmisivní spongiformní encefalopatie jako příčina demence způsobená priony
- Ageismus – hrozba sociální izolace ve stáří
- Geriatrics and Gerontology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hluboká žilní trombóza a její léčba v otázkách a odpovědích
- Onemocnění štítné žlázy se zaměřením na seniorský věk
- Transmisivní spongiformní encefalopatie jako příčina demence způsobená priony
- Specializace v geriatrii a kompetence geriatra
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


