-
Medical journals
- Career
Společné stanovisko odborných společností k farmakologické léčbě obezity
Authors: D. Müllerová 1,2; M. Haluzík 3; P. Sucharda 4; J. Boženský 5; M. Fried 6; P. Holéczy 7; M. Kunešová 8; I. Málková 9; Š. Slabá 10; P. Šrámková 6; R. Taxová Braunerová 8; V. Hainer 8
Authors‘ workplace: Ústav hygieny a preventivní medicíny, Lékařská fakulta v Plzni, Univerzita Karlova, Vedoucí: prof. MUDr. Dana Müllerová, Ph. D. 1; Obezitologická ambulance I. interní kliniky, FN Plzeň, Přednosta: prof. MUDr. Martin Matějovič, Ph. D. 2; Centrum diabetologie, Institut experimentální a klinické medicíny, Praha, Přednosta: prof. MUDr. František Saudek, DrSc. 3; 3. interní klinika 1. lékařské fakulty Univerzity Karlovy a VFN, Praha, Přednosta: prof. MUDr. Michal Kršek, CSc. 4; Dětské oddělení, nemocnice AGEL Ostrava-Vítkovice, a. s., Primář: MUDr. Jan Boženský 5; OB KLINIKA, a. s., Praha, Přednosta: prof. MUDr. Martin Fried, CSc. 6; Chirurgické oddělení, Nemocnice AGEL Ostrava-Vítkovice, a. s., Primář: MUDr. Miloslav Mazur, Ph. D., MBA 7; Endokrinologický ústav, Centrum pro diagnostiku a léčbu obezity, Praha, Ředitelka: doc. RNDr. Běla Bendlová, CSc. 8; STOB, Praha 9; Gynekologicko-porodnická klinika 1. lékařské fakulty Univerzity Karlovy a VFN, Praha, Přednosta: prof. MUDr. Alois Martan, DrSc. 10
Published in: Prakt. Lék. 2021; 101(1): 32-47
Category: Of different specialties
Overview
Obezita se stala v posledních 30 letech celosvětovou pandemií. V léčbě obezity se v současnosti uplatňuje především úprava životního stylu, která však mnohdy dlouhodobě selhává. Pro příští desetiletí se jako perspektivní jeví v léčbě obezity spolu s chirurgickou léčbou dlouhodobé podávání antiobezitik, tedy léků, které příznivě ovlivňují nejen pokles nadměrné hmotnosti, ale i zdravotní rizika spojená s obezitou. Tento text podává přehled o současných možnostech farmakoterapie obezity včetně jejich indikací, vhodném výběru pacienta a nežádoucích účincích léčby. Přináší také přehled studií, které prokazují dlouhodobou účinnost a bezpečnost této léčby. Přesto, že účinná a bezpečná antiobezitika jsou v současné době k dispozici, není tato léčba ani částečně hrazena ze všeobecného zdravotního pojištění. Náklady na léčbu jsou však pro velkou část obézních dlouhodobě neúnosné. Faktická nedostupnost účinných antiobezitik pro indikované pacienty má závažné zdravotně-ekonomické dopady. Nevyužívání účinných možností léčby, potvrzených postupy medicíny založené na důkazech, má za následek vysokou prevalenci s obezitou spojených nemocí, jejichž léčení je ekonomicky ještě nákladnější a v případě diabetes mellitus 2. typu dokonce méně efektivní. Jsme přesvědčeni, že alespoň částečná úhrada antiobezitik z prostředků všeobecného zdravotního pojištění pro pacienty s prokázanou compliance a za jasně vymezených podmínek je nezbytným krokem ke zlepšení situace a ve svých důsledcích bude jednoznačně ekonomicky prospěšná.
Klíčová slova:
obezita – farmakoterapie – komplikace obezity – diabetes mellitus 2. typu – úhrada antiobezitik
Toto společné stanovisko odborných lékařských společností se vydává vzhledem ke společenské závažnosti problematiky obezity jako chronického onemocnění, které je společným patofyziologickým nastavením organismu, na jehož podkladě se zvyšuje riziko rozvoje kardiovaskulárních, metabolických, plicních, nádorových onemocnění a onemocnění pohybového ústrojí, přičemž jeho prevence a správná léčba snižuje jak rozvoj, tak progresi těchto onemocnění. Cílem stanoviska je zvýšit povědomí o obezitě jako onemocnění, které vyvolává řadu závažných komplikací. Její prevenci a léčbě by proto měla být věnována stejná pozornost jako jiným závažným civilizačním onemocněním.
Za odborné společnosti:
prof. MUDr. Martin Haluzík, DrSc. – předseda České obezitologické společnosti ČLS JEP
MUDr. Martin Hrubý – předseda Společné sekce bariatricko-metabolické chirurgie ČLS JEP
prof. MUDr. Michal Vrablík, Ph.D. – předseda České asociace preventivní kardiologie a předseda České společnosti pro aterosklerózu
prof. MUDr. Jan Škrha, DrSc. – předseda České diabetologické společnosti ČLS JEP
ÚVOD
Obezita je celkové onemocnění organismu, které neléčené významně zvyšuje riziko vzniku a rozvoje diabetes mellitus 2. typu (DM2T), kardiovaskulárních a nádorových onemocnění, vede k ventilační nedostatečnosti a dalším multiorgánovým a multisystémovým postižením, včetně přetížení pohybového ústrojí, která zhoršují kvalitu života, snižují práceschopnost, zvyšují nemocnost a úmrtnost. Obezita se stala pandemií a podle Světové zdravotnické organizace (WHO) je jednou z největších výzev v oblasti veřejného zdraví 21. století. V České republice podle dostupných údajů za posledních 40 let dramaticky narostl podíl obyvatel s obezitou. Podle údajů NCDRisC (Non-Communicable Diseases Risk Factor Collaboration, světové sítě, která shromažďuje data ze zdravotnictví, http://www.ncdrisc.org/index.html) se zvýšilo zastoupení mužů s obezitou 1. stupně více než 2krát, s obezitou 2. stupně téměř 5krát a obezitou 3. stupně téměř 14krát. U žen byl nárůst menší. Nadváhou či obezitou trpělo v roce 2016 podle analýzy projektu Česko v datech 71 % mužů a téměř 56 % žen, což v té době představovalo dosud nejvyšší číslo v historii. Podobné údaje pro Českou republiku, 72 % mužů a 60 % žen s nadváhou a obezitou, tentokrát z roku 2008, vykazuje databáze WHO, kdy obezita byla shledána u 33 % mužů i žen. O něco příznivější zastoupení nadváhy a obezity – 65 % mužů a 46 % žen vykazuje šetření VZP s agenturou STEM MARK z roku 2013, kdy samotnou obezitou trpí 23 % mužů a 19 % žen. Modely WHO predikují pro Českou republiku nárůst prevalence obezity v roce 2030 na 36 % dospělé populace. V České republice se podle České lékařské společnosti JEP odhadují přímé i nepřímé zdravotní náklady související s obezitou až na 10 % celkových výdajů na zdravotnictví, což ročně představuje 30 miliard – ovšem dosud chybí podrobná farmakoekonomická analýza. Geograficky nejbližší studie z Německa, provedená u osob starších 57 let, prokázala zhruba 1,7krát vyšší přímé celkové náklady na zdravotní péči s obezitou druhého a vyššího stupně (BMI ≥ 35 kg/m2) v porovnání s osobami s normální tělesnou hmotností (1). Systematické přehledové studie se shodují, že obezita spotřebovává obrovské množství zdrojů na zdravotní péči (2, 3).
ZDRAVOTNÍ RIZIKA OBEZITY
Podle Zpráv o zdraví obyvatel České republiky jsou chronická neinfekční onemocnění hlavní příčinou úmrtnosti a invalidity. Česká republika patří k evropským zemím s nejvyšší incidencí zhoubných novotvarů, s téměř dvojnásobnou úmrtností na kardiovaskulární onemocnění proti evropským zemím s nejnižší úmrtností. Obezita se svými komplikacemi patří mezi základní determinanty chronických neinfekčních onemocnění, které lze modifikovat. Podle mezinárodních studií se odhaduje atributivní riziko obezity v rozmezí 5–15 % celkové mortality, pro nádorová nemocnění do 8 %, kardiovaskulární onemocnění 7–44 % a DM2T v rozmezí 3–83 % (4). Podle návrhu Evropské společnosti pro studium obezity (European Association for the Study of Obesity – EASO) je za nejvyšší zdravotní riziko spojené s obezitou považována přítomnost minimálně jednoho z následujících onemocnění: DM2T, metabolický syndrom, kardiovaskulární/renální orgánové poškození či muskuloskeletální poškození (5). Vysoké riziko komplikací obezity ale představuje i syndrom spánkové apnoe s ventilační insuficiencí. Za středně závažné riziko zdravotního stavu spojené s obezitou považuje EASO pozitivní rodinnou anamnézu u příbuzného prvního stupně s ohledem na výskyt DM2T, hypertenze, infarktu myokardu či cévní mozkové příhody; u osoby mladší 30 let pak BMI ≥ 35 kg/m2, u starších BMI ≥ 40 kg/m2; viscerální obezitu, porušenou glukózovou toleranci, hypertenzi, dyslipidemii, současné kuřáctví a fyzickou inaktivitu. Mezi středně závažné riziko je možné započítat i současně přítomnou depresi (5). U obézních, kteří výše uvedená zdravotní rizika nemají, se pak celkové zdravotní riziko považuje za nízké. Pro praxi má navržená klasifikace závažný dopad na míru intenzity léčby obezity. Čím závažnější stupeň zdravotního rizika, tím důraznější terapeutické intervence je třeba vynaložit. Nejen na hmotnostní redukci, ale zejména na léčbu komplikací obezity, jejíž iniciální strategii lze navrhnout podle Doporučení pro léčbu obezity, navržených výborem EASO pro léčbu obezity (tab. 1) (6). Obezita je velmi obtížně léčitelné onemocnění; především je obtížné udržet dlouhodobý pokles tělesné hmotnosti. Při snaze o redukci hmotnosti se spouští kompenzační mechanismy, které snižují metabolismus a zvyšují produkci hormonů, které zvyšují chuť k jídlu (7, 8). Na druhé straně již pokles hmotnosti o 5–10 % vede nejen ke snížení nemocnosti na kardiovaskulární onemocnění, hypertenzi a DM2T, ale snižuje též i další zdravotní rizika spojená s obezitou. U pacientů s DM2T snižuje pokles hmotnosti o 5–10 % koncentraci HbA1c až o 10 mmol/mol. Stejně tak se snižuje systolický a diastolický krevní tlak, což navozuje snížení potřeby farmak (9). Snížení hmotnosti o 15 a více kg bylo v DiRECT studii obézních, s délkou trvání diagnózy DM2T až do 6 let, spojeno s remisí DM2T v 86 %, a to při vysazení antihypertenziv a antidiabetik (10).
Table 1. Stratifikace léčby obezity dospělých podle doporučeného postupu EASO (6) 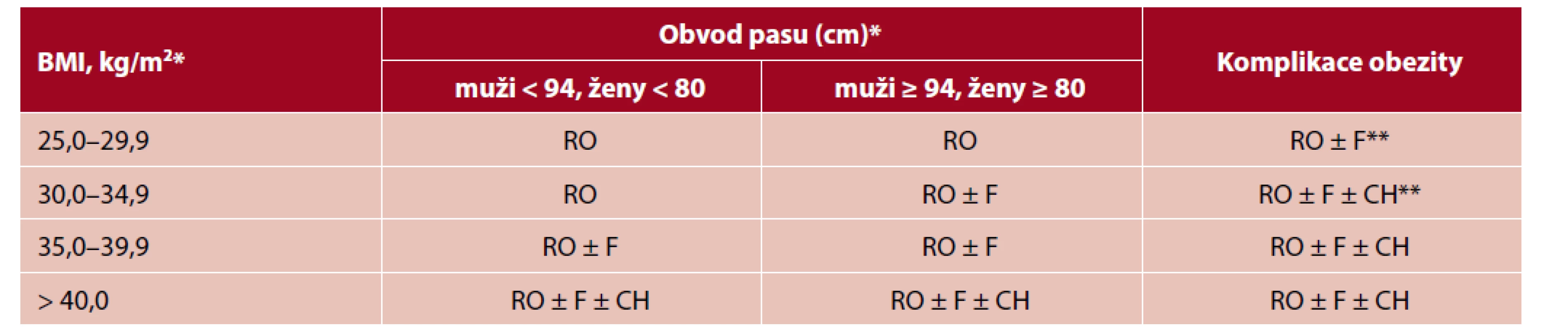
RO – režimová opatření (intervence diety, fyzické aktivity a psychologické podpory), F – farmakoterapie, CH– metabolicko bariatrická chirurgie
*hraniční hodnoty pro BMI a obvod pasu se liší podle etnických skupin, **individuální přístup u pacientů s DM2TLÉČBA OBEZITY
Léčení obezity vyžaduje multidisciplinární přístup, zároveň je nezbytná pacientova aktivní účast (6, 11). Základem léčby jsou vždy režimová opatření, zejména úprava stravy a dostatečná fyzická aktivita. Pokud nejsou provázena personálně velmi náročnou psychoterapeutickou a motivační podporou, z hlediska dlouhodobého efektu často selhávají. Dlouhodobě je úspěšnější kombinace s podáváním antiobezitik a zvláště s bariatrickou chirurgií. V léčení obezity tak stále můžeme využít kombinace pěti přístupů:
1. úprava stravy
2. zvýšení fyzické aktivity
3. psychoterapie
4. farmakoterapie
5. metabolicko-bariatrická léčba
Při léčbě komplikací obezity je imperativem (tam, kde to lze) výběr léků, které hmotnost dále nezvyšují. To se týká diabetu, kardiovaskulárních, psychických, gynekologických, revmatologických, pneumologických, autoimunních a dalších onemocnění. První tři léčebné postupy, jakkoliv vypadají jednoduše, jsou málo úspěšné. Pacient musí mít motivaci, podporu psychologa, nutričního terapeuta, fyzioterapeuta či osobního trenéra pro pohybovou aktivitu zaměřeného na jedince s obezitou. Chování populace je obtížně ovlivnitelné pouze zdravotními argumenty, pokud nejsou podpořeny dalšími faktory, např. ekonomickou motivací či tlakem médií a sociálních sítí.
Pro příští desetiletí se jako perspektivní jeví spolu s chirurgickou léčbou dlouhodobé podávání antiobezitik, tedy léků, které podporují a příznivě ovlivňují pokles nadměrné tělesné hmotnosti. Takové léky jsou v současné době k dispozici, ale nejsou ani částečně hrazeny ze všeobecného zdravotního pojištění. Náklady na léčbu jsou však pro velkou část obézních dlouhodobě neúnosné.
Faktická nedostupnost účinných antiobezitik pro indikované pacienty má závažné zdravotně-ekonomické dopady. Nevyužívání účinných možností léčby, potvrzených postupy medicíny založené na důkazech, má za následek vysokou prevalenci s obezitou spojených nemocí, jejichž léčení je ekonomicky ještě nákladnější a v případě DM2T dokonce méně efektivní.
Jsme přesvědčeni, že úhrada antiobezitik z prostředků všeobecného zdravotního pojištění, alespoň částečná a za vymezených podmínek, je nezbytným krokem ke zlepšení situace a ve svých důsledcích bude jednoznačně ekonomicky efektivní. I když pro angažování lékařů v léčbě obezity bylo vynaloženo značné úsilí, od zařazení této problematiky do programů pregraduálního vzdělávání všeobecného lékařství, přes vydání doporučených postupů pro praktické lékaře, doporučených postupů pro léčbu metabolickou chirurgií a pro léčbu dětské obezity, pořádání pravidelných postgraduálních školení v obezitologii až po zařazení praktických stáží z obezitologie do přípravy ve specializačním vzdělávání z endokrinologie a diabetologie, přesto se většina oborů převážně z důvodů časové tísně problematikou obezity nezabývá.
Obezita se dnes převážně léčí v obezitologických ambulancích a obezitologických centrech. Podle typu vybavení pracoviště, personálního zabezpečení a možnosti poskytovat vyšší či nejvyšší míru specializované léčebné péče obézním lze pracoviště rozdělit na pracoviště 1. a 2. typu podle standardů akreditace vypracovaných Českou obezitologickou společností ČLS JEP (ČOS). Lékaři, kteří léčbu pacientům poskytují, se většinou rekrutují z lékařů se specializací interní, endokrinologickou, diabetologickou, pediatrickou či chirurgickou. Většinou mají, nikoliv ale povinně, kurz v obezitologii pořádaný pod záštitou ČOS. V současné době není zavedena postgraduální specializace v obezitologii. Podle zákona č. 48/1997 Sb. nejsou ani dostatečně specifikovány výkony používané v obezitologii, které by byly v potřebném rozsahu hrazenými službami z veřejného zdravotního pojištění. Na léčbě pacientů s obezitou se podílejí i další odborní zdravotničtí pracovníci specializovaní v oblastech výživy, fyzioterapie a psychoterapie.
Psychologické postupy léčby spočívají v psychologické diagnostice, v poradenství a v terapii pacienta s obezitou. V diagnostice jde o zjištění psychogenní složky podílející se na nesprávném, „proobezigenním“ chování, detekci jejích hereditárních či naučených komponent. V poradenství jde o ovlivnění motivačního chování, naučení se sebeúctě a správnému uspokojování emočních potřeb, postupnému trénování a posilování volního úsilí a naučení se behaviorálním scénářům ve vypjatých psychosociálních situacích.
Dietoterapie v léčbě obezity a přidružených onemocnění zahrnuje dva základní aspekty: energetickou restrikci vedoucí k negativní energetické bilanci a zajištění nutriční biologické kvality stravy. Energetickou restrikci s cílem negativní energetické bilance lze dosáhnout pomocí velmi přísné nízkoenergetické diety o energetickém obsahu 1,5–3 MJ/den nebo nízkoenergetické diety s energetickým obsahem 5–7 MJ/den.
Stravou o energetickém obsahu 1,5–3 MJ nelze uhradit denní nároky na požadované mikro - a makronutrienty dospělých, proto byly vyvinuty velmi přísné nízkoenergetické diety, tzv. VLED, dříve označované jako VLCD diety (Very Low Energy Diets, Very Low Calorie Diets), které představují nutričně definované náhrady jídla v podobě „potravin pro zvláštní výživu“ určených podle současné legislativy „k náhradě celodenní stravy pro regulaci hmotnosti“ nebo „potravin pro zvláštní lékařské potřeby“ tak, aby byly zabezpečeny alespoň minimální denní dávky všech esenciálních nutrientů, které jsou nutné k pokrytí fyziologických potřeb organismu. Není doporučeno podávat je déle než 3 měsíce, přičemž jejich aplikaci by měl řídit a kontrolovat lékař.
V některých případech, zpravidla při doporučení celkové energie v rozsahu 3–5 MJ/den, se přistupuje ke kombinaci jídla a nutričně definované náhrady jídla. Bylo prokázáno, že náhrada jednoho či dvou denních jídel porcí VLED zlepšuje účinnost kognitivně behaviorální intervence životního stylu (v jedné porci bývá obvykle kolem třetiny denních doporučených dávek esenciálních nutričních faktorů) (12).
Nízkoenergetické diety o obsahu 5–7 MJ/den lze už zajistit vhodně navolenou stravou tak, aby byly pokryty nezbytné fyziologické potřeby základních nutrientů. Pro zajištění nutriční kvality stravy je ale třeba navýšení nutričních znalostí a informovanosti pacienta o obsahu živin, minerálních látek, vitaminů, vlákniny a vody v potravinách a znalost dalších informací o výživě, včetně podpory zajištění dosažitelnosti zdravější volby.
Terapie pohybem a pravidelná fyzická aktivita je integrální součástí léčby obezity bez ohledu na redukci hmotnosti, protože navýšení kardiorespirační zdatnosti snižuje riziko rozvoje a progresi kardiovaskulárních onemocnění, DM2T a celkovou mortalitu. Při preskripci objemu a intenzity fyzické aktivity je třeba vycházet z aktuálního zdravotního stavu pacienta, jeho pohybových a kardiorespiračních možností. Na základě zjištěné úrovně kardiorespirační zdatnosti lze individuálně optimalizovat intenzitu a objem pohybové aktivity s ohledem na její očekávaný efekt. U obézních je doporučovaná frekvence cvičení alespoň 5krát v týdnu, v trvání 30–60 minut. Alternativou mohou být i intervalová cvičení trvající minimálně 10 minut, několikrát denně, s vyšší intenzitou zátěže. Vždy je nutné začínat z úrovně výchozího stavu, tj. v případě delší neaktivity postupným prodlužováním doby trvání od 10 minut a přidáváním intenzity z lehké na střední a vyšší. Zároveň je třeba volit takové typy pohybové aktivity, které vedou k navýšení či udržení kardiorespirační zdatnosti a přitom rizikově nezatěžují již tak nadměrnou hmotností přetížený podpůrně-pohybový systém pacientů s obezitou (chůze, plavání, cyklistika a další). Důležitou formou cvičení pro pacienty s obezitou je i dechová rehabilitace a posilování posturálního svalstva.
FARMAKOLOGICKÁ LÉČBA
U obézních pacientů je třeba zaléčit nejen obezitu, ale i velmi často se vyskytující komplikace v podobě arteriální hypertenze, dyslipidemie, DM2T, prokoagulačního stavu, které vedou k rozvoji kardiovaskulárních onemocnění a dalších orgánových poškození. Časté jsou i depresivní stavy a syndrom obstrukční spánkové apnoe, které rovněž zhoršují prognózu pacienta a vyžadují léčebnou intervenci.
Vlastní farmakologická léčba obezity, antiobezitika, může být předepsána u pacientů s hodnotou BMI ≥ 30 kg/m2 nebo ≥ 27 kg/m2 s přidruženými závažnějšími komplikacemi. Rozhodnutí zahájit farmakologickou léčbu má být individualizováno a realizováno pouze po důkladném vyhodnocení rizik a přínosů všech možností léčby. Také se doporučuje ukončit léčbu a/nebo použít jinou medikaci, pokud po 12 týdnech terapie na cílových dávkách nedojde k úbytku tělesné hmotnosti ≥ 5 %.
Z hlediska farmakoterapie byly v léčbě obezity zatím úspěšné léky s následujícími mechanismy účinku:
• léky centrálně tlumící chuť k jídlu
• léky omezující vstřebávání tuku v trávicím traktu
• léky působící podobným mechanizmem jako hormony trávicího traktu – inkretiny
Antiobezitika mají za cíl především:
• předcházet morbiditě a mortalitě pacientů s obezitou a snižovat rizika rozvoje komplikací obezity
• zvyšovat hmotnostní redukci dosaženou úpravou životního stylu
• zlepšovat již přítomné kardiometabolické komplikace
• redukovat tělesný tuk, zejména tuk viscerální
• zlepšovat kvalitu života a adherenci k zdraví protektivním režimovým opatřením (13)
Následuje popis léků v pořadí, jak byly uváděny na český trh. Před předepsáním některého z uvedených antiobezitik je se třeba vždy seznámit s platnou Souhrnnou informací o léčivém přípravku (SPC) zveřejněnou na stránkách Státního ústavu pro kontrolu léčiv (www.sukl.cz). Základní informace o dostupných antiobeziticích v ČR jsou v přehledu uvedeny v tabulkách 2 až 5.
Table 2. Antiobezitika schválená v ČR, jejich popis a přehled statisticky významných výsledků studií hodnotících průměrné poklesy tělesné hmotnosti (udávané v % výchozí hmotnosti) u pacientů léčených daným antiobezitikem oproti (vs) kontrolní skupině; ≥5 %: zastoupení osob, které dosáhli více než 5% redukce výchozí váhové hmotnosti při léčbě daným antiobezitikem oproti (vs.) kontrolní skupině (zpracováno dle studií 13–15, 23–25, 31–34, 47). 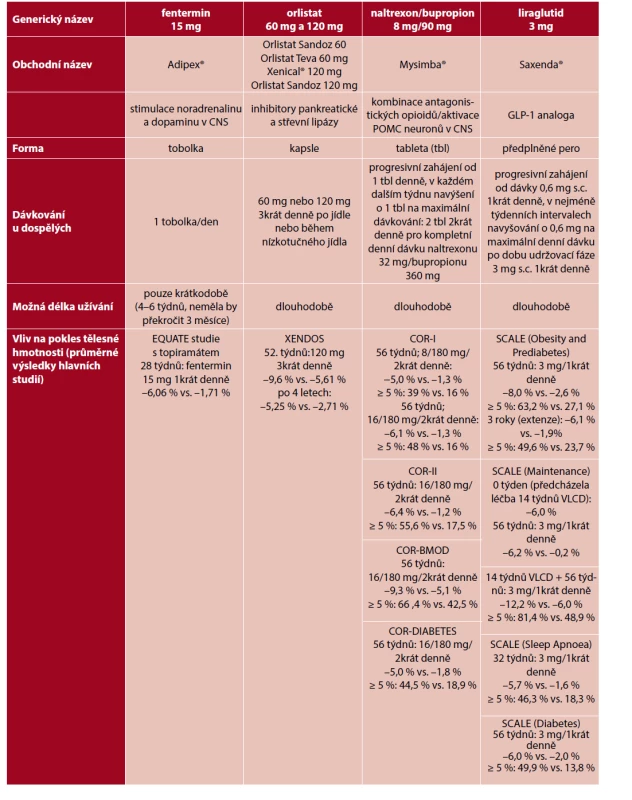
Table 3. Přehled velmi častých nežádoucích účinků a kontraindikací antiobezitik schválených v České republice 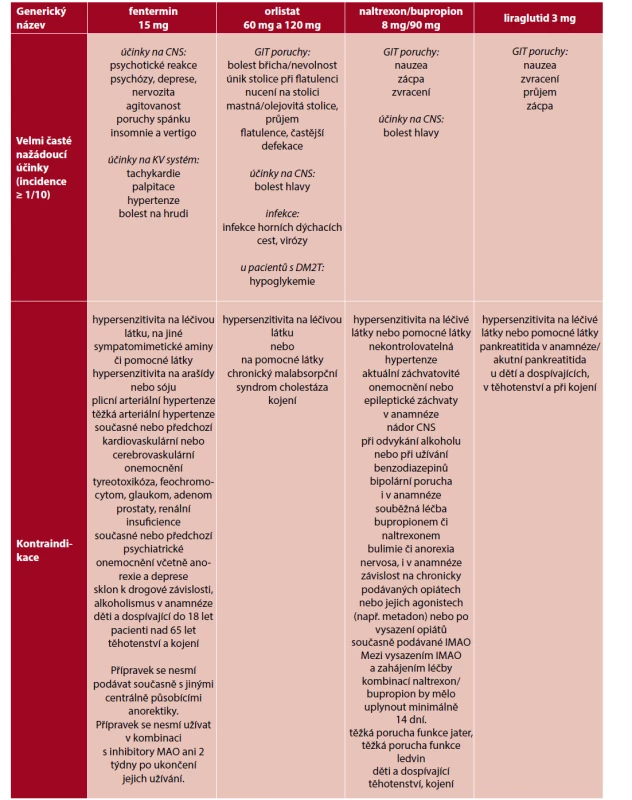
CNS – centrální nervový systém, GIT – gastrointestinální trakt, KV – kardiovaskulární, DM2T – diabetes mellitus 2. typu, IMAO – inhibitory monoaminooxidázy Table 4. Potřebný monitoring a doporučení dalších opatření při léčbě jednotlivými antiobezitiky 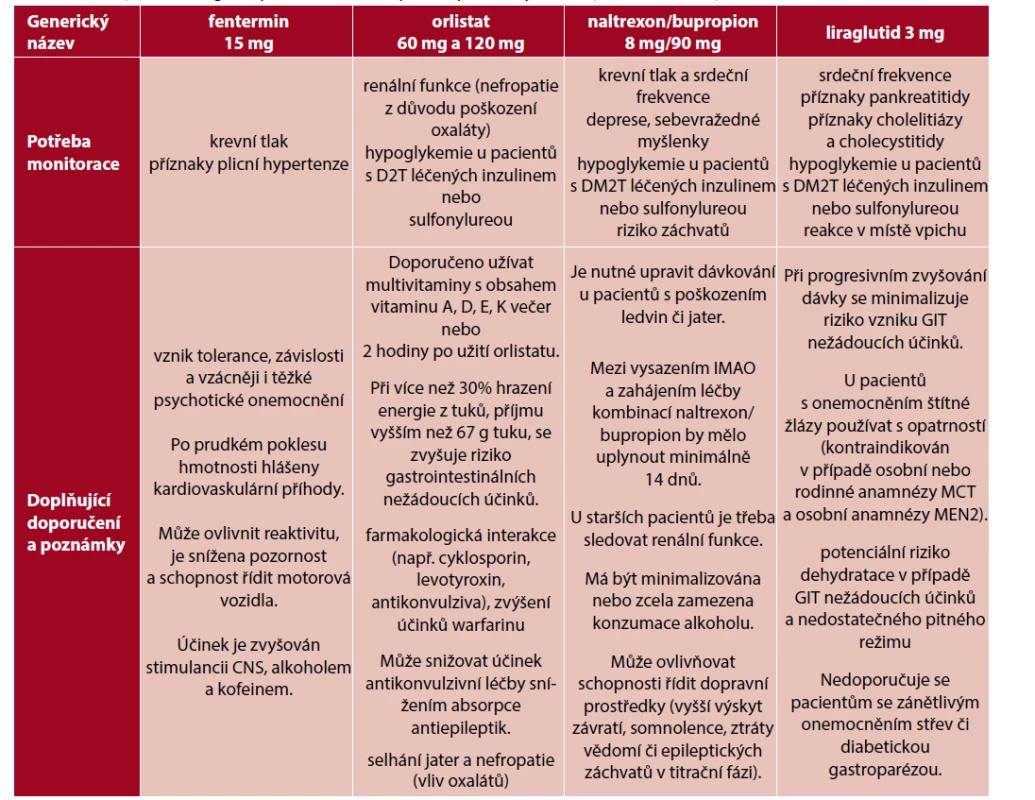
DM2T – diabetes mellitus 2. typu, IMAO – inhibitory monoaminooxidázy, MCT – medulární karcinom štítné žlázy, MEN2 – syndrom mnohočetné endokrinní dysplazie, CNS – centrální nervový systém, GIT – gastrointestinální trakt Table 5. Výběr antiobezitik v závislosti na přítomnosti k obezitě přidružených onemocnění dle zásad medicíny založené na důkazech (EBM) (převzato a upraveno podle aktuálních souhrnných údajů o přípravcích (SPC) a (46)) 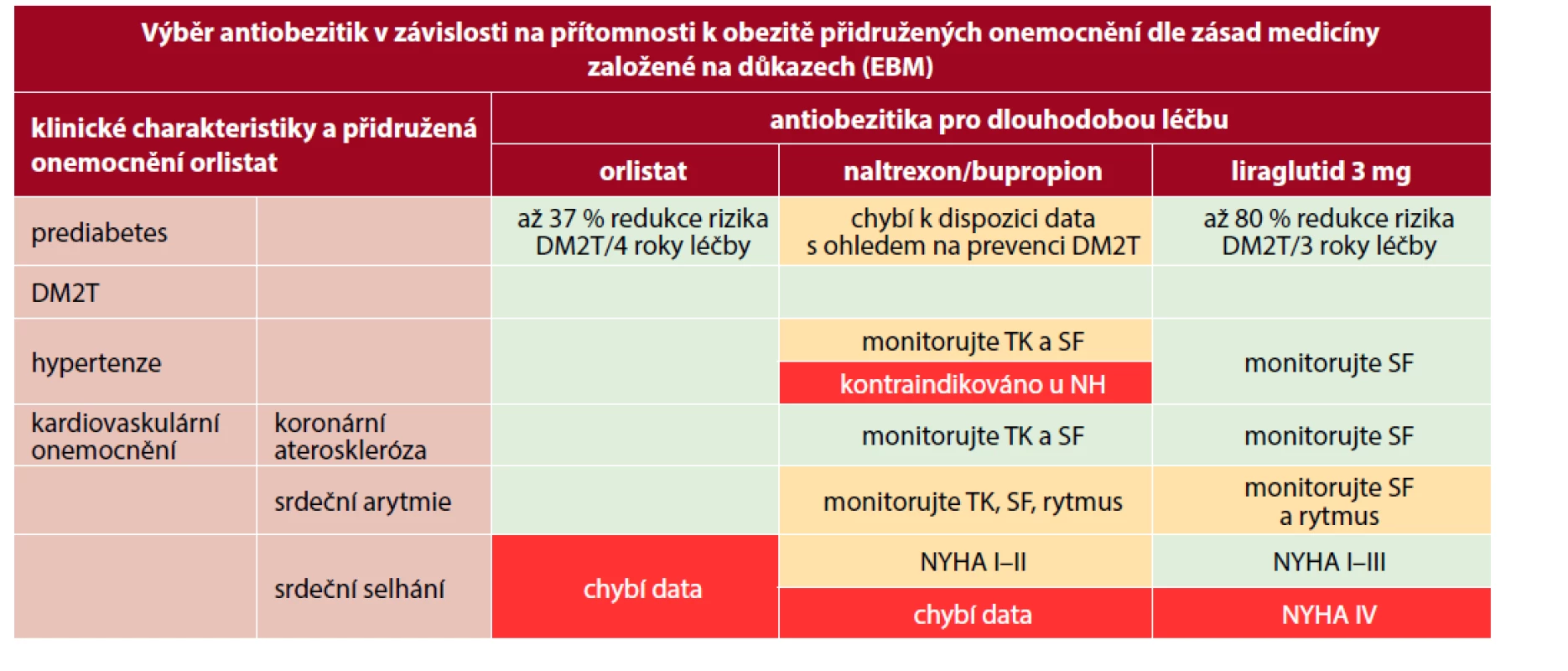

zelená – preferovaný lék, oranžová – použijte s opatrností, červená – nepoužívejte
DM2T – diabetes mellitus 2. typu, TK – krevní tlak, SF – srdeční frekvence, NH – nekontrolovatelná hypertenze, NYHA – New York Heart Association, eGFR – odhadovaná glomerulární filtrace, MEN2 – syndrom mnohočetné endokrinní neoplazie tyou II, MTC – medulární karcinom štítné žlázyFENTERMIN
Mechanismus účinku. Fentermin je léčebnou látkou ze skupiny fenylethylaminů. Stimuluje uvolňování noradrenalinu a dopaminu v centrálním nervovém systému (CNS). V České republice je tato látka na rozdíl od většiny evropských zemí stále registrována jako léčivý přípravek k léčbě obezity. Jedná se o anorexikum, u nějž je dlouhodobější léčba spojena s rizikem farmakologické tolerance, závislosti a s abstinenčními příznaky po vysazení. Jeho předpis je proto vázán na opiátový recept nebo žádanku s modrým pruhem.
Vliv na redukci tělesné hmotnosti. Vzhledem k tomu, že přípravek byl schválen americkou lékovou agenturou FDA (U. S. Food and Drug Administration) již v roce 1959, nejsou k dispozici recentní prospektivní klinické studie účinnosti a bezpečnosti. Také došlo ke snížení dávkování na 15 mg/den. Částečnou představu o účinnosti a efektech na kardiometabolické parametry mohou poskytnout pouze studie, kde byl fentermin zkoumán v kombinaci s topiramátem, u nás ale není tato kombinace zatím k dispozici.
Dávkování, kontraindikace a nežádoucí účinky. Od roku 2019 došlo také k úpravám jeho doporučeného dávkování na maximálně 1 tabletu denně. Tobolky se užívají při snídani, nerozkousané, zapijí se dostatečným množstvím tekutiny. Přípravek se nepodává večer, protože léčivá látka může způsobit nervozitu a nespavost. Léčba obvykle trvá 4–6 týdnů a neměla by překročit 3 měsíce. Pokud je plánována další léčba, je možné ji zopakovat až po přestávce, která je stejně dlouhá jako byla předcházející terapie s délkou užívání do 3 měsíců. Fentermin je indikován pro pacienty s BMI vyšším než 30 kg/m2. Přípravek se nesmí podávat současně s jinými centrálně působícími anorexiky, užívat v kombinaci s inhibitory MAO a ani 2 týdny po ukončení jejich užívání. Kontraindikován je také při kardiovaskulárních či cerebrovaskulárních onemocněních, plicní hypertenzi, těžké arteriální hypertenzi, psychiatrických onemocněních, poruchách příjmu potravy, sklonech k drogovým závislostem, abúzu alkoholu, při renálním selhávání, tyreotoxikóze, feochromocytomu, u starších 65 let, mladších 18 let, těhotných a kojících. Z nežádoucích účinků jsou nejčastěji popisovány účinky na centrální nervový systém (psychotické reakce, psychózy, deprese, nervozita, agitovanost, poruchy spánku, insomnie a vertigo) a na kardiovaskulární systém ve formě tachykardie, palpitace, hypertenze a bolesti na hrudi.
ORLISTAT
Mechanismus účinku. Orlistat je reverzní inhibitor lipáz trávicího traktu, který redukuje absorpci tuku z potravy o 30 %. Absorpce orlistatu ve střevě je menší než 1 % a jeho účinnost byla prokázána v různých randomizovaných studiích (14–16).
Vliv na redukci tělesné hmotnosti. V metaanalýze 12 studií s orlistatem a dietními opatřeními se prokázal po roce průměrný 8% pokles výchozí tělesné hmotnosti, který byl udržitelný v následujících 3 letech léčby (15). Ve studii XENDOS zahrnující 3304 pacienty bez DM2T byl po roce pozorován úbytek výchozí tělesné hmotnosti o 10,6 kg (vs. hmotnostní redukce 6,2 kg ve skupině s placebem). Po 4 letech léčby se udržel úbytek hmotnosti o 5,8 kg ve srovnání s výchozí hodnotou (vs. 3,0 kg ve skupině, která dostávala placebo) (16).
Efekty na další kardiometabolické parametry. Léčba orlistatem je rovněž spojována se signifikantním úbytkem obvodu pasu i hodnot krevního tlaku, celkového cholesterolu, LDL-cholesterolu a postprandiální koncentrace triglyceridů (4, 17–19). Po 4 letech léčby orlistatem se snížila incidence DM2T oproti skupině s placebem (celková incidence 2,9 % vs. 4,2 %) – relativní riziko rozvoje DM2T se snížilo o 37,3 % (16). Ve studiích s pacienty s DM2T léčba orlistatem podporuje větší pokles tělesné hmotnosti a snížení hladiny HbA1c po 12 měsících ve srovnání s placebem (17, 18). Nebylo však prokázáno vyšší snížení HbA1c, než odpovídá snížení hmotnosti. U pacientů se selháním ledvin a/nebo jater nebyla účinnost orlistatu studována.
Dávkování, kontraindikace a nežádoucí účinky. Orlistat je dostupný v balení 120 mg na lékařský předpis pod obchodním názvem Xenical, Orlistat Sandoz 120 mg a jako volně prodejný lék v síle 60 mg pod obchodním názvem Orlistat Sandoz 60 mg či Orlistat Teva 60 mg. Doporučené dávkování u síly 120 mg je 3krát denně bezprostředně před/během nebo až 1 hodinu po každém hlavním jídle za dodržování nízkoenergetické diety. Pokud se vynechá jedno jídlo, popř. jídlo neobsahuje tuk, není třeba orlistat užít.
Hlavní nežádoucí účinky jsou pozorovány na gastrointestinální úrovni: olejovitý anální výtok (4–27 %), bolest břicha (< 26 %), nadýmání a fekální výtok (2–24 %) a imperativní nucení na stolici (3–22 %) (viz tab. 3) (20, 21). Orlistat má poměrně málo kontraindikací, může ovlivnit absorpci jiných léků (amiodaron, antikonvulziva, antiretrovirové léky, propafenon, cyklosporin a l-tyroxin) a vitaminů rozpustných v tucích (betakaroten a vitaminy A, D, E, K) (20). Z toho důvodu se doporučuje oddělit podání těchto léků po dobu 3–4 hodin po užití orlistatu (20). Orlistat také může ovlivnit antikoagulační účinek antagonistů vitaminu K. Při dlouhodobé léčbě se doporučuje užívání vitaminů rozpustných v tucích.
KOMBINACE NALTREXON/BUPROPION S POSTUPNÝM UVOLŇOVÁNÍM
Mechanismus účinku. Bupropion je selektivní inhibitor zpětného vychytávání dopaminu a noradrenalinu a americký Úřad pro kontrolu potravin a léčiv (Food and Drug Administration – FDA) jej schválil již v roce 1985 jako antidepresivum a lék pro odvykání závislosti na tabáku (22). Naltrexon je antagonista opioidních receptorů schválený FDA pro léčbu závislostí na alkoholu a dalších opiátech (23). Mechanismus, kterým kombinace naltrexon/bupropion s postupným uvolňováním způsobuje pokles tělesné hmotnosti, souvisí jak se schopností bupropionu stimulovat anorexigenní neurony POMC/CART (proopiomelanokortinem regulovaná transkripce kokainu a amfetaminu), tak se schopností naltrexonu antagonizovat opioidní receptor. Naltrexon blokuje opioidy zprostředkovanou inhibici POMC neuronů v nucleus arcuatus, čímž potencuje výraznější a déletrvající aktivaci anorexigenní osy POMC/CART bupropionem (7).
Vliv na redukci tělesné hmotnosti. Vliv na redukci tělesné hmotnosti byl studován v rámci klinického programu COR (Contrave Obesity Research). V rámci tohoto klinického programu byly realizovány čtyři randomizované klinické studie. Ve všech studiích byla zkoumána účinnost a bezpečnost kombinace naltrexon/bupropion v celkové denní dávce 32 mg naltrexon/360 mg bupropion.
Studie COR-I (1) zkoumala vliv kombinace naltrexonu v dávce 16 nebo 32 mg/den s bupropionem v dávce 360 mg/den na tělesnou hmotnost pacientů s nadváhou či obezitou a s dyslipidemií nebo hypertenzí v randomizované, dvojitě zaslepené studii (24). Úbytek tělesné hmotnosti byl u léčených kombinací naltrexon/bupropion s postupným uvolňováním statisticky významný oproti skupině s placebem a činil 6,1 % výchozí hmotnosti ve skupině s naltrexonem v dávce 32 mg, 5,0 % ve skupině s naltrexonem v dávce 16 mg a 1,3 % ve skupině s placebem. Ve dvojitě zaslepené studii COR-II trvající 56 týdnů s 1496 randomizovanými pacienty s nadváhou nebo obezitou, dyslipidemií a/nebo hypertenzí, účastníci užívali placebo nebo kombinaci s postupným uvolňováním naltrexonu v dávce 32 mg/den a bupropionu v dávce 360 mg/den. Bylo zjištěno signifikantní snížení výchozí tělesné hmotnosti (–6,4 % vs. –1,2 %; p < 0,001), dále došlo zlepšení ukazatelů kardiometabolického rizika, kvality života a kontroly chuti k jídlu (24).
Studie COR-Diabetes hodnotila účinnost léčby naltrexonem v dávce 32 mg a bupropionem v dávce 360 mg během 56 týdnů u pacientů s DM2T a s nadváhou nebo obezitou. Někteří z pacientů užívali perorální antidiabetika. Do studie nebyli zařazeni pacienti léčení inzulinem a/nebo analogy GLP-1 (25). Léčba kombinací naltrexon/bupropion vyvolala u pacientů s DM2T a nadváhou/obezitou vyšší úbytek tělesné hmotnosti oproti placebové skupině (pokles o 5,0 % vs. 1,8 %; p < 0,001), s větším podílem pacientů (44,5 %), kteří dosáhli vyššího poklesu než 5 % výchozí hmotnosti ve srovnání s placebem. Léčba kombinací naltrexon/bupropion s postupným uvolňováním navodila ve srovnání s placebem větší snížení HbA1c (–0,6 % vs. –0,1 %) a rovněž větší podíl pacientů dosáhl snížení koncentrace HbA1c pod 7,0 %. Léčba kombinací naltrexon/bupropion zlepšovala některé z faktorů kardiovaskulárního rizika (25).
V poslední studii COR-BMOD byli všichni pacienti zařazeni do programu strukturovaných změn životního stylu a randomizováni k léčbě naltrexonem v dávce 32 mg a bupropionem v dávce 360 mg s postupným uvolňováním (n = 591) nebo k podávání placeba (n = 202) (26). V rámci této studie byl po 56 týdnech zaznamenán větší pokles tělesné hmotnosti u intervenované skupiny ve srovnání s kontrolní skupinou, která dostávala placebo (–9,3 % vs. –5,1 %; p < 0,001), kdy 80,4 % pacientů snížilo svou výchozí hmotnost o více než 5 % (26).
Působení na další kardiometabolické parametry. V rámci všech uvedených klinických studií bylo u pacientů léčených kombinací naltrexon/bupropion pozorováno v porovnání s placebovou skupinou zlepšení obvodu pasu, triglyceridemie, HDL-cholesterolemie a poměru LDL-C/HDL-C. U pacientů s DM2T došlo ke zlepšení parametrů kontroly glykemie (pokles HbA1c, inzulinu nalačno a HOMA-IR) v porovnání s placebem. V klinických studiích fáze III s kombinací naltrexon/bupropion byly pozorovány vzestupy systolického krevního o 1,1–2,6 mmHg tlaku a mírný vzestup tepové frekvence (22, 24).
Kardiovaskulární bezpečnost kombinace naltrexon/bupropion měla prokázat randomizovaná, multicentrická, dvojitě zaslepená, placebem kontrolovaná studie LIGHT (27). Do studie bylo zařazeno 8910 pacientů s obezitou ve vysokém kardiovaskulárním riziku. Pacienti měli být sledování po dobu až 4 let. Bohužel, na základě požadavku hlavních řešitelů této studie bylo klinické hodnocení předčasně ukončeno. Byl porušen protokol studie, neboť společností Orexigen byly zveřejněny průběžné důvěrné výsledky. Kardiovaskulární bezpečnost kombinace naltrexon/bupropion nebyla definitivně stanovena, a je proto potřeba provést novou obdobnou studii.
Dávkování, kontraindikace a nežádoucí účinky. Fixní kombinace naltrexon/bupropion je u nás dostupná pod obchodním názvem Mysimba a je na lékařský předpis. Jedna tableta kombinace naltrexon/bupropion obsahuje 8 mg naltrexonu a 90 mg bupropionu. Lék se postupně titruje 1. týden 1 tableta ráno, 2. týden 1 tableta ráno a 1 tableta večer, 3. týden 2 tablety ráno a 1 tableta večer a 4. týden 2 tablety ráno a 2 tablety večer. Maximální doporučená denní dávka přípravku Mysimba jsou 2krát denně 2 tablety v celkové dávce 32 mg naltrexonu a 360 mg bupropionu.
Nejčastějšími nežádoucími účinky kombinace naltrexon/bupropion jsou nauzea, zácpa (velmi časté), zvracení (velmi časté), závrať (časté) a sucho v ústech (časté). Gastrointestinální nežádoucí účinky (nauzea, zácpa, zvracení) většinou samy ustupují. Většina nežádoucích účinků ustupuje během 4 týdnů a téměř všechny během 24 týdnů podávání přípravku.
LIRAGLUTID
Mechanismus účinku. Liraglitud je 97% homologem nativního glucagon-like peptidu-1 (GLP-1), který má dvě hlavní odlišnosti: nahrazení lysinu na pozici 34 argininem a přidání laterálního řetězce palmitové kyseliny na pozici 26 (28, 29). Zmíněné odlišnosti snižují citlivost liraglutidu k degradaci dipeptidyl peptidázou-4 (DPP-4), a prodlužují tak jeho poločas, což umožňuje terapeutické podávání liraglutidu 1krát denně ve formě subkutánní injekce (29). Liraglutid v dávce 3,0 mg vede u pacientů s obezitou ke zvýšení pocitu sytosti, snížení pocitu hladu a k výslednému snížení energetického příjmu až o 16 % (30–32).
Vliv na redukci tělesné hmotnosti. Klinický program s podáváním liraglutidu v dávce 3,0 mg označovaný jako SCALE (Satiety and Clinical Adiposity, Liraglutide Evidence) ve své III. fázi zahrnuje čtyři multicentrické, randomizované, dvojitě zaslepené a placebem kontrolované studie s paralelními skupinami: SCALE Obesity and Prediabetes, SCALE Diabetes, SCALE Maintenance a SCALE Sleep Apnoea (32–37). Ve všech studiích SCALE byla léčba liraglutidem zahájena v dávce 0,6 mg a navyšována až do dosažení maximální denní dávky 3,0 mg. Maximální dávkování bylo dodrženo beze změn během celé studie. Do hodnocení výsledků byli zahrnuti všichni randomizovaní pacienti, kteří užili alespoň jednu dávku intervenčního léčiva nebo srovnávaného přípravku.
Studie SCALE Obesity and Prediabetes hodnotila pokles tělesné hmotnosti po 56 týdnech léčby u pacientů s obezitou (BMI ≥ 30 kg/m2) nebo s nadváhou (BMI ≥ 27 kg/m2) a s dyslipidemií a/nebo s hypertenzí, avšak bez DM2T (33). U všech pacientů byl dále proveden screening pro zjištění prediabetického stavu. Pacienti s prediabetem byli dále sledováni až po celkovou dobu 160 týdnů léčby. Po obou léčebných periodách následovalo 12týdenní observační pokračovací období s vysazením léku/placeba. V 56. týdnu došlo u pacientů léčených liraglutidem v dávce 3,0 mg k průměrnému poklesu tělesné hmotnosti o 8,4 kg, což odpovídá 8,0 % výchozí hodnoty, ve srovnání s 2,8 kg (2,6 %) ve skupině s placebem. U pacientů, kteří studii dokončili, byl úbytek hmotnosti ještě větší: 9,6 kg (9,2 %) při léčbě liraglutidem vs. 3,7 kg (3,5 %) při užívání placeba. Pacienti s prediabetem, kteří pokračovali v léčbě (celkově byli léčeni 160 týdnů), dosáhli úbytku tělesné hmotnosti 7,1 % ve srovnání s 2,7 % ve skupině s placebem (p < 0,0001). Během 56 týdnů léčby dosáhla remise prediabetu většina pacientů (69,2 % v intervenované skupině vs. 32,7 % ve skupině s placebem; p = 0,0001). Ve 160. týdnu léčby byl DM2T diagnostikován u 3 % pacientů léčených liraglutidem a u 11 % pacientů, kterým bylo podáváno placebo. Odhadovaný čas do nástupu DM2T byl u pacientů léčených liraglutidem v dávce 3,0 mg 2,7krát delší. Liraglutid po 3 letech léčby tedy snížil riziko rozvoje DM2T u prediabetiků téměř o 80 % ve srovnání s placebem (34).
Studie SCALE Diabetes trvající 56 týdnů byla navržena k hodnocení schopnosti liraglutidu v dávce 3,0 mg snížit tělesnou hmotnost pacientů s nedostatečně kontrolovaným DM2T s obezitou či nadváhou (35). Studie randomizovala pacienty (v poměru 2 : 1 : 1) k léčbě liraglutidem v dávce 3,0 mg (n = 423), liraglutidem v dávce 1,8 mg (n = 211) nebo k podávání placeba (n = 212). Pokles tělesné hmotnosti po 56 týdnech byl 6,0 % při léčbě liraglutidem 3,0 mg a 2,0 % při užívání placeba. Ve vztahu ke kompenzaci diabetu se po 56 týdnech léčby hladina HbA1c snížila v průměru o 13 mmol/mol u pacientů léčených liraglutidem v dávce 3,0 mg vs. o 4 mmol/mol u pacientů, jimž bylo podáváno placebo (p < 0,0001).
Ve studii SCALE Maintenance byla zkoumána schopnost liraglutidu v dávce 3,0 mg zvýšit úbytek tělesné hmotnosti, který byl dosažen během 12 týdnů léčby velmi přísnou nízkokalorickou dietou (VLCD) a pravidelnou fyzickou aktivitou u pacientů bez DM2T a s nadváhou (BMI > 27 kg/m2 a komorbidity) nebo obezitou (36). Pacienti během této první fáze průměrně zredukovali 6 % tělesné hmotnosti. V následující léčebné fázi byli pacienti v nultém týdnu randomizováni do skupin užívajících buď liraglutid, nebo placebo. Po 56 týdnech léčby liraglutidem bylo ve srovnání s výchozí hodnotou dosaženo dalšího úbytku tělesné hmotnosti o 6,2 % oproti 0,2 % u skupiny s placebem (p < 0,0001). Za celkové období léčby (14 týdnů VLCD + 56 týdnů léčby liraglutidem v dávce 3 mg) dosáhl hmotnostní pokles pacientů 12,2 % výchozí tělesné hmotnosti.
Čtvrtá studie SCALE Sleep Apnoea byla navržena ke zhodnocení vlivu léčby liraglutidem v dávce 3,0 mg na zlepšení parametrů, které se vztahují ke spánku a k tělesné hmotnosti u obézních pacientů se syndromem obstrukční spánkové apnoe (OSA) středního nebo závažného stupně, kteří nejsou schopni používat přístroj CPAP, popř. jej netolerují (37). Závažnost syndromu OSA byla určena podle indexu apnoe/hyperpnoe (AHI) (38). Po 32 týdnech bylo při léčbě liraglutidem v dávce 3,0 mg dosaženo signifikantního snížení hodnoty AHI ve srovnání s placebem (12,2 vs. 6,1 příhody/h; p = 0,015). Podobně vyšší podíl pacientů vyřešil svoji respirační poruchu dosažením hodnoty AHI < 5 příhod/h (5,4 % při léčbě liraglutidem vs. 1,2 % při užívání placeba) a také vyšší podíl (26,2 % vs. 19,3 % s placebem) dosáhl snížení své hodnoty AHI pod 15 příhod/h, čímž se klasifikovali jako skupina s mírným syndromem OSA, které bylo umožněno nepoužívat přístroj CPAP. Co se týče tělesné hmotnosti, léčba liraglutidem v dávce 3,0 mg způsobila pokles o 5,7 %, což bylo významně více než ve skupině s placebem 1,6 % (p < 0,0001).
Vliv na další kardiometabolické parametry. Kardiovaskulární bezpečnost liraglutidu je popsána ve studii LEADER (39). Délka expozice byla mezi 3,5–5 lety. Liraglutid v dávce 1,8 mg u pacientů s DM2T ve vysokém kardiovaskulárním riziku nebo již s anamnézou kardiovaskulární příhody oproti placebu významně snížil výskyt závažných nežádoucích kardiovaskulárních příhod (Major Adverse Cardiovascular Events – MACE, kompozit smrti z kardiovaskulárních příčin, nefatálního infarktu myokardu a nefatálních cévních mozkových příhod) o 13 %. Samotné riziko úmrtí z kardiovaskulárních příčin bylo sníženo až o 22 % (39), významně bylo sníženo i riziko celkové mortality (o 15 %). K podobným závěrům dospěla také metaanalýza dat SCALE, tzn., že léčba liraglutidem v dávce 3 mg je bezpečná. Na základě silných důkazů o prokázané kardioprotektivitě ve studii LEADER jsou GLP-1 analoga s prokázanou kardioprotektivitou včetně liraglutidu lékem druhé volby (po metforminu) v doporučeních ADA/EASD z roku 2018 pro pacienty s DM2T typu s převažujícím aterosklerotickým kardiovaskulárním onemocněním a také u pacientů s DM2T a obezitou, kde zároveň přispívají k redukci tělesné hmotnosti. Léčba liraglutidem v dávce 3,0 mg byla doprovázena zvýšením tepové frekvence o dva až tři tepy/min, aniž by byl zaznamenán vyšší výskyt kardiovaskulárních příhod (36). Tento účinek nezávisel na dávce a tepová frekvence se normalizovala po ukončení léčby. Zároveň bylo zjištěno, že došlo ke zlepšení některých parametrů nad úroveň, kterou lze očekávat při poklesu hmotnosti. Liraglutid tak ovlivňuje některé kardiovaskulární parametry přímo, tedy i nezávisle na poklesu hmotnosti. Jde zejména o krevní tlak, glykovaný hemoglobin, glykemii na lačno, hladinu LDL či celkového cholesterolu (40). Léčba liraglutidem v dávce 3,0 mg vedla ke zlepšení kvality života v následujících parametrech: fyzická kondice, sebeúcta, sexuální život, obecná úzkost v práci (41). Stejně tak vedla ke zlepšení hodnot systolického a diastolického krevního tlaku či lipidového profilu (významné snížení hladin celkového a LDL-cholesterolu, triglyceridů, společně se zvýšením hladin HDL-cholesterolu). Snížily se rovněž hladiny C-reaktivního proteinu a zvýšily se hladiny adiponektinu (33, 35, 36, 41, 42).
Dávkování, kontraindikace a nežádoucí účinky. Liraglutid pro léčbu obezity v dávce 3 mg je u nás dostupný pod obchodním názvem Saxenda. Počáteční dávka je 0,6 mg jednou denně. Dávka se postupně navyšuje v přírůstcích po 0,6 mg v nejméně jednotýdenních intervalech (0,6 mg – 1,2 mg – 1,8 mg – 2,4 mg – 3,0 mg), aby se zlepšila gastrointestinální snášenlivost. Liraglutid se podává jednou denně kdykoliv v průběhu dne, nezávisle na jídle a ideálně ve stejnou dobu. Aplikuje se injekčně do podkoží břicha, stehna nebo horní části paže. Maximální denní dávka liraglutidu je 3,0 mg/den.
Co se týče bezpečnosti a tolerance, vyšší podíl pacientů léčených liraglutidem v dávce 3,0 mg udával nežádoucí příznaky ve srovnání s placebem (91,6 % vs. 83,6 %). Bezpečnostní profil liraglutidu v dávce 3,0 mg byl shodný s účinky liraglutidu v dávce 1,8 mg, který je užíván v léčbě DM2T, a byl podobný jak při užívání po dobu 56 týdnů, tak i při dlouhodobějším podávání. Nejčastěji byly zaznamenány gastrointestinální nežádoucí účinky (nauzea, zvracení, průjem, zácpa). Incidence nevolnosti dosáhla svého maxima v období zvyšování dávky a byla vyšší při vyšších dávkách (33, 35, 36). V 12. týdnu dosáhla incidence nevolnosti při léčbě liraglutidem v dávce 3,0 mg kolem 10 %. Nevolnost byla přechodná, mírné (73 %) nebo střední závažnosti (24 %). Reakce se obvykle objevily během prvních týdnů léčby a zeslábly během několika dnů nebo týdnů pokračující léčby. Pouze 3 % pacientů ukončilo studii z důvodu nevolnosti.
Analoga GLP-1 receptoru účinkují v závislosti na glukóze, takže spontánně uváděná četnost hypoglykemie u pacientů bez DM2T užívajících liraglutid byla nízká, přičemž nebyla hlášena závažná hypoglykemie (33). Ve studii SCALE Diabetes měli pacienti léčení liraglutidem vyšší výskyt hypoglykemie ve srovnání s pacienty užívajícími placebo, a to zejména u skupiny, které byla zároveň podávána sulfonylurea (35). Při zahájení podávání liraglutidu má být zváženo snížení dávky derivátů sulfonylurey či inzulinu, aby se snížilo riziko hypoglykemie.
Během programu SCALE bylo pozorováno nepatrné zvýšení hladin amylázy a lipázy v séru, přičemž nebyla překročena průměrná horní hranice normálních hodnot a po ukončení léčby se hladiny normalizovaly (33, 35, 37).
Během studie SCALE Obesity and Prediabetes byla četnost výskytu biliární litiázy vyšší ve skupině s liraglutidem v dávce 3,0 mg než s placebem (2,5/100 vs. 1,0/100 paciento-roků léčby), přičemž nebyly zaznamenány rozdíly v četnosti hepatobiliárních příhod během studií SCALE Diabetes, Maintenance a Sleep Apnoea (33, 35–37). Liraglutid vykazuje velmi dobrý bezpečnostní profil s minimem kontraindikací jeho užívání. Jeho podávání není doporučenou pacientů s pankreatitidou nebo cholecystitidou či jejich přítomností v předchozím období, u pacientů s mnohočetnou endokrinní neoplazií a u pacientů, kteří mají anamnézu medulárního karcinomu štítné žlázy. Opatrnost při podávání se doporučuje i při pokročilém onemocnění ledvin nebo jater a u pacientů s cholelitiázou a gastroparézou.
ALGORITMUS VOLBY JEDNOTLIVÝCH ANTIOBEZITIK
Dnes, po dlouhé době, jsou k dispozici čtyři antiobezitika s různými mechanismy účinku a další nové léky budou pravděpodobně v čase přibývat. Je tedy více než důležité vědět, jakou účinnost tyto léky mají, jaké mají nežádoucí účinky a podle jakých kritérií zvolit vhodný lék pro konkrétního pacienta.
Doporučovaný postup při výběru vhodného antiobezitika
Při volbě vhodného antiobezitka pro konkrétního pacienta je možné se držet uvedeného schématu (obr. 1).
Antiobezitika jsou indikována, pokud pacient splňuje indikační kritéria:
• BMI ≥ 30 kg/m2 nebo
• BMI ≥ 27 kg/m2 za přítomnosti alespoň jedné komorbidity související s vyšší hmotností
V dalším kroku by měla o volbě vhodného antiobezitika rozhodnout přítomnost či nepřítomnost komplikací a komorbidit. Pokud nejsou, lze volit ze čtyř stávajících antiobezitik, kdy o výběru vhodného antiobezitika je třeba rozhodnout na základě:
• kontraindikací
• lékových interakcí
• účinnosti na pokles hmotnosti
• preference pacienta (tablety vs. injekční léčba, cena atd.)
Jsou-li přítomny již konkrétní komplikace obezity či komorbidity, mělo by být upřednostněno antiobezitikum s jednoznačně prokázaným benefitem podle medicíny založené na důkazech. V případě pacientů s prediabetem, DM2T a kardiovaskulárním onemocněním by měla být preference antiobezitik v tomto pořadí liraglutid – orlistat – kombinace naltrexon/bupropion. Pro liraglutid hovoří největší účinnost při snížení hmotnosti, přímý vliv na některé složky metabolického syndromu a zatím nejsilnější důkazy o kardiovaskulární bezpečnosti. Nicméně je třeba se vyvarovat použití liraglutidu u pacientů s předchozím onemocněním pankreatitidou nebo cholecystitidou, u pacientů s mnohočetnou endokrinní neoplazií a u pacientů s anamnézou medulárního karcinomu štítné žlázy. Opatrnosti při podávání se doporučuje při pokročilém onemocnění ledvin nebo jater, v přítomnosti cholelitiázy a gastroparézy.
Kombinace naltrexon-bupropion vyhovuje pacientům, kteří nezvládají dodržovat dietní opatření, prokazují jistou impulzivitu v přijímání potravy nebo se u nich vyskytují poruchy jako přejídání a z těchto důvodů se jim komplikuje dodržování diety. Před tím, než je medikace předepsána, je třeba přezkoumat kontraindikace jejího použití, nemožnost podání u pacientů s nekontrolovanou hypertenzí, při poruchách příjmu potravy (anorexia nervosa a bulimie), při závažné depresi, u pacientů léčených inhibitory monoaminooxidázy (IMAO) a u těch, kteří jsou ve fázi odvykání alkoholu nebo léčeni léky s opioidním účinkem. Zvláštní pozornost by měla být věnována přítomnosti srdeční arytmie, glaukomu s úzkým úhlem, přetrvávajícím migrénám, záchvatům generalizované úzkosti, bipolárním poruchám a poruchám funkce jater či ledvin.
Nejběžnější nežádoucí účinky obou přípravků – jak kombinace naltrexon/Ibupropion, tak liraglutidu, jsou přechodné a nepředstavují hlavní důvod pro ukončení léčby. Těmi jsou v současné době hlavně limity finanční. Další důvody, které ovlivňují indikaci dlouhodobé léčby, jsou potřeba užívat 4 tablety/den v případě přípravku Mysimba nebo subkutánně denně aplikovat přípravek Saxenda.
Orlistat lze s výhodou předepisovat u pacientů bez intestinálního onemocnění, kteří si nepřejí lék s možnými centrálními účinky a kteří volním úsilím obtížně zvládají jak nepravidelnost v jídle, tak preferenci tučné stravy. Orlistat může interferovat s podáváním warfarinu, a proto je třeba u pacientů léčených warfarinem při léčbě orlistatem dávku warfarinu upravovat.
K předepisování fenterminu je třeba přistupovat pouze výjimečně, z důvodu vysokého rizika vzniku závislosti a také řady závažných nežádoucích účinků.
Pokud u pacientů po 12 týdnech léčby antiobezitikem v cílové dávce nedochází k poklesu tělesné hmotnosti alespoň o 5 %, má být léčba ukončena. Na podkladě výsledků klinických studií je prokázáno, že u každého antiobezitika existují tzv. non-respondeři. Tito pacienti na léčbu daným antiobezitikem nereagují nebo reagují minimálně. Odhadnout, zda pacient bude na léčbu odpovídat, lze zatím pouze empiricky. U těchto pacientů je třeba buď vyzkoušet jiný léčebný přípravek, nebo hledat další možnosti léčby obezity. U liraglutidu bylo non-responderů ve studii SCALE Obesity and prediabetes kolem 32,5 % u nediabetiků a 49,6 % u pacientů s DM2T. Na druhou stranu pacienti, kteří na léčbu reagují dobře v prvních 16 týdnech, dosahují lepších průměrných výsledků dlouhodobě. Pokles hmotnosti responderů byl v průměru 11,5 % výchozí hodnoty u nediabetiků a 9,3% výchozí hodnoty u pacientů s DM2T (42). Antiobezitika, která lze užívat dlouhodobě, jsou liraglutid, naltrexon/bupropion a orlistat. V 1. roce léčby dochází k poklesu hmotnosti, následně pomáhají antiobezitika udržení dosaženého poklesu tělesné hmotnosti z prvního roku léčby (34).
Bohužel proti dlouhodobému užívání zatím hovoří chybění jakékoliv úhrady pojišťovnami a v případě moderních preparátů vysoká cena.
Účinek léčby antiobezitiky je třeba podpořit dalšími běžnými přístupy v léčbě obezity. Studie s liraglutidem v kombinaci s intenzivní behaviorální terapií a úpravou životního stylu prokazují, že v této kombinaci lze dosáhnout významně vyššího poklesu tělesné hmotnosti o 11,5 % oproti výchozí hodnotě vs. 6,1 % u intenzivní behaviorální terapie samotné (43). V podobné studii s naltrexon/bupropionem v kombinaci s intenzivní behaviorální terapií bylo dosaženo 9,4% redukce tělesné hmotnosti vs. 5,1% u intenzivní behaviorální terapie samotné (26). Antiobezitika lze také úspěšně využít v přípravě na bariatrické operace (44). Pomáhají také po bariatrických operacích k zabránění nárůstu hmotnosti či k mírnému zlepšení výsledků bariatrických operací (45). Kombinovat v současnosti u nás dostupná antiobezitika navzájem se nedoporučuje, neboť existují pouze minimální zkušenosti a zcela chybí randomizované klinické studie, které by prokázaly, že účinnost a bezpečnost případných kombinací převažují nad případnými riziky. Opakovaně bylo také prokázáno, že vysazení farmak snižujících tělesnou hmotnost nebo jejich nahrazení placebem obvykle vede k opětnému nárůstu tělesné hmotnosti. V této souvislosti je třeba upozornit, že farmaka upravují často geneticky podmíněnou metabolickou nebo regulační poruchu u obezity, a proto je třeba počítat s jejich dlouhodobým, často celoživotním podáváním podobně, jako je tomu u jiných komplexních chorob, např. u hypertenze. Při nezbytnosti jejich vysazení, nejčastěji z finančních důvodů, lze do jisté míry limitovat toto navýšení jak důkladnou edukací pacienta v režimových opatřeních, tak i postupným snižováním dávky antiobezitika při jeho vysazování. I nadále je však nutné sledovat pacienta s cílem minimalizovat nárůst tělesné hmotnosti.
ZÁVĚR
Obezita je chronické onemocnění, které v posledních 30 letech dosahuje rozměrů celosvětové pandemie. Z hlediska jednotlivce zhoršuje kvalitu života a pracovní výkonnost. Zmnožení tuku v organismu nad optimální mez a jeho zánětlivá změna spojená s dysfunkcí tukové tkáně je podkladem pro rozvoj zejména kardiometabolických komplikací obezity, které, jsou-li neléčené, významně zkracují život. V současné době je již řada léčebných postupů, které prognózu a kvalitu života nemocných s obezitou výrazně zlepšují, od režimových opatření, přes farmakoterapii až k bariatricko-metabolické chirurgii. Základním omezením pro použití léků v léčení obezity je zcela chybějící úhrada z veřejného zdravotního pojištění, což zásadně snižuje jejich dostupnost pro potřebné nemocné. Na úhradu antiobezitik nelze nadále pohlížet jako na ekonomicky neúnosné náklady. Jejich alespoň částečné hrazení ze zdravotního pojištění u dobře motivovaných pacientů s vyšším stupněm obezity a přítomností závažných komorbidit, kteří prokázali compliance k režimovým opatřením a dietě, považujeme za součást efektivního využívání zdrojů, a to zejména z pohledu předcházení vzniku a rozvoje DM2T, kardiovaskulárních komplikací, některých nádorových onemocnění, ventilační nedostatečnosti, přetížení pohybového aparátu, psychosociálních stigmatizací, pracovní neschopnosti a snížené kvality života. Definice podskupiny pacientů s největším benefitem z farmakoterapie by měla vyplynout z diskuze odborníků s aktivním zapojením odborných společností, které podpořily toto stanovisko.
Konflikt zájmů: žádný.
adresa pro korespondenci:
doc. MUDr. Vojtěch Hainer, CSc.
Endokrinologický ústav
Centrum pro diagnostiku a léčbu obezity
Národní 8, 116 94 Praha 1
e-mail: vhainer@endo.cz
Sources
1. König HH, Lehnert T, Brenner H, et al. Health service use and costs associated with excess weight in older adults in Germany. Age Ageing 2015; 44(4): 616–623. doi:10.1093/ageing/afu120
2. Specchia ML, Veneziano MA, Cadeddu C, et al. Economic impact of adult obesity on health systems: a systematic review. Eur J Public Health 2015; 25(2): 255–262. doi:10.1093/eurpub/cku170
3. Tremmel M, Gerdtham UG, Nilsson PM, et al. Economic burden of obesity: a systematic literature review. Int J Environ Res Public Health 2017; 14(4): 435. doi:10.3390/ijerph14040435
4. Flegal KM, Panagiotou OA, Graubard BI. Estimating population attributable fractions to quantify the health burden of obesity. Ann Epidemiol 2015; 25(3): 201–207. doi:10.1016/j. annepidem.2014.11.010
5. Hebebrand J, Holm JC, Woodward E, et al. A proposal of the European association for the study of obesity to improve the ICD-11 diagnostic criteria for obesity based on the three dimensions etiology, degree of adiposity and health risk. Obes Facts 2017; 10(4): 284–307. doi:10.1159/000479208
6. Yumuk V, Tsigos C, Fried M, et al. European guidelines for obesity management in adults. Obes Facts 2015; 8(6): 402–424. doi:10.1159/000442721
7. Greenway FL. Physiological adaptations to weight loss and factors favouring weight regain. Int J Obes (Lond) 2015; 39(8): 1188–1196. doi:10.1038/ijo.2015.59
8. Sumithran P, Prendergast LA, Delbridge E et al. Long-term persistence of hormonal adaptations to weight loss. N Engl J Med 2011; 365(17): 1597–1604. doi:10.1056/NEJMoa1105816
9. Jensen MD, Ryan DH, Apovian CM, et al. 2013 AHA/ACC/TOS guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and The Obesity Society. J Am Coll Cardiol 2014; 63(25 Pt B): 2985–3023. doi:10.1016/j.jacc.2013.11.004
10. Lean ME, Leslie WS, Barnes AC, et al. Primary care-led weight management for remission of type 2 diabetes (DiRECT): an open-label, cluster-randomised trial. Lancet 2018; 391(10120): 541–551. doi:10.1016/S0140-6736(17)33102-1
11. Schutz DD, Busetto L, Dicker D, et al. European practical and patient-centred guidelines for adult obesity management in primary care. Obes Facts 2019; 12(1): 40–66. doi: 10.1159/000496183.
12. Wadden TA, West DS, Neiberg , et al. One-year weight losses in the Look AHEAD study: factors associated with success. Obesity (Silver Spring) 2009; 17(4): 713–722. doi:10.1038/oby.2008.637
13. Hainer V. Základy klinické obezitologie. Praha: Grada Publidhing 2011.
14. Sjöström L, Rissanen A, Andersen T, et al. Randomised placebo-controlled trial of orlistat for weight loss and prevention of weight regain in obese patients. European Multicentre Orlistat Study Group. Lancet 1998; 352(9123): 167–172. doi:10.1016/s0140-6736(97)11509-4
15. Leblanc ES, O’Connor E, Whitlock EP, et al. Effectiveness of primary care-relevant treatments for obesity in adults: a systematic evidence review for the U.S. Preventive Services Task Force. Ann Intern Med 2011; 155(7): 434–447. doi:10.7326/0003-4819-155-7-201110040-00006
16. Torgerson JS, Hauptman J, Boldrin MN, et al. XENical in the prevention of diabetes in obese subjects (XENDOS) study: a randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patients. Diabetes Care 2004; 27(1): 155–161. doi:10.2337/diacare.27.1.155
17. Davidson MH, Hauptman J, DiGirolamo M, et al. Weight control and risk factor reduction in obese subjects treated for 2 years with orlistat: a randomized controlled trial. JAMA 1999; 281(3): 235–242. doi:10.1001/jama.281.3.235
18. Kelley DE, Bray GA, Pi-Sunyer FX, et al. Clinical efficacy of orlistat therapy in overweight and obese patients with insulin-treated type 2 diabetes: A 1-year randomized controlled trial. Diabetes Care 2002; 25(6): 1033–1041. doi:10.2337/diacare.25.6.1033
19. Tonstad S, Pometta D, Erkelens DW, et al. The effect of the gastrointestinal lipase inhibitor, orlistat, on serum lipids and lipoproteins in patients with primary hyperlipidaemia. Eur J Clin Pharmacol 1994; 46(5): 405–410. doi:10.1007/BF00191901
20. Hvizdos KM, Markham A. Orlistat: a review of its use in the management of obesity. Drugs 1999; 58(4): 743–760. doi:10.2165/00003495-19995804 0-00015
21. McNeely W, Benfield P. Orlistat. Drugs 1998; 56(2): 241–250. doi:10.2165/00003495-19985 6020-00007
22. Greig SL, Keating GM. Naltrexone ER/Bupropion ER: a review in obesity management. Drugs 2015; 75(11): 1269–1280. doi:10.1007/ s40265-015-0427-5
23. Caixàs A, Albert L, Capel I, et al. Naltrexone sustained-release/bupropion sustained-release for the management of obesity: review of the data to date. Drug Des Devel Ther 2014; 8 : 1419–1427. doi:10.2147/DDDT.S55587
24. Greenway FL, Dunayevich E, Tollefson G, et al. Comparison of combined bupropion and naltrexone therapy for obesity with monotherapy and placebo. J Clin Endocrinol Metab 2009; 94(12): 4898–4906. doi:10.1210/jc.2009-1350
25. Hollander P, Gupta AK, Plodkowski R, et al. Effects of naltrexone sustained-release/bupropion sustained-release combination therapy on body weight and glycemic parameters in overweight and obese patients with type 2 diabetes. Diabetes Care 2013; 36(12): 4022–4029. doi:10.2337/dc13-0234
26. Wadden TA, Foreyt JP, Foster GD et al. Weight loss with naltrexone SR/bupropion SR combination therapy as an adjunct to behavior modification: the COR-BMOD trial. Obesity (Silver Spring) 2011; 19(1): 110–120. doi:10.1038/oby.2010.147
27. Nissen SE, Wolski KE, Prcela L, et al. Effect of naltrexone-bupropion on major adverse cardiovascular events in overweight and obese patients with cardiovascular risk factors: a randomized clinical trial. JAMA 2016; 315(10): 990–1004. doi:10.1001/jama.2016.1558
28. Bode B. An overview of the pharmacokinetics, efficacy and safety of liraglutide. Diabetes Res Clin Pract 2012; 97(1): 27–42. doi:10.1016/j. diabres.2011.12.015
29. Jacobsen LV, Flint A, Olsen AK, et al. Liraglutide in type 2 diabetes mellitus: clinical pharmacokinetics and pharmacodynamics. Clin Pharmacokinet 2016; 55(6): 657–672. doi:10.1007/s40262-015-0343-6
30. van Can J, Sloth B, Jensen CB, et al. Effects of the once-daily GLP-1 analog liraglutide on gastric emptying, glycemic parameters, appetite and energy metabolism in obese, non-diabetic adults. Int J Obes (Lond) 2014; 38(6): 784–793. doi:10.1038/ijo.2013.162
31. Flint A, Kapitza C, Hindsberger C, et al. The once-daily human glucagon-like peptide-1 (GLP-1) analog liraglutide improves postprandial glucose levels in type 2 diabetes patients. Adv Ther 2011; 28(3): 213–226. doi:10.1007/s12325-010-0110-x
32. Horowitz M, Flint A, Jones KL, et al. Effect of the once-daily human GLP-1 analogue liraglutide on appetite, energy intake, energy expenditure and gastric emptying in type 2 diabetes. Diabetes Res Clin Pract 2012; 97(2): 258–266. doi:10.1016/j.diabres.2012.02.016
33. Pi-Sunyer X, Astrup A, Fujioka K et al. A randomized, controlled trial of 3.0 mg of liraglutide in weight management. N Engl J Med 2015; 373(1): 11–22. doi:10.1056/NEJMoa1411 892
34. le Roux CW, Astrup A, Fujioka K et al. 3 years of liraglutide versus placebo for type 2 diabetes risk reduction and weight management in individuals with prediabetes: a randomised, double-blind trial. Lancet 2017; 389(10077): 1399–1409. doi:10.1016/S0140-6736(17)30069-7
35. Davies MJ, Bergenstal R, Bode B et al. Efficacy of liraglutide for weight loss among patients with type 2 diabetes: The SCALE Diabetes Randomized Clinical Trial. JAMA 2015; 314(7): 687–699. doi:10.1001/JAMA.2015.9676
36. Wadden TA, Hollander P, Klein S, et al. Weight maintenance and additional weight loss with liraglutide after low-calorie-diet-induced weight loss: The SCALE Maintenance randomized study. Int J Obes (Lond) 2013; 37 : 1443–1451. doi:10.1038/ijo.2013.120
37. Blackman A, Foster GD, Zammit G, et al. Effect of liraglutide 3.0 mg in individuals with obesity and moderate or severe obstructive sleep apnea: the SCALE sleep apnea randomized clinical trial. Int J Obes (Lond) 2016; 40(8): 1310–1319. doi:10.1038/ijo.2016.52
38. Sleep-related breathing disorders in adults: recommendations for syndrome definition and measurement techniques in clinical research. The Report of an American Academy of Sleep Medicine Task Force. Sleep 1999; 22(5): 667–689.
39. Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016; 375(4): 311–322. doi:10.1056/NEJMoa1603827
40. Bays H, Pi-Sunyer X, Hemmingsson JU, et al. Liraglutide 3.0 mg for weight management: weight-loss dependent and independent effects. Curr Med Res Opin 2017; 33(2): 225–229. doi:10.1080/03007995.2016.1251892
41. Kolotkin RL, Fujioka K, Wolden ML, et al. Improvements in health-related quality of life with liraglutide 3.0 mg compared with placebo in weight management. Clin Obes 2016; 6(4): 233–242. doi:10.1111/cob.12146
42. Fujioka K, O‘Neil PM, Davies M, et al. Early weight loss with liraglutide 3.0mg predicts 1-year weight loss and is associated with improvements in clinical markers. Obesity (Silver Spring) 2016; 24(11): 2278–2288. doi:10.1002/oby.21629
43. Wadden TA, Walsh OA, Berkowitz RI, et al. Intensive behavioral therapy for obesity combined with liraglutide 3.0mg: a randomized controlled trial. Obesity (Silver Spring) 2019; 27(1): 75–86. doi:10.1002/oby.22359
44. Modi R, Rye P, Cawsey, et al. Liraglutide effects on upper gastrointestinal investigations: implications prior to bariatric surgery. Obes Surg 2018; 28(7): 2113–2116. doi:10.1007/s11695-018-3249-1
45. Suliman M, Buckley A, Tikriti AA, et al. Routine clinical use of liraglutide 3mg for the treatment of obesity: outcomes in non‐surgical and bariatric surgery patients. Diabetes Obes Metab 2019; 21(6): 1498–1501. doi:10.1111/dom.13672
46. Garvey WT, Mechanick, JI, Brett EM, et al. American Association of Clinical Endocrinologists and American College of Endocrinology comprehensive clinical practice guidelines for mediccal care of patients with obesity. Endocr Pract 2016; 22(Suppl 3): 1–203. doi:10.4158/EP161365.GL
47. Aronne LJ, Waden T, Peterson C, et al. Evaluation of phentermine and topiramate versus phentermine/topiramate extended-release in obese adults. Obesity 2013; 21 : 2163–2171. doi.10.1002/oby.20584
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2021 Issue 1-
All articles in this issue
- Nový parametr hodnocení kompenzace diabetes mellitus: Čas v cílovém rozmezí (time-in-range)
- Prediabetes v ordinaci praktického lékaře
- Konzervatívne možnosti ovplyvnenia chronickej myalgickej encefalopatie
- Sebereflexe potřeb pacientů s tělesným znevýhodněním v průběhu hospitalizace
- Komparace couhousingů ve vybraných zemích EU v kontextu péče o seniory 65+
- Možnosti rehabilitace pacientů s onemocněním COVID-19
- Společné stanovisko odborných společností k farmakologické léčbě obezity
- Četnost a potenciál využití digitálního zdravotního sebe-sledování (self-tracking) ve věkové skupině mladých dospělých
- Dějiny hydroterapie
- Nové povrchy v boji proti mikrobům byly vyvinuty v evropské spolupráci, která pokračuje Modifikace materiálu pro 3D tisk stříbrnými nanočásticemi
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nový parametr hodnocení kompenzace diabetes mellitus: Čas v cílovém rozmezí (time-in-range)
- Společné stanovisko odborných společností k farmakologické léčbě obezity
- Prediabetes v ordinaci praktického lékaře
- Možnosti rehabilitace pacientů s onemocněním COVID-19
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


