-
Medical journals
- Career
Nanomedicínský přístup v cílené terapii karcinomu prsu: využití uhlíkových nanostruktur
Authors: M. Löffelmann 1; S. Skaličková 2; M. Gargulák 1; M. Dočekalová 1; M. Kepinská 3; B. Ruttkay-Nedecký 1; P. Suchý 2; R. Kizek 1,2,3
Authors‘ workplace: Veterinární a farmaceutická univerzita Brno Farmaceutická fakulta ; Centrální laboratoře Přednosta: prof. Ing. René Kizek, DrSc., MBA 1; Ústav humánní farmakologie a toxikologie Přednosta: doc. MVDr. Pavel Suchý, Ph. D. 2; Ústav biomedicínských a environmentálních analýz Wroclaw Medical University, Wroclaw, Polsko Přednosta: prof. Dr. hab. Halina Milnerowicz, MD 3
Published in: Prakt. Lék. 2017; 97(6): 264-269
Category: Of different specialties
Overview
Cíl:
Cílem této práce bylo vyvinout nanoléčivo založené na specifickém transportu pomocí oligonukleotidové próby (komplementární k BRCA1 genové mutaci) s předpokládaným účinkem cytostatika bez výrazných toxických efektů k nenádorovým buňkám. Použitým cytostatikem bylo antracyklinové antibiotikum doxorubicin. Přes svou terapeutickou účinnost však vykazuje vysokou kardiotoxicitu. Možnost, jak zvýšit terapeutické okno, představují nanotransportéry.Metodika:
Doxorubicin a oligonukleotidová próba byly navázány k fullerenům. Doba modifikace nanotransportérů byla 24 h. Nanotransportér byl následně charakterizován pomocí biofyzikálních technik (SEM, dynamického rozptylu světla, spektrální a elektrochemické metody). Pomocí elektrochemické a fluorescenční analýzy byl vzniklý komplex nanotransportéru potvrzen.Výsledky:
Doxorubicin se záporně nabitým povrchem interaguje s kladně nabitými fullereny elektrostatickou interakcí a tato interakce byla potvrzena na základě elektronové mikroskopie (SEM), elektrochemicky (změna potenciálu byla 35 mV) a měřením dynamického rozptylu světla (změna ζ-potenciálu byla 22 mV). Ke komplexu byla amidovou vazbou připojena oligonukleotidová proba, která je komplementární k mutované sekvenci BRCA genu. Pokles fluorescenčního signálu nanokonstruktu o 80 % indikoval navázání oligonukleotidu. Pro prokázání funkčnosti byla navržena magnetická zlatá nanočástice modifikovaná komplementární sekvencí k testovanému nanotransportéru.Závěr:
Předpokládáme, že navržený nanokonstrukt bude možné využít pro DNA cílené směřování protinádorového léčiva k buňkám s mutací v genu BRCA. Nanotransportér má tyto základní vlastnosti: a) fulleren vykazuje vysokou afinitu k buňce a proniká cytoplazmatickou membránou; b) doxorubicin se uvolní do cytoplazmy v nádorových buňkách díky nízkému pH; c) celý konstrukt je směřován cíleně na mutovanou sekvenci genu BRCA; d) zlatá nanočástice zesiluje cytotoxický efektKLÍČOVÁ SLOVA:
doxorubicin – zhoubné nádory prsu – fullereny – magnetické zlaté nanočástice – oligonukleotid – nanomedicínaÚVOD
V současné době dochází k velkému rozvoji nanotechnologií a jejich uplatnění v nejrůznějších oborech. Výjimkou není ani zdravotnictví. V tomto odvětví hovoříme o nanomedicíně (1). Nanomedicína se momentálně zabývá třemi směry: cílený transport léčiv, diagnostika a regenerativní medicína (2,3). Její uplatnění nalézají odborníci v nejrůznějších zdravotnických oborech: onkologie, diabetologie, infekční lékařství a také při léčbě nejrůznějších chorob, jako jsou Alzheimerova choroba, ateroskleróza nebo artritida. Principem cíleného transportu léčiv je vytvoření nanotransportéru, v němž je uzavřené léčivo, které na základě interakce mezi patogenní buňkou a nanotransportérem je uvolněno v místě požadovaného účinku (2,4). Představuje tak velmi efektivní léčbu nádorových a jiných onemocnění. Velký význam mají v současném výzkumu nanočástice, modifikace proteinů, využití polymerů a genetická manipulace s léčivy (5).Perspektiva nanomedicíny spočívá v cílené léčbě a zcela novému přístupu lékaře vůči pacientovi.
Zhoubné nádory prsu jsou v rozvinutých zemích nejčastějším nádorovým onemocněním, postihující převážně ženy (3,6). Odhaduje se, že přibližně 5–10 % karcinomů prsu je podmíněno genetickou zátěží, způsobenou mutací genu BRCA1 (7). Jedná se o tumor supresorový a reparační gen, nacházející se na chromozomu 17. Gen je běžně exprimován v buňkách prsu a jiných tkáních. Jeho funkcí je opravovat poškozenou DNA během buněčného cyklu, popřípadě spustit buněčnou smrt. Pokud se objeví mutace v genové sekvenci BRCA1, dojde k zastavení reparačního procesu, a tím se zvyšuje riziko vzniku nádorového onemocnění (8). Bylo prokázáno, že mutovaný BRCA1 gen exprimuje defektní protein, jehož neschopnost opravit DNA vede k dalším mutacím. Následná kumulace mutací umožňuje nekontrolovatelný růst a dělení buněk a vznik nádoru. Ze statistik je známo, že s nejzávažnějším stadiem karcinomu prsu se často potýkají mladé pacientky a ženy s malými dětmi. Podle odhadů Národního onkologického registru se tato diagnóza týká zhruba 3370 českých žen. Metastatický nádor prsu stále patří mezi nevyléčitelná onemocnění. Díky léčbě lze však průběh této nemoci zastavit, pacientkám prodloužit život a zlepšit jeho kvalitu.
Cytostatikum doxorubicin
Konvenční léčba zhoubných nádorů prsu zahrnuje lokální způsoby typu: chirurgické léčby, radioterapie v kombinaci s chemoterapií, hormonální a cílenou terapii (biologická léčba). Nejpoužívanějším léčivem pro pacienty s metastázemi u zhoubných nádorů prsu je doxorubicin (Adriamycin®, Rubex®). Doxorubicin patří do skupiny protinádorových antibiotik, která jsou produkována grampozitivními bakteriemi rodu Streptomyces. Odezva léčby se u pacientů pohybuje v rozmezí 25–33 %, s mediánem k progresi 3,6 měsíců a mediánem přežití 8,9 měsíců. Přes svou terapeutickou účinnost však vykazuje vysokou kardiotoxicitu (9) (obr. 1). Tento vedlejší efekt limituje kumulativní aplikovaná dávka. Uvádí se, že poškození srdečního svalu se vyskytuje u 3 % pacientů při dávce 400 mg/m2, 7 % při dávce 500 mg/m2 a u více jako 15 % pacientů dochází k poškození srdečního svalu při dávce 700 mg/m2 (10).
Image 1. Schéma účinku doxorubicinu na srdeční sval a symptomy kardiotoxicity. Dochází k poškození na molekulární úrovni: chronické přetížení vápenatými ionty, energetická nerovnováha a vazba na kardiolipin nacházející se ve vnitřní membráně mitochondrií srdečních buněk. Dlouhodobý účinek doxorubicinu může vyvolat selhání srdce. 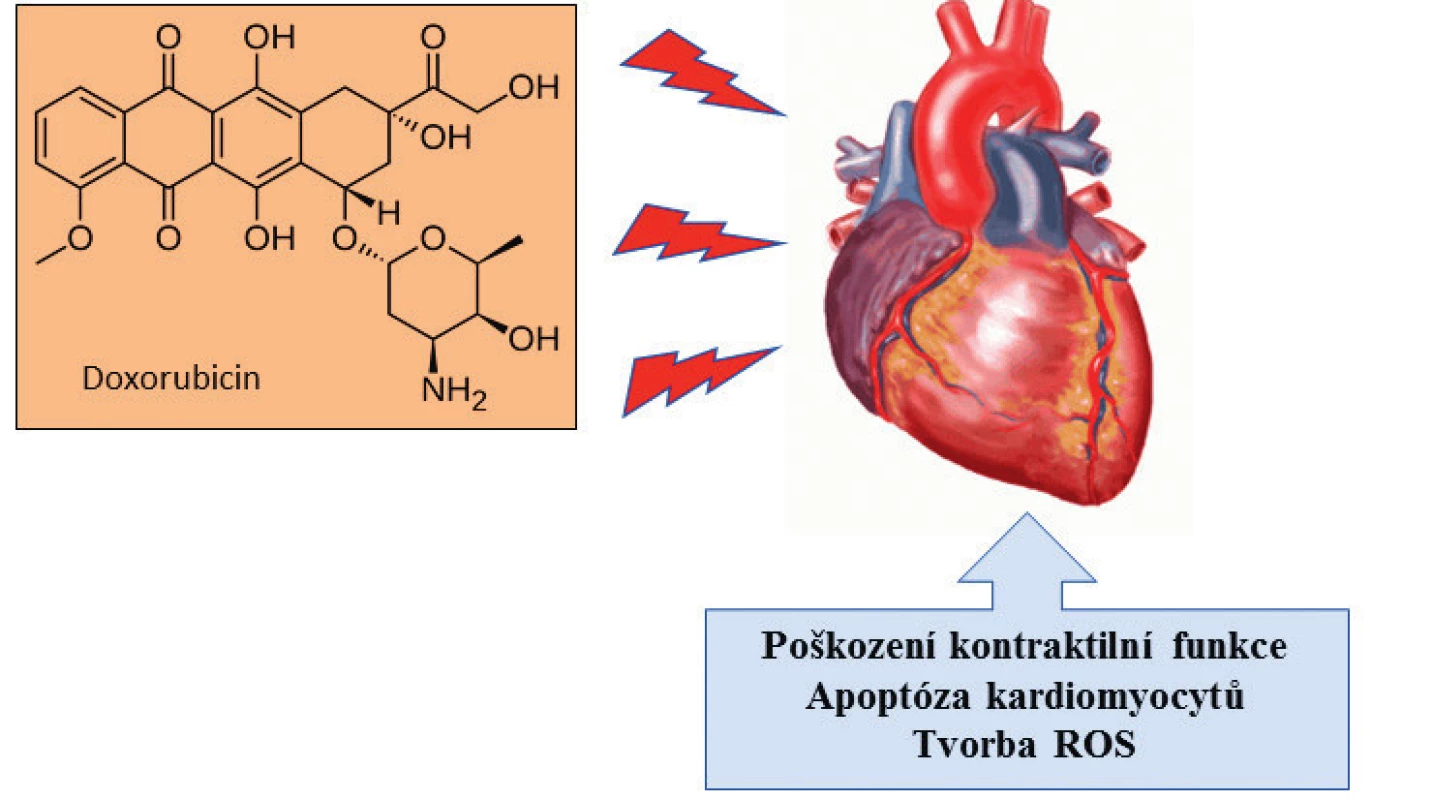
Hlavní biologické efekty doxorubicinu jsou shrnuty na zjednodušeném schématu na obrázku 2. Vývoj nových nanotransportérů léčiv je zaměřen na snížení kardiotoxicity antracyklinových antibiotik a zvýšení jejich terapeutické účinnosti. Metody nanomedicíny za využití různých nanokonstruktů (polypeptidové, zinkové, uhlíkové apod.) by mohly snížit vedlejší efekty spojené s léčbou známými cytostatiky u nádorového onemocnění (4, 5, 11).
Image 2. Schéma působení doxorubicinu (DOXO) uvnitř nádorové buňky. DOXO v jádru buňky blokuje topoizomerázu (TOP2A) a způsobuje tak poškození DNA a vede k aktivaci řady genů <i>(MLH1, MSH2, ERCC2, TP53)</i> směřující buňku k buněčné smrti. Kyslíkové radikály (ROS, generované DOXO) působí poškození DNA v jádře a zároveň vede buňku k oxidačnímu stresu a následně spouští procesy apotózy. 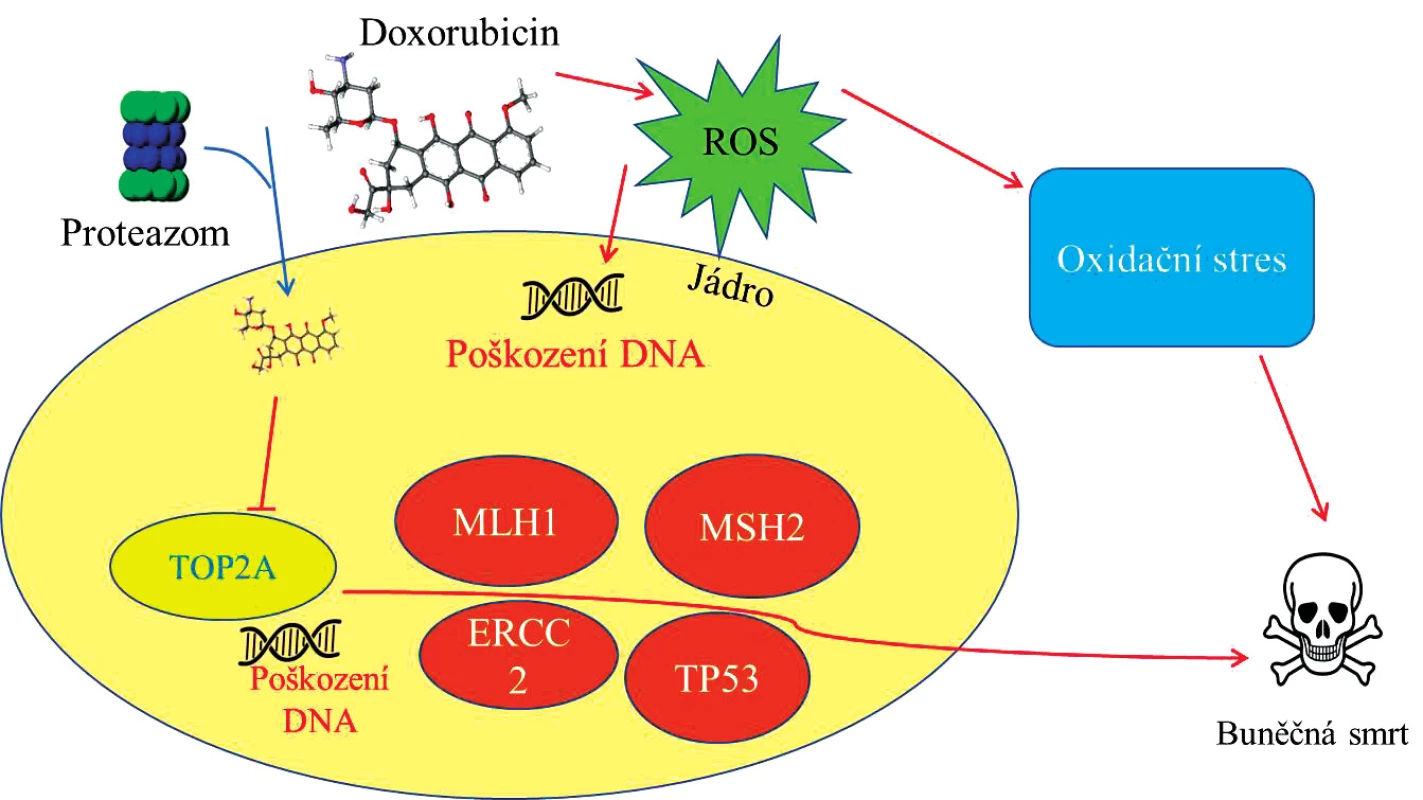
Fullereny jako nanotransportéry doxorubicinu
Bylo popsáno mnoho různých forem uhlíku s rozdílnými fyzikálně-chemickými vlastnostmi (obr. 3). Fullereny jsou nanočástice tvořené atomy uhlíku, jejichž fyzikálně-chemické vlastnosti jim udávají vysokou stabilitu (12). Za objev a studium vlastností fullerenů byla v roce 1996 udělena Nobelova cena R. F. Curlovi, R. E. Smalleymu a H. R. Krotoovi. Jednou z významných vlastností fullerenů je možnost oxidace povrchu, a tím je umožněna vazebná interakce s chemoterapeutiky (13, 14). Řada studií prokázala synergický efekt doxorubicinu a fullerenu v inhibici metastáz a snížení toxicity u zvířecích modelů (15). Tento efekt může být vysvětlen schopností aromatických molekul tvořit nekovalentní heterokomplex v roztocích. Vznikem heterokomplexu doxorubicinu s fullerenem se také snižuje jeho negativní vliv na srdeční tkáň. Komplex fullerenu a doxorubicinu představuje perspektivní metodu léčby u nádorových onemocnění (16). Cílem této práce je vyvinout nanotransportérový systém využívající uhlíkové struktury fullerenu pro vazbu doxorubicinu.
Image 3. Různé modifikace uhlíku: A – molekula fullerenu C<sub>60</sub>, tvořená sítí uhlíkových atomů uspořádaných do šestiúhelníků doplněných pětiúhelníky, B – grafit (tuha), nejčastější přírodní modifikace složená z vrstev, které jsou tvořeny uhlíky navázanými do šestiúhelníků, C – uhlíkové nanotrubice, D – diamant je tvořen uhlíkem krystalizujícím v krychlové soustavě 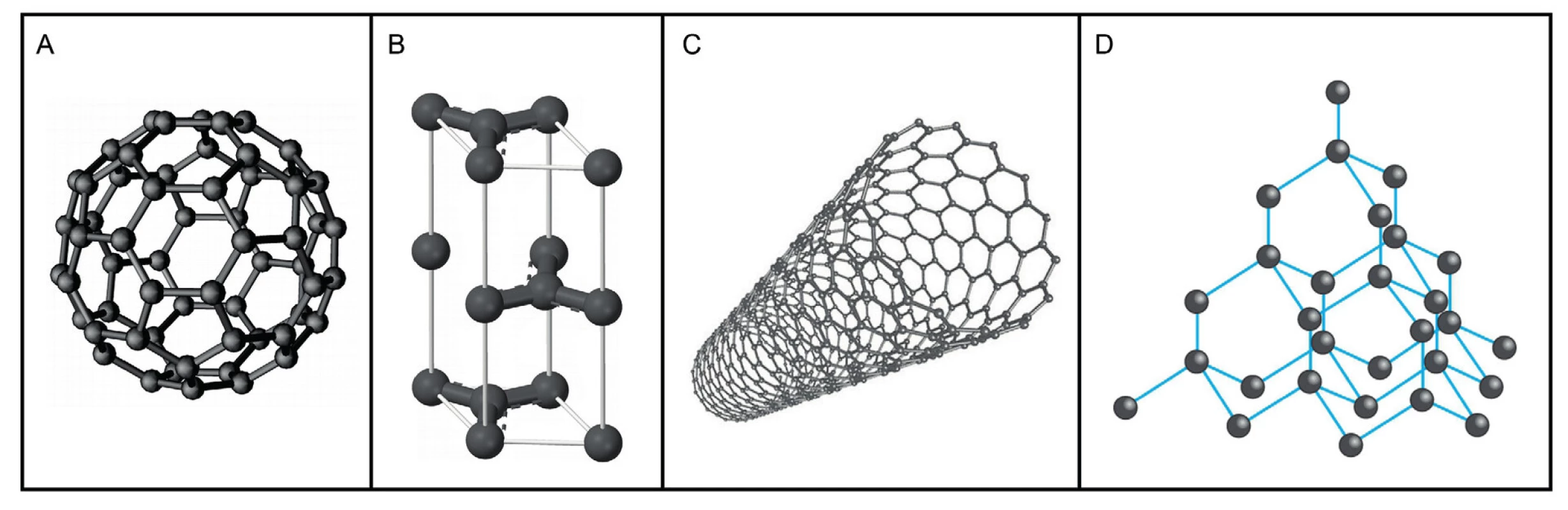
METODIKA
Chemikálie
Oligonukleotidy použité v experimentu byly navrženy dle bodové mutace BRCA1 rs1799949. Sekvence ODN1 : 5´-NH2-GTAC TGTCA CTAT GAAA G-3’ a sekvence ODN2 : 3´-CATG ACAG TGAT ACTT TC-Thi-5’. Oligonukleotidy a další chemikálie použité v experimentu byly zakoupeny od firmy Sigma-Aldrich (St. Louis, USA) o čistotě odpovídající ACS, není-li uvedeno jinak. K pipetování byly použity pipety od firmy Eppendorf Research (Hamburg, Německo) s nejvýše certifikovanou chybou pipetování (± 12 %). Deionizovaná voda byla připravena pomocí reverzní osmózy Aqual 25 (Aqual, Brno, Česká republika) (18).
Příprava magnetických zlatých nanočástic
Nonahydrát dusičnanu železitého byl rozpuštěn ve vodě. Po 10 minutách míchání byl přidán roztok tetrahydridoboritanu sodného rozpuštěného v amoniaku. Barva roztoku se změnila na černou s počátečním pěněním. Následně byla teplota zvýšena na 100 °C po dobu 2 hodin. Směs byla míchána přes noc. Druhý den byly magnetické částice odděleny z roztoku magnetem a několikrát promyty ve vodě. Následně byl přidán roztok kyseliny chlorozlatité. Směs byla míchána 1 hodinu a poté byl k ní přidán roztok dihydrátu citrátu trisodného. Po míchání přes noc byly zlaté částice separovány magnetem a usušeny za teploty 40 °C (18, 19).
Příprava nanotransportéru fulleren-doxorubicin-ODN1
K 5 mg fulerenu bylo přidáno 0,5 ml destilované vody (výsledná koncentrace 10 mg/ml) a roztok byl následně vložen na 30 minut do ultrazvukové lázně (50 W) (VWR, USC 300T, USA). Poté byly fullereny centrifugovány (Eppendorf, Hamburg, Německo). K nanočásticím byla přidána 65% HNO3 a takto připravený roztok byl hodinu inkubován. Následně byl k fullerenům navázán doxorubicin (30 µM). Interakce probíhala 24 h za laboratorní teploty a poté byly fullereny opět promyty. K fulleren-doxorubicin komplexu byl přidán ODN1 (1 µM) a směs se nechala interagovat při 37 °C 24 h (18, 20).
Příprava komplexu nanotransportéru s AuMNPs-ODN2
10 mg/ml zlatých magnetických částic bylo vloženo do ultrazvukové lázně. K takto připraveným nanočásticím byl přidán 1 µM roztok ODN2. Interakce probíhala při 37 °C 24 h. K připravenému komplexu byl přidán nanotransportér a proběhla interakce při 37 °C, aby se oba komplementární oligonukleotidy hybridizovaly. Pomocí magnetu byl nenavázaný transportér ze směsi promyt.
Rastrovací elektronový mikroskop (SEM) – charakterizace
Pro dokumentaci nanočásticové struktury byl použit MIRA3 LMU (Tescan, Brno, Česká republika). SEM byl propojen s In-Beam SE detektorem. Pro automatické snímání označených oblastí byl použit softwarový program s názvem Image Snapper (TESCAN, Brno, Česká republika).
Velikost nanočástic a ζ-potenciál
Velikost částic a ζ-potenciál byly určeny pomocí analyzátoru dynamického rozptylu světla Malvern Zetasizer (NANO-ZS, Malvern Instruments Ltd., Worcestershire, Velká Británie).
Elektrochemická analýza
Stanovení doxorubicinu probíhalo elektrochemicky pomocí adsorptivní přenosové techniky a standardní cely se třemi elektrodami (potenciostat AUTOLAB 100, Švýcarsko).
Fluorescenční spektroskopie
Fluorescenční spektra byla získána na multifunkčním fluorimetru Tecan Infinite 200 PRO (TECAN, Švýcarsko). Excitační vlnová délka doxorubicinu byla 480 nm.
Spektrofotometrická analýza
Absorbanční spektra byla měřena v rozsahu od 230 do 500 nm v plastových UV-propustných kyvetách (VWR, Německo) na spektrofotometru UV-3100 PC Spectrophotometer (VWR International, Německo).
Vyhodnocení dat
Základní vyhodnocení bylo provedeno nástroji v laboratorním informačním systému LADYS. Všechna experimentální data jsou evidována v databázi LADYS.
VÝSLEDKY
V této pilotní studii jsme se zaměřili na vytvoření cíleného transportu protinádorového léčiva doxorubicinu do mutovaného genu BRCA1 interakcí fullerenu jako nanonosiče a protismyslného oligonukleotidového řetězce (vytvoření komplexu s komplementárním vláknem vede k zablokování funkce daného úseku nukleové kyseliny) (21).
Zvýšení efektivity transportu doxorubicinu k cílové tkáni – prokázání tvorby komplexu nanotransportéru a AuMNPs-ODN2
Hlavním cílem bylo navrhnout unikátní nanokonstrukt, který zvýší efektivitu transportu doxorubicinu. Doxorubicin je elektroaktivní látka, kterou lze snadno stanovit pomocí voltametrie (22) (za zavedení elektrochemické techniky polarografie dostal v roce 1959 Jaroslav Heyrovský Nobelovu cenu). Před ověřením vazby doxorubicinu k fullerenu byla naměřena závislost koncentrace doxorubicinu na výšce elektrochemického signálu doxorubicinu. Následně byl připraven komplex doxorubicinu a fullerenu. Poté byl tento komplex elektrochemicky analyzován. Při jeho vzniku došlo k potenciálové změně, která potvrzuje vazbu obou látek. Tyto výsledky byly v dobré shodě s předchozím zjištěním z elektronového mikroskopu, kdy docházelo k odrazu elektronového paprsku mikroskopu molekulami doxorubicinu, což se projevilo výrazně světlejším povrchem studovaných fullerenů.
Ověření interakce nanotransportéru s cílovým genem BRCA1
Fullerenové nanotransportéry představují jednu z možností jak snížit toxicitu protinádorových léčiv a zároveň vhodnou modifikací je lze zacílit přímo k nádorové tkáni. V našem experimentu jsme zvolili připojení krátké oligonukleotidové sekvence, která je komplementární k bodové mutaci BRCA1 genu. Aby bylo možné ověřit vazbu nanotransportéru k nádorové buňce, použili jsme AuMNPs a k nim navázaný oligonukleotid, který zde představuje cílovou genovou sekvenci. Výhodou takového uspořádání je možnost odmýt nenavázaný transportér díky magnetickým vlastnostem AuMNPs. Pro ověření funkčnosti nanotransportéru jsme zvolili fluorescenční detekci doxorubicinu. Fluorescenční spektrum komplexu nanotransportéru vykazuje pík o stejné emisní vlnové délce jako samotný doxorubicin.
Následně byla funkčnost komplexu prokázána pomocí elektrochemického stanovení doxorubicinu (23). Pomocí metody DPV byl stanoven komplex nanotransportéru a AuMNPs-ODN2 komplexu. Z výsledků je patrné, že samotné fullereny vykazují slabé zvýšení elektrochemického signálu. U AuMNPs nebyl v daném potenciálovém okně zaznamenán elektrochemický signál a průběh křivky koresponduje s průběhem křivky pufru. Získaný elektrochemický záznam komplexu nanotransportéru vázaného na AuMNPs-ODN2 vykazuje oxidační pík s maximem kolem –0,6 V, který odpovídá oxidačnímu píku doxorubicinu (24). Posunutí maxima (o +30 mV) komplexu je pravděpodobně způsobeno vazbou komplexu fulleren-doxorubicin. Tyto výsledky dvou nezávislých analýz prokazují funkčnost námi navrženého nanotransportéru pro cílený transport léčiva do nádorové tkáně s bodovou mutací v BRCA1 genu. Zjednodušené schéma nanotransportéru s metodami jednotlivých ověření je znázorněno na obrázku 4.
Image 4. Schéma nanotransportéru testovaného pro jeho schopnost vazby k cílové mutaci genu <i>BRCA1</i> a znázornění jednotlivých analýz pro ověření jeho funkčnosti. Ověření vazby nanotransportéru na cílovou sekvenci BRCA1 genu. Pomocí magnetické zlaté nanočástice byl komplex purifikován od nenavázaných částí. 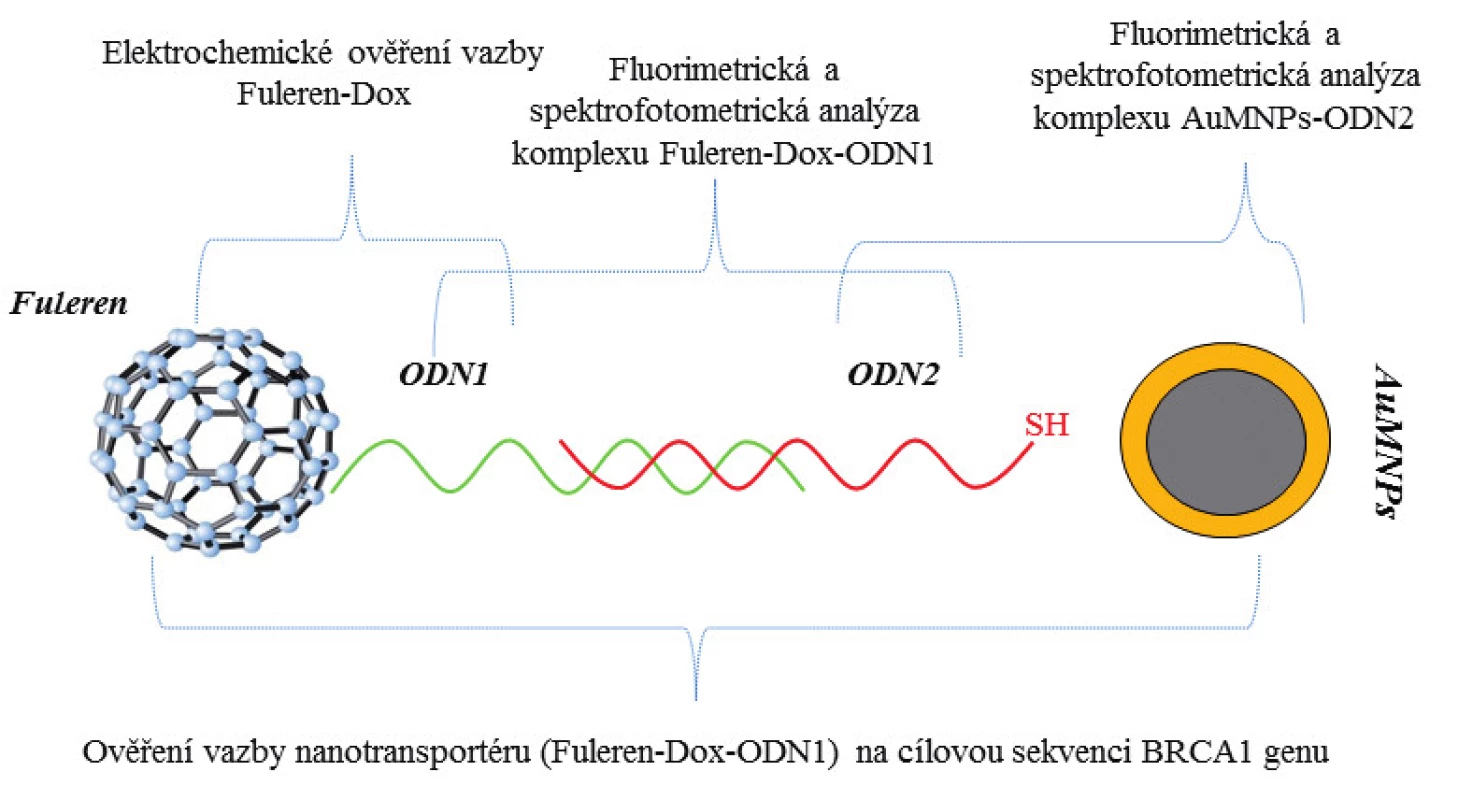
Uhlíkový nanotransportér doxorubicinu byl testován na nádorové buněčné linii prsu
Nanotransportér byl testován na nádorové buněčné linii MCF-7. Samotný nanotransportér v testovaných koncentracích neovlivňoval významně metabolickou aktivitu buněk. Po ovlivnění buněčných linií doxorubicinem byl pozorován pokles metabolické aktivity s rostoucí koncentrací doxorubicinu. Po inkubaci testovaných buněčných linií s kombinací fullerenu a doxorubicinu opět docházelo ke snížení metabolické aktivity buněk s rostoucí koncentrací doxorubicinu ve vzorku. Z vypočítaných hodnot inhibiční koncentrace látky způsobující snížení metabolické aktivity na 50 % bylo patrné, že s využitím kombinace fullerenu a doxorubicinu je možné snížit tuto hodnotu o více než dvojnásobek oproti samotnému doxorubicinu. Cílem experimentu bylo efektivně dopravit cytostatikum do nádorové buňky s následným uvolněním léčiva. Díky nanotransportéru bylo toto dopravení potvrzeno snížením metabolické aktivity buněk a navíc se podařilo prokázat netoxicitu fullerenu jako nanonosiče.
DISKUZE
Mutace tumor supresorového genu BRCA může být vrozená nebo získaná během života. Radikální metodou léčby zhoubných nádorů asociovaných s touto mutací v rámci profylaxe je bilaterální salpingooforektomie (odstranění obou vaječníků a vejcovodů) a mastektomie. Zákrok může být doprovázen hysterektomií. Po adnexektomii se riziko vzniku ovariálního karcinomu snižuje o 96 %. Odstraněním dělohy riziko dále klesá. Zároveň se snižuje i riziko vzniku karcinomu prsu – u nosiček BRCA1 přibližně na polovinu a u nosiček BRCA2 na čtvrtinu.
Pro cílenou terapii je nutné znát typ mutace BRCA. Do současné cílené léčby zhoubných nádorů patří biologická léčba, léčba platinovými deriváty a inhibitory enzymu PARP (polymeráza polyADP-ribóza) (23, 25). PARP inhibitory jsou testovány v klinických studiích u pacientů se zhoubným nádorem prsu a u pacientek s ovariálním karcinomem. Inhibitory blokují účinky proteinu PARP, který patří mezi opravné nástroje buňky sloužící k prevenci přenosu chyb ve struktuře DNA, které vznikají při buněčném dělení. Mezi stejné opravné nástroje patří gen BRCA1, jehož mutace vede ke zhoubným nádorům prsu. Při blokádě účinků PARP pomocí inhibitorů nemůže buňka pokračovat v neefektivních opravách chyb v DNA, proces replikace není dokončen a buňka umírá (24). Léčivo, které se jako první z této skupiny dostalo do klinického výzkumu, byl Olaparib. V kanadské klinické studii, která zahrnovala 91 pacientů, mezi nimiž byly pacientky s ovariálním karcinomem i rakovinou prsu, byl podáván Olaparib 400 mg 2krát denně. U sedmi ze 17 pacientů byla potvrzena objektivní reakce s mutacemi BRCA1 nebo BRCA2 a u jedenácti ze 46 bez mutací. Nebyly hlášeny žádné potvrzené objektivní reakce u pacientů se zhoubným nádorem prsu. Nejčastějšími nežádoucími účinky byla únava (70 % pacientů s ovariálním karcinomem, 50 % pacientů se zhoubným nádorem prsu), nevolnost (66 % a 62 %), zvracení (39 % a 35 %) a snížená chuť k jídlu (36 % a 27 %) (26,27).
BRCA pozitivní nádory vykazují zvýšenou citlivost na cytostatika způsobující dvojité zlomy DNA (platinové deriváty, antracyklinová antibiotika), což vede k lepší prognóze, především u BRCA2. Studie prokázaly, že užívání antracyklinových antibiotik (doxorubicin, epirubicin, daunorubicin) je spojeno s nežádoucími vedlejšími účinky, jímž je vysoká kardiotoxicita a další poškození necílových tkání (9, 28). Doxorubicin navíc stejným mechanismem, kterým ničí buňky tumoru, zabíjí i zdravé buňky v okolní tkáni. Tímto mechanismem je především tvorba ROS a zablokování enzymu topoizomerázy v jádru buňky. Mezi další závažné nežádoucí účinky patří: zarudnutí, bolest nebo otok v místě vpichu infuze, bolest na hrudi, dušnost a těžké alergické reakce, které u některých lidí mohou vést ke kolapsu. U jednoho z deseti pacientů se může vyskytnout sepse.
V této studii bylo prokázáno vytvoření uhlíkového nanotransportéru pro antracyklinové antibiotikum doxorubicin, který je založen na fullerenové struktuře. Studie byla zaměřena na mutaci BRCA1 genu. Předpokládáme, že tento komplex může být efektivně použit pro cílené dopravení k nádorovým buňkám tumoru v prsu. Díky fullerenové struktuře byly výsledky účinku léčiva v nanotransportéru mnohem lepší než při použití léčiva samotného. Nanotransportéry představují novou možnost cílené, přesné a vysoce efektivní léčby. Jedná se o individuální léčbu podle potřeb pacienta. Očekáváme, že využití v klinické praxi může pacientům přinést snížení toxických a nežádoucích účinků cytostatik a efektivnější léčbu zhoubných nádorů prsu (18).
ZÁVĚRY PRO KLINICKOU PRAXI
Postupné zavádění nových, cílených zdravotnických postupů a léčiv do zdravotnické praxe vede k nutnosti zvyšovat náklady na zdravotní péči. V roce 2015 činily podle Českého statistického úřadu, OECD a Eurostatu výdaje ČR na zdravotnictví 7,8 % HDP. Lze předpokládat, že tento trend zůstane zachován i v dalších letech i s ohledem na zavádění nanoléčiv. Léčiva založená na principech nanomedicíny se oproti tomu snaží snížit nebo v ideálním případě eliminovat nežádoucí účinky. Díky cílenému transportu nejsou okolní zdravé buňky v místě tumoru vystaveny tolika toxickým účinkům cytostatik a léčba je s pomocí nanotransportérů efektivnější. První nanotransportéry založené na cíleném transportu léčiva byly schváleny pro klinickou praxi již v devadesátých letech 20. století v USA. Nyní je k dispozici okolo 50 nanoléčiv schválených pro klinické účely jak v USA, tak v Evropě. Nanonosičem jsou nejčastěji polymery a lipozomy, do kterých se léčivo uzavírá. V současné době je pro léčbu zhoubných nádorů nejpoužívanější lipozomální forma doxorubicinu (Myocet®).
Seznam použitých zkratek
ACS ultra čistá voda
AuMNPs magnetické zlaté nanočástice
BRCA tumor supresorové geny
DNA deoxyribonukleová kyselina
DOXO doxorubicin
DPV diferenční pulzní voltametrie
LPR Liga proti rakovině
MCF-7 nádorová buněčná linie zhoubného nádoru prsu
ODN oligonukleotid
OECD Organizace pro hospodářskou spolupráci a rozvoj
PARP polymeráza polyADP-ribóza
ROS reaktivní kyslíkové radikály
SEM skenovací elektronový mikroskop
Experimentální práce byla podpořena projektem NANO LPR 2017 Liga proti rakovině Praha a The European Technology Platform for Nanomedicine.
Autoři vyjadřují poděkování Zuzaně Bábkové za provedení testů na buněčných liniích.
Střet zájmů: žádný.
ADRESA PRO KORESPONDENCI:
prof. Ing. René Kizek, DrSc., MBA
Centrální laboratoře
Farmaceutická fakulta VFU
Palackého tř. 1946/1,
612 00 Brno
e-mail: kizekr@vfu.cz
Sources
1. Kováč J. Budúcnosť nanotechnológie v medicíne a stomatologii. Prakt. Lék. 2012; 92(6): 334–338.
2. Heger Z, Eckschlager T, Stiborová M, a kol. Moderní nanomedicína v léčbě karcinomů plic. Klin Onkol 2015; 28(4): 245–250.
3. Martinez-Outschoorn UE, Peiris-Pages M, Pestell RG, et al. Cancer metabolism: a therapeutic perspective. Nat Rev Clin Oncol 2017; 14(1): 11–31.
4. Skaličková S, Gargulák M, Löffelmann M, a kol. Zinečnatými ionty modifikovaný nanotransportér antracyklinových antibiotik pro cílenou terapii nádoru prsu. Klin Onkol 2017; 30(Suppl 1): 174–176.
5. Drbohlavova J, Chomoucka J, Adam V, et al. Nanocarriers for anticancer drugs – new trends in nanomedicine. Curr Drug Metab 2013; 14(5): 547–564.
6. Büchler T, Hornová J, Kordíkova D, a kol. Karcinom prsu u žen v pokročilém věku. Prakt. Lék. 2010; 90(1): 40–42.
7. Narod SA. BRCA mutations in the management of breast cancer: the state of the art. Nat Rev Clin Oncol 2010; 7(12): 702–707.
8. Friedenson B. The BRCA1/2 pathway prevents hematologic cancers in addition to breast and ovarian cancers. BMC Cancer 2007; 7 : 152.
9. Kizek R, Adam V, Hrabeta J, et al. Anthracyclines and ellipticines as DNA-damaging anticancer drugs: recent advances. Pharmacol Ther 2012; 133(1): 26–39.
10. Rahman AM, Yusuf SW, Ewer MS. Anthracycline-induced cardiotoxicity and the cardiac-sparing effect of liposomal formulation. Int J Nanomedicine 2007; 2(4): 567–583.
11. Blazkova I, Viet Nguyen H, Kominkova M, et al. Fullerene as a transporter for doxorubicin investigated by analytical methods and in vivo imaging. Electrophoresis 2014; 35(7): 1040–1049.
12. Lynchak OV, Prylutskyy YI, Rybalchenko VK, et al. Comparative analysis of the antineoplastic activity of C-60 fullerene with 5-fluorouracil and pyrrole derivative in vivo. Nanoscale Res Lett 2017; 12 : 8.
13. Panchuk RR, Prylutska SV, Chumak VV, et al. Application of C-60 fullerene-doxorubicin complex for tumor cell treatment in vitro and in vivo. J Biomed Nanotechnol 2015; 11(7): 1139–1152.
14. Wang H, Agarwal P, Zhao ST, et al. A biomimetic hybrid nanoplatform for encapsulation and precisely controlled delivery of therasnostic agents. Nat Commun 2015; 6 : 10081.
15. Grebinyk A, Prylutska S, Matyshevska O, et al. Fullerene C60 as a nanocarrier of doxorubicin for cancer treatment. Febs J 2016; 283 : 177.
16. Shi J, Wang B, Wang L, et al. Fullerene (C-60)-based tumor-targeting nanoparticles with “off-on” state for enhanced treatment of cancer. J Control Release 2016; 235 : 245–258.
17. Garcia-Casado Z, Romero I, Fernandez-Serra A, et al. A de novo complete BRCA1 gene deletion identified in a Spanish woman with early bilateral breast cancer. BMC Med Genet 2011; 12(134): 1471–2350.
18. Skaličková S, Löfelmann M, Gargulák M, a kol. Fullerenový nanotransportér doxorubicinu pro cílenou interakci s mutovaným genem BRCA2. Klin Onkol 2017; 30(Suppl 1): 177–179.
19. Mizukoshi Y, Seino S, Okitsu K, et al. Sonochemical preparation of gold/iron oxide composite magnetic nanoparticles and selective magnetic separation of biomolecules. Int J Nanomedicine 2006; 5(2/3): 359–364.
20. Prylutskyy YI, Evstigneev MP, Pashkova IS, et al. Characterization of C-60 fullerene complexation with antibiotic doxorubicin. Phys Chem Chem Phys 2014; 16(42): 23164–23172.
21. Beierlein FR, Paradas Palomo M, Sharapa DI, et al. DNA-dye-conjugates: conformations and spectra of fluorescence probes. PloS ONE 2016; 11(7): e0160229.
22. Hajian R, Tayebi Z, Shams N. Fabrication of an electrochemical sensor for determination of doxorubicin in human plasma and its interaction with DNA. J Pharm Anal 2017; 7(1): 27–33.
23. Rackus DG, Shamsi MH, Wheeler AR. Electrochemistry, biosensors and microfluidics: a convergence of fields. Chem Soc Rev 2015; 44(15): 5320–5340.
24. Kominkova M, Guran R, Rodrigo, MAM, et al. Study of functional qualities of different types of tailored liposomes with encapsulated doxorubicin using electrochemical and optical methods. Int J Electrochem Sci 2014; 9(6): 2993–3007.
25. Králíčková P, Krejsek J, Krčmová I. Biologická léčba v onkologii (I). Prakt. Lek. 2011; 91(4): 189–192.
26. Kim H, George E, Ragland R, et al. Targeting the Atr/Chk1 axis with PARP Inhibition results in tumor regression in BRCA-mutant ovarian cancer models. Clin Cancer Res 2017; 23(12): 3097–3108.
27. Gelmon KA, Tischkowitz M, Mackay H, et al. Olaparib in patients with recurrent high-grade serous or poorly differentiated ovarian carcinoma or triple-negative breast cancer: a phase 2, multicentre, open-label, non-randomised study. Lancet Oncol 2011; 12(9): 852–861.
28. Chatterjee K, Zhang J, Honbo N, et al. Doxorubicin cardiomyopathy. Cardiology 2010; 115(2): 155–162.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2017 Issue 6-
All articles in this issue
- Následná a dlouhodobá péče na území České republiky – přehled aktuálního stavu a změn lůžkové kapacity z dat Národního zdravotnického informačního systému
- Studie nových antikoagulancií – dílčí výsledky
- Dilacerace oka způsobená výbuchem zábavní pyrotechniky
- Metastázy malígneho melanómu do myokardu – raritná príčina srdcového zlyhania
- Inoperabilná forma alveolárnej echinokokózy pečene
- Nanomedicínský přístup v cílené terapii karcinomu prsu: využití uhlíkových nanostruktur
- Vybrané aspekty životního stylu a zdravotní gramotnost u osob ohrožených chudobou žijících v Jihočeském kraji
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Následná a dlouhodobá péče na území České republiky – přehled aktuálního stavu a změn lůžkové kapacity z dat Národního zdravotnického informačního systému
- Inoperabilná forma alveolárnej echinokokózy pečene
- Dilacerace oka způsobená výbuchem zábavní pyrotechniky
- Studie nových antikoagulancií – dílčí výsledky
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

