-
Medical journals
- Career
Biologická léčba v onkologii (II)
Monoklonální protilátky, cytokiny
: P. Králíčková; J. Krejsek; I. Krčmová
: ÚSTAV KLINICKÉ IMUNOLOGIE A ALERGOLOGIE ; Přednosta: prof. RNDr. Jan Krejsek, CSc. ; Fakultní nemocnice Hradec Králové
: Prakt. Lék. 2011; 91(5): 258-262
: Reviews
Biologická léčba se v posledních letech stává důležitou součástí komplexní protinádorové léčby. V klinické praxi je asi nejvíce používanou formou podávání monoklonálních protilátek (samostatně či v konjugaci) a cytokinů. Článek shrnuje přípravu, mechanismy účinku, indikace a nežádoucí účinky monoklonálních protilátek a cytokinů.
Klíčová slova:
biologická léčba, monoklonální protilátky, cytokiny.Úvod
Biologická léčba se v posledních letech stává důležitou součástí komplexní protinádorové léčby. Má různé formy, jejichž společnou charakteristikou je zásah do biologických pochodů, které se podílejí na vzniku nádorového onemocnění. Na rozdíl od chemoterapie a radioterapie je schopna ničit nádorové buňky nezávisle na jejich generačním cyklu (15, 16). V klinické praxi asi nejvíce používanou formou je podávání monoklonálních protilátek.
Mechanismy cytotoxického účinku monoklonálních protilátek
- přímá vazba a neutralizace toxinů;
- aktivace imunitní
odpovědi;
- a) vazba a aktivace komplementu klasickou dráhou vazbou C1q složky komplementu přes Fc fragment s tvorbou MAC (membrane attack complex) s následnou lýzou buňky – na komplementu závislá cytotoxicita
- b) na protilátce závislá cytotoxicita (ADCC) vazbou na Fc receptor pro IgG (CD16, CD32, CD64) na NK buňkách, monocytech a makrofázích s opsonizačním účinkem (13, 27)
- reakce tvorbou antiidiotypových protilátek;
- indukce apoptózy;
- pokud jsou cílové struktury exprimovány v malé míře či pouze po krátkou dobu, pak je vhodná konjugace např. s toxiny či radioizotopy (5, 24, 25).
Princip přípravy
v současnosti spočívá v propojení hybridomové a DNA rekombinantní technologie. Nejdříve se získá klasickou hybridomovou technologií myší monoklonální protilátka proti nádorovému antigenu. Z hybridomové linie produkující protilátku s příslušnou specifitou se připraví RNA a z ní reverzní transkripcí cDNA. Následně se pomocí PCR amplifikují úseky genů myšího imunoglobulinu, které kódují hypervariabilní domény CDR. Touto částí genetické informace se nahradí CDR lidského imunoglobulinu a chimerní geny kódující humanizovanou monoklonální protilátku jsou posléze vloženy do vhodné savčí buňky, ve které jsou výchozím materiálem pro velkokapacitní produkci. Protože platí, že mikroprostředí nádoru vytváří významnou bariéru pro prostup intaktních makromolekul, je prováděna řada studií na chemicky nebo geneticky připravených fragmentech protilátek (diabodies) (16). Běžně se používají F(ab)2 a Fab, Fv (6, 24, 27).
V 80. letech minulého století se vědci v rámci klinických aplikací potýkali s tvorbou lidských protilátek proti těmto terapeutickým protilátkám. V případě myších monoklonálních protilátek se jedná o tzv. HAMA protilátky (human anti mouse antibodies), které odstraňovaly terapeutické protilátky dříve, než mohly začít působit. Navíc bylo jejich podání často komplikováno alergickými reakcemi až typu anafylaktického šoku (24). Širší klinické uplatnění nalezla OKT3 (MUROMAB) při léčbě rejekce transplantovaných orgánů (29). Následně byly konstruovány chimérické protilátky, které obsahují 30–40 % myší komponenty a konstantní oblast (60 až 70 %) je tvořena lidskou bílkovinou (přípona –ximab).
Další generací jsou pak protilátky humanizované (přípona –zumab). Ty obsahují pouze 5–10 % myší komponenty a zbytek je lidského původu. Nicméně i proti těmto protilátkám je organismus schopen tvořit protilátky:
- HACA (human anti chimeric antibodies),
- HAHA (human anti human antibodies) (27).
Z názvosloví monoklonálních protilátek lze vyčíst řadu informací. První část názvu je variabilní, po ní následuje část, která označuje cíl monoklonální protilátky např.:
- -tu(m) – libovolný tumor,
- -vi(r) – pro libovolný virový antigen, a/nebo
- -li(m) – pro složku imunitního systému.
Další písmeno či slabika vysvětluje původ monoklonální protilátky. Nejčastěji se setkáme s
- –u – pro protilátky lidského původu,
- -o – myší,
- –zu – humanizované,
- -e – křeččí,
- -xi – chimérické monoklonální protilátky.
Název je zakončen příponou –mab.
Fúzní proteiny jsou označovány příponou –cept. Jedná se o proteiny vzniklé prostřednictvím spojení dvou a více produktů genů, které kódují různé bílkoviny (24).
Klinické studie však přinesly řadu dalších otázek a problémů spojených s jejich aplikací. S ohledem na poměrně velkou molekulovou hmotnost mají monoklonální protilátky ve srovnání s běžně užívanými cytostatiky pomalejší distribuční kinetiku a podstatně nižší průnik do nádorové tkáně. Vlastní distribuce v nádoru je nehomogenní v důsledku rozdílné exprese nádorových antigenů v jednotlivých místech tumoru a dále přirozenými bariérami. Snížený průnik protilátek byl pozorován v málo vaskularizovaných nádorech.
Další bariérou je zvýšený intersticiální tlak uvnitř nádorů, který pracuje proti pasivní difúzi imunoglobulínů do tumoru. Poměrně velká vzdálenost mezi cévou a intersticiem, v němž se nacházejí nádorové buňky, limitují použití monoklonálních protilátek u pacientů s objemnějšími nádory. Logicky z toho vyplývá směřování léčby směrem k reziduální chorobě.
Poměrně zásadním problémem je dále heterogenní exprese antigenů v nádoru, kdy snížená denzita antigenu pak bude jedním z klíčových mechanismů rezistence nádorových buněk na léčbu protilátkami (6).
Protilátky jsou stále četněji používány v konjugaci (viz obr. 1).
Obr 1. Konjugace monoklonálních protilátek je možná s radionuklidem, lékem, toxinem, enzymem anebo s lékem spojeným s dalším nosičem. Nejmenší antigen-vázající fragment je jediný řetězec (scFv), který je představován VL a VH řetězci (společně nazývané Fv), který je spojen s 15–18 aminokyselinami. scFv je monovalentní, ale tvoří vzor pro multivalentní molekuly. scFv bývá spojen s CH3 za vzniku miniprotilátek či geneticky modifikovaným Fc fragmenem, aby poskytl bivalentní vazbu. 
Konjugace s radionuklidem používá navázaný radionuklid k cílenému ozáření nádorových buněk. To se pak kombinuje s protinádorovým účinkem protilátky. V klinické praxi jsou indikovány zejména při léčbě maligních lymfomů. Protilátka anti CD20 konjugovaná s 131I (Bexxar) je zdrojem gamma a beta záření, které má dosah asi 2,4 mm do okolí. Tím jsou zasaženy i přilehlé lymfomové buňky se slabší expresí CD20. Dalším lékem je pak anti CD20 v konjugaci s 90Y jako zdroj beta záření (Zavalin), s větším dosahem 11,9 mm (15, 16, 23, 25).
Protilátku je možno konjugovat i s toxinem, který je navázán peptidickou či disulfidickou vazbou. Toxiny (např. pseudomonádový exotoxin, difterický toxin, ricin) poškozují ribozomy a inhibují buněčnou proteosyntézu (5,16).
U konjugace s cytostatikem se ukázalo, že vazba cytostatika může měnit specificitu protilátky či může váznout internalizace léčiva do buňky. Do klinické praxe zatím jako jediný pronikl do léčby akutní myeloidní leukémie gentuzumab ozogamicin (Mylotarg), kde antibiotikum s protinádorovým účinkem (calicheamicin) je spojeno s protilátkou anti CD-33 (5,16, 23).
Konjugace monoklonální protilátky s enzymem schopným konvertovat netoxickou látku „prodrug“ v látku cytotoxickou se nazývá ADEPT (antibody directed enzyme prodrug therapy). Např. konjugace alkalické fosfatázy s monoklonální protilátkou zaručí po vazbě monoklonální protilátky na nádorovou buňku vysokou koncentraci enzymu v nádorové tkáni. Podá-li se následně, např. fosforylované cytostatikum s omezenou toxicitou, je pak v oblasti nádoru selektivně defosforylováno a přeměněno v účinnou cytotoxickou látku, která má minimální celkové nežádoucí účinky (15, 16, 25).
Klasické monoklonální protilátky jsou monospeficifké a bivalentní (mají schopnost vázat jeden antigen dvěma totožnými Fab). V různých fázích výzkumných prací jsou vyráběny protilátky bispecifické, kdy každý Fab fragment je schopen vázat jinou antigenní strukturu. Tyto také zvané trifunkční protilátky obvykle váží jedním Fab fragmentem nádorový antigen, zatímco druhým atrahují T-lymfocyty do místa nádoru. Prostřednictvím Fc fragmentu pak mají navíc schopnost aktivovat pomocné buňky a indukovat tak ADCC (16).
V klinické praxi jsou monoklonální protilátky využívány nejen v léčbě onkologických nemocí, ale i v transplantologii, při léčbě autoimunitních onemocnění a dále pak i u očních a infekčních chorob (18, 20, 24, 26, 29, 30, 32).
Tabulkový přehled v klinické praxi používaných monoklonálních protilátek uvádí tabulky č. 1–4.
1. Přehled monoklonálních protilátek v klinické onkologii 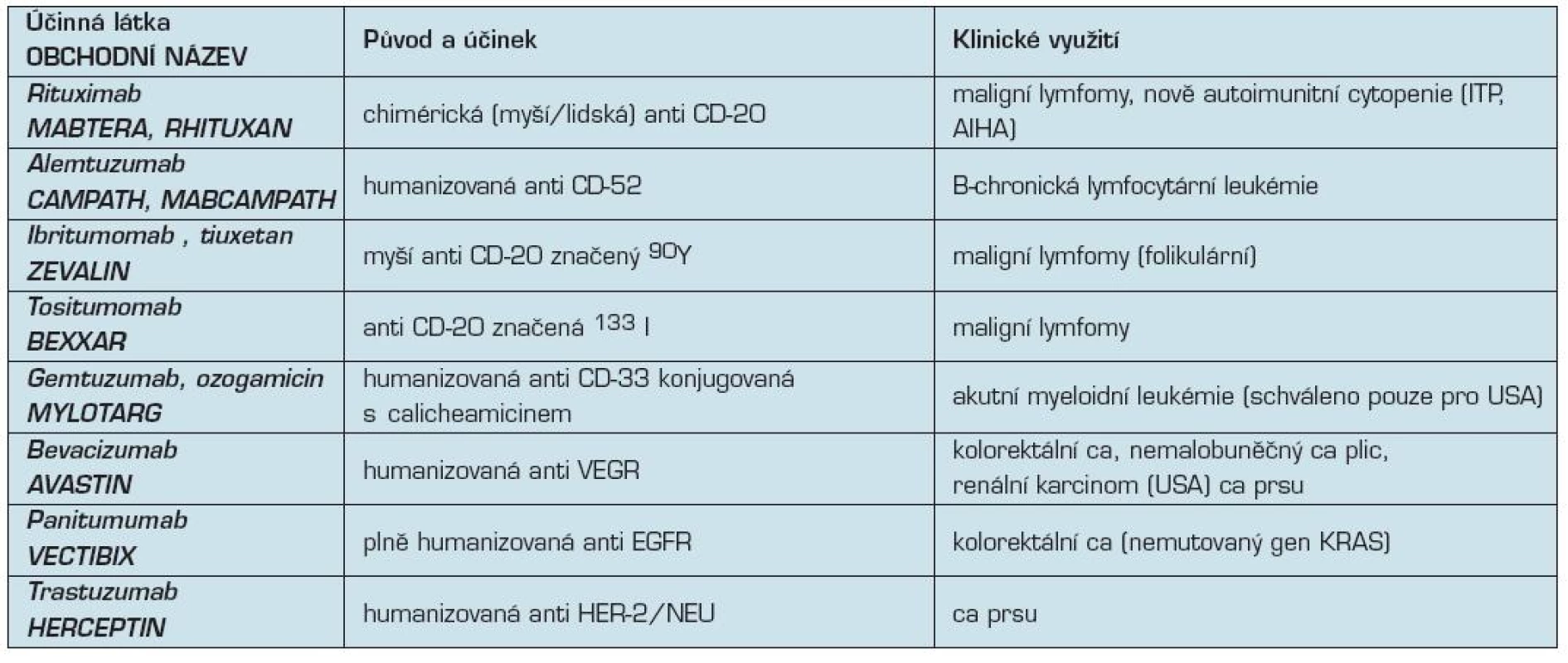
2. Tyrozinkinázové inhibitory v klinické onkologii 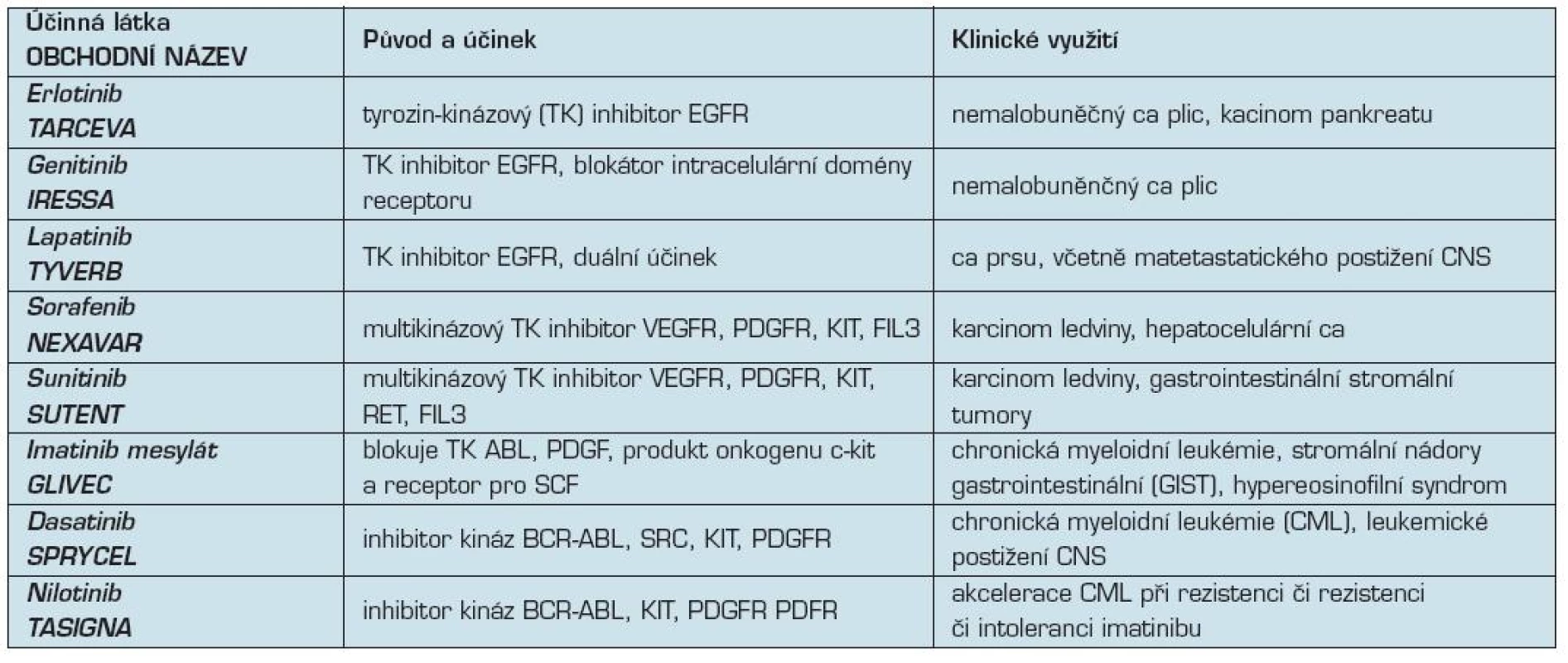
3. Další biologické léky v klinické onkologii 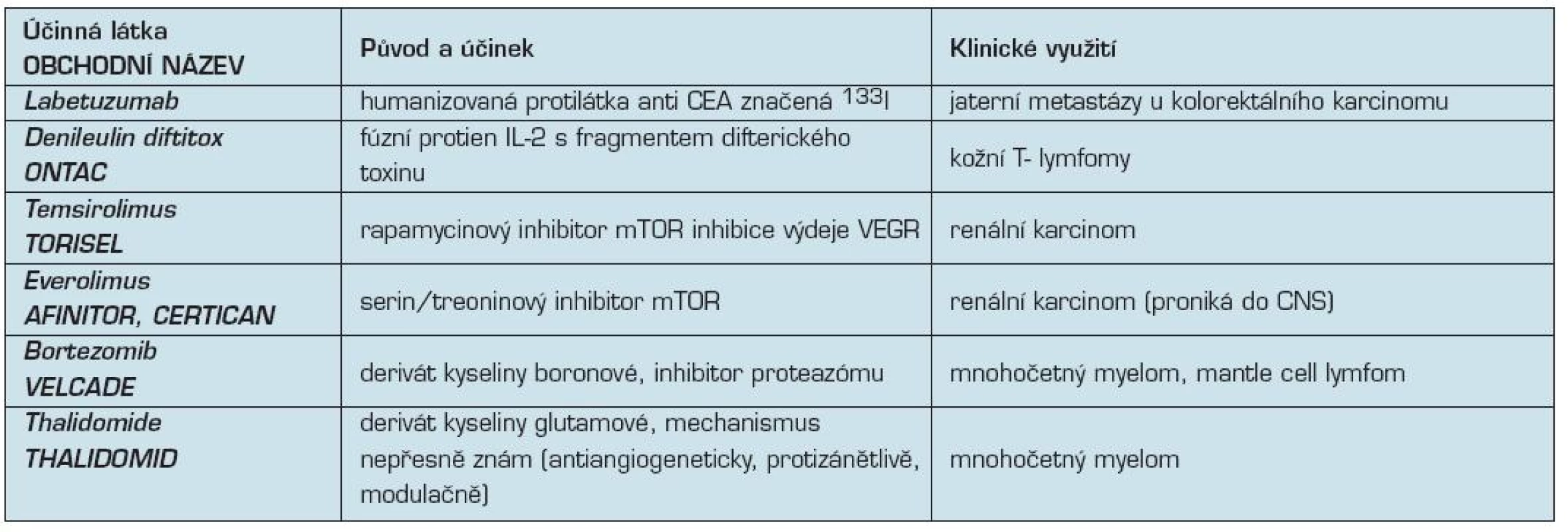
4. Přehled monoklonálních protilátek z neonkologické indikace 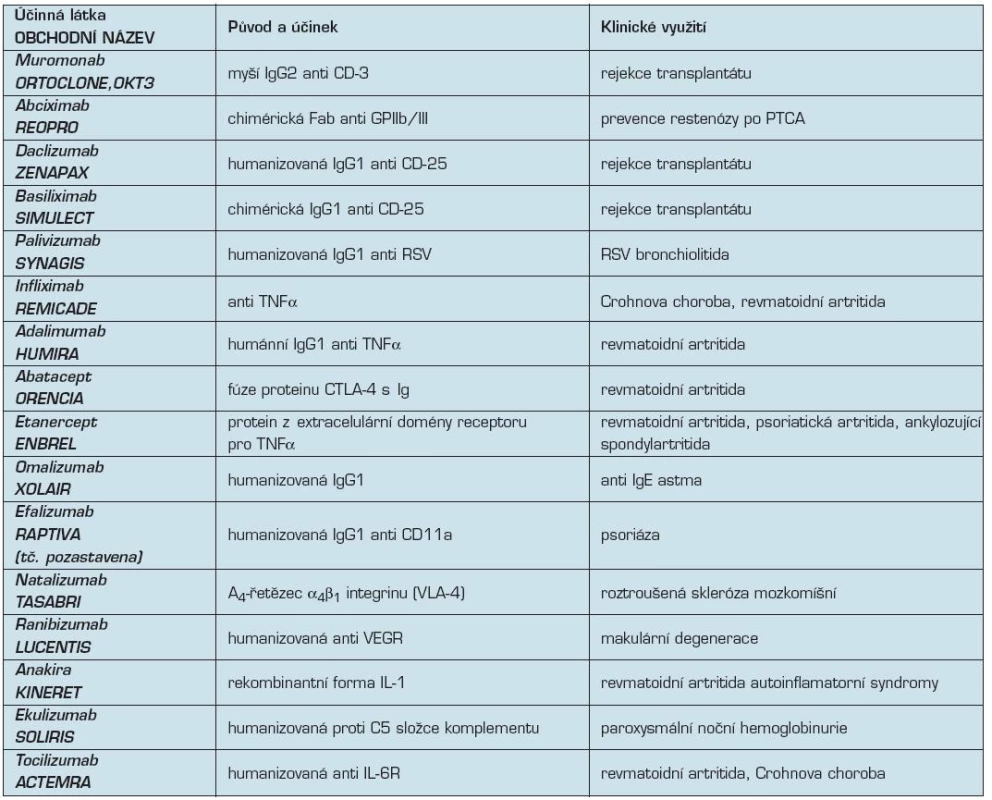
Monoklonální protlátky jsou obvykle organismem dobře tolerovány. Některé nežádoucí účinky jsou všem společné, jiné specifické pro daný typ léčiva. Především u chimérických protilátek hrozí při tvorbě HACA alergické reakce včetně anafylaktického šoku s projevy:
- hypotenze,
- bronchospasmu,
- pískání na hrudi,
- laryngeálního edému,
- plicního edému,
- cyanózy,
- hypoxie,
- arytmií,
- zástavou dechu a oběhu,
- urtikárie,
- pruritu.
Zejména při prvním podání jsou pacienti ohroženi vznikem hypoxie, hypotenze či kardiovaskulárního kolapsu, vznikem plicních infiltrátů až ARDS. Infúze mohou být dále provázeny zimnicí, horečkami. Vše v důsledku uvolnění cytokinů (IL-6, TNF-α) tzv. cytokinová reakce (24).
Pro inhibitory VEGF jsou pak charakteristické
- krvácivé komplikace i trombembolické příhody,
- hypertenze,
- perforace gastrointestinálního traktu,
- nefrotoxicita,
- mukozitída,
- kožní toxicita,
- zhoršené hojení ran (8, 14, 21, 22).
Dominujícím nežádoucím účinkem trastuzumabu (anti Her2-neu) je kardiotoxicita (31). Dermatologická toxicita je četně vídána při podávání inhibitorů tyrozinkináz a proteazómu (akneiformní erupce, rosaceiformní exantémy, projevy napodobující seboroickou dermatitidu, pruritus, venektazie, xerodermie, paronychia). Vznik exantému bývá dokonce považován za projev účinnosti léčby (4, 7, 17, 28).
Pro monoklonální protilátky využívané především v léčbě autoimunitních onemocnění (zejm. infliximabem, etanerceptem) je charakteristické riziko vážných infekcí či reaktivace TBC (i se smrtelným průběhem) (24, 32).
Biologická léčba cytokiny
IFN-α je používán s cílem zvýšit antigenně specifickou odpověď, podílí se i na zvýšení diferenciace a inhibici angiogeneze. Klinicky je využíván v léčbě
- chronické myeloidní leukemie,
- vlasatobuněčné leukemie,
- B i T maligních lymfomů,
- maligního melanomu,
- karcinomu ledviny či Kaposiho sarkomu (1, 15, 19).
Jeho antiangiogenní účinky jsou využívány v léčbě angiomů, zejména u dětí. S poměrně významnou účinností byl použit ve vybraných případech často rekurujících laryngeálních papilomatóz (10). Novou formu představují jeho pegylované formy s protrahovaným účinkem. (16).
IL-2 představuje cytokin s asi nejširším klinickým uplatněním. Ex vivo je používán při aktivaci a pomnožení tumor specifických cytotoxických T-lymfocytů či tzv. LAK buněk (lymphokine-activated killers) (3, 9, 11). Používá se však četně i systémově, zejména v léčbě maligního melanomu a karcinomu ledviny (1). Rekombinantní formu představuje aldesleukin (Proleukin), pro léčbu plicních metastáz byla vyvinuta i inhalační forma. Dále se stává součástí fúzních proteinů.
V klinických zkouškách je asi nejdále denileukin diftitox (Ontac), u něhož je na IL-2 navázán fragment difretického toxinu za účelem eliminovat nádorové buňky exprimující receptor pro IL-2. (15, 16, 21, 23).
IL-12 (spíše v rámci klinických studií) byl použit při léčbě pacientů s pokročilým karcinomem ledviny, je využíván i při výrobě nádorových vakcín (19).
TNF-α v rámci preklinických studií je používán v rámci kombinované chemoimunoterapie. Jeho načasování před podáním chemoteraputik vede k následné zvýšené penetraci daných léčiv do nádoru a tím i vyšší účinnosti (2).
Závěr
Monoklonální protilátky i cytokiny, jako nedílné součásti komplexní protinádorové léčby, představují pro onkologicky nemocné jednoznačné zlepšení jejich prognózy, zlepšení kvality života při redukci nežádoucích účinků.
MUDr. Pavlína Králíčková
Ústav klinické imunologie a alergologie
Fakultní nemocnice
Sokolská tř. 581
500 05 Hradec Králové
E-mail: kralickova.pavlina@fnhk.cz
Sources
1. Bellmunt, J. Current treatment in advanced renal cell carcinoma (RCC): impact of target therapies in management of RCC. Eur. Urol. 2007, 6, p. 484-491.
2. Bellone, M., Mondino, A., Corti, A. Vascular targeting, chemotherapy and active immunotherapy:teaming up to attack cancer. Trends Immunol. 2008, 29(5), p. 235-241.
3. Bubeník, J., Mikyšková, R., Vonka, V. et al. Interleukin-2 and dendritic cells as adjuvans for surgical therapy of tumours associated with human papillomavirus type 16. Vaccine 2003, 21(9-10), p. 891-896.
4. Cortes, J., Rousselot, P., Kim, DW. et al. Dasatinib induces complete hematologic and cytogenetic responses in patients with imatinib-resistant or –intolerant chronic myeoid leukemia in blast crisis. Blood 2007, 109(8), p. 3207-3213.
5. Congy-Jolivet, N. Probst, A. Watier, H. et al. Recombinant therapeutic monoclonal antibodies: Mechanisms of action in relation to structural and functional duality. Crit. Rev. Oncol. Hematol. 2007, 64(3), p. 226-233.
6. Cwiertka, K., Trojanec, R., Špašková, K., Hajdúch, M. Terapeutické monoklonální protilátky v onkologii. Klin. Farmakol. Farm. 2004, 21(3), s. 165-170.
7. Dassonville, O., Bozec, A., Fischel, J.L. et al. EGFR targeting therapies: Monoclonal antibodies versus tyrosine kinase inhibitors similarities and differences. Crit. Rev. Oncol. Hematol. 2007, 62, p. 53-61.
8. Eskens, A.L.M., Verweij, J. The clinical toxicity profile of vascular endothelial growth factor (VEGF) and vascular endothelial growth factor receptor (VEGFR) targeting angiogenesis inhibitors. Rev. Eur. J. Cancer 2006, 42(16), p. 3127-3139.
9. Escudier, B., Farace, F., Angevin, E. et al. Immunotherapy with IL-2 and lymphokine-activated natural killer cells: Improvement of clinical responses in metastatic renal cell carcinoma patients previously treated with IL-2. Eur. J. Cancer 1994, 30(8), p. 1078-1083
10. Gerein, V., Rastorguev, E., Gerein, J. et al. Use of interferon - alpha in recurrent respiratory papillomatosis: 20-year follow-up. Ann. Otol. Rhinol. Laryngol. 2005, 14(6), p. 463-471.
11. Gregoire, M., Ligeza-Poisson, C., Juge-Morineau, N., Spisek, R. Anti-cancer therapy using dendritic cells and apoptotic tumour cells: pre-clinical data in human mesothelioma and acute myloid leukemia. Vaccine 2003, 21(7-8), p. 791-794.
12. Hájek, R., Maisnar, V., Krejčí, M. Thalidomid. Klin. Farmakol. Farm. 2005, 19(1), s. 43-46.
13. Hořejší, V., Bartůňková, J. Základy imunologie. 3. vydání, Praha: Triton, 2005, s. 40, 106-118, 128-144, 174-182.
14. Hurwitz, H., Saini, S. Bevacizumab in the treatment of metastatic colorectal cancer: safety profile and management of adverse events. Semin. Oncol. 2006, 33(10), p. 26-34.
15. Klener, P. a kol. Klinická onkologie. 1. vydání, Praha: Galén, 2002, s. 223-225.
16. Klener, P. Klener, P. ml. Nová protinádorová léčiva a léčebné strategie v onkologii. 1. vydání, Praha: Grada, 2010, s. 77-84, 157-190.
17. Krajsová, I. Kožní projevy cílené léčby nádorů. Remedia 2006, 16(4), s. 416-420.
18. Krčmová, I. Omalizumab – terapeutická perspektiva v léčbě těžkého bronchiálního astmatu. Remedia 2006, 16(4), s. 4308-4442.
19. Motzer, R.J., Rakhit, A., Thompson, J.A. et el. Randomized multicenter phase II trial of subcutaneous recombinant human interleukin-12 versus interferon –α2a for patients with advanced renal cell carcinoma. J. Interferon. Cytokine. Res. 2001, 21(4), p. 254-263.
20. Pilz, G., Wipfler, P., Ladurner, G., Kraus, J. Modern multiple sclerosis treatment – what is approved, what is on the horizon. Drug. Discov. Today 2008, 13(23/24), p. 1013-1025.
21. Prenen, H., Gil, T., Awada, A. New therapeutic developments in renal cell cancer. Crit. Rev. Oncol. Hematol. 2009, 69(1), p.56-63.
22. Ravaud, A., Wallerand, H., Culine, S. et al. Update the medical treatment of metastatic renal cell carcinoma. Eur. Urol. 2008, 54(2), p. 315-325.
23. Sharkey, R.M., Goldenberg, D.M. Use of antibodies and immunoconjugates for the therapy of more accesible cancer. Adv. Drug Deliv. Rev. 2008, 60(12), p. 1407-1420.
24. Sobotková, M., Bartůňková, J. Monoklonální protilátky a další biologická léčiva užívaná v imunosupresivní léčbě. Remedia 2008, 5, p. 356-364.
25. Stern, M., Herrmann, R. Overview of monoclonal antibodies in cancer therapy: present and promise. Crit. Rev. Oncol. Hematol. 2005, 54, p. 11-29.
26. Stueve, O. The effect of natalizumab on the innate and adaptive immune system in the central nervous system. J. Neurol. Sci. 2008, 274(1-2), p. 39-41.
27. Swann, P.G.,Tolnay, M., Muthukkumar, S. et al. Consideration for the development of therapeutic monoclonal antibodies. Curr. Opin. Immunol. 2008, 20(4), p. 1-7.
28. Špička, I., Kleibel, Z., Hájek, R. Bortezomib. Remedia 2005, 15(3), s. 196-204.
29. Špinarová, L., Vítovec, J. Kombinovaná léčba po transplantaci srdce. Remedia 2006, 16(3), s. 168-273.
30. Vencovský, J. Abatacept v léčbě revmatoidní artritidy. Remedia 2007, 17(6), s. 455-463.
29. Widakowich, Ch., de Azambuja, E., Gil, T. et al. Molecular targeted therapies in breast cancer: Where are we now? Int. J. Biochem. Cell. Biol. 2007, 39(7-8), p. 1375-1387.
31. Zbořil, V. Infliximab v klinické léčebné praxi. Klin. Farmakol. Farm. 2005, 19(1), s. 67-71.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2011 Issue 5-
All articles in this issue
-
Základy kognitivní, afektivní a sociální neurovědy
V. Láska -
Biologická léčba v onkologii (II)
Monoklonální protilátky, cytokiny - Fenclová Z., Urban P., Pelclová D., Havlová D., Čerstvá M.: Occupational diseases reported in the Czech Republic in 2010
- Jarošová D., Janíková E., Vrublová Y., Zeleníková, R., Tomášková H., Papastavrou E.: Patient satisfaction with nursing care in surgical departments
- Pohlová L., Kozáková R., Jarošová D.: Burn-out among nurses working in geriatric departments
-
Klodronát … aneb stará láska nerezaví
Využití u karcinomu prsu a karcinomu prostaty - Matějek J.: Spirituality of the patient in connection with the interpretation of advance directives
- Kučera I., Hlaváč P.: Evaluation of risk factors in the working environment and occupational diseases
- Nešpor K., Mattanelli O.: Lifestyle and addictive diseases
- Chlumský J.: Differential diagnosis of elevated serum troponin in the department of Internal Medicine
-
Základy kognitivní, afektivní a sociální neurovědy
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Chlumský J.: Differential diagnosis of elevated serum troponin in the department of Internal Medicine
- Pohlová L., Kozáková R., Jarošová D.: Burn-out among nurses working in geriatric departments
-
Biologická léčba v onkologii (II)
Monoklonální protilátky, cytokiny - Kučera I., Hlaváč P.: Evaluation of risk factors in the working environment and occupational diseases
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

