-
Medical journals
- Career
Aktinická keratóza: poznatky o biologickom správaní a klinicko-patologických aspektoch ochorenia z pohľadu bioptika
Authors: V. Bartoš 1; K. Adamicová 2; M. Péč 3
Authors‘ workplace: Oddelenie patologickej anatómie FNsP, Žilina, Slovenská republika, Vedúci: prim. MUDr. Dušan Pokorný 1; Ústav patologickej anatómie Jesseniovej lekárskej fakulty a UNM v Martine, Vedúci: prof. MUDr. Lukáš Plank, CSc. 2; Ústav lekárskej biológie Jesseniovej lekárskej fakulty v Martine, Vedúci: doc. MUDr. Martin Péč, PhD. 3
Published in: Prakt. Lék. 2011; 91(11): 646-652
Category: Various Specialization
Overview
Aktinická keratóza (AK) je v dermatologickej praxi veľmi často diagnostikované ochorenie, ktoré vzniká najmä na častiach tela vystavených slnečnému žiareniu. Táto kožná lézia je historicky považovaná za prekancerózu, ale v súčasnosti sa odporučuje klasifikovať ju ako skvamocelulárny karcinóm (SCC) in situ. Priebeh ochorenia býva rôznorodý. Lézie môžu
- spontánne regredovať,
- recidivovať,
- pretrvávať bez zmien dlhé obdobie, alebo
- progredovať do invazívneho karcinómu.
Tento 3-stupňový “gradingový” systém vhodnejšie vystihuje proces postupnej malignizácie epidermy, ale o jeho praktickom využití zatiaľ pretrvávajú kontroverzné názory. Hoci je malígny potenciál AK relatívne nízky, zatiaľ nepoznáme jednoznačné klinicko-patologické ukazovatele predpovedajúce priebeh ochorenia. Z toho dôvodu pretrváva potreba ďalších štúdií zameraných na patogenézu a biologické správanie AK, ktoré sú najmä v klinickej praxi podporované dilemou, či všetky lézie bezpodmienečne vyžadujú liečbu a aká forma terapie je pri konkrétnych léziách optimálna.Kľúčové slová:
aktinická keratóza, keratinocytová intraepidermálna neoplázia, skvamocelulárny karcinóm.Úvod
Aktinická (solárna) keratóza (AK) je v dermatologickej praxi veľmi často diagnostikovaná lézia vyskytujúca sa najmä na častiach tela vystavených slnečnému žiareniu (oblasti hlavy a krku, predlaktia, zápästia) (7, 10, 30, 31). Makroskopicky sa väčšinou prejavuje vo forme rôzne ohraničených solitárnych či mnohopočetných hyperkeratotických makúl alebo papúl s erytematóznou spodinou a povrchovým olupovaním, niekedy aj s ulceráciou a teleangiektáziami (7, 27, 30, 31). Vzhľadom na drsný povrch sa niekedy lepšie diagnostikuje palpačne ako vizuálne (10, 30, 31).
Celkový vzhľad lézií však môže byť rôznorodý, preto klinicky rozlišujeme niekoľko typov AK:
- hyperkeratotický,
- atrofický,
- verukózny,
- pigmentovaný,
- lichenoidný,
- konfluentný, a
- AK typu cornu cutaneum (5).
Osobitnú formu predstavuje aktinická cheilitída, ktorá je charakteristická postihnutím červene pery s atrofiou, belavým olupovaním až tvorbou erózí a ragád (10, 30, 31).
Presnú incidenciu AK nemožno stanoviť, nakoľko časť týchto lézií nebýva klinicky diagnostikovaná a liečená. Aj u dispenzarizovaných pacientov však mnohé lézie (najmä pri mnohopočetnom výskyte) nie sú biopticky odstránené a histologicky vyšetrované, ale skôr liečené lokálnou deštruktívnou či medikamentóznou terapiou (36). Významný vplyv má aj geografická lokalizácia a veková hranica hodnotených osôb. Z týchto dôvodov uvádzaný výskyt v literatúre výrazne varíruje v rozpätí 1,4–55 % (18, 23, 24, 28).
V Európe sa celková prevalencia AK pohybuje okolo 15 % u mužov a 6 % u žien, ale vo veku nad 70 rokov stúpa na 34 % u mužov a 18 % u žien.
V USA sa prevalencia uvádza v rozpätí 11–26 %, zatiaľ čo v Austrálii je výskyt AK u ľudí do 70 rokov až 55 % u mužov a 37 % u žien (18).
Hoci je toto ochorenie historicky označované za prekancerózu či premalígnu kožnú léziu, v súčasnosti je centrom mnohých kontroverzných diskusií. Spory vznikajú najmä v dôsledku heterogénneho biologického správania lézií, následkom ktorého sú aj prognóza ochorenia a klinický manažment pacientov diskutabilné. Navyše podľa mnohých autorov (1, 7, 8, 13, 19, 34, 35) nie je správne túto léziu klasifikovať ako prekancerózu, ale ako včasné štádium skvamocelulárneho karcinómu (SCC) kože, čo by významne ovplyvňovalo nielen epidemiologické údaje, ale aj celkový pohľad na nádorové kožné ochorenia.
Histomorfologický obraz a klasifikácia aktinickej keratózy
Všeobecným histologickým znakom AK je proliferácia nádorovo tranformovaných keratinocytov v epiderme (7, 30), ale jej skutočný obraz býva rôznorodý. Podľa WHO klasifikácie nádorových ochorení kože (17) rozlišujeme 6 histologických typov AK:
- hypertrofický,
- atrofický,
- bowenoidný,
- akantolytický,
- pigmentovaný, a
- lichenoidný typ (tab 1).
Table 1. Klinická a patologická klasifikácia aktinickej keratózy (5, 17) 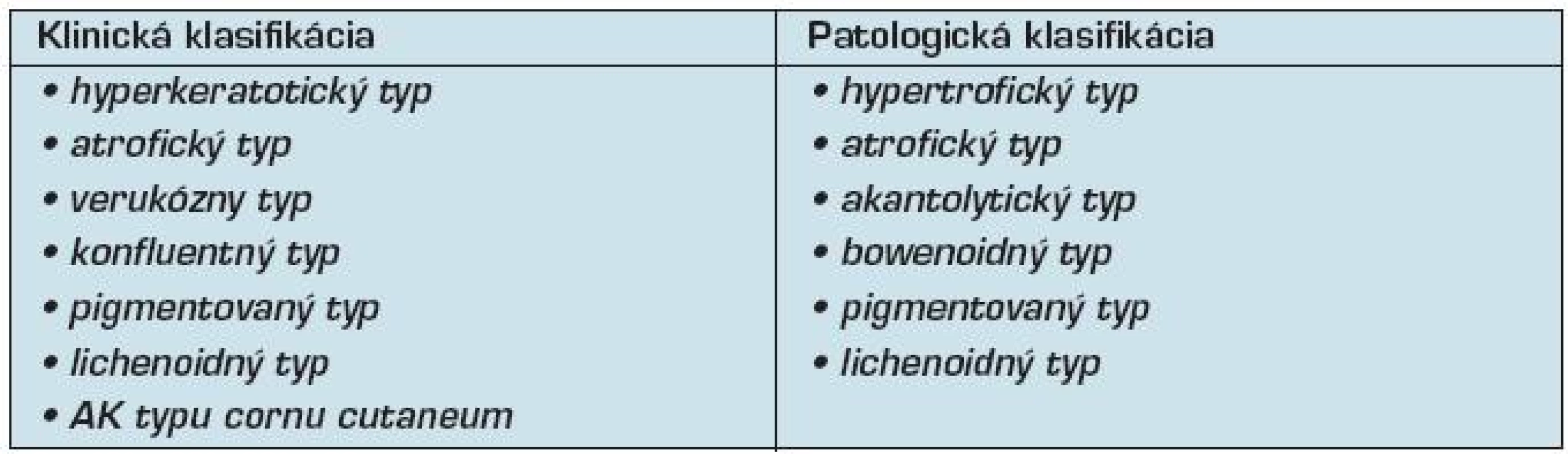
Základnou črtou všetkých uvedených typov sú atypie keratinocytov so stratou fyziologického vyzrievania epidermy (8, 17, 36). V závislosti od štádia ochorenia možno pozorovať rôzny stupeň atypií jadier a cytoplazmy, zvýšenú mitotickú aktivitu buniek, nález dyskeratocytov a ojedinele aj monocelulárne nekrózy (36). K bunkovým atypiám spočiatku dochádza iba v bazálnej vrstve epidermy, ale s pokročilosťou ochorenia atypické keratinocyty expandujú do vyšších vrstiev. Epiderma môže mať rôznu hrúbku s hypogranulózou a zvýraznenou parakeratózou a hyperkeratózou (17, 36). Bazálna membrána ostáva intaktná, hoci dermoepidermálna junkcia je často veľmi nepravidelná s množstvom epidermálnych protrúzií (rete ridges) do povrchových častí kória (8). V derme nachádzame solárnu denegeráciu (elastózu) väziva so zvýšenou vaskularizáciou a rôzne intenzívnym chronickým zápalovým infiltrátom (17, 36). Okrem uvedených znakov sa jednotlivé typy odlišujú niektorými špecifickými histomorfologickými nálezmi (17).
Hypertrofický typ
je charakteristický najmä rozšírením epidermy v dôsledku akantózy, ako aj predĺžením a zmnožením epidermálnych protrúzií (34, 36), ktoré môžu byť v pokročilejších štádiách nápomocnou diagnostickou črtou (36). Viditeľná je taktiež papilomatóza a výraznejšia hyperkeratóza striedajúca sa s parakeratózou (17) (obr. 1).
Image 1. Hypertrofický typ AK – akantoticky zhrubnutá epiderma s atypiami keratinocytov a výraznou parakeratózou a hyperkeratózou na povrchu (H&E, 400x). 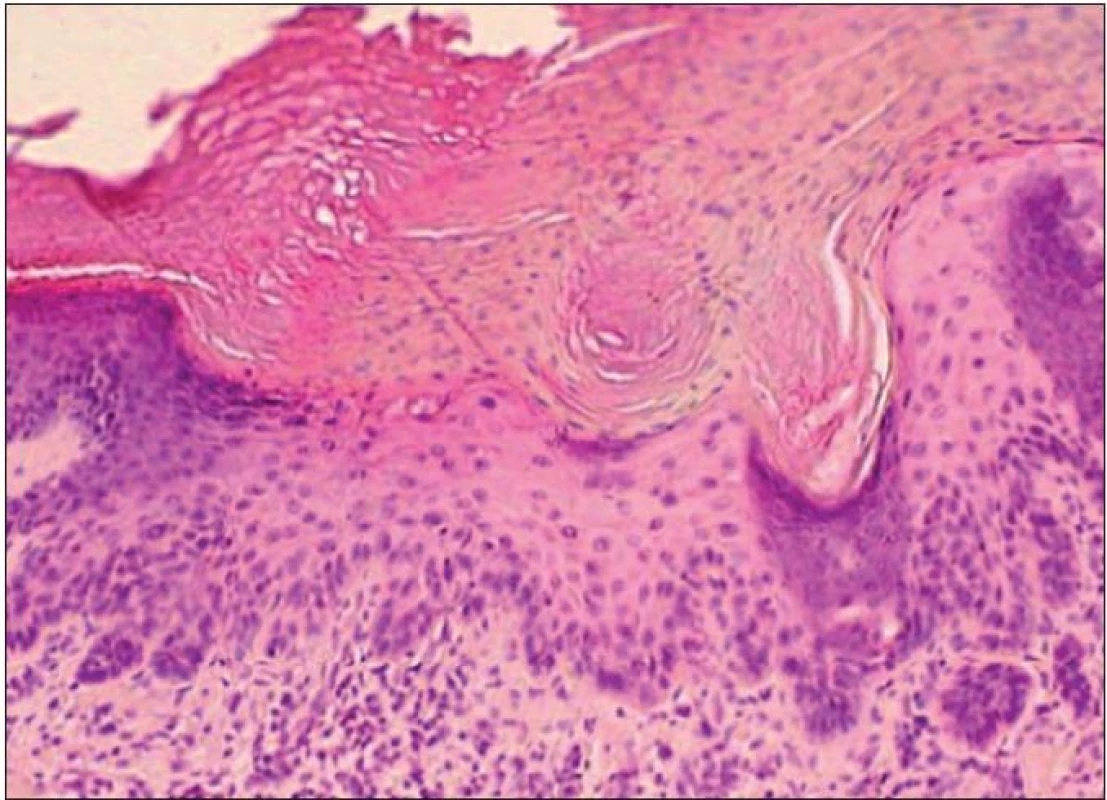
Atrofický typ
sa naopak prejavuje atroficky zmenenou epidermou a vymiznutím epidermálnych protrúzií (34). V prípade abscencie výraznejších atypií keratinocytov môže byť diagnosticky ľahko prehliadnutý. Často dochádza k infiltrácii bazálnej membrány a kožných adnex atypickými bunkami (17) (obr. 2)
Image 2. Atrofický typ AK – atroficky zmenená epiderma s fokálnou nevýraznou hyperkeratózou na povrchu. Atypické keratinocyty postihujú štruktúry vlasového folikulu (H&E, 400x). 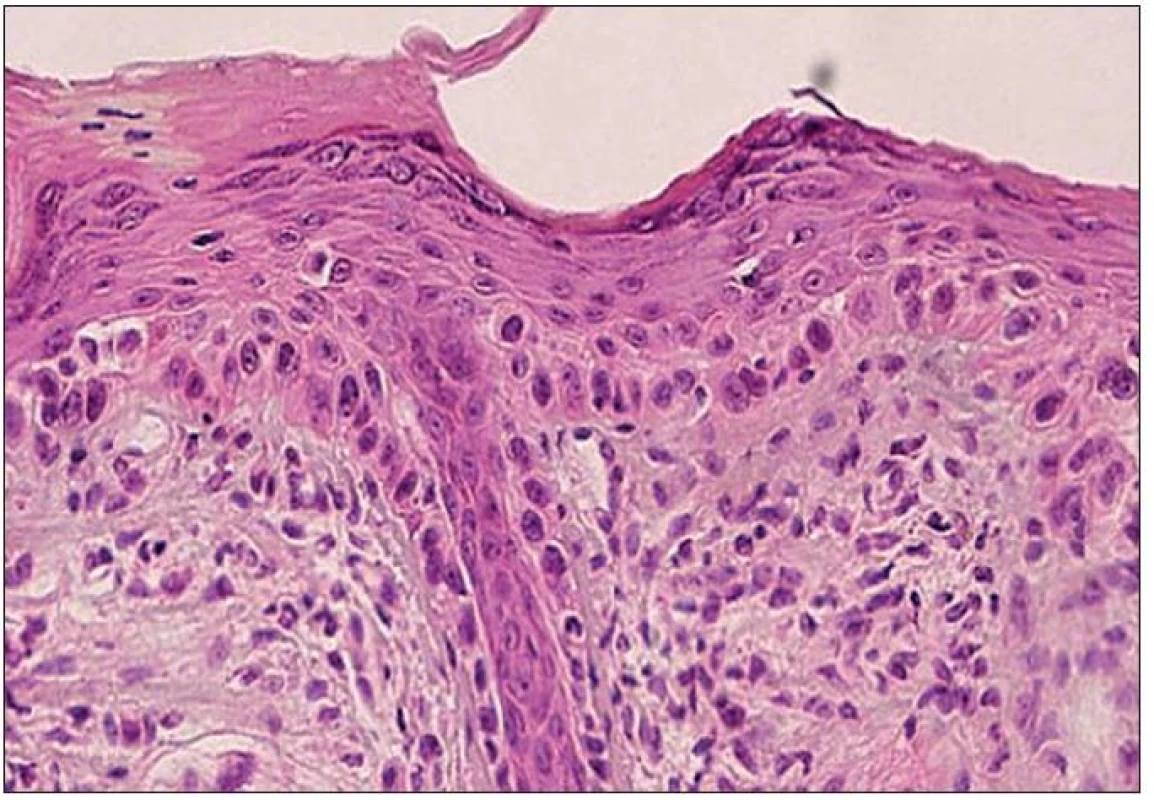
Akantolytický typ
sa vyznačuje akantolýzou epidermy a dyskeratózu rôzneho stupňa (34). Akantolýza je dôsledkom straty funkčných dezmozómov medzi keratinocytmi (36). Atypie keratinocytov napomáhajú v rozlíšení lézie od bežných akantolytických dermatóz.
Bowenoidný typ
je ťažko odlíšiteľný od Bowenovej choroby, z ktorou má podobné histologické črty. Na rozdiel od tohto ochorenia nie sú väčšinou prítomné atypie buniek v celej hrúbke epidermy, pričom ostávajú intaktné najmä oblasti vlasových folikulov a akrosyringeálne úseky (17). Pri Bowenovej chorobe je v kontraste s AK parakeratóza výraznejšia bez striedania úsekov ortokeratózy a parakeratózy (34).
Pigmentovaný typ
je charakteristický zvýšeným množstvom melanínového pigmentu v atypických keratinocytov epidermy a makrofágoch kória (17, 34).
Lichenoidný typ
vykazuje známky apoptózy keratinocytov, vakuolizáciu buniek a v povrchovej časti kória masívnejší lymfocytový infiltrát s prítomnými „koloidnými“ telieskami (17, 34). Vo včasných štádiách je epiderma akantoticky rozšírená, ale v pokročilejších léziách postupne atrofizuje (17). Od nenádorových lichenoidných lézií možno tento typ AK rozlíšiť pomocou atypií keratinocytov.
V praxi však často dochádza k prekrývaniu a kombinácii jednotlivých diagnostických čŕt (34), preto nie je mnohokrát možné priradiť léziu ku konkrétnemu histologickému typu a tým presne stanoviť ich percentuálne zastúpenie. V práci Changa a spol. (16) predstavoval
- hypertrofický typ 25 % prípadov,
- atrofický typ 21,3 %,
- kombinovaný hypertroficko-atrofický typ 18,1 %,
- bowenoidný typ 17,6 %,
- akantolytický typ 13,3 %, a
- pigmentovaný typ 4,7 % (obr. 3).
Image 3. Kombinovaný hypertroficko-atrofický typ AK – nepravidelne hrubá epiderma s atypiami keratinocytov a epiteovými protrúziami do papilárnej časti kória. Na povrchu je výrazná parakeratóza a hyperkeratóza, v kóriu chronická zápalová celulizácia (H&E, 400x). 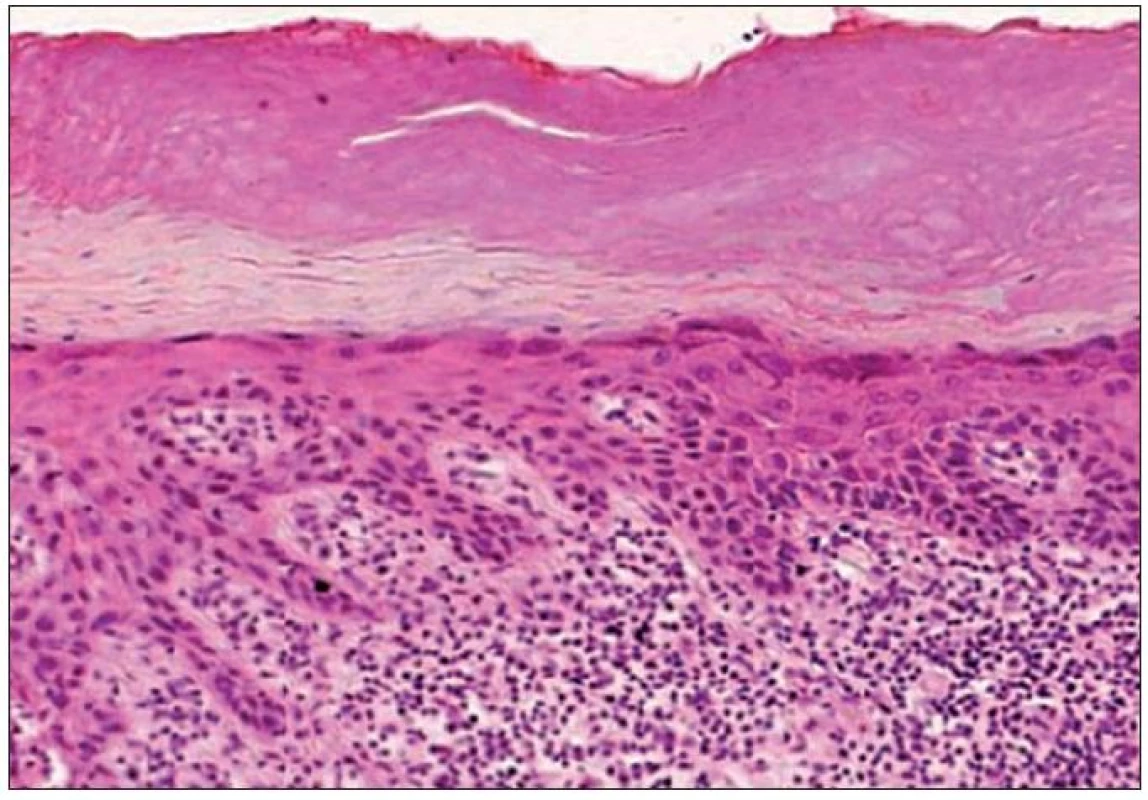
Etiopatogenéza a biologické správanie aktinickej keratózy
Názov aktinická keratóza bol pôvodne definovaný na báze makroskopického vzhľadu, respektíve klinických čŕt lézií bez ohľadu na ich histopatologický obraz a najmä biologické správanie (8). V súčasnosti je známe, že AK a SCC kože predstavujú jednu nozologickú jednotku v rozdielnom štádiu vývoja (7, 8, 26, 30, 36). K tomuto záveru sa postupne dospelo na základe viacerých poznatkov.
Obidve lézie vznikajú u ľudí prevažne na slnkom exponovaných častiach kože, pričom u väčšiny biopticky vyšetrovaných SCC možno v bezprostrednom okolí nádoru vidieť aj črty AK. Mittelbronn a spol. (25) potvrdili až v 82,4 % prípadov SCC kože nález AK, či už v priamom súvise s nádorovým ložiskom, alebo v jeho bezprostrednej blízkosti.
Nádorová transformácia keratinocytov indukovaná hlavným etiologickým faktorom – ultrafialovým (UV) žiarením je pri obidvoch typoch lézií sprevádzaná vznikom rovnakých mutácií tumor supresorického génu p53 (8). Aj cytomorfologické zmeny a alterácie ďalších génov sú v nich takmer identické (2, 7, 29, 36). Typ a početnosť chromozomálnych aberácií jasne napovedajú o spoločných mechanizmoch karcinogenézy keratinocytov v epiderme a dokazujú, že SCC kože sa vyvíja z postupne vzrastajúcich bunkových atypií (36).
AK a SCC teda predstavujú kontinuálny proces, ktorý začína poškodením DNA keratinocytov následkom UV žiarenia, pokračuje klonálnou expanziou buniek a končí invazívne rastúcim karcinómom (8, 18).
Na druhej strane je však uvedená schéma iba zjednodušená, pretože biologické správanie AK býva veľmi rôznorodé a závisí od mnohých faktorov. V princípe existujú tri formy priebehu ochorenia, ale v klinickej praxi nie je možné predpovedať, ktorý z nich nastane u konkrétnej lézie (30, 31).
Približne v 20–25 % prípadov dochádza k spontánnej regresii AK, najmä po odstránení vplyvu slnečného žiarenia (12, 21, 32, 38). Nie je však zriedkavosťou, že regredované lézie v danej lokalite po čase opäť recidivujú (12). Podľa Quaedvliega a spol. (32) v priebehu jedného roka opätovne recidivuje asi 15 % regredovaných AK. Lézie môžu taktiež perzistovať veľmi dlhé obdobie bez výraznejších zmien. V najnepriaznivejších prípadoch však dochádza k progresii do invazívneho karcinómu, väčšinou SCC, prípadne až k metastázam (27, 30).
Nádorová transformácia AK je postupný (multistep) proces, v ktorom rozoznávame 3 štádiá:
- iniciáciu,
- promóciu, a
- progresiu (27).
V štádiu iniciácie
vyvoláva UV žiarenie mutácie DNA keratinocytov, vrátane protoonkogénu ras a najmä tumor supresorického génu p53 (27). Za normálnych okolností kóduje gén p53 dôležitý fosfoproteín, ktorý participuje na kontrolných mechanizmoch bunkového cyklu a celkovom udržiavaní chromozómovej stability. V rámci reakcie na poškodenie DNA dochádza k jeho aktivácii, pričom jednou z odpovedí môže byť zastavenie bunkového cyklu, alebo spustenie apoptotických mechanizmov. V prípade mutácie p53 dochádza k tvorbe a hromadeniu jeho aberantného proteínového produktu v bunkách.
Viaceré štúdie preukázali pri AK výrazne zvýšenú expresiu proteínu p53 (4, 33, 37) a bcl-2 (4, 37), čo len potvrdzuje ich význam v patobiologických mechanizmoch ochorenia. Zaujímavé výsledky prezentovali vo svojej štúdii Barzilai a spol. (3), ktorí zistili, že pri AK a SCC vzniknutých v miestach kože so solárnou expozíciou, respektíve aktinickým poškodením, je imunohistochemická expresia p53 výrazná, zatiaľ čo v normálnej koži a SCC vzniknutých na koži nevystavenej slnečnému žiareniu bez známok aktinického poškodenia je nízka. Na základe toho predpokladajú, že aj molekulovo-biologické procesy vzniku SCC kože sú pravdepodobne rozdielne v závislosti od rozsahu pôsobenia UV žiarenia, čím by sa mohol odlišovať aj klinický priebeh a prognóza ochorenia. UV žiarenie zároveň potláča lokálne imunitné procesy kože (18, 31), čo taktiež prispieva k poklesu reparatívnych mechanizmov.
V štádiu promócie
dochádza vplyvom permanentnej expozície tzv. promotérov (chemických alebo fyzikálnych faktorov s prozápalovým efektom) ku klonálnej expanzii transformovaných buniek do intraepidermálnej neoplázie (27). Expanzia mutovaných bunkových klonov sa prejavuje ich hyperproliferáciou a supresiou apoptotických mechanizmov. Mutované klony sa vytvárajú na viacerých miestach aktinicky poškodenej kože, čo pravdepodobne vysvetľuje viacpočetnosť a rôznorodosť prejavov AK (18, 31). Tento fenomén sa nazýva „kancerizácia polí“ (field cancerization) a označuje oblasti kože v okolí nádoru, ktoré sú klinicky okultné, ale vykazujú multifokálne preneoplastické zmeny s genetickými mutáciami, ktoré predchádzajú vývoju ďalších primárnych nádorov a lokálnych recidív (9, 39).
V štádiu konverzie
dochádza v poškodených bunkách epidermy k ďalším genetickým alteráciám, ktoré postupne vedú k ich malignizácii a invazívnemu nádorovému rastu (27).
Malígny potenciál aktinickej keratózy a progresia ochorenia
Percentuálne riziko progresie AK do invazívneho SCC však v literatúre výrazne varíruje, nakoľko je objektívne ťažko hodnotiteľné a zároveň ovplyvnené viacerými ukazovateľmi. K najvýznamnejším rizikovým faktorom patrí
- imunosupresívny stav pacienta,
- vyšší vek,
- svetlý typ kože,
- predchádzajúca lokálna radiačná terapia, a
- osobná alebo rodinná anamnéza zhubného nádorového ochorenia kože (27, 32).
Hodnotenie rizika transformácie AK do invazívneho SCC sťažuje aj fakt, že u osôb s kožou výrazne poškodenou slnečným žiarením je presné stanovenie počtu AK veľmi problematické, nakoľko sa lézie môžu manifestovať vo forme vzájomne splývajúcich ložísk (32). V rámci objektívneho hodnotenia by navyše museli byť aj všetky lézie bioptizované a histologicky vyšetrované, čo v praxi mnohokrát nie je možné. Aj napriek tomu sa však odhaduje, že v prípadoch neliečených AK je pravdepodobnosť progresie do invazívneho SCC počas jedného roka približne 0,1–0,2 % na každú léziu (21, 22). Keďže u mnohých pacientov však dochádza v priebehu života k vzniku viacerých lézií, extrapoláciou údajov zohľadňujúcich priemerný počet AK u jednotlivých pacientov sa zistilo, že riziko progresie AK do invazívneho SCC je na osobu počas 10-ti ročného obdobia približne 10 % (11, 14).
Hoci toto riziko nie je štatisticky vysoké, v klinickej praxi je problémom, že sa všeobecne vzťahuje na celkovú populáciu a nemôže objektívne slúžiť na hodnotenie rizika pre jednotlivé lézie u konkrétneho pacienta (14). Navyše nie je možné určiť moment, od ktorého nadobúda intraepidermálna neoplázia schopnosť invadovať bazálnu membránu a infiltrovať dermu (36). V dermatologickej praxi by preto bolo veľkým prínosom rozlíšenie vysoko-rizikových (high risk) a nízko-rizikových (low risk) AK, už aj z toho dôvodu, že mnohé lézie nemožno klinicky jednoznačne diferencovať od včasného invazívneho SCC, čím je aj celkový manažment pacienta diskutabilný (32).
Aj napriek početným štúdiám však nie sú stanovené jednoznačné rizikové prognostické ukazovatele ochorenia. Quaedvlieg a spol. (32) sa pokúsili aspoň čiastočne selektovať veľké (major) a malé (minor) klinické kritériá (tab. 2), ktoré by v praxi pomohli rozpoznať AK s horšou prognózou. Najdôležitejšie parametre označili akronymom IDRBEU, ktorý zahrňuje nasledovné názvy:
- zatvrdnutie a zápal lézie (I – induration & inflammation),
- rozmer lézie > 1 cm (D – diameter),
- náhle zväčšenie lézie (R – rapid enlargement),
- krvácanie lézie (B – bleeding),
- začervenanie lézie (E – erythema), a
- ulceráciu lézie (U – ulceration).
Table 2. Veľké a malé klinické kritériá predpovedajúce riziko progresie AK do invazívneho SCC kože (32). 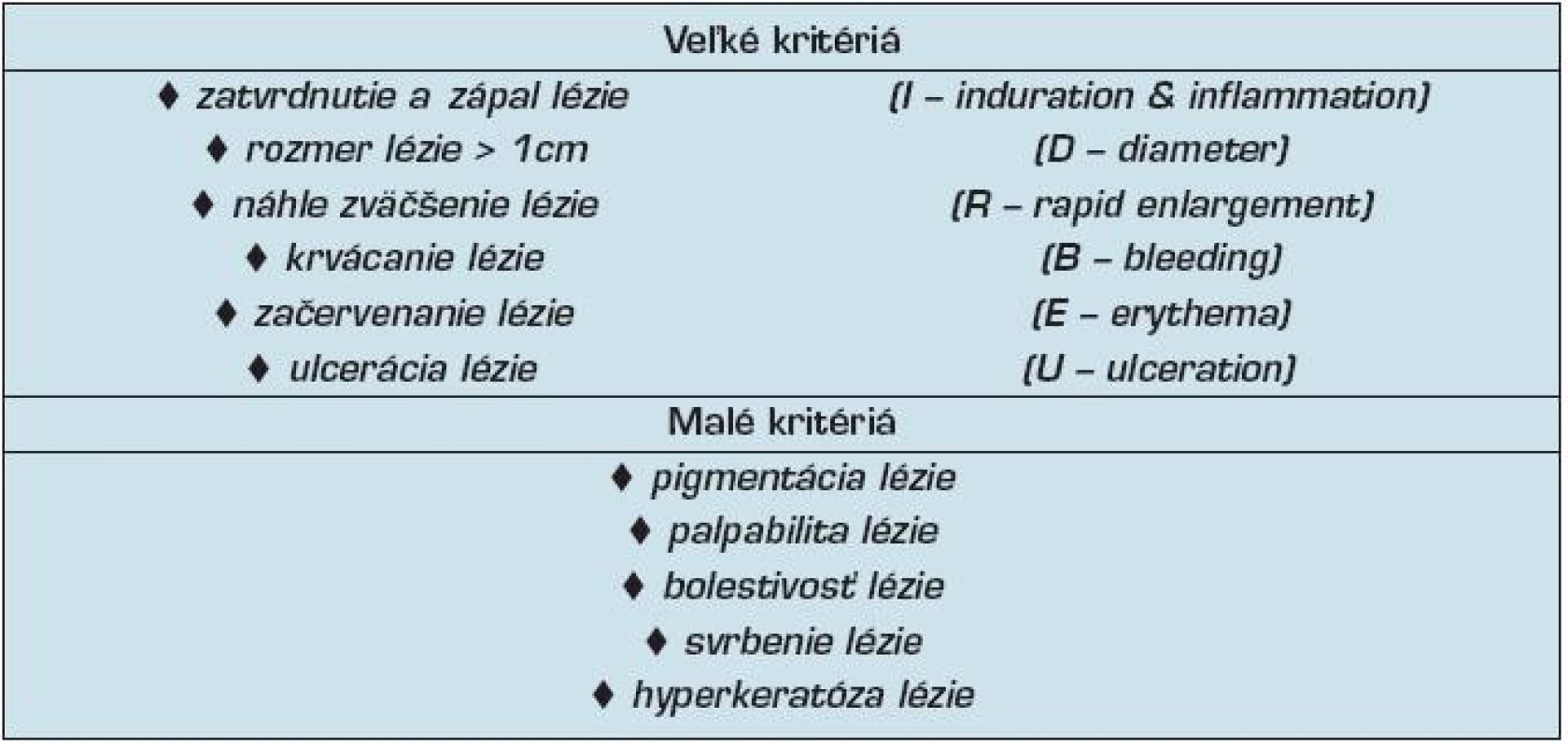
Ani pri bioptickom vyšetrení však nie je možné predpovedať, ktoré histomorfologické parametre, respektíve typy AK majú väčšiu pravdepodobnosť transformácie do invazívneho SCC.
Ramzi a spol. (33) predpokladajú, že najvyšší malígny potenciál má bowenoidný typ AK a najnižší akantolytický a atrofický typ. Berhane a spol. (4) postulujú teóriu, že na konverzii AK do SCC sa vo významnej miere podieľa zápalová infiltrácia, ktorá môže byť spúšťačom malígnej konverzie, a teda indikátorom horšej prognózy. Na druhej strane podľa iných zdrojov (36) stupeň a kvalita zápalovej odpovede nesúvisí s rozsahom cytologických atypií alebo inváziou do dermy, ale skôr ide o individuálnu funkciu tkaniva hostiteľa.
Za nepriaznivý typ s vysokým malígnym potenciálom považujú Goldberg a spol. (15) proliferatívny typ AK, ktorý je rezistentný na konvenčné terapeutické postupy. Histologicky je charakteristický zoskupeniami dysplastických keratinocytov rastúcich paralelne s bazálnou vrstvou a migrujúce hlboko nadol pozdĺž vlasových folikulov a potných žliazok.
Pre patológov prináša zaujímavé poznatky štúdia Caraga a spol. (6), v ktorej prospektívne analyzovali vzorky 69 kožných lézií, pri ktorých bola v prvých histologických rezoch stanovená diagnóza AK. Tieto excízie dávali dodatočne hlbšie zrezať a po opakovanom spracovaní potvrdili až v 23 vzorkách (33 %) ďalšie diagnózy, ktoré
- v 9 prípadoch (13 %) predstavoval in situ SCC,
- v 3 prípadoch (4 %) bazocelulárny karcinóm, a
- v 2 prípadoch (3 %) invazívny SCC.
Na základe toho konštatujú, že v biopsiách s prvotnou diagnózou AK je veľmi užitočné ich hlbšie zrezanie, ktoré môže prispieť k odhaleniu včasných nádorových ložísk.
Hoci sa v rutínnej bioptickej praxi väčšinou excízie sériovo nezrezávajú, výsledok tejto štúdie len potvrdzuje patogenetickú dôležitosť AK ako prekurzora malígnych neoplázií a ich priamy patogenetický súvis.
Koncepcia keratinocytovej intraepidermálnej neoplázie
Pokým diagnostika invazívne rastúceho SCC je pri mikroskopickom vyšetrení pomerne jednoduchá, v bioptickej praxi robí problém najmä rozlíšenie vyvinutej AK od in situ SCC (8, 19). Keďže medzi nimi neexistuje žiadna ostrá hranica, nie je prekvapujúce, že doteraz neboli konsenzuálne stanovené ich jednoznačné diferenciálno-diagnostické kritériá (19, 20). Väčšina dermatopatológov odlišuje AK od in situ SCC podľa rozsahu bunkových atypií epidermy. Ak sa atypické keratinocyty vyskytujú v celej hrúbke epidermy, lézia je označovaná ako in situ SCC, zatiaľ čo atypie nezahrňujúce kompletne celú epidermu spadajú ešte pod diagnózu AK (1, 19, 20). Definitívne stanovenie diagnózy je však vo veľkej miere subjektívne (19, 20) a uvádza sa (19), že konečné rozhodnutie či je lézia AK, alebo in situ karcinóm závisí iba na individuálnom pohľade a zaužívanej praxi patológa.
Základným problémom však ostáva, že označenie AK má charakter „stacionárneho stavu” a nereflektuje vyvíjajúci sa patobiologický proces lézie (8). Keďže proces malígnej transformácie AK a vzniku SCC kože je podobný s mechanizmom vzniku SCC krčka maternice u žien nazývaný cervikálna intraepitelová neoplázia (CIN), podobná klasifikačná schéma bola navrhnutá (7, 8, 40) aj pri nádorových zmenách epidermy s označením keratinocytová intraepidermálna neoplázia (KIN). Tento 3-stupňový „gradingový” systém reflektuje prognosticky sa zhoršujúce zmeny v slede
KIN I → KIN II → KIN III
a omnoho lepšie vystihuje proces postupnej malignizácie epidermy (tab. 3).
Table 3. Kritéria pre „grading” keratinocytovej intraepidermálnej neoplázie (8, 13, 40) 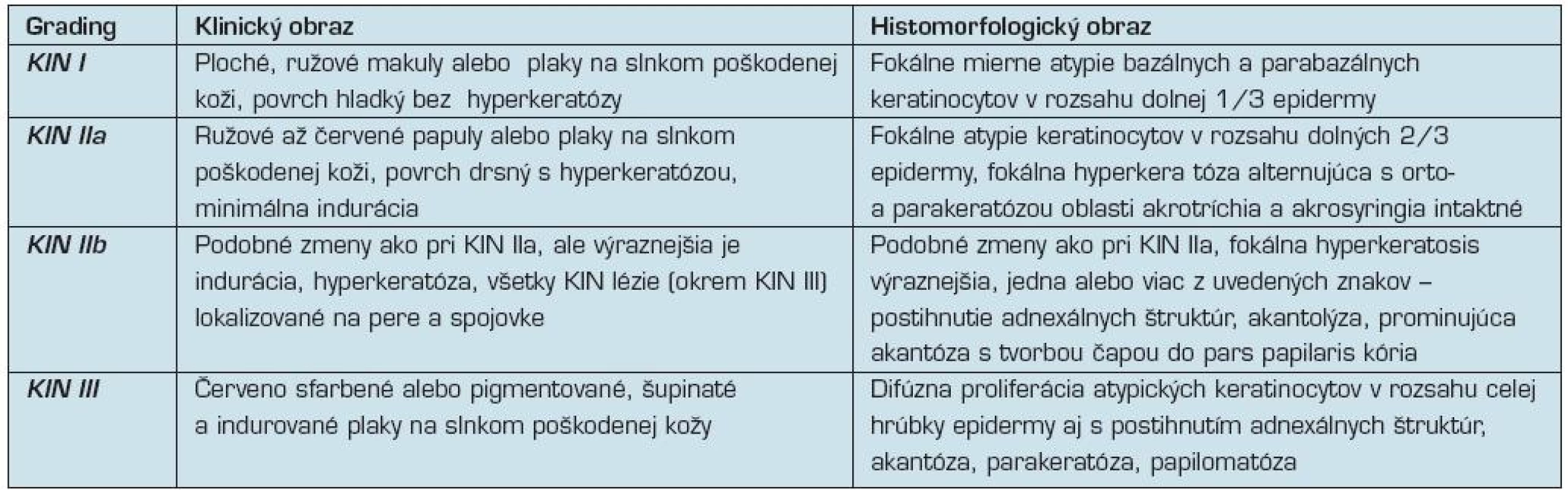
Včasné, zvyčajne subklinické štádium ochorenia je označované ako KIN I.
V prípade, že sú lézie klinicky viditeľné, majú väčšinou vzhľad plochých naružovelých makúl alebo plakov vyskytujúcich sa na solárne poškodenej koži. Histologicky vykazujú jadrá bazálnych a suprabazálnych buniek epidermy rôznu veľkosť a stupeň hyperchrómie s výskytom prominujúcich jadierok. Zvyčajne si zachovávajú okrúhly či oválny tvar, ale často dochádza k strate ich polarity a mnohé z buniek majú pretiahnuté jadrá orientované v rôznych uhloch namiesto typického kolmého postavenia k povrchu epidermy. Hyperkeratóza ani parakeratóza nie sú prítomné.
Histomorfologické a cytologické abnormality sú pri KIN I léziách väčšinou iba nevýrazné bez postihnutia adnexálnych štruktúr (7, 8, 40).
Ďalšie štádium ochorenia predstavuje KIN II.
Klinicky sa tieto lézie prejavujú ako ružové až červené papuly alebo plaky s drsným, hyperkeratotickým povrchom a induráciou. Uvedené štádium najviac korešponduje s léziami v praxi bežne označovanými ako AK.
V mikroskopickom obraze dominuje fokálna proliferácia atypických keratinocytov, ktorá postihuje spodné 2/3 epidermy. Už pri malom zväčšení sú viditeľné úseky atypických keratinocytov striedajúce sa s úsekmi intaktnej epidermy, najmä v oblastiach akrotríchia a akrosyringia. V postihnutých partiách vykazujú keratinocyty pleomorfiu jadier aj cytoplazmy (eozinofíliu, bazofíliu, dyskeratózu, vakuolizáciu), ktoré sú výraznejšie ako pri KIN I. V niektorých prípadoch dochádza aj k akantolýze a zvýšenej melanínovej pigmentácii.
Bazálna a suprabazálna vrstva obsahuje väčší počet mitóz. Na povrchu epidermy sú prítomné úseky nepravidelnej parakeratózy alternujúce s ortokeratózou (7, 8, 40).
KIN III je najpokročilejšou formou intraepidermálnej nádorovej keratinocytovej proliferácie.
Lézie sa makroskopicky zvyčajne prejavujú ako načervenalé, šupinaté plaky prítomné na koži výrazne poškodenej slnečným žiarením. Histologicky je viditeľná proliferácia atypických keratinocytov postihujúca celú hrúbku epidermy vrátane adnexálnych štruktúr. Akantóza je často nepravidelná a strieda sa s úsekmi
- papilomatózy,
- hyperkeratózy,
- parakeratózy,
- hypogranulózy, prípadne
- akantolýzy.
Keratinocyty môžu vykazovať výrazné atypie jadier a cytoplazmy, dyskeratotické zmeny a zvýšený počet abnormálnych mitóz. KIN III je recentne označovaná ako in situ SCC, alebo Bowenova choroba (7, 8, 40).
Podobne ako pri karcinóme krčka maternice sú KIN I a KIN II lézie klasifikované ako low-grade KIN, ktorá v dermatologickej praxi korešponduje s termínom aktinická keratóza.
KIN III je považovaná za high-grade KIN a predstavuje in situ karcinóm (13, 36).
Niektorí autori (35) navrhli pre AK modifikovaný klasifikačný systém, ktorý je odvodený od KIN modelu a jednotlivé lézie označuje ako SCC v nasledovnej schéme:
- včasný SCC in situ typu AK I;
- včasný SCC in situ typu AK II;
- SCC in situ typu AK III;
Pozitívom uvedených systémov je lepšie pochopenie podstaty diagnózy (nie stacionárny stav lézie, ale postupne sa vyvíjajúci proces) a odstránenie „benígne“ pôsobiaceho názvu keratóza. V praxi môže zároveň napomáhať pri klinickom manažmente a špecifických liečebných odporúčaniach. Na druhej strane však treba pripomenúť, že KIN klasifikácia doteraz nenašla všeobecné uplatnenie a o jej aplikácii sa vedú mnohé kontroverzné diskusie.
Uvedený „gradingový“ systém totiž naráža v bioptickej diagnostike na viaceré nedostatky a nemožno ho považovať za presný analóg CIN klasifikácie zaužívaný v onkogynekológii.
Ako už bolo uvedené, lézie typu AK môžu mať rôznorodý histologický obraz a vzhľad nádorovo transformovanej epidermy, pričom tieto črty sa môžu meniť či kombinovať aj v rámci jednej lézie. Uvedený fakt vo veľkej miere sťažuje objektívne hodnotenie rozsahu atypických keratinocytov v pomere k celkovej hrúbke epidermy. Taktiež sa uvádza (36), že pri mikroskopickom vyšetrení AK nie je zriedkavosťou vidieť malé ložiská stromálnej invázie v léziách, ktoré nemajú atypie buniek v rozsahu celej hrúbky epidermy. Tieto karcinómy pravdepodobne nevznikajú z kontinuálneho procesu malignizácie, ale do invazívneho karcinómu progredujú priamo z včasného štádia bazálnych bunkových atypií (36). Niektorí autori (20) preto v bioptickej praxi stále preferujú používanie tradičných názvov AK a SCC.
Záver
V našom príspevku sme prezentovali základné poznatky o histomorfologickej diagnostike a biologickom správaní aktinickej keratózy. V súčasnosti sa diskutuje, či je túto léziu vhodnejšie označovať ako prekancerózu alebo ako skvamocelulárny karcinóm in situ. Priebeh ochorenia býva totiž rôznorodý, pričom lézie môžu spontánne regredovať, recidivovať, pretrvávať bez zmien dlhé obdobie, alebo progredovať do invazívneho karcinómu. V klinickej praxi však nie je možné z istotou predpovedať, ktorá alternatíva nastane u konkrétnej lézie, nakoľko spoľahlivé prediktory priebehu ochorenia nepoznáme. Preto aj v súčasnosti pretrváva potreba ďalších štúdií zameraných na patogenézu a biologické správanie AK, ktoré sú najmä v klinickej praxi podporované dilemou, či všetky lézie bezpodmienečne vyžadujú liečbu a aká forma terapie je pri konkrétnych léziách optimálna.
MUDr. Vladimír Bartoš
Oddelenie patologickej anatómie FNsP v Žiline
V. Spanyola 43
012 07 Žilina, Slovenská republika
E-mail: bartos@jfmed.uniba.sk
Sources
1. Ackerman, A.B. Solar keratosis is squamous cell carcinoma. Arch. Dermatol. 2003, 139, p. 1216–1217.
2. Ashton, K.J., Weinstein, S.R., Maguire, D.J., Griffiths, L.R. Chromosomal aberrations in squamous cell carcinoma and solar keratoses revealed by comparative genomic hybridization. Arch. Dermatol. 2003, 139, p. 876-882.
3. Barzilai, A., Lyakhovitsky, A., Trau, H. et al. Expression of p53 in the evolution of squamous cell carcinoma: correlation with the histology of the lesion. J. Am. Acad. Dermatol. 2007, 57(4), p. 669-676.
4. Berhane, T., Halliday, G.M., Cooke, B., Barnetson, R.S. Inflammation is associated with progression of actinic keratoses to squamous cell carcinomas in humans. Br. J. Dermatol. 2002, 146, p. 810-815.
5. Berman, B., Bienstock, L., Kuritzky, L. et al. Actinic keratoses: sequelae and treatments. Recommendations from a consensus panel. J. Fam. Pract. 2006, 55(5), S1-S8.
6. Carag, H.R., Prieto, V.G., Yballe, L.S., Shea, C.R. Utility of step sections: Demonstration of additional pathological findings in biopsy samples initially diagnosed as actinic keratosis. Arch. Dermatol. 2000, 136, p. 471-475.
7. Cockerell, C.J. Histopathology of incipient intraepidermal squamous cell carcinoma (“actinic keratosis”). J. Am. Acad. Dermatol. 2000, 42(1 Pt 2), p. 11–17.
8. Cockerell, C.J., Wharton, J.R. New histopathological classification of actinic keratosis (incipient intraepidermal squamous cell carcinoma). J. Drugs. Dermatol. 2005, 4(4), p. 462-473.
9. Deltondo, J.A., Helm, K.F. Actinic keratosis: precancer, squamous cell carcinoma, or marker of field cancerization? G. Ital. Dermatol. Venereol. 2009, 144(4), p. 441-444.
10. Divišová, B., Cetkovská, P., Pizinger, K. Nejčastější maligní epitelové kožní nádory. Onkologie 2010, 4(4), s. 230-232.
11. Dodson, J.M., DeSpain, J., Hewett, J.E., Clark, D.P. Malignant potential of actinic keratoses and the controversy over treatment. A patient-oriented perspective. Arch. Dermatol. 1991, 127, p. 1029-1031.
12. Frost, C., Williams, G., Green, A. High incidence and regression rates of solar keratoses in a Queensland community. J. Invest. Dermatol. 2000, 115, p. 273-277.
13. Fu, W., Cockerell, C.J. The actinic (solar) keratosis: a 21st-century perspective. Arch. Dermatol. 2003, 139(1), p. 66–70.
14. Glogau, R.G. The risk of progression to invasive disease. J. Am. Acad. Dermatol. 2000, 42(1) Suppl 1, S23-S24.
15. Goldberg, L.H., Chang, J.R., Baer, S.C., Schmidt, J.D. Proliferative actinic keratosis: three representative cases. Dermatol. Surg. 2000, 26(1), p. 65-69.
16. Chang, S.N., Chun, S.I., Kim, S.N. et al. Clinical and histopathological observations of actinic keratoses in Korea. Korean J. Dermatol. 1997, 35(5), p. 931-939.
17. James, C., Crawford, R.I., Martinka, M., Marks, R. Actinic keratosis. In LeBoit P, Burg G, Weedon D, Sarasin A. World Health Organization Classification of Tumours, Pathology and Genetics of Skin tumours. Lyon: IARCPress, 2006; p. 30-33.
18. Litvik, R., Paciorek, M., Vantuchová, Y. Příspěvek k léčbě aktinických keratóz. Dermatol. praxi 2009, 3(4), s. 184-187.
19. Lober, B.A., Lober, C.W. Actinic keratosis is squamous cell carcinoma. Southern Med. J. 2000, 93, p. 650-657.
20. Lohmann, C.M., Solomon, A.R. Clinicopathologic variants of cutaneous squamous cell carcinoma. Adv. Anat. Pathol. 2001, 8(1), p. 27-36.
21. Marks, R., Foley, P., Goodman, G. et al. Spontaneous remission of solar keratoses: the case for conservative management. Br. J. Dermatol. 1986, 115, p. 649-655.
22. Marks, R., Rennie, G., Selwood, T.S. Malignant transformation of solar keratoses to squamous cell carcinoma. Lancet 1988, 1, p. 795-797.
23. Massa, A., Alves, R., Amado, J. et al. Prevalence of cutaneous lesions in Freixo de Espada a Cinta. Acta Med. Port. 2000, 13, p. 247-254.
24. Memon, A.A., Tomenson, J.A., Bothwell, J., Friedmann, P.S. Prevalence of solar damage and actinic keratosis in a Merseyside population. Br. J. Dermatol. 2000, 142, p. 1154-1159.
25. Mittelbronn, M.A., Mullins, D.L., Ramos-Caro, F.A., Flowers, F.P. Frequency of pre-existing actinic keratosis in cutaneous squamous cell carcinoma. Int. J. Dermatol. 1998, 37, p. 677-681.
26. Moy, R.L. Clinical presentation of actinic keratoses and squamous cell carcinoma. J. Am. Acad. Dermatol. 2000, 42, S8-S10.
27. Murad, A. Actinic keratoses: prevalence, pathogenesis, presentation, and prevention. Adv. Stud. Med. 2006, 6 (8A), S785-S790.
28. Naldi, L., Chatenoud, L., Piccitto, R. et al. Prevalence of actinic keratoses and associated factors in a representative sample of the Italian adult population: Results from the prevalence of actinic keratoses Italian study, 2003-2004. Arch. Dermatol. 2006, 142 (6), p. 722-726.
29. Padilla, R.S., Sebastian, S., Jiang, Z. et al. Gene expression patterns of normal human skin, actinic keratosis, and squamous cell carcinoma: a spectrum of disease progression. Arch. Dermatol. 2010, 146(3), p. 288-293.
30. Poláková, K. Nemelanómová rakovina kože – I. časť: Etiopatogenéza a klinický obraz. Dermatol. praxi 2008, 3, s. 112-115.
31. Poláková, K. Účinky topického imudomodulátoru (imiquimodu) v léčbe aktinické keratózy. Dermatol. praxi 2010, 4(2), s. 83-85.
32. Quaedvlieg, P.J., Tirsi, E., Thissen, M.R. et al. Actinic keratosis: how to differentiate the good from the bad ones ? Eu. J. Dermatol. 2006, 16(4), p. 335-339.
33. Ramzi, S.T., Maruno, M., Khaskhely, N.M. et al. An assessment of the malignant potential of actinic keratoses and Bowen’s disease; p53 and PCNA expression pattern correlate with the number of desmosomes. J. Dermatol. 2002, 29, p. 562-572.
34. Roewert-Huber, J. Actinic keratosis. In Stockfleth E (Eds). Managing skin cancer. Berlin, Heildelberg: Springer-Verlag, 2010, p. 20-21. ISBN 978-3-540-79346-5.
35. Rowert-Huber, J., Patel, M.J., Forschner, T. et al. Actinic keratosis is an early in situ squamous cell carcinoma: a proposal for reclassification. Br. J. Dermatol. 2007, 156 Suppl 3, p. 8-12.
36. Smoller, B.R. Squamous cell carcinoma: from precursor lesions to high-risk variants. Mod. Pathol. 2006, 19, (Suppl 2) S88-S92.
37. Stanimirovic, A., Cupic, H., Bosnjak, B. et al. Expression of p53, bcl-2 and growth hormone receptor in actinic keratosis, hypertrophic type. Arch. Dermatol. Res. 2003, 295, p. 102-108.
38. Thompson, S.C., Jolley, D., Marks, R. Reduction of solar keratoses by regular sunscreen use. N. Engl. J. Med. 1993, 329, p. 1147-1151.
39. Vatve, M., Ortonne, J.P., Birch-Machin, M.A., Gupta, G. Management of field change in actinic keratosis. Br. J. Dermatol. 2007, 157 (Suppl 2), p. 21-24.
40. Yantsos, V.A., Conrad, N., Zabawski, E., Cockerell, C.J. Incipient intraepiderrnal cutaneous squamous cell carcinoma: A proposal for reclassifying and grading solar (actinic) keratoses. Semin. Cutan. Med. Surg. 1999, 18, p. 3-14.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2011 Issue 11-
All articles in this issue
-
Základy kognitivní, afektivní a sociální neurovědy
XI. Sociální rozhodování - Probiotika z pohledu praktického lékaře – klinické indikace pro podání probiotik, výsledky dotazníkového šetření mezi praktickými lékaři
- Aktinická keratóza: poznatky o biologickom správaní a klinicko-patologických aspektoch ochorenia z pohľadu bioptika
- Koordinovanost ucelené rehabilitace
- Diagnostika pľúcnej tromboembólie – úskalia CT angiografie
- Rizikové a škodlivé pití alkoholu u mladých dospělých: demografické a sociální souvislosti
- Aktuálne odporúčania pre prevenciu a liečbu fibrilácie predsiení a jej tromboembolických komplikácií
- Kalprotektin ve stolici
-
Základy kognitivní, afektivní a sociální neurovědy
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kalprotektin ve stolici
- Probiotika z pohledu praktického lékaře – klinické indikace pro podání probiotik, výsledky dotazníkového šetření mezi praktickými lékaři
- Diagnostika pľúcnej tromboembólie – úskalia CT angiografie
- Aktinická keratóza: poznatky o biologickom správaní a klinicko-patologických aspektoch ochorenia z pohľadu bioptika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

