-
Medical journals
- Career
Nové léky pro léčbu infekce HIV/AIDS a revize evropské a revize evropské klasifikace HIV/AIDS
Authors: D. Sedláček
Authors‘ workplace: Vedoucí: doc. MUDr. Dalibor Sedláček, CSc. ; AIDS centrum FN Plzeň
Published in: Prakt. Lék. 2008; 88(11): 643-647
Category: Various Specialization
Overview
Jsou uvedeny základní informace o nových přípravcích pro léčbu infekce HIV/AIDS, které jsou postupně zaváděny do klinické praxe. Ve druhé části sdělení je porovnávána současná revidovaná evropská klasifikace HIV/AIDS s původní, platnou od roku 1993.
Klíčová slova:
nová antiretrovirotika, etravirin, raltegravir, maraviroc, léčba HIV/AIDS, klasifikace infekce HIV.Nové léky pro léčbu infekce HIV/AIDS
Od roku 1987, kdy bylo do klinické praxe zavedeno první kauzálně působící antiretrovirotikum (azidothymidin – AZT, v anglosaské literatuře označovaný častěji jako zidovudin – ZDV) uplynula již více než dvě desetiletí. Za tuto dobu vědy zaměřené na výzkum retrovirů učinily velký pokrok. Převratné objevy byly učiněny jak v základním, tak aplikovaném výzkumu. Byl poznán replikační cyklus HIV, detailně prozkoumán jeho genom a na základě získaných poznatků vědci v řadě zemí (ČR nevyjímaje) zkonstruovali mnoho stovek molekul, které byly později podrobeny preklinickým, a ty nadějné, i klinickým zkouškám. Proběhly tak stovky klinických studií, v nichž úspěšně obstálo nevelké množství přípravků – antiretrovirotik, jež dnes využíváme v klinické praxi (tab. 1).
Table 1. Přehled generických názvů v ČR komerčně dostupných a používaných antiretrovirotik a jejich kombinací 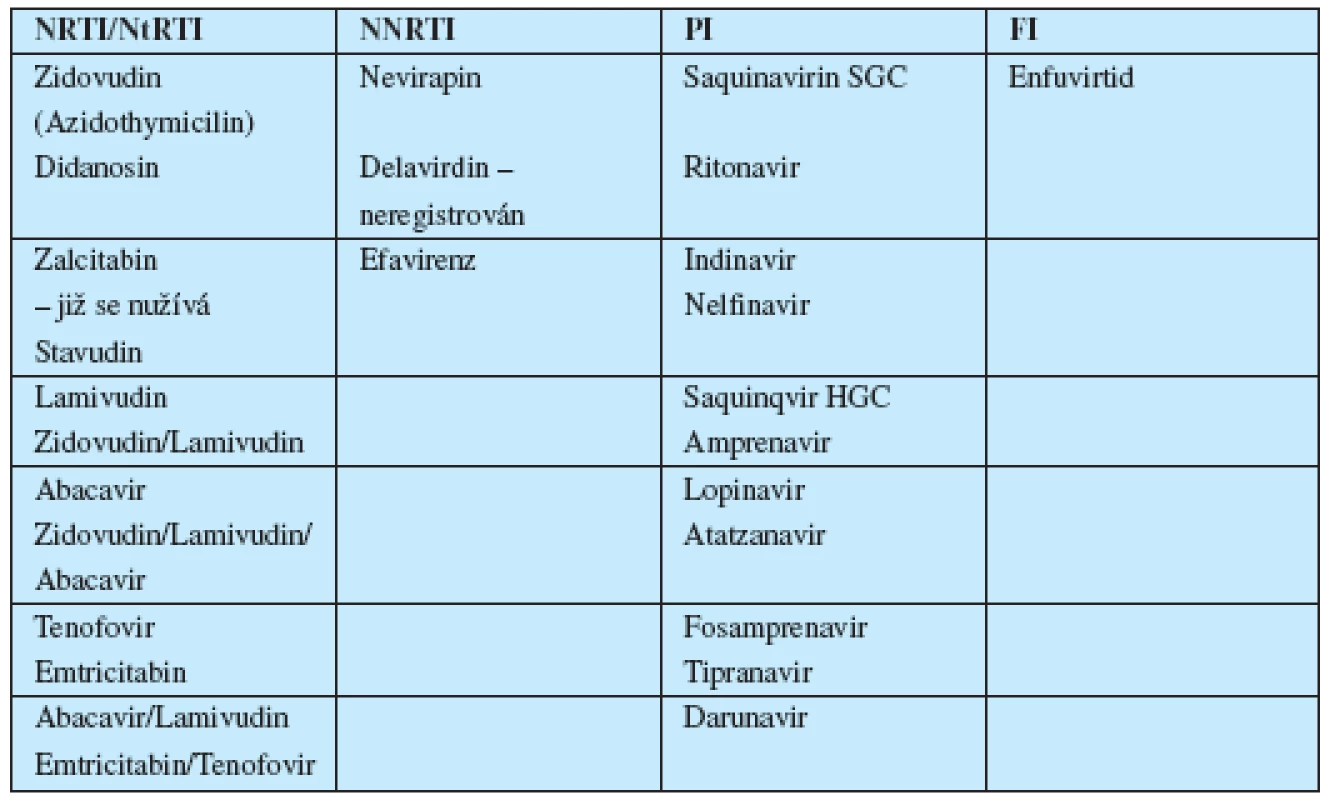
Jednotlivá léčiva blokují různá místa replikačního cyklu HIV nebo některé receptory hostitelských cílových buněk. Podle toho je dělíme na:
- nukleosi(ti)dové inhibitory reverzní transkriptázy HIV (N(t)RTI),
- nenukleosidové inhibitory reverzní transkriptázy HIV (NNRTI),
- inhibitory HIV integrázy (II),
- inhibitory HIV proteázy (PI),
- inhibitory maturace (MI),
- inhibitory vstupu (EI),
mezi ně patří:
- inhibitory fúze (FI),
- inhibitory buněčných receptorů CD4, a
- antagonisté chemokinových koreceptorů CCR5 a CXCR4.
Zmíněné EI, II a MI jsou novými třídami antiretrovirotik, k nimž se upíná velká pozornost a do nichž jsou vkládány velké naděje.
Přes veškerý pokrok řady příbuzných vědních oborů se zatím nepodařilo připravit lék, kterým by bylo možno infekci HIV/AIDS zcela vyléčit. Přesto bylo učiněno mnoho pozitivního – u pacientů s dobrou adherencí k léčbě jsme schopni dlouhodobě inhibovat replikaci HIV, a tím výrazně zpomalit progresi onemocnění, které ještě v nedávné době končívalo smrtí často za dramatických okolností. Kvalitní léčba výrazně zpomaluje množení HIV v cílových CD4+ buňkách, čímž chrání zbylé intaktní CD4+ lymfocyty T před napadením a postupnou destrukcí. Imunitní systém se tak může pozvolna restaurovat a vykonávat z větší části funkce, k nimž byl určen. Z tohoto pohledu se infekce HIV dnes stává chronickým léčitelným, ale dosud nevyléčitelným onemocněním (3).
Od objevu HIV letos uplynulo 25 let. K dispozici dnes máme mnoho validních informací týkajících se prevence, diagnostiky a léčby jak pro laiky, tak samozřejmě pro lékaře. Přesto jsme bohužel stále svědky toho, že někteří nemocní přicházejí ve značně pokročilém stavu (byť byli opakovaně vyšetřováni lékaři různých odborností), kdy jim lze pomoci jen velmi obtížně. Dalším nešvarem je falešný pocit bezpečí ze strany některých pacientů, kteří z nepochopitelných důvodů ztrácejí z infekce HIV respekt a začínají se chovat rizikově. Své jednání sobě a svému okolí často odůvodňují neopodstatněnou důvěrou v léčebné možnosti, které má současná medicína k dispozici. Předpokládají totiž, že v případě nákazy bude jejich infekce zvládnuta tak, jak je tomu např. u banálních infekčních onemocnění.
Přes zmíněné úspěchy je léčba spojena s velkými problémy stran nežádoucích vedlejších účinků, interakcí, dávkování a vzniku rezistence HIV na většinu dostupných medikamentů (3). Je proto nanejvýše žádoucí, aby farmaceutické společnosti intenzivně pracovaly na vývoji a přípravě nových léků, u nichž budou výše uvedené problémy minimalizovány.
V posledních dvou letech do našeho léčebného repertoáru byly zařazeny nové léky, patřící jednak k již standardním skupinám (NNRTI – etravirin, PI – darunavir), jednak se poprvé objevují přípravky, ovlivňující jiné cíle generačního cyklu HIV, jako je např. virová integráza (raltegravir), nebo vazebné místo na povrchu cílových buněk – chemokinový koreceptor CCR5 (maraviroc, vicriviroc). Velká pozornost je posledních 10 let věnována simplifikaci léčebných režimů formou minimalizace počtu denních dávek a celkového počtu tablet (např. kombinace efavirenz+ emtricitabin+ tenofovir v jedné tabletě jednou denně).
Probíhají studie s tzv. druhou generací antiretrovirotik, jež mají být aktivní i proti mutantám HIV, rezistentním na přípravky prvních generací.
Jedná se o:
- NRTI (elvucitabin, MIV-210, racivir, SPD754),
- NNRTI (+/-calanolid A, GW5634, MIV-150, etravirin /TMC125/ a TMC128),
- PI (GW640385 a RO033-4649),
- inhibitory fúze a připojení (AMD070, BMS-378806, INCB9471, PRO 140, vicriviroc /SCH-D/, TAK-220 a TNX-355 ),
- inhibitory genů (např. TAT) nebo jejich součástí (antisense oligonukleotidy, např. HGTV43),
- inhibitory tzv. zinkových prstů,
- inhibitory maturace, a
- další látky, ovlivňující příslušná místa replikačního cyklu HIV.
Pozornost je věnována i zlepšování imunitního profilu HIV-pozitivních osob pomocí více než tuctu imunomodulačních látek, které jsou tč. podrobovány rozsáhlým zkouškám.
Mezi hlavní úkoly současného výzkumu v oblasti antiretrovirotik patří vývoj substancí účinných proti vysoce rezistentním mutantám HIV. Ty se zpravidla vyskytují u léčebně pokročilých nemocných, ale za určitých okolností mohou být příčinou primární HIV infekce (asi 10 % primárních infekcí je vyvoláno rezistentní mutantou HIV). Velký důraz je rovněž kladen na minimalizaci současných typů toxicity, jako je např. lipoatrofie, dyslipidémie, inzulínová rezistence, kardiovaskulární toxicita, nefro - hemato - a neurotoxicita. Stále více pozornosti je věnováno možnostem ovlivnění poruch kostního metabolismu a reprodukce, působených antiretrovirotiky.
Hlavním cílem všech doporučených léčebných strategií je maximální potlačení produkce nových virionů HIV-1 (nedetekovatelné hladiny HIV-1 RNA v plazmě infikovaných jedinců). Hlavní terapeutickou zásadou je správné používání kombinací antiretrovirotik, z nichž nejméně dvě látky musí být aktivní (tj. HIV vůči nim není rezistentní) (3).
Nové léky, o nichž bude v následujícím textu pojednáno, patří mezi NNRTI, inhibitory HIV integrázy a antagonisty chemokinového receptoru CCR5.
Etravirin (ETR, dříve TMC 125, obchodním názvem INTELENCE).
Nový NNRTI 2. generace, účinný na řadu kmenů HIV, rezistentních ke stávajícím NNRT, (obr. 1.). V lednu 2008 byl schválen pro kombinační léčbu infekce HIV. Složením jde o diaryl-pyrimidinový derivát, který se váže na hydrofobní součást v blízkosti aktivního místa reverzní transkriptázy i u rezistentních kmenů HIV. Přípravek se podává v dávce dvakrát 200 mg denně (2x2 tbl.).
Image 1. Chemický vzorec etravirinu 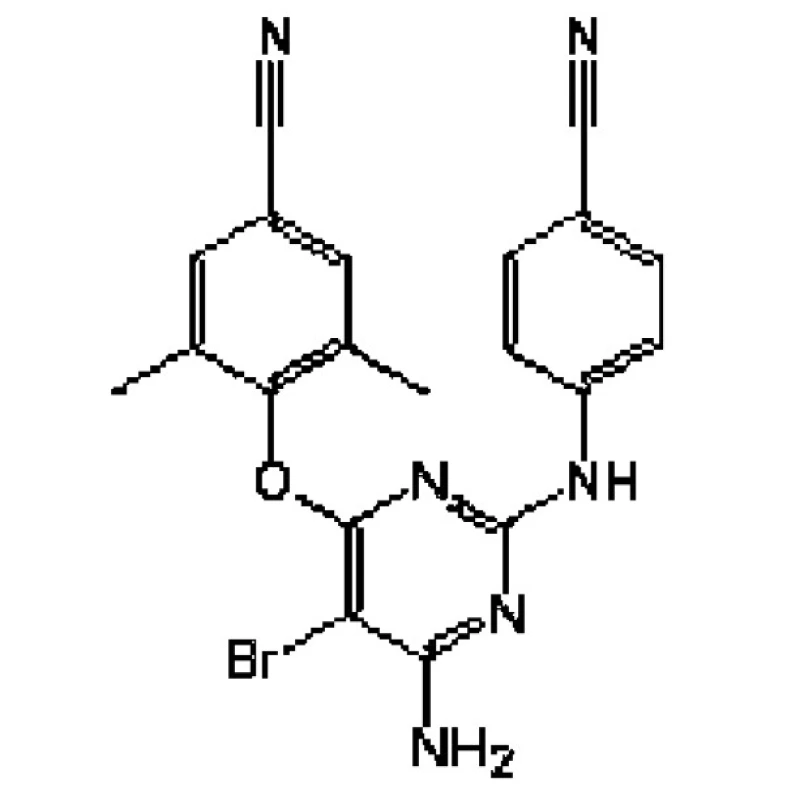
U pacientů, u nichž selhaly stávající NNRTI z důvodu potvrzené fenotypové rezistence, vedlo podání ETR během sedmi dnů k poklesu HIV virémie o 0,89 log (medián). Nejčastějšími nežádoucími účinky byly průjmy (u 31 %) a bolesti hlavy (u 21 %).
Ve studii TMC-C223 bylo sledováno 199 léčebně pokročilých HIV pozitivních osob s prokázanou rezistencí na NNRTI a se třemi a více primárními mutacemi HIV proteázy. Účinek ETR podávaného s optimalizovaným antiretrovirovým režimem byl srovnáván s větví s boostovaným lopinavirem (PI) a enfuvirtidem (FI). Po 48 týdnech ve větvích s ETR (2 x 400 a 2 x 800 mg) poklesla HIV virémie o 0,88 log, respektive 1,01 log. HIV virémie pod 50 kopií/ml byla prokázána u 22 %, respektive 23 % osob léčených ETR.
V placebem kontrolované studii DUET 1 a 2, byl ve větvi s ETR (spolu s boostovaným darunavirem a optimalizovaným antiretrovirovým režimem) po 24 týdnech léčby prokázán pokles HIV virémie pod 50 kopií/ml u statisticky významně vyššího počtu pacientů ve srovnání s kontrolním souborem (8, 10).
Dosud je známo 13 NNRTI mutací, ovlivňujících citlivost HIV na ETR (V90I, A98G, L100I, K101E/P, V106I, V179D/F, Y181C/I/V, G190A/S). Nepatří však mezi ně K103N, způsobující vysoký stupeň rezistence na NNRTI 1. generace. Osoby s nejvýše dvěma rezistentními mutacemi neměly zhoršenou virologickou odpověď (70 % osob mělo jen jednu a 14 % osob více než tři mutace).
Z nežádoucích účinků jsou nejběžnější:
- postižení GIT,
- postižení CNS,
- chřipkové příznaky,
- různé kožní projevy.
Inhibitory HIV integrázy (II, strand transfer inhibitors).
Jde o zcela novou skupinou antiretrovirotik. HIV integráza vytváří spolu s transkribovanou dvouvláknovou DNA, několika virovými a celulárními proteiny tzv. preintegrační komplex. Ten je dopraven zvláštním transportním kanálem do jádra hostitelské buňky, kde dojde k zabudování provirové DNA do chromozomu hostitele. Integráza tudíž katalyzuje přenos řetězce provirové DNA, který končí vytvořením kovalentní vazby mezi virovou a hostitelskou DNA. Buněčné enzymy opraví spoje v DNA, čímž je provirová DNA plně integrována.
Tento krok blokují II již v nanomolárních koncentracích tím, že sdílí 2 Mg+2 kationty společně s HIV integrázou, čímž znemožňují její funkci. Díky odlišnému místu zásahu působí i na HIV, rezistentní vůči ostatním skupinám antiretrovirotik (7).
Raltegravir (RAL, dříve označovaný MK-0518, obchodním názvem ISENTRESS).
Je prvním inhibitorem virové integrázy (obr. 2.), schváleným FDA v říjnu a EMEA v prosinci r. 2007 pro léčbu osob s pokročilou infekcí HIV, u nichž při stávající terapii v důsledku rezistence narůstá HIV-virémie.
Image 2. Chemický vzorec raltegraviru (hydroxypyrimidinon karboxamidu) 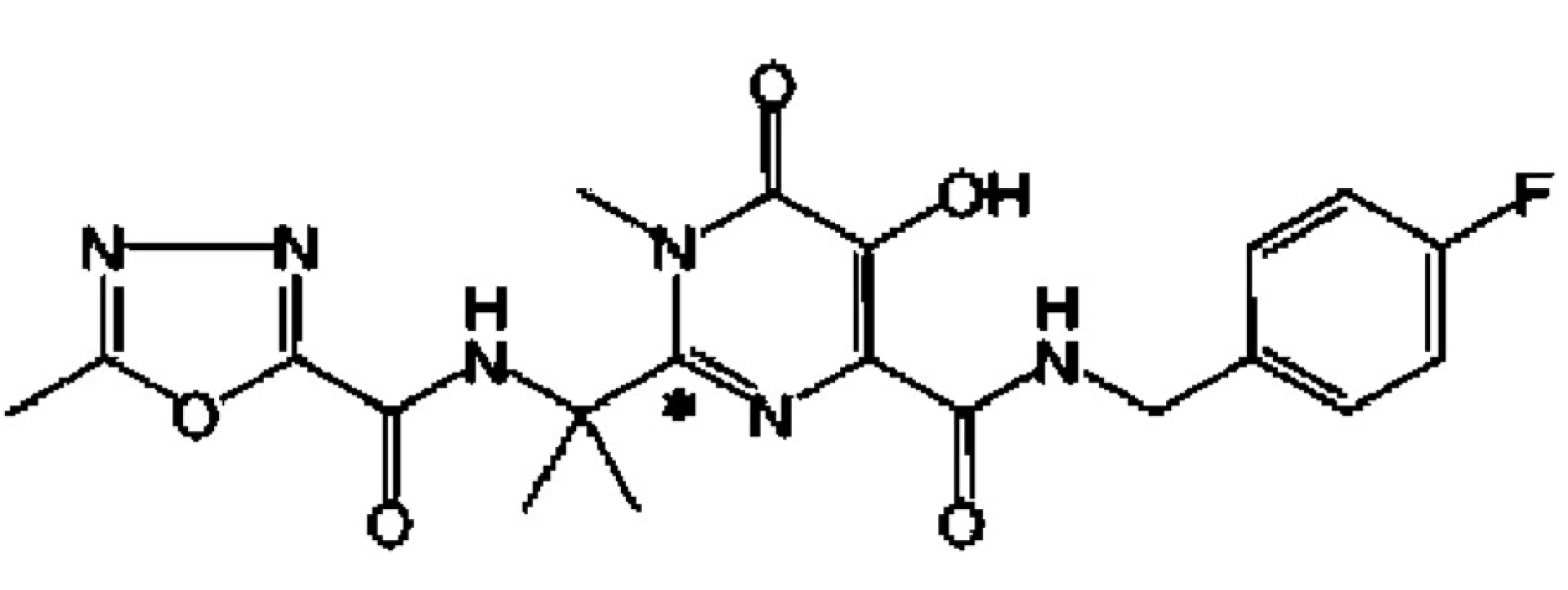
RAL je metabolizován glukuronidací v játrech, nemá tudíž interakce s léky metabolizovanými CYP 450. Podává se ve dvou denních dávkách po 400 mg.
In vitro byla jeho IC95 v 50% lidském séru stanovena na 33 nM ± 23 nM. Je účinný na multirezistentní HIV-1, včetně rezistentních R5 a X4 tropních kmenů. Se všemi ostatními třídami ART vykazuje in vitro synergický účinek. Kmeny HIV-1 rezistentní k RAL zůstávají citlivé na ostatní třídy antiretroviritik (4, 11).
Ve studiích při dávkování 2 x 100 až 600 mg bylo po 10denním léčebném období dosaženo poklesu HIV virémie až o 2,2 log. Podobných výsledků bylo dosaženo i při použití nižších dávek.
RAL byl dobře tolerován, nebyly popsány žádné nežádoucí účinky. Ve 24. a 48. týdnu mělo 67–80 % osob HIV virémii pod 50 kopií/ml.
V placebem kontrolované studii BENCHMARK 1 a 2, v nichž byl RAL přidán v dávce 2 x 400 mg ke standardní léčbě, bylo u 77 % léčených RAL v 16. týdnu léčby dosaženo poklesu HIV virémie pod 400 kopií/ml (5).
Rezistence na RAL je spojena s mutacemi N155H a Q148H/R/K v molekule HIV integrázy. Vysoký stupeň rezistence byl zjištěn při těchto kombinacích:
- N155H + L74M + E92Q + G163R, a
- Q148H/R/K + E138K + G140S/A.
Mutace G140S + Q148H/R vedou ke zkřížené rezistenci i na ELV.
Elvitegravir (ELV, dříve GS9137).
Nový, zatím FDA neschválený II. Je určen pro léčbu pacientů s pokročilou infekcí, způsobenou HIV-1, rezistentními na jiné třídy antiretrovirotik. Je metabolizován CYP450 (3A4), může proto docházet k interakcím s léčivy (NNRTI, PI, antagonisté CCR5), metabolizovanými tímto cytochromem. Této vlastnosti lze využít. Při inhibici CYP450 např. ritonavirem (RTV) je možno ELV podávat v jedné denní dávce.
Ve studiích již při dávkování 50 mg ELV + 100 mg RTV jednou denně byl již po 10 dnech dosažen pokles HIV virémie o 2,0 log. Nebyly pozorovány závažné nežádoucí účinky (2). V jiné studii bylo zjištěno, že účinek ELV v dávce 50 a 125 mg se 100 mg RTV v jedné denní dávce spolu s NRTI je srovnatelný s boostovanými PI.
Inhibitory vstupu – antagonisté CCR5
Maraviroc (MRV, UK-427,857, obchodním názvem CELSENTRY)
Inhibuje na chemokinovém koreceptoru CCR5 buněčné membrány makrofágů a CD4+ lymfocytů T vazebné místo, potřebné (vedle receptoru CD4) ke spojení povrchového glykoproteinu (gp120) HIV-1 s cílovou hostitelskou buňkou (obr. 3).
Image 3. Chemický vzorec maravirocu 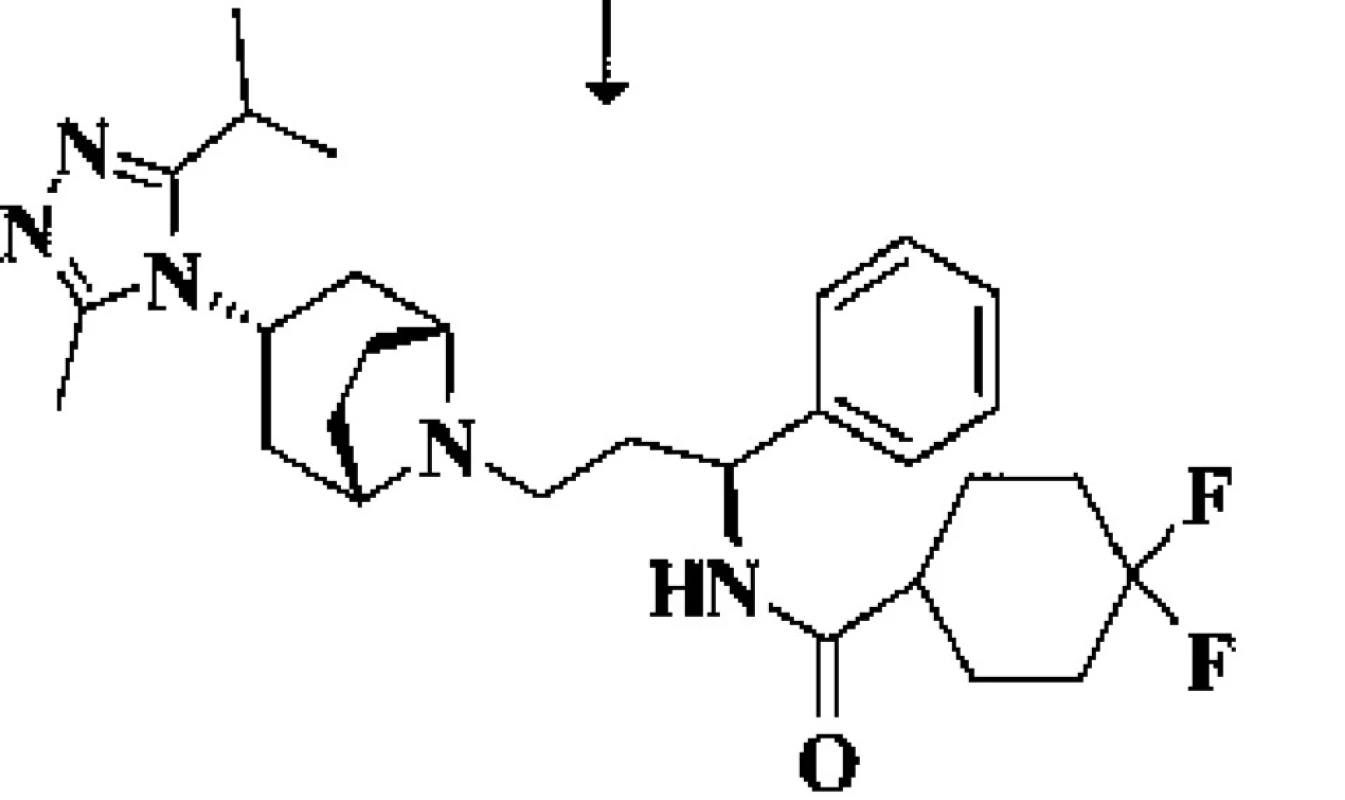
V srpnu 2007 byl schválen FDA a o měsíc později také EMEA pro léčbu HIV-pozitivních osob s pokročilým onemocněním, u nichž dochází k progresi klinického stavu a/nebo laboratorních nálezů v důsledku multirezistence HIV na přípravky stávajících terapeutických tříd. Základní dávkování je 2x 300 mg p.o. Dávka se upravuje na polovinu, nebo na dvojnásobek podle typu přípravků (inhibitory x induktory CYP450) podávaných v terapeutických kombinacích.
Zavedení léčby musí předcházet speciální test na vyšetření tzv. R5 tropismu HIV (13). Bylo zjištěno, že jedině u tzv. R5 tropních variant HIV-1 (využívají ke vstupu do hostitelské buňky jedině koreceptor CCR5) je možno využít vlastností přípravku inhibovat jednu z externích součástí CCR5. CCR5 je exprimován na povrch makrofágů a CD4+ lymfocytů T. Lymfocyty T exprimují kromě toho ještě další typ koreceptoru – CXCR4, na nějž se pak vážou tzv. X4 tropní HIV, nebo duálně či smíšeně tropní HIV (D/M, vážou se jak na CCR5, tak CXCR4) (12).
Bylo zjištěno, že při primoinfekci jsou přednostně infikovány makrofágy právě prostřednictvím CCR5, neboť dominantní populací v této fázi infekce jsou právě R5 tropní HIV-1. V průběhu času, zpravidla v pokročilé fázi onemocnění, se objevuje vyšší procento X4 tropních (SI, syncytia indukujících) kmenů HIV-1.
Pokud jsou přítomny X4 nebo D/M tropní varianty HIV-1, nejsou antagonisté CCR5 indikovány.
Po p.o. podání je MRV účinný již při dávkování 100 mg a více dvakrát denně.
In vitro byla zjištěna IC90 = 2nM. Po vazbě MRV nedochází ke stimulaci CCR5. MRV je jen substrát CYP450, proto dochází k interakcím s dalšími léky jen v minimální míře.
Koncentrace MRV však může být zvýšena současným podáním inhibitorů CYP450, jako jsou např. PI (kromě potencovaného tipranaviru), delavirdin, ketokonazol a makrolidy. Naopak koncentrace MRV klesá vlivem induktorů CYP450, jako je efavirenz, etravirin, rifampicin, carbamazepin, fenobarbital, fenytoin (9).
Podkladem pro registrační řízení byly výsledky několika studií. Ve studii MOTIVATE, kontrolované placebem, se MRV podával spolu se základním kombinačním režimem v dávkách 300 mg jednou nebo dvakrát denně. Přestože byli léčeni pokročilí HIV pozitivní jedinci s rezistencí na tři třídy antiretrovirotik, došlo do 24 týdnů ve větvích s MRV k poklesu HIV virémie pod 400 kopií/ml u více než dvojnásobného počtu osob než ve větvi s placebem.
Vicriviroc (VCV, dříve SCH D).
Je dalším nadějným antagonistou CCR5, který je rovněž účinný u infekcí, vyvolaných R5 tropními variantami HIV-1. Je taktéž substrátem pro CYP450 a jeho IC50 byla in vitro stanovena na 20nM. Také jeho plazmatickou hladinu zvyšuje ritonavir. VCV neprodlužuje QTc v EKG záznamu. Ve studii, kdy byl VCV podáván v monoterapii u pacientů, kteří dosud nebyli léčeni v dávkách 50 mg dvakrát denně, došlo po 14 dnech k poklesu HIV virémie o 1,62 log.
Ve studii ACTG 5211, trvající 48 týdnů, byl MRV podáván léčebně pokročilým pacientům a vykazoval dlouhodobě příznivý účinek (HIV virémie pod 50 kopií/ml) již v dávkách 10 a 15 mg ve srovnání s větví s placebem (6).
Tato studie se mj. zabývala objasněním vzniku rezistence HIV vůči antagonistům CCR5. Prokázala malé množství případů virologického selhání v důsledku mutací v oblasti V3-loop (jedna z pěti částí gp120), ale i mimo ni. Mutace v oblasti gp120 totiž umožňuje vazbu HIV na CCR5 i v případě, že je obsazen antagonistou. Po vysazení antagonistů CCR5 (selekčního tlaku) se po čase znovu objeví senzitivní kmeny HIV-1. Relativně častěji než rezistence na antagonisty CCR5 se však při virologickém selhání prokazovaly D/M nebo X4 tropní HIV-1, které byly v malém množství senzitivními metodami zjišťovány již před zahájením terapie (6).
Závěry pro praxi
Třída NNRTI byla rozšířena o prvního zástupce 2. generace. Je jím etravirin, který je účinný proti řadě kmenů HIV-1, rezistentních na NNRTI 1. generace. Spolu s níže uvedenými EI a II může být použit jako aktivní součást antiretrovirových kombinací u léčebně pokročilých pacientů.
Do léčebného arzenálu přibyly nové skupiny antiretrovirotik (EI, II).
Inhibitory HIV integrázy blokují zabudování provirové DNA do chromozomu hostitele. V řadě evropských zemí je dostupný raltegravir; elvitegravir bude zřejmě registrován v dohledné době.
Antagonisté CCR5 (alosterické inhibitory) po vazbě na CCR5 způsobují konformační změny, znemožňující interakci virového gp120 s buněčným receptorem CCR5. Jsou však použitelné pouze u infekcí, vyvolaných R5 tropními HIV-1. Před jejich nasazením je nutno pomocí speciálního testu (např. Trofile assay) vyloučit přítomnost X4 tropních variant HIV.
Přípravky patřící jak do stávajících, tak do nových tříd antiretrovirotik je nutno optimálně kombinovat, aby bylo dosaženo co největšího účinku.
Kombinacemi, obsahujícími nejméně dva aktivní léky je možno dosahovat suprese HIV virémie pod 50 kopií/ml u většiny léčených po dlouhou dobu.
Rezistence HIV k antiretrovirotikům postihuje nejen osoby léčebně velmi pokročilé, ale i jedince dosud neléčené. Tento stav je výhledově velmi nepříznivý a vyžaduje intenzívní vývoj nových látek s účinkem proti rezistentním HIV-1.
Revidovaná evropská klasifikace infekce HIV/AIDS, navržená WHO
Předchozí klasifikace platící od 1. 1. 1993 byla publikována kolektivem autorů ze CDC v časopisu MMWR (1). Vychází ze tří klinických a tří laboratorních kategorií, kterými je možno popsat stav každého HIV-pozitivního jedince.
Klinická kategorie A zahrnuje akutní (pokud je u daného jedince vyjádřena) a asymptomatickou infekci HIV; končí stádiem perzistující generalizované lymfadenopatie (PGL).
Pokročilejší kategorie B (časně symptomatická) se přiřazuje těm HIV-pozitivním osobám, které ještě nesplňují kritéria definice AIDS, ale mají již některé příznaky svědčící pro poruchu imunity.
Teprve kategorie C vyjadřuje plně rozvinuté stádium AIDS. Kromě HIV pozitivity je nutné, aby zde byly přítomny tzv. AIDS definující diagnózy (neboli indikativní onemocnění). Je jich asi 30 a jsou nejčastěji vyvolány oportunními patogeny (viry, baktériemi, prvoky a původci mykóz), méně se zde uplatňují nádory – často indukované viry – (např. Kaposiho sarkom, primární lymfom mozku, nehodgkinovské lymfomy, invazivní karcinom děložního hrdla), či stavy vyvolané přímo HIV (Wasting syndrom a AIDS Dementia Complex).
Laboratorní kategorie určují stav imunologické kompetence HIV pozitivních jedinců. Odvozují se z absolutních počtů CD4+ lymfocytů T, které se stanovují v periferní krvi.
Pokud je množství těchto „pomocných“ lymfocytů T větší než 500/mm3(kategorie 1), výkonnost imunity je srovnatelná se zdravými jedinci.
Poklesne-li počet CD4+ pod 500, ale ne pod 200/mm3(kategorie 2), odpovídá to snížení výkonnosti imunitních funkcí.
Teprve počty CD4+ nižší než 200/mm3(kategorie 3) jsou spojeny s výrazným imunodeficitem a následným vznikem oportunních infekcí. Čím je nižší počet CD4+, tím závažnější oportunní infekce nebo jejich kombinace můžeme očekávat.
Americká klasifikace navíc zohledňuje i tuto situaci a přiřazuje osobám s CD4+ pod 200/mm3 (<14 %) kategorii C bez ohledu na přítomnost oportunních infekcí nebo nádorů. Dle evropské nomenklatury je klasifikace C (AIDS) dána především klinickým stavem.
Ve snaze unifikovat a zpřesnit klinickou i laboratorní nomenklaturu, používanou při klasifikaci HIV pozitivních osob, navrhuje WHO nově následující klinická stádia s příslušnými nozologickými jednotkami (14):
Akutní HIV infekce:
- asymptomatická nebo akutní retrovirový syndrom.
Klinické stádium 1:
- asymptomatická fáze a perzistující generalizovaná lymfadenopatie (PGL).
Klinické stádium 2:
- seborrhoická dermatitida,
- angulární cheilitida,
- rekurentní ulcerace v dutině ústní (nejméně dvě epizody v průběhu šesti měsíců),
- herpes zoster (zasahující více dermatomů),
- rekurentní infekce respiračního traktu (sinusitida, otitis media, bronchitida, faryngitida, tracheitida, nejméně dvě epizody v průběhu šesti měsíců),
- mykotické infekce nehtů,
- papulózní svědivé erupce.
Klinické stádium 3:
- „vlasatá“ leukoplakie sliznic dutiny ústní,
- nevysvětlitelné chronické průjmy trvající déle než jeden měsíc,
- rekurentní kandidóza dutiny ústní (nejméně dvě epizody v průběhu šesti měsíců),
- těžké infekce s předpokládanou bakteriální etiologií (např. pneumonie, empyém, pyomyositida, infekce kostí a kloubů, meningitida, bakteriémie),
- akutní ulcerózně-nekrotizující stomatitida,
- gingivitida, nebo
- periodontitida.
Klinické stádium 4:
- plicní a mimoplicnítuberkulóza (kromě lymfadenitidy),
- nevysvětlitelný úbytek hmotnosti (více než 10 % v průběhu šesti měsíců),
- HIV-wasting syndrom,
- pneumocystová pneumonie,
- rekurentní těžká, nebo RTG prokázaná bakteriální pneumonie (nejméně dvě epizody během jednoho roku),
- CMV retinitida a/nebo kolitida,
- chronická nebo perzistující HSV infekce (trvající nejméně jeden měsíc),
- HIV-asociovaná encefalopatie,
- kardiomyopatie,
- nefropatie,
- progresivní multifokální leukoencefalopatie (PML),
- Kaposiho sarkom a HIV-asociované malignity,
- toxoplazmóza,
- diseminované mykotické infekce (např. kandidóza, kokcidioidomykóza, histoplasmóza),
- kryptosporidióza,
- kryptokoková meningitida,
- mykobakteriózy.
Předpokládá se, že sem podle výsledků studií přibudou ještě karcinomy konečníku a lymfómy (T buněčný Hodgkinův lymfom) (tab. 2).
Table 2. Srovnání nové a původní klasifikace infekce HIV/AIDS (podle 1, 14) 
Také v nové klasifikaci hraje celkový počet CD4+ lymfocytů T rozhodující roli při posuzování stavu imunokompetence, zahájení a hodnocení léčby (tab. 3).
Table 3. Doporučení WHO pro zahájení léčby u HIV pozitivních osob (14) 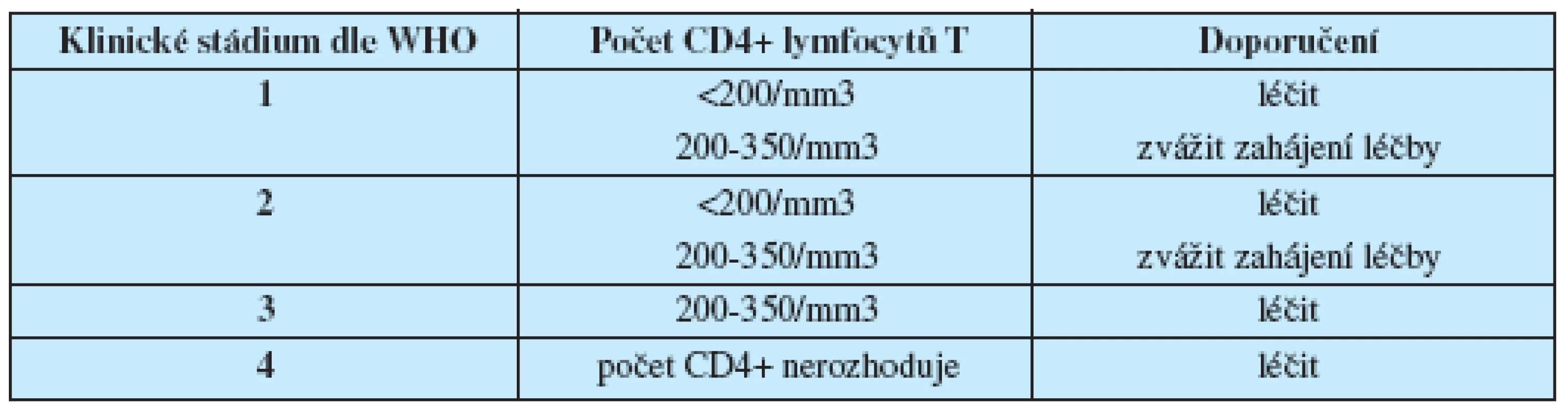
Zkratky:
AIDS (Acquired Immunodeficiency Syndrome) – syndrom získané imunodeficience,
boostovaný – potencovaný zpravidla ritonavirem,
cART – kombinovaná antiretrovirová terapie,
CCR5, CXCR4 – buněčné receptory pro chemokiny,
CD4+ receptor – umožňuje vazbu glykoproteinu gp120, přítomného na povrchu HIV,
CDC – centrum pro kontrolu nemocí,
EI – inhibitory vstupu,
ELV – elvitegravir,
EMEA – evropská léková agentura,
ETR – etravirin,
FDA – Food and drug administration, Úřad pro potraviny a léky v USA,
FI – inhibitory fúze,
HIV – Human Immunodeficiency Virus,
II – inhibitory HIV integrázy,
MI – inhibitory maturace,
MRV – maraviroc,
NNRTI – nenukleosidové inhibitory reverzní transkriptázy HIV,
N(t)RTI – nukleosi(ti)dové inhibitory reverzní transkriptázy HIV,
PI – inhibitory HIV proteázy,
RAL – raltegravir,
RTV – ritonavir,
VCV – vicriviroc.
Tato práce byla podpořena výzkumnými záměry LFUK V Plzni MSM0021620812 a MSM0021620819.
Doc. MUDr. Dalibor Sedláček, CSc.
Infekční klinika FN Plzeň
třída dr. E. Beneše 13
305 99 Plzeň
E-mail: sedlacek@fnplzen.cz
Sources
1. Castro, K.G., Ward, J.W., Slutsker, L. et al. 1993 Revised Classification System for HIV Infection and Expanded Surveillance Case Definition for AIDS Among Adolescents and Adults. MMWR. 1992 / 41(RR-17). Dostupné na: http://www. cdc.gov/mmwr/preview/mmwrhtml/00018871.htm
2. DeJesus, E., Berger, D., Markowitz, M. et al. Antiviral activity, pharmacokinetics, and dose response of the HIV-1 integrase inhibitor GS-9137 (JTK-303) in treatment-naive and treatment-experienced patients. J. Acquir. Immune Defic. Syndr. 2006, 43(1), p. 1-5.
3. DHHS Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents. January 29, 2008. Dostupné na: http://aidsinfo.nih.gov/contentfiles/AdultandAdolescentGL.pdf
4. Grinsztejn, B., Nguyen, B-Y., Katlama, C. et al. Potent Antiretrovirall Effect of MK-0518, a Novell HIIV-1 Integrase Inhibitor, in Patients with Triplle-class Resistant Virus. Abstracts. ICAAC 2006. Abstract book. ABS # H-1670b.
5. Grinsztejn, B., Nguyen, B-Y., Katlama, C. et al. Safety and efficacy of the HIV-1 integrase inhibitor raltegravir (MK-0518) in treatment-experienced patients with multidrug-resistant virus: a phase II randomised controlled trial. Lancet 2007, 369, p. 1261-1269.
6. Gulick, R.M., Su, Z., Flexner, C. et al. Phase 2 study of the safety and efficacy of vicriviroc, a CCR5 inhibitor, in HIV-1-Infected, treatment-experienced patients: AIDS clinical trials group 5211. J. Infect. Dis. 2007, 196(2), p. 304-312.
7. Hazuda, D.J., Felock, P., Witmer, M. et al. Inhibitors of strand transfer that prevent integration and inhibit HIV-1 replication in cells. Science 2000, 287(5453), p. 646-650.
8. Lazzarin, A., Campbell, T., Clotet, B. et al. Efficacy and safety of TMC125 (etravirine) in treatment-experienced HIV-1-infected patients in DUET-2 : 24-week results from a randomised, double-blind, placebo-controlled trial. Lancet 2007, 370(9581), p. 39-48.
9. MacArthur, R.D., Novak, R.M. Reviews of anti-infective agents: maraviroc: the first of a new class of antiretroviral agents. Clin. Infect. Dis. 2008, 47(2), p. 236-241.
10. Madruga, J.V., Cahn, P., Grinsztejn, B. et al. Efficacy and safety of TMC125 (etravirine) in treatment-experienced HIV-1-infected patients in DUET-1 : 24-week results from a randomised, double-blind, placebo-controlled trial. Lancet 2007, 370(9581), p. 29-38.
11. Markowitz, M., Morales-Ramirez, J.O., Nguyen, B-Y. et al. Antiretroviral activity, pharmacokinetics, and tolerability of MK-0518, a novel inhibitor of HIV-1 integrase, dosed as monotherapy for 10 days in treatment-naive HIV-1-infected individuals. J. Acquir. Immune Defic. Syndr. 2006, 43(5), p. 509-515.
12. Moore, J.P., Kitchen, S.G., Pugach, P., Zack. J.A. The CCR5 and CXCR4 coreceptors—central to understanding the transmission and pathogenesis of human immunodeficiency virus type 1 infection. AIDS Res. Hum. Retroviruses 2004, 20(1), p. 111-126.
13. Whitcomb, J.M., Huang, W., Fransen, S. et al. Development and characterization of a novel single-cycle recombinant-virus assay to determine human immunodeficiency virus type 1 coreceptor tropism. Antimicrob. Agents Chemother. 2007, 51(2), p. 566-575.
14. WHO Regional Office for Europe. Annex 2. Revised WHO clinical staging of HIV/AIDS for adults and adolescents. In: Eramova I, Matic S, Munz M.: HIV/AIDS teatment and the clinical protocols for the WHO European region. World Health Organization, 2007, p. 18-64.
Labels
General practitioner for children and adolescents General practitioner for adults
Article was published inGeneral Practitioner

2008 Issue 11-
All articles in this issue
- HIV encefalopatie
- Dvacet pět let od objevu viru lidské imunodeficience (HIV)
- Metabolické komplikace a antiretrovirová léčba
- Cerebrovaskulární komplikace infekce HIV
- Problematika virových hepatitid u HIV infikovaných osob
- Nové léky pro léčbu infekce HIV/AIDS a revize evropské a revize evropské klasifikace HIV/AIDS
- Současné možnosti aktivní imunizace pacientů s HIV infekcí
- Pneumocystová pneumonie u pacienta s čerstvě diagnostikovanou chronickou retrovirovou infekcí
- Kryptokoková meningitida u pacienta s dosud nediagnostikovanou HIV infekcí
- General Practitioner
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kryptokoková meningitida u pacienta s dosud nediagnostikovanou HIV infekcí
- HIV encefalopatie
- Pneumocystová pneumonie u pacienta s čerstvě diagnostikovanou chronickou retrovirovou infekcí
- Současné možnosti aktivní imunizace pacientů s HIV infekcí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

