-
Medical journals
- Career
Kolorektální karcinom po transplantaci jater
Authors: Jungwirth J. 1,2; Peter Mačinga 1; Jan Král 1; P. Taimr 1; Jiří Froněk 3; Julius Špičák 1; Tomáš Hucl 1
Authors‘ workplace: Klinika hepatogastroenterologie, IKEM, Praha 1; Klinik für Allgemein, Thorax und Visceralchirurgiechirurgie, Klinikum Weiden 2; Klinika transplantační chirurgie, IKEM, Praha 3
Published in: Gastroent Hepatol 2022; 76(4): 302-308
Category: Clinical and Experimental Gastroenterology: Review Article
doi: https://doi.org/10.48095/ccgh2022302Overview
Úvod: Pacienti po transplantaci solidních orgánů mají vyšší riziko vzniku malignit, zejména nádorů kůže a lymfoproliferativních onemocnění. Kolorektální karcinom (CRC) patří mezi nejčastější nádorová onemocnění a také jeho vyšší výskyt byl popsán po transplantaci některých orgánů. Riziko vzniku CRC u pacientů po transplantaci jater není jednoznačně známé. Cíl a metody: Cílem naší práce bylo zhodnotit literární údaje o výskytu CRC u pacientů po transplantaci jater a doplnit je o vlastní zkušenosti z našeho transplantačního centra. Výsledky: Literární práce popisují většinou riziko vzniku CRC u pacientů po transplantaci jater od srovnatelného až po dvojnásobně vyšší oproti obecné populaci. Většina studií však hodnotí výskyt různých typů nádorů po transplantaci různých orgánů a bez ohledu na indikaci k transplantaci. Jednoznačně prokázaným rizikovým faktorem vzniku CRC je primární sklerozující cholangitida (PSC) a ulcerózní kolitida (UC). Studie, ve které byli příjemci transplantovaných jater hodnoceni s ohledem na přítomnost PSC/ UC, shodně prokázaly vysoké riziko vzniku CRC v této skupině pacientů, a naopak většinou absenci rizika u pacientů bez PSC/UC. Závěr: Výskyt CRC je v populaci všech pacientů po transplantaci jater dle většiny studií mírně vyšší než v obecné populaci. Výrazně vyšší je riziko u pacientů po transplantaci jater pro PSC/UC, což zásadně podporuje potřebu jejich pravidelného a efektivního endoskopického sledování po transplantaci. U pacientů transplantovaných pro ostatní indikace se zdá být riziko vzniku CRC srovnatelné s obecnou populací. Pro CRC po transplantaci je typická pravostranná lokalizace, diagnóza v pokročilejším stadiu a horší prognóza
Klíčová slova:
transplantace jater – transplantace – kolorektální karcinom
Úvod
Transplantace je v indikovaných případech zavedenou a život zachraňující léčebnou metodou pro pacienty se selháním různých orgánů. Nádorová onemocnění po transplantaci mohou obecně vzniknout de novo, rekurencí primárního nádoru, přenosem od dárce či se může jednat o nerozpoznaný nádor přítomný již před transplantací. Pacienti po transplantaci solidních orgánů mají vyšší výskyt de novo malignit ve srovnání s obecnou populací, zejména nádorů kůže a lymfoproliferativních onemocnění. Předpokládá se, že zásadní roli u většiny de novo vzniklých malignit hraje oslabení imunitního systému při nezbytné posttransplantační imunosupresi, významnou roli hrají infekce onkogenními viry. V úvahu je také nutné vzít neustále narůstající věk a dobu přežití příjemců orgánů [1–3].
Kolorektální karcinom (CRC – colorectal carcinoma) je celosvětově čtvrté nejčastější maligní nádorové onemocnění a třetí nejčastější příčina úmrtí na malignity. V roce 2018 bylo ve světě diagnostikováno téměř 1,9 milionu nových případů a téměř 900 000 pacientů na toto onemocnění zemřelo [4]. V současné době všeobecně přijatý koncept rozvoje CRC ve smyslu sekvence adenom–karcinom dává možnost screeningu s cílem onemocnění předcházet či jej zachytit v časném stadiu.
Rozsáhlá americká studie zahrnující 175 732 příjemců solidních orgánů ze 13 registrů prokázala vyšší riziko nádorů po transplantaci, které bylo při vyjádření pomocí poměru standardizované incidence dvojnásobné (standardized incidence ratio – SIR 2,1; 95% CI 2,06–2,14). Příjemci jater představovali v tomto souboru 22 % pacientů. Riziko bylo zvýšené u celkem 32 různých malignit, nejčastěji se jednalo o non-Hodgkinův lymfom, karcinom plic, jater a ledvin. Riziko CRC bylo zvýšeno pouze mírně (SIR 1,24; 95% CI 1,15–1,34; p < 0,0001) [5]. Riziko CRC je výrazně zvýšené u pacientů s nespecifickými střevními záněty (IBD – inflammatory bowel disease), a to zejména v důsledku role chronického zánětu v karcinogenezi [6].
Transplantace jater (LTx – liver transplantation) je zavedená metoda léčby jaterního selhání. I pacienti po transplantaci jater mají vyšší riziko vzniku malignit, zejména nádorů kůže a lymfatického systému [1,2]. Zároveň jsou u těchto pacientů nádory považovány za třetí nejčastější příčinu úmrtí, hned po kardiovaskulárních a infekčních příčinách. Riziko vzniku solidních nádorů je zdokumentováno hůře [3]. U pacientů po transplantaci jater existují pouze omezené a v některých případech rozporuplné údaje o vzniku solidních nádorů a vlastnostech CRC. Někteří autoři popsali riziko CRC po transplantaci srovnatelné se zdravou populací, zatímco jiní prokázali různou míru zvýšeného rizika ke vzniku pokročilých polypů a CRC. Relativně četnou indikaci transplantace jater přestavuje primární sklerozující cholangitida, která je v až 80 % případů asociována s nespecifickými střevními záněty, především s ulcerózní kolitidou (UC – ulcerative colitis), která je sama o sobě rizikovým faktorem vzniku CRC. V řadě epidemiologických prací zkoumajících výskyt CRC po transplantaci ale není tato indikace k transplantaci zohledněna.
Cíl a metody
Cílem naší práce bylo zhodnotit literární údaje o výskytu CRC u pacientů po transplantaci jater a doplnit je údaje o vlastní zkušenost z našeho transplantačního centra. Retrospektivě jsme zhodnotili anamnestická data a průběh onemocnění u všech pacientů, u nichž byl v potransplantačním období diagnostikován v našem transplantačním centru CRC.
Výsledky
Studie prokazující srovnatelný výskyt CRC po orgánové transplantaci
V jedné z prvních studií využili Silva MA et al data o výskytu CRC z různých transplantačních registrů a práce dalších autorů a zhodnotili dohromady 6 476 post-LTx pacientů, z nichž 42 rozvinulo CRC. Poměr standardizované incidence SIR byl 1,01; a studie tak navzdory určitým metodologickým nedostatkům neprokázala vyšší výskyt CRC u neselektovaných pacientů po transplantaci jater [7].
Aigner et al studovali v Rakousku 3 595 příjemců transplantovaného orgánu (játra, ledviny, srdce, plíce, pankreas, tenké střevo) a zjistili nádorové onemocnění u 206 z nich (5,7 %), přičemž 9 mělo CRC (0,25 %, játra 4×, srdce 3×, ledviny 2×). Tento výskyt se nelišil od výskytu CRC u imunokompetentních jedinců odpovídajícího věku (0,25 vs. 0,3 %) [8].
V retrospektivní studii Merchea et al byli zhodnoceni všichni pacienti s diagnózou CRC po orgánové transplantaci provedené na Mayo Clinic mezi roky 2000 a 2011. Z celkové kohorty 3 946 pacientů po orgánové transplantaci bylo identifikováno 20 s výskytem CRC (incidence 0,5 %). Medián doby od transplantace k diagnóze CRC byl 8,7 let (rozmezí 0,4–19 let). Nejčastěji transplantovaným orgánem u postižených pacientů byly ledviny (n = 8), játra (n = 3), srdce (n = 2), plíce (n = 1) a dále multiorgánové transplantace jater a ledvin v jedné době (n = 1) a jater a ledvin metachronně (n = 2). Zbytek představovaly multiorgánové transplantace srdce a ledvin. Celkově tedy bylo zaznamenáno šest pacientů po transplantaci jater, z nichž tři byli příjemci ještě jiného orgánu. CRC byl nejčastěji nalezen v pravé části tračníku (n = 14) a stejně tak nejčastěji (n = 6) ve IV. stadiu onemocnění. U sedmi (35 %) pacientů byla rovněž diagnostikována jiná malignita. Indikací k transplantaci jater byla PSC (n = 3, 50 %), biliární a alkoholická cirhóza (n = 2) a deficit alfa-1 antitrypsinu (n = 1). Čtyři pacienti ze všech (20 %) měli diagnózu IBD (3× ulcerózní kolitida, 1× Crohnova choroba). Tato studie neprokázala vyšší incidenci CRC u pacientů po orgánové transplantaci [9]. Stejní autoři o několik let později svůj soubor rozšířili na 63 pacientů s CRC po transplantaci orgánů, z nichž o játra se jednalo v 36,5 % případů. Medián času do diagnózy CRC byl 59,3 měsíců (4,4 – –251,4 měsíců). Prokázán však byl, stejně jako v jiných studiích, vyšší výskyt neoplazií v pravém tračníku a častější záchyt pokročilého stadia onemocnění [10].
V recentní multicentrické celonárodní studii z Velké Británie byl hodnocen výskyt CRC u 8 115 dospělých příjemců jater (transplantace mezi lety 1990 a 2010) a byl srovnán s obecnou populací. CRC byl nalezen u 52 pacientů (0,6 %) a ve srovnání s obecnou populací nebyl výskyt CRC u transplantovaných pacientů vyšší (SIR 0,92) [11].
Studie neprokazující vyšší výskyt CRC po transplantaci jsou shrnuty v tab. 1.
Table 1. Studie dokumentující srovnatelný výskyt CRC po orgánové transplantaci.
Tab. 1. Study documenting the comparable incidence of CRC after organ transplantation.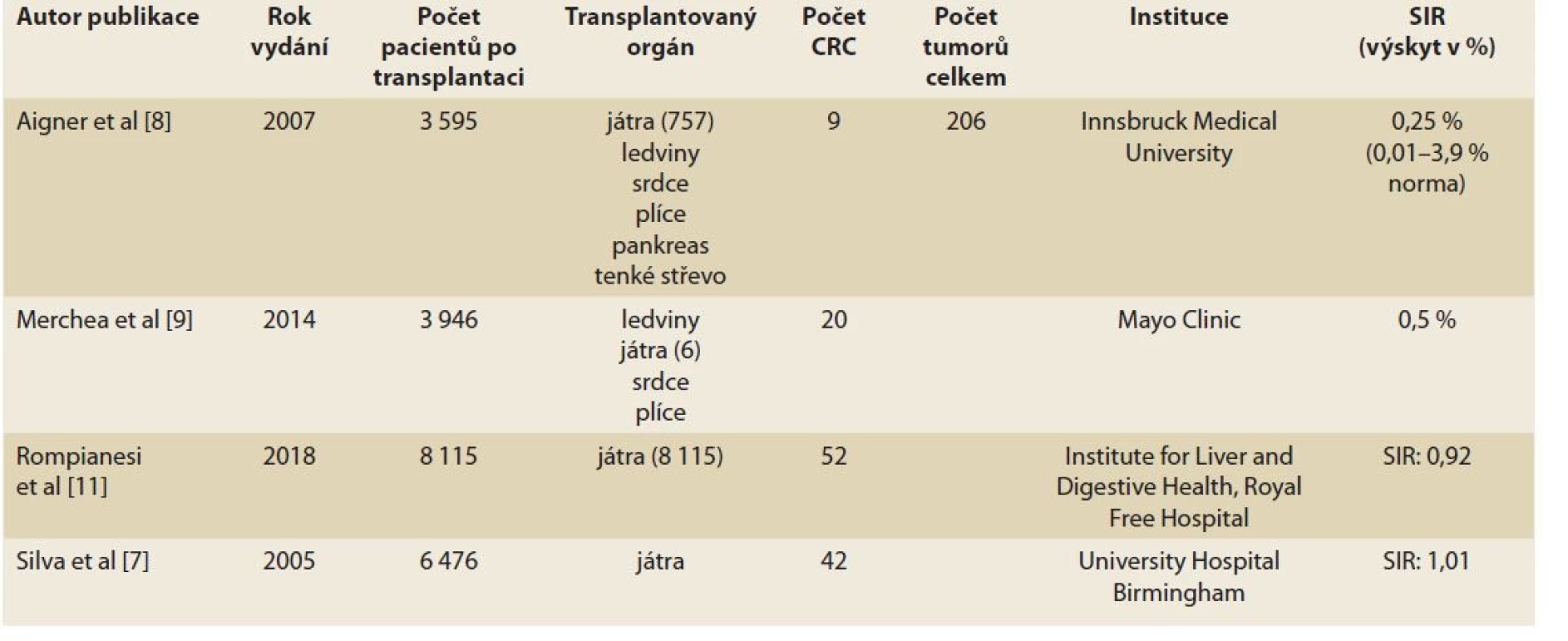
Studie prokazující vyšší výskyt CRC po orgánové transplantaci
V rozsáhlé metaanalýze z roku 2010 publikovali Sint Nicolaas et al data z 29 studií zabývajících se specificky výskytem CRC po LTx. Při známé asociaci PSC/UC s výskytem CRC rozdělili pacienty na ty, u nichž proběhla LTx z indikace PSC, a na pacienty bez diagnózy PSC. Celkově tato metaanalýza prokázala 2,6× zvýšené riziko rozvoje CRC po LTx oproti normální populaci (RR 2,6; 95% CI 1,7–4,1). Po vyřazení pacientů s diagnózou PSC kleslo toto riziko na 1,8násobek oproti normální populaci (RR 1,8; 95% CI 1,1–2,9) [12].
V roce 2018 Kang et al publikovali soubor 17 pacientů (4,9 %), u kterých byly z celkových 348 transplantovaných zaznamenány pokročilé kolorektální neoplazie. Riziko vzniku CRC bylo u pacientů po LTx 8,4× vyšší ve srovnání s normální populací, (95% CI 1,808 – –39,172; p < 0,001). V této studii nebyly výsledky ovlivněny diagnózou PSC asociovanou s UC, jelikož se v Jižní Koreji toto onemocnění vyskytuje velice zřídka. Hlavní indikace představovaly virus hepatitidy B (HBV; n = 296), virus hepatitidy C (HCV; n = 17) a alkohol (n = 13) [13].
Sint Nicolaas et al studovali skupinu 394 pacientů po transplantaci jater v Nizozemsku [14]. V celkové populaci pacientů byl SIR po CRC 2,16 (95% CI 0,81–5,76), hodnota však poklesla na 1,26 (95% CI 0,31–5,03) u příjemců jater bez diagnózy PSC.
Jiná nizozemská studie hodnotila malý soubor 174 post-LTx (po transplantaci jater) pacientů, u nichž zjistila kumulativní riziko malignity 5, 10 a 15 let od transplantace 6 %, 20 % a 55 %. Relativní riziko vzniku malignity ve srovnání s obecnou populací bylo 4,3 (95% CI 2,4–7,1) a relativní riziko pro CRC 12,5 (95% CI 2,5–36,6), ovšem pouze tři pacienti z celkového počtu 21 s nádorovým onemocněním rozvinuli CRC [1].
Engels et al zpracovali data 175 732 pří - jemců transplantátu (játra, ledviny, srdce, plíce) z několika amerických registrů a ukázali dvojnásobně zvýšené celkové riziko nádorového onemocnění u populace po transplantaci (SIR 2,10; 95% CI 2,06–2,14). U 627 pacientů byl zachycen CRC s výsledným poměrem SIR 1,24 (95% CI 1,15–1,34) [5].
Ve švédské studii Adami et al hodnotili 5 931 pacientů po transplantaci solidních orgánů (ledviny, játra, srdce, plíce pankreas a kombinace) a zaznamenali zvý - šené riziko neoplazií u příjemců transplantovaných orgánů se SIR 4,0 (95% CI 3,7–4,4) a pro adenokarcinom tlustého střeva SIR 2,3 (95% CI 1,5–3,4) [15].
Recentní epidemiologická studie hodnotila 2 105 122 příjemců transplantovaných orgánů. Ve srovnání s obecnou populací bylo riziko vzniku nádorů u pacientů po transplantaci jater dvaapůlkrát vyšší (SIR 2,45; 95% CI 2,22–2,70), riziko vzniku CRC bylo v neselektované populaci příjemců jater skoro dvojnásobné (SIR 1,89; 95% CI 1,59–2,24; p < 0,001) [16]. Studie dokumentující vyšší výskyt CRC po transplantaci jsou shrnuty v tab. 2.
Table 2. Studie potvrzující vyšší výskyt CRC po orgánové transplantaci.
Tab. 2. Study confirming a higher incidence of CRC after organ transplantation.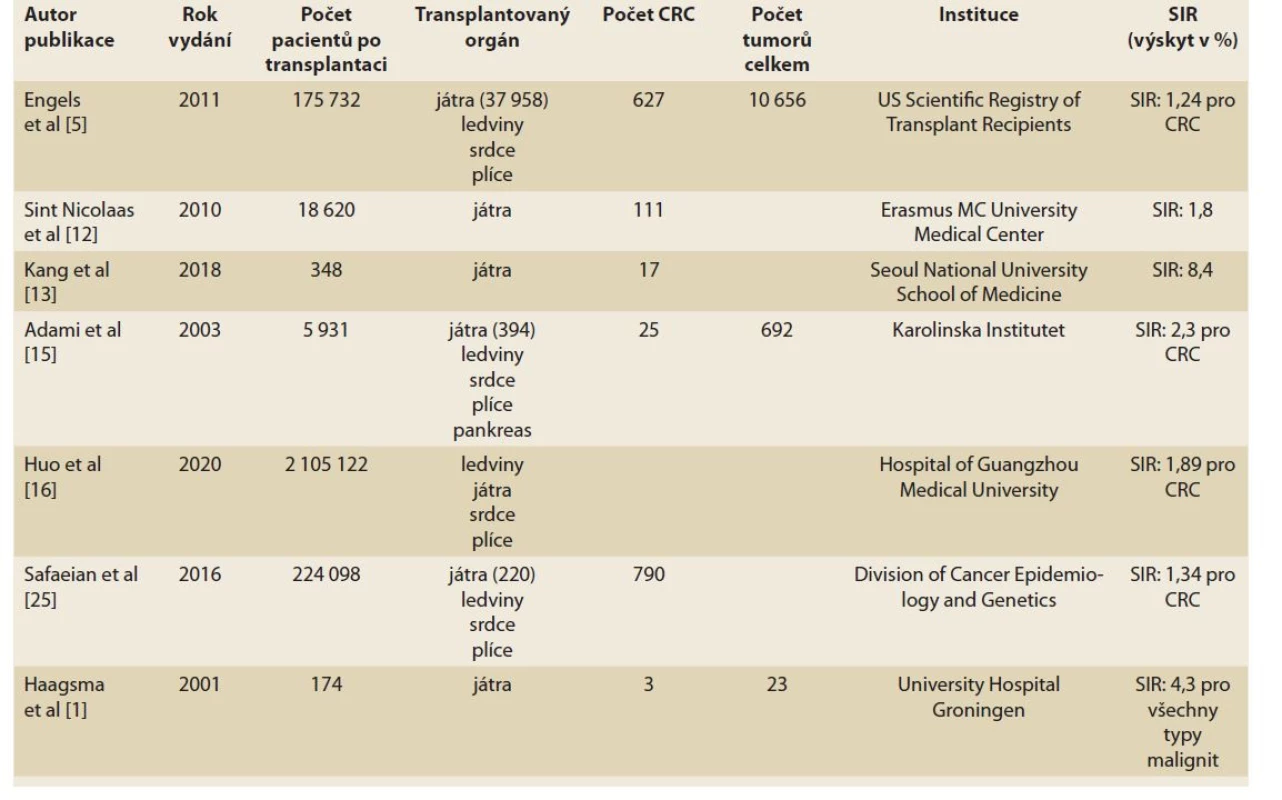
Etiopatogeneze
V etiopatogenezi potransplantačních malignit se uvažuje o několika faktorech na straně pacienta, samotné transplantace a jí doprovázející imunosupresivní léčby. Mezi faktory příjemce patří věk, kouření, konzumace alkoholu, hmotnost, přítomnost chronicky zánětlivých onemocnění včetně reaktivace onkogenních virů (virus Epstein-Barrové, cytomegalovirus, JC virus, lidský papilomavirus, viry hepatitidy B a C) či již přítomná nerozpoznaná malignita. Přenos nádoru od dárce je vzácný, ale možný. Nejčastěji byly popsány melanomy, karcinomy plic, prsu, tlustého střeva či ledviny. Imunosuprese inhibuje protinádorové imunitní mechanizmy a zvyšuje incidenci virem indukovaných malignit [17,18].
Existuje jen málo údajů o etiologii a patogenezi CRC po transplantaci orgánů, některé potenciálně relevantní faktory však byly identifikovány. Selgrad et al [17] prokázali, že přítomnost JCV (John Cunningham virus) v kolorektální sliznici u post-LTx pacientů ve spojení s užíváním imunosuprese způsobuje reaktivaci viru a následnou expresi T antigenu (TAg). Onkogenní potenciál viru je důsledkem právě tohoto silně transformujícího onkoproteinu. TAg je multifunkční protein, který je schopen vázat a inaktivovat tumor supresorové proteiny p53 a pRb, což vede k deregulaci buněčného cyklu. To umožňuje například replikaci buněk s poškozenými chromozomy [19,20]. Kromě toho interaguje TAg s h-cateninem a v důsledku této interakce může deregulovat signální dráhu WNT [21]. U kolorektálního karcinomu existuje také silná korelace mezi expresí JCV TAg a aberantní metylací, což roli JCV v karcinogenezi CRC dále podporuje [22].
Carenco et al [23] prokázali na souboru 465 pacientů po transplantaci jater, že předtransplantační kouření zvyšuje pravděpodobnost rozvoje CRC 5,5x (95% CI 2,5–12) a obezita 2,2× (95% CI 1,1–4,3). Jiná studie uvedla patologickou konzumaci alkoholu jako nezávislý rizikový faktor výskytu karcinomů po transplantaci [24].
Mezi nejvýznamnější rizikové faktory CRC patří nespecifické střevní záněty. Incidence CRC se v této skupině pacientů za posledních 30 let snížila, což je přičítáno jak úspěšnému screeningu, tak lepší farmakologické kontrole zánětu. Mezi rizikové faktory, které dále zvyšují riziko CRC souvisejícího s IBD, patří doba, rozsah, závažnost a trvání onemocnění, přítomnost zánětlivých pseudopolypů, koexistující primární sklerozující cholangitida (PSC) a rodinná anamnéza. Všechny světové odborné společnosti se shodují, že screening CRC by u pacientů s IBD měl probíhat intenzivněji než u běžné populace [6]. Pacienti s PSC asociovanou s IBD mají 10× větší riziko vzniku CRC a pacienti s PSC bez IBD 5× vyšší riziko vzniku CRC ve srovnání s obecnou populací. CRC se v této skupině pacientů může vyskytovat v časnějším věku, pokročilejším stadiu a predominantně v pravostranném kolon [11]. Tento vztah PSC a UC ke kolorektálnímu karcinomu se tak stává také nejsilnějším rizikovým faktorem k potransplantačnímu vzniku CRC na straně pacienta. Tento fakt dokladuje řada studií.
Již v roce 2013 poukázali Singh et al na vysoké riziko vzniku CRC po transplantaci jater u pacientů s PSC (IR 5,8/1 000 oso - bo-roků, 95% CI 3,8–7,8) a s PSC/IBD (IR 13,5/1 000 osobo-roků, 95% CI 8,7–18,2). Toto zvýšené riziko bylo následně potvrzeno v dalších studiích. Například analýza amerických registrů z let 1987–2010, která identifikovala 790 pacientů s CRC z celkových 224 098 po transplantaci různých orgánů, stanovila SIR pro CRC po transplantaci jater na 1,34 (95% CI 1,16–1,52). Při podrobnější analýze však vyšlo najevo, že je riziko zásadně závislé na základní diagnóze před transplantací. U všech pacientů s PSC byl SIR 4,49 (95% CI 3,36–5,89), u pacientů s PSC a IBD 5,69 (95% CI 3,98–7,88), u pacientů s PSC bez IBD 3,05 (95% CI 1,74 – –4,96) a u pacientů bez PSC 1,10 (95% CI 0,94–1,28) [25].
Obdobné výsledky byly pozorovány v národní britské studii, která neprokázala zvýšené riziko CRC u celkové populace pacientů po transplantaci jater (SIR 0,92), avšak prokázala významně vyšší riziko u pacientů s PSC/UC (SIR 7,0) [11].
Znalost vysokého rizika vzniku CRC s často nepříznivým průběhem onemocnění podporuje nutnost dlouhodobého endoskopického sledování pacientů po transplantaci pro PSC. Minimálně by se mělo jednat o sledování srovnatelné s doporučením platným pro pacienty bez transplantace, tedy koloskopií v ročním intervalu. Někteří autoři diskutují i roli profylaktické kolektomie mimo jiné proto, že bylo prokázáno, že pacienti s PSC, u nichž byla provedena před transplantací kolektomie, mají nižší riziko rekurence PSC [11].
Klinická charakteristika a prognóza
Většina prací se shoduje na častějším záchytu karcinomu v pravé části tračníku, na rychlejším rozvoji onemocnění v porovnání se zdravou populací a s tím souvisejícím záchytem až v pokročilejších stadiích [1,2,7,12,13,26,27]. Nejpodrobněji zpracované údaje na doposud největším vzorku pacientů z jednoho centra přinášejí Merchea et al, kteří zkoumali charakteristiku a prognózu CRC u pacientů po orgánové transplantaci (srdce, plíce, ledviny, pankreas a játra), jež byla provedena mezi lety 1987 a 2016 v jednom centru (Mayo Clinic). Celkově bylo nalezeno 63 pacientů, kterým byl diagnostikován CRC po orgánové transplantaci (játra 36,5 %). Medián času do diagnózy CRC 59,3 měsíců (4,4–251,4 měsíců). Průměrný věk pacientů v době diagnózy byl 63,4 let (37,0–82,0). Většina nádorů se vyskytovala v pravém kolon (60,9 %). U 15 pacientů byla diagnóza stanovena ve stadiu IV a u 13 (21,3 %) ve stadiu III. Medián přežití byl 30,8 měsíců. Pěti-, deseti - a patnáctileté přežití bylo 42,5 %, 17,9 % a 7,5 %. Pětileté přežití ve stadiu I, II a III bylo 77 %, 50 % a 42 %, tedy menší než v obecné populaci. Celkové přežití po 5 letech bylo příznivé při brzkém záchytu onemocnění (celkové 5leté přežití bylo 42,5 %), ovšem rapidně klesalo spolu s postupujícím stadiem onemocnění (žádný z pacientů ve IV. stadiu se nedožil 5 let od diagnózy) [10].
Klinickou charakteristikou pacientů se také zabývala nedávná britská studie hodnotící 52 pacientů s CRC po transplantaci jater. Medián diagnózy CRC od transplantace byl 5,6 let. Nejčastěji se jednalo o grade 2 (76,9 %) a stadium T3 (50 %). Většina pacientů měla stadium T3 nebo T4 (65 %). Nádory pravého tračníku představovaly < 50 %. Roční, pěti - a desetileté přežití bylo 71 %, 48 % a 31 %, což je významně méně než u sporadických nádorů [11].
Poněkud optimističtější výsledky přinesla práce korejských autorů, kteří porovnávali 66 pacientů s CRC po transplantaci jater se sporadickými nádory v obecné populaci. Transplantovaná skupina měla vyšší zastoupení T1–2 a N0 choroby, i když tyto rozdíly nebyly statisticky významné. Vysvětlením by mohla být časnější detekce u pacientů pod pravidelným lékařských dohledem ve srovnání s běžnou populací [28].
Vlastní zkušenosti
Od roku 1996 do června 2022 bylo na pracovišti IKEM provedeno 2 057 transplantací u 1 904 pacientů. Jednalo se o 1 140 mužů a 764 žen průměrného věku 53,6 (18,1–77,2) let. V tomto souboru bylo zaznamenáno sedm pacientů (pět mužů, dvě ženy, průměrný věk 53,7 let), u nichž byl po transplantaci diagnostikován CRC (0,37 %). Kolorektální karcinom byl u našich pacientů zjištěn v rozmezí od 2 do 6 let po transplantaci, a to přesto, že u všech pacientů bylo před transplantací provedeno pankoloskopické vyšetření bez záchytu neoplazie. V pěti případech (71,4 %) se jednalo o pacienty bez PSC/UC. Většina těchto nádorů (80 %) byla lokalizována v pravé části tračníku, tedy v literárně dokumentované převažující lokalizaci. U dvou pacientů probíhaly kolposkopické kontroly, při nichž byly zjištěny časné karcinomy řešené chirurgickou resekcí. U dalších tří pacientů došlo k záchytu onemocnění náhodně při jiném vyšetření (metastáza CRC v resekátu appendixu, ztluštění stěny céka jako vedlejší nález při CT urografii, sonografický nález metastatického postižení jater). U dvou pacientů (28,6 %) se jednalo o CRC v terénu PSC/UC. CRC byl v obou případech zjištěn při pravidelné kolposkopické kontrole 4 a 8 let po transplantaci (tab. 3).
Table 3. Charakteristika pacientů s CRC po OLTx v IKEM.
Tab. 3. Characteristics of CRC patients after OLTx in IKEM.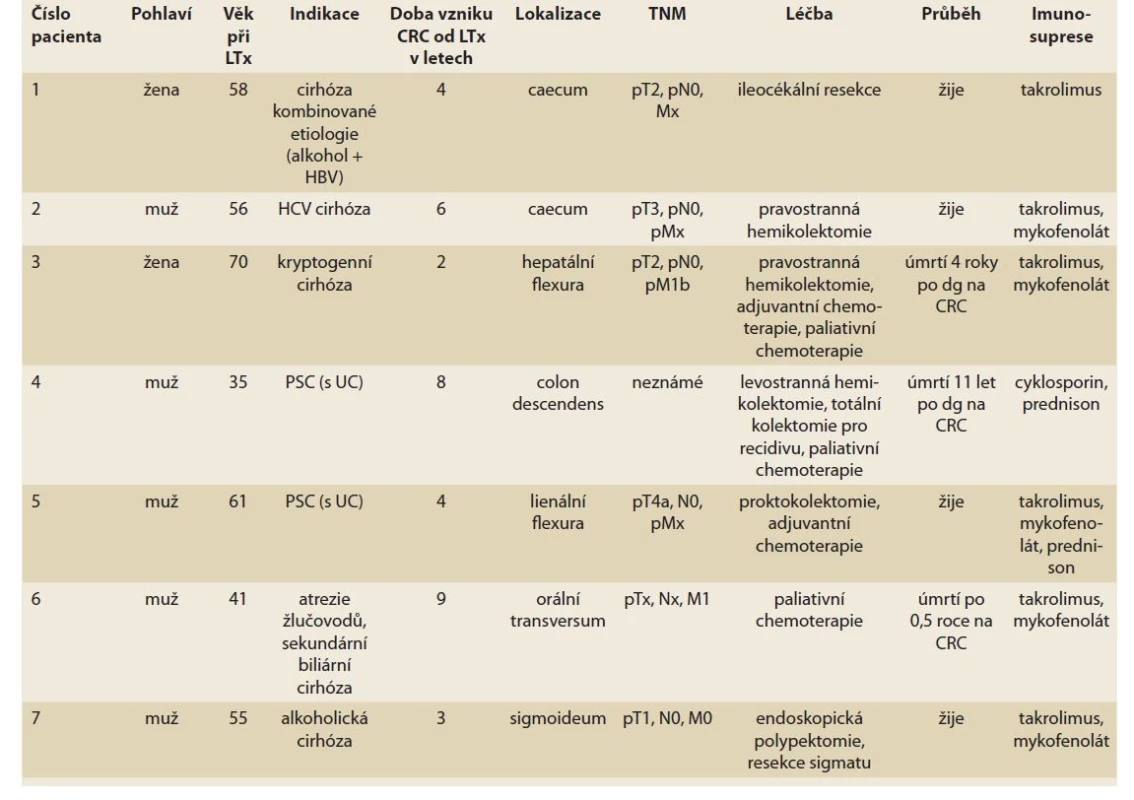
Limitace
Hlavní nedostatek naší práce vychází z limitací citovaných publikací. Jedná se o retrospektivní studie většinou hodnotící velké množství dat příjemců různých solidních orgánů a studující vznik všech malignit, tedy studie, které nejsou specificky zaměřené na pacienty po transplantaci jater ani na riziko CRC. Většina těchto prací také postrádá vlastní adekvátní kontrolní skupinu. Pacienti po transplantaci jater nejsou v některých studiích hodnoceni s ohledem na etiologii onemocnění, které bylo indikací k transplantaci, tedy v případě CRC často chybí zásadní informace o přítomnosti PSC/UC. Vedle toho nebývají k dispozici údaje o dalších eventuálních rizikových faktorech včetně protokolu imunosuprese. Důležitá je v případě CRC také znalost před - a potransplantačního vyšetřovacícho protokolu, z nichž některé obsahují koloskopii, jejichž provedení a výsledek mohou zásadně ovlivnit riziko vzniku CRC po transplantaci. Dalším problémem je fakt, že absolutní počet pacientů s kolorektálním karcinomem je obvykle nízký, a to i ve studiích, které se specificky zaměřují na pacienty s post-LTx CRC. I náš vlastní soubor pacientů je zatížen retrospektivním charakterem sběru dat a malým počtem pacientů ke stanovení zásadního závěru.
Závěr
Výskyt kolorektálního karcinomu u všech pacientů po transplantaci jater je dle většiny studií srovnatelný či mírně vyšší než v obecné populaci. Výrazně vyšší je u pacientů po transplantaci jater pro PSC s přítomností UC, či bez ní, což výrazně podporuje nutnost dlouhodobého pravidelného efektivního endoskopického sledování těchto pacientů. U pacientů transplantovaných pro ostatní indikace se zdá, že riziko vzniku CRC je jen minimálně zvýšené a nejspíše není důvodem k jiným než obvyklým způsobům screeningu. Dominantním faktorem vzniku CRC po transplantaci jater se tak zdá být preexistující jaterní a střevní onemocnění, rizikové faktory specifické pro transplantaci hrají nejspíše malou roli. K rozvoji CRC může však docházet rychleji ve srovnání se zdravou populací, častěji jsou nalézány pokročilejší formy onemocnění vedoucí k horší prognóze. Povědomí o riziku CRC po transplantaci jater u lékařů sledujících tyto pacienty může přispět k adekvátní prevenci a včasnému záchytu této malignity.
ORCID autorů
P. Mačinga ORCID 000-0003-3699-6914,
J. Král ORCID 0000-0001-6960-1013,
P. Taimr ORCID 0000-0002-6272-4608,
J. Froněk ORCID 0000-0003-2379-3886,
J. Špičák ORCID 0000-0002-3823-2881,
T. Hucl ORCID 0000-0002-5648-4011.
Doručeno/Submitted: 2. 8. 2022
Přijato/Accepted: 5. 8. 2022
prof. MUDr. Tomáš Hucl, Ph.D.
Klinika hepatogastroenterologie
IKEM Vídeňská 9
140 21 Praha 4
Sources
1. Haagsma EB, Hagens VE, Schaapveld M et al. Increased cancer risk after liver ůtransplantation: a population-based study. J Hepatol 2001; 34 (1): 84–91. doi: 10.1016/s0168-8278 (00) 00077-5.
2. Fung JJ, Jain A, Kwak EJ et al. De novo malignancies after liver transplantation: a major cause of late death. Liver Transpl 2001; 7 (11 Suppl 1): 109–118. doi: 10.1053/jlts.2001.28645.
3. Rocha A, Malheiro J, Fonseca I et al. Noncutaneous neoplasms after kidney transplantation: Analysis at single center. Transplantation Proc 2013; 45 (3): 1102–1105. doi: 10.1016/ j.transproceed.2013.02.005.
4. International agency for research on Cancer, Global cancer observatory. Globocan. 2018 [online]. Available from: https: //gco.iarc.fr/today/data/ factsheets/cancers/39-All-cancers-fact-sheet.
5. Engels EA, Pfeiffer RM, Fraumeni JF Jr et al. Spectrum of cancer risk among US solid organ transplant recipients. JAMA 201; 306 (17): 1891–1901. doi: 10.1001/jama.2011.1592.
6. Clarke WT, Feuerstein JD. Colorectal cancer surveillance in inflammatory bowel disease: Practice guidelines and recent developments. World J Gastroenterol 2019; 25 (30): 4148–4157. doi: 10.3748/wjg.v25.i30.4148.
7. Silva MA, Jambulingam PS, Mirza DF. Colorectal cancer after orthotopic liver transplantation. Crit Rev Oncol Hematol 2005; 56 (1): 147–153. doi: 10.1016/j.critrevonc.2004.12.013.
8. F. Aigner, E. Boeckle, J. Albright et al. Malignancies of the colorectum and anus in solid organ recipients. Transplant Int 2007; 20 (6): 497–504. 10.1111/j.1432-2277.2007.00 469.x.
9. Merchea A, Abdelsattar ZM, Taner T et al. Outcomes of colorectal cancer arising in solid organ transplant recipients. J Gastrointest Surg 2014; 18 (3): 599–604. doi: 10.1007/s11605-013-2402-3. doi: 10.1007/s11605-013-2402-3.
10. Merchea A, Shahjehan F, Croome KP et al. Colorectal Cancer characteristics and outcomes after solid organ transplantation. J Oncol 2019 : 5796108. doi: 10.1155/2019/5796108.
11. Rompianesi G, Ravikumar R, Jose S et al. Incidence and outcome of colorectal cancer in liver transplant recipients: A national, multicentre analysis on 8115 patients. Liver Int 2019; 39 (2): 353–360. doi: 10.1111/liv.13947.
12. Nicolaas JS, De Jongea V, Steyerbergb EW et al. Risk of colorectal carcinoma in post‐liver transplant patients: a systematic review and meta-analysis. Am J Transplant 2010; 10 : 868 – 876. doi: 10.1111/j.1600-6143.2010.03049.x.
13. Kang EA, Koh S, Kim JW et al. Prevalence of advanced colorectal neoplasm is higher in liver transplant recipients. Turk J Gastroenterol 2018; 29 (3): 316–324. doi: 10.5152/tjg.2018.17 458.
14. Sint Nicolaas J, Tjon ASW, Metselaar HJ et al. Colorectal cancer in post-liver transplant recipients. Dis Colon Rectum 2010; 53 (5): 817–821. doi: 10.1007/DCR.0b013e3181cc90c7.
15. Adami J, Gäbel H, Lindelöf B et al. Cancer risk following organ transplantation: a nationwide cohort study in Sweden. Br J Cancer 2003; 89 (7): 1221–1227. doi: 10.1038/sj.bjc.6601219.
15. Huo Z, Li C, Xu X et al. Cancer Risks in Solid Organ Transplant Recipients: Results from a Comprehensive Analysis of 72 Cohort Studies. Oncoimmunology 2020; 9 (1): 1848068. doi: 10.1080/2162402X.2020.1848068.
17. Selgrad M, Koornstra JJ, Fini L et al. JC virus infection in colorectal neoplasia that develops after liver transplantation. Clin Cancer Res 2008; 14 (20): 6717–6721. doi: 10.1158/1078-0432.CCR-08-0961.
18. Waldner M, Schimanski CC, Neurath MF. Colon cancer and the immune system: the role of tumor invading T cells. World J Gastroenterol 2006; 12 (45): 7233–7238. doi: 10.3748/wjg.v12.i45.7233.
19. Krynska B, Gordon J, Otte J et al. Role of cell cycle regulators in tumor formation in transgenic mice expressing the human neurotropic virus, JCV, early protein. J Cell Biochem 1997; 67 : 223–230. doi: 10.1002/ (sici) 1097-4644 (19971101) 67 : 2<223:: aid-jcb7>3.0.co; 2-z.
20. Dyson N, Bernards R, Friend SH et al. Large T antigens of many polyomaviruses are able to form complexes with the retinoblastoma protein. J Virol 1990; 64 : 1353–1356. doi: 10.1128/JVI.64.3.1353-1356.1990.
21. Enam S, Del VL, Lara C et al. Association of human polyomavirus JCV with colon cancer: evidence for interaction of viral T-antigen and h-catenin. Cancer Res 2002; 62 : 7093.
22. Goel A, Li MS, NagasakaT et al. Association of JC virusT-antigen expression with the methylator phenotype in sporadic colorectal cancers. Gastroenterology 2006; 130 : 1950–1961. doi: 10.1053/j.gastro.2006.02.061.
23. Carenco C, Faure S, Herrero A et al. Incidence of solid organ cancers after liver transplantation: Comparison with regional cancer incidence rates and risk factors. Liver Int 2015; 35 (6): 1748–1755. doi: 10.1111/liv.12758.
24. Albright JB, Bonatti H, Stauffer J et al. Colorectal and anal neoplasms following liver transplantation. Colorectal Dis 2010; 12 (7): 657–666. doi: 10.1111/j.1463-1318.2009.01840.x.
25. Safaeian M, Robbins HA, Berndt SI et al. Risk of Colorectal Cancer After Solid Organ Transplantation in the United States. Am J Transplant 2016; 16 (3): 960–967. doi: 10.1111/ajt.13549. doi: 10.1111/ajt.13549.
26. Johnson EE, Leverson GE, Pirsch JD et al. A 30-year analysis of colorectal adenocarcinoma in transplant recipients and proposal for altered screening. J Gastrointest Surg 2007; 11 (3): 272–279. doi: 10.1007/s11605-007-0084-4.
27. Atassi T, Thuluvath PJ. Risk of colorectal adenoma in liver transplant recipients compared to immunocompetent control population undergoing routine screening colonoscopy. J Clin Gastroenterol 2003; 37 (1): 72–73. doi: 10.1097/00004836-200307000-00018.
28. Kim M, Kim CW, Hwang S et al. Characteristics and Prognosis of Colorectal Cancer after Liver or Kidney Transplantation. World J Surg 2021; 45 (10): 3206–3213. doi: 10.1007/s00 268-021-06219-9.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2022 Issue 4-
All articles in this issue
- Klinická a experimentální gastroenterologie
- Kvíz z klinické praxe
- Sarkopenie, myosteatóza a syndrom křehkosti u pacientů s cirhózou jater
- Význam biologické léčby v časné fázi Crohnovy choroby: mini-review
- Kolorektální karcinom po transplantaci jater
- Poruchy pánevního dna u žen z pohledu koloproktologa
- Asociácia nealkoholovej tukovej choroby pečene s kardiálnym štrukturálnym postihnutím
- Výběr z mezinárodních časopisů
- Odešel MUDr. Ivo Novotný, CSc., a endoskopické Brno už nebude nikdy stejné
- Zpráva o činnosti výboru ČGS ČLS JEP v období 2018–2022
- Profesor Martin Freeman hostem Olomouc Live Endoscopy 2022
- Tak šel čas s PBC – je třeba posunout se zase o krok vpřed
- Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Účinek ketaminu, antagonisty NMDA-receptoru, na žaludeční myoelektrickou aktivitu experimentálních prasat
- Úprava životního stylu pro zlepšení úzkosti a deprese u pacientů se syndromem dráždivého tračníku
- Cirhóza pečene u rómskych pacientov z pohľadu hepatologického transplantačného centra
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Poruchy pánevního dna u žen z pohledu koloproktologa
- Odešel MUDr. Ivo Novotný, CSc., a endoskopické Brno už nebude nikdy stejné
- Sarkopenie, myosteatóza a syndrom křehkosti u pacientů s cirhózou jater
- Význam biologické léčby v časné fázi Crohnovy choroby: mini-review
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

