-
Medical journals
- Career
Gastroskopie – standardy kvality České gastroenterologické společnosti ČLS JEP
Authors: Cyrany J. 1; Balihar K. 2; Falt P. 3; D. Kohoutová 1,4; Kroupa R. 5; Martínek J. 6; Mikoviny-Kajzrlíková I. 7; Klusáková H. 1; Procházka R. 8; Štěpán M. 9; Vaňásek T. 10; S. Rejchrt 1
Authors‘ workplace: II. interní gastroenterologická klinika LF UK a FN Hradec Králové 1; I. interní klinika LF UK a FN Plzeň 2; II. interní klinika – gastroenterologická a geriatrická LF UP a FN Olomouc 3; Royal Marsden Hospital NHS Foundation Trust, London 4; Interní gastroenterologická klinika LF MU a FN Brno 5; Klinika hepatogastroenterologie IKEM, Praha 6; Beskydské gastrocentrum, Nemocnice ve Frýdku-Místku, p. o. 7; Gastroenterologie, Nemocnice Jablonec nad Nisou, p. o. 8; Centrum péče o zažívací trakt, Nemocnice AGEL Ostrava-Vítkovice a. s. 9; Hepato-Gastroenterologie HK, s. r. o., Hradec Králové 10
Published in: Gastroent Hepatol 2022; 76(3): 194-211
Category:
doi: https://doi.org/10.48095/ccgh2022194Úvod
Gastroskopie (horní digestivní endoskopie) je široce používanou diagnostickou a terapeutickou metodou. Historicky se jedná o nejstarší z endoskopických metod, které následně expandovaly do ostatních oblastí (koloskopie, ERCP, EUS). Na základě dlouhé historie a relativní jednoduchosti provedení je metoda považována za konvenční a kvalita jejího provádění dosud nebyla v zemích s nízkým rizikem výskytu karcinomu žaludku v ohnisku zájmu. To však kontrastuje s aktuálními výzvami časné diagnostiky pre/ neoplastických lézí v horní části GIT a nezbytností kvalitní dispenzarizace někte rých vysokorizikových skupin. Hlavním cílem definování kvalitativních parametrů je zejména časná diagnostika neoplastických lézí, která pak umožňuje minimálně invazivní endoskopickou terapii se zachováním daného orgánu a zásadním dopadem na léčebné výsledky, kvalitu života a prognózu pacienta. V populaci dále roste význam někte rých neonkologických onemocnění (především celiakie a eozinofilní ezofagitidy), jejichž diagnostika má také svá úskalí. Přestože je metoda považována obecně za velmi bezpečnou, může být provázena komplikacemi, na jejichž řešení musejí být endoskopisté připraveni. Neméně důležitým aspektem je komfort pacienta podstupujícího gastroskopii.
Snaha definovat parametry kvality endoskopického vyšetření horní části GIT vedla k publikaci evropských standardů [1,2], a to i přes nedostatek kvalitních důkazů, což kontrastuje s podobnými aktivitami u koloskopického vyšetření.
Endoskopická sekce České gastroenterologické společnosti se rozhodla přispět ke zvýšení kvality horní endoskopie v České republice definováním doporučení, která z výše uvedených standardů vycházejí, s přihlédnutím k lokálním podmínkám a potřebám i aktuálnímu stavu poznání. Cílem je vytvořit maximálně praktický nástroj kultivace gastroskopického vyšetření v České republice, podobně jak se to již úspěšně podařilo s metodou koloskopickou.
Metodika
Na základě publikovaných evropských doporučení [1,2] a další diskuze bylo formulováno 17 klíčových tvrzení týkajících se parametrů kvality, které byly připomínkovány všemi spoluautory. Tyto jednotlivé kapitoly byly rozděleny mezi členy autorského kolektivu k aktualizaci literární rešerše a případné modifikaci jednotlivých tvrzení, která pak autoři doplnili doprovodným textem. Výsledný text byl pak znovu připomínkován autorským kolektivem, ve kterém jsou zastoupeni lékaři z nemocnic oblastního i univerzitního typu, ambulantní specialista, chirurg a endoskopická sestra.
Každé tvrzení je opatřeno údajem o jistotě důkazů (A – vysoký, B – střední, C – nízký, D – velmi nízký) dle systému GRADE [3] tak, jak vyplývá z analýz evropských doporučení [1,2], pokud nebyly v dané oblasti získány důkazy nové. Síla doporučení (1 – silná, 2 – slabá) jednotlivých tvrzení, vycházející ze stejného zdroje, byla s cílem zohlednit lokální podmínky navíc podrobena hlasování autorského kolektivu dle Delfské procedury (pětibodová Likertova škála, dvě kola hlasování, potřeba nejméně 80% shody), jehož výsledek je připojen ke každému tvrzení jako procento souhlasu autorů (detailní výsledek hlasování přístupný graficky na webu časopisu www.csgh.info).
Výsledky
Doporučení je možno rozdělit na preprocedurální, procedurální, specifická pro postižení a postprocedurální (tab. 1).
Table 1. Přehled parametrů kvality horní endoskopie (síla doporučení: 1 – silné, 2 – slabé; jistota důkazů: A – vysoký, B – střední, C – nízký, D – velmi nízký; procento souhlasu autorů).
Tab. 1. Overview of upper endoscopy quality parameters (strength of recommendation: 1 – strong, 2 – weak; certainty of evidence: A – high, B – medium, C – low, D – very low; percentage of authors‘ agreement).
Tab. 1 – pokračování. Přehled parametrů kvality horní endoskopie (síla doporučení: 1 – silné, 2 – slabé; jistota důkazů: A – vysoký, B – střední, C – nízký, D – velmi nízký; procento souhlasu autorů).
Tab. 1 – continuing. Overview of upper endoscopy quality parameters (strength of recommendation: 1 – strong, 2 – weak; certainty of evidence: A – high, B – medium, C – low, D – very low; percentage of authors‘ agreement).
Preprocedurální doporučení
Doporučení 1 – příprava k vyšetření
Pacient podstupující plánovanou gastroskopii by měl být nalačno. Pevnou stravu by měl přijímat nejpozději 6 hodin a tekutiny 2 hodiny před vyšetřením.
Pacient před plánovanou gastroskopií má být nalačno a má o tom být řádně informován. Perorální příjem je za normálních okolností omezen pro pevné lehce stravitelné jídlo na 6 hodin a tekutiny na 2 hodiny před výkonem [4]. Prodlužování těchto intervalů za normálních okolností nezvyšuje bezpečnost výkonu, ale zhoršuje komfort pacienta [1,5,6]. K upřesnění těchto instrukcí pomůže extrapolace anesteziologických standardů, které doporučují stejný interval 6 hodin po požití nehumánního mléka a doporučují interval prodloužit na 8 a více hodin v případě příjmu masa, tučných a smažených jídel [7]. U stavů s porušenou evakuací jícnu (např. achalázie) nebo žaludku (např. polyrostenóza) je vhodné zvážit:
1. prodloužení intervalu omezení perorálního příjmu;
2. evakuaci obsahu žaludku nazogastrickou sondou před vyšetřením;
3. použití endoskopu s co největším průměrem pracovního kanálu případně více pracovními kanály (tzv. terapeutický nebo dvoukanálový gastroskop) a/ nebo
4. asistenci anesteziologa k zajištění dýchacích cest v celkové anestezii.
Posledních dvou přístupů využíváme také v případě urgentní gastroskopie (do 6 hodin), jakkoli je tato indikace výjimečná (např. extrakce knofl íkové baterie z jícnu, krvácení do GIT u pacienta, kterého se nedaří oběhově stabilizovat apod.). Nutno si uvědomit, že zajištění dýchacích cest orotracheální intubací při plném žaludku je také výkon s vysokým rizikem aspirace. V případě masivního krvácení do GIT lze vyprázdnění žaludku urychlit podáním i.v. erytromycinu (v ČR k dispozici na individuální dovoz). Perorální podání protipěnivého přípravku (např. simeticonu) a mukolytika (např. N-acetylcysteinu) může zvýšit přehlednost, snížit potřebu oplachu, a zkrátit tak dobu vyšetření, zatím bez průkazu vyššího záchytu patologických lézí – blíže viz bod 4 – kvalita zobrazení sliznice.
Doporučení 2 – vstupní kontrolní seznam
Před zahájením každé gastroskopie je vhodná rutinní kontrola základních bezpečnostních podmínek: identifikace pacienta; alergická anamnéza; lačnění; medikace (především an ti trom botická); významné komorbidity; informace o minulých vyšetřeních; potvrzení indikace vyšetření; informovaný souhlas, kterému pacient porozuměl a nemá další otázky; přítomnost doprovodu pacienta.
Vstupní vyhodnocení je nezbytné k zachování správného postupu a omezení výskytu nežádoucích příhod, které jsou v moderní medicíně relativně časté, uvádí se 10% výskyt medicínské chyby při retrospektivním hodnocení [8]. To se týká i endoskopických výkonů, kdy při hodnocení 1 818 úmrtí nemocných do 30 dnů od endoskopické intervence bylo považováno 14 % indikací za nepřiměřených a 9 % zbytečných [9]. Následná opatření reagující na tyto skutečnosti zahrnují i zavedení doporučení a nástrojů k vyhledání rizik a nápravě chyb včetně vstupních procedur. Mezi ně se řadí i písemné formy kontrolního seznamu potvrzující splnění všech klíčových bodů správného postupu [10]. Zavedení kontrolních seznamů („checklistů“) má své výhody (formální návod zajišťuje správný postup bez ohledu na změny personální, rušivé stresující momenty, je forenzně důležitým dokladem), i nevýhody: zvyšuje administrativní zátěž a podhodnocení rizik při formálním přístupu.
Je doporučováno v dokumentaci potvrdit (odškrtnout), že:
• nemocný byl správně identifikován;
• vyšetřující tým se mu formálně představil;
• byla správně zadána data do softwaru souvisejícího s vyšetřením;
• vyšetřující lékař potvrdil správnost indikace vyšetření;
• nemocný potvrdil svůj souhlas s vyšetřením či jinak byla naplněna legislativní způsobilost úkonu;
• nemocný je k vyšetření řádně připraven (lačnění);
• jsou splněny podmínky analgosedace (žilní přístup, monitorace saturace krve kyslíkem a tepové frekvence);
• vyhodnocena rizika: alergie, komorbidity, antitrombotická medikace;
• zhodnocen stav chrupu;
• zhodnocena epidemiologická anamnéza;
• zváženo podání antibiotické profylaxe
• je připraven správný typ endoskopu a zkontrolována jeho funkce.
Součástí může být i potvrzení správného provedení postprocedurálních opatření jako správné vystavení nálezu z vyšetření, označení vzorků, použitého materiálu a následného sledování nemocného (viz doporučení 8).
Použití „checklistů“ u potenciálně rizikových postupů se zdá být užitečným opatřením v řadě medicínských oborů [11], pro endoskopické vyšetření je udáváno jako silné doporučení se slabou silou důkazů [2]. Recentní analýza pěti studií na toto téma [12] prokázala proveditelnost zavedení kontrolního seznamu a jeho pozitivní vliv na komunikaci v endoskopickém týmu. Vliv na bezpečnost a redukci chyb lze zatím pouze předpokládat, přesto je této problematice věnováno recentní doporučení evropských autorit [13].
Autoři těchto doporučení aktuálně nepovažují za nezbytné závazné použití „checklistu“, to je předmětem diskuze a lokálních standardů každého pracoviště.
Písemný informovaný souhlas či vyjádření k legální indikaci vyšetření i bez takto ověřeného souhlasu je v rámci současné legislativy naléhavě doporučen, musí obsahovat srozumitelně i rizika a alternativy vyšetření.
Přítomnost doprovodu pacienta je komplexním problémem etickým a legislativním, pacient by měl před ambulantním podáním analgosedace deklarovat, že má zajištěnu kompetentní osobu k následnému dohledu, přebírající osoba optimálně podepíše, že nemocného v daném čase pod svůj dohled přebírá (legislativní pohled se může lišit, není známo závazné stanovisko).
Zásadní je vyhodnocení správné indikace vyšetření, která musí být obsažena ve zprávě o vyšetření; je třeba vyhodnotit, zda od prvotní indikace odesílajícím lékařem se situace nezměnila, nejsou přítomny kontraindikace výkonu, a naopak trvá benefit pro pacienta vzhledem k jeho věku a komorbiditám.
Procedurální doporučení
Doporučení 3 – rozsah a délka vyšetření
Rozsah a trvání gastroskopického vyšetření mají být dokumentovány. Gastroskopie u pacienta, který toto vyšetření nepodstoupil v posledních 3 letech, by měla zhodnotit jícen, žaludek i duodenum. Gastroskopie u pacienta, který toto vyšetření nepodstoupil v posledních 3 letech, by měla trvat optimálně alespoň 7 minut od zavedení po vytažení přístroje.
Základem hodnocení kompletnosti diagnostické gastroskopie je popis dosažení sestupného úseku duodena. Vizualizace (případně fotodokumentace) Vaterovy papily standardním axiálním přístrojem (jako analogie dosažení dna céka při koloskopii) není zatím vše obecně akceptována jako dobře reprodukovatelný parametr kvality [1]. Pokud není horní endoskopie provedena kompletně, mělo by to být uvedeno v závěru vyšetření a v popisu vysvětlen důvod. Možným ukazatelem kvality horní endoskopie z hlediska detekce patologických nálezů je délka procedury od zavedení přístroje po jeho vytažení. Doporučení času vyšetření 7 minut a déle vychází z jedné retrospektivní práce [14], která prokázala cca trojnásobně vyšší šanci na záchyt intestinální metaplazie, žaludeční atrofie, dysplazie nebo karcinomu oproti vyšetřením trvajícím méně než 7 minut. Jiná práce ukázala 1,5násobně vyšší záchyt žaludeční dysplazie a karcinomu u endoskopistů vyšetřujících déle než 3 minuty [15]. Při nedostatečné zkušenosti a tréninku endoskopisty nemusí být samotná délka vyšetření pro záchyt neoplazie rozhodující [16,17]. Sledování časového intervalu má význam především u „naivních“ vyšetření u pacientů, kteří v uplynulých 3 letech vyšetřeni nebyli, a u dispenzárních vyšetření pro dříve známou patologii [2] – blíže viz doporučení 9 [18]. Delší čas byl měl být vymezen dispenzárnímu vyšetření pacientů s dlouhým segmentem Barrettova jícnu – blíže viz bod 10 [19]. S dobou prohlížení jícnu při endoskopii a potenciálně kvalitou vyšetření může souviset i detekce heterotopické žaludeční sliznice obvykle v orálním jícnu (cervical inlet patch). Při předpokládané prevalenci 3–14 % v populaci [20–22] lze z frekvence záchytu této abnormality jinak nevyžadující dispenzarizaci [23] nepřímo usuzovat na preciznost prohlížení [24]. Nově koncipovaný indikátor kvality gastroskopie – CDR (composite detection rate) také zahrnuje parametr heterotopické žaludeční sliznice v orálním jícnu současně s detekcí polypu žaludku a povředové deformace bulbu duodena – výsledný parametr koreluje se záchytem neoplazií v horní části trávicí trubice [25]. Další vědecké důkazy pro vztah délky vyšetření a diagnostického přínosu gastroskopie očekáváme od recentně probíhajících studií [26].
Doporučení 4 – kvalita zobrazení sliznice
Během horní endoskopie by mělo být dosaženo adekvátního zobrazení sliznice jícnu, žaludku a dvanáctníku. Pokud to není z nějakého důvodu možné, skutečnost je třeba zaznamenat a individuálně posoudit nutnost opakování endoskopie. Kvalitního zobrazení lze kromě správné přípravy a analgosedace dosáhnout kombinací adekvátní insufl ace, oplachu a aspirace. V individuálních případech a dle zvyklostí pracoviště lze před horní endoskopií zvážit perorální podání roztoku surfaktantu a/ nebo mukolytika.
Adekvátní zobrazení sliznice je podmínkou kvalitní diagnostické horní endoskopie. Toho lze dosáhnout dostatečnou distenzí po insufl aci vzduchu nebo oxidu uhličitého, oplachem vodou, nejlépe aplikovanou pomocí vodní pumpy a akcesorního kanálu endoskopu, a odsáváním zbytkové tekutiny [2]. Oplachovou vodu lze doplnit roztoky s odpěňovacím a mukolytickým účinkem, v našem prostředí nejčastěji simetikonem a/ nebo N-acetylcysteinem. Oplach sliznice mukolytikem navíc může zlepšit kvalitu a diagnostickou výtěžnost klešťových biopsií žaludku [27]. Simetikon může ulpívat na stěnách kanálu endoskopu i po standardním reprocesingu, proto je preferováno jeho podání pracovním (nikoli oplachovým) kanálem endoskopu v nejnižší účinné koncentraci [28,29]. Řada převážně východoasijských studií prokazuje zvýšení přehlednosti sliznice, snížení potřeby oplachu a zkrácení doby vyšetření po perorálním podání roztoku simetikonu, pronázy, N-acetylcysteinu nebo jejich kombinací [30–35], zatím bez jednoznačného průkazu vyšší detekce lézí [36]. Účinnost roztoku může být negativně ovlivněna nízkou koncentrací účinné látky [37]. Obvyklé je podání roztoku o objemu 100 ml 15–30 minut před zahájením endoskopie.
Doporučení 5 – analgosedace a lokální anestezie
Intravenózní analgosedace a lokální anestezie hrdla mohou být používány jednotlivě, nebo v kombinaci (s opatrností u pacientů se zvýšeným rizikem aspirace). Endoskopická jednotka respektuje zásady bezpečné analgosedace včetně řádné dokumentace a sledování komplikací analgosedace.
Endoskopie horní části trávicího traktu má být bezpečná, komfortní a technicky úspěšná [4]. O potřebě a typu analgosedace a/ nebo lokální anestezie rozhoduje lékař s přihlédnutím k preferenci pacienta po zvážení rizik a průběhu předchozích vyšetření. K lokální anestezii je používán např. 10% lidokain, jehož topický účinek nastupuje za 1–3 minuty a trvá do 15 minut po aplikaci. Byť lokální anestetikum bezpochyby zlepšuje toleranci nemocného při gastroskopii [38], není jeho aplikace z hlediska výše zmíněných cílů u části pacientů dostatečná. Cílem analgosedace je zmírnit pacientovu úzkost a diskomfort, dosáhnout optimální kvality vyšetření a pokud možno eliminovat vzpomínky pacienta na samotné vyšetření [4]. Více studií prokázalo, že kombinace lokálního ane stetika s analgosedací komfort a toleranci gastroskopie zvýší, přičemž kardiorespirační vedlejší účinky zůstávají minimální [39,40]. Přesto je třeba zvážit potenciální zvýšení rizika komplikací (aspirace) při kombinaci lokálního anestetika a intravenózně podané analgosedace, a to především u starších jedinců. Princip lokální anestezie a analgosedace má být pacientovi vysvětlen a má být součástí informovaného souhlasu.
Před podáním analgosedace je nutné ponechat nemocného nalačno nejméně 6 hodin (pokud jde o pacienta bez poruchy evakuace žaludku). Čiré tekutiny nemá pacient pít nejméně 2 hodiny před výkonem [41]. Pokud to není splněno a není-li možný odklad endoskopie z medicínského hlediska, pak má být konzultován anesteziolog ke zvážení zajištění dýchacích cest [4]. Endo skopista se má před podáním analgosedace seznámit s komorbiditami pacienta (lze použít ASA klasifi kace), medikací, alergiemi a u žen ve fertilním věku s případnou graviditou. Lékař by měl vědět o eventuálních nežádoucích účincích léků podaných při minulé analgosedaci [4,42–44]. Analgosedace má být titrována edukovaným personálem, který je schopen posoudit hloubku sedace a je schopen adekvátně reagovat v případě vzniku nežádoucí reakce, včetně případné kardiopulmonální resuscitace [2]. V zájmu optimálního zaručení bezpečnosti a kvality výkonu v analgosedaci je vhodná přítomnost alespoň dvou sester, zvláště u rizikových a technicky náročnějších výkonů.
Podmínkou podání nitrožilní analgosedace je funkční periferní žilní katétr (fl exila), pokud není vstup zajištěn jinak (centrální žilní katétr, port apod.). Nedoporučujeme jednorázové podání jehlou – kromě možnosti doplňovat v průběhu výkonu analgosedaci je hlavním bezpečnostním důvodem možnost bezodkladného podání antidot.
Základními léky používanými v současnosti k analgosedaci je krátkodobě působící benzodiazepin (obvykle midazolam) a opiátové analgetikum (fentanyl, sufentanyl). Na pracovišti musí být dostupná antidota: naloxon (antidotum opiátu) a fl umazenil (antidotum benzodiazepinu) [44] – základní farmakologické údaje o těchto léčivech viz apendix 1. Podání propofolu neanesteziologem není na rozdíl od ně kte rých jiných evropských států v České republice v současné době dovoleno [45]. Navozená sedace může být od minimální (normální odpověď na verbální stimulaci) přes střední až po hlubokou (cílená odpověď až na opakované nebo bolestivé podněty). Při střední a hluboké sedaci má být podána oxygenoterapie, která zamezí desaturaci, jež by se mohla eventuálně podílet na vzniku kardiovaskulárních příhod [44,46]. Povinná je monitorace krevního tlaku, pulzu, kyslíkové saturace, ventilační aktivity a úrovně vědomí před výkonem, během výkonu a po výkonu. U nemocných se signifikantním kardiovaskulárním onemocněním nebo arytmiemi má být již při středně hluboké sedaci kontinuálně monitorováno EKG. Sledována má být úroveň diskomfortu pacienta při výkonu [4,47], špatnou toleranci výkonu pacientem je vhodné zaznamenat do zprávy o vyšetření. Nutná je přesná dokumentace dávky použité analgosedace, eventuálních intraprocedurálních a postprocedurálních komplikací spojených s podáním analgosedace [2].
Mezi minimální požadavky pro dimisi pacienta po horní endoskopii s analgosedací patří následující:
1. stabilní vitální funkce během sledování po výkonu;
2. pacient je při vědomí, orientovaný místem, časem a osobou (u osob s narušeným stavem vědomí před endoskopií je požadován návrat k původnímu stavu vědomí);
3. nepřítomnost významné bolesti, krvácení či zvracení;
4. schopnost se obléknout a opustit endoskopické pracoviště s doprovodem;
5. endoskopovaný je předán kompetentní dospělé osobě, která bude pacienta sledovat po dobu adekvátní typu podané analgosedace a provedeného endoskopického zákroku;
6. pacient a jeho doprovod obdrží písemné a ústní instrukce stran diety, fyzických a pracovních aktivit, medikace, dalšího sledování;
7. je přiložen postup a telefonní kontakt pro případ vzniku odložených komplikací [48].
Doporučení 6 – fotodokumentace vyšetření
Kvalitní dokumentace gastroskopie obsahuje fotodokumentaci všech abnormálních nálezů a všech normálních anatomických oblastí (D2 duodenum, bulbus duodena, antrum žaludku, angulární řasa, tělo žaludku, fundus žaludku z retrofl exe, distální jícen s impresí bránice, horním okrajem gastrických řas a skvamokolumární junkcí epitelů; proximální jícen – celkem nejméně 8 snímků).
Fotodokumentace pořízená během vyšetření horního trávicího traktu patří mezi důležité nástroje ke zvyšování kvality horní endoskopie. Na druhou stranu neexistují žádná data, která by dokazovala, že fotodokumentace normálních anatomických oblastí a abnormálních nálezů v horním gastrointestinálním traktu zlepšuje diagnostický přínos [1,2]. Nicméně řada expertů a odborných společností se shoduje, že fotodokumentace je důležitým ukazatelem kompletního vyšetření, umožňuje a zlepšuje následnou komunikaci mezi endoskopisty při hodnocení abnormálních nálezů včetně dalšího sledování [1,49]. Horní endoskopie by měla být prováděna videoendoskopickými systémy s vysokým rozlišením se schopností pořizovat obrazové snímky, které by měly být adekvátním způsobem archivovány pro další potřebu [2]. Snímky by měly být pořízeny po dostatečném oplachu sliznice, přičemž střed lumina orgánu by měl být většinou ve středu obrazu. Žaludek by měl být dostatečně insuflovaný, aby byla dobře přehledná sliznice mezi záhyby [17]. Během diagnostické gastroskopie by mělo být pořízeno nejméně 8 snímků z těchto oblastí (obr. 1) [2,49]:
Image 1. Schéma základní fotodokumentace při gastroskopii.
1 – orální jícen, 2 – jícen s gastro-ezofageální funkcí, 3 – tělo žaludku, 4 – antrum žaludku, 5 – bulbus duodena, 6 – D2 duodena, 7 – angulární řasa, 8 – fundus žaludku v retroflexi.
Fig. 1. Scheme of basic photo documentation in gastroscopy.
1 – oral esophagus, 2 – esophagus with gastro-oesophageal function, 3 – gastric body, 4 – gastric antrum, 5 – duodenal bulb, 6 – D2 duodenum, 7 – angular fold, 8 – gastric fundus in retroflex position.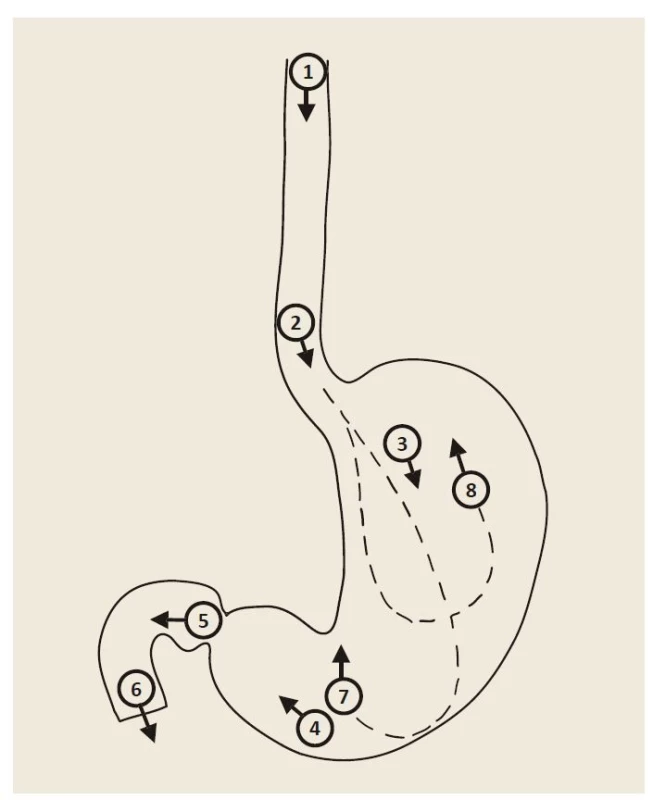
• proximální jícen (snímek z oblasti 20 cm od řezáků);
• distální jícen (2 cm nad Z linií, skvamokolumární junkce, horní okraj gastrických řas, imprese bránice);
• kardie v retroflexi (kardie, fundus žaludku);
• tělo žaludku;
• angulus v parciální retroflexi;
• antrum žaludku;
• bulbus duodena (z bulbární strany pyloru);
• D2 duodenum včetně Vaterovy papily, pokud je viditelná (obr. 1).
Nejdůležitější je pořízení dostatečné snímkové dokumentace všech abnormálních nálezů [1,2,17]. Celé spektrum doporučených fotografií neprovádíme při někte ých terapeutických výkonech, akutních výkonech (například pro krvácení do horní části trávicí trubice) a tehdy, kdy není indikováno kompletní gastroskopické vyšetření (jak je specifikováno v doporučení 3) [1]. Pokud nelze fotodokumentaci v dostatečné kvalitě pořídit (nespolupráce pacienta, porucha přístroje), je to nutné zaznamenat v popisu vyšetření.
Ve specifických situacích je žádoucí pořídit více standardní snímkové dokumentace zajišťující dostatečné pokrytí rizikové oblasti: například u osob se zvýšeným rizikem karcinomu žaludku (22 snímků) nebo Barrettovým jícnem (jeden obrázek na 1 cm Barrettova jícnu), pokud není k dispozici videozáznam [19,50]. Také u gastroskopií terapeutických je vhodné dokumentovat celé vyšetření videozáznamem i vzhledem k možnosti analýzy případných komplikací vzniklých v průběhu výkonu. S foto - i videodokumentací je nutné nakládat v souladu s pravidly kybernetické bezpečnosti. Pořizovací náklady systémů elektronického snímání obrazu jsou dnes již vyváženy výhodami, které tato dokumentace přináší, a ta by se proto měla stát jednou z priorit pro nemocniční i ambulantní endoskopisty [1,51].
Doporučení 7 – standardizovaná terminologie
Abnormální nálezy by měly být popsány dle minimální standardní terminologie; v závěru vyšetření je vhodné využít dostupnou mezinárodně validovanou a standardizovanou terminologii pro konkrétní abnormální nález.
• Forrestova klasifikace (tab. 2) – krvácející vředy gastroduodena;
Table 2. Forrestova klasifikace krvácejících peptických vředů.
Tab. 2. Forrest classification of bleeding peptic ulcers.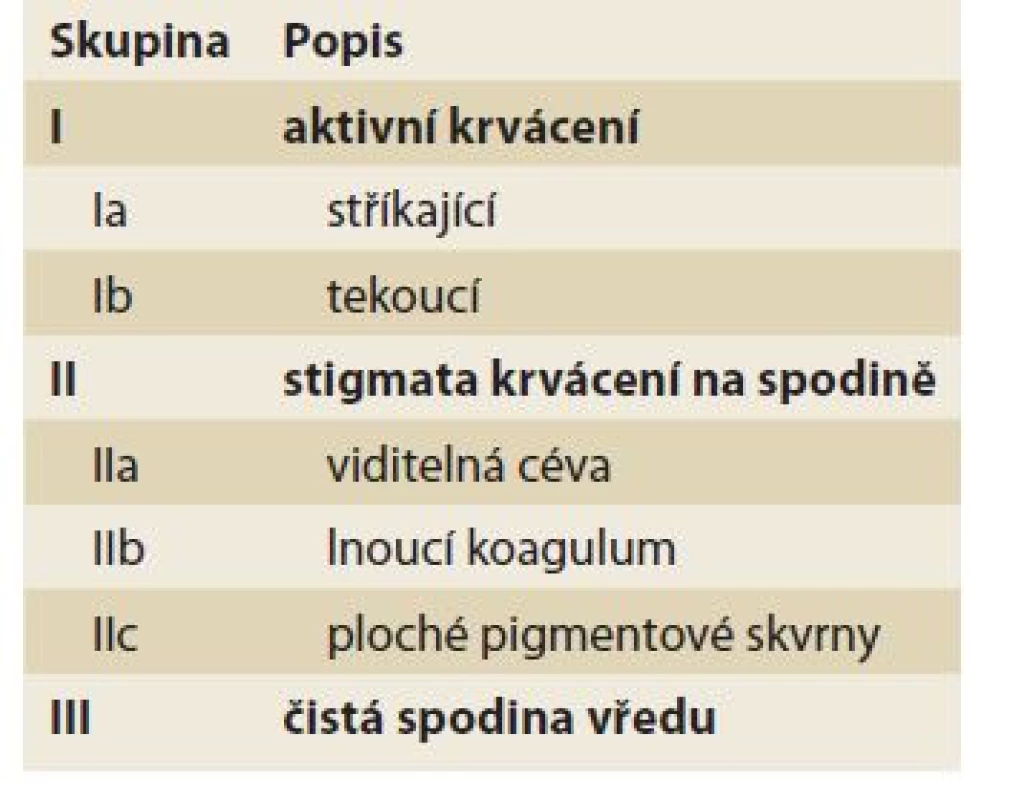
• Pařížská klasifikace (obr. 2) – viditelné léze v jícnu, žaludku a duodenu;
Image 2. Schéma Pařížské klasifikace.
Fig. 2. Paris classification scheme.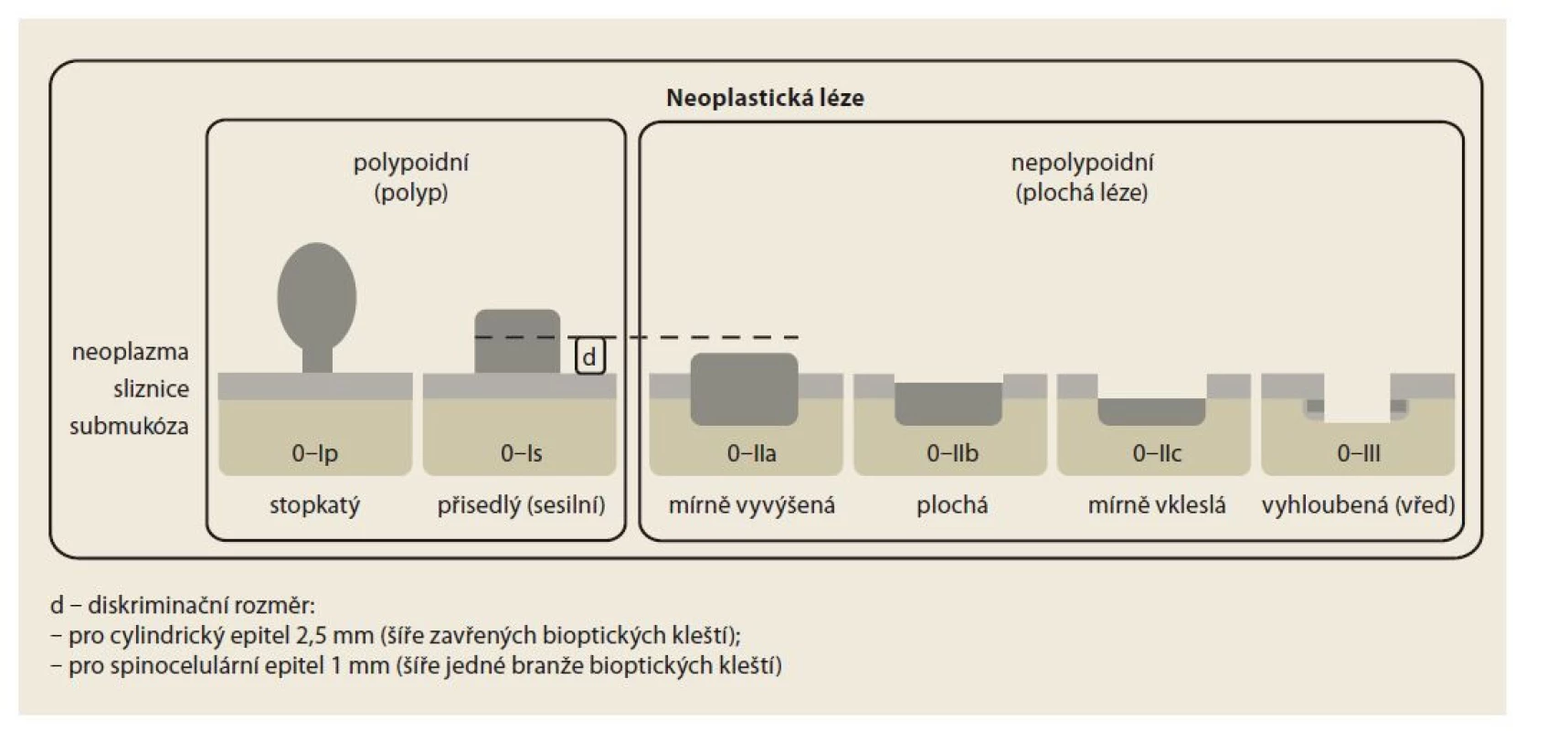
• Losangeleská klasifikace (tab. 3)
Table 3. Losangeleská klasifikace refluxní ezofagitidy.
Tab. 3. Los Angeles classification of reflux esophagitis.
• Savaryho-Millerova klasifikace (tab. 4) – endoskopické projevy refluxní choroby;
Table 4. Savaryho Millerova klasifikace endoskopických projevů refluxní choroby jícnu.
Tab. 4. Savary Miller‘s classification of endoscopic manifestations of esophageal reflux disease.
• Pražská klasifikace (obr. 3 a tab. 5) – Barrettův jícen;
Image 3. Schéma Pražské klasifikace.
Fig. 3. Prague classification scheme.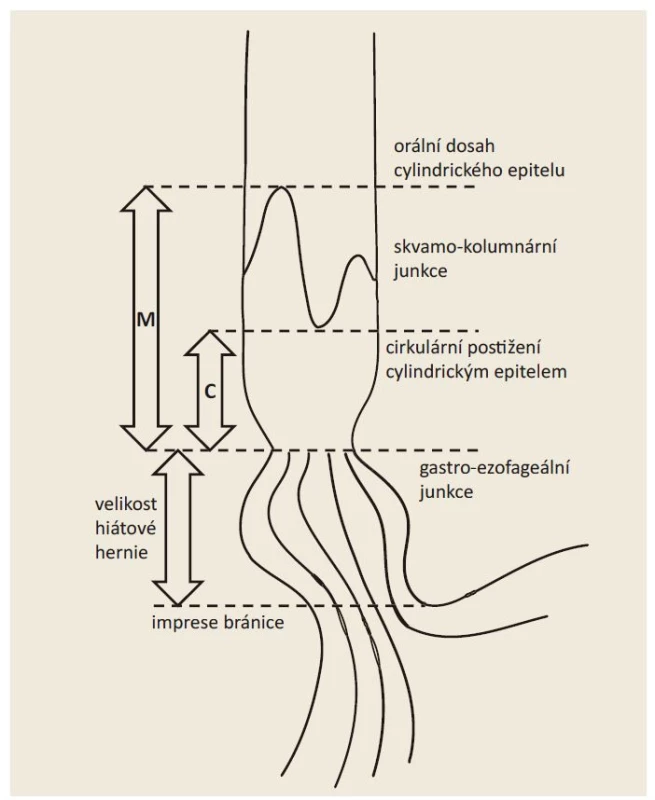
Table 5. Pražská klasifikace.
Tab. 5. Prague classification.
• Baveno klasifikace (tab. 6);
Table 6. Baveno klasifikace jícnových varixů.
Tab. 6. Baveno classification of esophageal varices.
• Sarinova klasifikace (tab. 7) – varixy při portální hypertenzi;
Table 7. Sarinova klasifikace žaludečních varixů.
Tab. 7. Sarin‘s classification of gastric varices.
• EREFS klasifikace (tab. 8) – eozinofilní ezofagitida;
Table 8. EREFS klasifikace.
Tab. 8. EREFS classification.
• Zargarova klasifikace (tab. 9) – poleptání horního gastrointestinálního traktu;
Table 9. Zargarova klasifikace.
Tab. 9. Zargar‘s classification.
• Spigelmanova klasifikace (tab. 10, 11) – duodenální adenomatóza při FAP.
Table 10. Spigelmanova klasifikace.
Tab. 10. Spigelman‘s classification.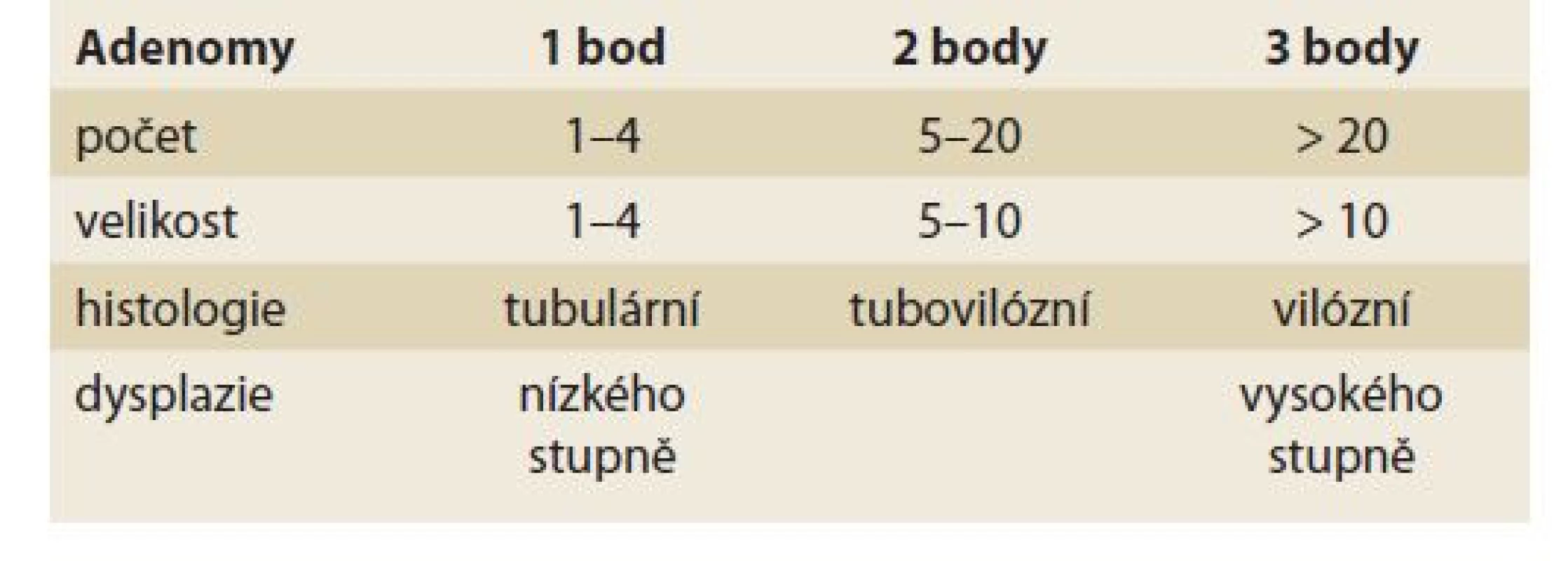
Table 11. Spigelmanova klasifikace.
Tab. 11. Spigelman classification.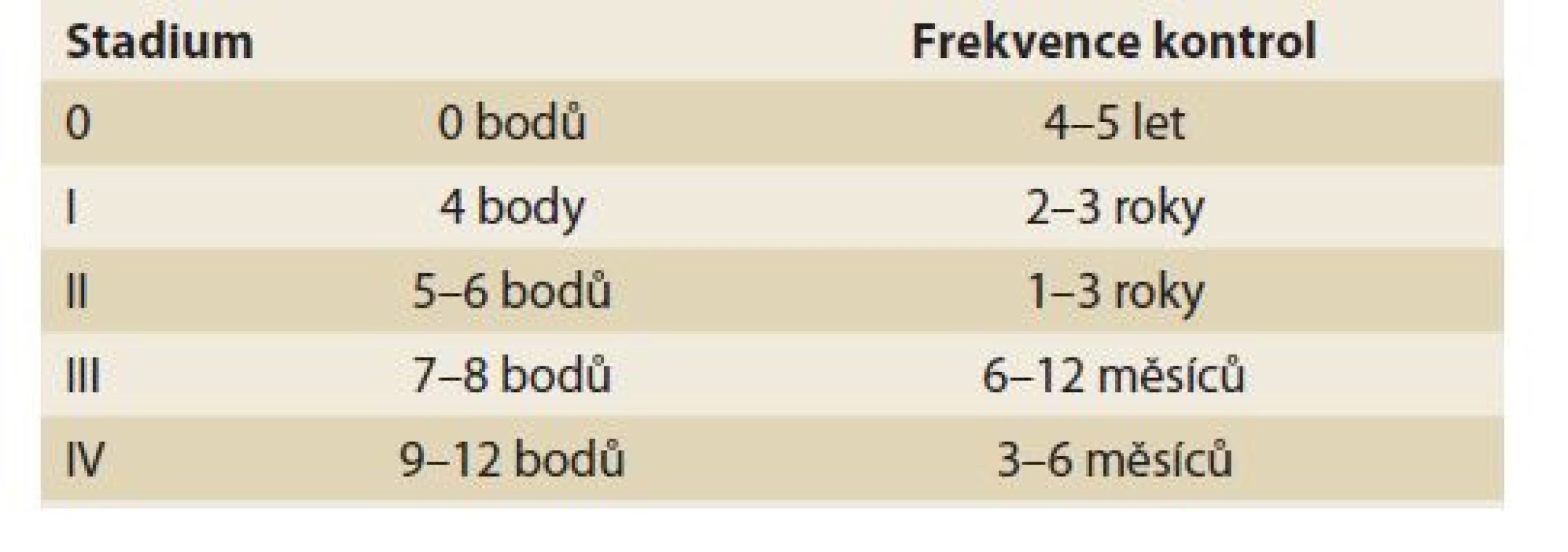
Minimální standardní terminologie (MST) pro gastrointestinální endoskopii nás vybavuje základními termíny pro popis endoskopických nálezů. U zrodu standardizace terminologie stál prof. Zdeněk Mařatka a tato standardizace nabývá na významu především s rostoucím využitím elektronického strukturovaného zápisu endoskopických nálezů [52]. Význam níže uvedených klasifikací je různý v závislosti na četnosti příslušných onemocnění, ale i míry dopadu do dia gnostiky a terapie nemocných.
Forrestova klasifikace [53] rozděluje krvácející peptické vředy v horní části trávicí trubice (tab. 2). Jednotlivé klasifikační skupiny se významně liší v rizicích pokračujícího a recidivujícího krvácení i v mortalitě. Z klasifikace se odvíjí doporučení endoskopického přístupu k jednotlivým lézím – vysokorizikové (Ia, Ib, IIa) jsou doporučeny k endoskopickému ošetření, v případě adherujícího koagula (IIb) je doporučeno zvážit jeho odstranění a dále postupovat dle nálezu na spodině. Nízkorizikové situace (IIc a III) endoskopickou terapii nevyžadují [54]. Shoda mezi endoskopisty je vysoká u aktivního krvácení, nižší je u hodnocení stigmat, především pak při nálezu viditelné cévy [55–57].
Pařížská klasifikace [58,59] je určena ke klasifikaci patologických lézí dle jejich tvaru. Rozděluje vlastně typ 0, který Japonská klasifikace nádorů žaludku (JGCA – Japanese Gastric Cancer Association) přičlenila k původní Borrmannově klasifikaci pokročilých nádorů žaludku (typy 1–5) s cílem odlišit povrchové neoplastické léze. Dnes je tato klasifikace využívána u neoplazií v celé trávicí trubici (obr. 2), kde tvar léze spoluurčuje pravděpodobnost submukózní invaze a její hloubky, a hraje tedy významnou roli v indikaci endoskopické terapie. Shoda mezi endoskopisty je při hodnocení povrchových neoplastických lézí žaludku dobrá, horší pro typy IIc a III – u kterých ji lze zlepšit přídatnými technikami chromodia gnostiky nebo elektronické modifikace obrazu, např. NBI (narrow band imaging) [60].
Pro klasifikaci endoskopických projevů refluxní choroby jícnu jsou většinou užívány dvě klasifikace. Losangeleská klasifikace (tab. 3) zavedená v roce 1996 klasifikuje rozsah postižení jícnu refluxní ezofagitidou a je podložena daty o dobré shodě popisu a gradingu mezi endoskopisty pokročilými i začínajícími [61,62]. I díky této klasifikaci považujeme za endoskopický korelát refluxní ezofagitidy porušení slizniční integrity (mucosal breaks) – eroze a nikoli nálezy „edému“ nebo „iritace“ v oblasti gastroezofageální junkce. Dia gnostiku refluxní ezofagitidy je možné zpřesnit použitím elektronické úpravy obrazu (např. NBI) [63].
Starší klasifikace Savaryho-Millera byla publikovaná švýcarskými autory již v 80. letech. Je dnes méně používaná, ale postihuje širší spektrum komplikací refluxní choroby jícnu, jako jsou vřed, stenóza a Barrettův jícen (tab. 4), není však k dispozici její formální validace.
Pražská klasifikace C&M (tab. 5, obr. 3) je používána k přesnému popisu rozsahu Barrettova jícnu [64]. Systém byl validován nejen pro skupinu endoskopistů expertních [64,65], ale i začínajících a pracujících v terénní praxi [66]. Zásadní pro popis Barrettova jícnu je lokalizace gastroezofageální junkce, která je nejlépe definována proximálním okrajem žaludečních řas [67]. Dalšími možnými anatomickými strukturami určujícími polohu gastroezofageální junkce jsou cirkulární kruh či imprese těsně orálně od proximálního okraje žaludečních řas, které odpovídají aborálnímu okraji dolního jícnového svěrače (varianta v originální C&M klasifikaci), a distální okraj longitudinálních palisádovitých submukózních cév v jícnu. Délka axiální hiátové hernie je stanovena jako vzdálenost mezi impresí bránice a proximálním okrajem žaludečních řas. Délka axiální hiátové hernie se v průběhu vyšetření mění a nejspolehlivější hodnota je změřena na počátku vyšetření před výraznější insuflací žaludku.
Doporučení zaměřená na dia gnostiku a terapii portální hypertenze používají třístupňovou klasifikaci jícnových varixů na malé, střední a velké (tzv. Baveno klasifikace jícnových varixů) [68]. Přesné definice kategorií ale v těchto doporučeních chybějí. Pro rozhodování o léčbě mají význam jen dvě kategorie: varixy malé a varixy střední až velké. Většina autorů včetně Světové gastroenterologické organizace [69] užívá tyto definice kategorií (tab. 6).
Velikost varixů spoluurčuje riziko krvácení: za vysokorizikové jsou považovány střední a velké varixy, ale také malé varixy s červenými znameními a při pokročilé jaterní cirhóze (Child Pugh C) – ty jsou pak indikovány k primární profylaxi.
Sarinova klasifikace gastrických varixů rozlišuje varixy gastroezofageální (GOV) a izolované gastrické (IGV). Gastrické varixy se objevují jen asi u 20 % pacientů s jaterní cirhózou, nejčastěji ve formě GOV1, nejvyšší riziko krvácení však nesou varixy ve fundu typu IGV1 (78 %) a GOV2 (55 %) [70] (tab. 7).
EREFS klasifikace hodnotí přítomnost a tíži hlavních endoskopických znaků eozinofilní ezofagitidy: edém, prstence, exsudát, rýhy a strikturu [71] (tab. 8).
Nutno zdůraznit, že endoskopický obraz není kritériem dia gnózy, nicméně systém se zdá užitečný pro identifikaci nemocných s eozinofilní ezofagitidou [72]. Byla prokázána uspokojivá shoda mezi endoskopisty začínajícími, praktickými i akademickými [71,73]. Nicméně tíže endoskopického nálezu nemusí korelovat s histologickou ani klinickou aktivitou onemocnění. Zvýšený počet eozinofilů je obvykle prokazován v oblastech s přítomností exsudátu [74]. Proto je také vhodné biopsie preferenčně odebírat v oblastech s endoskopickými známkami onemocnění, a to především exsudátu a rýh (furrows) [75]. Postižení prstenci pak koreluje se sníženou roztažností jícnu, a tedy s rizikem uváznutí sousta [76].
Zargarova klasifikace [77,78] je zaměřena na klasifikaci kaustického poranění horní části trávicí trubice, především jícnu (tab. 9). Jednotlivá stadia se významně liší v riziku komplikací, a to jak akutních (perforace), tak pozdních (stenóza). Stupeň postižení 3B je spojen s časnou mortalitou až 65 % především z důvodu perforace a mediastinitidy a pacienti často vyžadují resekci jícnu s náhradou tubulizovaným žaludkem nebo tračníkem ve druhé době. Pacienti s postižením stadia 2B a 3A vyvinou kaustickou stenózu v 70–100 % [79]. Endoskopický nález má zásadní prognostický význam a určuje další terapeutická opatření [80].
Spigelmanova klasifikace [81] a její pozdější modifikace [82] klasifikují závažnost duodenální adenomatózy u pacientů s familiární adenomatózní polypózou (tab. 10, 11). Přestože je duodenum u pacientů s FAP postiženo adenomy velmi často (95 %), je celkové životní riziko karcinomu 5 %. Toto riziko však významně narůstá s tíží postižení – u IV. stupně dosahuje až 36 % v průběhu 10 let [83]. Z tohoto důvodu se od klasifikace také odvíjejí doporučené intervaly endoskopických kontrol od 3 let u I. stupně, do maximálně 3–6 měsíců u IV. stupně.
Doporučení 8 – výstupní kontrolní seznam
Po ukončení gastroskopického vyšetření je doporučena v rámci endoskopického týmu kontrola zahrnující:
• počet bioptických vzorků, jejich správné označení a vystavení žádanky;
• typ a dávka podané analgosedace a způsob observace pacienta po výkonu;
• doporučení pro pacienta vyplývající z endoskopického nálezu, včetně případného termínu kontroly, zvláště při dispenzarizaci vysokorizikových situací.
Vytvoření a dodržování určitého bezpečnostního seznamu úkonů, které je třeba neopomenout v průběhu endoskopického vyšetření či zákroku, zvyšuje bezpečnost pacientů, zlepšuje týmovou práci, komunikaci a konzistenci péče. Při chirurgických a endoskopických procedurách implementace těchto seznamů snižuje výskyt komplikací a mortalitu [10,84]. V období od ukončení gastroskopického vyšetření do propuštění pacienta z endoskopické jednotky je třeba mimo jiné věnovat pozornost správnému zpracování odebraných bioptických vzorků, dokumentaci způsobu analgosedace a formulaci komplexního doporučení další léčby a opatření vyplývajících z vyšetření [2].
Indikace k odběru slizničních vzorků v průběhu gastroskopického vyšetření jsou velmi široké a odběr biopsie je dle recentní multicentrické studie proveden u 22–66 % gastroskopií [85]. K prevenci záměny vzorku a nesprávné interpretace výsledků následného histologického vyšetření je doporučeno během vyšetření přehledně řadit odebírané vzorky. Před odesláním vzorků na histologické vyšetření je třeba zkontrolovat počet odebraných vzorků a jejich odpovídající označení na zkumavce a vystavené žádance [2]. Tato pravidla jsou přiměřeně aplikována také na ostatní vzorky určené ke zpracování biochemickému (rychlý ureázový test), kultivačnímu, imunofenotypizačnímu apod. včetně specifikace způsobu uložení či fixace. Označení vzorků a lokalizace jejich odběru by měla být zdokumentována také ve výstupní zprávě z vyšetření, explicitně by měla být dokumentována i situace, kdy žádný vzorek odebrán nebyl.
Podání analgosedace během gastroskopie je předmětem doporučení 5. Po ukončení vyšetření je třeba zaznamenat v dokumentaci typ a dávku podané analgosedace a v kontextu celkového stavu pacienta a případného provedeného zákroku rozhodnout o způsobu observace pacienta po výkonu. Průběh, délka a případné komplikace observace by měly být dokumentovány ve zprávě z vyšetření [2].
Endoskopický nález, doporučení další léčby, postupu a plánu následných kontrol je třeba zformulovat na konci každého vyšetření a předat pacientovi srozumitelnou formou ústně a v psané podobě. Ústní poučení by měl pacientovi optimálně poskytnout lékař, který vyšetření prováděl, na vhodném místě a po odeznění analgosedace, pokud byla podána. Výstupní doporučení by mělo obsahovat postup, jak se dozvědět výsledek histologického vyšetření, byla-li provedena biopsie [2].
Doporučení specifická dle postižení
Doporučení 9 – prekancerózní léze v žaludku (chronická atrofická gastritida a/ nebo intestinální metaplazie)
Gastroskopie indikovaná ke sledování chronické atrofické gastritidy a/ nebo intestinální metaplazie by měla trvat nejméně 7 minut od zavedení po vytažení přístroje. Při endoskopických známkách atrofické gastritidy/ intestinální metaplazie a při gastroskopii indikované ke sledování těchto stavů jsou indikovány alespoň dvě biopsie z antra, dvě biopsie z těla a jedna biopsie z angulární řasy, diagnostika Helicobacter pylori a jeho eradikace v případě pozitivity.
Adenokarcinom žaludku stále představuje v celosvětovém měřítku významný problém, neboť zůstává pátou nejčastěji diagnostikovanou malignitou s druhou nejvyšší letalitou [86]. Vzniku intestinálního typu adenokarcinomu žaludku předchází sekvence chronický zánět–atrofie–intestinální metaplazie–dysplazie [87]. Správná endoskopická diagnostika chronické atrofické gastritidy a intestinální metaplazie jakožto prekancerózních stavů žaludku je tedy zásadní. K jejich diagnostice slouží pečlivá endoskopie horní části trávicího traktu při použití kvalitní, vysokorozlišovací endoskopie s chromoendoskopií [1]. Přínos virtuální chromoendoskopie pomocí NBI byl dobře dokumentován pro detekci intestinální metaplazie [88], vhodná je kombinace se zvětšením (near focus). Asijský konsenzus ohledně standardů pro diagnostickou horní endoskopii sloužící k záchytu neoplazií doporučuje používat mukolytika a/ nebo přípravky snižující přítomnost bublin [89]. Délka horní endoskopie by měla být > 7 minut, neboť bylo prokázáno, že endoskopie trvající > 7 minut byly spojeny s vyšší detekcí rizikových lézí v žaludku [14].
K diagnostice chronické atrofické gastritidy a/ nebo intestinální metaplazie doporučujeme odebrat dvě biopsie z antra (velká a malá kurvatura), dvě biopsie z těla žaludku (velká a malá kurvatura) a biopsie z angulární řasy do jednotlivých, řádně označených zkumavek. V biopsiích má být vyšetřena přítomnost Helicobacter pylori. V případě suspektní léze má být bioptována cíleně [18]. Odběr biopsie z angulární řasy výrazněji nezvýší záchyt intestinální metaplazie ve srovnání s biopsiemi z antra a těla žaludku [90], avšak může pomoci identifikovat závažnější atrofické, metaplastické a zánětlivé změny [91,92].
V případě identifikace mírné nebo středně závažné atrofie pouze v antru žaludku není takového nemocného nutné sledovat. V případě přítomnosti intestinální metaplazie v jedné lokalizaci má být nemocný pozván k další endoskopii za tři roky v případě, že jde o nekompletní intestinální metaplazii a/ nebo má nemocný rodinnou anamnézu karcinomu žaludku a/ nebo je přítomna chronická infekce Helicobacter pylori (předchozí eradikace nebyla úspěšná). Jde-li o pokročilou atrofickou gastritidu nebo přítomnost intestinální metaplazie v obou lokalizacích (antru i těle žaludku), má pacient podstoupit další horní endoskopii v intervalu tří let [18,93].
Interval kontrolní horní endoskopie v případě nálezu atrofie a/ nebo intestinální metaplazie tedy závisí kromě jejich rozsahu také na závažnosti atrofie, typu intestinální metaplazie (in/ kompletní), rodinné anamnéze karcinomu žaludku, perzistenci infekce H. pylori a autoimunitní etiologii.
Je-li přítomna v histologii dysplazie a při endoskopii nebyla popsána viditelná léze, má neprodleně následovat kvalitní vysokorozlišovací horní endoskopie s chromoendoskopií [94]. Pokud ani tato endoskopie neprokáže přítomnost viditelné léze, následuje v případě záchytu vysokého stupně dysplazie gastroskopie za 6 měsíců a v případě nízkého stupně dysplazie do 12 měsíců [18]. Pacient má v případě nálezu viditelné léze s nízkým nebo vysokým stupněm dysplazie podstoupit endoskopickou léčbu, v případě karcinomu staging a adekvátní léčbu [18,95]. V případě autoimunitní gastritidy navrhujeme provádět kontrolní gastroskopii každých 5 let – shrnutí doporučení viz apendix 2. Z lézí potenciálně endoskopicky resekovatelných bychom měli odebírat maximálně 1–2 bioptické vzorky [96]. Eradikace Helicobacter pylori jakožto karcinogenu 1. třídy je v případě nálezu chronické atrofické gastritidy, intestinální metaplazie a neoplazie indikována vždy [2,97].
Doporučení 10 – Barrettův jícen
Inspekce jícnu při endoskopii indikované ke sledování Barrettova jícnu by měla trvat nejméně 1 min/ cm délky segmentu a je vhodná chromoendoskopie kyselinou octovou. Při horní endoskopii indikované k dispenzarizaci Barrettova jícnu by měly být biopsie odebírány dle Seattleského protokolu (4 vzorky každé 1–2 cm délky postižení navíc k biopsiím ze všech viditelných lézí).
Barrettův jícen (BJ) je prekanceróza, proto všichni pacienti s BJ mají být endoskopicky sledováni. Cílem tohoto sledování je včasný záchyt dysplazie (low - -grade – LGD, nebo high-grade – HGD) nebo časného karcinomu, které jsou léčitelné endoskopicky. Riziko vzniku karcinomu je malé u nedysplastického BJ (0,2 % ročně) a roste u LGD a HGD [98]. BJ musí být endoskopicky viditelný a minimální délka metaplastického segmentu je 1 cm. V případě kratšího segmentu či ostrůvků hovoříme o nepravidelné Z-linii a tento nález většinou nevyžaduje dispenzarizaci a rutinní biopsie [99]. Naopak u všech pacientů s BJ jsou biopsie indikovány podle Seattleského protokolu, tj. čtyřkvadrantové biopsie každé 1–2 cm (1 cm v případě předchozí dysplazie, 2 cm u nedysplastického BJ), nejlépe do separátních kontejnerů [100]. Při délce BJ 10 cm je tedy nezbytné odebrat alespoň 20 biopsií, z každé etáže do separátního kontejneru. Bylo prokázáno, že při dodržování tohoto protokolu se zvyšuje záchyt dysplazie [101]. Bohužel jen část endoskopujících dodržuje doporučený protokol, u BJ > 9 cm jen 10 % lékařů [101]. Mezi důvody (a jejich řešení), proč nelze odebrat doporučený počet biopsií, patří:
• krvácení zhoršující přehled – sliznici jícnu lze infiltrovat pomocí sprejové kanyly roztokem adrenalinu 10–20 ml 1 : 10 000, zmenší se tak krvácení po biopsii [102];
• neklid pacienta – vhodné je užít analgosedaci;
• nedostatek času v programu – zvl. při nečekaném prvním nálezu BJ u daného pacienta je lépe naplánovat řádné vyšetření s dostatkem času na jiný termín. Pro pacienty s BJ, zvláště pak s dlouhým segmentem, je v programu vhodné rezervovat až 45 minut/ vyšetření, jinak nemohou být splněna kritéria kvality;
• lékař se rozhodne indikovat endoskopickou resekci/ disekci viditelné léze bez odběru biopsií – jde o možný postup, nejedná se o chybu.
K odběru biopsií je možné používat kleští o větším objemu (large capacity), jejich použití poskytuje větší, a tím i adekvátnější vzorky k histopatologické analýze [103].
Před odběrem bioptických vzorků je vhodné důkladné prohlížení segmentu BJ (1 min/ 1 cm délky) [19] a použití oplachů. V ČR lze doporučit rutinní použití chromodiagnostiky kyselinou octovou (1–2 %; v praxi ředíme potravinářský ocet 3 díly, 7 dílů fyziologického roztoku), aplikujeme 10–30 ml dle délky segmentu. Po aplikaci čekáme 1–2 minuty a snažíme se detekovat místa, kde dochází k rychlému odbarvení bělavého zbarvení sliznice jícnu – ta pak cíleně bioptujeme, neboť rychlejší odbarvení koreluje s rizikem dysplazie [104]. I další metody mohou zvýšit záchyt dysplazie/ lézí jako např. metody elektronické modifi kace obrazu (např. NBI). Na počátku používání je využití umělé inteligence k detekci a charakterizaci lézí v terénu BJ. Z lézí potenciálně endoskopicky resekovatelných bychom měli odebírat maximálně 1–2 bioptické vzorky [96].
Na základě přítomnosti/ absence a stupně dysplazie je pak dále určen interval další endoskopické kontroly, pacienti bez dysplazie jsou sledováni každých 3–5 let, pacienti s LGD se sledují intenzivně každých 6 měsíců nebo jsou indikováni k endoskopické léčbě, pacienti s HGD jsou indikováni k endoskopické léčbě. Konec dispenzarizace je záležitostí individuální a záleží na biologickém věku pacienta a dalších faktorech.
Při primozáchytu BJ je druhá endoskopie s rebiopsiemi podle většiny doporučených postupů včetně českých indikována za 6 měsíců. Jednoznačně je indikována, pokud první endoskopie nebyla provedena za ideálních podmínek (např. ezofagitida, nekompletní odběr biopsií, použití méně kvalitního endoskopu apod.).
Každý pacient s BJ by měl být dlouhodobě léčen inhibitory protonové pumpy, které prokazatelně snižují riziko vzniku karcinomu. Toto doporučení platí i pro asymptomatické pacienty.
Léčba lézí v BJ by měla probíhat v centru, které se této problematice věnuje [99]. Není vhodné provádět endoskopickou resekci/ disekci mimo velkoobjemová centra, která mají k dispozici radiofrekvenční ablaci nebo kryoablaci, specializovaného patologa a přímou vazbu na jícnového chirurga a onkologa zabývajícího se touto problematikou.
V poslední době se objevuje snaha o nalezení parametrů kvality endoskopického vyšetření u pacientů s BJ. Jednoznačně se jedná o čas vyšetření a dodržování bioptického protokolu. Mezi další kritérium může v budoucnu patřit tzv. neoplasia detection rate, což je analogický parametr jako v případě koloskopie „adenoma detection rate“. Podle metaanalýzy je cílová hodnota tohoto parametru 4 % (tj. ze 100 vyšetřených pacientů s BJ by 4 % měly mít detekovánu LGD, HGD nebo karcinom) [105].
Doporučení 11 – zvýšené riziko spinocelulárního karcinomu
U pacientů ve zvýšeném riziku spinocelulární neoplazie jícnu a s podezřením na ni je indikována chromoendoskopie s použitím Lugolova roztoku. V individuálních případech lze provést chromoendoskopii NBI.
U nemocných ve zvýšeném riziku spinocelulární neoplazie jícnu nebo s podezřením na ni při běžné endoskopii doporučují evropské autority chromoendoskopii Lugolovým roztokem [1,2]. Jedná se o nemocné s nádory hlavy a krku a nemocné bronchogenním karcinomem, kteří podstupují horní endoskopii a byli nebo jsou léčeni s kurativním záměrem a jejich očekávané přežití je delší než 2 roky [1]. U nemocných s nádory hlavy a krku je spinocelulární neoplazie detekována až v 10 % případů v závislosti na geografii a lokalizaci primárního tumoru a většina invazivních karcinomů vzniká metachronně [106–113]. Pokročilý spinocelulární karcinom má výrazně negativní vliv na další prognózu těchto nemocných [114,115], a cílem je proto detekce dysplazie a časného karcinomu. Mezi vzácnější prekancerózy spinocelulárního karcinomu jícnu také patří achalázie, stav po kaustickém poranění jícnu, tylóza a stav po radioterapii pro karcinom prsu [116]. Chromodiagnostika Lugolovým roztokem vykazuje vysokou senzitivitu (91–100 %) v diagnostice těžké dysplazie a karcinomu jícnu [106,110,117–119], při lehké dysplazii se senzitivita zdá být nižší [120]. Lugolův roztok je aplikován sprejovou kanylou v množství 10–20 ml a po dosažení tmavě hnědého zbarvení sliznice jsou vyhledávány bledé (tzv. lugol-negativní okrsky). Vzhledem k přechodnému efektu je někdy nutné aplikaci Lugolova roztoku opakovat. Je doporučeno při vyšetření vyčkat 1–2 minuty k detekci tzv. pink color znamení [1,121], které je asociováno s přítomností těžké dysplazie a karcinomu [122]. Ložiska podezřelá z přítomnosti neoplazie by měla být bioptována. Lugolův roztok je doporučeno používat v ředění 1–2 %. Koncentrace 1% je ve srovnání s 2% koncentrací asociována s menším postprocedurálním diskomfortem při zachování diagnostické výtěžnosti [123].
Virtuální chromoendoskopie pomocí módu NBI se zdá být dostatečně účinná v detekci spinocelulární neoplazie jícnu a ve srovnání s Lugolovým roztokem přesnější v odlišení slizničních změn jiné etiologie [124], trvá významně kratší dobu [125], není spojena s postprocedurálním diskomfortem [123] a umožňuje i vyšetření hypofaryngu [126]. Retrospektivní studie [127] neshledala přínos v použití Lugolova roztoku v porovnání s NBI v dosažení kompletní resekce spinocelulární jícnové neoplazie. Recentní prospektivní randomizovaná studie [128] prokázala vyšší specificitu NBI v porovnání s Lugolovým roztokem v kohortě rizikových pacientů s karcinomem horního aerodigestivního traktu ve všech typech endoskopických pracovišť od univerzitních po ambulantní; autoři však nadále doporučují kombinovaný přístup. Tato data činí z virtuální chromoendoskopie NBI racionální doplněk chromoendoskopie Lugolovým roztokem nebo alternativu v případě alergie na jód, zvýšeného rizika aspirace a nemožnosti delšího vyšetření.
Doporučení 12 – eozinofilní ezofagitida
U pacientů s dysfagií či obstrukcí soustem bez jasné příčiny jsou indikovány biopsie z nejméně dvou odlišných míst jícnu (preferenčně z patologií sliznice, v celkovém počtu nejméně šest vzorků) k vyloučení eozinofilní ezofagitidy.
Dysfagie a váznutí sousta jsou nejčastějším projevem eozinofilní ezofagitidy u dospělých [129]. Eozinofilní ezofagitida je imunitně podmíněný zánět jícnu. Jedná se o chronické progresivní onemocnění provázené postupnou remodelací jícnu. Diagnostika nemoci se opírá o příznaky dysfunkce jícnu, histologický nález 15 a více eozinofilů/ high power field (HPF) v biopsii z jícnu a vyloučení dalších příčin jícnové eozinofilie [130]. Endoskopické známky postižení jícnu jsou přítomny u 93 % pacientů s eozinofilní ezofagitidou, i když samy o sobě přesně nevypovídají o aktivitě nemoci a efekt léčby nelze hodnotit pouze z endoskopického obrazu bez odběru histologie [71]. Endoskopický nález je vhodné popisovat pomocí klasifikace EREFS, která hodnotí přítomnost a tíži otoku, prstenců, exsudátů, rýhování a striktur – Edema (0, 1) Rings (0, 1, 2, 3) Exudates (0, 1, 2) Furrows (0, 1) Stricture (0,1) [71]. K diagnostice je klíčový nález 15 a více eozinofilů/ HPF (60 eozinofilů/ mm²) v jícnové biopsii ve standardním barvení pomocí hematoxylin-eozinu. Je doporučeno odebírat minimálně šest biopsií z různých míst proximální i distálního jícnu [96,131], přičemž nejvýtěžnější jsou biopsie z distálního jícnu. Biopsie by měly být odebírány preferenčně z patologických míst, zejména z podélných rýh a exsudátů, kde byla prokázána největší denzita eozinofilů [75]. Kromě dietní a medikamentózní léčby se v léčbě eozinofilní ezofagitidy v případě symptomatické stenózy uplatňuje endoskopická dilatace balonem nebo bužiemi [132]. Kontrola efektu léčby by měla následovat po 8–12 týdnech léčby pomocí endoskopie s odběrem biopsií [130].
Doporučení 13 – sideropenická anemie
Při gastroskopii u pacientů se sideropenickou anemií bez zjevné příčiny je vhodné provedení biopsií z antra i těla žaludku a z duodena, pokud nebyla dříve vyloučena celiakie.
Sideropenická anemie je jednou z rutinních indikací k provedení gastroskopie. Refl uxní nemoc jícnu, vředová choroba gastroduodenální, angiodysplazie a tumory patří mezi makroskopicky zjistitelné příčiny sideropenie v horní části trávicího traktu. Atrofická gastritida (AG) a celiakie náleží mezi příčiny sideropenie, jejichž přítomnost je třeba vždy ověřit bioptickým vyšetřením [133]. Incidence AG u pacientů se sideropenickou anemií je cca 10 % [134]. K detekci AG při gastroskopickém vyšetření z důvodu sideropenie je doporučeno odebrat alespoň dva vzorky z antra a dva vzorky z těla žaludku, a vyhnout se tak zbytečnému opakování vyšetření v budoucnu [18]. Odběr pátého bioptického vzorku z malé kurvatury žaludku (upravený Sydneyský protokol) [135] zlepšuje přesnost stagingu AG a následné dispenzarizace při pozitivním záchytu AG – viz doporučení 9. Proto provedení biopsie z malé kurvatury žaludku lze zvážit, zvláště jsou-li při vyšetření makroskopické známky atrofie žaludeční sliznice [91,136]. Americká doporučení z roku 2020 [137] rutinní provádění biopsií k detekci AG nedoporučují s velmi nízkou kvalitou důkazů. Doporučení zdůvodňují nepřítomností specifické terapie autoimunní i atrofické helicobacterové gastritidy a dosud jasně nedefinovaným onkologickým rizikem. Autoři tohoto článku se přiklánějí k výše citovaným evropským doporučením provádět odběr biopsií ke zjištění AG z několika důvodů:
1. znalost přítomnosti AG i přítomnosti metaplasie či dysplazie může vést k selekci onkologicky rizikových jedinců a jejich dispenzarizaci;
2. vysvětlení příčiny sideropenické anemie může předejít indikaci složitějších vyšetření v budoucnu;
3. bioptické vyšetření je nejpřesnější v detekci H. pylori a může vést k správné indikaci eradikační léčby.
Celiakie je diagnostikována u 4,8 % pacientů se sideropenickou anemií [138]. V případě pozitivních celiakálních protilátek je indikováno provedení biopsií z duodena – viz doporučení 14. Pokud výsledek protilátkových testů není při gastroskopii indikované pro anemii k dispozici, je vhodnější biopsii odebrat, zvláště pokud se jedná o rizikovou skupinu pacientů (autoimunitní choroba v osobní anamnéze, příbuzný s diagnostikovanou celiakií aj.), a zabránit tak případnému opakování vyšetření v budoucnu [139]. Biopsie z duodena je také vhodné odebrat, pokud sliznice duodena vypadá abnormálně [140].
Doporučení 14 – celiakie
Při podezření na celiakii je nutné odebrat biopsie z nejméně čryř míst sestupného duodena a nejméně dvou vzorků z bulbu duodena; při dietě obsahující lepek.
Celiakie je autoimunní choroba charakterizována glutenem spouštěnou zánětlivou reakcí vedoucí k poškození vilózní architektury sliznice tenkého střeva. Typický endoskopický obraz celiakie zahrnuje atrofický vzhled sliznice duodena, oploštění, redukci řasení, drobné nodularity a políčkovaný rozbrázděný povrch sliznice. Endoskopicky normální vzhled duodena přítomnost choroby nevylučuje [141], proto je při podezření nutné bioptické vyšetření. Vzhledem k možné nepravidelné distribuci změn je doporučen odběr alespoň šesti vzorků z různých oblastí duodena včetně sestupné části a bulbu duodena [96,142–145]. K diagnostickému průkazu celiakie z biopsie je nezbytná předchozí konzumace nejméně 10 g lepku alespoň jednou denně po dobu nejméně 6 týdnů [146,147]. Odběr biopsie kleštěmi vždy jen po jednom vzorku zlepšuje orientaci biopsie a hodnocení slizniční architektury [148]. Standardizace uložení a transportu vzorků ve spolupráci s histopatologem může usnadnit přesnost hodnocení a omezit nejisté nálezy [149,150].
Doporučení 15 – vředy a stenózy jícnu, žaludku a dvanáctníku
Vředy jícnu a žaludku by měly být vždy bioptovány a endoskopicky kontrolovány po 6 týdnech adekvátní terapie, biopsie a endoskopická kontrola vředů bulbu duodena není nutná. Při nálezu vředů žaludku a/ nebo dvanáctníku je nutné stanovení Helicobacter pylori a eradikace při pozitivitě. Stenóza v horní části trávicí trubice neurčené etiologie suspektní z malignity by měla být bioptována.
Eroze a vřed jsou definovány jako zjevná porušení integrity sliznice. Eroze postihuje pouze sliznici, vřed zasahuje do submukózy (precizní rozlišení je možné výhradně histologicky).
Vřed jícnu musí být v době diagnózy řádně popsán včetně lokalizace a velikosti a vždy bioptován [2], při podezření na pokročilý karcinom jícnu by mělo být odebráno nejméně šest vzorků [96], stejně tak při podezření na virovou ezofagitidu [96], a to z okraje i spodiny. Hojení jícnového vředu by mělo být ověřeno za 6 týdnů terapie (většinou vysokou dávkou inhibitoru protonové pumpy) [2].
Refluxní ezofagitida je při gastroskopii častým nálezem (11 %). Změny při refluxní ezofagitidě mohou překrýt přítomnost Barrettova jícnu až ve 12 %. Toto riziko je však výrazně vyšší u těžké refluxní ezofagitidy (stupeň C a především D dle Losangeleské klasifikace), u které je proto také indikována biopsie a endoskopická kontrola po 6 týdnech řádné terapie inhibitorem protonové pumpy [2]. Častější lehká forma refluxní ezofagitidy (stupeň A a B dle Losangeleské klasifikace) není indikována k biopsii ani rutinním endoskopickým kontrolám [23].
Vřed žaludku musí být v době diagnózy řádně popsán včetně lokalizace a velikosti a bioptován [2,151]. Existují endoskopické známky maligní povahy ulcerace: vyvýšený a nepravidelný okraj, velikost > 3 cm, „špinavá“ spodina a lokalizace v kardii a těle [152]. V případě podezření na pokročilý karcinom žaludku je indikován odběr nejméně šesti vzorků [96] z okrajů i spodiny, současně s diagnostikou infekce H. pylori (viz níže). Hojení by mělo být vždy ověřeno kontrolní gastroskopií po 6 týdnech řádné terapie (nejčastěji inhibitorem protonové pumpy, eradikací infekce H. pylori v případě jejího průkazu, eliminací nesteroidních antiflogistik).
Vřed bulbu duodena je častým gastroskopickým nálezem (2–13 %) a častou příčinou krvácení do gastrointestinálního traktu. Vřed bulbu duodena je v naprosté většině případů peptické etiologie, nenese žádné riziko malignity a není indikována jeho biopsie [96,153] ani endoskopická kontrola a sledování, pokud se pacient zlepší po standardní terapii (inhibitor protonové pumpy, eradikace H. pylori a eliminace nesteroidních antirevmatik) [23]. Endoskopická kontrola je indikována u pacientů s přetrvávajícími příznaky, jejichž příčinou může být refrakterní peptický vřed. Vředy v postbulbárním úseku duodena (zvláště izolované) jsou méně obvyklé a vždy budí podezření na jinou než peptickou etiologii (např. Crohnova choroba) a ani malignitu v této oblasti nelze zcela vyloučit, proto doporučujeme v tomto případě postupovat individuálně.
Vřed žaludku a duodena je jednoznačnou indikací pro testování H. pylori. Při negativitě vstupního fokálního testu (nejčastěji rychlý ureázový test; alternativně histologický průkaz) doporučujeme posouzení ještě ně kte rou z globálních metod (dechový test s 13C-ureou nebo antigen H. pylori ve stolici). Při průkazu H. pylori je jednoznačně indikována jeho eradikace, stejně jako v případě peptické erozivní bulbitidy (výčet ostatních indikací přesahuje zaměření tohoto textu stejně jako typy eradikačních schémat). Efekt eradikace by měl být ověřen globálním nebo fokálním testem. Odběr sliznice na kultivaci H. pylori a stanovení citlivosti je po prvním selhání eradikační terapie vhodné, po druhém nutné.
Stenóza v horní části trávicí trubice neurčené etiologie suspektní z malignity by měla být bioptována. Vzhledem k (malému) riziku rozsevu malignity v případě perforace komplikující dilataci maligní stenózy [2,154] by měl endoskopista vyvinout maximální úsilí o histologickou diagnostiku před dilatací [2]. V případě jícnové stenózy neprostupné pro standardní gastroskop je možno použít ultratenkého přístroje (např. nazogastroskop) [96]. S počtem biopsií stoupá jejich výtěžnost, doporučujeme nejméně šest biopsií [96].
Postprocedurální doporučení
Doporučení 16 – karcinom horní části trávicí trubice po negativní gastroskopii (POUGIC)
Endoskopické pracoviště by mělo sledovat výskyt karcinomu jícnu a žaludku u pacientů, kteří v posledních 3 letech podstoupili gastroskopické vyšetření, jenž toto onemocnění neprokázalo (POUGIC – post oesophago-gastro-duodenoscopy upper gastrointestinal cancer). Počet těchto případů ze všech případů karcinomů horní části trávicí trubice by neměl na pracovišti přesáhnout 10 %.
Karcinom horní části trávicí trubice po negativní gastroskopii (POUGIC) můžeme definovat jako karcinom jícnu a žaludku, který se vyskytne do 3 let po provedené gastroskopii s negativním nálezem [2,155]. POUGIC může představovat selhání předchozí endoskopické diagnostiky. Yalamarti et al ve své retrospektivní studii zjistili, že 73 % POUGIC bylo způsobeno chybou endoskopisty a 27 % chybou patologa hodnotícího bioptované vzorky [156]. Řada retrospektivních studií prokázala, že míra POUGIC se pohybuje od 4,6 do 14,4 % [156–161]. Ně kte ré studie ukázaly, že je POUGIC asociován s chybějícími symptomy onemocnění, s mladším věkem, nedostatečným odběrem biopsií, gastroskopií v primární péči, mnohočetnými komorbiditami a ženským pohlavím [156–158,162]. Jiné studie naopak ukazují, že je častější u mužského pohlaví a ve vyšším věku [156,163,164]. Většina evropských doporučení se pak shoduje, že by endoskopická pracoviště měla sledovat výskyt těch případů karcinomu jícnu a žaludku, u nichž předcházelo v posledních 3 letech gastroskopické vyšetření, které tuto nemoc neprokázalo. Podíl POUGIC ze všech zjištěních karcinomů by pak neměl přesáhnout 10 % a měly by být analyzovány příčiny, které vedly k jednotlivým případům [2,17].
Při praktickém sledování frekvence POUGIC můžeme vycházet z faktu, že každý nádor horní části trávicí trubice je nakonec diagnostikován endoskopicky (výjimky jsou možné, ale málo pravděpodobné). V čase diagnózy endoskopista aktivně zjišťuje anamnézou přímou (od pacienta) i nepřímou (z informačního systému), zda byla u pacienta provedena gastroskopie v posledních 3 letech a s jakým výsledkem. Pokud předchozí gastroskopie nádor nezjistila, jedná se o POUGIC (missed cancer). V případě, že se jednalo o výkon na stejném pracovišti, bude POUGIC registrován na tomto pracovišti. V případě, že byl předchozí výkon proveden jinde, je poskytnuta zpětná vazba vedoucímu tohoto pracoviště.
Doporučení 17 – komplikace gastroskopie
Každé endoskopické pracoviště by mělo sledovat, dokumentovat a analyzovat bezprostřední i pozdní komplikace u všech, tj. diagnostických i terapeutických gastroskopií. Tyto komplikace by měly být klasifikovány podle validované klasifikace na mírné, středně závažné, závažné a fatální. V případě nadměrného (nad míru očekávání) výskytu/ tíže komplikací by mělo každé pracoviště analyzovat příčiny a navrhnout opatření k nápravě.
Komplikace jsou součástí veškeré lékařské činnosti, obecným cílem je jim předcházet (tím, že pracujeme podle určitých pravidel, vyšetření provádíme jen u indikovaných pacientů atd.) a v případě jejich výskytu je časně detekujeme (např. perforaci) a adekvátně reagujeme. Na komplikace, časté nebo i jen teoretické, musíme pacienty upozornit, a to nejen tím, že jim dáme přečíst a podepsat informovaný souhlas, ale že s nimi tuto záležitost podrobně probereme před vyšetřením.
Jako komplikaci definujeme událost, která zabraňuje provedení/ dokončení procedury nebo vede k neplánované hospitalizaci nebo prodloužení hospitalizace stávající, potřebě další zdravotní péče (operace, lékařské konzilium) nebo úmrtí [165].
Za komplikaci tudíž v tomto smyslu nepovažujeme akutní krvácení po polypektomii, kterou se podařilo zastavit klipem a nevedla k hospitalizaci nebo jejímu prodloužení. Pokud však takové krvácení vyústí v neplánovanou hospitalizaci, pak se již o komplikaci jedná. Nicméně i „drobné příhody“ krvácení, které bylo intraprocedurálně úspěšně ošetřeno, bychom měli zaznamenat.
Komplikace by měly být klasifikovány podle validované klasifikace (např. ASGE lexicon) [165] na mírné, středně závažné, závažné a fatální.
Při diagnostické gastroskopii je výskyt závažných komplikací raritní, častěji se vyskytují komplikace při léčebných výkonech.
Obecně lze dělit komplikace na ty, které:
1. souvisejí s analgosedací/ anestezií;
2. souvisejí přímo s endoskopickým výkonem;
3. souvisejí s výkonem nepřímo, tj. podmíněné komorbiditami apod.
V případě anestezie řeší komplikaci anesteziolog, kterému bychom však vždy měli být nápomocni. V případě endoskopistou podávané analgezie je nezbytné se na desaturační a jiné příhody (aspirace, hypotenze, hypertenze, poruchy srdečního rytmu aj.) připravit. Nezbytností je možnost rychlého podání kyslíku, antidota, časného vytažení endoskopu a uložení pacienta do vhodné polohy, na vhodné lůžko a zajištění žilního přístupu. I z tohoto důvodu je vhodnější podávat premedikaci nitrožilní kanylou, která zůstává zavedena a funkční až do propuštění pacienta. V případě problémů je tak ihned přístupný žilní vstup. Samozřejmostí je schopnost personálu endoskopické jednotky (i mimonemocniční ambulantní) zahájit základní neodkladnou resuscitaci, a to jak po stránce technické, tak po stránce znalostí a dovedností. K další péči je neprodleně volán resuscitační tým (v případě nemocnice) nebo rychlá zdravotnická pomoc (v případě mimo nemocnici). Frekvence těchto komplikací by neměla přesáhnout 1 % [1].
U diagnostické gastroskopie jsou komplikace vzácné, ale možné. Jedná se o perforace (Zenkerův divertikl při neopatrném zavádění, méně často jiné perforace), desaturaci při mylném zavedení endoskopu do trachey, zaklínění endoskopu v retroflexi v kardii při neopatrném provádění tohoto manévru, poškození endoskopu pacientem při ztrátě ochranného náustku, krvácení při zavedení endoskopu a přítomnosti varixů – např. pacient kašle, a zvyšuje tak intravarikózní tlak, kdy může dojít k ruptuře atd. Frekvence těchto komplikací by neměla přesáhnout 0,5 % a jejich řešení by mělo být endoskopické ve většině případů.
Větší riziko komplikací je u terapeutických výkonů. Z tohoto důvodu by měly být tyto zákroky prováděny vyškolenými endoskopisty, v centrech s adekvátním objemem výkonů a za optimálních podmínek [1].
Mezi nejčastější komplikace bezprostřední patří:
• perforace (u dilatací, polypektomií, endoskopických slizničních resekcí, submukózních disekcí, septotomií Zenkerova divertiklu): max. výskyt do 2 %, řešení nad 90 % endoskopicky – klipy, sutura, stent [166];
• krvácení (u slizničních resekcí, submukózních disekcí, ligace varixů atd.) – až 15 %, nad 90 % řešena endoskopicky. Největší riziko krvácení je u resekce duodenálních lézí, kdy lze důrazně doporučit adaptaci spodiny (klipy);
• kapnoperitoneum a podkožní emfyzém (metody submukózní endoskopie, u 50–60 %, u části řešitelné punkcí břišní dutiny) [167];
• migrace stentu – v případě zavedení stentu dochází k jeho okamžité migraci, většinou řešitelné okamžitě endoskopicky extrakcí stentu a jeho novým zavedením [168]
Prevence okamžitých komplikací a jejich následků:
• adekvátní analgosedace/ anestezie;
• dostupnost dostatečného spektra pomůcek k hemostáze a k uzávěru perforace včetně nových metod, např. vakuové terapie (endosponge);
• provádět dilatace/ zavádění stentů pod RTG i endoskopickou kontrolou;
• adekvátně kontrolovat místo po dilataci/ resekci – spodina resekce má být důkladně ošetřena – tj. všechny viditelné cévy mají být koagulovány;
• uzávěr či redukce slizničního defektu adaptací okrajů – zvl. po resekci plochých lézí duodena – klipy nebo endoloopem, což sníží riziko krvácení;
• před ošetřením krvácení do trávicího traktu u rizikových nemocných (jaterní cirhóza s portální hypertenzí, jaterní encefalopatie, masivní krvácení s opakovanou hematemézou) individuálně zvážit přítomnost či konzultaci anesteziologa nebo intenzivisty k zajištění dýchacích cest orotracheální intubací v celkové anestezii;
• v případě zavedení stentu bez stenózy (léčba leaků apod.) je vhodné volit adekvátní průměr stentu, případně je fixovat (včetně možnosti fixace k nosu či tváři);
• k terapeutickým výkonům preferovat insuflaci CO2;
• v případě nejasností či příznaků včas informovat chirurga nebo vyšší pracoviště.
Komplikace pozdní (2 dny po zákroku–měsíce):
• pozdní krvácení (po polypektomiích apod.) – nemělo by přesáhnout 5 %;
• syndrom koagulovaného střeva s perforací – podobně jako v tračníku se s tímto syndromem lze setkat po termickém ošetření v duodenu – nejčastěji argonovou plazmakoagulací;
• rozvoj stenóz jícnu/ pyloru po extenzivních resekcích – až 100 % při cirkumferenční resekci – zvážit topické a systémové steroidy, event. preventivní stenting;
• rozvoj gastroezofageálního refluxu po perorální endoskopické myotomii (POEM) – až 50 % pacientů potřebuje dlouhodobou antisekreční léčbu;
• pneumonie – komplikace aspirace.
Infekční komplikace jsou v případě endoskopie horní části trávicí trubice málo časté až vzácné, včetně terapeutických zákroků. Je nezbytné dodržovat doporučené postupy ohledně antibio tické profylaxe u vybraných výkonů. Stejně tak je nezbytné dodržovat doporučení ohledně antikoagulační a antiagregační léčby u vybraných terapeutických zákroků [169]. Bolest jako komplikace vyžadující léčbu nebo hospitalizaci se může vyskytnout nejčastěji po zavedení stentu u těsné stenózy, dilatací nebo POEM.
Závěr
Cílem uvedených doporučení je definovat parametry kvality horní endoskopie na základě nejlepších dostupných vědeckých dokladů. Zvyšování kvality gastroskopie je směřováno k vyšší bezpečnosti i komfortu pacienta a ke zvýšení efektivity gastroskopické diagnostiky – především ve směru časné detekce neoplazií a redukce výskytu intervalových karcinomů.
Autoři si jsou dobře vědomi limitů této iniciativy.
Ve většině studovaných domén je relativní nedostatek kvalitních vědeckých důkazů, další můžeme očekávat z recentně probíhajících prospektivních studií [170].
Všechny parametry kvality jistě nemají stejný význam pro realizaci výše uvedených klinických cílů.
Existuje celá řada dalších bariér implementace parametrů kvality do široké denní endoskopické praxe, které jsou již na evropské úrovni dobře definovány [171], včetně logistických a nákladových. Cílem tohoto doporučení tedy není vymezení nepodkročitelného minima současné péče, ale popis stavu, k němuž bychom měli v dohledné době dospět cestou zajištění objektivních podmínek jeho realizace.
V návaznosti na úsilí evropských autorit (ESGE a UEG) proto považuje ČGS za nezbytné formulovat parametry kvality, ke kterým by měl směřovat vývoj gastroskopie v České republice, jakkoli si uvědomujeme, že všechny tyto parametry není možné implementovat ihned a na všech endoskopických pracovištích. Přesto chceme motivovat endoskopisty a endoskopické sestry v úsilí o zvyšování kvality a v neposlední řadě poskytnout poklady pro výchovu nové generace endoskopických odborníků. Systematické sledování parametrů kvality bude v následujících letech závislé na širokém užívání elektronického strukturovaného záznamu endoskopických vyšetření [171], což by také měla reflektovat vedení endoskopických pracovišť i managementy nemocnic. Jedině tak bude možné zajistit další vývoj v této dynamické oblasti. Překonáváním bariér se nám podaří zlepšit kvalitu gastroskopie ve prospěch našich nemocných.
Graph 1. Výsledky hlasování v druhém kole Delfské procedury. 
Doručeno/ Submitted: 8. 4. 2022
Přijato/ Accepted: 9. 4. 2022
MUDr. Jiří Cyrany, Ph.D.
II. interní gastroenterologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
Kompletní seznam použité literatury naleznete na webu časopisu www.csgh.info
Apendix 1. Farmakologický profil léčiv používaných pro analgosedaci při gastrointestinální endoskopii. Převzato z [44].
Appendix 1. Pharmacological profile of drugs used for analgosedation in gastrointestinal endoscopy [44] .![Apendix 1. Farmakologický profil léčiv používaných pro analgosedaci při gastrointestinální endoskopii.
Převzato z [44].<br>
Appendix 1. Pharmacological profile of drugs used for analgosedation in gastrointestinal endoscopy [44] .](https://pl-master.mdcdn.cz/media/image_pdf/5776a4607f44cf2057d97c6f7c69d3d3.jpg?version=1655964783)
Apendix 2. Diagnosticko-léčebný postup u pacientů s atrofickou gastritidou, intestinální metaplazií/dysplazií v žaludku. Převzato z [18].
Appendix 2. Diagnostic and treatment algorithm in patients with atrophic gastritis, intestinal metaplasia/dysplasia in the stomach [18].![Apendix 2. Diagnosticko-léčebný postup u pacientů s atrofickou gastritidou, intestinální metaplazií/dysplazií v žaludku.
Převzato z [18].<br>
Appendix 2. Diagnostic and treatment algorithm in patients with atrophic gastritis, intestinal metaplasia/dysplasia
in the stomach [18].](https://pl-master.mdcdn.cz/media/image_pdf/2aaf5fe13a0589e8fa769bbeb1b2dc6f.jpg?version=1655964806)
Sources
1. Bisschops R, Areia M, Coron E et al. Performance measures for upper gastrointestinal endoscopy: a European Society of Gastrointestinal Endoscopy (ESGE) Quality Improvement Initiative. Endoscopy 2016; 48(9): 843–864. doi: 10.1055/s-0042-113128.
2. Beg S, Ragunath K, Wyman A et al. Quality standards in upper gastrointestinal endoscopy: a position statement of the British Society of Gastroenterology (BSG) and Association of Upper Gastrointestinal Surgeons of Great Britain and Ireland (AUGIS). Gut 2017; 66(11): 1886–1899. doi: 10.1136/gutjnl-2017-314109.
3. Guyatt G, Vist G, Falck-Ytter Y et al. An emerging consensus on grading recommendations? Evid Based Med 2006; 11(1): 2–4. doi: 10.1136/ebm.11.1.2-a.
4. Committee ASoP, Early DS, Lightdale JR et al. Guidelines for sedation and anesthesia in GI endoscopy. Gastrointest Endosc 2018; 87(2): 327–337. doi: 10.1016/j.gie.2017.07.018.
5. De Silva AP, Amarasiri L, Liyanage MN et al. One-hour fast for water and six-hour fast for solids prior to endoscopy provides good endoscopic vision and results in minimum patient discomfort. J Gastroenterol Hepatol 2009; 24(6): 1095–1097. doi: 10.1111/j.1440-1746.2009.05782.x.
6. Koeppe AT, Lubini M, Bonadeo NM et al. Comfort, safety and quality of upper gastrointestinal endoscopy after 2 hours fasting: a randomized controlled trial. BMC Gastroenterol 2013; 13 : 158. doi: 10.1186/1471-230X-13-158.
7. Practice Guidelines for Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration: Application to Healthy Patients Undergoing Elective Procedures: An Updated Report by the American Society of Anesthesiologists Task Force on Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration. Anesthesiology 2017; 126(3): 376–393. doi: 10.1097/ALN.0000000000001452.
8. Vincent C, Neale G, Woloshynowych M. Adverse events in British hospitals: preliminary retrospective record review. BMJ 2001; 322(7285): 517–519. doi: 10.1136/bmj.322.7285.517.
9. Cullinane M, Gray AJG, Hargraves CMK et al. Scoping our practice. The 2004 report of the national confidential enquiry into patient outcome and death. 2022 [online]. Dostupné z: https://www.ncepod.org.uk/2004report/Full_Report_2004.pdf.
10. Matharoo M, Thomas-Gibson S, Haycock A et al. Implementation of an endoscopy safety checklist. Frontline Gastroenterol 2014; 5(4): 260–265. doi: 10.1136/flgastro-2013-100393.
11. Hale G, McNab D. Developing a ward round checklist to improve patient safety. BMJ Qual Improv Rep 2015; 4(1): u204775.w2440. doi: 10.1136/bmjquality.u204775.w2440.
12. Bitar V, Martel M, Restellini S et al. Checklist feasibility and impact in gastrointestinal endoscopy: a systematic review and narrative synthesis. Endosc Int Open 2021; 9(3): E453–E460. doi: 10.1055/a-1336-3464.
13. Gralnek IM, Bisschops R, Matharoo M et al. Guidance for the implementation of a safety checklist for gastrointestinal endoscopic procedures: European Society of Gastrointestinal Endoscopy (ESGE) and European Society of Gastroenterology and Endoscopy Nurses and Associates (ESGENA) position statement. Endoscopy 2022; 54(2): 206–210. doi: 10.1055/a-1695-3244.
14. Teh JL, Tan JR, Lau LJ et al. Longer examination time improves detection of gastric cancer during diagnostic upper gastrointestinal endoscopy. Clin Gastroenterol Hepatol 2015; 13(3): 480–487.e2. doi: 10.1016/j.cgh.2014.07.059.
15. Park JM, Huo SM, Lee HH et al. Longer observation time increases proportion of neoplasms detected by esophagogastroduodenoscopy. Gastroenterology 2017; 153(2): 460–469.e1. doi: 10.1053/j.gastro.2017.05.009.
16. Yoshimizu S, Hirasawa T, Horiuchi Y et al. Differences in upper gastrointestinal neoplasm detection rates based on inspection time and esophagogastroduodenoscopy training. Endosc Int Open 2018; 6(10): E1190–E1197. doi: 10.1055/a-0655-7382.
17. Januszewicz W, Kaminski MF. Quality indicators in diagnostic upper gastrointestinal endoscopy. Therap Adv Gastroenterol 2020; 13 : 1756284820916693. doi: 10.1177/1756284820916693.
18. Pimentel-Nunes P, Libanio D, Marcos-Pinto R et al. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019. Endoscopy 2019; 51(4): 365–388. doi: 10.1055/a-0859-1883.
19. Gupta N, Gaddam S, Wani SB et al. Longer inspection time is associated with increased detection of high-grade dysplasia and esophageal adenocarcinoma in Barrett's esophagus. Gastrointest Endosc 2012; 76(3): 531–538. doi: 10.1016/j.gie.2012.04.470.
20. Akbayir N, Alkim C, Erdem L et al. Heterotopic gastric mucosa in the cervical esophagus (inlet patch): endoscopic prevalence, histological and clinical characteristics. J Gastroenterol Hepatol 2004; 19(8): 891–896. doi: 10.1111/j.1440-1746.2004.03474.x.
21. Maconi G, Pace F, Vago L et al. Prevalence and clinical features of heterotopic gastric mucosa in the upper oesophagus (inlet patch). Eur J Gastroenterol Hepatol 2000; 12(7): 745–749. doi: 10.1097/00042737-200012070-00005.
22. Peitz U, Vieth M, Evert M et al. The prevalence of gastric heterotopia of the proximal esophagus is underestimated, but preneoplasia is rare – correlation with Barrett's esophagus. BMC Gastroenterol 2017; 17(1): 87. doi: 10.1186/s12876-017-0644-3.
23. Rodriguez-de-Santiago E, Frazzoni L, Fuccio L et al. Digestive findings that do not require endoscopic surveillance – reducing the burden of care: European Society of Gastrointestinal Endoscopy (ESGE) position statement. Endoscopy 2020; 52(6): 491–497. doi: 10.1055/a-1137-4721.
24. Azar C, Jamali F, Tamim H et al. Prevalence of endoscopically identified heterotopic gastric mucosa in the proximal esophagus: endoscopist dependent? J Clin Gastroenterol 2007; 41(5): 468–471. doi: 10.1097/01.mcg.0000225519.59030.8d.
25. Romanczyk M, Ostrowski B, Marek T et al. Composite detection rate as an upper gastrointestinal endoscopy quality measure correlating with detection of neoplasia. J Gastroenterol 2021; 56(7): 651–658. doi: 10.1007/s00535-021-01790-3.
26. Setting the shortest examination time of gastroscopy to improve the detection rate of upper gastrointestinal tumors. 2022 [online]. Dostupné z: www.clinicaltrials.gov.
27. Lee SY, Han HS, Cha JM et al. Endoscopic flushing with pronase improves the quantity and quality of gastric biopsy: a prospective study. Endoscopy 2014; 46(9): 747–753. doi: 10.1055/s-0034-1365811.
28. Barakat MT, Huang RJ, Banerjee S. Simethicone is retained in endoscopes despite reprocessing: impact of its use on working channel fluid retention and adenosine triphosphate bioluminescence values (with video). Gastrointest Endosc 2019; 89(1): 115–123. doi: 10.1016/j.gie.2018.08.012.
29. Devereaux BM, Taylor ACF, Athan E et al. Simethicone use during gastrointestinal endoscopy: position statement of the Gastroenterological Society of Australia. J Gastroenterol Hepatol 2019; 34(12): 2086–2089. doi: 10.1111/jgh.14757.
30. Chang CC, Chen SH, Lin CP et al. Premedication with pronase or N-acetylcysteine improves visibility during gastroendoscopy: an endoscopist-blinded, prospective, randomized study. World J Gastroenterol 2007; 13(3): 444–447. doi: 10.3748/wjg.v13.i3.444.
31. Neale JR, James S, Callaghan J et al. Premedication with N-acetylcysteine and simethicone improves mucosal visualization during gastroscopy: a randomized, controlled, endoscopist-blinded study. Eur J Gastroenterol Hepatol 2013; 25(7): 778–783. doi: 10.1097/MEG.0b013e32836076b2.
32. Asl SM, Sivandzadeh GR. Efficacy of premedication with activated Dimethicone or N-acetylcysteine in improving visibility during upper endoscopy. World J Gastroenterol 2011; 17(37): 4213–4217. doi: 10.3748/wjg.v17.i37.4213.
33. Bhandari P, Green S, Hamanaka H et al. Use of gascon and pronase either as a pre-endoscopic drink or as targeted endoscopic flushes to improve visibility during gastroscopy: a prospective, randomized, controlled, blinded trial. Scand J Gastroenterol 2010; 45(3): 357–361. doi: 10.3109/00365520903483643.
34. Chen HW, Hsu HC, Hsieh TY et al. Pre-medication to improve esophagogastroduodenoscopic visibility: a meta-analysis and systemic review. Hepatogastroenterology 2014; 61(134): 1642–1648.
35. Elvas L, Areia M, Brito D et al. Premedication with simethicone and N-acetylcysteine in improving visibility during upper endoscopy: a double-blind randomized trial. Endoscopy 2017; 49(2): 139–145. doi: 10.1055/s-0042-119034.
36. Liu X, Guan CT, Xue LY et al. Effect of premedication on lesion detection rate and visualization of the mucosa during upper gastrointestinal endoscopy: a multicenter large sample randomized controlled double-blind study. Surg Endosc 2018; 32(8): 3548–3556. doi: 10.1007/s00464-018-6077-4.
37. Stepan M, Falt P, Pipek B et al. Administration of mucolytic solution before upper endoscopy – double-blind, monocentric, randomized study. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2021. doi: 10.5507/bp.2021.038.
38. Campo R, Brullet E, Montserrat A et al. Topical pharyngeal anesthesia improves tolerance of upper gastrointestinal endoscopy: a randomized double-blind study. Endoscopy 1995; 27(9): 659–664. doi: 10.1055/s-2007-1005783.
39. Evans LT, Saberi S, Kim HM et al. Pharyngeal anesthesia during sedated EGDs: is “the spray” beneficial? A meta-analysis and systematic review. Gastrointest Endosc 2006; 63(6): 761–766. doi: 10.1016/j.gie.2005.11.059.
40. Froehlich F, Schwizer W, Thorens J et al. Conscious sedation for gastroscopy: patient tolerance and cardiorespiratory parameters. Gastroenterology 1995; 108(3): 697–704. doi: 10.1016/0016-5085(95)90441-7.
41. American Society of Anesthesiologists Committee. Practice guidelines for preoperative fasting and the use of pharmacologic agents to reduce the risk of pulmonary aspiration: application to healthy patients undergoing elective procedures: an updated report by the American Society of Anesthesiologists Committee on Standards and Practice Parameters. Anesthesiology 2011; 114(3): 495–511. doi: 10.1097/ALN.0b013e3181fcbfd9.
42. Sharma VK, Nguyen CC, Crowell MD et al. A national study of cardiopulmonary unplanned events after GI endoscopy. Gastrointest Endosc 2007; 66(1): 27–34. doi: 10.1016/j.gie.2006.12.040.
43. ASGE Standard of Practice Committee, Shergill AK, Ben-Menachem T et al. Guidelines for endoscopy in pregnant and lactating women. Gastrointest Endosc 2012; 76(1): 18–24. doi: 10.1016/j.gie.2012.02.029.
44. American Association for Study of Liver Diseases, American College of Gastroenterology, American Gastroenterological Association Institute et al. Multisociety sedation curriculum for gastrointestinal endoscopy. Gastrointest Endosc 2012; 76(1): e1–e25. doi: 10.1016/j.gie.2012.03.001.
45. Dumonceau JM, Riphaus A, Schreiber F et al. Non-anesthesiologist administration of propofol for gastrointestinal endoscopy: European Society of Gastrointestinal Endoscopy, European Society of Gastroenterology and Endoscopy Nurses and Associates Guideline –Updated June 2015. Endoscopy 2015; 47(12): 1175–1189. doi: 10.1055/s-0034-1393414.
46. Bell GD, Bown S, Morden A et al. Prevention of hypoxaemia during upper-gastrointestinal endoscopy by means of oxygen via nasal cannulae. Lancet 1987; 1(8540): 1022–1024. doi: 10.1016/s0140-6736(87)92282-3.
47. ASGE Ensuring Safety in the Gastrointestinal Endoscopy Unit Task Force, Calderwood AH, Chapman FJ et al. Guidelines for safety in the gastrointestinal endoscopy unit. Gastrointest Endosc 2014; 79(3): 363–372. doi: 10.1016/j.gie.2013.12.015.
48. Dumonceau JM, Riphaus A, Beilenhoff U et al. European curriculum for sedation training in gastrointestinal endoscopy: position statement of the European Society of Gastrointestinal Endoscopy (ESGE) and European Society of Gastroenterology and Endoscopy Nurses and Associates (ESGENA). Endoscopy 2013; 45(6): 496–504. doi: 10.1055/s-0033-1344142.
49. Rey JF, Lambert R, ESGE Quality Assurance Committee. ESGE recommendations for quality control in gastrointestinal endoscopy: guidelines for image documentation in upper and lower GI endoscopy. Endoscopy 2001; 33(10): 901–903. doi: 10.1055/s-2001-42537.
50. Yao K. The endoscopic diagnosis of early gastric cancer. Ann Gastroenterol 2013; 26(1): 11–22.
51. Committee AT, Murad FM, Banerjee S et al. Image management systems. Gastrointest Endosc 2014; 79(1): 15–22. doi: 10.1016/j.gie.2013.07.048.
52. Aabakken L, Rembacken B, LeMoine O et al. Minimal standard terminology for gastrointestinal endoscopy MST 3.0. Endoscopy 2009; 41(8): 727–728. doi: 10.1055/s-0029-1214949.
53. Forrest JA, Finlayson ND, Shearman DJ. Endoscopy in gastrointestinal bleeding. Lancet 1974; 2(7877): 394–397. doi: 10.1016/s0140-6736(74)91770-x.
54. Gralnek IM, Dumonceau JM, Kuipers EJ et al. Diagnosis and management of nonvariceal upper gastrointestinal hemorrhage: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2015; 47(10): a1–46. doi: 10.1055/s-0034-1393172.
55. Bour B, Person B, Cales P et al. Interobserver agreement on endoscopic diagnosis of bleeding peptic ulcers. Gastrointest Endosc 1997; 46(1): 27–32. doi: 10.1016/s0016-5107(97)70205-0.
56. Mondardini A, Barletti C, Rocca G et al. Non-variceal upper gastrointestinal bleeding and Forrest's classification: diagnostic agreement between endoscopists from the same area. Endoscopy 1998; 30(6): 508–512. doi: 10.1055/s-2007-1001335.
57. Lau JY, Sung JJ, Chan AC et al. Stigmata of hemorrhage in bleeding peptic ulcers: an interobserver agreement study among international experts. Gastrointest Endosc 1997; 46(1): 33–36. doi: 10.1016/s0016-5107(97)70206-2.
58. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002. Gastrointest Endosc 2003; 58(6 Suppl): S3–43. doi: 10.1016/s0016-5107(03)02159-x.
59. Endoscopic Classification Review Group. Update on the paris classification of superficial neoplastic lesions in the digestive tract. Endoscopy 2005; 37(6): 570–578. doi: 10.1055/s-2005-861352.
60. Ribeiro H, Libanio D, Castro R et al. Reliability of Paris classification for superficial neoplastic gastric lesions improves with training and narrow band imaging. Endosc Int Open 2019; 7(5): E633–E640. doi: 10.1055/a-0828-7541.
61. Lundell LR, Dent J, Bennett JR et al. Endoscopic assessment of oesophagitis: clinical and functional correlates and further validation of the Los Angeles classification. Gut 1999; 45(2): 172–180. doi: 10.1136/gut.45.2.172.
62. Armstrong D, Bennett JR, Blum AL et al. The endoscopic assessment of esophagitis: a progress report on observer agreement. Gastroenterology 1996; 111(1): 85–92. doi: 10.1053/gast.1996.v111.pm8698230.
63. Lee YC, Lin JT, Chiu HM et al. Intraobserver and interobserver consistency for grading esophagitis with narrow-band imaging. Gastrointest Endosc 2007; 66(2): 230–236. doi: 10.1016/j.gie.2006.10.056.
64. Sharma P, Dent J, Armstrong D et al. The development and validation of an endoscopic grading system for Barrett's esophagus: the Prague C & M criteria. Gastroenterology 2006; 131(5): 1392–1399. doi: 10.1053/j.gastro.2006.08.032.
65. Lee YC, Cook MB, Bhatia S et al. Interobserver reliability in the endoscopic diagnosis and grading of Barrett's esophagus: an Asian multinational study. Endoscopy 2010; 42(9): 699–704. doi: 10.1055/s-0030-1255629.
66. Alvarez Herrero L, Curvers WL, van Vilsteren FG et al. Validation of the Prague C&M classification of Barrett's esophagus in clinical practice. Endoscopy 2013; 45(11): 876–882. doi: 10.1055/s-0033-1344952.
67. Anand O, Wani S, Sharma P. When and how to grade Barrett's columnar metaplasia: the Prague system. Best Pract Res Clin Gastroenterol 2008; 22(4): 661–669. doi: 10.1016/j.bpg.2008.02.001.
68. European Association for the Study of the Liver. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol 2018; 69(2): 406–460. doi: 10.1016/j.jhep.2018.03.024.
69. LaBrecque DKA, Sarin SK, Le Mair AW. Esophageal varices. World Gastroenterology Organisation Global Guidelines. 2022 [online]. Dostupné z: https://www.worldgastroenterology.org/guidelines/esophageal-varices/esophageal-varices-english.
70. Sarin SK, Lahoti D, Saxena SP et al. Prevalence, classification and natural history of gastric varices: a long-term follow-up study in 568 portal hypertension patients. Hepatology 1992; 16(6): 1343–1349. doi: 10.1002/hep.1840160607.
71. Hirano I, Moy N, Heckman MG et al. Endoscopic assessment of the oesophageal features of eosinophilic oesophagitis: validation of a novel classification and grading system. Gut 2013; 62(4): 489–495. doi: 10.1136/gutjnl-2011-301817.
72. Dellon ES, Cotton CC, Gebhart JH et al. Accuracy of the eosinophilic esophagitis endoscopic reference score in diagnosis and determining response to treatment. Clin Gastroenterol Hepatol 2016; 14(1): 31–39. doi: 10.1016/j.cgh.2015.08.040.
73. van Rhijn BD, Warners MJ, Curvers WL et al. Evaluating the endoscopic reference score for eosinophilic esophagitis: moderate to substantial intra - and interobserver reliability. Endoscopy 2014; 46(12): 1049–1055. doi: 10.1055/s-0034-1377781.
74. Rodriguez-Sanchez J, Barrio-Andres J, Nantes Castillejo O et al. The endoscopic reference score shows modest accuracy to predict either clinical or histological activity in adult patients with eosinophilic oesophagitis. Aliment Pharmacol Ther 2017; 45(2): 300–309. doi: 10.1111/apt.13845.
75. Salek J, Clayton F, Vinson L et al. Endoscopic appearance and location dictate diagnostic yield of biopsies in eosinophilic oesophagitis. Aliment Pharmacol Ther 2015; 41(12): 1288–1295. doi: 10.1111/apt.13201.
76. Chen JW, Pandolfino JE, Lin Z et al. Severity of endoscopically identified esophageal rings correlates with reduced esophageal distensibility in eosinophilic esophagitis. Endoscopy 2016; 48(9): 794–801. doi: 10.1055/s-0042-107340.
77. Zargar SA, Kochhar R, Mehta S et al. The role of fiberoptic endoscopy in the management of corrosive ingestion and modified endoscopic classification of burns. Gastrointest Endosc 1991; 37(2): 165–169. doi: 10.1016/s0016-5107(91)70678-0.
78. Zargar SA, Kochhar R, Nagi B et al. Ingestion of strong corrosive alkalis: spectrum of injury to upper gastrointestinal tract and natural history. Am J Gastroenterol 1992; 87(3): 337–341.
79. Cheng HT, Cheng CL, Lin CH et al. Caustic ingestion in adults: the role of endoscopic classification in predicting outcome. BMC Gastroenterol 2008; 8 : 31. doi: 10.1186/1471-230X-8-31.
80. Hoffman RS, Burns MM, Gosselin S. Ingestion of caustic substances. N Engl J Med 2020; 382(18): 1739–1748. doi: 10.1056/NEJMra1810769.
81. Spigelman AD, Williams CB, Talbot IC et al. Upper gastrointestinal cancer in patients with familial adenomatous polyposis. Lancet 1989; 2(8666): 783–785. doi: 10.1016/s0140-6736(89)90840-4.
82. Saurin JC, Gutknecht C, Napoleon B et al. Surveillance of duodenal adenomas in familial adenomatous polyposis reveals high cumulative risk of advanced disease. J Clin Oncol 2004; 22(3): 493–498. doi: 10.1200/JCO.2004.06.028.
83. Syngal S, Brand RE, Church JM et al. ACG clinical guideline: genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol 2015; 110(2): 223–262; quiz 263. doi: 10.1038/ajg.2014.435.
84. Haugen AS, Sevdalis N, Softeland E. Impact of the World Health Organization Surgical Safety Checklist on Patient Safety. Anesthesiology 2019; 131(2): 420–425. doi: 10.1097/ALN.0000000000002674.
85. Januszewicz W, Wieszczy P, Bialek A et al. Endoscopist biopsy rate as a quality indicator for outpatient gastroscopy: a multicenter cohort study with validation. Gastrointest Endosc 2019; 89(6): 1141–1149. doi: 10.1016/j.gie.2019.01.008.
86. Ferlay J, Colombet M, Soerjomataram I et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods. Int J Cancer 2019; 144(8): 1941–1953. doi: 10.1002/ijc.31937.
87. Kapadia CR. Gastric atrophy, metaplasia, and dysplasia: a clinical perspective. J Clin Gastroenterol 2003; 36(5 Suppl): S29–36; discussion S61–62. doi: 10.1097/00004836-200305001-00006.
88. Ang TL, Pittayanon R, Lau JY et al. A multicenter randomized comparison between high-definition white light endoscopy and narrow band imaging for detection of gastric lesions. Eur J Gastroenterol Hepatol 2015; 27(12): 1473–1478. doi: 10.1097/MEG.0000000000000478.
89. Chiu PWY, Uedo N, Singh R et al. An Asian consensus on standards of diagnostic upper endoscopy for neoplasia. Gut 2019; 68(2): 186–197. doi: 10.1136/gutjnl-2018-317111.
90. Eriksson NK, Farkkila MA, Voutilainen ME et al. The clinical value of taking routine biopsies from the incisura angularis during gastroscopy. Endoscopy 2005; 37(6): 532–536. doi: 10.1055/s-2005-861311.
91. Isajevs S, Liepniece-Karele I, Janciauskas D et al. The effect of incisura angularis biopsy sampling on the assessment of gastritis stage. Eur J Gastroenterol Hepatol 2014; 26(5): 510–513. doi: 10.1097/MEG.0000000000000082.
92. Varbanova M, Wex T, Jechorek D et al. Impact of the angulus biopsy for the detection of gastric preneoplastic conditions and gastric cancer risk assessment. J Clin Pathol 2016; 69(1): 19–25. doi: 10.1136/jclinpath-2015-202858.
93. Shichijo S, Hirata Y, Niikura R et al. Histologic intestinal metaplasia and endoscopic atrophy are predictors of gastric cancer development after Helicobacter pylori eradication. Gastrointest Endosc 2016; 84(4): 618–624. doi: 10.1016/j.gie.2016.03.791.
94. Simone A, Casadei A, De Vergori E et al. Rescue endoscopy to identify site of gastric dysplasia or carcinoma found at random biopsies. Dig Liver Dis 2011; 43(9): 721–725. doi: 10.1016/j.dld.2011.04.007.
95. Lim H, Jung HY, Park YS et al. Discrepancy between endoscopic forceps biopsy and endoscopic resection in gastric epithelial neoplasia. Surg Endosc 2014; 28(4): 1256–1262. doi: 10.1007/s00464-013-3316-6.
96. Pouw RE, Barret M, Biermann K et al. Endoscopic tissue sampling – part 1: upper gastrointestinal and hepatopancreatobiliary tracts. European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2021; 53(11): 1174–1188. doi: 10.1055/a-1611-5091.
97. Kodama M, Murakami K, Okimoto T et al. Helicobacter pylori eradication improves gastric atrophy and intestinal metaplasia in long-term observation. Digestion 2012; 85(2): 126–130. doi: 10.1159/000334684.
98. Martinek J, Benes M, Brandtl P et al. Low incidence of adenocarcinoma and high-grade intraepithelial neoplasia in patients with Barrett's esophagus: a prospective cohort study. Endoscopy 2008; 40(9): 711–716. doi: 10.1055/s-2008-1077502.
99. Weusten B, Bisschops R, Coron E et al. Endoscopic management of Barrett's esophagus: European Society of Gastrointestinal Endoscopy (ESGE) position statement. Endoscopy 2017; 49(2): 191–198. doi: 10.1055/s-0042-122140.
100. Levine DS, Haggitt RC, Blount PL et al. An endoscopic biopsy protocol can differentiate high-grade dysplasia from early adenocarcinoma in Barrett's esophagus. Gastroenterology 1993; 105(1): 40–50. doi: 10.1016/0016-5085(93)90008-z.
101. Abrams JA, Kapel RC, Lindberg GM et al. Adherence to biopsy guidelines for Barrett's esophagus surveillance in the community setting in the United States. Clin Gastroenterol Hepatol 2009; 7(7): 736–742; quiz 710. doi: 10.1016/j.cgh.2008.12.027.
102. Pohl J, Nguyen-Tat M, Manner H et al. “Dry biopsies” with spraying of dilute epinephrine optimize biopsy mapping of long segment Barrett's esophagus. Endoscopy 2008; 40(11): 883–887. doi: 10.1055/s-2008-1077678.
103. Martinek J, Maluskova J, Stefanova M et al. Improved specimen adequacy using jumbo biopsy forceps in patients with Barrett's esophagus. World J Gastroenterol 2015; 21(17): 5328–5335. doi: 10.3748/wjg.v21.i17.5328.
104. Longcroft-Wheaton G, Brown J, Basford P et al. Duration of acetowhitening as a novel objective tool for diagnosing high risk neoplasia in Barrett's esophagus: a prospective cohort trial. Endoscopy 2013; 45(6): 426–432. doi: 10.1055/s-0032-1326630.
105. Parasa S, Desai M, Vittal A et al. Estimating neoplasia detection rate (NDR) in patients with Barrett's oesophagus based on index endoscopy: a systematic review and meta-analysis. Gut 2019; 68(12): 2122–2128. doi: 10.1136/gutjnl-2018-317800.
106. Shiozaki H, Tahara H, Kobayashi K et al. Endoscopic screening of early esophageal cancer with the Lugol dye method in patients with head and neck cancers. Cancer 1990; 66(10): 2068–2071. doi: 10.1002/1097-0142(19901115)66 : 10<2068::aid-cncr2820661005>3.0.co;2-w.
107. Jones AS, Morar P, Phillips DE et al. Second primary tumors in patients with head and neck squamous cell carcinoma. Cancer 1995; 75(6): 1343–1353. doi: 10.1002/1097-0142(19950315)75 : 6<1343::aid-cncr2820750617>3.0.co;2-t.
108. Scherubl H, von Lampe B, Faiss S et al. Screening for oesophageal neoplasia in patients with head and neck cancer. Br J Cancer 2002; 86(2): 239–243. doi: 10.1038/sj.bjc.6600018.
109. Petit T, Georges C, Jung GM et al. Systematic esophageal endoscopy screening in patients previously treated for head and neck squamous-cell carcinoma. Ann Oncol 2001; 12(5): 643–646. doi: 10.1023/a:1011191720336.
110. Ina H, Shibuya H, Ohashi I et al. The frequency of a concomitant early esophageal cancer in male patients with oral and oropharyngeal cancer. Screening results using Lugol dye endoscopy. Cancer 1994; 73(8): 2038–2041. doi: 10.1002/1097-0142(19940415)73 : 8<2038::aid-cncr2820730804>3.0.co;2-x.
111. Leon X, Quer M, Diez S et al. Second neoplasm in patients with head and neck cancer. Head Neck 1999; 21(3): 204–210. doi: 10.1002/(sici)1097-0347(199905)21 : 3<204::aid-hed4>3.0.co;2-7.
112. Chen YH, Wang YK, Chuang YS et al. Endoscopic surveillance for metachronous esophageal squamous cell neoplasms among head and neck cancer patients. Cancers (Basel) 2020; 12(12): 3832. doi: 10.3390/cancers12123832.
113. Kominek P, Vitek P, Urban O et al. Chromoendoscopy to detect early synchronous second primary esophageal carcinoma in patients with squamous cell carcinomas of the head and neck? Gastroenterol Res Pract 2013; 2013 : 236264. doi: 10.1155/2013/236264.
114. Park JW, Lee SW. Clinical outcomes of synchronous head and neck and esophageal cancer. Radiat Oncol J 2015; 33(3): 172–178. doi: 10.3857/roj.2015.33.3.172.
115. Lim H, Kim DH, Jung HY et al. Clinical significance of early detection of esophageal cancer in patients with head and neck cancer. Gut Liver 2015; 9(2): 159–165. doi: 10.5009/gnl13401.
116. Saftoiu A, Hassan C, Areia M et al. Role of gastrointestinal endoscopy in the screening of digestive tract cancers in Europe: European Society of Gastrointestinal Endoscopy (ESGE) position statement. Endoscopy 2020; 52(4): 293–304. doi: 10.1055/a-1104-5245.
117. Dawsey SM, Fleischer DE, Wang GQ et al. Mucosal iodine staining improves endoscopic visualization of squamous dysplasia and squamous cell carcinoma of the esophagus in Linxian, China. Cancer 1998; 83(2): 220–231.
118. Mori M, Adachi Y, Matsushima T et al. Lugol staining pattern and histology of esophageal lesions. Am J Gastroenterol 1993; 88(5): 701–705.
119. Meyer V, Burtin P, Bour B et al. Endoscopic detection of early esophageal cancer in a high-risk population: does Lugol staining improve videoendoscopy? Gastrointest Endosc 1997; 45(6): 480–484. doi: 10.1016/s0016-5107(97)70177-9.
120. Li J, Xu R, Liu M et al. Lugol chromoendoscopy detects esophageal dysplasia with low levels of sensitivity in a high-risk region of China. Clin Gastroenterol Hepatol 2018; 16(10): 1585–1592. doi: 10.1016/j.cgh.2017.11.031.
121. Zheng JY, Chen YH, Chen YY et al. Presence of pink-color sign within 1 min after iodine staining has high diagnostic accordance rate for esophageal high-grade intraepithelial neoplasia/invasive cancer. Saudi J Gastroenterol 2019; 25(2): 113–118. doi: 10.4103/sjg.SJG_274_18.
122. Ishihara R, Kanzaki H, Iishi H et al. Pink-color sign in esophageal squamous neoplasia, and speculation regarding the underlying mechanism. World J Gastroenterol 2013; 19(27): 4300–4308. doi: 10.3748/wjg.v19.i27.4300.
123. Gotoda T, Kanzaki H, Okamoto Y et al. Tolerability and efficacy of the concentration of iodine solution during esophageal chromoendoscopy: a double-blind randomized controlled trial. Gastrointest Endosc 2020; 91(4): 763–770. doi: 10.1016/j.gie.2019.10.022.
124. Morita FH, Bernardo WM, Ide E et al. Narrow band imaging versus lugol chromoendoscopy to diagnose squamous cell carcinoma of the esophagus: a systematic review and meta-analysis. BMC Cancer 2017; 17(1): 54. doi: 10.1186/s12885-016-3011-9.
125. Goda K, Dobashi A, Yoshimura N et al. Narrow-band imaging magnifying endoscopy versus lugol chromoendoscopy with pink-color sign assessment in the diagnosis of superficial esophageal squamous neoplasms: a randomised noninferiority trial. Gastroenterol Res Pract 2015; 2015 : 639462. doi: 10.1155/2015/639462.
126. Waclawek M, Milonski J, Olszewski J. Comparative evaluation of the diagnostic value of biopsy and NBI endoscopy in patients with cancer of the hypopharynx and larynx. Otolaryngol Pol 2019; 73(5): 12–17. doi: 10.5604/01.3001.0013.2309.
127. Costa-Santos MP, Ferreira AO, Mouradides C et al. Is lugol necessary for endoscopic resection of esophageal squamous cell neoplasia? Endosc Int Open 2020; 8(10): E1471–E1477. doi: 10.1055/a-1198-4316.
128. Gruner M, Denis A, Masliah C et al. Narrow-band imaging versus lugol chromoendoscopy for esophageal squamous cell cancer screening in normal endoscopic practice: randomized controlled trial. Endoscopy 2021; 53(7): 674–682. doi: 10.1055/a-1224-6822.
129. Dellon ES, Gibbs WB, Fritchie KJ et al. Clinical, endoscopic, and histologic findings distinguish eosinophilic esophagitis from gastroesophageal reflux disease. Clin Gastroenterol Hepatol 2009; 7(12): 1305–1313; quiz 1261. doi: 10.1016/j.cgh.2009.08.030.
130. Lucendo AJ, Molina-Infante J, Arias A et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J 2017; 5(3): 335–358. doi: 10.1177/2050640616689525.
131. Wechsler JB, Bolton SM, Gray E et al. Defining the patchy landscape of esophageal eosinophilia in children with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2021; S1542–3565(21)01347–1. doi: 10.1016/j.cgh.2021.12.023.
132. Moawad FJ, Molina-Infante J, Lucendo AJ et al. Systematic review with meta-analysis: endoscopic dilation is highly effective and safe in children and adults with eosinophilic oesophagitis. Aliment Pharmacol Ther 2017; 46(2): 96–105. doi: 10.1111/apt.14123.
133. Bouri S, Martin J. Investigation of iron deficiency anaemia. Clin Med (Lond) 2018; 18(3): 242–244. doi: 10.7861/clinmedicine.18-3-242.
134. Rockey DC, Altayar O, Falck-Ytter Y et al. AGA technical review on gastrointestinal evaluation of iron deficiency anemia. Gastroenterology 2020; 159(3): 1097–1119. doi: 10.1053/j.gastro.2020.06.045.
135. Dixon MF, Genta RM, Yardley JH et al. Classification and grading of gastritis. The updated Sydney system. International workshop on the histopathology of gastritis, Houston 1994. Am J Surg Pathol 1996; 20(10): 1161–1181. doi: 10.1097/00000478-199610000-00001.
136. Kim YI, Kook MC, Cho SJ et al. Effect of biopsy site on detection of gastric cancer high-risk groups by OLGA and OLGIM stages. Helicobacter 2017; 22(6). doi: 10.1111/hel.12442.
137. Ko CW, Siddique SM, Patel A et al. AGA Clinical Practice Guidelines on the Gastrointestinal Evaluation of Iron Deficiency Anemia. Gastroenterology 2020; 159(3): 1085–1094. doi: 10.1053/j.gastro.2020.06.046.
138. Mahadev S, Laszkowska M, Sundstrom J et al. Prevalence of celiac disease in patients with iron deficiency anemia – a systematic review with meta-analysis. Gastroenterology 2018; 155(2): 374–382.e1. doi: 10.1053/j.gastro.2018.04.016.
139. Elli L, Norsa L, Zullo A et al. Diagnosis of chronic anaemia in gastrointestinal disorders: a guideline by the Italian Association of Hospital Gastroenterologists and Endoscopists (AIGO) and the Italian Society of Paediatric Gastroenterology Hepatology and Nutrition (SIGENP). Dig Liver Dis 2019; 51(4): 471–483. doi: 10.1016/j.dld.2019.01.022.
140. Goddard AF, James MW, McIntyre AS et al. Guidelines for the management of iron deficiency anaemia. Gut 2011; 60(10): 1309–1316. doi: 10.1136/gut.2010.228874.
141. Dickey W, Hughes D. Disappointing sensitivity of endoscopic markers for villous atrophy in a high-risk population: implications for celiac disease diagnosis during routine endoscopy. Am J Gastroenterol 2001; 96(7): 2126–2128. doi: 10.1111/j.1572-0241.2001.03947.x.
142. Lebwohl B, Kapel RC, Neugut AI et al. Adherence to biopsy guidelines increases celiac disease diagnosis. Gastrointest Endosc 2011; 74(1): 103–109. doi: 10.1016/j.gie.2011.03.1236.
143. Ozakinci H, Kirmizi A, Tural M et al. Duodenal bulb biopsy in the diagnostic work-up of coeliac disease. Virchows Arch 2020; 477(4): 507–515. doi: 10.1007/s00428-020-02832-6.
144. Bai JC, Ciacci C. World Gastroenterology Organisation Global Guidelines: Celiac Disease February 2017. J Clin Gastroenterol 2017; 51(9): 755–768. doi: 10.1097/MCG.0000000000000919.
145. Mooney PD, Kurien M, Evans KE et al. Clinical and immunologic features of ultra-short celiac disease. Gastroenterology 2016; 150(5): 1125–1134. doi: 10.1053/j.gastro.2016.01.029.
146. Jones HJ, Warner JT. NICE clinical guideline 86. Coeliac disease: recognition and assessment of coeliac disease. Arch Dis Child 2010; 95(4): 312–313. doi: 10.1136/adc.2009.173849.
147. Al-Toma A, Volta U, Auricchio R et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. United European Gastroenterol J 2019; 7(5): 583–613. doi: 10.1177/2050640619844125.
148. Latorre M, Lagana SM, Freedberg DE et al. Endoscopic biopsy technique in the diagnosis of celiac disease: one bite or two? Gastrointest Endosc 2015; 81(5): 1228–1233. doi: 10.1016/j.gie.2014.10.024.
149. Husby S, Murray JA, Katzka DA. AGA clinical practice update on diagnosis and monitoring of celiac disease-changing utility of serology and histologic measures: expert review. Gastroenterology 2019; 156(4): 885–889. doi: 10.1053/j.gastro.2018.12.010.
150. Werkstetter KJ, Korponay-Szabo IR, Popp A et al. Accuracy in diagnosis of celiac disease without biopsies in clinical practice. Gastroenterology 2017; 153(4): 924–935. doi: 10.1053/j.gastro.2017.06.002.
151. Selinger CP, Cochrane R, Thanaraj S et al. Gastric ulcers: malignancy yield and risk stratification for follow-up endoscopy. Endosc Int Open 2016; 4(6): E709–714. doi: 10.1055/s-0042-106959.
152. Gielisse EA, Kuyvenhoven JP. Follow-up endoscopy for benign-appearing gastric ulcers has no additive value in detecting malignancy: it is time to individualise surveillance endoscopy. Gastric Cancer 2015; 18(4): 803–809. doi: 10.1007/s10120-014-0433-4.
153. ASGE Standards of Practice Committee, Banerjee S, Cash BD et al. The role of endoscopy in the management of patients with peptic ulcer disease. Gastrointest Endosc 2010; 71(4): 663–668. doi: 10.1016/j.gie.2009.11.026.
154. Di Franco F, Lamb PJ, Karat D et al. Iatrogenic perforation of localized oesophageal cancer. Br J Surg 2008; 95(7): 837–839. doi: 10.1002/bjs.6055.
155. Chiu PWY. Editorial on quality standards in upper gastrointestinal endoscopy: a position statement of the British Society of Gastroenterology (BSG) and Association of Upper Gastrointestinal Surgeons of Great Britain and Ireland (AUGIS). Transl Gastroenterol Hepatol 2018; 3 : 13. doi: 10.21037/tgh.2018.01.05.
156. Yalamarthi S, Witherspoon P, McCole D et al. Missed diagnoses in patients with upper gastrointestinal cancers. Endoscopy 2004; 36(10): 874–879. doi: 10.1055/s-2004-825853.
157. Cheung D, Menon S, Hoare J et al. Factors associated with upper gastrointestinal cancer occurrence after endoscopy that did not diagnose cancer. Dig Dis Sci 2016; 61(9): 2674–2684. doi: 10.1007/s10620-016-4176-4.
158. Pimenta-Melo AR, Monteiro-Soares M, Libanio D et al. Missing rate for gastric cancer during upper gastrointestinal endoscopy: a systematic review and meta-analysis. Eur J Gastroenterol Hepatol 2016; 28(9): 1041–1049. doi: 10.1097/MEG.0000000000000657.
159. Shakhatreh MH, Duan Z, Avila N et al. Risk of upper gastrointestinal cancers in patients with gastroesophageal reflux disease after a negative screening endoscopy. Clin Gastroenterol Hepatol 2015; 13(2): 280–286. doi: 10.1016/j.cgh.2014.06.029.
160. Delgado Guillena PG, Morales Alvarado VJ, Jimeno Ramiro M et al. Gastric cancer missed at esophagogastroduodenoscopy in a well-defined Spanish population. Dig Liver Dis 2019; 51(8): 1123–1129. doi: 10.1016/j.dld.2019.03.005.
161. Menon S, Trudgill N. How commonly is upper gastrointestinal cancer missed at endoscopy? A meta-analysis. Endosc Int Open 2014; 2(2): E46–50. doi: 10.1055/s-0034-1365524.
162. Januszewicz W, Witczak K, Wieszczy P et al. Prevalence and risk factors of upper gastrointestinal cancers missed during endoscopy: a nationwide registry-based study. Endoscopy 2021. doi: 10.1055/a-1675-4136.
163. Voutilainen ME, Juhola MT. Evaluation of the diagnostic accuracy of gastroscopy to detect gastric tumours: clinicopathological features and prognosis of patients with gastric cancer missed on endoscopy. Eur J Gastroenterol Hepatol 2005; 17(12): 1345–1349. doi: 10.1097/00042737-200512000-00013.
164. Raftopoulos SC, Segarajasingam DS, Burke V et al. A cohort study of missed and new cancers after esophagogastroduodenoscopy. Am J Gastroenterol 2010; 105(6): 1292–1297. doi: 10.1038/ajg.2009.736.
165. Cotton PB, Eisen GM, Aabakken L et al. A lexicon for endoscopic adverse events: report of an ASGE workshop. Gastrointest Endosc 2010; 71(3): 446–454. doi: 10.1016/j.gie.2009.10.027.
166. Lee JH, Kedia P, Stavropoulos SN et al. AGA clinical practice update on endoscopic management of perforations in gastrointestinal tract: expert review. Clin Gastroenterol Hepatol 2021; 19(11): 2252–2261.e2. doi: 10.1016/j.cgh.2021.06.045.
167. Werner YB, Hakanson B, Martinek J et al. Endoscopic or surgical myotomy in patients with idiopathic achalasia. N Engl J Med 2019; 381(23): 2219–2229. doi: 10.1056/NEJMoa1905380.
168. Ahmed O, Lee JH, Thompson CC et al. AGA clinical practice update on the optimal management of the malignant alimentary tract obstruction: expert review. Clin Gastroenterol Hepatol 2021; 19(9): 1780–1788. doi: 10.1016/j.cgh.2021.03.046.
169. Sharma P. Top 10 tips for performing a high-quality upper endoscopy (with videos). Gastrointest Endosc 2021; 94(5): 989–994. doi: 10.1016/j.gie.2021.08.012.
170. Diagnostic Performance Indicators in Upper GI Endoscopy: PROSPERO Study. 2022 [online]. Dostupné z: www.clinicaltrials.gov.
171. Bisschops R, Rutter MD, Areia M et al. Overcoming the barriers to dissemination and implementation of quality measures for gastrointestinal endoscopy: European Society of Gastrointestinal Endoscopy (ESGE) and United European Gastroenterology (UEG) position statement. Endoscopy 2021; 53(2): 196–202. doi: 10.1055/a-1312-6389.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2022 Issue 3-
All articles in this issue
- Editorial
- Gastroskopie – standardy kvality České gastroenterologické společnosti ČLS JEP
- Prevence vzniku pankreatické píštěle u laparoskopických levostranných pankreatektomií
- Subskvamózní neoplazie po radiofrekvenční ablaci Barrettova jícnu
- Raritní příčina biliární obstrukce – kazuistika
- Endoskopická léčba refluxní nemoci jícnu pomocí radiofrekvenční energie (Stretta procedura) – ošetření prvních pacientů v České republice
- Krátkodobé a dlhodobé výsledky pneumatickej dilatácie v liečbe pacientov s achaláziou pažeráka: 16 rokov skúseností
- 42. české a slovenské endoskopické dny a ESGE Days 2022
- Zpráva o konání gastroenterologického mezinárodního kongresu v prezenční podobě v době pandemické
- Několik poznámek k léčbě mesalazinem u nemocných s ulcerózní kolitidou a Crohnovou chorobou
- Výběr z mezinárodních časopisů
- Prof. MUDr. Julius Špičák, CSc., jubilující
- Lze předpovědět, nebo dokonce předejít IBD?
- Subkutánní infliximab – začátek éry biobetters v léčbě imunitně podmíněných zánětlivých onemocnění
- Kreditovaný autodidaktický test: digestivní endoskopie
- 11th Symposium of portal hypertension 17.–18. June 2022 Banská Štiavnica
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Endoskopická léčba refluxní nemoci jícnu pomocí radiofrekvenční energie (Stretta procedura) – ošetření prvních pacientů v České republice
- Gastroskopie – standardy kvality České gastroenterologické společnosti ČLS JEP
- Raritní příčina biliární obstrukce – kazuistika
- Prof. MUDr. Julius Špičák, CSc., jubilující
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


