-
Medical journals
- Career
Prevalencia hypovitaminózy D a poruchy glukózovej tolerancie u pacientov s neuroendokrinnými tumormi podstupujúcich liečbu somatostatínovými analógmi
Authors: L. Nosáková 1; P. Bánovčin Jr. 1; Pindura M. 2; Uhrík P. 1; Hyrdel R. 1
Authors‘ workplace: Interná klinika gastroenterologická JLF UK a UN Martin, Slovenská republika 2 Chirurgická klinika a transplantačné centrum JLF UK a UN Martin, Slovenská republika 1
Published in: Gastroent Hepatol 2020; 74(5): 410-414
Category:
Overview
Úvod: Neuroendokrinné nádory gastrointestinálneho traktu (GEP-NET – gastroenteropancreatic neuroendocrine tumors) sa považujú za zriedkavé nádorové ochorenia reprezentujúce heterogénnu skupinu tumorov. Somatostatínové analógy (SSA) sú bežne používané v paliatívnej liečbe GEP-NET. Cieľom práce bolo stanoviť potencionálne nežiadúce účinky liečby SSA. Metodika a súbor pacientov: Súbor tvorili pacienti aktívne podstupujúci liečbu SSA ambulantnou formou. Hodnotili sme údaje o dĺžke trvania ochorenia, liečby SSA a typ preparátu SSA. Následne pacienti podstúpili vyšetrenie hladiny vitamínu D a glykémie. Výsledky: Celkovo sme vyhodnotili 16 pacientov (8 žien a 8 mužov). Priemerný vek bol 61 rokov (43 – 82 rokov). Hypovitaminóza D bola prítomná u 13 pacientov (81,25 %). Hladina vitamínu D sa pohybovala v rozmedzí 12,2 – 55,8 ng/ml. Porucha glukózovej tolerancie bola prítomná u 44 % pacientov. Glykémia sa pohybovala v rozmedzí 4,5 – 7,6 mmol/l. Záver: SSA sú vo všeobecnosti považované za bezpečné a dobre tolerované. V našej práci sme poukázali na relatívne vysokú prevalenciu hypovitaminózy D a poruchy glukózovej tolerancie.
Klíčová slova:
neuroendokrinné tumory – somatostatínové analógy – hypovitaminóza D – glykémia
Úvod
Neuroendokrinné nádory gastrointestinálneho traktu – neuroendokrinné neoplázie (NEN) a neuroendokrinné nádory (NET – neuroendocrine tumors) reprezentujú heterogénnu skupinu tumorov s rozličným funkčným a biologickým správaním v závislosti od lokalizácie, veľkosti a klinických symptómov. Vyskytujú sa v rozličných častiach tráviacej sústavy a sumárne ich nazývame gastroenteropankreatické neuroendokrinné tumory (GEP-NET – gastroenteropancreatic neuroendocrine tumors) [1,2]. NET sú vo všeobecnosti považované za zriedkavé a ich incidencia sa odhaduje na 5,25/100 000/rok. Prevalencia je približne 35/100 000/rok [3].
Čo sa liečby týka, jedinou kuratívnou liečbou je liečba chirurgická. Vzhľadom k faktu, že sa väčšinou jedná o nádory s nízkym profileračným indexom, rádioterapia a chemoterapia majú len okrajový význam v terapii, indikované sú väčšinou len pri nádoroch s vysokým Ki-67 indexom. Naopak biologická terapia má zásadný význam. V terapii NET sa využívajú viaceré biologiká, ako sú somatostatínové analógy (SSA), inhibítory mTOR (mammalian target of rapamycin) a inhibítory tyrozínkinázy. SSA sa v klinickej praxi používajú od roku 1980. Experimentálne štúdie ukázali, že dlhodobé podávanie SSA spomaľuje rast mnohých nádorov transplantovaných zvieratám, vrátane neuroendokrinných [4]. Mechanizmus účinku, ktorým SSA vplývajú na bunky neuroendokrinných tumorov, je komplexný a nie úplne známy. Je známe, že SSA sú schopné inhibovať rozličné bunkové funkcie, ako sú sekrécia, motilita a proliferácia. Môžu pôsobiť na úrovni neurotransmiterov, parakrínne, autokrínne, dokonca lokálne v luméne čreva. Protinádorový efekt SSA je navodený cytostatickým a cytotoxickým pôsobením. SSA majú priamy antiproliferačný efekt na nádorové bunky, inhibujú mitogenickú aktivitu a navodzujú apoptózu. Okrem toho majú inhibičný vplyv na angiogenézu blokovaním tvorby VEGF (vascular endothelial growth factor) a iných rastových faktorov [5,6]. Ich účinok je daný exprimáciou somatostatínových receptorov (SSTR), pričom podtyp SSTR 2 býva u NET exprimovaný najčastejšie. Zaujímavosťou je, že pozorujeme rozdiely v expresii SSTR nielen medzi rôznymi typmi NET, ale aj medzi NET toho istého typu. Vo všeobecnosti platí, že zle diferencované neuroendokrinné karcinómy (NEC – neuroendocrine carcinomas) (G3) majú nižšiu expresiu k SSTR ako dobre diferencované NEN (G1, G2). SSA sú štandardnou liečebnou metódou dľa odporúčaní ENETS (Europe Neuroendocrine Tumor Society). Indikovaná je u pacientov s midgut karcinoidmi na zvládnutie karcinoidového syndrómu, s funkčnými GEP-NET, s pokročilými neuroendokrinnými midgut tumormi alebo tumormi s neznámou lokalizáciou [7–10]. V súčasnosti máme k dispozícií dva preparáty používané v liečbe NET – oktreotid a lanreotid v depotnej forme podávané subkutánne 1× mesačne. Pasireotid je u nás registrovaný len v indikácií akromegálie. V našej práci sme sa rozhodli analyzovať potencionálne nežiaduce účinky liečby SSA u pacientov s NET podstupujúcich ambulantnú liečbu.
Súbor pacientov a metodika
Súbor pacientov tvorili pacienti Internej kliniky gastroenterologickej Jesseniovej lekárskej fakulty Univerzity Komenského (JLF UK) a Univerzitnej nemocnice Martin (UN Martin), ktorí aktívne podstupujú liečbu SSA ambulantnou formou a sú dispenzarizovaní v gastroenterologickej ambulancii našej kliniky. Pred zaradením do súboru bol pacientom dôkladne vysvetlený postup všetkých vyšetrení a všetci pacienti podpísali informovaný súhlas schválený etickou komisiou JLF UK. V prvom bode pacienti podstúpili dôkladný odber anamnézy so zameraním sa na dĺžku trvania ochorenia, dátum stanovenia diagnózy, dátum začiatku liečby SSA a typ preparátu SSA. Taktiež nás zaujímal čas do stanovenia správnej diagnózy. Tieto údaje boli doplnené o konkrétny typ NEN, rozsah pokročilosti ochorenia, stupeň diferenciácie nádoru (G1, event. G2) a informácie získané z histologického vyšetrenia. Následne pacienti podstúpili vyšetrenie hladiny vitamínu D a glykémie. Odoberali sme 15 ml natívnej krvi pacientovi po 10 – 12 hod. lačnení. Vitamín D sme stanovovali metódou ECL (Roche). Vzorky sme expedovali na vyhodnotenie do biochemického a hematologického laboratória UN Martin. Po obdàžaní výsledkov sme získané výsledky hodnotili podľa referenčných hodnôt našich laboratórií.
Výsledky
Celkový počet pacientov podstupujúcich ambulantnú liečbu SSA na našej ambulancii bolo 16, z toho 8 žien a 8 mužov. Charakteristika pacientov je sumárne uvedená v tab. 1. Priemerný vek bol 61 rokov (43 – 82 rokov). Pacienti boli podľa typu konkrétneho NET nastavení na liečbu depotným lanreotidom (n = 7) alebo oktreotidom (n = 9). Zastúpenie jednotlivých typov NET je znázornené v grafe 1. Najčastejšie sa vyskytujúcim NET u našich pacientov je NET tenkého čreva (n = 5). Na druhom mieste sú zhodne NET pankreasu, NET duodena a NET neznámeho origa. Čo sa biologickej povahy ochorenia týka, drvivá väčšina pacientov (n = 11) mala NET histopatologický, zaradený do skupiny G1, teda Ki-67 index bol < 2 %. Štyria pacienti majú NET G2, čo znamená že Ki-67 index bol stanovený v rozmedzí 2 – 20 %. U jedného pacienta sa presná biologická povaha nádoru nedala určiť. V tomto súbore pacientov podstúpilo chirurgickú liečbu väčšina z nich, celkovo 14 pacientov, z toho niektorí dokonca opakovane.
Table 1. Charakteristika súboru pacientov.
Tab. 1. Characteristics of the group of patients.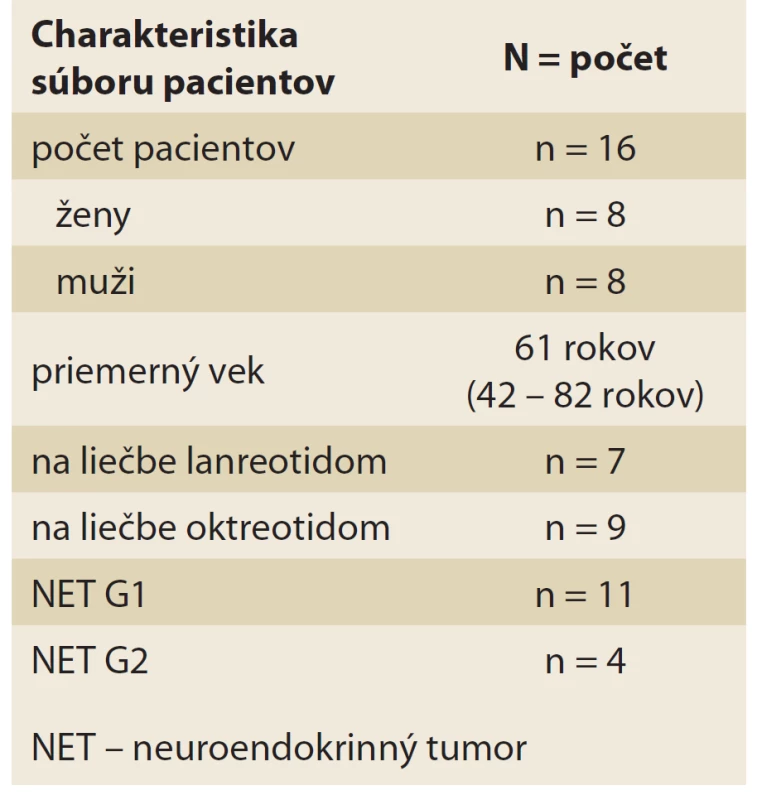
Graph 1. Zastúpenie jednotlivých neuroendokrinných nádorov v súbore našich pacientov.
Graf. 1. Representation of individual neuroendocrine tumours in the group of our patients.
Najčastejším nežiadúcim účinkom v súbore našich pacientov bola hnačka (u 9 pacientov), ktorá ale odoznela pár dní po podaní SSA. Menej často sa vyskytovali prechodné bolesti brucha (u 5 pacientov). Čo sa týka prítomnosti cholecystolitiázy, 13 pacientov v období pred diagnostikovaním NET podstúpilo cholecystektómiu. Zvyšní traja podstúpili ultrasonografiu, u jedného bola prítomná asymptomatická cholecystolitiáza.
Dĺžku liečby sme stanovovali k februáru 2019. Priemerná dĺžka liečby SSA v našom súbore je 38,6 mesiaca. Najdlhšie liečený pacient v našom súbore je úspešne nastavený na liečbu od januára roku 2009. Čo sa týka dĺžky klinických prejavov od začiatku ochorenia po stanovenie diagnózy, priemerný čas bol u našich pacientov 10,5 mesiacov. Najdlhšie obdobie trvania diagnostického procesu bolo 3 roky. Naopak najkratšie obdobie bolo 0 mesiacov, teda bezpríznakový priebeh konkrétne u troch pacientov, ktorým sa ochorenie zistilo náhodne pri vyšetrovaní pacienta z iných príčin. Hladina vitamínu D sa u našich pacientov pohybovala v rozmedzí 12,2 – 55,8 ng/ml. Iba u troch pacientov bola prítomná normálna (referenčná) hladina vitamínu D. U 13 pacientov (81,25 %) bola prítomná hypovitaminóza vitamínu D rôzneho stupňa. Hladiny vitamínu D u pacientov v našom súbore znázorňuje graf 2. Žiadny z týchto pacientov nemal v predchorobí diagnostikovanú osteoporózu, v anamnéze sa nevyskytla prítomnosť patologických zlomenín.
Graph 2. Hladiny vitamínu D u pacientov s neuroendokrinným nádorom podstupujúcich liečbu somatostatínovými analógmi.
Graph 2. Vitamin D levels in neuroendocrine tumour patients undergoing treatment with somatostatin analogues.
Ďalším vyšetrovaným parametrom bola hladina glykémie nalačno. Tá sa pohybovala v našom súbore v rozmedzí 4,5 – 7,6 mmol/l (graf 3). Celkovo sedem pacientov malo zvýšenú hladinu glykémie v krvi nalačno. Týmto pacientom bolo doporučené odborné vyšetrenie s doplnením gamaglutamyltransferázy.
Graph 3. Hodnoty glykémií u pacientov s neuroendokrinným nádorom podstupujúcich liečbu somatostatínovými analógmi.
Graph 3. Blood glucose values in patients with neuroendocrine tumours undergoing treatment with somatostatin analogues.
Diskusia
Liečba SSA je vo všeobecnosti považovaná za bezpečnú a dobre tolerovanú. Preukázať jej vplyv na ľudský organizmus bolo jedným z cieľov našej práce. Najčastejšie nežiadúce účinky SSA bývajú hnačka, flatulencia, steatorea, bolesti brucha, rozvoj cholecystolitiázy. Týmito nežiadúcimi účinkami sme sa v našej práci zaoberali len okrajovo. Celkovo sme získali dáta od 16 pacientov podstupujúcich aktívne ambulantnú liečbu depotnými SSA. Najčastejším NET u našich pacientov bol NET tenkého čreva. Histopatologicky, v zmysle diferenciácie nádoru a proliferačnej aktivity hodnotenej Ki-67 indexom, sa jednalo väčšinou o nádory G1, v G2 skupine sa nachádzali štyri pacienti. To zodpovedá zloženiu pacientov vo svetových randomizovaných štúdiách zaberajúcich sa liečbou jednotlivými SSA, ako PROMID a CLARINET [11–13]. Najčastejším nežiadúcim účinkom v súbore našich pacientov bola hnačka, ktorá ale odoznela pár dní po podaní SSA. Čo sa týka prítomnosti cholecystolitiázy, 13 pacientov v období pred diagnostikovaním NET podstúpilo cholecystektómiu. Zvyšní traja podstúpili ultrasonografiu, u jedného bola prítomná asymptomatická cholecystolitiáza.
Vo svetovej literatúre je dostupných niekoľko štúdií zaoberajúcich sa trvaním diagnostického procesu. Napr. v štúdií Basuroya et al stanovili priemernú dobu od objavenia sa prvých príznakov po stanovenie správnej diagnózy 53,8 mesiacov. V tejto štúdií vyšetrili 229 pacientov s NET [13]. V ďalšej štúdii realizovanej Basuroyom porovnávali dĺžku diagnostického procesu u pacientov s pankreatickými NET oproti pacientom s inými gastrointestinálnymi NET. U pacientov s pankreatickými NET bol medián trvania 24 mesiacov, u pacientov s ostatnými typmi NET to bolo 36 mesiacov [14].
Priemerná dĺžka trvania diagnostického procesu v našom súbore bola 10,5 mesiaca. Najdlhší interval trval 3 roky. Najkratší bol u náhodne zistených nádoroch, resp. metastáz u asymptomatických pacientov, ktorým sa diagnostickým procesom podarilo stanoviť origo NET. To je pravdepodobne príčina kratšieho trvania diagnostického procesu v porovnaní s údajmi udávanými vo svetovej literatúre.
Ďalšou z hypotéz bolo, že SSA inhibičným vplyvom na gastrointestinálne hormóny znižujú vstrebávanie vitamínov rozpustných v tukoch. Najprv sme sa zamerali na vitamín D. Vyšetrili sme celkovo 16 našich pacientov. Hladina vitamínu D sa pohybovala v rozmedzí 12,2 – 55,8 ng/ml. U 13 (81,25 %) pacientov bola prítomná hypovitaminóza vitamínu D. Vzhľadom k týmto výsledkom sme teda ďalej predpokladali, že ak je u pacientov prítomná hypovitaminóza vitamínu D, môže byť u týchto pacientov narušená aj rovnováha kalciovo-fosfátového metabolizmu. Vyšetrili sme teda hladinu kalcia, fosforu a parathormónu u všetkých našich pacientov. Tieto hladiny však boli normálne u všetkých našich pacientov, a teda túto hypotézu sme nepotvrdili.
O vzťahu deficitu vitamínov rozpustných v tukoch a liečby SSA je dostupný len jeden článok publikovaný v Aliment Pharmacol Ther. V tejto Fiebrichovej et al štúdii sa zamerali na pacientov s akromegáliou a karcinoidovým syndrómom liečených dlhodobými SSA. Do štúdie zahrnuli 54 pacientov, 19 s akromegáliou a 35 s karcinoidovým syndrómom. U pacientov vyšetrovali plazmatické koncentrácie vitamínu A (retinolu), D, E a K. Priemerná doba liečby SSA bola 48 mesiacov, min. však museli byť pacienti nastavení na túto liečbu 18 mesiacov. Výsledky boli prekvapivé. Abnormálne nízka hladina aspoň jedného zo štyroch vitamínov rozpustných v tukoch bola prítomná u 78 % pacientov. Najčastejšie bol prítomný deficit vitamínu K1. Deficit vitamínu D bol prítomný u 28 % pacientov. U 12 % pacientov s prítomným deficitom vitamínu K1 bol prítomný predĺžený protrombínový čas. Vzťah medzi dĺžkou liečby, dávkou SSA a závažnosť deficitu vitamínov sa nepreukázal [15].
Problémom v našej práci bolo, že v biochemickom laboratóriu UN Martin nemáme k dispozícii stanovenie hladiny vitamínu K, A a E. Deficit vitamínu A ani E sme sa rozhodli neskúmať a nezahrnuli sme ich do našej práce. Čo sa týka prevalencie deficitu vitamínu D, tá bola v našom súbore značne vyššia.
Posledným cieľom bolo stanovenie prevalencie poruchy glukózového metabolizmu (hladiny glykémie nalačno) u pacientov liečených SSA. Hladina glykémie nalačno sa u našich pacientov pohybovala od 4,5 po 7,6 mmol/l. Celkovo sedem (teda 43,76 %) pacientov z nášho súboru malo zvýšenú hladinu glukózy v krvi.
V dostupnej literatúre sa porucha glukózovej tolerancie a rozvoj diabetes mellitus pokladá za veľmi zriedkavý nežiadúci účinok liečby SSA. Mechanizmus tohto účinku vyplýva z prechodnej inhibície inzulínovej sekrécie [16,17].
Limitácie našej práce spočívajú v relatívne malom počte pacientov, heterogenite súboru a absencie kontrolnej skupiny k porovnaniu hladín vitamínu D a glykémií.
Záver
SSA sú bežne používané v paliatívnej liečbe GEP-NET. Z výsledkov našej práce vyplýva, že pacienti s NET liečenými SSA sú pacienti, ktorí pri dobrej odpovedi na liečbu prežívajú relatívne dlho. Liečba týmito preparátmi prináša určité úskalia, na ktoré treba myslieť. Preto by títo pacienti mali byť pravidelne dispenzarizovaní u internistov, gastroenterológov a onkológov. Výsledky našej práce poukázali na relatívne vysokú prevalenciu hypovitaminózy D (u 81,25 % pacientov). Taktiež sme u značnej časti pacientov dokázali zvýšenú hladinu glykémie nalačno.
Vo všeobecnosti sa však dá povedať, že liečba SSA je bezpečná a má minimálne nežiaduce účinky. Najdôležitejšie je na možnosť týchto nežiaducich účinkov myslieť, preto by pacienti nastavení na liečbu SSA mali aspoň 1× ročne podstúpiť štandardné biochemické vyšetrenie krvi, vyšetrenie hladiny vitamínu D, elektrokardiografické vyšetrenie a abdominálnu ultrasonografiu.
Doručené/Submitted: 12. 6. 2020
Prijaté/Accepted: 15. 7. 2020
MUDr. Peter Bánovčin, PhD.
Interná klinika gastroenterologická
JLF UK a UN Martin
Kollárova 2
036 01 Martin
Slovenská republika
Konflikt záujmov: Autori deklarujú, že text článku zodpovedá etickým štandardom, bola dodržaná anonymita pacientov, a vyhlasujú, že v súvislosti s predmetom článku
nemajú finančné, poradenské ani iné komerčné záujmy.
Publikačná etika: Príspevok nebol doteraz publikovaný ani nie je v súčasnosti zaslaný do iného časopisu na posúdenie. Autori súhlasí s uverejnením svojho mena a e-mailového
kontaktu v publikovanom texte.
Dedikácia: Táto práca bola podporovaná Ministerstvom zdravotníctva Slovenskej republiky v rámci projektu s registračným číslom 2019/ 44-UKMT-7.
Redakčná rada potvrdzuje, že rukopis práce splnil ICMJE kritériá pre publikácie zasielané do bio medicínskych časopisov.
Conflict of Interest: The authors declare that the article/ manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no
financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/ manuscript has not been published or is currently being submitted for another review. The authors agree to publish their name and e-mail in
the published article/ manuscript.
Dedication: This work was supported by the Ministry of Health of the Slovak Republic within the project with registration number 2019/ 44-UKMT-7.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for bio medical papers.
Sources
1. Kloppel G, Perren A, Heitz PU et al. The gastroenteropancreatic neuroendocrine cell system and its tumors: the WHO classification. Ann N Y Acad Sci 2004; 1014 : 13–27. doi: 10.1196/annals.1294.002.
2. Hyrdel R. Endokrinné nádory tráviaceho traktu. In: Hrnčiar J et al. Endokrinné a hormonálno-metabolické choroby: ich racionálna diagnostika a komplexná liečba. Banská Bystrica: CentroMedian 2000 : 171–194.
3. Yao JC, Hassan M, Phan A et al. One hundred years after “carcinoid” epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol 2008; 26 (18): 3063–3072. doi: 10.1200/JCO.2007.15.4377.
4. Lamberts SW, Krenning E, Reubi JC. The role of somatostatin and its analogs in the diagnosis and tretamnet of tumors. Endocr Rev 1991; 12 (4): 450–482. doi: 10.1210/edrv-12-4-450.
5. Oberg K. Somatostatin analog octreotide LAR in gastro-entero-pancreatic tumors. Expert Rev Anticancer Ther 2009; 9 (5): 557–566. doi: 10.1586/era.09.26.
6. Öberg K, Ferone D, Kaltsas G et al. ENETS consensus guidelines for the standards of care in neuroendocrine tumors: biotherapy. Neuroendocrinology 2009; 90 (2): 209–213. doi: 10.1159/000183751.
7. Caplin ME, Pavel M, Ćwikła JB et al. Anti-tumour effects of lanreotide for pancreatic and intestinal neuroendocrine tumours: the CLARINET open-label extension study. Endocr Relat Cancer 2016; 23 (3): 191–199. doi: 10.1530/ERC-15-0490.
8. Kulke MH. Somatostatin analogues in neuroendocrine tumors. J Natl Compr Canc Netw 2016; 14 (3): 241–242. doi: 10.6004/jnccn.2016.0029.
9. Modlin IM, Pavel M, Kidd M et al. Review article: somatostatin analogues in the treatment of the gastroenteropancreatic neuroendocrine (carcinoid) tumours. Aliment Pharmacol Ther 2010; 31 (2): 169–188. doi: 10.1111/j.1365 - 2036.2009.04174.x.
10. Massironi S, Conte D, Rossi RE. Somatostatin analogues in functioning gastroenteropancreatic neuroendocrine tumours: literature review, clinical recommendations and schedules. Scand J Gastroenterol 2015; 51 (1): 513–523. doi: 10.3109/00365521.2015.1115117.
11. Rinke A, Müller HH, Schade-Brittinger C et al. Placebo-controlled, double-blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: a report from the PROMID Study Group. J Clin Oncol 2009; 27 (28): 4656–4663. doi: 10.1200/JCO.2009.22.8510.
12. Rubin J, Ajani J, Schirmer W et al. Octreotide acetate long-acting formulation versus open-label subcutaneous octreotide acetate in malignant carcinoid syndrome. J Clin Oncol 1999; 17 (2): 600–606. doi: 10.1200/JCO.1999.17. 2.600.
13. Basuroy R, Bouvier C, Ramage JK et al. Delays and routes to diagnosis of neuroendocrine tumours. BMC Cancer 2018; 18 (1): 1122. doi: 10.1186/s12885-018-5057-3.
14. Basuroy R, Bouvier C, Ramage JK et al. Presenting symptoms and delay in diagnosis of gastrointestinal and pancreatic neuroendocrine tumours. Neuroendocrinology 2018; 107 (1): 42–49. doi: 10.1159/000488510.
15. Fiebrich HB, van den Berg G, Kema IP et al. Deficiencies in fat-soluble vitamins in long-term users of somatostatin analogue. Aliment Pharmacol Ther 2010; 32 (11–12): 1398–1404. doi: 10.1111/j.1365-2036.2010.044 79.x.
16. Grasso LF, Auriemma RS, Pivonello R et al. Adverse events associated with somatostatin analogs in acromegaly. Expert Opin Drug Saf 2015; 14 (8): 121–126. doi: 10.1517/14740338.2 015.1059817.
17. O’Toole D, Ducreux M, Bommelaer G et al. Treatment of carcinoid syndrome: a prospective crossover evaluation of lanreotide versus octreotide in terms of efficacy, patient acceptability, and tolerance. Cancer 2000; 88 (4): 770–776. doi: 10.1002/ (sici) 1097-0142 (20000215) 88 : 4<770:: aid-cncr6>3.0.co; 2-0.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

-
All articles in this issue
- Gastroenterologie v době pandemie covid-19
- Gastrointestinální onkologie
- Kvíz z klinické praxe
- Prediktory pokročilé kolorektální neoplazie ve screeningu kolorektálního karcinomu – průběžné výsledky multicentrické prospektivní studie
- Fenotyp akútneho hepatálneho zlyhania pri inaparentnom malobunkovom karcinóme pľúc
- Prevalencia hypovitaminózy D a poruchy glukózovej tolerancie u pacientov s neuroendokrinnými tumormi podstupujúcich liečbu somatostatínovými analógmi
- Covid-19 a hepatogastroenterologie
- Srdeční selhání u pacientky s cirhotickou kardiomyopatií jako neobvyklá indikace k transplantaci jater
- První použití single-use duodenoskopu v České republice
- Inhibitory protonové pumpy – známe je dobře? Jsou skutečně tak bezpečné? – část 1
- Kreditovaný autodidaktický test: gastrointestinální onkologie
- Prof. MUDr. Jiří Ehrmann, CSc., osmdesátiletý
- Nová členka redakční rady MUDr. Kristýna Zárubová
- Výběr z mezinárodních časopisů
- Budesonid v léčbě idiopatických střevních zánětů
- Primární biliární cholangitida – zacíleno na farnesoidní X receptor
- Správná odpověď na kvíz Endometrióza postihující serózní povrch (okruží) terminálního ilea
- Surveillance hepatocelulárneho karcinómu na Slovensku
- Současné možnosti predikce léčebné odpovědi na neoadjuvantní chemoradioterapii u karcinomu konečníku
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Budesonid v léčbě idiopatických střevních zánětů
- Inhibitory protonové pumpy – známe je dobře? Jsou skutečně tak bezpečné? – část 1
- Nová členka redakční rady MUDr. Kristýna Zárubová
- Prediktory pokročilé kolorektální neoplazie ve screeningu kolorektálního karcinomu – průběžné výsledky multicentrické prospektivní studie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

