-
Medical journals
- Career
Prediktory pokročilé kolorektální neoplazie ve screeningu kolorektálního karcinomu – průběžné výsledky multicentrické prospektivní studie
Authors: Grega T. 1; Vojtěchová G. 1; O. Ngo 2,3; Ambrožová M. 3; Voška M. 1; O. Májek 2,3; Jirkovská J. 1; Zavoral M. 1; Nek . Sucha S 1
Authors‘ workplace: Interní klinika 1. LF UK a ÚVN Praha 2 Institut biostatistiky a analýz LF MU, Brno 3 Ústav zdravotnických informací a statistiky ČR, Praha 1
Published in: Gastroent Hepatol 2020; 74(5): 386-392
Category: Gastrointestinal Oncology: Original Article
Overview
Úvod: Výskyt pokročilé kolorektální neoplazie ve screeningové populaci vykazuje velkou diverzitu s prevalencí 3–12 %. Vzhledem k nerovnoměrnému rozložení v populaci jsou hledány potenciální rizikové faktory, které by umožňovaly stratifikaci jedinců dle míry rizika kolorektální neoplazie. Cíl: Hodnocení potenciálních rizikových faktorů asociovaných s výskytem pokročilé kolorektální neoplazie ve screeningové populaci. Metodika: Do analýzy byli zahrnuti asymptomatičtí jedinci ve věku 45–75 let, kteří podstoupili preventivní koloskopii v letech 2012–2016 v rámci multicentrické prospektivní studie sledující metabolické rizikové faktory kolorektálního karcinomu (MRF KRK studie). Byly provedeny základní popisné statistiky dat. Srovnání potenciálních rizikových faktorů asociovaných s výskytem pokročilé kolorektální neoplazie bylo provedeno pomocí Fisherova exaktního testu. Výsledky: Do studie bylo zahrnuto celkem 1 967 jedinců; 1 108 mužů (56,3 %) a 859 žen (43,7 %); průměrný věk jedinců byl 60 let. Celkem 59,7 % osob bylo referováno k primární screeningové koloskopii (1 174 osob) a 793 osob (40,3 %) podstoupilo koloskopii po pozitivním testu na okultní krvácení do stolice (TOKS). Celkový počet pokročilých kolorektálních neoplazií v souboru byl 11,8 % (233 jedinců). Mezi potenciální rizikové faktory asociované s pokročilou kolorektální neoplazií patřily věk (p < 0,001), mužské pohlaví (p = 0,001), kouření (p < 0,001), sérová koncentrace triglyceridů (p = 0,029; zejména koncentrace > 2 mmol/l) a nízká hladina vitaminu D (p = 0,033). Jedná se o předběžné výsledky, které budou podrobně zkoumány v navazující analýze dat pomocí logistické regrese. Závěr: Potenciálně nejsilnějšími faktory asociovanými s pokročilou kolorektální neoplazií byly věk, pohlaví a kouření. Kromě těchto faktorů byla signifikantně asociovaná s výskytem pokročilé kolorektální neoplazie sérová koncentrace triglyceridů a nízká hladina vitaminu D. U jedinců s vyšším výskytem pokročilých kolorektálních neoplazií dle daných faktorů by měla být zvažována primárně screeningová koloskopie.
Klíčová slova:
kolorektální neoplazie – rizikové faktory – screening – koloskopie – metabolický syndrom
Úvod
Kolorektální karcinom (KRK) patří mezi nejčastější příčiny celkové morbidity a mortality ve vyspělých zemích [1]. Přirozený vývoj sporadického KRK je víceletý proces a obvykle probíhá cestou prekancerózních adenomových lézí [2]. Časná detekce a endoskopická resekce prekancerózních lézí je spojena s poklesem incidence KRK. Kromě prekancerózních lézí umožňuje screening detekci časných stadií KRK, které jsou lépe léčitelné v porovnání s pokročilým KRK [3]. Zlatým standardem screeningového vyšetření tlustého střeva je koloskopie. Ačkoli je koloskopie vysoce efektivní, její celoplošné použití je limitováno dostupností lidských a ekonomických zdrojů, nižší mírou adherence cílové populace a vyšší mírou komplikací v porovnání s neinvazivními testy na okultní krvácení (TOKS) [4]. Na základě těchto limitací jsou hledány klinické, laboratorní a genetické prediktory, které by umožnily stratifikaci rizika kolorektální neoplazie v běžné populaci. Stratifikace jedinců na vyšší nebo nižší riziko kolorektální neoplazie je krokem k personalizovanému screeningu KRK. Stratifikace umožňuje na základě rizikovosti pacienta zahájit screening v mladším nebo starším věku, včetně určení optimálních intervalů pro další koloskopie. Recentně byla vyvinuta řada prediktivních skórovacích systémů kolorektální neoplazie, nicméně pro výrazně heterogenní výsledky není většina z nich uplatňována v běžné klinické praxi. Výjimku představuje Asijsko-pacifický skórovací systém (APCS – Asia-Pacific Colorectal Cancer Score), který je běžně využíván v jihovýchodní Asii [5]. Tento bodovací systém stratifikuje asymptomatické jedince na základě přítomnosti čtyř rizikových faktorů:
věk;
pohlaví;
rodinná anamnéza;
přítomnost kouření.
Systém APCS je jednoduchý a mohou ho používat praktičtí lékaři nebo zdravotní sestry. Asymptomatičtí jedinci s vyšším rizikem kolorektální neoplazie jsou na základě APCS referováni ke koloskopickému screeningu, zatímco pacienti s běžným nebo středním rizikem podstupují TOKS.
V posledních letech se hromadí důkazy o zvýšeném riziku kolorektální neoplazie u pacientů s metabolickým syndromem (MS) [6]. Vzhledem k narůstající incidenci MS v západních zemích jsou kromě věku, pohlaví, rodinné anamnézy a kouření zkoumány složky MS jako prediktivní faktory k identifikaci jedinců s vyšším rizikem kolorektální neoplazie. Podle definice z roku 2009 je MS definován jako stav splňující tři nebo více kritérií z následujících:
centrální/abdominální obezita měřená jako obvod pasu (u mužů > 102 cm, u žen > 88 cm);triglyceridy nalačno > 1,7 mmol/l;
nízký HDL cholesterol (u mužů < 1,0 mmol/l, u žen < 1,3 mmol/l);
arteriální hypertenze (≥ 130/85 mm Hg);glykemie nalačno ≥ 5,6 mmol/l;
diagnostikovaný diabetes mellitus 2. typu [7].Cílem naší studie bylo stanovení asociace faktorů metabolického syndromu a dalších potenciálních faktorů (věk, pohlaví, přítomnost kouření, hladina vitaminu D a přítomnost medikace statinem, kyselinou acetylsalicylovou [ASA], inzulinem anebo metforminem) asociovaných s výskytem pokročilé kolorektální neoplazie v asymptomatické screeningové populaci.
Metodika
Do analýzy byli zahrnuti asymptomatičtí jedinci s běžným rizikem kolorektální neoplazie ve věku 45–75 let, kteří podstoupili screeningovou nebo TOKS pozitivní koloskopii mezi lety 2012 a 2016 v rámci multicentrické prospektivní studie sledující metabolické rizikové faktory KRK (MRF KRK studie). Podrobný popis metodiky včetně sledovaných cílů této studie byl publikován v roce 2016 [6]. Z analýzy byli vyřazeni jedinci s vysokým rizikem kolorektální neoplazie, kteří měli pozitivní rodinnou nebo osobní anamnézu, event. familiární hereditární syndromy. Dále byly vyřazeny osoby s přítomností alarmujících symptomů a se zánětlivým střevním onemocněním. Před samotným endoskopickým vyšetřením bylo provedeno měření krevního tlaku a krevní odběry (krevní obraz, koagulace a biochemické vyšetření včetně vitaminu D, lipidového a glukózového metabolizmu včetně glykovaného hemoglobinu). Koloskopie byla prováděna standardním postupem dle doporučení České gastroenterologické společnosti ČLS JEP [8]. Po absolvování koloskopie se provádělo antropometrické měření (obvod pasu, hmotnost, výška), stanovení indexu tělesné hmotnosti (BMI – body mass index). Následně všichni jedinci vyplnili dotazník zaměřený na informace o kouření, přítomnosti poruchy glukózového metabolizmu (diabetes mellitus 2. typu nebo prediabetes na základě orálního glukózového tolerančního testu) a užívané medikace (statiny, ASA, u diabetiků metformin a inzulin). Pokročilá kolorektální neoplazie byla definována jako adenom velikosti > 10 mm a/nebo adenom s vilózní složkou a/nebo s těžkou dysplazií.
Data byla analyzována a prezentována prostřednictvím základních popisných statistik. Hodnocení faktorů souvisejících s výskytem pokročilé kolorektální neoplazie bylo provedeno pomocí Fisherova exaktního testu. Hladina významnosti testu byla stanovena na 0,05. Analýza byla provedena ve statistickém softwaru STATA/IC 15.
Výsledky
Soubor pacientů
Celkem bylo osloveno 2 362 jedinců, z toho 10 jedinců odmítlo účast a 33 jedinců nesplňovalo věkové vstupní kritérium (45–75 let). Po vyřazení jedinců s nekompletními záznamy bylo do finální analýzy zařazeno 1 967 jedinců: 1 108 mužů (56,3 %) a 859 žen (43,7 %) s průměrným věkem 60 let (tab. 1). Počet jedinců s obezitou charakterizovanou jako BMI > 30 kg/m2 byl 587 (29,8 %). V souboru bylo celkem 514 (26,1 %) jedinců s poruchou glukózového metabolizmu: diabetes mellitus 2. typu (T2DM) a prediabetes. Celkem 504 osob (25,6 %) přiznalo, že dříve kouřilo cigarety, ale nyní již nekouří, a 364 osob (18,5 %) udávalo aktivní kouření cigaret. Většina jedinců byla referovaná k primární screeningové koloskopii (1 174 jedinců; 59,7 %) a 793 jedinců (40,3 %) podstoupilo TOKS pozitivní koloskopii. Podíl vybrané medikace v souboru pacientů (statiny, ASA, u diabetiků metformin a inzulin) je uveden v tab. 2.
Table 1. Celková charakteristika jedinců v souboru.
Tab. 1. Overall characteristics of individuals in the group.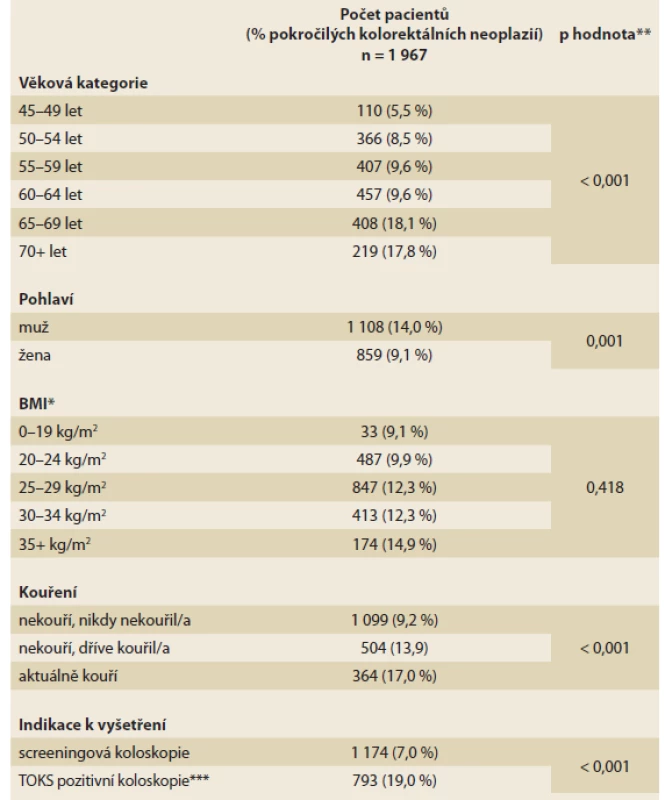
*u 13 pacientů nebyly vyplněny údaje o BMI, **p hodnota získána pomocí Fisherova exaktního testu,
***TOKS – test na okultní krvácení do stolice.Table 2. Farmakologická anamnéza.
Tab. 2. Pharmacological history.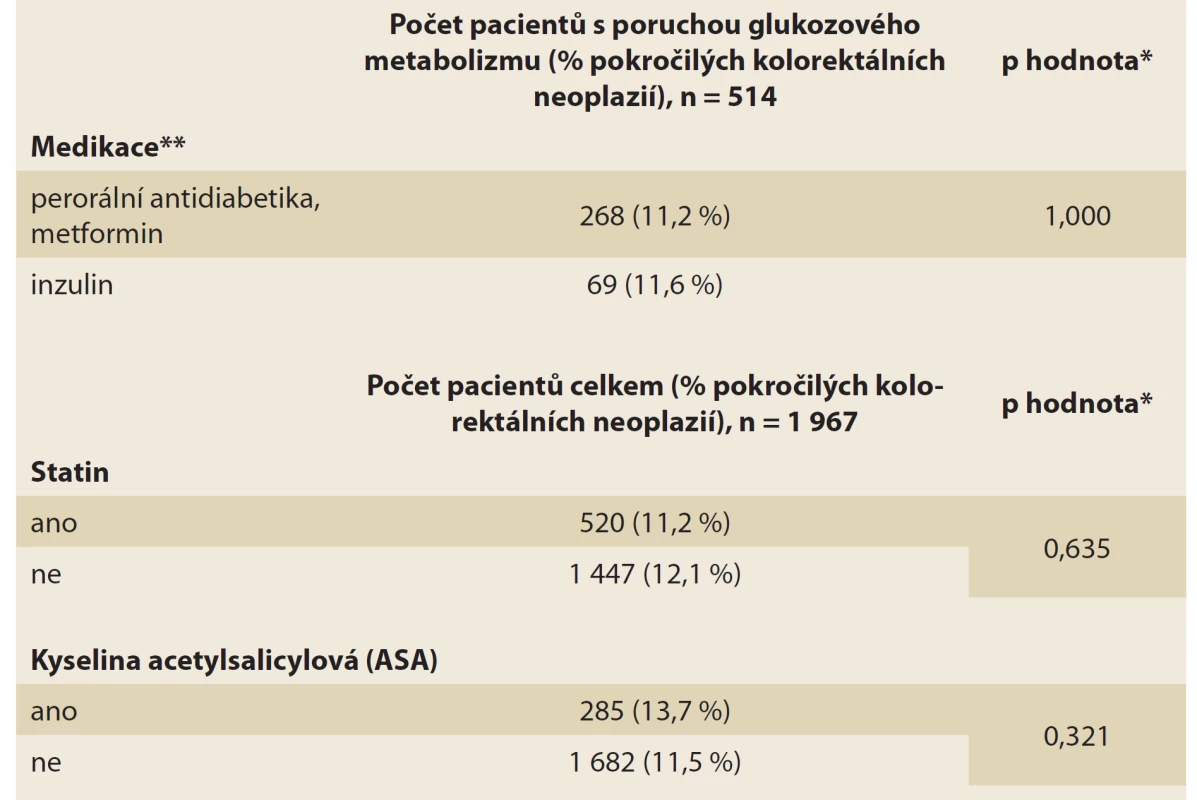
*p hodnota získána pomocí Fisherova exaktního testu, **chybí údaje o medikaci u 177 záznamů, byli srovnáváni diabetici užívající perorální antidiabetika či metformin a diabetici užívající inzulin vs. výskyt pokročilých kolorektálních neoplazií u těchto pacientů. Potenciální faktory asociované s pokročilou kolorektální neoplazií
Celkový počet pokročilých kolorektálních neoplazií ve studovaném souboru jedinců představoval 11,8 % (233 jedinců). Výskyt pokročilých kolorektálních neoplazií se statisticky významně lišil u parametrů:
věk (p < 0,001);
pohlaví (p = 0,001);
kouření (p < 0,001);
sérová koncentrace triglyceridů (p = 0,029);hladina vitaminu D (p = 0,033).
Hodnota BMI a užívaná medikace (statiny, ASA, u diabetiků inzulin a metformin) nebyly signifikantně asociovány s pokročilou kolorektální neoplazií. Při analýze jedinců s poruchou glukózového metabolizmu bylo z předběžných výsledků sledováno, že výskyt pokročilé kolorektální neoplazie byl signifikantně asociován s hladinou glykovaného hemoglobinu (p = 0,031), nikoli s vyšší glykemií nalačno (p = 0,368) (tab. 3).
Tab. 3a. Laboratorní hodnoty a jejich asociace s pokročilou kolorektální neoplazií.
Tab. 3a. Laboratory values and their association with advanced colorectal neoplasia.
*u těchto parametrů chybí údaje: glykemie nalačno (n = 17), glykovaný hemoglobin (n = 100), vitamin D (n = 297),**p hodnota získána pomocí Fisherova exaktního testu. Tab. 3b. Laboratorní hodnoty a jejich asociace s pokročilou kolorektální neoplazií.
Tab. 3b. Laboratory values and their association with advanced colorectal neoplasia.
*u 18 pacientů nebyl vyplněn údaj o triglyceridech, **p hodnota získána pomocí Fisherova exaktního testu. Diskuze
Cílem předkládané prospektivní multicentrické studie byla analýza potenciálních faktorů asociovaných s výskytem pokročilé kolorektální neoplazie v asymptomatické screeningové populaci. Z hlediska rizikovosti prekancerózních lézí jsou nejvýznamnější pokročilé adenomy charakterizované jako adenomy velikosti > 10 mm a/nebo adenomy s vilózní složkou či s vysokým stupněm dysplazie. Výskyt pokročilé kolorektální neoplazie v populaci s běžným rizikem vykazuje velkou diverzitu a její prevalence v běžné populaci se uvádí kolem 3–12 % [9–11]. Za nejsilnější a univerzální rizikový faktor kolorektální neoplazie je považován věk > 50 let, který je indikátorem zahájení screeningu KRK u většiny screeningových programů v Evropě i ve světě. Vzhledem k nerovnoměrnému rozložení pokročilé kolorektální neoplazie v populaci jsou hledány potenciální rizikové faktory, které by umožňovaly stratifikaci jedinců dle měřitelných proměnných. Jsou vytvářeny různé skórovací modely predikce kolorektální neoplazie, nicméně jejich hlavní limitací je chybění validace v heterogenní populaci, která nejvíce imituje realitu. V klinické praxi je nejvíce využíván APCS v jihovýchodní Asii [5]. Tento bodovací systém stratifikuje asymptomatické jedince na základě přítomnosti čtyř rizikových faktorů – věk, pohlaví, rodinná anamnéza a přítomnost kouření.
V rámci analýzy bylo hodnoceno 1 967 preventivních koloskopií u jedinců s běžným rizikem kolorektální neoplazie. Za potenciální rizikové faktory jsme kromě věku, pohlaví a kouření vybrali složky metabolického syndromu a další potenciální rizikové faktory (hladina vitaminu D a přítomnost medikace statinem, ASA, inzulinem nebo metforminem).
Celkový počet pokročilých kolorektálních neoplazií v souboru 1 967 jedinců představoval 11,8 % (233 jedinců). Podíl pokročilých kolorektálních neoplazií v našem souboru byl v porovnání s literárně uváděnými daty (3–12 %) srovnatelný.
Mezi potenciální faktory statisticky významně asociované s pokročilou kolorektální neoplazií patřily věk, pohlaví, kouření, sérová koncentrace triglyceridů a nízká hladina vitaminu D. Hodnota BMI a užívaná medikace (statiny, ASA, u diabetiků inzulin a metformin) nebyla signifikantně asociována s pokročilou kolorektální neoplazií.
Ve shodě s APCS byla v našem souboru prokázána významná asociace kolorektální neoplazie s věkem, mužským pohlavím a kouřením. Věk a mužské pohlaví patří mezi základní neovlivnitelné rizikové faktory kolorektální neoplazie. Typický věk českého pacienta s KRK se pohybuje v rozmezí 61–77 let, nicméně až 20,5 % všech nemocných je mladších 60 let. Věková struktura populace pacientů s tímto onemocněním dokládá nárůst diagnostikovaných KRK ve věku > 50 let. Ve věkové skupině 50–54 let činí 6,3 %, ve věku 55–59 let již 9,9 % a maxima (17,6 %) dosahuje ve věku 70–74 let [12]. Mužské pohlaví je spojeno s téměř dvojnásobně vyšším rizikem pokročilé kolorektální neoplazie [13]. Ve srovnávacích epidemiologických analýzách o incidenci a mortalitě vztažených k pohlaví bylo prokázáno, že ženy dosáhly ekvivalentní hodnoty 10letého kumulativního rizika výskytu KRK o 4–8 let později v porovnání s muži ve věku 50, 55 a 60 let [14]. Screeningové studie také prokázaly, že během šestého decennia mají ženy nižší absolutní riziko pokročilé kolorektální neoplazie než muži [15,16]. V souladu s dříve publikovanými zahraničními daty bylo kouření signifikantně asociováno s výskytem pokročilé kolorektální neoplazie. Dle rozsáhlé metaanalýzy z roku 2008 bylo kouření spojeno s dvojnásobným rizikem adenomových polypů [17].
Porucha metabolizmu glukózy s inzulinovou rezistencí je považována za rizikový faktor pro rozvoj KRK. Tato skutečnost je založena na hypotéze, že hyperinzulinemie podporuje karcinogenezi v tlustém střevě na podkladě zvýšené produkce inzulinu podobného růstového faktoru 1. Ten působí jako antiapoptický a mitogenní faktor [18,19]. Epidemiologické studie podporují teorii, že T2DM je rizikový faktor KRK [20,21]. Nicméně, práce zaměřené na asociaci hladin inzulinu, glykemie nalačno či glykovaného hemoglobinu s výskytem KRK vykazují nekonzistentní výsledky [22,23]. V rámci naší analýzy jsme u jedinců s poruchou glukózového metabolizmu (T2DM a prediabetes) pozorovali inverzní vztah s výskytem kolorektální neoplazie a hladiny glykovaného hemoglobinu (p = 0,031). Tyto výsledky nejsou v souladu s dosud publikovanými daty. Domníváme se, že jde o chybu v důsledku analýzy malého počtu pacientů a heterogenity analyzované skupiny jedinců (kombinace pacientů s T2DM a prediabetem). Rozsáhlá práce z roku 2011 prokázala, že zvýšena hladina glykovaného hemoglobinu je ve srovnání se sérovou hladinou glykemie nalačno silnějším a nezávislým rizikovým faktorem kolorektální neoplazie [24].
Dle předběžných výsledků patří mezi další potenciální faktory v našem souboru signifikantně asociované s kolorektální neoplazií zvýšená hladina triglyceridů. Výsledky epidemiologických studií porovnávající asociaci sérových hladin triglyceridů a HDL cholesterolu s výskytem KRK jsou nekonzistentní [25]. Některé prospektivní studie uvádějí významnou asociaci mezi vysokou hladinou triglyceridů a KRK u mužů [26]. Recentní přehledové práce podporují silnější asociaci triglycerolemie s výskytem kolorektálních adenomů než karcinomů [27]. Vztah hladiny HDL cholesterolu s kolorektální neoplazií bude předmětem další podrobnější analýzy. V evropské prospektivní studii byly vysoké koncentrace HDL v séru spojeny se sníženým rizikem karcinomu tračníku, nikoli však karcinomu rekta [28].
Nález inverzního vztahu hladiny vitaminu D s výskytem pokročilé kolorektální neoplazie v našem souboru byl v korelaci s americkou metaanalýzou, která potvrdila nižší riziko kolorektální neoplazie u jedinců s vyšším příjmem vitaminu D [29]. Zatímco vyšší příjem vitaminu D v potravě byl spojen s 11% redukcí rizika kolorektální neoplazie, nález vyšších sérových hladin celkového vitaminu D (25-hydroxyvitamin D) byl spojen s 30% redukcí rizika kolorektální neoplazie. Některé studie také naznačují, že inverzní vztah mezi příjmem vitaminu D a rizikem kolorektální neoplazie může být silnější v případě vyššího příjmu vápníku v potravě [30].
Hodnota BMI nebyla v našem souboru pacientů signifikantně asociovaná s výskytem kolorektální neoplazie. Několik systematických přehledů a metaanalýz ukázalo, že relativní riziko KRK asociovaného s obezitou definovanou BMI ≥ 30 kg/m2 bylo vyšší pro karcinom tračníku a mužské pohlaví. Abdominální obezita charakterizovaná obvodem pasu (u mužů > 102 cm a u žen > 88 cm) nebo poměrem obvodu pasu a boků, tzv. waist to hip ratio (WHR), vykazovala silnější asociaci s KRK u obou pohlaví [31]. Výsledky těchto studií naznačují, že viscerální tuková tkáň je více asociována s vývojem a progresí kolorektálního adenomu a měření WHR je vhodnější pro hodnocení rizika kolorektální neoplazie.
Přítomnost arteriální hypertenze nebyla asociována s výskytem kolorektální neoplazie a ani v zahraniční literatuře není prokázána přímá souvislost tohoto rizikového faktoru ve vztahu ke kolorektální neoplazii [28].
Žádný ze sledovaných léků (statiny, ASA, inzulin, metformin) nebyl významně spojen s výskytem kolorektální neoplazie. Důvodem může být jednak absence informací ohledně dávkování a délky užívání jednotlivých léků a také nezahrnutí typu inzulinu do naší analýzy. Například ASA snižuje podle řady studií prevalenci KRK o 20–40 % [32], nicméně redukce rizika kolorektální neoplazie je signifikantní při užívání nejméně 325 mg aspirinu denně po dobu nejméně 5 let. Studií podporujících chemopreventivní roli statinů v kolorektální neoplazii je relativně málo a jsou téměř výlučně retrospektivního charakteru [33]. Na základě těchto observačních studií se vliv užívání statinů na kolorektální neoplazii jeví spíše jako neutrální. Nelze však vyloučit jejich pozitivní vliv u jedinců s dyslipidemií při vyšším dávkování a užívání po delší dobu. Potenciálně pozitivní vliv metforminu na redukci rizika kolorektální neoplazie byl prokázán v mnoha observačních studiích [34]. Jeho užívání však bylo limitováno nežádoucími účinky, zejména vznikem laktátové acidózy nebo gastrointestinální intolerancí (průjem). Úplné objasnění optimální dávky chemopreventivního účinku metforminu v karcinogenezi KRK je předmětem probíhajících dlouhodobých klinických studií na velkém souboru pacientů [35]. Obdobně inzulinová terapie byla zkoumána v mnoha observačních studiích jako potenciálně riziková medikace, která může vést k zvýšenému riziku kolorektální neoplazie. Nicméně, výsledky studií jsou značně inkonzistentní. Recentní metaanalýza 12 epidemiologických studií zahrnujících celkem 7 947 případů KRK a 491 384 účastníků prokázala zvýšení rizika KRK u jedinců s inzulinovou terapií [36].
Závěr
V souboru 1 967 asymptomatických jedinců s provedenou preventivní koloskopií ve věku 45–75 let bylo nalezeno 11,8 % pokročilých kolorektálních neoplazií. Z předběžných výsledků analýzy bylo identifikováno pět faktorů asociovaných s výskytem pokročilých kolorektálních neoplazií. Mezi tyto faktory patřily věk, pohlaví, kouření, zvýšená sérová koncentrace triglyceridů a nízká hladina vitaminu D. Jedincům s těmito rizikovými faktory by měla být věnována zvýšená pozornost a v rámci screeningového programu nabídnuta primárně screeningová koloskopie. Výsledky studie jsou prozatím předběžné a budou nadále zkoumány podrobnější analýzou dat.
Poděkování
Rádi bychom poděkovali všem lékařům (Karel Balihar, Nagyija Brogyuk, Jan Bureš, Klára Kmochová, Norbert Král, Eva Kundratová, Petra Mináriková, Filip Neumann, Milana Šáchlová, Bohumil Seifert, Olga Shonová, Svatopluk Solař, Julius Špičák, Ondřej Urban, Petr Volšanský), zdravotním sestrám, administrativním pracovnicím (Simona Birtová a Barbara Nápravová), kteří se významně podíleli na studii sledující metabolické rizikové faktory KRK (MRF KRK studie).
Submitted: 22. 9. 2020
Accepted: 1. 10. 2020
MUDr. Tomáš Grega
Oddělení gastrointestinální endoskopie
Interní klinika 1. LF UK a ÚVN Praha
U Vojenské nemocnice 1200
169 02 Praha 6
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašují, že v souvislosti s předmětem článku nemají
finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení. Autoři souhlasí s uveřejněním svého jména a e-mailového
kontaktu v publikovaném textu.
Dedikace: Studie byla podpořena granty 17-31909A, NV18-08-00246, MO1012 a Progres Q28 / LF1.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Conflict of Interest: The authors declare that the article/ manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no
financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/ manuscript has not been published or is currently being submitted for another review. The authors agree to publish their name and e-mail in
the published article/manuscript.
Dedication: The article/ manuscript is supported by grants 17-31909A, NV18-08-00246, MO1012 and Progres Q28 / LF1.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers
Sources
1. Ferlay J, Soerjomataram I, Dikshit R et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136 (5): E359–E386. doi: 10.1002/ijc.29210.
2. Brenner H, Altenhofen L, Stock C et al. Natural history of colorectal adenomas: birth cohort analysis among 3.6 million participants of screening colonoscopy. Cancer Epidemiol Biomark Prev 2013; 22 (6): 1043–1051. doi: 10.1158/1055-9965.EPI-13-0162.
3. Nishihara R, Wu K, Lochhead P et al. Long-term colorectal-cancer incidence and mortality after lower endoscopy. N Engl J Med 2013; 369 (12): 1095–1105. doi: 10.1056/NEJMoa1301969.
4. Lansdorp-Vogelaar I, Knudsen AB, Brenner H. Cost-effectiveness of colorectal cancer screening. Epidemiol Rev 2011; 33 (1): 88–100. doi: 10.1093/epirev/mxr004.
5. Yeoh KG, Ho KY, Chiu HM et al. The Asia-Pacific Colorectal Screening score: a validated tool that stratifies risk for colorectal advanced neoplasia in asymptomatic Asian subjects. Gut 2011; 60 (9): 1236–1241. doi: 10.1136/gut.2010.221168.
6. Suchanek S, Grega T, Ngo O et al. How significant is the association between metabolic syndrome and prevalence of colorectal neoplasia? World J Gastroenterol 2016; 22 (36): 8103–8111. doi: 10.3748/wjg.v22.i36.8103.
7. Alberti KG, Eckel RH, Grundy SM et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation 2009; 120 (16): 1640–1645. doi: 10.1161/CIRCULATIONAHA.109.192644.
8. Falt P, Urban O, Suchanek Š et al. Doporučené postupy České gastroenterologické společnosti ČLS JEP pro diagnostickou a terapeutickou koloskopii. Gastroent Hepatol 2016; 70 (6): 523–538. doi: 10.14735/amgh2016csgh.info19.
9. Sung JJ, Chan FK, Leung WK et al. Screening for colorectal cancer in Chinese: comparison of fecal occult blood test, flexible sigmoidoscopy, and colonoscopy. Gastroenterology 2003; 124 (3): 608–614. doi: 10.1053/gast.2003.50090.
10. Soon MS, Kozarek RA, Ayub K et al. Screening colonoscopy in Chinese and Western patients: a comparative study. Am J Gastroenterol 2005; 100 (12): 2749–2755. doi: 10.1111/j.1572-0241.2005.00355.x.
11. Chiu HM, Wang HP, Lee YC et al. A prospective study of the frequency and the topographical distribution of colon neoplasia in asymptomatic average-risk Chinese adults as determined by colonoscopic screening. Gastrointest Endosc 2005; 61 (4): 547–553. doi: 10.1016/s0016-5107 (05) 00121-5.
12. Schneiderová M, Bencko V. Colorectal cancer – contemporary view on risk and protective factors, chances of prevention. Onkologie 2015; 9 (4): 178–182.
13. Nguyen SP, Bent S, Chen YH et al. Gender as a risk factor for advanced neoplasia and colorectal cancer: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2009; 7 (6): 676–681. doi: 10.1016/j.cgh.2009.01.008.
14. Brenner H, Hoffmeister M, Arndt V et al. Gender differences in colorectal cancer: implications for age at initiation of screening. Br J Cancer 2007; 96 (5): 828–831. doi: 10.1038/sj.bjc.6603628.
15. Regula J, Rupinski M, Kraszewska E et al. Colonoscopy in colorectal-cancer screening for detection of advanced neoplasia. N Engl J Med 2006; 355 (18): 1863–1872. doi: 10.1056/ NEJMoa054967.
16. Schoenfeld P, Cash B, Flood A et al. Colonoscopic screening of average-risk women for colorectal neoplasia. N Engl J Med 2005; 352 (20): 2061–2068. doi: 10.1056/NEJMoa042 990.
17. Botteri E, Iodice S, Raimondi S et al. Cigarette smoking and adenomatous polyps: a meta-analysis. Gastroenterology 2008; 134 (2): 388–395. doi: 10.1053/j.gastro.2007.11.007.
18. Ozasa K, Ito Y, Suzuki K et al. Glucose intolerance and colorectal cancer risk in a nested case-control study among Japanese People. J Epidemiol 2005; 15 (Suppl 2): S180–S184. doi: 10.2188/jea.15. s180.
19. Colangelo LA, Gapstur SM, Gann PH et al. Colorectal cancer mortality and factors related to the insulin resistance syndrome. Cancer Epidemiol Biomarkers Prev 2002; 11 (4): 385–391.
20. Larsson SC, Orsini N, Wolk A. Diabetes mellitus and risk of colorectal cancer: a meta-analysis. J Natl Cancer Inst 2005; 97 (22): 1679–1687. doi: 10.1093/jnci/dji375.
21. Jee SH, Ohrr H, Sull JW et al. Fasting serum glucose level and cancer risk in Korean men and women. JAMA 2005; 293 (2): 194–202. doi: 10.1001/jama.293.2.194.
22. Saydah SH, Platz EA, Rifai N et al. Association of markers of insulin and glucose control with subsequent colorectal cancer risk. Cancer Epidemiol Biomarkers Prev 2003; 12 (5): 412–418.
23. Rinaldi S, Rohrmann S, Jenab M et al. Glycosylated hemoglobin and risk of colorectal cancer in men and women, the European prospective investigation into cancer and nutrition. Cancer Epidemiol Biomarkers Prev 2008; 17 (11): 3108–3115. doi: 10.1158/1055-9965.EPI-08 - 0495.
24. Hsu YC, Chi HM, Liou JM et al. Glycated hemoglobin A1c is superior to fasting plasma glucose as an independent risk factor for colorectal neoplasia. Cancer Causes Control 2011; 23 (2): 321–328. doi: 10.1007/s10552-011-9 880-y.
25. Tsushima M, Nomura AM, Lee J et al. Prospective study of the association of serum triglyceride and glucose with colorectal cancer. Dig Dis Sci 2005; 50 (3): 499–505. doi: 10.1007/s10620-005 - 2464-5.
26. Borena W, Stocks T, Jonsson H et al. Serum triglycerides and cancer risk in the metabolic syndrome and cancer (Me-Can) collaborative study. Cancer Causes Control 2011; 22 (2): 291–299. doi: 10.1007/s10552-010-9697-0.
27. Siddiqui AA. Metabolic syndrome and its association with colorectal cancer: a review. Am J Med Sci 2011; 341 (3): 227–231. doi: 10.1097/MAJ.0b013e3181df9055.
28. van Duijnhoven FJ, Bueno-De-Mesquita HB, Calligaro M et al. Blood lipid and lipoprotein concentrations and colorectal cancer risk in the European Prospective Investigation into Cancer and Nutrition. Gut 2011; 60 (8): 1094–1102. doi: 10.1136/gut.2010.225011.
29. Wei MY, Garland CF, Gorham ED et al. Vitamin D and prevention of colorectal adenoma: a meta-analysis. Cancer Epidemiol Biomarkers Prev 2008; 17 (11): 2958–2969. doi: 10.1158/1055-9965.EPI-08-0402.
30. Wu K, Feskanich D, Fuchs C et al. A nested case-control study on plasma 25-hydroxyvitamin D concentrations and risk of colorectal cancer. J Natl Cancer Inst 2007; 99 (14): 1120–1129. doi: 10.1093/jnci/djm038.
31. Renehan AG, Tyson M, Egger M et al. Body-mass index and incidence of cancer: a systematic review and meta-analysis of prospective observational studies. Lancet 2008; 371 (9612): 569–578. doi: 10.1016/S0140-6736 (08) 60269-X.
32. Garcia-Albeniz X, Chan AT. Aspirin for the prevention of colorectal cancer. Best Pract Res Clin Gastroenterol 2011; 25 (4–5): 461–472. doi: 10.1016/j.bpg.2011.10.015.
33. Lochhead P, Chan AT. Statins and colorectal cancer. Clin Gastroenterol Hepatol 2013; 11 (2): 109–118. doi: 10.1016/j.cgh.2012.08.037.
34. Higurashi T, Nakajima A. Metformin and Colorectal Cancer. Front Endocrinol (Lausanne) 2018; 9 : 622. doi: 10.3389/fendo.2018.00622.
35. Chan AT. Metformin for cancer prevention: a reason for optimism. Lancet Oncol 2016; 17 (4): 407–409. doi: 10.1016/S1470-2045 (16) 00 006-1.
36. Bu WJ, Song L, Zhao DY et al. Insulin therapy and the risk of colorectal cancer in patients with type 2 diabetes: a meta-analysis of observational studies. Br J Clin Pharmacol. 2014; 78 (2): 301–309. doi: 10.1111/bcp.12350.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

-
All articles in this issue
- Gastroenterology in the covid-19 pandemic era
- Gastrointestinal oncology
- Kvíz z klinické praxe
- Predictors of advanced colorectal neoplasia in colorectal cancer screening – interim results of multicentric prospective study
- Phenotype of acute liver failure in inapparent small cell lung cancer
- Prevalence of hypovitaminosis D and impaired glucose tolerance in patients with neuroendocrine tumours undergoing somatostatin analogues therapy
- Covid-19 and hepato-gastroenterology
- Heart failure in a patient with cirrhotic cardiomyopathy as an unusual indication for liver transplantation
- The first employment of a single-use duodenoscope in the Czech Republic
- Proton pump inhibitors – do we know them well and are they really that safe? – part 1
- Kreditovaný autodidaktický test: gastrointestinální onkologie
- Prof. MUDr. Jiří Ehrmann, CSc., 80 years old
- New member of the editorial board MUDr. Kristýna Zárubová
- The selection from international journals
- Budesonide in the treatment of idiopathic intestinal infl ammation
- Primary biliary cholangitis – targeted to the farnesoid X receptor
- Správná odpověď na kvíz Endometrióza postihující serózní povrch (okruží) terminálního ilea
- Surveillance of hepatocellular carcinoma in Slovakia
- Current possibilities of predicting the therapeutic response to neoadjuvant chemoradiotherapy in rectal cancer
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Budesonide in the treatment of idiopathic intestinal infl ammation
- Proton pump inhibitors – do we know them well and are they really that safe? – part 1
- New member of the editorial board MUDr. Kristýna Zárubová
- Predictors of advanced colorectal neoplasia in colorectal cancer screening – interim results of multicentric prospective study
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

