-
Medical journals
- Career
EUS navigované gastrointestinální anastomózy – nové možnosti terapeutické endoskopie
Authors: Nosek V.; Pintová J.
Authors‘ workplace: Gastroenterologické oddělení, Nemocnice Jablonec nad Nisou, p. o.
Published in: Gastroent Hepatol 2020; 74(4): 302-310
Category: Clinical and Experimental Gastroenterology: Original Article
doi: https://doi.org/10.14735/amgh2020302Overview
Úvod: Endosonograficky navigovaná gastroenteroanastomóza (EUS-GEA) lumen apozičními metalickými stenty je novou alternativou léčby gastric outlet obstruction (GOO) maligní i benigní etiologie. EUS-GEA se také využívají k provedení endoskopické retrográdní cholangiopankreatografie (ERCP) u pacientů s chirurgicky alterovanou anatomií horní části trávicího traktu.
Metodika: Retrospektivně jsme vyhodnotili konsekutivní soubor 25 endoskopicky vytvořených gastrointestinálních anastomóz. Odděleně 20 pacientů s indikací GOO a pět pacientů s biliární obstrukcí při chirurgicky alterované anatomii a po selhání enteroskopicky asistované ERCP. Primárně jsme sledovali technickou úspěšnost, klinickou úspěšnost a komplikace.
Výsledky: Ve skupině 20 pacientů s GOO byla technická úspěšnost 95 % (19/20) a klinická úspěšnost 94,7 % (18/19). Časné komplikace jsme nezaznamenali. Pozdní komplikace se vyskytly ve třech případech (15,8 %). Endoskopická reintervence byla nutná v 5,3 % (1/19). V 16 případech se jednalo o maligní etiologii GOO. Zemřelo 10 pacientů a průměrná doba od výkonu do smrti byla 92,5 dní (20–256). Průměrná doba sledování u přežívajících pacientů byla 175,5 dní (32–259). V souboru pěti pacientů s chirurgicky alterovanou anatomií byla technická úspěšnost v provedení gastrointestinálních anastomóz 100 %, úspěšná ERCP následovala u čtyř z pěti pacientů (80 %) a komplikace jsme nezaznamenali.
Závěr: EUS-GEA mají vysokou technickou i klinickou úspěšnost a nízké procento reintervencí. Ve správných indikacích jsou slibnou alternativou chirurgického a radiologického přístupu.
Klíčová slova:
endosonografie – gastrointestinální anastomóza
Úvod
Gastric outlet obstruction (GOO) je termín užívaný při mechanické obstrukci vývodné části žaludku, pyloru a duodena. Dochází k retenci potravy a tekutin nad úrovní obstrukce. Klinickým projevem porušené evakuace žaludku je časný pocit plnosti po jídle, nauzea, zvracení, bolestivý tlak v nadbřišku, malnutrice, dehydratace a významné snížení kvality života [1]. K diagnostice GOO se tradičně indikoval rentgen žaludku, ale komplexní diagnostický potenciál má CT vyšetření. Zlatým standardem je gastroskopie s přímou vizualizací místa obstrukce a s odběrem tkáně na histologické vyšetření. Nejčastější příčinou GOO jsou maligní tumory – vývodná část žaludku, duodenum, pankreas, Vaterská papila, žlučník a žlučové cesty. Etiologie GOO může být i benigní – při chronické pankreatitidě, rekurentní akutní pankreatitidě, vředové chorobě duodena a stenóze chirurgických anastomóz [2].
Podstatná část pacientů s GOO maligní etiologie nemůže být pro pokročilost onemocnění, věk a komorbidity indikována k primární chirurgické resekci. Tradičním paliativním přístupem je chirurgická gastroenteroanastomóza (GEA) otevřená nebo laparoskopická a u velmi pokročilých onemocnění endoskopické zavedení samoexpandibilního kovového nepotaženého duodenálního stentu (SEMS – self expanding metal stent) [1]. Chirurgická GEA má ve srovnání s duodenálním stentem lepší dlouhodobé výsledky, ale vyšší morbiditu (25–35 %) a mortalitu (> 2 %) [3]. Většina chirurgů preferuje neoperační přístup u pacientů s GOO při velmi pokročilé malignitě podjaterní krajiny. Pacientům po endoskopické léčbě duodenálním stentem rychleji odezní klinické příznaky GOO a jsou rychleji propouštěni do domácí péče [3]. Na druhou stranu hrozí obstrukce duodenálního stentu potravou a migrace stentu. V případě delšího přežívání pacientů narůstá riziko recidivy GOO z důvodu uzávěru stentu prorůstáním/přerůstáním tumorózní nebo granulační tkání. Obvykle pak následuje endoskopická reintervence [4,5]. GOO benigní etiologie se preferenčně řeší chirurgicky. Endoskopická dilatace stenóz má variabilní výsledky a riziko perforace je 3–7 % [2].
Endosonograficky navigovaná gastroenteroanastomóza (EUS-GEA) je novou alternativou léčby GOO maligní i benigní etiologie [2]. Jedná se o endoskopické propojení žaludku a tenkého střeva lumen apozičním metalickým stentem (LAMS – lumen-apposing metal stent) (obr. 1A). Indikací k EUS-GEA může být obstrukce antra žaludku, prvního, druhého a třetího úseku duodena. Naopak tumorózní infiltrace žaludečního těla nebo obstrukce v úrovni čtvrtého úseku duodena, oblasti Treitzova ligamenta a první kličky jejuna provedení EUS-GEA většinou neumožňuje [6]. Jednoznačnou kontraindikací k EUS-GEA je víceúrovňová obstrukce tenkého střeva pod místem předpokládané anastomózy, interpozitum mezi žaludkem a kličkou střevní > 1 cm a obecné kontraindikace terapeutické endoskopie jako např. koagulopatie [1]. Recentní studie ukazují, že po EUS-GEA dochází u pacientů k obnově perorálního příjmu v 90 %, riziko uzávěru stentu je minimální a to vše při významně nižší morbiditě ve srovnání s chirurgickou GEA [6].
Velmi dobré výsledky EUS-GEA při GOO vedly k rozšíření indikací. Nejlépe dokumentovaná je kohorta pacientů po bariatrické operaci typu Roux-en-Y gastrický bypass. V případě biliární obstrukce lze u těchto pacientů na přechodnou dobu propojit remnantní gastrický pouch a exkludovanou část žaludku EUS navigovanou gastro-gastroanastomózou (EUS-GGA) (obr.1B). Následuje konvenční endoskopická retrográdní cholangiopankreatografie (ERCP), odstranění LAMS z anastomózy a případně endoskopický uzávěr vytvořené fistuly. Uvedený postup je alternativou enteroskopicky asistované ERCP (e-ERCP) [7]. Při obstrukci žlučových cest u pacientů s chirurgicky alterovanou anatomií horní části trávicího traktu (resekce žaludku Billroth II (BII) nebo Roux-en-Y hepatikojejunoanastomóza (HJA)) a po selhání e-ERCP je obvykle indikován perkutánní přístup (perkutánní transhepatická cholangiografie/drenáž (PTC/PTD). Publikované kazuistiky ukazují slibnou endoskopickou alternativu řešení biliární obstrukce cestou EUS-GEA nebo enteroenteroanastomózou (EUS-EEA). Přechodně zavedeným LAMS endoskopista poměrně krátkou cestou proniká k Vaterské papile nebo HJA (obr. 1C). Popsány jsou také EUS-GEA v řešení syndromu přívodné kličky po resekci žaludku Billroth II nebo po resekci pankreatu.
Image 1. EUS navigované gastrointestinální anastomózy.
A – Organická stenóza proximálního duodena. EUS-GEA v oblasti Treitzova ligamenta – na distální duodenum nebo první kličku jejuna. B – Roux-en-Y gastrický bypass. EUS-GGA k provedení ERCP. C – Roux-en-Y hepatikojejunoanastomóza. EUS-DJA k provedení ERCP.
EUS-GEA – endosonografi cky navigovaná gastroenteroanastomóza, EUS-GGA – endosonografi cky navigovaná gastrogastroanastomóza, ERCP – endoskopická retrográdní cholangiopankreatografi e, EUS-DJA – endosonografi cky navigovaná duodenojejunoanastomóza
EUS guided gastrointestinal anastomoses.
A – Organic stenosis of the proximal duodenum. EUS-GEA in the area of the Treitz ligament – to the distal duodenum or the fi rst loop of jejunum. B – Roux-en-Y gastric bypass. EUS-GGA to implement ERCP. C – Roux-en-Y hepaticojejunoanastomosis. EUS-DJA for ERCP.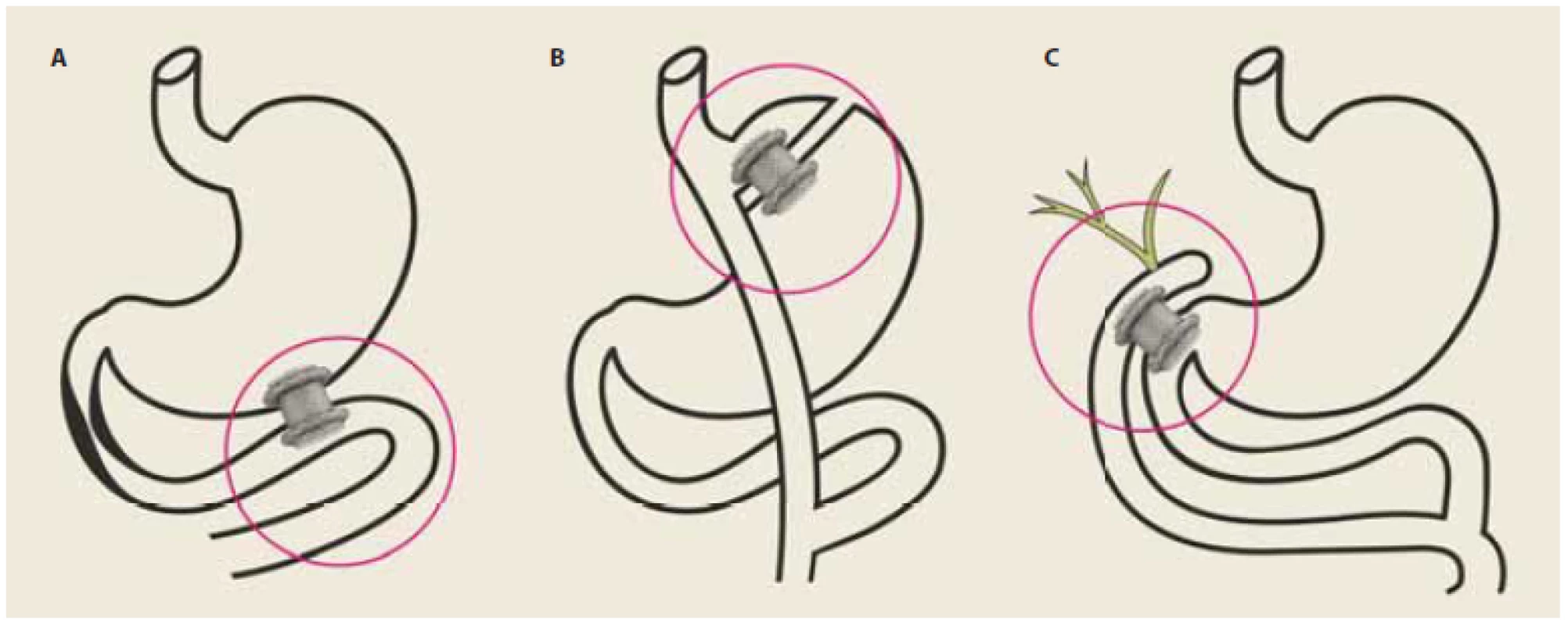
Cílem naší práce je zhodnocení souboru prvních 25 endoskopicky vytvořených gastrointestinálních anastomóz. Samostatně jsme vyhodnotili 20 pacientů se zavedenou EUS-GEA z indikace GOO. Primárně jsme sledovali technickou úspěšnost, klinickou úspěšnost a komplikace. Odděleně hodnotíme pět pacientů s endoskopicky vytvořenými gastrointestinálními anastomózami při chirurgicky alterované anatomii horní části trávicího traktu, klinickými známkami biliární obstrukce a po selhání e-ERCP. Zde jsme sledovali technickou úspěšnost provedení anastomóz, úspěšnost terapeutické ERCP a komplikace.
Soubor pacientů a metody
Retrospektivně jsme zhodnotili konsekutivní soubor 20 pacientů, kteří podstoupili na našem pracovišti EUS-GEA z indikace GOO maligní i benigní etiologie v období od května 2018 do června 2020, a soubor pěti pacientů s alterovanou anatomií zažívacího traktu, kteří podstoupili EUS-GGA nebo EUS-EEA v období od května 2018 do června 2020.
Preproceurální strategie
Podle stupně GOO pacient průměrně 2 dny před výkonem přijímá pouze čisté tekutiny nebo je na plné parenterální výživě se zavedenou derivační nazogastrickou sondou. Před výkonem vždy podáváme antibiotika.
Technika výkonu
Všechny výkony byly provedeny na skiaskopicko-endoskopickém sále v celkové anestezii s orotracheální intubací v poloze pacienta na zádech. Endoskopický výkon začíná zavedením terapeutického gastroskopu (GIF 2TH180, Olympus Medical Systems) do žaludku nebo proximálního duodena a odsátím případného rezidua tekutin a potravy. ERCP kanylou a vodičem pronikáme za skiaskopické kontroly přes stenózu (obvykle duodenální) a dále po aplikaci kontrastní látky do první kličky jejuna. Po vodiči zavádíme do jejuna tenký katétr (používáme nazobiliární drén 8,5 FR, Wilson Cook Medical). Měníme gastroskop za lineární terapeutický echoendoskop (GF-UCT180, Olympus Medical Systems). Katétrem za pomoci oplachové pumpy instilujeme do jejuna fyziologický roztok s metylenovou modří a podáváme spazmolytikum (Buscopan 20–40 mg intravenózně). Endosonograficky z pozice v žaludečním těle nacházíme kličku tenkého střeva v oblasti Treitzova ligamenta, která přímo naléhá na stěnu žaludku. Dle anatomické situace, rozsahu tumorózní infiltrace, případně množství ascitu nastavujeme v EUS obraze k provedení anastomózy distální duodenum nebo proximální jejunum. V případě významného ascitu jej v úvodu výkonu perkutánně odpouštíme. K vytvoření EUS-GEA jsme ve všech případech použili novou generaci lumen apozičních stentů s elektrokauterizačním hrotem ECE-LAMS (electrocautery-enhanced LAMS), typ Hot AXIOS (Xlumena Inc., Boston Scientific) [8]. První námi použitý stent měl průměr 15 mm, všechny ostatní 20 mm. Gastrointestinální anastomózy vytváříme přímou „freehand“ technikou. Po průniku hrotu instrumentária stěnou žaludku a tenkého střeva (Autocut mode, 100W, Effect 4) rozvíjíme distální konec stentu ve střevním lumen a za EUS kontroly jej přitahujeme tak, aby se již opřený o slizniční stranu kličky tenkého střeva lehce deformoval (obr. 2). Následuje finální fáze uvolnění proximálního konce stentu s jeho rozvinutím v lumen žaludku (obr. 3). Tato fáze je nejméně standardizovaným krokem celého výkonu a vyžaduje „pocitovou“ zručnost endoskopisty. Po správném zavedení stentu vytéká do žaludku methylenovou modří obarvený fyziologický roztok z tenkého střeva. Po endoskopické i skiaskopické kontrole správné pozice stentu vytahujeme instrumentárium vč. jejunálního katétru. Stent ponecháváme ke spontánnímu rozvinutí do předdefinovaného průsvitu 20 mm bez balonové dilatace (obr. 1A a 4). V případech EUS-EEA je technika výkonů podobná. Nedosáhneme-li při chirurgicky alterované anatomii enteroskopicky Vaterskou papilu cestou přívodné kličky, umístíme do ní katétr a instilujeme fyziologický roztok (FR) s metylenovou modří. Jedná-li se o stav po resekci žaludku BII, hledáme lineárním echoendoskopem místo, kde resekovaný žaludek nebo jejunální klička pod chirurgickou GEA naléhá na přívodnou kličku. Přímou technikou zavedeme LAMS o průměru 15 mm. Tento průsvit je dostatečný pro průchod duodenoskopu nebo terapeutického gastroskopu k provedení ERCP. Vytváříme-li přístup ke stenotické HJA, umístíme LAMS z proximálního duodena do přívodné jejunální kličky poblíž jejího zaslepeného vrcholu u jaterního hilu (obr. 1C a 5). Technicky odlišná je úvodní fáze EUS-GGA u pacientů po Roux-en-Y gastrickém bypassu. Lineární echoendoskop zavedeme do remnantního gastrického pouche a 19 G jehlou provedeme punkci exkludované části žaludku. Následuje instilace FR s metylenovou modří jehlou. LAMS umístíme po vodiči, následuje balonová dilatace stentu. ERCP se následně provede duodenoskopem díky přechodnému obnovení obvyklého anatomického přístupu do D2 (obr. 1B).
Image 2. EUS obraz rozvíjejícího se LAMS v jejunální kličce. Horní šipka – LAMS, dolní šipka – tekutina v jejunální kličce. EUS – endosonografi e, LAMS – lumen apoziční metalický stent
EUS image of opening LAMS in the jejunal loop. Upper arrow – LAMS, lower arrow – fl uid in the jejunal loop. EUS – endosonography, LAMS – lumen-apposing metal stent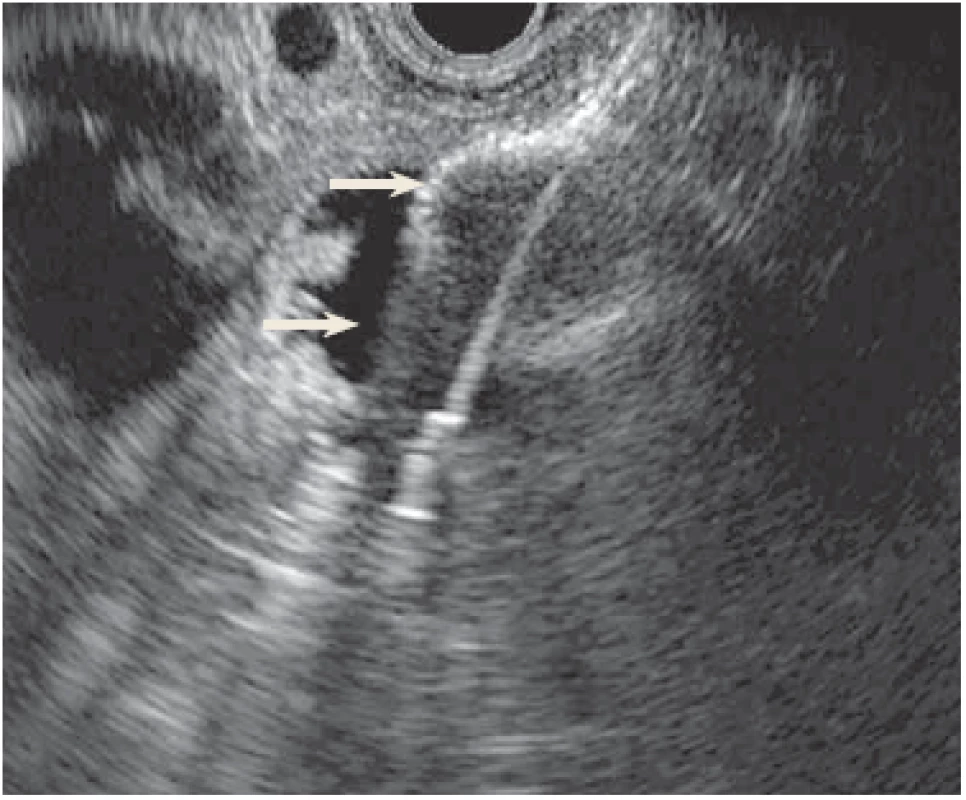
Image 3. Skia obraz právě vytvořené gastroenteroanastomózy. Horní šipka – tělo žaludku, prostřední šipka – lumen apoziční metalický stent s ještě nerozvinutou středovou částí, dolní šipka – jejunum se zavedeným irrigačním katetrem.
Fluoroscopic image of just formed gastroenteroanastomosis. Upper arrow – stomach body, middle arrow – lumen-apposing metal stent with still undilated central part, lower arrow – jejunum with inserted irrigation catheter.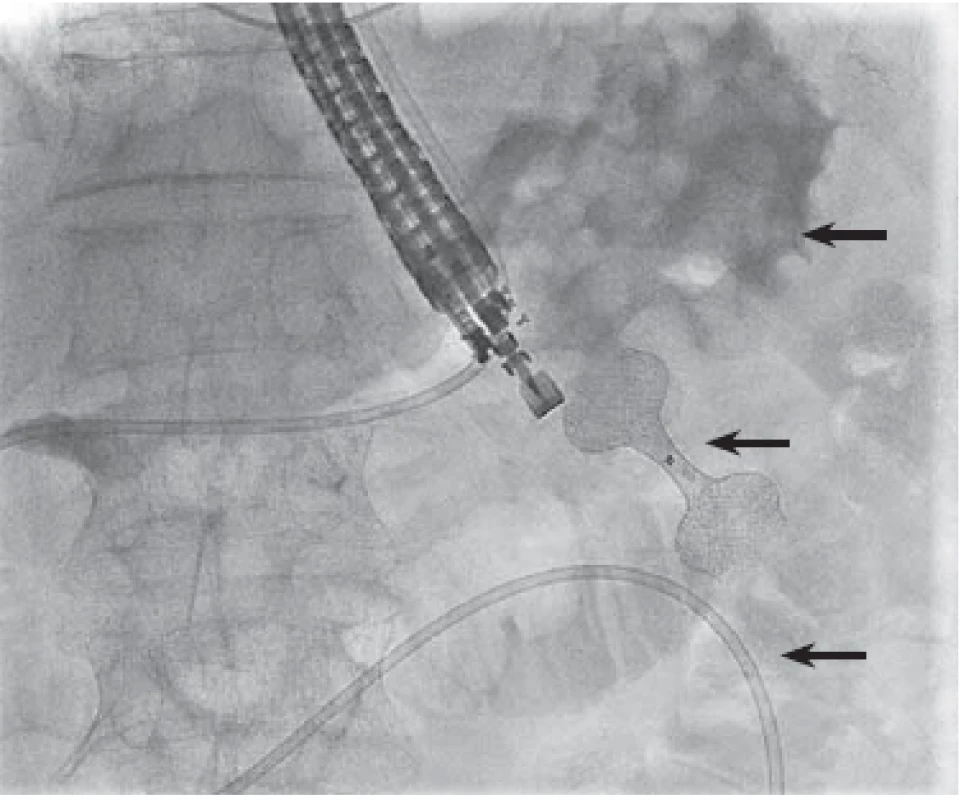
Postprocedurální strategie
Antibiotika podáváme min. 2 dny po výkonu. Tekutiny po doušcích začíná pacient přijímat většinou 3 hod po výkonu. První den po výkonu doporučujeme tekutou stavu, 2. den řídkou kašovitou stravu a dále postupně dle tolerance hutnější kašovitou stravu a pevnou, dobře rozkousanou stravu v menších porcích. Pacienti s maligní etiologií GOO potřebují klinický dohled a nastavení paliativní péče, jelikož jsou většinou v pokročilé fázi onemocnění, trpí nechutenstvím, bolestmi a celkově se zhoršujícím stavem.
Výsledky
Vyhodnotili jsme prvních 20 konsekutivních pacientů s provedenou EUS-GEA pro diagnózu GOO. Žádný pacient nebyl ze studie vyřazen. Průměrný věk pacientů byl 67 let (37–91). Soubor obsahuje 16 mužů (80 %) a 4 ženy (20 %). Maligní etiologii GOO mělo 16 pacientů (80 %), benigní etiologii čtyři pacienti (20 %). Z maligních diagnóz byl nejčastější tumor pankreatu (11×). Dále se jednalo 1× o tumor duodena, 1× Klatskinův tumor a 3× o rozsáhlý tumor podjaterní krajiny nejasného primárního origa. Ve skupině benigních diagnóz byla 1× protrahovaná akutní pankreatitida, 1× stenóza duodena po gangrenózní cholecystitidě a pericholecystitidě, 1× benigní leiomyom duodena a 1× stenóza odvodné kličky po resekci žaludku a pankreatu (tab. 1). Technickou úspěšnost výkonu jsme definovali jako správnou pozici LAMS v nově vytvořené gastrointestinální anastomóze s adekvátním rozvinutím obou konců stentu. Ověření bylo endoskopické a skiaskopické. EUS-GEA přímou metodou byla technicky úspěšná u 19 z 20 pacientů (95 %). U jednoho pacienta došlo během výkonu k dislokaci stentu do peritoneální dutiny. Tato komplikace byla vyřešena chirurgicky – laparoskopickou revizí, extrakcí stentu a GEA. Klinickou úspěšnost jsme definovali dobrou tolerancí perorálního příjmu min. kašovité stravy do 5 dní po výkonu. Zaznamenali jsme ji u 18 z 19 pacientů (94,7 %). Jeden pacient s pokročilou malignitou podjaterní krajiny sice neměl po výkonu příznaky GOO, ale přijímal pouze tekutiny. Více než 50 % pacientů z našeho souboru tolerovalo téměř normální pevnou stavu. Kašovitou stravu, případně menší porce výběrové pevné stravy přijímalo 40 % pacientů. Časné komplikace (do 3 dní po výkonu) jsme nezaznamenali. Pozdní komplikace (do 30 dní po výkonu) se vyskytly ve třech případech (15,8 %). U jednoho pacienta se 21 dní po výkonu objevily symptomy recidivy GOO. CT vyšetření ukázalo malpozici stentu v anastomóze s navazující abscesovou dutinou. Endoskopicky jsme LAMS extrahovali a zavedli duodenální stent. Jednalo se o jedinou vynucenou endoskopickou reintervenci v našem souboru. Jeden pacient měl 18. den po výkonu febrilie s lehkou elevací C-reaktivního proteinu. Etiologie se nezjistila, stav byl vyřešen empirickou antibiotickou terapií. U jednoho pacienta se ve 2. týdnu po výkonu objevily postprandiální průjmy. Byly řešeny symptomaticky (tab. 2).
Table 1. Základní charakteristika souboru 20 pacientů s GOO.
Basic characteristics of a group of 20 patients with GOO.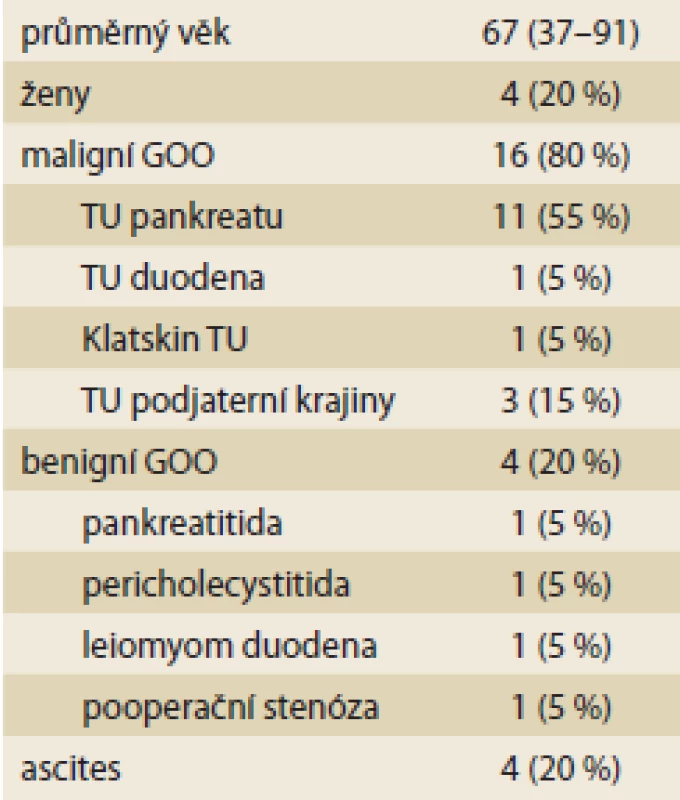
GOO – gastric outlet obstruction, TU – tumor Table 2. Výsledky endosonograficky navigované gastroenteroanastomózy u pacientů s GOO.
Results of endoscopic ultrasound-guided gastroenterostomy in patients with GOO.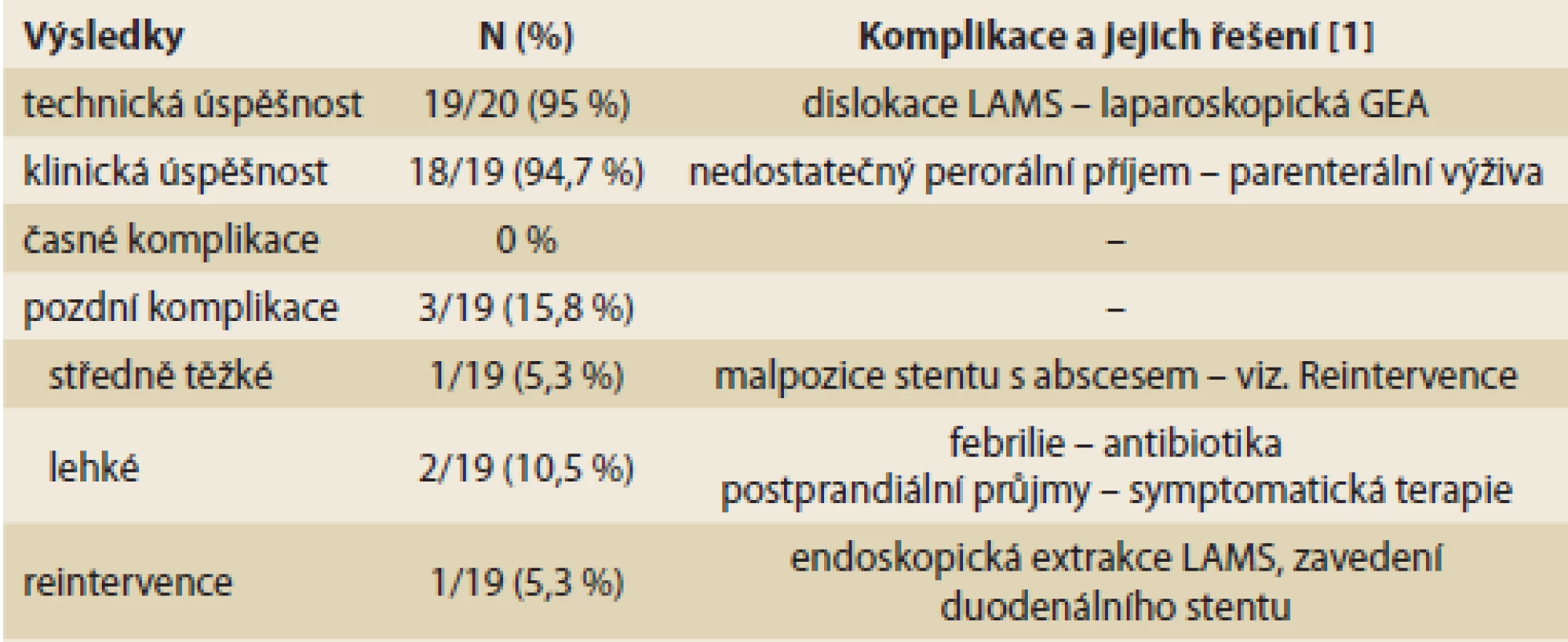
GOO – gastric outlet obstruction, LAMS – lumen apoziční metalický stent, GEA – gastroenteroanastomóza Maligní stenóza byla indikací k provedení EUS-GEA v 16 případech. Do doby zpracování naší studie 10 pacientů zemřelo a šest přežívalo. Průměrná doba od provedení výkonu do smrti byla 92,5 dní (20–256), průměrná doba sledování u přežívajících pacientů byla 175,5 dní (32–259).
Při benigní etiologii byla EUS-GEA provedena 4×. První pacient měl protrahovanou těžkou akutní pankreatitidu s klinicky významnou stenózou duodena (D1 + D2). Po 5měsíční hospitalizaci byly odpady z derivační NG sondy 6–8 l denně. Po provedené EUS-GEA se pacientův stav skokově zlepšil. Ambulantní extrakce LAMS proběhla po 31 dnech. Druhá pacientka se stenózou D2 po těžké cholecystitidě a pericholecystitidě, neschopna z interního hlediska chirurgického výkonu, byla sledována po úspěšné EUS-GEA zatím 228 dní. Třetí, inoperabilní pacient s velkým leiomyomem duodena profitoval z EUS-GEA 21 dní. Po lokální komplikaci jsme LAMS extrahovali a zavedli duodenální stent (viz rozbor pozdních komplikací výše). Čtvrtý pacient s GOO jako pozdní komplikací po resekci pankreatu mohl přejít po EUS-GEA na příjem pevné stravy, ale zemřel 48 dní po zavedení LAMS na jaterní komplikace související s prvotní operací.
Image 4. Endoskopická gastroenteroanastomóza. Plně rozvinutý lumen apoziční metalický stent Hot-AXIOS.
Endoscopic gastroenteroanastomosis. Fully developed lumen-apposing metal stent Hot-AXIOS.
Image 5. Stenóza hepatikojejunoanastomózy (HJA). Endoskopická retrográdní cholangiopankreatografi e cestou duodenojejunoanastomózy. Horní šipka – stenóza HJA, prostřední šipka – pahýl jejuna, dolní šipka – lumen apoziční metalický stent.
Stenosis of hepaticojejunoanastomosis (HJA). Endoscopic retrograde cholangiopancreatography via duodenojejunoanastomosis. Upper arrow – HJA stenosis, middle arrow – jejunal stump, lower arrow – lumenapposing metal stent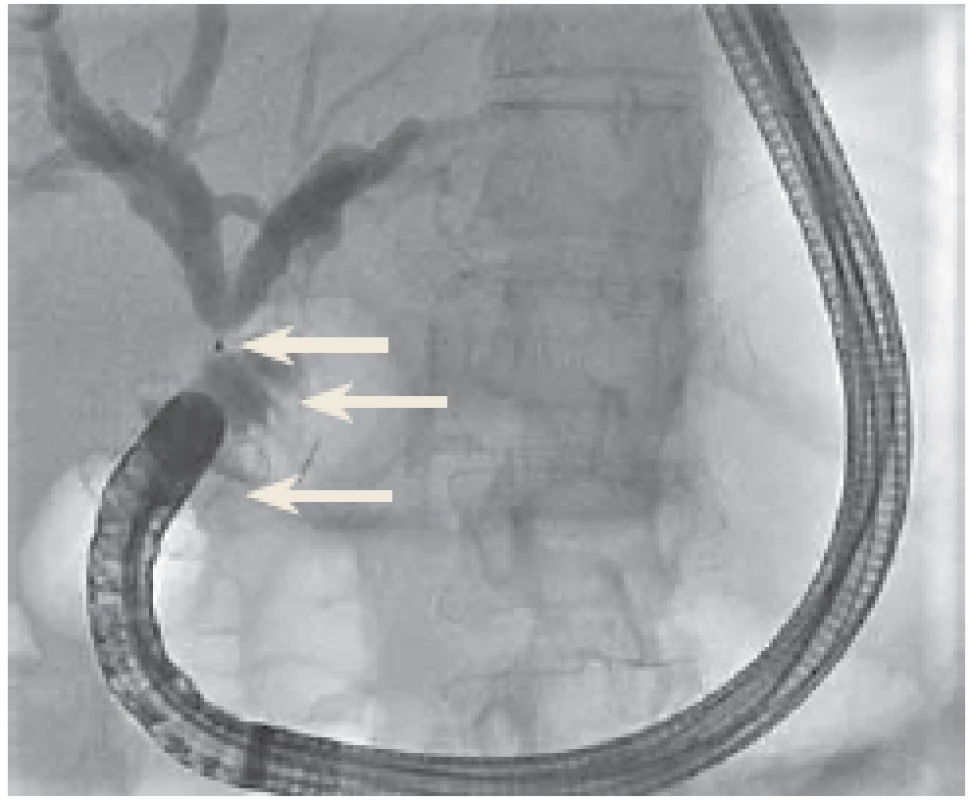
V kazuistickém souboru pěti pacientů s chirurgicky alterovanou anatomií horní části trávicího traktu, biliární obstrukcí a po selhání e-ERCP prezentujeme různé typy EUS navigovaných gastrointestinálních anastomóz (tab. 3). Technická úspěšnost v provedení anastomóz byla 100 %. Technické obtíže během výkonu jsme měli 1× při duodenojejunoanastomóze. Tukové a fibrózní interpozitum v šířce 1,5 cm způsobilo suboptimální rozvinutí jednoho konce stentu. V obavě z možné následné komplikace – malpozice stentu – jsme zavedli luminem LAMS (Hot-AXIOS 15 × 10 mm, Xlumena Inc., Boston Scientific) další stent typu LAMS, ale s delší středovou částí (krčkem) délky 20 mm (HANARO stent, M. I. Tech, South Korea). Úspěšné ERCP s terapeutickými výkony jsme provedli u čtyř z pěti pacientů (80 %), 2× se jednalo o opakované dilatace stenotické HJA (obr. 6), 1× o extrakci obtížné choledocholitiázy a 1× o řešení benigní stenózy choledochu kovovým biliárním stentem (FCSEMS – fully covered self-expandable metallic stent) a extrakci litiázy. Ve všech případech bylo nutné provést opakovaná ERCP. Stenty v gastrointestinálních anastomózách byly ponechány v průměru 159 dní (42–274). Nezaznamenali jsme žádné klinické komplikace. U jednoho pacienta (20 %) po resekci proximálního duodena jsme vytvořením gastroduodenoanastomózy Vaterské papily nedosáhli. Příčinou byla těžká pooperační deformace pahýlu duodena těsně pod úrovní Vaterské papily. Pacient byl reoperován.
Table 3. Soubor pěti pacientů s biliární obstrukcí při chirurgicky alterované anatomii a po selhání enteroskopicky asistovaného ERCP.
A group of fi ve patients with biliary obstruction in surgically altered anatomy and after failure of enteroscopically assisted ERCP.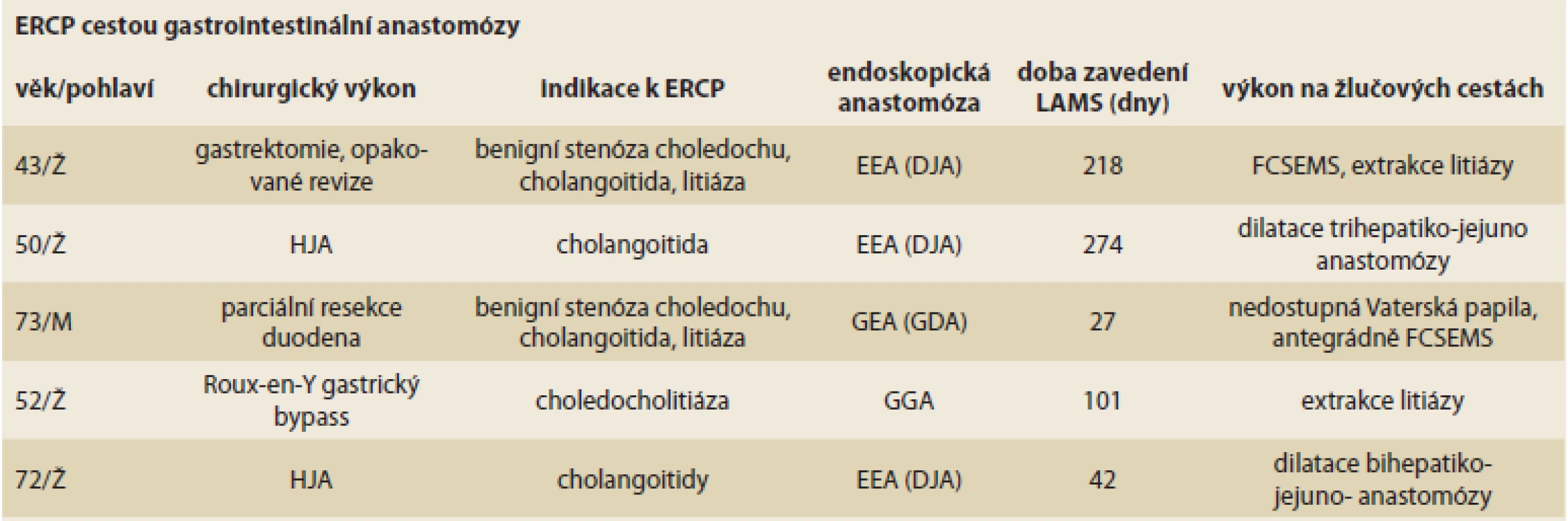
ERCP – endoskopická retrográdní cholangiopankreatografi e, Ž – ženy, M – muži, HJA – hepatikojejunoanastomóza, EEA – enteroenteroanastomóza, DJA – duodenojejunoanastomóza, GDA – gastroduodenoanastomóza, GGA – gastrogastroanastomóza, LAMS – lumen apoziční metalický stent, FCSEMS – plně potažený kovový biliární stent Image 6. Bihepatikojejunoanastomóza po balonové dilataci cestou endoskopicky vytvořené duodenojejunoanastomózy.
Bihepaticojejunoanastomosis after balloon dilatation by endoscopically formed duodenojejunoanastomosis.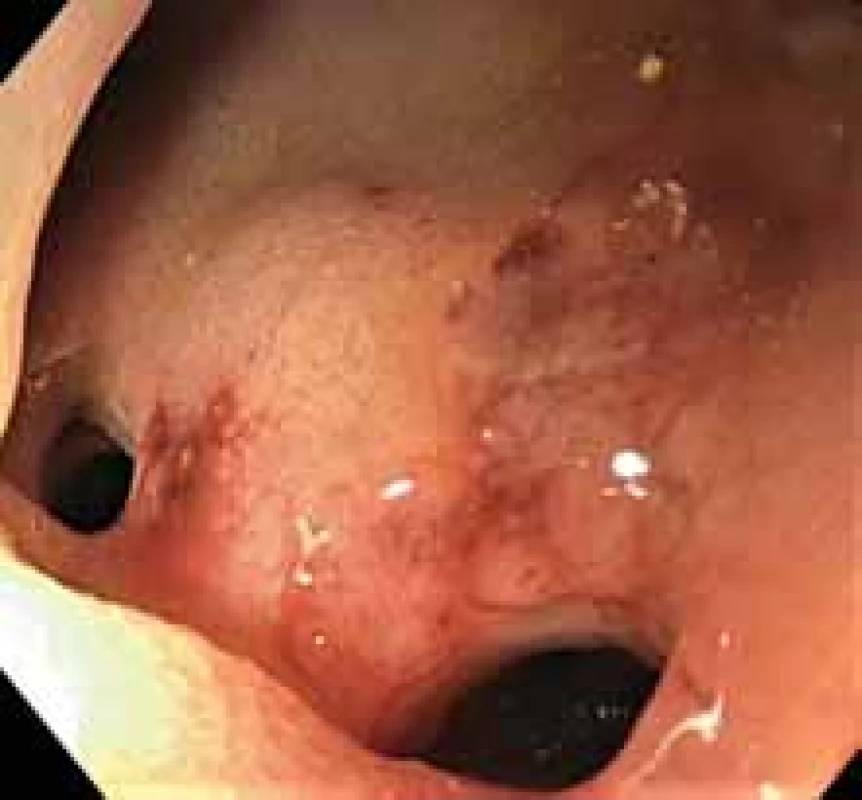
Diskuze
Terapeutická endosonografie posledních let v sobě zahrnuje přístupy intervenční radiologie, pokročilé endoskopie a min. invazivní chirurgie [9]. Lákavá idea endoskopického vytvoření gastrointestinální anastomózy mohla být experimentálně realizována až po vytvoření vhodného instrumentária – LAMS. Činkovitý tvar LAMS zajišťuje optimální přitažení stěn drénovaných struktur a brání migraci stentu (obr. 1). Prevence leaku v místě anastomózy je zajištěna plným pokrytím stentu silikonovou membránou. Radiální síla stentu vytváří kompresi v místě punkčního otvoru ve stěně žaludku i tenkého střeva a brání krvácení. Možnost aplikace elektrokoagulace přímo hrotem zaváděcího systému stentu eliminuje nutnost výměny akcesorií. Přístup do cílového orgánu a zavedení stentu je tak spojeno do jednoho kroku.
V roce 2012 Binmoeller et al. jako první prezentovali soubor úspěšných EUS-GEA na prasečích modelech [10]. O rok později uvádí Itoi et al. vynikající výsledky s použitím „double ballon enteric tube“ [11]. Khashab et al. publikovali v roce 2015 první klinické zkušenosti s EUS-GEA na souboru 10 pacientů s benigní (n = 7) a maligní (n = 3) etiologií GOO. Technická úspěšnost byla u devíti pacientů (90 %). U všech devíti pacientů došlo k obnově perorálního příjmu pevné stravy (klinická úspěšnost 100 %). Nebyla zaznamenána recidiva GOO při průměrné době sledování 150 dní [12]. Opět Kashab et al. v roce 2017 publikovali mezinárodní multicentrickou retrospektivní studii porovnávající výsledky EUS-GEA a chirurgické GEA v indikaci maligní GOO. Do studie bylo zařazeno 30 pacientů s EUS-GEA a 63 pacientů s chirurgickou GEA. Technická úspěšnost byla u endoskopické skupiny signifikantně nižší než u skupiny operovaných (87 vs. 100 %; p = 0,009). Klinická úspěšnost byla ale porovnatelná (87 vs. 90 %; p = 0,18), procento komplikací rovněž (16 vs. 25 %; p = 0,3) [13]. Chen et al. retrospektivně porovnávali v multicentrické studii EUS-GEA a duodenální stent v indikaci maligního GOO. Zařazeno bylo 82 pacientů, 30 s EUS-GEA a 52 s duodenálním stentem. Technická úspěšnost byla 86,7 vs. 94,2 (p = 0,2), klinická úspěšnost 83,3 vs. 67,3 % (p = 0,2). Recidiva symptomatologie GOO s nutností reintervence byla signifikantně nižší ve skupině EUS-GEA (4 vs. 28,6 %; p = 0,015) [14].
V literatuře jsou popsány čtyři různé techniky k vytvoření EUS-GEA [1], rutinně se však dnes požívají pouze dvě. Technika EUS-guided double-ballon-occluded gastrojejunostomy bypass (BAGE) využívá náplně krátkého úseku tenkého střeva mezi dvěma balony. Tento úsek naléhající na stěnu žaludku je endosonograficky dobře viditelný a při zavádění LAMS nemá tendenci oddalovat se od žaludeční stěny. Jedná se o preferovaný přístup asijských endoskopistů. Instrumentárium pro dvoubalonovou techniku není v Evropě dostupné. Druhá technika používána v Evropě a USA se nazývá „přímá“ (DGE – direct/freehand gastroenterostomy) a popisujeme ji v našem textu výše. Dle výsledků multicentrické, retrospektivní, komparativní studie Chena et al. jsou obě techniky efektivní a bezpečné. Přímá technika může být preferována pro kratší procedurální čas (průměrně 35,7 min vs. 89,9 min; p < 0,001). V souboru 74 pacientů (52 s DGE, 22 s BAGE) došlo během výkonu k pěti komplikacím (3× u DGE 6 %, 2× u BAGE 9 %). Vždy se jednalo o nechtěné umístění jedné strany stentu do peritoneální dutiny. Komplikace byla 4× řešena endoskopicky (3× novým umístěním stentu, 1× endoskopickým uzávěrem punkčního kanálu). Jeden pacient byl řešen chirurgicky [2]. Dlouhodobé výsledky použití přímé techniky EUS-GEA v řešení GOO benigní i maligní etiologie dokumentuje studie Kerdsirichairata et al. na 57 pacientech ze dvou center [15]. Autoři demonstrují výbornou technickou i klinickou úspěšnost (93 a 89,5 %). Průměrný čas výkonu je 39 min. Technický neúspěch u čtyř pacientů byl řešen dilatací peptické stenózy (1×), perkutánní endoskopickou gastrostomií (2×) a duodenálním stentem (1×). Autoři upozorňují na jednu těžkou komplikaci s leakem v oblasti LAMS. Endoskopista neprovedl anastomózu v místě naléhajících orgánů, ale přes tukové interpozitum mezokolon. Došlo k napětí a malpozici stentu. Tato komplikace si vyžádala laparotomii. Středně těžkou komplikací bylo hemoperitoneum s negativní angiografií a následným konzervativním postupem. Průměrná doba sledování pacientů s benigní etiologií byla 254 dní. Kratší doba sledování pacientů s maligní etiologií (123,5 dní) byla dána špatnou prognózou onemocnění. V porovnání s jinými studiemi autoři uvádějí vyšší procento endoskopických reintervencí ve sledovaném období – 15,1 %. To bylo způsobeno dlouhou dobou sledování a vysokým podílem pacientů s maligní etiologií – 84,2 %. Při endoskopické reintervenci mělo 62,5 % těchto pacientů průchodný LAMS a klinické symptomy nebyly způsobeny mechanickou obstrukcí stentu. Recentní review a metaanalýza McCartyho hodnotila 199 pacientů s EUS-GEA. Vážné komplikace výkonu se vyskytly u 5,6 % pacientů a zahrnovaly perforace, peritonitidu, krvácení a bolesti břicha [16].
Náš soubor 20 pacientů s benigní a maligní etiologií GOO byl hodnocen retrospektivně. Všechny EUS-GEA jsme vytvořili přímou technikou. Technická úspěšnost byla vysoká – 95 %. U jednoho pacienta došlo k dislokaci proximálního konce stentu do peritoneální dutiny. Příčinou byla technická chyba na straně endoskopisty – absence povytažení endoskopu v době vysouvání proximálního konce stentu z pracovního kanálu echoendoskopu. Intubovaný pacient byl převezen na operační sál k laparoskopické GEA. V našem souboru nastala ještě jedna technická komplikace během výkonu. Po nedostatečném uvolnění stentu z instrumentária došlo k dislokaci stentu do žaludku. Zavedením jiného stentu byla komplikace vyřešena a neměla vliv na bezproblémový klinický průběh po výkonu. Klinická úspěšnost dosáhla v našem souboru 94,7 %. Přes tuto vysokou celkovou klinickou úspěšnost se vyskytl pacient, u kterého byl efekt GEA nedostatečný. Pacient toleroval po EUS-GEA pouze tekutiny. Předpokládáme, že příčinou nebyla neprůchodnost anastomózy, ale preterminální stav maligního onemocnění. Při zpětném hodnocení jsme klinikem doporučovaný výkon neměli provádět. Osm pacientů s maligní diagnózou GOO (50 %) přežilo s EUS-GEA < 60 dní. Většina autorů doporučuje u pacientů v celkově špatném klinickém stavu a s předpokladem přežití < 2 měsíce spíše indikovat zavedení duodenálního stentu jako kratšího a jednoduššího výkonu [17]. Na druhou stranu je kvalita příjmu potravy ve skupině pacientů s EUS-GEA vyšší než u pacientů s duodenálním stentem. Vedle toho je u řady pacientů velmi obtížné přesněji odhadnout prognózu jejich onemocnění. Naše výsledky potvrzují nutnost pečlivého hodnocení indikací k EUS-GEA se snahou o zlepšení klinického odhadu předpokládané doby přežití pacientů s maligní etiologií GOO.
Časné komplikace jsme u našich pacientů nezaznamenali. Nejvíce obávanou časnou komplikací je krvácení, které se v našem souboru nevyskytlo. V rámci prevence časného krvácení po výkonu volíme tuto strategii:
1. před EUS navigovaným průnikem instrumentária stěnou žaludku a tenkého střeva dokumentujeme absenci významnějších cév v místě předpokládané punkční trajektorie;
2. roztažení stentu neurychlujeme balonovou dilatací, při které hrozí natržení tkání s možným krvácením. Do plného, předdefinovaného průsvitu se stent pomalu, spontánně rozvíjí 2–3 dny. Tento časový interval zároveň považujeme za optimální pro klinické sledování pomalé, postupné realimentace pacientů, kteří většinou před výkonem nepřijímali stravu žádnou nebo pouze omezeně tekutou.
V našem souboru jsme zaznamenali jednu významnou pozdní komplikaci – malpozici stentu. EUS-GEA byla indikována u 91letého polymorbidního pacienta s obstrukcí duodena velkým leiomyomem. Po výkonu pacient dobře přijímal pevnou stravu, ale 21. den došlo k recidivě klinických příznaků GOO. CT a endoskopická revize anastomózy ukázaly částečnou dislokaci stentu a navazující abscesovou dutinu široce otevřenou do anastomózy. LAMS byl vytažen a obstrukce duodena v jedné době řešena duodenálním stentem. Absces v oblasti anastomózy se po zavedení duodenálního stentu a antibiotické léčbě vyhojil. Příčinou malpozice stentu byla špatně zvolená punkční trajektorie. Mezi stěnou žaludku a jejunální kličky se nacházelo tukové interpozitum mezokolon. To způsobilo tenzi s tendencí oddalovat stěny drénovaných struktur. Naštěstí nedošlo k leaku do volné peritoneální dutiny, ale k tvorbě ohraničeného abscesu. Duodenální stent je u pacienta zaveden doposud (186 dní k červnu 2020). V případě další vynucené endoskopické reintervence bychom pravděpodobně opět provedli EUS-GEA. V našem souboru nedošlo k obstrukci anastomózy impaktovanou potravou. Domníváme se, že je to především ze dvou důvodů:
1. vyjma prvního pacienta s benigní etiologií GOO jsme všechny EUS-GEA provedli se stenty o průměru 20 mm. Tento rozměr se již blíží průsvitu chirurgicky vytvořených anastomóz, které mívají obvykle 25–30 mm;
2. důsledně poučujeme pacienty i popisujeme v dokumentaci postup perorální realimentace vč. vyjmenování nevhodných potravin. Dieta „na míru“ závisí i na kvalitě chrupu pacienta.
Maligní GOO bývá často sdružen s obstrukcí žlučových cest. Není-li biliární obstrukce vyřešena před klinickou manifestací GOO, lze v případě endoskopické nedostupnosti Vaterské papily provést vnitřní bilární drenáž EUS navigovaně. Po vytvoření EUS-GEA můžeme v jedné době provést stejným přístrojem (lineární echoendoskop) choledochoduodenoanastomózu (CHDA) z D1 nebo hepatikogastroanastomózu (HGA) ze subkardiální části žaludku (obr. 7). V našem souboru 16 řešených maligních GOO jsme tento kombinovaný výkon provedli u pěti pacientů (31 %). Jednalo se 2× o CHDA a 3× o HGA. Ve všech případech s technickým a klinickým úspěchem biliární drenáže.
Image 7. V jedné době vytvořená gastroenteroanastomóza a hepatikogastroanastomóza. Horní šipka – biliární stenty, dolní šipka – lumen apoziční metalický stent.
Gastroenteroanastomosis and hepaticogastroanastomosis formed at one time. Upper arrow – biliary stents, lower arrow – lumen-apposing metal stent.
Díky zkušenostem s EUS-GEA při řešení GOO jsme začali provádět gastrointestinální anastomózy i v dalších indikacích (tab. 3). Při alterované anatomii horní části trávicího traktu, biliární patologii a po selhání eERCP jsme vytvoření EUS navigovaných gastrointestinálních anastomóz volili jako alternativu PTC-PTD, případně operace. Endoskopicky vytvořená anastomóza významně zkrátí a napřímí přístupovou cestu k ústí žlučových cest. ERCP je následně dobře proveditelná duodenoskopem nebo terapeutickým gastroskopem. Extrakci LAMS z gastrointestinálních anastomóz indikujeme v době, kdy již nepředpokládáme další biliární intervenci (obr. 8). Jednou z častých příčin alterované anatomie jsou bariatrické operace, které zažívají celosvětově velký rozvoj. Mezi nejčastěji prováděné operace patří Roux-en-Y gastrický bypass, kdy je přerušena kontinuita žaludku (obr. 1B). Požadavků na endoskopické řešení choledocholitiázy u těchto pacientů bude pravděpodobně přibývat. V našem souboru pěti gastrointestinálních anastomóz máme jednu EUS-GGA u bariatrického pacienta s následným bezproblémovým řešením obtížné choledocholitiázy. Bukhari et al. publikovali soubor 60 pacientů s alterovanou anatomií, kdy u 30 provedli eERCP (19× double balloon enteroskop, 11× single balloon enteroskop) a u 30 EUS-GG-ERCP (ERCP cestou přechodně provedené EUS-GGA). Technická úspěšnost byla signifikantně vyšší ve skupině EUS-GG-ERCP než v eERCP (100 vs. 60 %; p < 0,001). Délka výkonu byla signifikantně nižší ve skupině EUS-GG-ERCP (49,8 vs. 90,7 min; p = 0,02) [7].
Image 8. Duodenojejunoanastomóza po extrakci lumen apozičního metalického stentu. Vlevo pohled do pahýlu jejuna, vpravo pohled do lumen duodena.
Duodenojejunoanastomosis after extraction of lumen-apposing metal stent. Left view of the jejunum stump, right view of the duodenum lumen.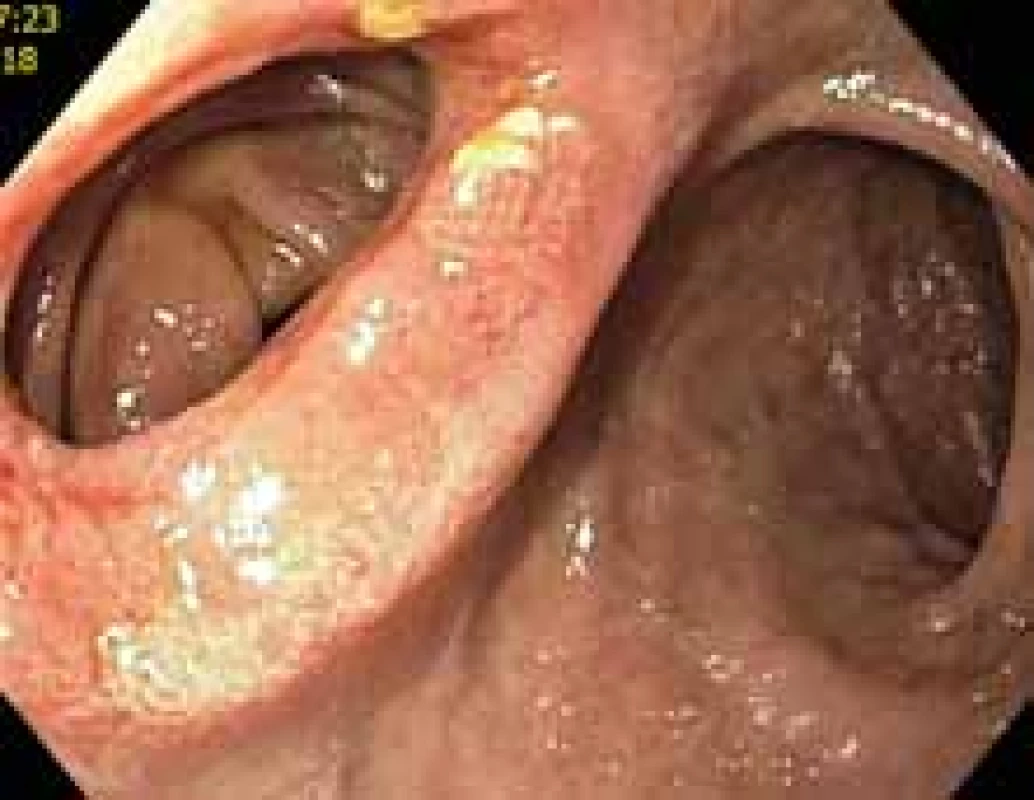
V našem souboru byla po vytvoření gastrointestinálních anastomóz jedna z pěti ERCP neúspěšná. Jednalo se o pacienta po komplikované resekci proximálního duodena a po několika reoperacích. Po vytvoření gastroduodenoanastomózy (na D3) jsme pronikli do pahýlu duodena, ale zde byla další stenóza s deformací a Vaterská papila nepřístupná. Vzhledem k prokázané stenóze distálního choledochu magnetickou rezonanční cholangiografií, suprastenotické litiáze a aktuálně probíhající cholangoitidě jsme po neúspěšné ERCP provedli v jedné době EUS navigovanou transgastrickou, transhepatální antegrádní drenáž distálního choledochu FCSEMS jako rescue zákrok. Definitivní operační řešení proběhlo s odstupem.
Závěr
EUS-GEA je novou metodou při řešení GOO benigní i maligní etiologie. Má vysokou technickou i klinickou úspěšnost a nízké procento reintervencí. Z publikovaných dat i našich výsledků vyplývá, že EUS-GEA lze zařadit jako alternativu k chirurgické GEA a duodenálnímu stentu při multidisciplinární diskuzi o managementu pacientů s GOO. V případě pokročilých malignit podjaterní krajiny lze řešit v rámci jednoho EUS navigovaného výkonu derivaci žaludku i derivaci žlučových cest. Nadějné výsledky přinesly i první zkušenosti s gastrointestinálními anastomózami při řešení biliárních obstrukcí u pacientů s chirurgicky alterovanou anatomií. Upřesnění indikací a techniky výkonů očekáváme v budoucnu od prospektivních, multicentrických a kontrolovaných studií na větších souborech pacientů.
Doručeno/Submited: 23. 7. 2020
Přijato/Accepted: 11. 8. 2020
prim. MUDr. Vladimír Nosek
Gastroenterologické oddělení
Nemocnice Jablonec nad Nisou, p. o.
Nemocniční 15
466 01 Jablonec nad Nisou
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a uvádějí, že V. Nosek je konzultantem fi rmy Boston Scientific.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení. Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Článek není podpořen grantem ani nevznikl za podpory žádné společnosti.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bio medicínských časopisů.
Sources
1. Shamah SP, Siddiqui UD. Endoscopic ultrasound-guided gastroenterostomy (EUS-GE). In: Adler DG (ed). Interventional endoscopic ultrasound. Springer Nature Switzerland AG 2019 : 159–168. doi: 10.1007/978-3-319-97376-0_15.
2. Chen YI, Kunda R, Storm AC et al. EUS-guided gastroenterostomy: a multicenter study comparing the direct and balloon-assisted techniques. Gastrointest Endosc 2018; 87 (5): 1215–1221. doi: 10.1016/j.gie.2017.07.030.
3. Ghoshal UC, Kumar V. Antroduodenal stenting for malignant gastric outlet obstruction: technique and outcome. J Dig Endosc 2019; 10 (1). doi: 10.4103/jde.JDE_64_18.
4. Khashab M, Alawad AS, Shin EJ et al. Enteral stenting versus gastrojejunostomy for palliation of malignant gastric outlet obstruction. Surg Endosc 2013; 27 (6): 2068–2075. doi: 10.1007/s00464-012-2712-7.
5. Jeurnink SM, Steyerberg EW, van Hooft JE et al. Surgical gastrojejunostomy or endoscopic stent placement for the palliation of malignant gastric outlet obstruction (SUSTENT study): a multicenter randomized trial. Gastrointest Endosc 2010; 71 (3): 490–499 doi: 10.1016/j.gie.2009.09.042.
6. Wang J, Liu X, Wang S et al. Endoscopic ultrasound-guided gastroenterostomy: a promising alternative to surgery. J Transl Int Med 2019; 7 (3): 93–99. doi: 10.2478/jtim-2019-0021.
7. Bukhari M, Kowalski T, Nieto J et al. An international, multicenter, comparative trial of EUS-guided gastrogastrostomy-assisted ERCP versus enteroscopy-assisted ERCP in patients with Roux-en-Y gastric bypass anatomy. Gastrointest Endosc 2018; 88 (3): 486–494. doi: 10.1016/j.gie.2018.04.2356.
8. Pintová J, Procházka R, Nosek V. Endosonograficky navigované drenážní výkony novými metalickými apozičními stenty s elektrokauterizační jednotkou (stent Hot AXIOS) – vlastní soubor 20 pacientů. Gastroent hepatol 2018; 72 (4): 309–316. doi: 10.14735/amgh2018309.
9. Amateau SK, Lim CH, McDonald NM et al. EUS-guided endoscopic gastrointestinal anastomosis with lumen-apposing metal stent: feasibility, safety, and efficacy. Obes Surg 2018; 28 (5): 1445–1451. doi: 10.1007/s11695-018-3171-6.
10. Binmoeller KF, Shah JN. Endoscopic ultrasound-guided gastroenterostomy using novel tools designed for transluminal therapy: a porcine study. Endoscopy 2012; 44 (5): 499–503. doi: 10.1055/s-0032-1309382.
11. Itoi T, Itokawa F, Uraoko T et al. Novel EUS-guided gastrojejunostomy technique using a new double-balloon enteric tube and lumen-apposing metal stent (with videos). Gastrointest Endosc 2013; 78 (6): 934–939. doi: 10.1016/j.gie.2013.09.025.
12. Khashab MA, Kumbhari V, Grimm IS et al. EUS-guided gastroenterostomy: the first U.S. clinical experience (with video). Gastrointest Endosc 2015; 82 (5): 932–938. doi: 10.1016/j.gie.2015.06.017.
13. Khashab MA, Bukhari M, Baron TH et al. International multicenter comparative trial of endoscopic ultrasonography-guided gastroenterostomy versus surgical gastrojejunostomy for the treatment of malignant gastric outlet obstruction. Endosc Int Open 2017; 5 (4): E275–E281. doi: 10.1055/s-0043-101695.
14. Chen YI, Itoi t, Baron TH et al. EUS-guided gastroenterostomy is comparable to metal stenting with fewer re-interventions in malignant gastric outlet obstruction. Surg Endosc 2017; 31 (7): 2946–2952. doi: 10.1007/s00464-016-5311-1.
15. Kerdsirichairat T, Irani S, Yang J et al. Durability and long-term outcomes of direct EUS-guided gastroenterostomy using lumen-apposing metal stents for gastric outlet obstruction. Endosc Int Open 2019; 7 (2): E144–E150. doi: 10.1055/a-0799-9939.
16. McCarty TR, Garg R, Thompson CC et al. Efficacy and safety of EUS-guided gastroenterostomy for benign and malignant gastric outlet obstruction: a systematic review and meta-analysis. Endosc Int Open 2019; 7 (11): E1474–E1482. doi: 10.1055/a-0996-8178.
17. Itoi T, Baron TH, Khashab MA et al. Technical review of endoscopic ultrasonography-guided gastroenterostomy in 2017. Dig Endosc 2017; 29 (4): 495–502. doi: 10.1111/den.12794.
Poděkování
Zvláštní poděkování autoři práce adresují prof. Rastislavu Kundovi, M.D., F. a. s.G.E., který nezištně poskytl množství cenných rad při zavádění konceptu EUS navigovaných gastrointestinálních anastomóz na našem pracovišti a osobně přijel provést EUS-GEA v rámci tradičního EUS workshopu v Jablonci nad Nisou v listopadu 2018.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2020 Issue 4-
All articles in this issue
- Clinical and experimental gastroenterology
- Portopulmonální hypertenze u pacientů indikovaných k transplantaci jater – zkušenosti transplantačního centra IKEM
- EUS-guided gastrointestinal anastomosis – new possibilities of therapeutic endoscopy
- Acute pancreatitis in patients after liver transplantation
- Autonomic dysregulation in irritable bowel syndrome, functional dyspepsia and globus pharyngeus – a review of literature and pilot results
- Whipple disease – two case reports
- Acute kidney injury in gastroenterology
- The selection from international journals
- Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Jorveza® – the expected preparation for the treatment of eosinophilic esophagitis
- Iron substitution in sideropenia or sideropenic anemia in patients with IBD with heme iron containing preparation
- Electrogastrography in systemic sclerosis – a pilot study
- Applicability of the Glasgow-Blatchford score in predicting low-risk patients with upper gastrointestinal bleeding – first data from the Czech Republic
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- EUS-guided gastrointestinal anastomosis – new possibilities of therapeutic endoscopy
- Jorveza® – the expected preparation for the treatment of eosinophilic esophagitis
- Whipple disease – two case reports
- Applicability of the Glasgow-Blatchford score in predicting low-risk patients with upper gastrointestinal bleeding – first data from the Czech Republic
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

