-
Medical journals
- Career
Odporúčania slovenskej pracovnej skupiny pre IBD pri SGS pre liečbu IBD v reprodukčnom veku
Authors: Zelinková Z. 1; Baláž J. 2; Bunganič I. 3; Čierna I. 4; Gombošová L. 5; Greguš M. 6; Hlavaty T. 6; Hlísta M. 7; Huorka M. 6; Kadlečková B. 1; Koller T. 6; Lietava P. 8; Valach B. 9; Záň J. 10; Zakuciová M. 5
Authors‘ workplace: Gastroenterologické oddelenie a oddelenie digestívnej endoskopie, Interná Klinika SZU, Univerzitná Nemocnica – Nemocnica sv. Michala, Bratislava 1; HEGITO – Hepatologické, gastroenterologické a transplantačné oddelenie II. internej kliniky SZU, FNsP F. D. Roosevelta, Banská Bystrica 2; Gastro I., s. r. o., Prešov 3; Národný ústav detských chorôb, DFNsP Bratislava 4; I. interná klinika LF UPJŠ a UNLP, Košice 5; Gastroenterologické a hepatologické oddelenie, V. interná klinika LF UK a UN Bratislava 6; Gastroenterologické pracovisko, FN Trenčín 7; Interná klinika gastroenterologická JLF UK a UN Martin 8; NovaMed poliklinika, Banská Bystrica 9; Gastroenterológia, Klinika vnútorného lekárstva ÚVN SNP Ružomberok 10
Published in: Gastroent Hepatol 2020; 74(1): 11-17
Category: IBD: Guidelines
doi: https://doi.org/10.14735/amgh202011Za skupinu členov pracovnej skupiny pre IBD SGS: M. Bátovský (Bratislava), J. Malík (Bratislava), M. Horáková (Martin), A. Krajčovičová (Bratislava), L. Lukáč (Bratislava), I. Šturdík (Bratislava), J. Tóth (Bratislava), J. Ušák (Trnava), I. Valachová (Banská Bystrica), E. Veseliny (Košice) a autori publikácie.
1. Metodika prípravy odporúčaní
Predkladané odporúčania nadväzujú na predchádzajúce odporúčania publikované v rokoch 2002–2018 [1–6].
Pri ich príprave boli použité medzinárodne akceptované štandardy prijímania konsenzuálnych odporúčaní expertov podľa metodiky Delphi [7,8].
V stručnosti (pre detailnú metodiku viď [5]), Zuzana Zelinková pripravila odporúčania. Tieto odporúčania boli predložené na rokovanie Pracovnej skupiny pre črevné zápalové ochorenia, ktoré sa konalo vo Zvolene. O každom z odporúčaní sa hlasovalo osobitne, pričom odporúčanie bolo prijaté, ak zaňho hlasovalo min. 70 % expertov. Ak nebolo odporúčanie v prvom kole prijaté, pripravilo sa upravené znenie odporúčania v zmysle diskusie a opätovne sa hlasovalo. Všetky predložené odporúčania boli v súlade s uvedenými pravidlami prijaté. Záverečné znenie odporúčaní spracovala a pre publikáciu pripravila Zuzana Zelinková.
2. Základné informácie a terminológia
Nešpecifické zápalové ochorenia čreva (IBD – inflammatory bowel disease) typicky postihujú mladých ľudí v reprodukčnom veku. U štvrtiny pacientov je ochorenie diagnostikované predtým, ako si založili rodinu [9], pričom tento podiel bude v nasledujúcich rokoch pravdepodobne stúpať spolu so všeobecným trendom vzostupu veku prvorodičiek. Liečba IBD je liečbou dlhodobou, obnášajúcou v prípade navodenia remisie min. 3–5 rokov udržiavacej liečby. Klinická dilema medzi udržaním remisie prostredníctvom efektívnej liečby a prípadným vplyvom tejto liečby na reprodukčné zdravie IBD pacientov predstavujú teda častý problém v klinickej praxi.
Klasická kategorizácia liečiv vo vzťahu k ich bezpečnosti z hľadiska reprodukčného zdravia vychádza z kategorizácie Úradu pre kontrolu potravín a liečiv (FDA – Food and Drug Administration). Táto kategorizácia zahŕňa výlučne hodnotenie sily dôkazu teratogénneho účinku a nezohľadňuje reprodukčné riziká spojené s rizikami asociovanými so základným ochorením per se a rovnako neberie do úvahy aktivitu ochorenia. Na rozdiel od FDA kategorizácie, z iniciatívy Európskej spoločnosti pre Crohnovu chorobu a ulceróznu kolitídu (ECCO – European Crohn’s and Colitis Organisation) bola vypracovaná alternatívna kategorizácia. Táto špecificky zohľadňuje rizikovosť liečby pre reprodukčné zdravie IBD pacientov berúc do úvahy základný výskyt porúch reprodukčného zdravia v populácii IBD pacientov a riziká nekontrolovanej aktivity ochorenia, ktoré dáva do protiváhy s klinickými dátami dokumentujúcimi reálne riziká spojené s liečivom samotným. Principiálne táto kategorizácia neoznačuje použitie žiadneho liečiva v perikoncepčnom období a/alebo v tehotenstve za bezpečné. V prípade, že pre dané liečivo sú dostupné dáta, ktoré neukazujú zvýšený výskyt nežiadúcich účinkov pri jeho použití v perikoncepčnom období alebo počas tehotenstva v porovnaní s adekvátnou kontrolnou populáciou, označuje sa ich použitie v tomto klinickom kontexte za nízkorizikové.
V predkladaných odporúčaniach používame princíp hodnotenia rizikovosti liečby v kontexte rizikovosti samotného ochorenia a jeho aktivity s použitím termínov označujúcich použitie jednotlivých liekov z hľadiska reprodukčného zdravia za nízko rizikové vs. kontraindikované. V prípade užívania lieku v perikoncepčnom období otcom označujeme toto tehotenstvo za tehotenstvo s nepriamou expozíciou lieku. V prípade matiek sa jedná o priamu expozíciu.
3. Liečba mužov v perikoncepčnom období
Štúdie zaoberajúce sa vplyvom liečiv používaných na liečbu IBD na mužskú fertilitu sú zriedkavé a aj tie, ktoré sú dostupné, sú výrazne limitované metodologickou kvalitou a veľkosťou študovanej populácie.
Aminosalicyláty a sulfasalazín
Sulfasalazín spôsobuje od dávky nezávislú prechodnú [10–13] oligo/azoospermiu so zníženou motilitou spermií. Po vysadení dochádza k plnej reštitúcii spermiogramu, efekt sulfasalazínu nie je revertovateľný kyselinou listovou. Dáta s použitím mesalazínu budúcimi otcami sú limitované, avšak štúdia so 16 pacientami s ulceróznou kolitídou (UC – ulcerative colitis), ktorí zmenili liečbu sulfasalazínom za mesalazín ukázala signifikantné zlepšenie kvality semena po 3 mesiacoch od zmeny liečby [14]. Rovnaký efekt bol pozorovaný v inej štúdii so 42 pacientami s UC [15]. V literatúre je dostupná jedna kazuistika pacienta s mesalazínom-indukovanou reverzibilnou infertilitou [16] a v inej štúdii so šiestimi pacientami liečenými mesalazínom pre IBD a sledovanými pre infertilitu došlo po vysadení mesalazínu k zlepšeniu spermiogramu a u štyroch pacientov bola následne koncepcia úspešná [17]. U pacientov liečených sulfasalazínom je odporúčané liečbu zmeniť na mesalazín, pokiaľ toto nie je možné, je vhodná urologická konzultácia s kontrolou spermiogramu pred definitívnym rozhodnutím o vysadení sulfasalazínu. Pacienti s UC v remisii pri liečbe mesalazínom nemajú jednoznačnú indikáciu túto liečbu vysadiť z dôvodu plánovanej koncepcie. Pacienti a ich partnerky by však mali byť upozornení, že v prípade neúspešnosti koncepcie v konvenčnom čase (v závislosti od veku pacienta a partnerky 6–12 mesiacov od vysadenia antikoncepcie) je rovnako ako v prípade sulfasalazínu vhodné realizovať kontrolu spermiogramu.
Imunosupresíva
Azatioprín neovplyvňuje motilitu a počet spermií [18], avšak výstupy tehotenstiev s nepriamou expozíciou (tj. expozícia otca v perikoncepčnom období) azatioprínu sú rozporné [19–22]. Metaanalýza týchto štúdií neukázala zvýšené riziko kongenitálnych malformácií (odds ratio (OR) 1,87; 95% confidence interval (CI) 0,67–5,25; p = 0,236) detí otcov užívajúcich azatioprín alebo 6-merkaptopurín v čase koncepcie [23]. Navyše, nedávno publikovaná štúdia analyzujúca fragmentáciu DNA vo vzorkách semena 40 pacientov IBD liečených azatioprínom alebo 6-merkaptopurínom neukázala rozdiely medzi zdravými dobrovoľníkmi a pacientami [24]. Berúc do úvahy tieto dáta, ako aj riziká neliečeného ochorenia, ktoré by prerušenie liečby prinieslo, nepredstavuje plánovanie koncepcie u IBD pacienta v remisii dôvod na prerušenie liečby azatioprínom, alebo 6-merkaptopurínom.
Cyklosporín sa používa ako záchranná terapia v prípade ťažkej UC v dennej dávke 2 mg/kg. Pre toto dávkovanie neexistujú literárne údaje vzhľadom k mužskej fertilite a výstupom tehotenstiev s nepriamou expozíciou cyklosporínu.
Metotrexát pôsobí teratogénne a počas jeho používania by mal pacient byť poučený o použití adekvátnej antikoncepcie [25]. V prípade plánovania počatia je potrebné ukončiť liečbu min. 4 mesiace pred počatím [26], berúc do úvahy biologický polčas metotrexátu a čas potrebný na spermatogenézu.
Kortikosteroidy
Systémové kortikosteroidy sa používajú na navodenie remisie pri relapse IBD a ich použitie nie je spájané s poruchami mužskej fertility [27], výstupy tehotenstiev s nepriamou expozíciou nie sú systematicky reportované.
Tofacitinib
Tofacitinib, inhibítor Janusovy kinázy, predstavuje novú molekulu registrovanú na liečbu UC. V rámci intervenčných štúdií s pacientami s UC bolo zachytených 14 tehotenstiev s nepriamou expozíciou tofacitinibu [28]. Z týchto 14 tehotenstiev skončilo 11 narodením zdravého novorodenca, v troch prípadoch výstup tehotenstva nebol známy. Vzhľadom k týmto limitovaným údajom nie je možné formulovať jednoznačné odporúčania pre užívanie tofacitinibu budúcimi otcami, aj keď dostupné dáta nesvedčia pre rizikový profil v tomto kontexte.
Biologická liečba
AntiTNF monoklonové protilátky
Dáta pre biologiká proti tumor nekrotizujúcemu faktoru (anti-TNF) – infliximab, adalimumab a certolizumab (registrovaný pre liečbu Crohnovej choroby FDA) – sú limitované. V malej štúdii reumatologických pacientov bola počas liečby infliximabom (Remicade®) zaznamenaná zlepšená kvalita semena [29] na rozdiel od malých súborov pacientov s IBD, kde bola zaznamená znížená motilita, ale zvýšená koncentrácia spermií počas tejto liečby [30,31]. Výstupy tehotenstiev s nepriamou expozíciou infliximabu (Remicade®) v IBD populácii sú limitované na 10 tehotenstiev, s deviatimi pôrodmi, jedným potratom, bez nálezu vrodených chýb [30]. V prípade adalimumabu (Humira®) sú k dispozícii limitované dáta siedmich pacientov s analýzou vplyvu liečby na zloženie semena v 3 a 6 mesiaci liečby, kde neboli zaznamená žiadne zmeny v priebehu liečby [32]. Dve tehotenstvá s nepriamou expozíciou adalimumabu (Humira®) boli súčasťou tejto štúdie a reportovali dve zdravé donosené deti.
Pre vedolizumab zatiaľ sú k dispozícii len limitované dáta zaoberajúce sa bezpečnosťou jeho použitia pacientami plánujúcimi koncepciu. V prehľade registrov z intervenčných štúdií bolo uvedených 19 tehotenstiev s nepriamou expozíciou vedolizumabu, z ktorých 11 skončilo pôrodom živého novorodenca, 2 spontánnym abortom, 3 umelým prerušením tehotenstva a 3 výstupy neboli zdokumentované [33]. Vzhľadom k možnej expresii MadCAM1 receptorov v urogenitálnom systéme nie je možné vylúčiť interferenciu liečby vedolizumabom s procesom spermatogenézy. Zohľadňujúc uvedené limitované klinické dáta by v prípade incidentálnych tehotenstiev s nepriamou expozíciou vedolizumabu pacient a jeho partnerka mali byť upozornení na potenciálne riziká.
Antibiotiká
Antibiotiká ciprofloxacín a metronidazol sú efektívne osobitne v liečbe perianálnej formy Crohnovej choroby a používajú sa ako účinná kombinácia aj v liečbe komplikácií penetrujúceho ochorenia lokalizovaného v tenkom alebo hrubom čreve. Vplyv na spermatogenézu v prípade metronidazolu nebol dokázaný, v prípade ciprofloxacínu sú dáta rozporuplné [26]. Vzhľadom k tomu nie sú k dispozícii jednoznačné odporúčania pre riziká spojené s užívaním týchto liečív mužmi s IBD v perikoncepčnom období.
4. Liečba žien v perikoncepčnom období a počas tehotenstva
Aktivita IBD v perikoncepčnom období a/alebo počas tehotenstva je asociovaná so signifikantným zvýšením rizika nepriaznivého priebehu tak pre matku, ako pre dieťa. Osobitne sa pri aktívnom ochorení zvyšuje riziko predčasného pôrodu, nízkej pôrodnej hmotnosti, zníženého Apgarovej skóre a pobytu na novorodeneckej jednotke intenzívnej starostlivosti [34–39]. Z hľadiska rizík pre matku zvyšuje aktivita ochorenia riziko tromboembolických komplikácií, urgentného cisárskeho rezu [40] a v prípade potreby liečby relapsu systémovými kortikosteroidami aj riziko gestačného diabetu [41].
Aktivita ochorenia v perikoncepčnom období signifikantne zvyšuje riziko pokračujúcej aktivity aj počas tehotenstva [42]. Koncepciu je preto vhodné plánovať na obdobie dlhodobej remisie a liečbu účinnú v udržaní remisie počas koncepcie ani počas tehotenstva neprerušovať. Lieky používané na udržanie remisie IBD sú považované v tomto kontexte za nízkorizikové s výnimkou metotrexátu (viď ďalej). Pre zvýšenie kompliancie pacientiek s IBD plánujúcich graviditu je vhodné realizovať cielené prekoncepčné poradenstvo, ktoré signifikantne znižuje riziko relapsu [43].
4a. Rizikový profil udržiavacej liečby budúcej matky v perikoncepčnom období a v tehotenstve
Aminosalicyláty a sulfasalazín
Aminosalicyláty a sulfasalazín sú považované za nízkorizikové pre použitie budúcou matkou. Populačné štúdie [44–46] a dve metaanalýzy [9,47] nepreukázali zvýšené riziko nežiadúcich výstupov tehotenstva pri expozícii počas ranných štádií tehotenstva. Niekoľko štúdií demonštrovalo zvýšený výskyt predčasného pôrodu, potratu a pôrodu dieťaťa s nízkou pôrodnou hmotnosťou [9,46,48]; vplyv aktívneho ochorenia v týchto štúdiách však nebol vylúčený. Sulfasalazín interferuje so vstrebávaním folátov, preto v prípade jeho užívania pacientkou s IBD plánujúcou tehotenstvo je potrebné zvýšiť štandardne doporučovanú preventívnu dávku kyseliny listovej na 1 mg denne [25].
Imunosupresíva
Tiopuríny, azatioprín a jeho metabolit 6-merkaptopurín prechádzajú cez placentu a ich metabolity boli detekované v erytrocytoch z pupočníkovej krvi v prospektívnej štúdii sledujúcej 30 tehotenstiev [49]. Recentné kontrolované štúdie [50–54] a metaanalýza [55] neukázali zvýšené riziko nepriaznivých výstupov tehotenstva s priamou expozíciou tiopurínov. V inej metaanalýze sa expozícia tiopurínom v tehotenstve spája s predčasným pôrodom [23]. Z hľadiska sledovania novorodencov nezvyšuje intrauterinná expozícia metabolitom tiopurínov riziko infekčných komplikácií alebo imunitných defektov [56]. Vo vyššie uvedenom prospektívnom sledovaní 30 tehotenstiev bola však u 60 % novorodencov v skorom popôrodnom období zaznamenaná anémia [49]. Tiopuríny sú teda považované za nízkorizikové pre použitie počas koncepcie a v tehotenstve, je však potrebná úzka spolupráca s gynekológom, neonatológom a pediatrom, ktorým gastroenterológ odovzdáva informáciu o týchto možných komplikáciách, osobitne riziku predčasného pôrodu a anémie novorodenca.
Metotrexát je teratogénny [57] a jeho použitie v perikoncepčnom období a počas tehotenstva je kontraindikované. Vzhľadom k dlhému biologickému polčasu by pacientka s IBD na udržiavacej liečbe metotrexátom plánujúca tehotenstvo mala liečbu vysadiť min. 3–6 mesiacov pred koncepciou.
Biologická liečba
AntiTNF monoklonové protilátky
Použitie anti-TNF biologík, infliximabu a adalimumabu, nie je v kontrolovaných a kohortových štúdiách spájané s nežiadúcimi výstupmi tehotenstiev u pacientiek s IBD [53,58–63]. Výnimkou je retrospektívna štúdia na základe dát z francúzskej národnej zdravotnej databázy, ktorá analyzovala výstupy 11 275 tehotenstiev. Z týchto bolo 1 457 bolo s priamou expozíciou anti-TNF, pričom expozícia anti-TNF zvyšovala riziko maternálnych komplikácií v tehotenstve (adjusted odds ratio (aOR) = 1,49; 95% CI 1,31–1,67). Na druhej strane, prerušenie anti-TNF liečby v tehotenstve bolo v tejto štúdii asociované so zvýšeným rizikom relapsu [64].
Deti narodené matkám liečeným počas tehotenstva anti-TNF sa nelíšia od detí neexponovaných anti-TNF in utero v psychomotorickom vývoji, ani v podieli infekčných ochorení a/alebo alergií v prvých rokoch života [64–67] a majú adekvátnu imunitnú reakciu na očkovania, osobitne proti Haemophilus influenzae B, tetanus toxoid [68] a hepati-tíde B [69].
Obidve molekuly sú triedy imunoglobulínu G1 a prechádzajú placentou procesom závislým od expresie neonatálneho Fc receptora [70]. Tento prechod začína v 2. trimestri a dosahuje maximum pred pôrodom. Deti narodené matkám liečeným infliximabom alebo adalimumabom počas 3. trimestra sú týmto molekulám intrauterinne exponované a peripartálne odobratá pupočníková krv týchto detí obsahuje koncentrácie infliximabu alebo adalimumabu niekoľkonásobne prevyšujúce hladiny matky [70–72]. Hoci sa táto intrauterinná expozícia v doterajších sledovaniach detí narodených matkám liečeným infliximabom/adalimumabom v 3. trimestri nespája s nežiadúcimi účinkami, osobitne nie s imunologickými abnormalitami [73] alebo vyšším rizikom infekcií [62], dlhodobé následky tejto expozície zatiaľ nie sú známe. V prípade ochorenia v plnej remisii počas celého tehotenstva je preto doporučované liečbu infliximabom/adalimumabom v 2. trimestri prerušiť [25]. V prípade, že je ochorenie v remisii, prerušenie liečby nezvyšuje riziko relapsu v 3. trimestri a intrauterinná expozícia je týmto prerušením liečby signifikantne redukovaná, aj keď nie nevyhnutne úplne eliminovaná [71,74]. Na základe nových dát sa zdá, že farmakokinetika infliximabu a adalimumabu sa v gravidite mení odlišným spôsobom, hladiny infliximabu v priebehu gravidity stúpajú, zatiaľ čo hladiny adalimumabu ostávajú stabilné [75]. Tieto farmakokinetické rozdiely sú pravdepodobne aj vysvetlením pozorovanej rozdielnej intrauterinnej expozície medzi infliximabom a adalimumabom [76]. Momentálne nie sú tieto pozorovania preložené do konkrétnych odporúčaní na farmakokinetický monitoring infiximabu počas tehotenstva.
Zhrnúc vyššie uvedené klinické dáta, infliximab/adalimumab sú považované za nízkorizikové pre použitie v perikoncepčnom období a v tehotenstve. Na redukciu intra-uterinnej expozície dieťaťa týmto molekúlam sa odporúča prerušiť liečbu v 2. trimestri, pokiaľ to aktivita ochorenia umožňuje. Gastroenterológ má informovať neonatológa a pediatra o možnosti placentárneho prechodu a v prípade, že je to možné, dať stanoviť hladiny infliximabu/adalimumabu v pupočníkovej krvi. V prípade detekovateľných hladín je potrebné postponovať všetky očkovania živými vakcínami do doby, keď hladiny už nie sú detekovateľné. V prípade, že meranie hladín nie je k dispozícii, sa odporúča postponovať očkovania živými vakcínami do 2. roka života. Očkovania neživými vakcínami môžu byť podané podľa štandardného očkovacieho kalendára.
Vedolizumab
S použitím vedolizumabu ako udržiavacej liečby IBD sú v perikoncepčnom období a v tehotenstve len limitované skúsenosti. V kontrolovanej prospektívnej observačnej štúdii 101 pacientiek so sclerosis multiplex liečených iným antiintegrínom, natalizumabom, bolo zaznamenané signifikantne vyššie percento potratov a detí s nízkou pôrodnou hmotnosťou v porovnaní so zdravou populáciou, nie však v porovnaní s pacientkami bez liečby [77]. Účinok vedolizumabu je sprostredkovaný blokádou α4β7-receptorov na povrchu leukocytov. Tieto receptory na povrchu leukocytov sa za normálnych okolností viažu na MadCAM1 receptory na endotelových bunkách ciev lamina propria črevnej steny a táto väzba umožňuje prechod leukocytov do subslizničného priestoru. Ľudská placenta exprimuje MadCAM1 receptory, pričom táto expresia dosahuje maximum v 1. trimestri a v priebehu gravidity klesá [78]. Nedá sa preto vylúčiť, že liečba vedolizumabom v perikoncepčnom období a osobitne v 1. trimestri môže interferovať s imunitným dozorom maternálneho imunitného systému v tomto období.
Doteraz boli publikované tri štúdie zaoberajúce sa výstupmi tehotenstiev s priamou a nepriamou expozíciou vedolizumabu. Prvú predstavuje postmarketingová analýza klinických programov a zahŕňa 27 tehotenstiev s priamou a 19 tehotenstiev s nepriamou expozíciou vedolizumabu, ktoré uvádzame vyššie [33]. V tejto štúdii z 27 tehotenstiev s priamou expozíciou bolo 11 pôrodov, z toho 1 s vrodenou chybou agenézy corpus callosum, 4 spontánne a 5 elektívnych potratov, 4 výstupy neboli zdokumentované. Druhou štúdiou je retrospektívna observačná štúdia sledujúca výstupy 24 tehotenstiev IBD pacientiek liečených vedolizumabom v perikoncepčnom období a v tehotenstve. Táto štúdia uvádza 25 % komplikácií tehotenstva u matiek a 35 % u detí (prematurita, nízka pôrodná váha vzhľadom ku gestačnému veku a vrodené chyby vrátane dysplázie bedrového kĺbu, stenóza pľúcnej chlopne a Hirschprungova choroba) [79]. Navyše v inej kohorte bola u dvoch detí s intrauterinnou expozíciou antiintegrínom zaznamenaná redukcia indukovanej chemotaxie T-lymfocytov [80]. Tretia klinická štúdia porovnávala výstupy 24 tehotenstiev pacientiek liečených vedolizumabom s 82 pacientkami liečenými anti-TNF a 224 pacientkami s konvenčnou liečbou, pričom neboli zistené rozdiely vo výstupoch tehotenstiev [81]. Vzhľadom k uvedenému nie je zatiaľ možné odhadnúť rizikový profil vedolizumabu v klinickej situácii IBD pacientky liečenej touto molekulou a plánujúcej koncepciu.
Ustekinumab
S liečbou ustekinumabom v perikoncepčnom období a počas tehotenstva sú u IBD pacientiek minimálne skúsenosti limitované na niekoľko kazuistík [68, 82–85], z ktorých jedna uvádza tehotenstvo s priamou expozíciou ustekinumabu, ktoré skončilo spontánnym potratom [82]. Tieto limitované dáta ukazujú, že ustekinumab prechádza cez placentu a rovnako aj do materského mlieka. Jednoznačné odporúčania ohľadom použitia ustekinumabu v perikoncepčnom období a v gravidite v tejto chvíli nie je možné pre IBD pacientov sformulovať, aj keď na základe dát z dermatologických registrov sa zdá jeho použitie v tejto klinickej situácii ako nízkorizikové.
4b. Liečba relapsu
Aktívne ochorenie je asociované so signifikantne vyšším rizikom komplikácií tehotenstva (viď vyššie), preto by aktívne ochorenie malo byť adekvátne a včas liečené.
Kortikosteroidy sú účinné v liečbe akútneho relapsu IBD a s ich použitím v tehotenstve sú rozsiahle skúsenosti. Prednizon, prednizolon a metylprednizolon sú metabolizované placentou a fetus je im limitovane exponovaný, preto sú v liečbe z maternálnej indikácie preferované [25]. Nežiadúce účinky steroidov na plod, osobitne v minulosti diskutované zvýšené riziko rázštepu pery a podnebia, neboli potvrdené v rozsiahlej populačnej štúdii zahŕňajúcej 51 973 tehotenstiev s priamou expozíciou kortikosteroidom v 1. trimestri [86]. Použitie steroidov v tehotenstve zvyšuje riziko gestačného diabetu u IBD pacientiek [41] a v literatúre sú publikované kazuistiky adrenálnej insuficiencie u novorodencov narodených IBD matkám liečených v tehotenstve steroidami [87]. Kortikosteroidy sú považované za nízkorizikové pre použitie v tehotenstve, ich použitie však musí byť starostlivo zvážené a pacientky intenzívne monitorované pre možný rozvoj komplikácií, osobitne gestačného diabetu. Rovnako má byť neonatológ informovaný o možnom riziku rozvoja adrenálnej insuficiencie v dôsledku intrauterinnej expozície systémovým kortikosteroidom.
S použitím budesonidu v tehotenstve u IBD pacientiek sú skúsenosti limitované na jednu štúdiu s ôsmimi pacientkami, kde neboli nežiadúce účinky reportované [88].
Skúsenosti s indukčnou anti-TNF liečbou v tehotenstve sú limitované na niekoľko kazuistík [58,89]. Berúc do úvahy riziká neliečeného ochorenia a ich nízkorizikový profil pri použití v rámci udržiavacej liečby je napriek nedostatku skúseností ich použitie v liečbe steroid-rezistentného relapsu počas tehotenstva indikované.
Alternatívu k liečbe steroid-rezistentného relapsu UC predstavuje cyklosporín. S jeho použitím v tehotenstve sú rozsiahle skúsenosti z transplantológie [90]. Pre použitie v kontexte aktívnej UC sú dáta limitované na niekoľko kazuistík [35,91]. Na základe kombinácie týchto dát je cyklosporín považovaný za nízkorizikový v liečbe počas tehotenstva a v perikoncepčnom období.
Antibiotiká
Metronidazol a ciprofloxacín sú používané v liečbe paučitídy a relapsu perianálneho ochorenia, ako aj pri liečbe komplikácií penetrujúceho ochorenia s tvorbou medzikľučkových abscesov. Všetky tieto situácie sa môžu vyskytnúť tak v perikoncepčnom období ako počas tehotenstva.
V kohortovej štúdií s vyše 900 tehotnými ženami liečenými metronidazolom v rôznych štádiách tehotenstva neboli zaznamenané asociácie s nežiadúcimi výstupmi tehotenstva [92]. Kongenitálne anomálie indukované ciprofloxacínom v zvieracích štúdiách [93] nemajú korelát pri použití tehotnými ženami, kde neboli zaznamenané nežiadúce výstupy tehotenstiev [94]. Vzhľadom k afinite chinolónov ku kostnému tkanivu a chrupavkám by ciprofloxacín nemal byť používaný v 1. trimestri. Mimo tejto situácie sú metronidazol a ciprofloxacín považované za nízkorizikové pre použitie v tehotenstve.
4c Vedenie pôrodu
Rozhodnutie o vedení pôrodu je predmetom multidiscplinárnej diskusie medzi pôrodníkom, gastroenterológom a neonatológom. Vo všeobecnosti je z gastroenterologického hľadiska možný vaginálny pôrod s výnimkou aktívneho perianálneho ochorenia a stavu po restoratívnej proktokolektómii. Rozsiahla retrospektívna štúdia zahŕňajúca 6 797 669 pôrodov, z ktorých 2 882 predstavovali pôrody pacientiek s Crohnovou chorobou, ukázala, že aktívna perianálna choroba zvyšuje riziko závažných perineálnych lacerácií [95]. Aktívna perianálna choroba predstavuje závažný argument pre vedenie pôrodu cisárskym rezom, ktorý by mal byť v diskusii s pôrodníkom starostlivo zvážený.
Vzhľadom k hraničnej kontinencii pri stave po restoratívnej proktokolektómii ako aj pri stave po ileo-rekto-anastomóze sú tieto dve klinické situácie považované za relatívnu indikáciu k vedeniu pôrodu cisárskym rezom [96–99]. Vzhľadom k nedostatočnému množstvu dát je potrebné zdôrazniť, že sa jedná o relatívnu indikáciu a definitívne rozhodnutie je rovnako ako vo vyššie uvedených prípadoch vedené prevahou pôrodníckych argumentov po multidisciplinárnej diskusii.
5. Liečba v laktačnom období
Hodnotenie rizikovosti používania lieku v laktačnom období vychádza jednak z farmakokinetického zhodnotenia prechodu liečiva do materského mlieka, pričom sa dávka vyjadruje v percentách materskej dávky. Druhým typom údajov, na základe ktorých sa hodnotí rizikovosť použitia liečiva počas laktácie, sú klinické údaje z kohort sledujúcich deti dojčené matkami užívajúcimi daný liek. Vo všeobecnosti sú štúdie zamerané na bezpečnosť užívania liekov na liečbu IBD počas laktácie limitované a kvalita dát nízka, s výnimkou aminosalicylátov a tiopurínov, ktoré sú považované za nízkorizikové pre použitie dojčiacou matkou.
Aminosalicyláty a sulfasalazín
Sulfasalazín a aminosalicyláty sú považované za nízkorizikové počas laktácie. Sulfasalazín prechádza v akceptovateľnom množstve do materského mlieka [100]. Nízke riziko aminosalicylátov bolo potvrdené v prospektívnych štúdiách [101–103].
Imunosupresíva
Tiopuríny sú vylučované v malom množstve do materského mlieka, v malých kohortách sa nepreukázali detekovateľné hladiny metabolitov tiopurínov u detí dojčených matkami užívajúcimi tiopuríny v liečbe IBD [103–106]. Používanie tiopurínov počas laktácie je považované za nízkorizikové.
Cyklosporín vzhľadom k signifikantnému vylučovaniu do materského mlieka je kontraindikovaný pre použitie počas laktácie [107].
Kortikosteroidy
Kortikosteroidy sú vylučované do materského mlieka. Na limitovanie expozície dojčaťa sa odporúča nedojčiť počas 4 hod od užitia prednizonu alebo metylprednizolonu a mlieko vyprodukované počas týchto 4 hod odstriekať a na dojčenie nepoužiť [108,109].
Biologická liečba
Infliximab aj adalimumab boli detekované v materskom mlieku [83,110,111]. Je nejasné, či tieto hladiny môžu mať efekt na mukozálny imunitný systém, ani či expozícia malým dávkam z materského mlieka môže viesť k systémovej expozícii. Rozsahom limitované štúdie však ukazujú, že deti dojčené matkami liečenými anti-TNF biologikami sa nelíšia v psychomotorickom vývoji ani v infekčných rizikách v porovnaní s deťmi dojčenými IBD matkami užívajúcimi inú liečbu [83]. Liečba anti-TNF biologikami počas laktácie sa preto môže považovať za nízkorizikovú. S použitím vedolizumabu a ustekinumabu sú v súčasnosti len minimálne skúsenosti, limitované na niekoľko kazuistických sérií.
Table 1. Rizikový profil liečiv používaných v liečbe IBD pre reprodukčné zdravie.
Tab. 1. Risk profile of drugs used in the treatment of IBD for reproductive health.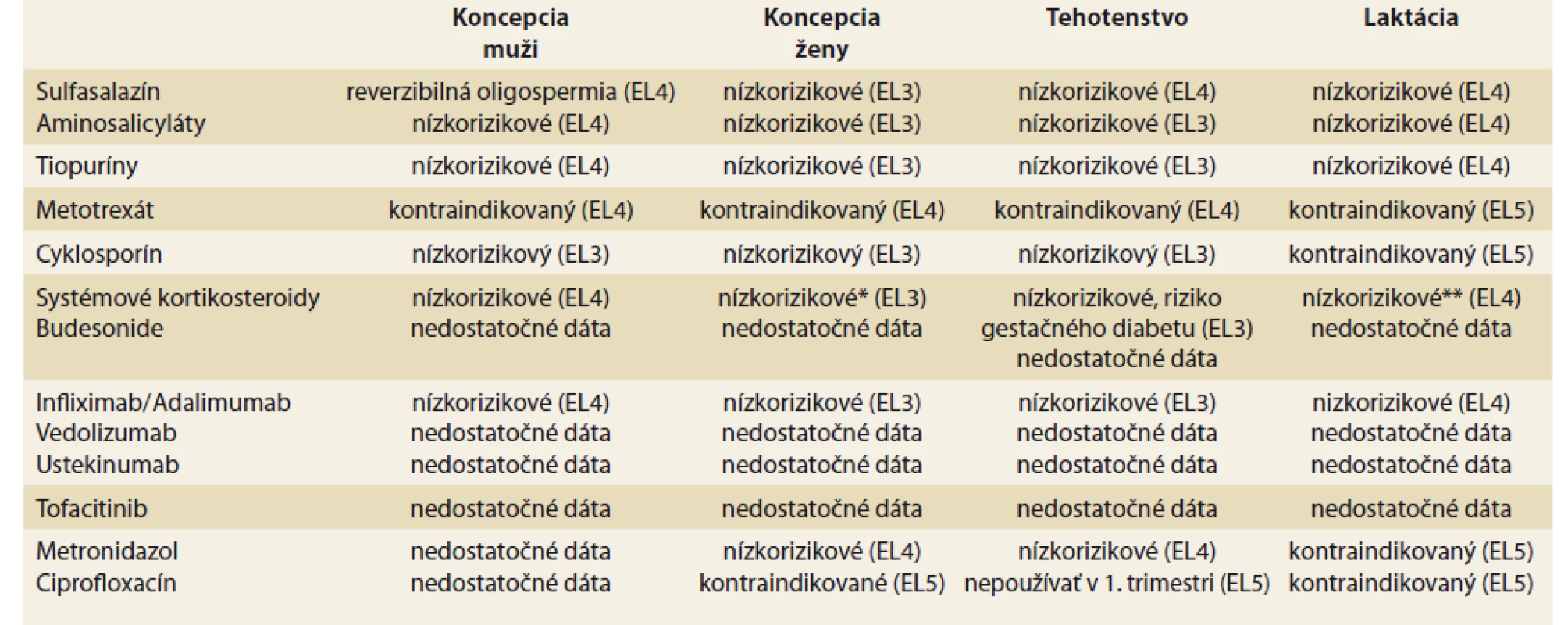
Poznámky
* preferovaný prednizon, prednizolon a metylprednizolon na zníženie intrauterin nej expozície
** na zníženie expozície je odporúčané nedojčiť počas 4 hod po užití lieku
*** reverzibilná oligospermia
**** sulfasalazín interferuje s metabolizmom kyseliny listovej, v perikoncepčnom období je potrebné zvýšiť jej dávku na 1 mg/ deňAntibiotiká
Metronidazol aj ciprofloxacín sú vylučované v signifikantnom množstve do materského mlieka a ich použitie počas laktácie je kontraindikované [112,113].
Odporúčanie 1
Aktivita IBD v perikoncepčnom období a/alebo počas tehotenstva je asociovaná so signifikantným zvýšením rizika nepriaznivého priebehu tehotenstva tak pre matku ako pre dieťa (EL3).
Ošetrujúci gastroenterológ by sa mal aktívne pýtať na reprodukčné plány pacientov s IBD a poskytnúť prekoncepčné poradenstvo. Prekoncepčné poradenstvo znižuje riziko relapsu počas gravidity (EL3).
Odporúčanie 2
Pri indikácii IBD liečby v perikoncepčnom období a v tehotenstve je potrebné zvážiť pomer rizika aktívneho ochorenia v porovnaní s rizikovým profilom liečiva (EL3).
Odporúčanie 3
IBD pacienti liečení sulfasalazínom alebo mesalazínom, u ktorých nedôjde k spontánnej koncepcii v priebehu 12 mesiacov by mali byť upozornení na riziko azoo/oligospermie s odporučením urologickej konzultácie s vyšetrením spermiogramu (EL4).
V prípade azoo/oligospermie je vhodné odporučiť prerušenie liečby sulfasalazínom/mesalazínom s kontrolným spermiogramom po mi-nimálnej dobe vysadenia 3 mesiace (EL4).
Odporúčanie 4
Monoklonové protilátky prechádzajú placentou od 2. trimestra (EL3).
Pri anti-TNF liečbe-Pri aktivite IBD v tehotenstve, alebo vysokom riziku relapsu nie je vhodné túto liečbu v tehotenstve prerušovať (EL3-4).
Pri ochorení v klinickej remisii je možné liečbu prerušiť v 18.–26. gestačnom týždni (EL3).
Pri akejkoľvek dĺžke anti-TNF liečby v tehotenstve je vhodné skontrolovať hladinu anti-TNF v pupočníkovej krvi (EL4).
Odporúčanie 5
Riziká spojené s priamou expozíciou kombinovanej imunosupresii pre dieťa a/alebo pre matku v súčasnosti nie sú jednoznačne známe (EL3).
Odporúčanie 6
Rozhodnutie o modus partus je predmetom multidiscplinárnej diskusie a primárne ho určujú pôrodnícke okolnosti (EL5).
Cisársky rez je indikovaný v prípade aktívnej perianálnej choroby alebo pri aktivite ochorenia v rekte (EL5).
Ileo-pauč-análna anastomóza alebo ileo-rekto-anastomóza predstavujú relatívnu indikáciu pre cisársky rez u žien s IBD (EL5).
Doručené: 27. 1. 2020
Prijaté: 4. 2. 2020
doc. MUDr. Zuzana Zelinková, PhD.
Univerzitná nemocnica – Nemocnica svätého Michala, a. s.
Satinského 1/I.7770
811 08 Bratislava
Slovenská republika
Sources
Seznam literatury je dostupný na www.csgh.info.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2020 Issue 1-
All articles in this issue
- Na prahu dalšího ročníku a výročí bitvy na Bílé hoře
- Kolik stojí idiopatické střevní záněty?
- Odporúčania slovenskej pracovnej skupiny pre IBD pri SGS pre liečbu IBD v reprodukčnom veku
- Telemedicína a idiopatické střevní záněty – výsledky pilotního projektu IBD Asistent
- Priame náklady na liečbu nešpecifických zápalových ochorení čreva
- Ustekinumab – nová biologická léčba ulcerózní kolitidy
- Ako správne vybrať vhodného pacienta s IBD na liečbu vedolizumabom
- Překvapivá příčina úmrtí pacienta s krvácením do horního trávicího traktu
- Transplantace střevní mikrobioty – historie, současnost a budoucnost
- Glomerulopatie u pacientů s idiopatickými střevními záněty
- Díl VII. – Časové trendy v objemu a zastoupení různých typů hospitalizací pacientů s IBD
- Docent MUDr. Václav Jirásek, CSc., zemřel 31. prosince 2019
- MUDr. Branislav Valach zemřel (28. 6. 1951 – 27. 12. 2019)
- Výběr z mezinárodních časopisů
- Autodidaktický test: IBD
- Účinnost a bezpečnost tofacitinibu u ulcerózní kolitidy v týdnu 8 – výsledky z klinické praxe
- Nové poznatky o tlustém střevě prof. Jaroslaw Regula – Gastro Update Europe 2019, Budapest
- Nemoci a infekce tenkého střeva prof. Gerhard Rogler – Gastro Update Europe 2019, Budapest
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Transplantace střevní mikrobioty – historie, současnost a budoucnost
- Ustekinumab – nová biologická léčba ulcerózní kolitidy
- Překvapivá příčina úmrtí pacienta s krvácením do horního trávicího traktu
- Telemedicína a idiopatické střevní záněty – výsledky pilotního projektu IBD Asistent
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

