-
Medical journals
- Career
Léčba Crohnovy choroby ustekinumabem v těhotenství – kazuistika
Authors: Lukešová L. 1; Nedbalová L. 1; Šerclová Z. 2
Authors‘ workplace: Centrum pro biologickou léčbu nespecifických střevních zánětů, Gastroenterologie, Nemocnice Turnov, KN Liberec, a. s. 1; Chirurgické oddělení, Nemocnice Hořovice 2
Published in: Gastroent Hepatol 2019; 73(1): 43-45
Category: IBD: Case Report
doi: https://doi.org/10.14735/amgh201943Overview
Při terapii pacientek s idiopatickým střevním zánětem (IBD – inflammatory bowel disease) v graviditě je důležitá rovnováha mezi udržením remise a bezpečností léčby. Koncepce a gravidita by měly být plánovány na dobu remise onemocnění a léčba, které k ní vedla, má pokračovat i v graviditě. S výjimkou metotrexátu jsou léky užívané k terapii IBD v graviditě a laktaci bezpečné. V současné době je k dispozici množství dat o léčbě anti-tumor nekrotizující faktor α (anti-TNFα) protilátkami, která svědčí pro bezpečnost léčby v graviditě pro matku i dítě. U dětí exponovaných anti-TNF terapii intrauterinně nebyl prokázán vyšší výskyt infekčních komplikací, alergií ani imunodeficitních stavů. S léčbou ustekinumabem v průběhu gravidity jsou v současné době jen omezené zkušenosti, většina dat pochází z oblasti dermatologie, kde je lék podáván v nižší dávce ve srovnání s Crohnovou chorobou (CD – Crohn’s disease). V předložené kazuistice autorky popisují případ pacientky s CD, u níž léčba ustekinumabem navodila klinickou, laboratorní a parciální slizniční remisi a udržela ji v průběhu celé gravidity. Ve 38. týdnu pacientka porodila zdravou dceru, která nadále velmi dobře prospívá.
Klíčová slova:
idiopatické střevní záněty – anti-TNFα – infliximab – adalimumab – ustekinumab – gravidita – Crohnova choroba – biologická léčba
Popis případu
Pacientka narozená v roce 1991 je jednou ze tří sester postižených idiopatickým střevním zánětem (IBD – inflammatory bowel disease). Starší sestra pacientky má kolonickou formu Crohnovy choroby (CD – Crohn’s desease), nejmladší sestra je sledována pro ulcerózní kolitidu. Pacientka sama trpí těžkou intraluminální kolonickou formou CD od 6 let. V průběhu léčby selhala postupně konvenční terapie systémovými kortikosteroidy (SKS), thiopuriny netolerovala. V 15 letech byla operována pro podezření na apendicitidu a poté opakovaně pro abscesy v ileocekální oblasti. Po hospitalizaci pro závažnou exacerbaci v 17 letech byla doporučena do našeho centra ke zvážení biologické léčby. Vzhledem k těžké endoskopické aktivitě choroby, častým relapsům, kortikodependenci a nesnášenlivosti azathioprinu byla v roce 2008 zahájena léčba infliximabem (IFX).
Pacientka se klinicky a laboratorně zlepšila, prokázali jsme slizniční zhojení. Během roku 2009 byl průběh onemocnění komplikován častými infekcemi horních dýchacích cest a tonzilitidami s opakovanou nutností přerušení léčby IFX. Následný těžký relaps si vyžádal opětovné podání SKS a v roce 2010 byl proveden switch na adalimumab (ADA). Pro přetrvávající těžké postižení ileocekální oblasti a vzestupného tračníku podstoupila pacientka v červnu 2010 pravostrannou hemikolektomii s vytvořením ileokolické anastomózy. Jelikož pacientka vykazovala atributy prognosticky nepříznivého a závažného průběhu choroby, zahájili jsme krátce po operaci opět terapii ADA.
V roce 2013 došlo navzdory intenzifikovanému režimu léčby ADA k dalšímu klinickému a laboratornímu zhoršení, pacientka podstoupila subtotální kolektomii a byla vytvořena ileorektální anastomóza. Navzdory pokračující léčbě však onemocnění progredovalo a v roce 2014 se poprvé manifestovala perianální forma CD. Pacientka podstoupila chirurgickou drenáž a vzhledem k těžkému postižení rekta i odlehčující ileostomii. K léčbě ADA byl přidán metotrexát, opakovaně byly drénovány perianální píštěle a píštěl rektovaginální. Tato léčba však neměla zřetelný vliv na těžké postižení anu a rekta (obr. 1), a proto byla v dubnu 2017 zahájena terapie ustekinumabem v indukční dávce 390 mg intravenózně, metotrexát byl vysazen. Při pokračující léčbě ustekinumabem v režimu 90 mg subkutánně (s.c.) po 8 týdnech začaly ustupovat zánětlivé změny v pahýlu rekta, hojení však bylo provázeno vznikem stenózy anorektálního přechodu s nutností opakované dilatace (obr. 2).
Image 1. Pahýl rekta před zahájením léčby ustekinumabem.
Fig. 1. The rectal stump before ustekinumab is started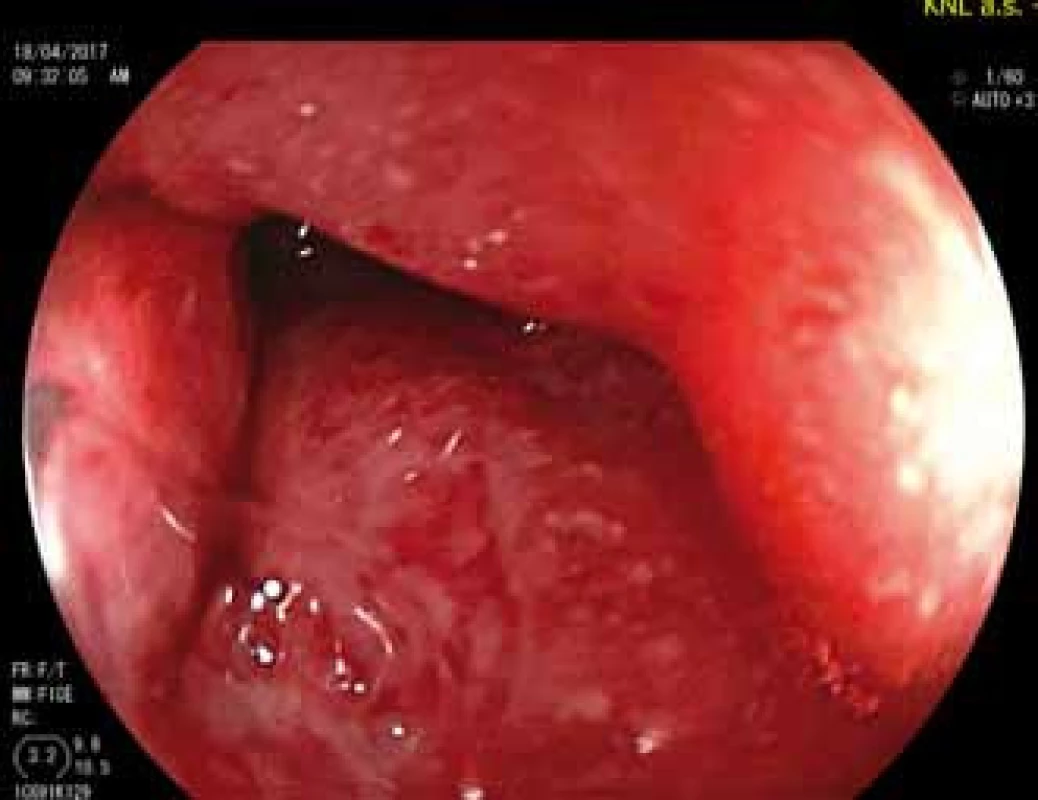
Image 2. Stav po dilataci rekta po zahájení léčby ustekinumabem.
Fig. 2. Dilatation of rectum after initiation of treatment with ustekinumab.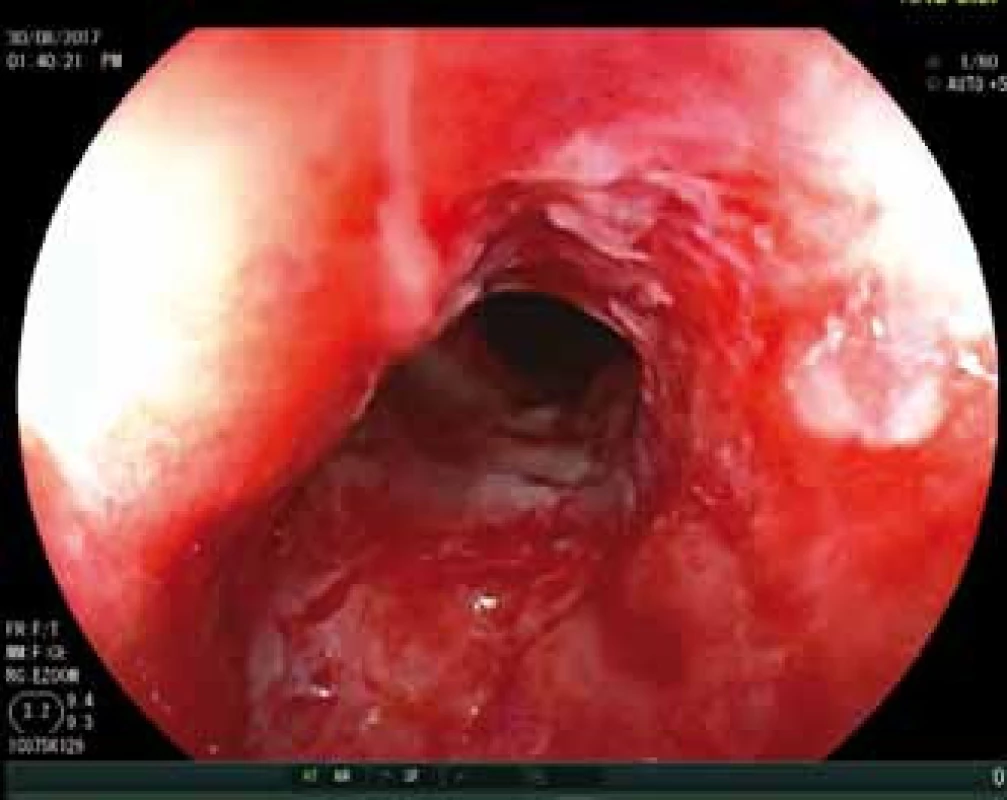
Image 3. Pahýl rekta během léčby ustekinumabem.
Fig. 3. The rectal stump during treatment with ustekinumab.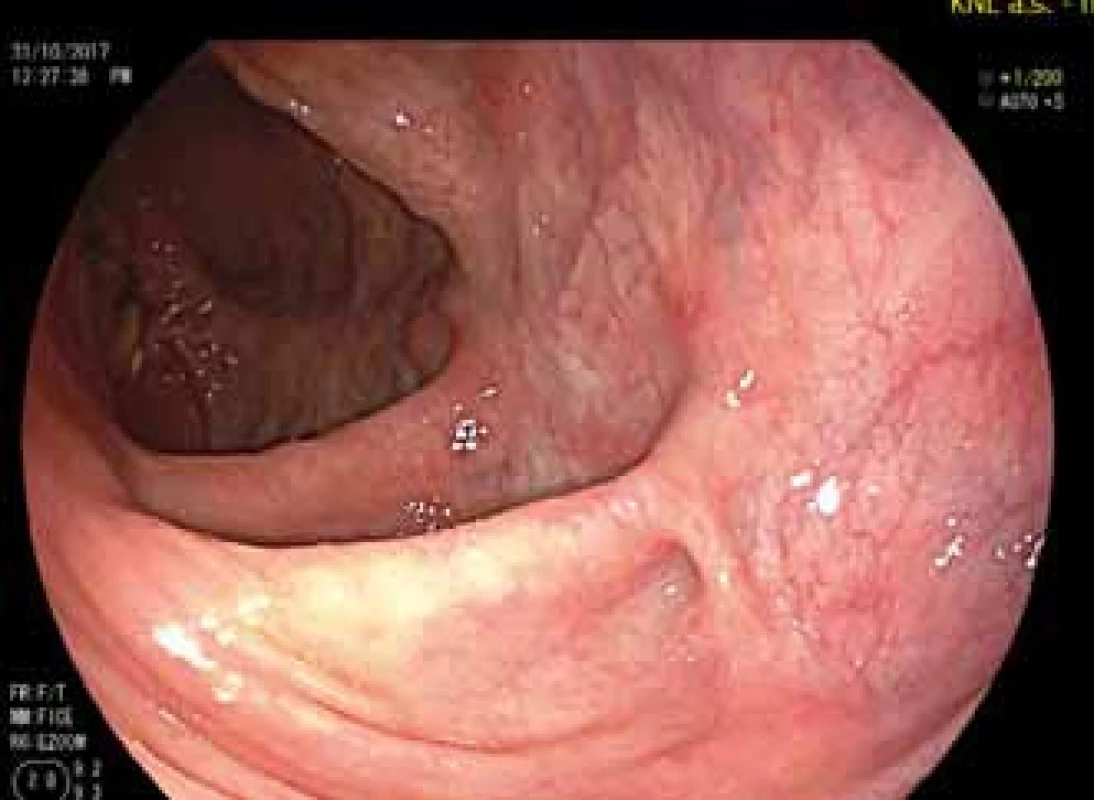
Koncem října 2017 pacientka oznámila, že je v 5. týdnu gravidity. Její klinický stav byl dobrý, normalizovaly se laboratorní parametry zánětu (fekální kalprotektin, krevní obraz a C reaktivní protein) a výrazně se zlepšil i endoskopický nález v rektu (obr. 3). Bylo zřejmé, že terapie ustekinumabem je efektivní a s ohledem na závažný a komplikovaný průběh onemocnění bylo rozhodnuto o jejím pokračování po celou dobu gravidity. Ustekinumab byl proto nadále aplikován v dávce 90 mg s.c. v intervalu 8 týdnů. Průběh gravidity byl klidný jak z hlediska CD, tak i z hlediska gynekologického. Počátkem června 2018 porodila pacientka ve 38. týdnu gravidity zdravou dceru, porod byl veden plánovaně sekcí s ohledem na předchozí průběh nemoci a zejména z důvodu těžké perianální formy CD. Během porodu ani v období poporodním nedošlo k žádné komplikaci, terminální ileostomie zůstala neporušena. Porodní váha dítěte byla nízká (2 180 g, 43 cm), avšak jeho celkový stav v době porodu byl velmi dobrý. V průběhu prvních 6 měsíců života se neobjevila žádná infekční komplikace a vyšetření hladiny ustekinumabu v 6. měsíci neprokázalo přítomnost léku v séru dítěte. Léčba pacientky ustekinumabem pokračuje i po porodu.
Diskuze
Naše kazuistika popisuje komplikovaný průběh CD u pacientky s těžkým intraluminálním postižením a současně perianální formou CD. U pacientky došlo postupně k selhání konvenční terapie a následně i léčby IFX a ADA. Po několika chirurgických intervencích, jejichž výsledkem byla subtotální kolektomie s ponechaným pahýlem rekta a terminální ileostomie, byla zahájena léčba ustekinumabem. Příznivá odpověď se projevila zlepšením klinického stavu i endoskopického nálezu v rektu a normalizací laboratorních parametrů. Přibližně půl roku po zahájení léčby ustekinumabem pacientka otěhotněla. Vzhledem k vysokému riziku komplikací CD pokračovala terapie ustekinumabem po celou dobu gravidity a pacientka porodila ve 38. týdnu zdravou dceru. I přes nižší porodní váhu byl vývoj dítěte v prvních 6 měsících normální a bez komplikací.
U těhotných pacientek s IBD se v současnosti řídíme dvěma základními pravidly: 1. pro úspěšný a nekomplikovaný průběh gravidity je nutné, aby ke koncepci došlo v klidové fázi onemocnění a remise byla udržena po celou dobu těhotenství; 2. pravidlo říká, že léky používané v terapii IBD jsou, s výjimkou metotrexátu, bezpečné a nemají nežádoucí vliv na matku, plod ani novorozence. Platí to i pro biologické preparáty, resp. protilátky anti-TNFα (tumor nekrotizující faktor α). Informace o této kategorii biologik jsou již dostatečně obsáhlé a jejich bezpečnost je podrobně zdokumentována [1– 6].
V případě ustekinumabu máme k dispozici dat podstatně méně. Stejně jako v případě anti-TNF protilátek patří i ustekinumab mezi imunoglobuliny IgG1, pro něž je charakteristický aktivní transplacentární přenos zejména ve 3. trimestru. Toxikologická data získaná na zvířecích modelech žádné nežádoucí účinky ustekinumabu na graviditu či plod neprokázala, Food and Drug Administration proto lék zařadila do kategorie B, stejně jako infliximab a ADA [7].
Většina údajů o léčbě ustekinumabem v těhotenství pochází z populace pacientek léčených pro psoriázu (registr PSOLAR). V této oblasti nebyly zaznamenány žádné signály svědčící pro zvýšené riziko nežádoucích účinků ustekinumabu na vývoj plodu, průběh porodu, event. zdravotní stav dětí exponovaných intrauterinně tomuto léku [8]. Je však třeba zdůraznit, že ustekinumab je v dermatologii podáván v dávce 45 mg s.c. po 12 týdnech, tedy dávce zřetelně nižší ve srovnání s léčbou CD.
V oblasti IBD jsou v současné době k dispozici jednak data z registračních studií, jednak kazuistiky či kazuistické série. Scherl et al popsali soubor 26 pacientek léčených v rámci klinických studií s ustekinumabem u pacientů s CD [9]. V tomto souboru skončilo 17 % gravidit spontánním potratem, tato hodnota se zásadně neliší od situace v běžné populaci. Ve všech uvedených případech skončilo těhotenství v 1. trimestru. U pacientek tohoto souboru však byla léčba ukončena ihned po zjištění gravidity, a vliv pokračující léčby ustekinumabem na pozdější fáze gravidity tak nebylo možno hodnotit. Kazuistická sdělení informují většinou o úspěšném průběhu gravidity i porodu u matek léčených po celou dobu těhotenství stejně, jako tomu bylo u naší pacientky [10– 12]. Podobně jako je tomu v případě IFX a ADA, převyšují koncentrace ustekinumabu v séru novorozenců (měřené v pupečníkové krvi) několikanásobně koncentrace mateřské [11,12]. U matek, které pokračovaly v terapii ustekinumabem po porodu, se lék objevuje v mateřském mléce asi ve dvou třetinách případů, tato hodnota je srovnatelná s IFX [13]. Navzdory přítomnosti léku v mateřském mléce však nebyly u takto exponovaných dětí pozorovány žádné nežádoucí účinky.
V naší kazuistice popisujeme první případ pacientky s CD v ČR, která byla v průběhu celé gravidity efektivně léčena ustekinumabem, přičemž tato léčba neměla žádné nežádoucí účinky na průběh gravidity ani stav novorozence. Dostupná data svědčí pro to, že ustekinumab je lékem v graviditě i laktaci bezpečným.
Autorky deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Doručeno: 5. 2. 2019
Přijato: 10. 2. 2019
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MU Dr. Lucie Lukešová
Centrum pro biologickou léčbu
nespecifických střevních zánětů,
Gastroenterologie
Nemocnice Turnov
28. října 1000, 511 01 Turnov
Sources
1. Vermeire S, Carbonnel F, Coulie PG et al. Management of inflammatory bowel disease in pregnancy. J Crohns Colitis 2012; 6(8): 811−823. doi: doi: 10.1016/ j.crohns.2012.04.009.
2. van der Woude CJ, Ardizzone S, Bengtson MB et al. The second European evidencedbased consensus on reproduction and pregnancy in inflammatory bowel disease. J Crohns Colitis 2015; 9(2): 107−124. doi: 10.1093/ ecco-jcc/ jju006.
3. Damas OM, Deshpande AR, Avalos DJ et al. Treating inflammatory bowel disease in pregnancy: the issues we face today. J Crohns Colitis 2015; 9(10): 928−936. doi: 10.1093/ ecco-jcc/ jjv118.
4. Glover LE, Fennimore B, Wingfield M. Inflammatory bowel disease: influence and implications in reproduction. Inflamm Bowel Dis 2016; 22(11): 2724– 2732. doi: 10.1097/ MIB.0000000000000884.
5. Bortlik M, Duricova D, Machkova N et al. Impact of anti-tumor necrosis factor alpha antibodies administered to pregnant women with inflammatory bowel disease on long-term outcome of exposed children. Inflamm Bowel Dis 2014; 20(3): 495– 501. doi: 10.1097/ 01.MIB. 0000440984.86659.4f.
6. Mahadevan U, Martin CF, Sandler RS et al. PIANO: A 1000 patient prospective registry of pregnancy outcomes in women with IBD exposed to immunomodulators and biologic therapy. Gastroenetol 2012: S149. [online]. Available from: https:/ / www.gastrojournal.org/ article/ S0016-5085(12)60561-7/ pdf.
7. SPC LP Stelara. [online]. Dostupné z: https:/ / www.ema.europa.eu/ documents/ product-information/ stelara-epar-product-information_cs.pdf.
8. Galluzzo M, D’Adamio S, Bianchi L. Psoriasis in pregnancy: case series and literature review of data concerning exposure during pregnancy to ustekinumab. J Dermatolog Treat 2018 : 1– 5. doi: 10.1080/ 09546634.2018.1468066.
9. Scherl E, Jacobstein D, Murphy C et al. A109 pregnancy outcomes in women exposedto ustekinumab in the Crohn’s disease clinical development program. J Can Assoc Gastroenterol 2018; 1 (Suppl 2): 166. doi: 10.1093/ jcag/ gwy009.109.
10. Cortes X, Borrás-Blasco J, Antequera B et al. J Clin Pharm Ther 2017; 42(2): 234– 236. doi: 10.1111/ jcpt.12492.
11. Rowan CR, Cullen G, Mulcahy HE et al. Ustekinumab drug levels in maternal and cord blood in a woman with Crohn‘s disease treated until 33 weeks of gestation. J Crohns Colitis 2018; 12(3): 376– 378. doi: 10.1093/ ecco-jcc/ jjx141.
12. Klenske E, Osaba L, Nagore D et al. Drug levels in the maternal serum, cord blood and breast milk of a ustekinumab-treated patient with Crohn‘s disease. J Crohns Colitis 2019; 13(2): 267– 269. doi: 10.1093/ ecco-jcc/ jjy153.
13. Matro R, Martin CF, Wolf D et al. Exposure concentrations of infants breastfed by women receiving biologic therapies for inflammatory bowel diseases and effects of breastfeeding on infections and development. Gastroenterology 2018; 155(3): 696– 704. doi: 10.1053/ j.gastro.2018.05.040.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2019 Issue 1-
All articles in this issue
- Novinky pro rok 2019
- Biologika v léčbě idiopatických střevních zánětů – počtvrté
- Idiopatické střevní záněty v posudkovém lékařství
- Léčba Crohnovy choroby ustekinumabem v těhotenství – kazuistika
- Překvapivá etiologie stenózy terminálního choledochu
- Terapeutický test s inhibítory protónovej pumpy v manažmente pacientov s laryngofaryngálnym refluxom
- Zlepší komprese břicha pásem úspěšnost a toleranci koloskopie?
- Toxické a lékové poškození jater a ledvin
- Výběr z mezinárodních časopisů
- Clensia® – první kombinovaný očistný prostředek se simetikonem
- Vedolizumab vs. ustekinumab u Crohnovy choroby jako léčivo druhé linie v klinické praxi
- Hladiny vedolizumabu měřené v časné fázi léčby nemají vztah ke krátkodobé odpovědi na terapii u pacientů s idiopatickými střevními záněty
- Crohnova nemoc ileocekální oblasti a familiární adenomatózní polypóza u jednoho pacienta – kazuistika
- First European Conference of Young Gastroenterologists – ECYG
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Clensia® – první kombinovaný očistný prostředek se simetikonem
- Toxické a lékové poškození jater a ledvin
- Překvapivá etiologie stenózy terminálního choledochu
- Terapeutický test s inhibítory protónovej pumpy v manažmente pacientov s laryngofaryngálnym refluxom
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

