-
Medical journals
- Career
Využití panelu somatických genových mutací a amplifikací pro odhad prognózy pacientů s karcinomem žaludku
Authors: L. Benešová 1; P. Mináriková 2; T. Hálková 1; B. Belšánová 1; Š. Suchánek 2; F. Bělina 3; L. Dušek 4; Jiří Jarkovský 4; M. Zavoral 2; M. Minárik 1,2
Authors‘ workplace: Genomac výzkumný ústav, s. r. o., Centrum aplikované genomiky solidních nádorů, Praha 1; Interní klinika 1. LF UK a ÚVN – VFN Praha 2; Chirurgická klinika 2. LF UK a ÚVN – VFN Praha 3; Institut biostatistiky a analýz, LF a PřF MU, Brno 4
Published in: Gastroent Hepatol 2016; 70(3): 244-251
Category: Gastrointestinal Oncology: Original Article
doi: https://doi.org/10.14735/amgh2016244Overview
I přesto, že se pětileté přežívání pacientů s karcinomem žaludku za posledních 20 let zlepšilo jen minimálně, existují specifické podskupiny pacientů, které přežívají výrazně déle. Významným tématem se tak stává hledání markerů na úrovni genových poruch umožňujících individualizovaný odhad prognózy pacientů. Cílem projektu bylo provést profilování somatických bodových mutací a genových amplifikací pro zmapování výskytu v české populaci a případně identifikace potenciálních prognostických markerů karcinomu žaludku.
Materiál a metody:
Soubor vyšetřených čítal 70 pacientů s histologicky potvrzeným karcinomem žaludku. Vzorky byly získány ve formě FFPE bločků z endoskopických tkáňových biopsií nebo resekátů u pacientů podstupujících operaci. Byla provedena vyšetření mutací genů KRAS, BRAF, PIK3CA, EGFR, CTNNB1, TP53 a APC a panelu amplifikací 29 genů zahrnujících nejčastější (proto)onkogeny a tumor supresorové geny procesu vzniku a progrese nádoru. Výsledky byly korelovány s klinickými daty vč. stadia, lokalizace a histopatologického podtypu karcinomu a přežití pacientů. Korelace amplifikací a mutací s přežitím byla analyzována Kaplan-Meierovou metodikou, relativní poměry rizik (HR – hazard ratio) byly analyzovány na základě vícerozměrného testu dle Coxova modelu proporcionálního rizika.Výsledky:
Četnosti poruch byly nižší ve srovnání s celosvětovou populací. Shluková analýza identifikovala specifickou skupinu profilů se zhoršeným přežitím (HR = 7,36; 95% CI 1,34 – 40,4; p = 0,022). Při analýze amplifikací pro tuto skupinu, PDGFRB, ERBB2, RET, EGFR, CCND1 a CDKN1B (p27/ Kip1), byl zjištěn zvýšený HR u pacientů s amplifikací u minimálně dvou genů (HR = 4,66; 95% CI 1,5 – 14,43; p = 0,008).Závěr:
V této studii byla určena frekvence somatických mutací a genových amplifikací u českých pacientů s karcinomem žaludku. Dále byla identifikována skupina genových amplifikací, které by mohly sloužit k odhadu prognózy pacientů. Pro ověření výsledků bude nutno provést validaci na rozšířeném souboru pacientů, pravděpodobně kombinací typicky malých souborů vzorků z více pracovišť. V případě potvrzení by vyšetřování této skupiny markerů mohlo najít uplatnění při racionálním rozhodování o léčbě, a tím zajistit celkové zlepšení přežívání pacientů s karcinomem žaludku.Klíčová slova:
karcinom žaludku – genová amplifikace – bodové mutace – shluková analýzaÚvod
Karcinom žaludku představuje v ČR v současnosti třetí nejčastější nádor gastrointestinálního traktu s udávanou incidencí 6,8 nemocných na 100 tis. obyvatel [1]. Přestože ve srovnání s jinými částmi světa, především s částí východní Asie a Latinské Ameriky, kde se hodnoty pohybují kolem 30, resp. 20/ 100 tis. [2], je tato incidence relativně nízká, jedná se o velmi závažnou malignitu, která je v naprosté většině případů diagnostikována v pokročilém stadiu, a následné terapeutické možnosti jsou tak velmi omezeny. Obdobně jako v jiných vyspělých zemích se pětileté přežití pohybuje na hranici 30 % bez rozdílu stadií a méně než 20 a 10 % pro pokročilá stadia III, resp. IV.
Vývoj tohoto multifaktoriálního onemocnění je založen na mnohastupňovém procesu morfologických změn vycházejících z premaligních stavů chronické atrofické gastritidy a intestinální metaplazie na podkladě defektů na molekulární úrovni. Důležitým rizikovým faktorem, který se může podílet na iniciaci celého procesu, je také infekce Helicobacter pylori [3]. Uplatňují se v něm jednak faktory environmentální, jako např. obsah nitrátů/ nitritů či nadbytek soli v potravě, nedostatek čerstvé zeleniny a ovoce a s tím spojený deficit vitaminu především C a A, tak i faktory genetické predispozice, např. omezené funkce systémů DNA oprav (DNA repair systems) nebo řízené buněčné smrti (apoptosis systems) vedoucí k nekontrolovatelné proliferaci (dělení a růstu buněk). S výše uvedenou charakteristikou též úzce souvisí rozmanitost průběhu tohoto onemocnění, na který mají vliv klíčové klinické faktory, kterými jsou věk, lokalizace nádoru, stadium a stupeň diferenciace. Průběh a především celkové přežití pacientů je též definováno histopatologickou klasifikací rozlišující dva základní tzv. Laurenovy podtypy karcinomu žaludku – intestinální a difuzní typ. Zatímco klinický průběh intestinálního typu má obdobný charakter jako kolorektální karcinom, tzn. zakládající vzdálené metastázy do jater a plic, difuzní typ je typický horší prognózou s vysoce agresivním růstem s metastatickým postižením do kostí nebo peritoneálním šířením [4]. Tyto morfologické odlišnosti a především výrazná heterogenita průběhu onemocnění jsou projevem rozdílných pochodů probíhajících v malignizovaných buňkách žaludku.
Již před více než 10 lety byly identifikovány základní molekulárních cesty karcinogeneze nádorů žaludku a současně i jejich vztah k jednotlivým histologickým podtypům [5]. Teprve nedávný vývoj v oblasti metod nádorové genomiky, především celogenomového sekvenování nové generace, však umožnil detailní zmapování molekulárních profilů a určení základních tzv. molekulárních subtypů [6,7]. Tato molekulární klasifikace byla založena na výskytu charakteristických poruch DNA zahrnující zejména somatické mutace a genové amplifikace. Jako jeden z nejvýznamnějších faktorů provázejících morfologické mezistadium atrofické gastritidy tak byly identifikovány mutace tumor supresorových genů TP53 a APC, které jsou časté i v ostatních nádorech gastrointestinálního traktu. Mutace genu TP53, které, mimo jiné, mohou vést k selhání kontroly buněčného cyklu a systému buněčné apoptózy, jsou u intestinálního typu nalézány s frekvencí až 60 %. Mutace tumor supresoru APC, který kóduje regulátory kontaktní inhibice a jehož dysfunkce typicky vede ve tkáních k polypózním strukturám, jsou nalézány u cca 9 % intestinálních nádorů žaludku. Další skupinou genů často vykazujících postižení v nádorových buňkách žaludku jsou geny kódující receptory růstových faktorů, transmembránové proteiny spouštějící buněčnou signalizaci. Nejčastější poruchou těchto tzv. receptorových tyrozinkináz (RTK) je jejich amplifikace vedoucí k nadměrné stimulaci růstu, dělení a diferenciaci [8]. Mezi nejvýznamnější RTK patří erbB-2 protein (označovaný jako CD340 nebo Neu) kódovaný genem ERBB2 (známější pod odznačením HER2/ Neu) a ze stejné rodiny pocházející protein erbB-1 kódovaný genem HER1 (častěji pod označením EGFR). Amplifikace receptoru HER2/ Neu je v současné době indikací k léčbě trastuzumabem, monoklonální protilátkou proti HER2, která v kombinaci se standardní chemoterapií prodlužuje celkové přežití pacientů s metastatickým karcinomem žaludku [9]. Dalšími RTK účastnícími se maligních pochodů GIT jsou potom proteiny CD332 kódované známým genem FGFR2, c-Met kódovaný genem MET (též pod označením HGFR), VEGFR (gen VEGFR) a PDGFR (gen PDGFR).
Pro vznik difuzního typu nádoru žaludku jsou charakteristické poruchy systému buněčné adheze, invaze a metastazování. Jedná se především o mutace genů CDH1, které jsou zachyceny u cca 20 % sporadických difuzních karcinomů žaludku, a RHOA, taktéž s frekvencí cca 20 %.
Předkládaná práce je zaměřena na vyšetřování somatických genových poruch u karcinomů žaludku. Studovány byly poruchy charakteristické pro gastrointestinální neoplazii zahrnující somatické genové mutace a genové amplifikace významných (proto)onkogenů a tumor supresorových genů. Cílem bylo zjistit jejich spektrum (frekvenci výskytu) a především jejich souvislost s přežitím pro identifikaci potenciálních prognostických faktorů využitelných pro management pacientů s karcinomem žaludku.
Materiál a metody
Design studie byl schválen vědeckou a etickou komisí Vojenské fakultní nemocnice v Praze. Do studie bylo retrospektivně zahrnuto celkem 84 pacientů (všichni běloši, Evropané) s klinicky potvrzeným karcinomem žaludku, kteří byli léčeni chirurgicky a/ nebo chemo(radio)terapií v letech 2009 – 2015. Vzorky nádorové tkáně byly získány ve formě biopsie odebrané během endoskopického vyšetření žaludku, případně ve formě resekátu u pacientů podstupujících chirurgický výkon. Dále byla shromažďována klinická data týkající se stadia onemocnění, lokalizace nádoru, klasifikace podle Laurena a celkového přežití.
Nádorová DNA byla izolována ze vzorků pocházejících z endoskopických tkáňových biopsií nebo tkáňových resekátů (u pacientů podstupující operační zákrok) fixovaných formalinem a zalitých parafínem. Vzorky byly vždy nejprve pečlivě zhodnoceny patologem a byla vyznačena oblast s výskytem nádorové tkáně, aby se minimalizovala možnost ovlivnění výsledků v důsledku přítomnosti nenádorové tkáně. Z této vyznačené oblasti byla makrodisekcí vyňata část pro extrakci DNA, pro kterou byl použit izolační kit Jetqiuick Tissue DNA spin (Genomed, Löhne, Německo).
Mutační detekce byla prováděna s použitím metodiky denaturační kapilární elektroforézy na přístroji ABI PRISM® 3100 (Applied Biosciences, Foster City, Kalifornie, USA), jak bylo dříve popsáno [10]. Detekce byla zaměřena na skupinu sedmi genů čítající onkogeny (KRAS, BRAF, PIK3CA, EGFR a CTNNB1) a tumor supresorové geny (TP53 a APC), které často vykazují poruchy v gastrointestinálních nádorech. Mutační analýza byla zaměřena na „hot-spot“ oblasti těchto genů, které často obsahují somatické mutace. V případě onkogenů se jednalo o exon 2 genu KRAS, mutaci V600E genu BRAF, exony 9 a 20 genu PIK3CA a exon 3 genu CTNNB1. U tumor supresorových genů byly vyšetřovány oblasti exonu 5 – 8 genu TP53 a oblast tzv. mutačního cluster regionu exonu 15 (rozsah kodonů 1 286 – 1 513) genu APC.
Po provedení mutační analýzy byla zbylá DNA využita k vyšetření genových amplifikací celkem 29 genů účastnících se hlavních procesů proliferace (dělení a růstu), apoptózy a metastazování nádorových buněk. Vyšetření bylo provedeno metodou MLPA (multiplex ligation-dependent probe amplification) pomocí komerčně dostupných kitů (SALSA MLPA P144, SALSA MLPA P145 and SALSA MLPA P175, MRC Holland, Nizozemsko) podle pokynů výrobce. PCR produkty byly přečištěny na kolonce Sephadexu (AutoSeq G-50, GE Healthcare Bio-Sciences, Piscataway, New Jersey, USA) a analyzovány na 16kapilárním DNA analyzátoru (ABI PRISM 3100) v POP-7 separační matrici.
Výsledky MLPA analýzy byly vizualizovány a vyhodnoceny v programu GeneMarker za použití příslušných MLPA panelů (dostupné na webových stránkách www.softgenetics.com).
Analýza přežití pacientů byla provedena Kaplan-Meierovou metodou s porovnáním skupin pacientů pomocí log-rank testu. Vztah mezi molekulárními prediktory a přežitím pacientů byl hodnocen s použitím jednorozměrného a vícerozměrného Coxova modelu proporcionálních rizik a kvantifikován pomocí poměru rizik (HR – hazard ratio) a odpovídajícího 95% intervalu spolehlivosti. Asociace s mutacemi/ amplifikacemi genů byla založena na asociačních tabulkách binárních Jaccardových koeficientů podobnosti s následnou vizualizací v „heatmap“ diagramu a dendrogramu vypočteném s pomocí Ward algoritmu.
Výsledky
Celková úspěšnost extrakcí DNA z FFPE vzorků žaludečních tkání byla na úrovni 85 % (70/ 82). To bylo způsobeno především sníženými výtěžky izolace DNA z archivovaných vzorků žaludečních endoskopických biopsií zpracovaných do FFPE sekcí, z nichž jen v 70 % (25/ 36) byla získána DNA v požadovaném množství a kvalitě. Naproti tomu úspěšnost extrakce DNA z větších FFPE vzorků pocházejících z resekátů byla na standardní úrovni 98 % (45/ 46). Charakteristika finálně vyšetřeného souboru pacientů je uvedena v tab. 1.
Table 1. Základní charakteristika finálního souboru sledovaných pacientů. Tab. 1. Basic characteristics of the final study group. 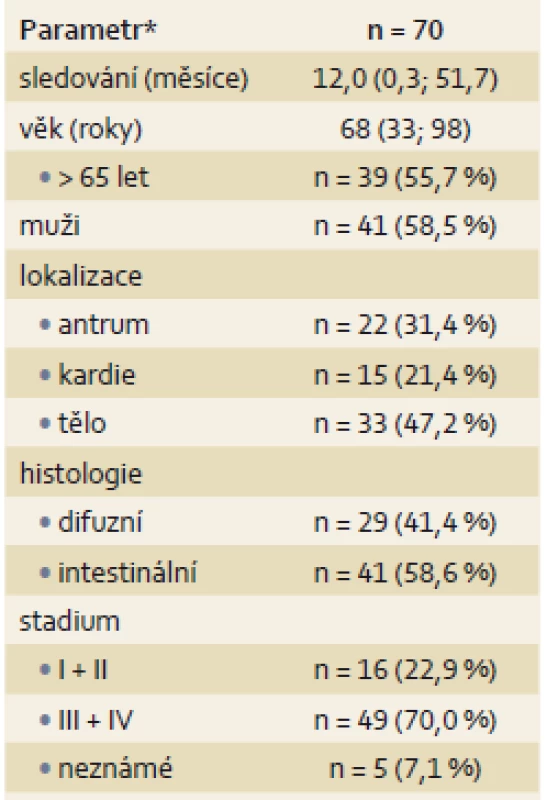
*medián, minima a maxima pro souvislé veličiny; absolutní a relativní hodnoty frekvencí Výskyt somatických mutací a genových amplifikací
Hodnotitelnost provedených DNA analýz byla 100 % (70/ 70). Získané frekvence somatických mutací a genových amplifikací jsou v grafu. 1. Jak je vidět, nejčastěji mutovaným byl gen TP53 s podílem 20 % (14/ 70), mutace ostatních genů se vyskytovaly s frekvencí nižší než 5 % (4,29 % PIK3CA; 2,86 % CTNNB1; APC a KRAS; 1,43 % EGFR), mutace genu BRAF zachycena nebyla (graf 1A). Genové amplifikace byly nalezeny u všech vzorků, nejčastější byly amplifikace genů CCND1 v 25,71 % (18/ 70), PDGFRB v 24,29 % (17/ 70) a CDKN1B (p27/ Kip1) ve 21,43 % (15/ 70). V ostatních případech byly frekvence amplifikací menší než 20 % (graf 1B). Amplifikace genu ERBB2 (HER2/ Neu) významná pro případné rozhodování o cílené biologické léčbě byla nalezena u 10 pacientů (14,29 %). Výskyt somatických mutací i genových amplifikací nebyl nijak asociován s klinickými parametry, jako je histologický typ, lokalizace nebo stadium nádoru.
Graph 1. Relativní četnost výskytu A. somatických mutací a B. genových amplifikací sledovaných genů v souboru 70 pacientů s karcinomem žaludku. Graph 1. Relative frequency of selected A. somatic mutations and B. gene amplifications of selected genes in 70 gastric cancer patients. 
Analýza přežití
U 52 pacientů byla dostupná informace o přežití. V analýze přežití pacientů byly hodnoceny klinické i molekulární faktory. Při jednorozměrné analýze klinických faktorů nebyl nalezen vztah mezi přežitím, pohlavím ani histologickým typem nádoru. Podle očekávání byl statisticky významný rozdíl v přežití potvrzen mezi skupinami pacientů s nádory v časných stadiích (I a II) ve srovnání s pokročilým onemocněním (stadia III a IV), kdy HR byl 5,622 (95% CI 1,706 – 18,529); p = 0,005. Střední doba přežití pacientů v pokročilých stadiích III a IV byla 10,2 měsíců, ve skupině pacientů se stadiem onemocnění I nebo II nebyl v době hodnocení dosažen medián přežití (p = 0,001). Z dalších klinických parametrů byla jako statisticky významný faktor potvrzena také lokalizace nádoru, kdy pacienti s nádory v oblasti kardie měli významně vyšší riziko ve srovnání s nádory v jiných částech žaludku. HR pro nádory v kardii byl 2,29 (95% CI 1,06 – 4,95; p = 0,035). Střední doba přežití pacientů s nádorem v oblasti kardie byla 10,2 měsíce vs. 10,8 v antru a 20,5 v těle žaludku (p = 0,097).
Výsledek shlukové analýzy podobnosti pacientů podle vyšetřovaných somatických mutací a genových amplifikací je znázorněn pomocí dvourozměrného diagramu (heatmap) a dendrogramů na grafu 2. Z výsledku je zřejmá existence několika shluků (I – III a IV pro ostatní), ve kterých pacienti vykazují podobné kombinace somatických mutací a genových amplifikací. Následně byla provedena Kaplan-Meierova analýza srovnání přežití pacientů v těchto shlucích. Výsledek je znázorněn na grafu 3. Jak je vidět, pacienti v různých shlucích vykazují pozorovatelné rozdíly v přežití. Shluk I vykazuje nejkratší přežití s mediánem 5 měsíců oproti shluku II (10,9 měsíců) a III (29,8 měsíců). Toto zjištění je bez statistické signifikance (p = 0,361), avšak vzhledem k současnému vlivu stadia a lokalizace bylo třeba provést zhodnocení jednotlivých shluků s využitím vícerozměrné analýzy s korekcí na věk, lokalizaci a stadium onemocnění. Na základě Coxova regresního modelu proporcionálního rizika byl následně zjištěn statisticky signifikantní HR pro pacienty ve shluku I (7,36; 95% CI1,34 – 40,4; p = 0,022).
Graph 2. Diagram shlukové analýzy výsledků molekulárního profilování somatických genových mutací a amplifikací. Graph 2. Dendrogram of a cluster analysis of the results of molecular profiling of selected somatic mutations and gene amplifications. 
mTP53 – mutovaný TP53, mKRAS – mutovaný KRAS, mBRAF – mutovaný BRAF, mPIK3CA – mutovaný PIK3CA, mEGFR – mutovaný EGFR, mAPC – mutovaný APC Graph 3. Přežití pacientů podle molekulárních profilů na základě výsledků shlukové analýzy. Graph 3. Patient survival according to molecular profiles based on cluster analysis results. 
Společným rysem pacientů ve shluku I jsou časté amplifikace genů pro RTK (PDGFRB, ERBB2, RET a EGFR) a genů kódujících proteiny zajišťující kontrolu buněčného cyklu (CCND1 a CDKN1B (p27/ Kip1)). Kaplan-Meierova analýza srovnání přežití pacientů podle celkového počtu postižených genů ze skupiny PDGFRB, ERBB2, RET, EGFR, CCND1 nebo CDKN1B (p27/ Kip1) rozšířená na celý sledovaný soubor odhalila rozdíly v přežití při srovnání pacientů, jejichž nádor nese amplifikaci pouze jednoho, případně žádného z těchto genů (graf 4). Pro nádory s více než dvěma geny s amplifikací byl medián přežití pouhých 4,5 měsíce oproti více než 30 měsícům přežití u pacientů s méně než dvěma geny s amplifikací (p = 0,237). Pro potlačení kofaktorů bylo obdobně jako v předchozím případě provedeno hodnocení Coxova regresního modelu proporcionálního rizika pro pacienty s nádory vykazujícími amplifikaci u min. dvou genů z uvedené skupiny. Výsledkem je taktéž statisticky signifikantně zvýšený HR pro pacienty s více než dvěma amplifikovanými geny 4,66 (95% CI 1,5 – 14,43); p = 0,008.
Graph 4. Přežití pacientů podle počtu amplifikovaných genů ze skupiny <em>PDGFRB, ERBB2, RET, EGFR, CCND1</em> a <em>CDKN1B (p27/Kip1)</em>. Graph 4. Patient survival according to the number of detected gene amplifications in a group containing <em>PDGFRB, ERBB2, RET, EGFR, CCND1</em> and <em>CDKN1B (p27/Kip1)</em>. 
Diskuze
Relativní výskyt somatických mutací ve studovaném souboru 70 pacientů odpovídá aktuálním údajům mezinárodní mutační databáze COSMIC [11], která uvádí shodné pořadí četnosti výskytu mutací v genech studovaných v tomto projektu s TP53 jako nejčastěji mutovaným. Absolutní četnost mutací uváděná v COSMIC je o něco vyšší než v našem souboru (32 vs. 20 % pro TP53, 9 vs. 4,9 % pro PIK3CA, 5 vs. 2,86 % pro CTNNB1, APC a KRAS, 4 vs. 1,43 % pro EGFR a 1,25 vs. 0 % pro BRAF). Rozdíly v absolutních četnostech mohou být způsobeny v důsledku souhrnných hodnot pro všechny populace uváděné v COSMIC, případně též únikem některých méně častých mutací tumor supresorů TP53 a APC v našem souboru, neboť nenákladná metodika mutační analýzy použitá v této práci byla založena na cílené detekci vybraných regionů s častým výskytem mutací, nikoli na celogenovém scanování (viz Materiál a metody). Údaje o četnosti genových amplifikací katalogizovány nejsou, v případě žaludku je často uváděn poměr vzorků nesoucích amplifikaci genu ERBB2 (HER2/ Neu) na úrovni 20 – 25 % [12], což je o několik procent vyšší než četnost zjištěná ve skupině pacientů v tomto projektu. Důvodem pro rozdíl v absolutních četnostech může být již zmiňovaná populační specifita, obdobně jako je tomu v případě HER2 pozitivit u karcinomu prsu, kde je ve světě udáváno 20 %, zatímco v ČR je to 16 % [13]. Dalším možným důvodem je i relativně malý soubor pacientů ve studii.
Zcela zásadním výsledkem této práce je identifikace podskupiny genů, jejichž amplifikace mohou v kombinaci představovat potenciálně významný molekulární prediktor přežití pacientů s karcinomem žaludku. Tato skupina čítá geny PDGFRB, ERBB2, RET, EGFR, CCND1 a CDKN1B (p27/ Kip1). V případě genu ERBB2 (HER2/ Neu) byla prognostická role u karcinomu žaludku již řadu let intenzivně studována [14]. Bylo opakovaně prokázáno, že nadměrná exprese nebo amplifikace ERBB2 je asociována se špatnou prognózou a s ní souvisejícími klinicko-patologickými faktory, jako je se šíření do serózy (viscerálního peritonea), metastazování do lymfatického systému a vytváření vzdálených metastáz. Postižení RTK genů je též společným znakem nedávno identifikovaného specifického molekulárního podtypu karcinomu žaludku [6].
Metoda MLPA byla k vyšetření panelu genových amplifikací karcinomů žaludku v minulosti již použita a porovnána s běžněji využívanou metodou FISH (fluorescent in situ hybridization) [15]. Byla prokázáno, že výsledky z MLPA vysoce korelují s výsledky z FISH. Hodnocení vlivu panelu genových amplifikací na prognózu pacientů s karcinomem žaludku však doposud provedeno nebylo. Z klinického hlediska by vyšetření amplifikací uvedeného panelu mohlo být pomocným nástrojem při rozhodování o radikalitě plánovaného chirurgického zákroku.
Pro volbu systémové léčby je důležitá možnost blokády RTK jako účinné biologické terapie. Přirozeně toto již platí v případě anti-HER2 léčby na bázi monoklonální protilátky trastuzumab podávané pacientům, jejichž nádor vykazuje amplifikaci genu ERBB2 (HER2/ Neu). I další z uvedené skupiny RTK genů jsou v současné době intenzivně studovány v rámci vývoje nových cílených léčiv, ať již jde o obdobné anti-EGFR protilátky [16], inhibitory PRGFR [17] nebo inhibitory RET [18]. Další dva geny v identifikované skupině (CCND1 a CDKN1B (p27/ Kip1)) jsou významnými regulátory buněčného cyklu a jsou též často zmiňovány jako potenciální cíle protinádorové léčby [19,20].
Závěr
V tomto projektu byla zmapována frekvence výskytu somatických mutací a genových amplifikací panelu onkogenů a tumor supresorových genů u českých pacientů s karcinomem žaludku. S využitím dostupné a nenákladné metodiky založené na MLPA se navíc podařilo identifikovat skupinu genových amplifikací, které v kombinaci mohou představovat potenciální nástroj pro odhad prognózy přežití pacientů s nádory žaludku. Vzhledem k nízké incidenci nádorů žaludku byla tato pozorování získána na relativně omezeném počtu pacientů. Pro potvrzení těchto výsledků bude účelné provést validaci na rozšířeném souboru.
Tato práce byla podpořena grantem IGA MZ č. NT13640.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 3. 5. 2016
Přijato: 9. 6. 2016
RNDr. Marek Minárik, Ph.D.
Genomac výzkumný ústav, s. r. o.
Centrum aplikované genomiky solidních nádorů
Drnovská 1112/ 60
161 00 Praha 6
mminarik@email.com
Sources
1. Ústav zdravotnických informací a statistiky ČR. Národní onkologický registr (NOR). [online]. Dostupné z: www.uzis.cz/ registry-nzis/ nor.
2. Ferlay J, Soerjomataram I, Dikshit R et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136(5): E359–E386. doi: 10.1002/ijc.29210.
3. Parsonnet J, Friedman GD, Vandersteen DP et al. Helicobacter pylori infection and the risk of gastric carcinoma. N Engl J Med 1991; 325(16): 1127 – 1131.
4. Hu B, El Hajj N, Sittler S et al. Gastric cancer: classification, histology and application of molecular pathology. J Gastrointest Oncol 2012; 3(3): 251 – 261. doi: 10.3978/ j.issn.2078-6891.2012.021.
5. Yuasa Y. Control of gut differentiation and intestinal-type gastric carcinogenesis. Nat Rev Cancer 2003; 3(8): 592 – 600.
6. Deng N, Goh LK, Wang H et al. A comprehensive survey of genomic alterations in gastric cancer reveals systematic patterns of molecular exclusivity and co-occurrence among distinct therapeutic targets. Gut 2012; 61(5): 673 – 684. doi: 10.1136/ gutjnl-2011-301839.
7. Cristescu R, Lee J, Nebozhyn M et al. Molecular analysis of gastric cancer identifies subtypes associated with distinct clinical outcomes. Nat Med 2015; 21(5): 449 – 456. doi: 10.1038/ nm.3850
8. Lemmon MA, Schlessinger J. Cell signaling by receptor tyrosine kinases. Cell2010; 141(7): 1117 – 1134. doi: 10.1016/ j.cell2010.06.011.
9. Bang YJ, Van Cutsem E, Feyereislova A et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010; 376(9742): 687 – 697. doi: 10.1016/ S0140-6736 (10)61121-X.
10. Minarik M, Minarikova L, Hrabikova M et al. Application of cycling gradient capillary electrophoresis to detection of APC, K-ras, and DCC point mutations in patients with sporadic colorectal tumors. Electrophoresis 2004; 25(7 – 8): 1016 – 1021.
11. Forbes SA, Bindal N, Bamford S et al. COSMIC: mining complete cancer genomes in the catalogue of somatic mutations in cancer. Nucleic Acids Res 2011; 39: D945 – D950. doi: 10.1093/ nar/ gkq929.
12. Gajria D, Chandarlapaty S. HER2-amplified breast cancer: mechanisms of trastuzumab resistance and novel targeted therapies. Expert Rev Anticancer Ther 2011; 11(2): 263 – 275. doi: 10.1586/ era.10.226.
13. Ryška A, Hejduk K, Fabián P et al. Korekce populačních predikcí počtu HER-2/ neupozitivních karcinomů prsu u žen na základě analýzy dat histologického registru karcinomů prsu (MAGISTER). XXXVI. Brno: Brněnské onkologické dny a XX. Konference pro sestry a laboranty, 19. – 21. duben 2012. Abstrakt 013.
14. Jørgensen JT, Hersom M. HER2 as a prognostic marker in gastric cancer – a systematic analysis of data from the literature. J Cancer 2012; 3 : 137 – 144. doi: 10.7150/ jca.4090.
15. Ooi A, Oyama T, Nakamura R et al. Semi-comprehensive analysis of gene amplification in gastric cancers using multiplex ligation-dependent probe amplification and fluorescence in situ hybridization. Mod Pathol 2015; 28(6): 861 – 871. doi: 10.1038/ modpathol.2015.33.
16. Morishita A, Gong J, Masaki T. Targeting receptor tyrosine kinases in gastric cancer. World J Gastroenterol 2014; 20(16): 4536 – 4545. doi: 10.3748/ wjg.v20.i16.4536.
17. Dai Y. Platelet-derived growth factor receptor tyrosine kinase inhibitors: a review of the recent patent literature. Expert Opin Ther Pat 2010; 20(7): 885 – 897. doi: 10.1517/ 13543776.2010.493559.
18. Shaw AT, Hsu PP, Awad MM et al. Tyrosine kinase gene rearrangements in epithelial malignancies. Nat Rev Cancer 2013; 13(11): 772 – 787. doi: 10.1038/ nrc3612.
19. Musgrove EA, Caldon CE, Barraclough Jet al. Cyclin D as a therapeutic target in cancer. Nat Rev Cancer 2011; 11(8): 558 – 572. doi: 10.1038/ nrc3090.
20. Nickeleit I, Zender S, Kossatz U et al. p27kip1: a target for tumor therapies? Cell Div 2007; 2 : 13.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2016 Issue 3-
All articles in this issue
- Digestivní endoskopie a endoterapie
- Renesance cholangiopankreatoskopie a nové možnosti intraduktální endoskopické terapie
- Terapeutická endosonografia – súčasné postavenie
- Endoskopické řešení volvulu sigmatu
- Neuroendokrinní nádory v gastroenterologické praxi
- První endoskopická submukózní resekce subepiteliálního nádoru (GIST) jícnu v ČR
- Lymfom imitující GIST
- Stenóza tlustého střeva neobjasněné etiologie
- Využití panelu somatických genových mutací a amplifikací pro odhad prognózy pacientů s karcinomem žaludku
- Doporučené postupy chirurgické léčby pacientů s idiopatickými střevními záněty – 3. část: ulcerózní kolitida, indikace k operaci
- The 38th Czech and Slovak Endoscopic Days
- 15th Czech-Slovak IBD symposium and IBD work ing days, Hořovice 2016
- Výběr z mezinárodních časopisů
- Mutaflor® – Escherichia coli (Nissle 1917), sérotyp O6:K5:H1 – nejlépe prozkoumané probiotikum současnosti
- Těžký (komplikovaný) průběh virové hepatitidy A v Cotonou (Benin) u nedostatečně očkovaného pacienta španělského původu
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Stenóza tlustého střeva neobjasněné etiologie
- Mutaflor® – Escherichia coli (Nissle 1917), sérotyp O6:K5:H1 – nejlépe prozkoumané probiotikum současnosti
- Endoskopické řešení volvulu sigmatu
- Neuroendokrinní nádory v gastroenterologické praxi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

