-
Medical journals
- Career
Renesance cholangiopankreatoskopie a nové možnosti intraduktální endoskopické terapie
Authors: O. Urban 1–3; P. Fojtík 1; O. Mikolájek 1; U. Arnelo 4,5
Authors‘ workplace: Centrum péče o zažívací trakt, Vítkovická nemocnice a. s., Ostrava 1; Interní klinika LF OU a FN Ostrava 2; Lékařská fakulta OU v Ostravě 3; Department of Clinical Science, Intervention and Technology (CLINTEC), Karolinska Institutet, Stockholm, Švédsko 4; Center for Digestive Diseases, Karolinska University Hospital, Stockholm, Švédsko 5
Published in: Gastroent Hepatol 2016; 70(3): 203-207
Category: Digestive Endoscopy: Review Article
doi: https://doi.org/10.14735/amgh2016203Overview
Cílem přehledového článku je popsat současné možnosti endoskopického vyšetření žlučových cest a pankreatického vývodu, seznámit s aktuální terminologií a základními endoskopickými nálezy. Zásadní technologickou změnou je přechod od systému ovládaného dvěma endoskopisty („dual operator“) na „single operator“ technologie. Základní diagnostickou indikací k cholangioskopii zůstává indeterminovaná stenóza žlučových cest, nejvýznamnější indikací terapeutickou litotrypse obtížné choledocholitiázy.
Klíčová slova:
stenóza žlučových cest – cholangioskopie – pankreatoskopieÚvod
Diagnostika stenóz a defektů v náplni žlučových cest a pankreatického vývodu se standardně opírá o neinvazivní zobrazení, jako jsou magnetická rezonanční cholangiopankreatografie a endosonografie, na které elektivně navazuje endoskopická retrográdní cholangiopankreatografie (ERCP) s možností tkáňové diagnostiky (brushing, biopsie) a terapie. Diagnostická výtěžnost tohoto postupu zůstává suboptimální. Proto je umožnění přímého endoskopického pohledu do obou vývodných systémů již několik desetiletí předmětem snahy endoskopistů a inženýrů technologických firem. Technologický pokrok je hlavní příčinou současné renesance zájmu o cholangiopankreatoskopii (CPS), které jsme aktéry a svědky také v ČR. Cílem sdělení je seznámit čtenáře se základními technologickými a endoskopickými pojmy, které jsou používány v souvislosti s CPS.
Technologie pro CPS dostupné v roce 2016
Zatím nelze tvrdit, že máme k dispozici ideální technologii pro CPS, pokrok je však nepopiratelný. V roce 2016 máme k dispozici tři metody:
- „mother-baby“ (lépe dual-operator mother-baby peroral cholangioscopy (DOC)),
- SpyGlass® (lépe single-operator mother-baby peroral cholangioscopy (SOC)),
- direktní perorální cholangioskopie (DPOC).
Při hodnocení těchto systémů je důležité si uvědomit, že se jejich indikační oblasti zcela nepřekrývají. Např. DPOC může být ideální pro vyšetření extrahepatálních žlučových cest, protože disponuje vyšší kvalitou zobrazení a větší průměr (5 mm) přístroje není limitující. SOC je vzhledem k menšímu průměru (3,3 mm) použitelná rovněž pro vyšetření stenózy intrahepatálních žlučových cest, kvalita zobrazení je však nižší. V následujícím přehledu uvedeme základní charakteristicky všech třech systémů.
„Mother-baby“
DOC byla zavedena do klinické praxe v roce 1975 Demlingem a Röschem, později byla používána rovněž na několika pracovištích v ČR. Ultratenký fibroskop (baby) byl do žlučových cest zaveden pracovním kanálem terapeutického duodenoskopu (mother) a ovládán druhým endoskopistou. Historický význam DOC je zásadní, protože metoda prokázala přínos v diagnostice tzv. indeterminovaných striktur a v navigaci léčby obtížné choledocholitiázy elektrohydraulickou litotrypsí (EHL) nebo laserem. Jejímu širokému uplatnění zabránily technické limity (přístroj ohebný pouze v jedné rovině, úzký pracovní kanál, limitované použití v pankreatickém vývodu), potřeba přítomnosti dvou endoskopistů u výkonu, ale zejména fragilita přístroje a s ní spojené vysoké provozní náklady. V současné době jsou zkoušeny nové typy video babyskopů, které jsou k vidění na velkých endoskopických workshopech, ale komerčně dostupné v EU zatím nejsou. Udivují vysokou kvalitou zobrazení a jejich výrobce deklaruje možnost opakovaného použití. Metoda DOC je uvedena v aktuálním sazebníku výkonů Ministerstva zdravotnictví ČR, o reálné úhradě skutečných nákladů však nelze hovořit.
SpyGlass®
První klinické studie využívající SOC byly publikovány v roce 2007, komerčně je dostupná od roku 2008, v ČR je k dispozici od roku 2012 a v loňském roce byly publikovány první zkušenosti ze Slovenska [1 – 3]. V současné době jsou používány dva typy zařízení:
- SpyGlass® Legacy je vývojově starší systém složený z vlastního endoskopu (SpyScope®), světelného zdroje, kamery a procesoru. SpyScope® se skládá ze zaváděcího katetru o průměru 3,3 mm (10 Fr), který je ohebný ve dvou vzájemně kolmých rovinách. Obsahuje pracovní kanál o průměru 1,2 mm, dva irigační kanálky o průměrů 0,6 mm a kanál o průměru 0,9 mm pro zavedení optického vlákna. Katetr je použitelný jednorázově, optické vlákno má životnost asi 20 vyšetření. SpyScope® je ovládán spolu s duodenoskopem jediným endoskopistou. Limitací je nižší kvalita obrazu (6 000 pixelů), složitost systému a obtíže při zavádění akcesorií (bioptických kleští SpyBite®, sondy pro litotrypsi) přes angulaci přístroje v duodenu.
- SpyGlass™ DS vznikl technickým zdokonalením předchozího systému, od kterého se odlišuje především vyšší kvalitou obrazu (digitální technologie, 24 000 pixelů, o 60 % větší úhel rozhledu), širším pracovním kanálem (1,3 mm) a jednodušším ovládáním („plug and scope“). Jedná se v podstatě o ultratenký endoskop pro jednorázové použití.
Direktní perorální cholangioskopie
DPOC byla poprvé popsaná v roce 1977, využívá ultratenkých (pediatrických nebo transnazálních, o průměru do 5 mm) endoskopů k vyšetření extrahepatálních žlučových cest, do kterých jsou zaváděny po vodiči nebo s pomocí kotvicího balonkového katetru [4]. Do této kategorie přístrojů patří rovněž prototypy cholangioskopů s možností přídatného ohybu přístroje umožňující intubaci choledochu bez použití vodiče (prof. Itoi, osobní sdělení). Jelikož DPOC, na rozdíl od SOC, umožňuje insuflaci, je nutné mít rovněž vybavení pro insuflaci CO2 z důvodu rizika vzduchové embolie. Metoda je pravděpodobně používána na řadě pracovišť v ČR.
Srovnání kvality zobrazení pomocí obou typů SOC a DPOC je dobře patrné z obr. 1A–C.
Indikace k cholangioskopii
Indikace k cholangioskopii můžeme rozdělit na diagnostické a terapeutické.
Diagnostické indikace
- indeterminované stenózy/ defekty (nejasná etiologie na základě vstupního ERCP s brushingem a/ nebo biopsií),
- dominantní striktury při PSC,
- určení intraduktální hranice šíření cholangiokarcinomu.
Terapeutické indikace
- litotrypse obtížné choledocholitiázy (EHL, laser) (video 1 – dostupné na http://www.csgh.info);
- cílená kanylace biliární obstrukce, kterou nelze vyřešit konvenčním přístupem (ERCP);
- monitorace intraduktální radiofrekvenční ablace (RFA) cholangiokarcinomu (video 2 – dostupné na http://www.csgh.info).
Kritéria pro odlišení maligní a benigní stenózy žlučových cest
Správnost konceptu cholangioskopické diagnostiky ideterminované stenózy pomocí DOC byla potvrzena v roce 1976, jak je uvedeno výše. Nástup nových technologií si vyžádal ověření konceptu v nových podmínkách. V roce 2011 publikovali Chen et al soubor 140 nemocných, které vyšetřil pomocí SOC (Legacy) pro indeterminovanou strikturu žlučových cest. Vizualizací léze dosáhl senzitivity 78 %, specificity 82 % a diagnostické přesnosti 80 %. Materiál k histologickému vyšetření získal v 88 % s diagnostickou přesností 75 %. Komplikace se vyskytly v 7,5 %. Výsledek vyšetření změnil přístup k léčbě pacienta v 66 % [5]. V roce 2012 porovnali Draganov et al „brush cytologii“, intrabiliární biopsii a SOC-navigovanou biopsii v diagnostice 26 nemocných s indeterminovanou stenózou žlučových cest a dosáhl diagnostické přesnosti 38,5, 53,8 a 84,6 % [6]. V roce 2015 analyzovali Tringali et al výsledky SOC-navigované biopsie v celkem sedmi studiích, z toho pěti prospektivních, čítajících 435 nemocných, a uvádí průměrnou senzitivitu 68 % [7].
Pro potřeby dalších studií a klinickou praxi je nezbytná terminologická standardizace, jak ji známe z jiných oblastí digestivní endoskopie. Dosud bylo učiněno několik pokusů na tomto poli, ale konsenzu zatím nebylo dosaženo. Např. podle tzv. Monackých kritérií rozlišili Sethi et al celkem osm cholangioskopických morfologických znaků a dosáhli diagnostické přesnosti pro odlišení benigní a maligní etiologie stenózy v 70 %. V multivariantní analýze byly pouze ulcerace (OR 10,3; p = 0,01) a papilární výběžky (OR 7,2; p = 0,02) signifikantně asociovány s maligní etiologií [8]. Jiné práce zdůrazňují vysokou specificitu abnormální vaskularizace, především přítomnosti spirálovitých cév (později prokázaných rovněž u IgG4 cholangitidy).
Příklady jednotlivých endoskopických morfologických znaků uvádíme spolu s obrazovou dokumentací histologicky ověřených nálezů: ulcerace (obr. 2), jizvení (obr. 3), papilární výběžky (obr. 4 a video 3 – dostupné na http://www.csgh.info), ložisková léze (obr. 5), výrazný „pit pattern“ (pouze u DPOC, obrázek z pracoviště autora není k dispozici), abnormální cévy (obr. 6), povrch sliznice (hladký vs. jiný) (obr. 1), striktura (obr. 7).
Image 1. Normální žlučové cesty – A. SOC, Spyglass<sup>®</sup> Legacy, B. SOC, Spyglass™ DS, C. DPOC, transnazální endoskop. Fig. 1. Normal bile ducts – A. SOC, Spyglass<sup>®</sup> Legacy, B. SOC, Spyglass™ DS, C. DPOC, transnasal endoscope. 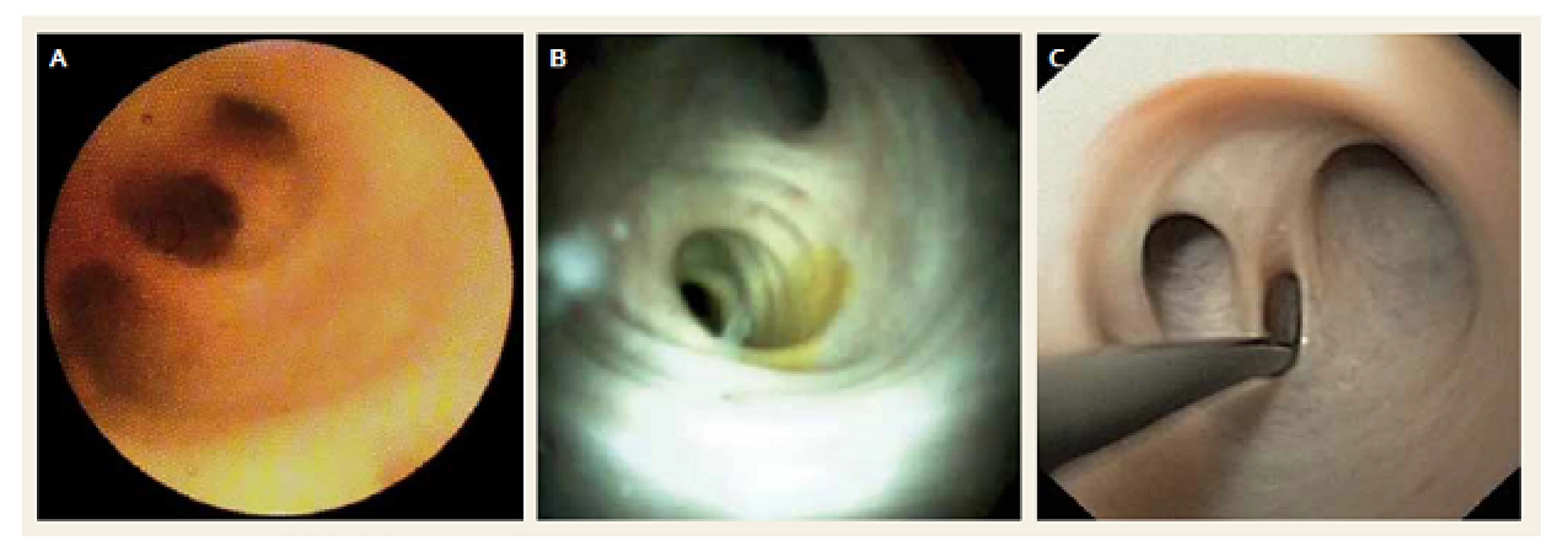
Image 2. Ulcerace. IgG4 cholangitida. Fig. 2. Ulceration. IgG4 cholangitis. 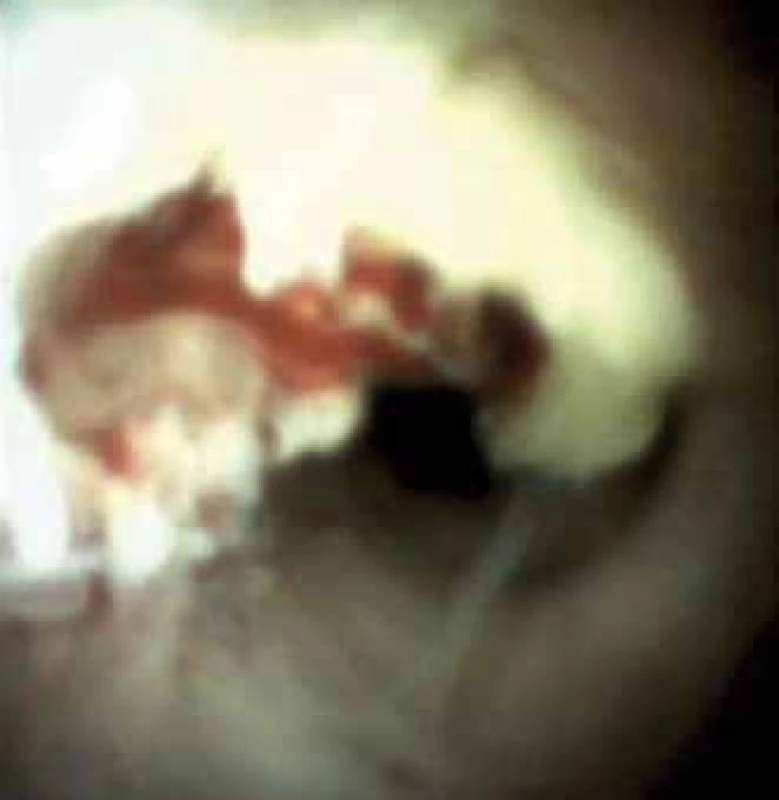
Image 3. Jizvení. IgG4 cholangitida po léčbě, stejný nemocný jako na obr.2. Fig. 3. Scarring. IgG4 cholangitis after treatment, the same patient as in fig. 2. 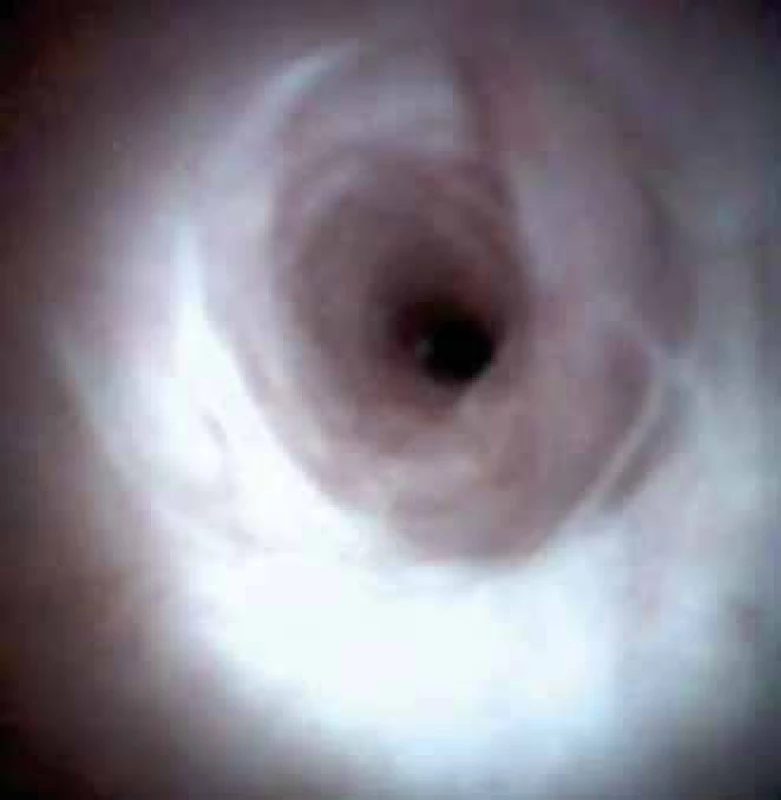
Image 4. Papilární výběžky. Papilomatóza žlučových cest. Fig. 4. Papillary projections. Papillomatosis of the biliary tract. 
Image 5. Ložisková léze. Cholangiokarcinom. Fig. 5. Lesion. Cholangiocarcinoma. 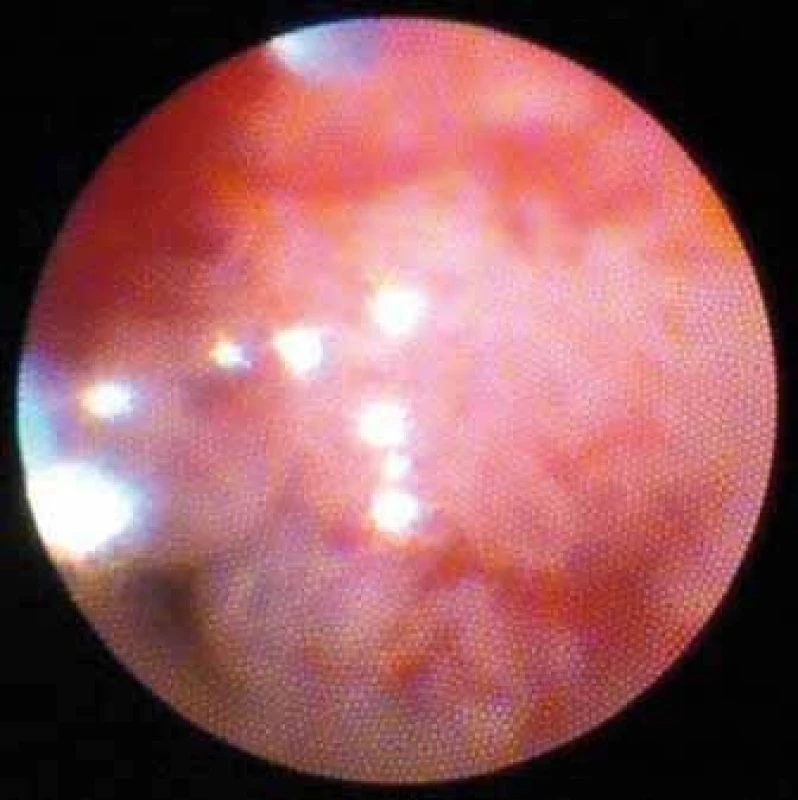
Image 6. Spirálovité cévy. Cholangiokarcinom. Fig. 6. Spiral vessels. Cholangiocarcinoma. 
Image 7. Striktura. Cholangiokarcinom. Fig. 7. Stricture. Cholangiocarcinoma. 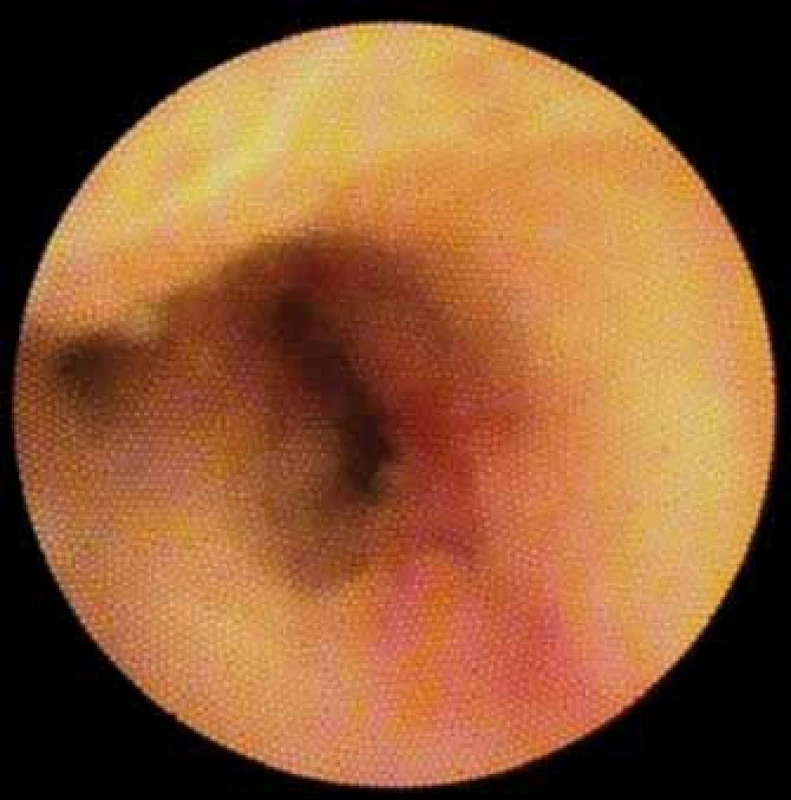
Jiná skupina hodnotí léze na základě těchto kritérií [9]:
- maligní – neovaskularizace (nepravidelně probíhající dilatováné a spirálovité cévy), fragilita, hrbolatý povrch/ nádorová masa.
- benigní – hladký povrch bez neovaskularizace, homogenní papilo-granulární mukóza bez nádorové masy.
Podle naší vlastní zkušenosti je důležité samostatně hodnotit vliv předchozího stentingu na morfologii stenózy, který popisujeme (mimo rámec Monackých kritérií) jako adherující koagulum a nekrózu (obr. 8 a 9).
Image 8. Adherující koagulum po extrakci plastového stentu. Fig.8. Adherent clot after extraction of a plastic stent. 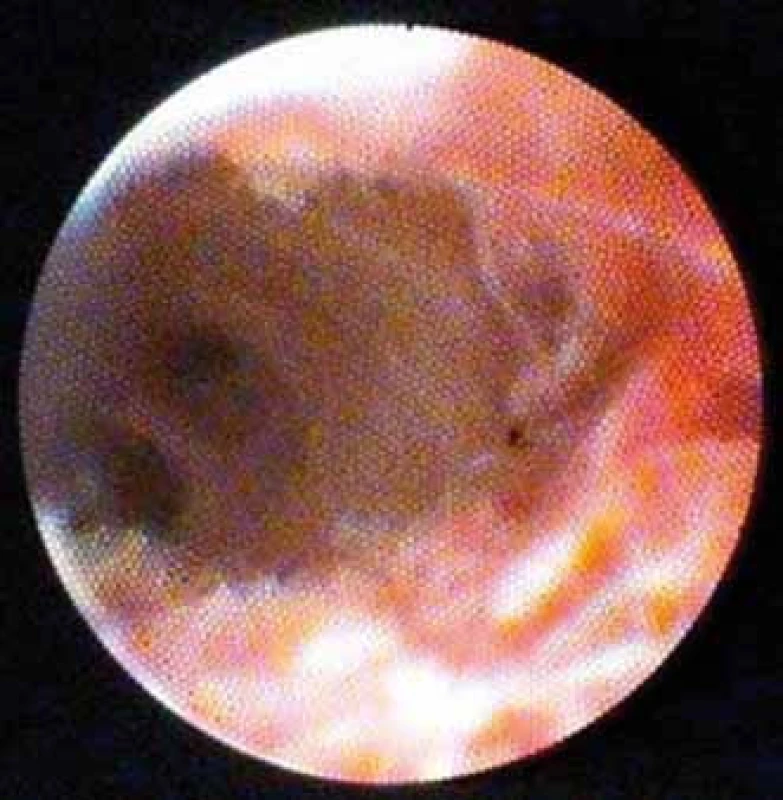
Image 9. Nekróza po extrakci plastového stentu. Fig. 9. Necrosis after extraction of a plastic stent. 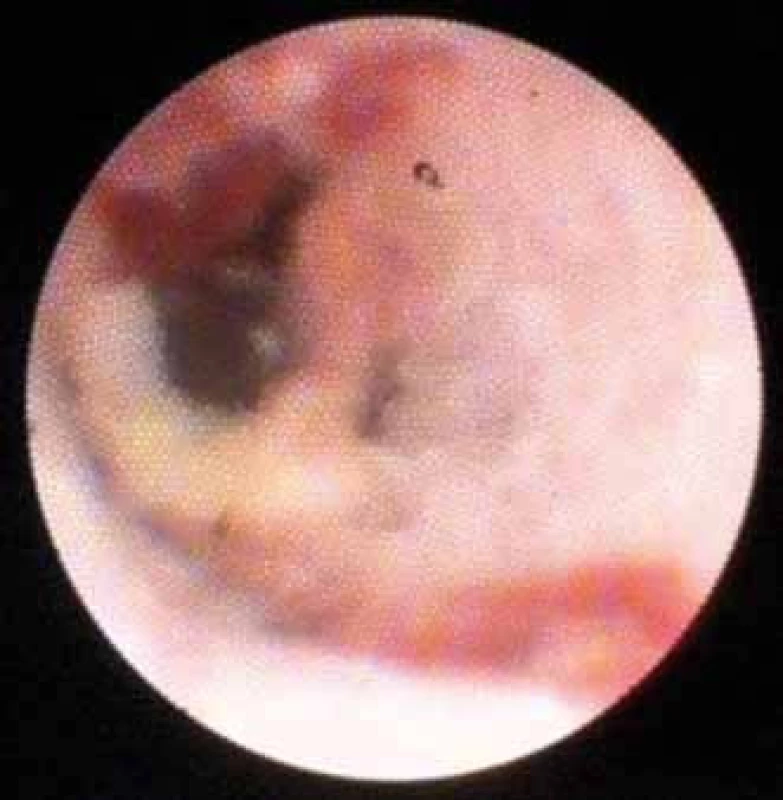
Cholangioskopie představuje přídatné riziko k ERCP. Nejčastější komplikací je cholangitida a podle posledních prací je doporučena antibiotická profylaxe před výkonem. Přehled komplikací, jak je uvádí Chen et al, uvádíme v tab. 1.
Table 1. Nežádoucí události u 291 vyšetření single-operator cholangioskopií (SOC) (prof. Chen, osobní sdělení). Tab. 1. Adverse events in 291 tests single-operator cholangioscopy (SOC) (Professor Chen, personal message). 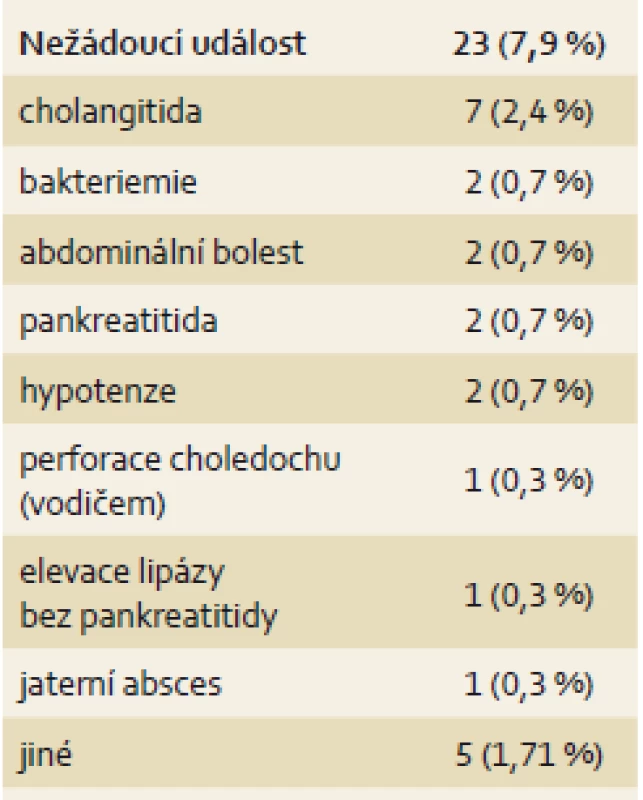
Intraduktální RFA
Intraduktální RFA je nová metoda k termické destrukci nádorové tkáně pomocí radiofrekvenční energie aplikované do cílové tkáně speciálním bipolárním katetrem (Habib Endo HPB katetr) (video 4 – dostupné na http://www.csgh.info). Někteří autoři hovoří rovněž o imunomodulačním efektu. Nejčastěji doporučované nastavení výkonu elektrochirurgické jednotky je 8 – 10 W a doba aplikace 60 – 120 s. Nové typy přístrojů měří teplotu v cílové tkáni a přizpůsobují výkon automaticky. Metodu je nutné ověřit v dalších studiích. Při ošetření stenózy v hilu jater byla popsána fatální krvácení. Costamagna et al shrnují potenciální indikace takto [10]:
- rekanalizace okludovaného SEMS,
- ablace léze před zavedením SEMS,
- ablace malých intraduktálních lézí,
- intraduktální rekurence ampulomu [11],
- léčba benigní stenózy.
Metody intraduktální litotrypse jsou detailně popsané na jiných místech a zde se jimi nebudeme zabývat [12].
Indikace k pankreatoskopii
- diagnostické – rozsah léze a přítomnost rizikových známek IPMN (intraductal papillary mucinous neoplasia) (obr. 10) [13], nejasná stenóza pankreatického vývodu (obr. 11), odběr biopsie.
- terapeutické – intraduktální litotrypse wirsungolitiázy.
Image 10. Pankreatoskopie. Mucin v dilatovaném pankreatickém vývodu, intraduktální papilární mucinózní neoplazie. Fig. 10. Pancreatoscopy. Mucin in dilated pancreatic duct, intraductal papillary mucinous neoplasia. 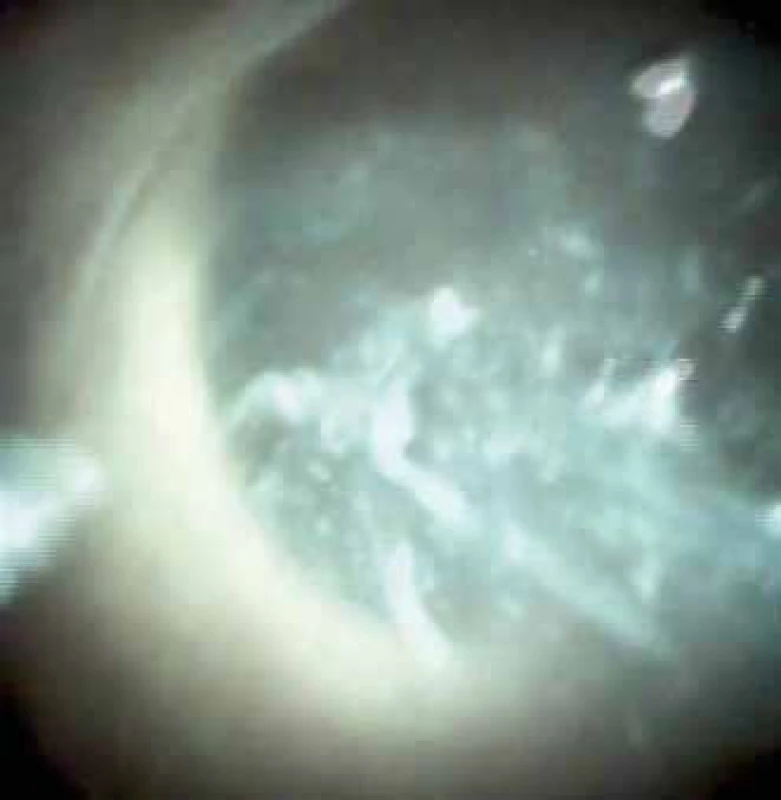
Image 11. Pankreatoskopie. Stenóza pankreatického vývodu. Histologicky low-grade dysplazie, stejný nemocný jako na obr. 10. Fig. 11. Pancreatoscopy. Stenosis of the pancreatic duct. Histologically low-grade dysplasia, the same patient as in fig. 10. 
Komplikace pankreatoskopie se vyskytují v 10 – 12 % a nejčastěji se jedná o lehkou pankreatitidu.
Závěr
S technologickým rozvojem dochází k renesanci zájmu o intraduktální biliopankreatické zobrazení. V ČR používá v současnosti SOC nejméně 10 pracovišť. Jedná se o metodu vysoce nákladnou, současná cena generátoru je 2 390 000 Kč a katetru (SpyGlass™ DS) 71 728 Kč. Další náklady představují bioptické kleště a vybavení pro intraduktální litotrypsi. Vzhledem k elektivní povaze výkonu a vysoké ceně bude vhodná přiměřená centralizace na pracoviště provádějící dostatečný počet ERCP. Konkrétní číslo je diskutováno, podle názoru autora se jedná o 400 – 500 ERCP ročně. Podle jednoho z modelů má cholangioskopie potenciál snížit počet ERCP při diagnostice indeterminované stenózy o 33 % a nejvyšší efektivity je dosaženo, je-li k dispozici jedno pracoviště na 1 mil. obyvatel. Bez ohledu na ekonomické a organizační aspekty můžeme konstatovat, že pokroky v biliopankreatickém zobrazení přinášejí pacientům s onemocněními žlučových cest a pankreatu prospěch.
Videozáznam si můžete přehrát na: http://www.csgh.info
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 19. 3. 2016
Přijato: 24. 5. 2016
O. Urban je konzultantem Boston Scientific.
MUDr. Ondřej Urban, Ph.D.
Centrum péče o zažívací trakt
Vítkovická nemocnice a. s.
Zálužanského 1192/15
703 84 Ostrava
ondrej.urban@vtn.agel.cz
Sources
1. Chen YK, Pleskow DK. SpyGlass single-operator peroral cholangiopancreatoscopy system for the diagnosis and therapy of bile-duct disorders a clinical feasibility study (with video). Gastrointest Endosc 2007; 65(6): 832–841.
2. Urban O, Arnelo U, Fojtík P et al. Cholangiopankreatikoskopie pomocí SpyGlass direct visualisation system: seznámení s metodou a první vlastní zkušenosti. Gastroent Hepatol 2013; 67(2): 124–126.
3. Husťak R, Ušák J, Kudlová D et al. Prvé skúsenosti s digitálnym Spyglass™ DS na Slovensku z gastroenterologického pracoviska Fakultnej nemocnice Trnava. Gastroent Hepatol 2015; 69(5): 418–423.
4. Moon JH, Ko BM, Choi HJ et al. Intraductal balloon-guided direct peroralcholangioscopy with an ultraslim upper endoscope (with videos). Gastrointest Endosc 2009; 70(2): 297–302. doi: 10.1016/j.gie.2008.11.019.
5. Chen YK, Parsi MA, Binmoeller KF et al. Single-operator cholangioscopy in patients requiring evaluation of bile duct disease or therapy of biliary stones (with videos). Gastrointest Endosc 2011; 74(4): 805–814. doi: 10.1016/j.gie.2011.04.016.
6. Draganov PV, Chauhan S, Wagh MS et al. Diagnostic accuracy of conventional and cholangioscopy-guided sampling of indeterminate biliary lesions at the time of ERCP: a prospective, long-term follow-up study. Gastrointest Endosc 2012; 75(2): 347–353. doi: 10.1016/j.gie.2011.09.020.
7. Tringali A, Lemmers A, Meves V et al. Intraductal biliopancreatic imaging: European Society of Gastrointestinal Endoscopy (ESGE) technology review. Endoscopy 2015; 47(8): 739–753. doi: 10.1055/s-0034-1392584.
8. Sethi A, Shah R, Itoi T et al. Defining imaging criteria for indeterminate biliary strictures utilizing video cholangioscopy: the Monaco classification. Gastrointest Endosc 2015; 81 (Suppl 5): AB 188–AB 189. doi: 10.1016/j.gie.2015.03.1939.
9. Beyna T, Neuhaus H. Role of cholangioscopy and pancreatoscopy in biliopancreatic lesions. Presented at: 18th Düsseldorf international endoscopy symposium. 11.–13. 2. 2016.
10. Costamagna G. RFA for biliopancreatic tumours. Presented at: 18th Düsseldorf international endoscopy symposium. 11.–13. 2. 2016.
11. Valente R, Urban O, Del Chiaro M et al. ERCP-directed radiofrequency ablation of ampullary adenomas: a knife-sparing alternative in patients unfit for surgery. Endoscopy 2015; 47 (Suppl 1): E515–E516. doi: 10.1055/s-0034-1392866.
12. Špičák J. Cholangioskopie. In: Špičák J, Urban O. Novinky v digestivní endoskopii. Praha: Grada Publishing 2015.
13. Arnelo U, Siiki A, Swahn F et al. Single-operator pancreatoscopy is helpful in the evaluation of suspected intraductal papillary mucinous neoplasms (IPMN). Pancreatology 2014; 14(6): 510–514. doi: 10.1016/j.pan.2014.08.007.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2016 Issue 3-
All articles in this issue
- Digestivní endoskopie a endoterapie
- Renesance cholangiopankreatoskopie a nové možnosti intraduktální endoskopické terapie
- Terapeutická endosonografia – súčasné postavenie
- Endoskopické řešení volvulu sigmatu
- Neuroendokrinní nádory v gastroenterologické praxi
- První endoskopická submukózní resekce subepiteliálního nádoru (GIST) jícnu v ČR
- Lymfom imitující GIST
- Stenóza tlustého střeva neobjasněné etiologie
- Využití panelu somatických genových mutací a amplifikací pro odhad prognózy pacientů s karcinomem žaludku
- Doporučené postupy chirurgické léčby pacientů s idiopatickými střevními záněty – 3. část: ulcerózní kolitida, indikace k operaci
- The 38th Czech and Slovak Endoscopic Days
- 15th Czech-Slovak IBD symposium and IBD work ing days, Hořovice 2016
- Výběr z mezinárodních časopisů
- Mutaflor® – Escherichia coli (Nissle 1917), sérotyp O6:K5:H1 – nejlépe prozkoumané probiotikum současnosti
- Těžký (komplikovaný) průběh virové hepatitidy A v Cotonou (Benin) u nedostatečně očkovaného pacienta španělského původu
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Stenóza tlustého střeva neobjasněné etiologie
- Mutaflor® – Escherichia coli (Nissle 1917), sérotyp O6:K5:H1 – nejlépe prozkoumané probiotikum současnosti
- Endoskopické řešení volvulu sigmatu
- Neuroendokrinní nádory v gastroenterologické praxi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

