-
Medical journals
- Career
Endoskopická histologizace diminutivních polypů tračníku. Jsme připraveni na změnu?
: R. Procházka; J. Pícha; H. Laurinová
: Gastroenterologie, Nemocnice Jablonec nad Nisou, p. o.
: Gastroent Hepatol 2015; 69(5): 424-428
: Clinical and Experimental Gastroenterology: Review Article
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amgh2015424Doplnění digitální chromoendoskopie o validované klasifikace umožňuje endoskopistům in vivo přesně předpovědět histologii kolorektálních polypů. Znalost biologické povahy polypů bez jejich histologického vyšetření nabízí nové strategie, jako je „resect and discard“ a „observe and leave“. Tyto strategie přenášejí zodpovědnost za správnou diagnózu z patologa na vyšetřujícího, ale na oplátku racionalizují praxi v prevenci kolorektálního karcinomu. Autoři shrnují argumenty pro přijmutí těchto nových endoskopických strategií a podmínky, za kterých je možné jejich rozšíření do běžné endoskopické praxe. Zahraniční data jsou doplněna o data z našeho pracoviště.
Klíčová slova:
polyp – adenom – NBI – diminutivní – chromoendoskopie – NICEÚvod
Doplnění technologie digitální chromoendoskopie o validované klasifikace umožňuje endoskopistům in vivo přesně předpovědět histologii kolorektálních polypů. Znalost biologické povahy polypů bez jejich histologického vyšetření nabízí nové strategie, jako je „resect and discard“ a „observe and leave“. Tyto strategie přenášejí zodpovědnost za správnou diagnózu z patologa na vyšetřujícího, ale na oplátku racionalizují systém prevence kolorektálního karcinomu. Článek uvádí argumenty podpořené studiemi pro přijmutí těchto nových endoskopických strategií a podmínky, za kterých je možné jejich rozšíření do běžné endoskopické praxe. Zahraniční data jsou obohacena o data z našeho pracoviště.
Endoskopickou histologizací je myšlena predikce biologické povahy lézí tračníku. Existuje několik nových endoskopických modalit, které se objevily během poslední dekády a umožnily endoskopistům s velkou přesností předpovídat histologii polypů. Obecně lze tyto modality rozdělit na technologie s větším a technologie s menším zorným polem. Do první skupiny patří klasická nebo digitální chromoendoskopie a autofluorescence, do druhé konfokální endomikroskopie a endocystoskopie. Někdy se v případě těchto technologií můžeme setkat s pojmem optická biopsie, někdy je tento termín vyhraněn pouze pro konfokální endomikroskopii a endocystoskopii. Vzhledem ke své dostupnosti a relativní nenáročnosti se z těchto modalit nejvíce rozšířila digitální chromoendoskopie. Digitální chromoendoskopie je schopna s vysokou přesností odlišit adenom od hyperplastického polypu a nabízí nové endoskopické strategie – malé adenomy po odstranění neposílat vždy k histopatologickému vyšetření a hyperplastické polypy rektosigmatu neodstraňovat.
Jaké jsou důvody, které vedou k zamyšlení nad stávající kolonoskopickou praxí histologicky vyšetřit každý odstraněný polyp?
Hlavním důvodem, proč uvažovat o endoskopické histologizaci, je narůstající počet diagnostikovaných polypů. Populační screening významně navýšil počet preventivních kolonoskopií a statisticky u každého druhého pacienta je nalezen alespoň jeden polyp [1]. Větší počet odstraněných a histologicky vyšetřených polypů navyšuje nároky na screeningový program. Zadruhé, zlatý standard, tedy histologické vyšetření, není dokonalé. Diagnóza záleží na místě odběru biopsie, která může komplikovat odložené endoskopické řešení. Dále si musíme uvědomit, že mezi patology je velká míra subjektivity v posuzování stupně dysplazie a vilozity adenomů a přesnost histologického vyšetření je často ovlivněna koagulačním poškozením. Ve finále 10–20 % odstraněných lézí není nikdy histologicky vyšetřeno [2]. Tato fakta jsou jedním z důvodů, proč Britská gastroenterologická společnost doporučuje nastavení dispenzárních intervalů pouze na základě počtu a velikosti adenomů.
Narozdíl od nativní endoskopie umožňuje chromoendoskopie přesněji odlišit adenom a hyperplastický polyp. Digitální chromoendoskopie nabízí optický kontrast podobný klasické chromoendoskopii bez časové náročnosti a bez nutnosti barviv. Nejrozšířenější je NBI (narrow band imaging) digitální chromoendoskopie, technologie využívající rozptylu filtrovaného světla o dvou vlnových délkách – modré (390–445 nm) a zelené (530–550 nm) – a jejich absorbci hemoglobinem vedoucí ke zvýraznění cév a struktury sliznice. Původní studie využívaly Kudovu klasifikaci slizniční struktury hodnotící „pit pattern“ ke stanovení histologie polypu pomocí NBI. Ovšem tato klasifikace nereflektuje NBI obraz a pro nízkou přesnost by neměla být používána. Eastova studie srovnávala shodu japonských a zkušených evropských endoskopistů v hodnocení pit patternu klasickou a NBI chromoendoskopií. Zjištěná shoda byla velmi nízká s hodnotou kappa pouhých 0,23 [3]. Z klasifikací vzniklých již na základě NBI stojí za zmínku Sanova klasifikace pro zvětšovací endoskop a Rastogiho klasifikace pro užití bez zvětšovacího endoskopu. Zajímavé je, že výsledná senzitivita, specificita a přesnost Sanovy a Rastogiho klasifikace byla srovnatelná – 96, 92 a 95 %, resp. 96, 89 a 93 % [4,5].
1. NICE klasifikace časných kolorektálních neoplazií. Fig. 1. NICE classification of early colorectal neoplasms. 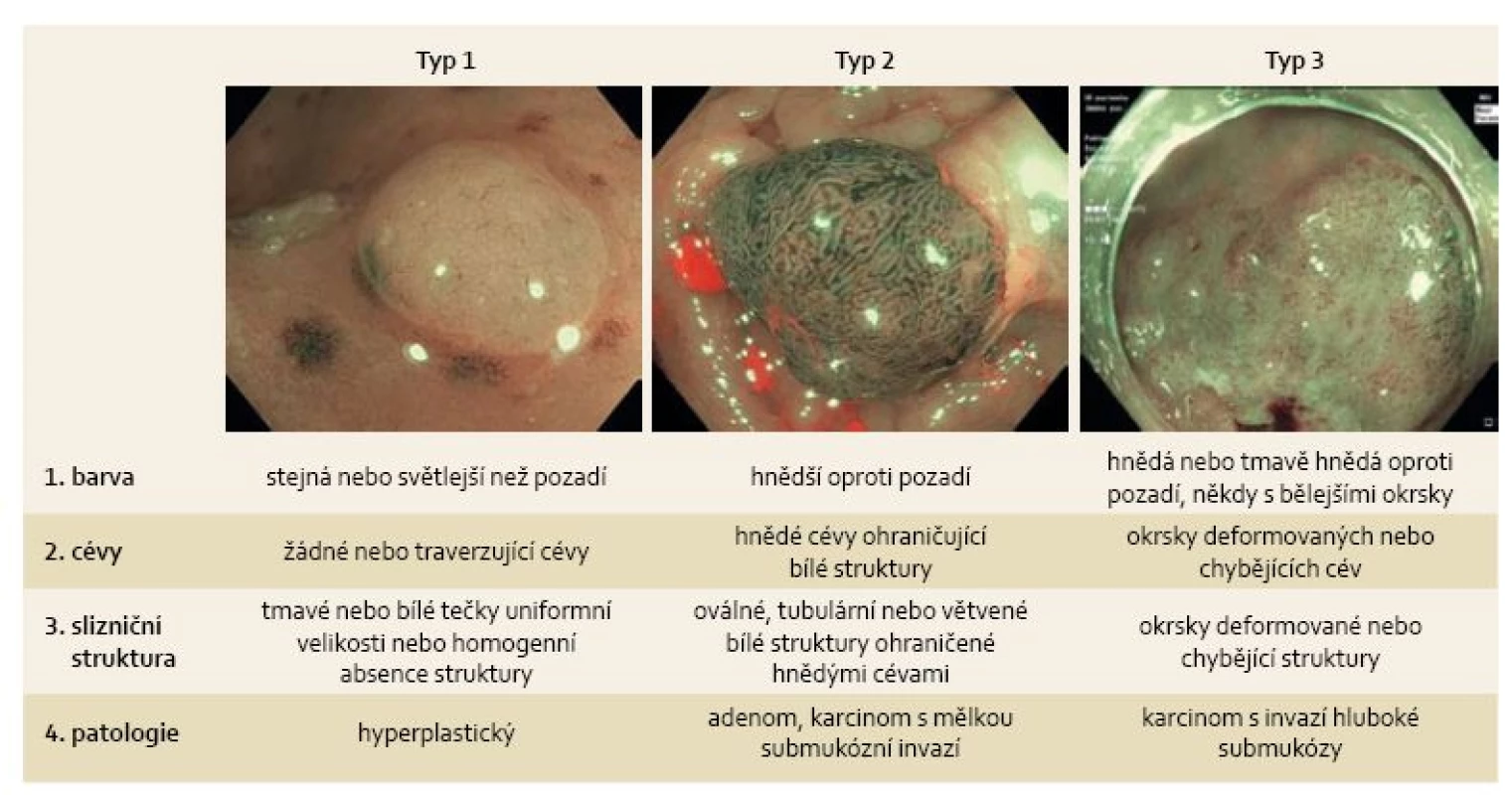
Nejen tyto klasifikace byly stimulem pro vznik NBI International Colorectal Endoscopic (NICE) klasifikace v roce 2012 [6,7]. Cílem mezinárodní skupiny expertů bylo vytvořit jednoduchou široce akceptovatelnou klasifikaci, která by bez nutnosti zvětšovacího endoskopu odlišila hyperplastické polypy od adenomů a navíc umožnila predikovat hloubku submukózní infiltrace u časných karcinomů. Polypy jsou na základě barvy, cévní a slizniční struktury rozděleny do jednoho ze tří histologických typů (obr. 1). Stejná skupina expertů, která vytvořila NICE klasifikaci, si vzala za cíl i její ověření. Zaprvé potvrdila vysokou přesnost jednotlivých kritérií v predikci histologie malých polypů < 10 mm, přičemž barva polypu byla kritériem nejméně spolehlivým a s nejmenší shodou mezi hodnotícími. Zadruhé prokázala, že přítomnost alespoň jednoho z kritérií svědčících pro adenom navyšuje senzitivitu a negativní prediktivní hodnotu (NPV – negative predictive value) hodnocení a přítomnost více kritérií svědčících pro adenom navyšuje specificitu a pozitivní prediktivní hodnotu (PPV – positive predictive value) hodnocení. V případě globálního hodnocení histologie polypu zaškolenými endoskopisty byla zjištěná hodnota senzitivity 89 % a NPV 90 %. V případě hodnocení s vysokou jistotou byla senzitivita, specificita, PPV i NPV > 95 % [6].
Několik metaanalýz ověřovalo spolehlivost NBI v predikci histologie kolorektálních polypů. Studie McGillové z roku 2013 uvádí celkovou senzitivitu 91 %, specificitu 82,6 % a NPV převyšující 86 % [8]. V případě vysoké míry jistoty hodnocení vzrostla senzitivita na 93,4 %, specificita na 84 % a NPV na 90 %, pokud neoplastické polypy tvořily < 60 % všech polypů [7]. Tato studie navíc uvádí 92,6% shodu v postpolypektomickém endoskopickém intervalu s histopatologickým vyšetřením. Důležité je zdůraznit velkou variabilitu v metaanalýze zahrnutých studií, a to především v použití zvětšení a klasifikace. Některé studie použily zvětšovací endoskop a jen 4 z 28 hodnotily polypy pomocí NICE klasifikace. Je možné, že pokud by všechny studie použily pouze klasifikaci NICE, zjištěné statistické hodnoty by byly ještě vyšší. Velmi zajímavá je metaanalýza American Society for Gastrointestinal Endoscopy (ASGE) z roku 2015. Tato metaanalýza 19 studií si vzala za cíl ověřit dosažitelnost vlastního prahu pro implementaci endoskopické histologizace v případě diminutivních polypů [9].
2. Diminutivní adenomy v bílém světle a v NBI, kategorie NICE II. Fig. 2. Adenomas in a native examination and in NBI, NICE II category. 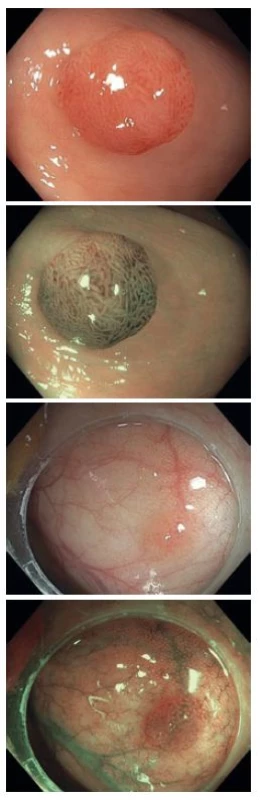
3. Diminutivní hyperplastické polypy v bílém světle a v NBI, kategorie NICE I. Fig. 3. Diminutive hyperplastic polyps in white light and in NBI, NICE I category. 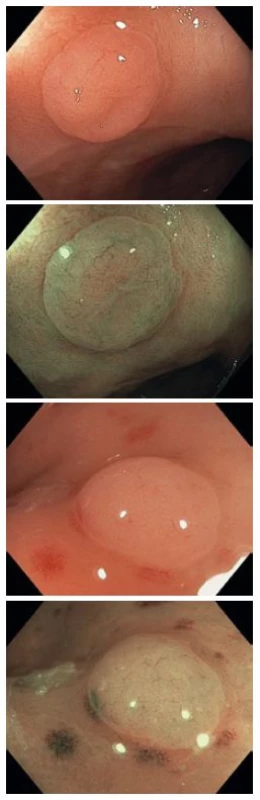
Diminutivní polypy (≤ 5 mm) jsou vzhledem k jejich četnosti při screeningové kolonoskopii a malému riziku pokročilé neoplazie vhodné k endoskopické histologizaci. Diminutivních nebo malých (6–9 mm) polypů je při screeningové kolonoskopii diagnostikováno > 90 %, přičemž diminutivní polypy tvoří většinu [1]. Polovina diminutivních a malých polypů jsou polypy hyperplastické, a tudíž většinou odstraňované zbytečně. Ovšem vzhledem k zatím chybějící chromodiagnostické NBI kategorii pro serátní léze je doporučeno hyperplastické léze mimo rektosigma odstranit. Hlavním důvodem pro endoskopickou histologizaci diminutivních polypů je malé riziko pokročilé histologie (high-grade dysplazie, vilózní složka) a malé riziko invazivního karcinomu 5,6, resp. 0 % [1]. Narozdíl od diminutivních polypů je v malých polypech riziko invazivního karcinomu již významných 0,9 %, a proto by po jejich odstranění mělo být vždy provedeno histologické vyšetření.
Přes uvedená fakta podporující bezpečnost endoskopické histologizace diminutivních polypů ASGE ve svém dokumentu Preservation and Incorporation of Valuable endoscopic Inovation (PIVI) nastavuje podmínky, za kterých by tento přístup mohl být použit v běžné endoskopické praxi [10]. První podmínkou je nejméně 90% NPV pro ponechání diminutivního adenomového polypu v sigmatu při „observe and leave“ strategii. Druhou podmínkou je nejméně 90% shoda v postpolypektomickém endoskopickém intervalu v případě čistě endoskopické histologizace „resect and discard“ strategie a intervalu zakládajícím se na histologickém vyšetření. V již zmiňované metaanalýze hodnotila ASGE možnost splnění nastavených implementačních podmínek při užití NBI [10]. První podmínka byla splněna s NPV 91,1 %. V případě hodnocení s vysokou mírou jistoty nebo hodnocení experty byla NPV dokonce 93 %. Druhá podmínka byla splněna v případě hodnocení s vysokou mírou jistoty v případě hodnocení experty nebo v případě akademických center, kdy zjištěná shoda v postpolypektomickém intervalu byla 91 a 92, resp. 91 %. Hlavně na základě požadavků nutných pro splnění druhé podmínky doporučila technologická skupina ASGE použití NBI strategie „observe and leave“ a „resect and discard“ pouze v případě hodnocení diminutivních polypů s vysokou mírou jistoty anebo v případě hodnocení zkušenými endoskopisty. Pozice European Society of Gastrointestinal Endoscopy je podobná. Navrhuje digitální chromodiagnostiku u diminutivních polypů jako náhradu za histopatologickou diagnózu v případě proškolených endoskopistů používajících validované klasifikace a fotodokumentaci [11].
Na našem pracovišti jsme na 26 pacientech při preventivní kolonoskopii hodnotili spolehlivost NBI chromodiagnostiky, resp. NICE klasifikace. Tři endoskopisté zařadili 48 diminutivních a malých polypů do některé ze tří NICE kategorií. NICE III polypy nejsou vhodné pro „discard strategii“, a proto byly ze souboru vyřazeny. Jeden z endoskopistů, který polypy hodnotil, používá NICE klasifikaci rutinně tři roky, druhý byl v NICE klasifikaci před rokem zaškolen a třetí hodnotící je zkušený endoskopista, který je seznámen s NICE klasifikací, ale běžně ji nepoužívá. V polovině případů byla k dispozici endoskopická sestava EXERA III CV-190 a u zbylých pacientů EXERA III CV-180. Ve všech případech byl k dispozici HD monitor. Před zařazením do NICE kategorie byl každý polyp oplachovou pumpou zbaven všech nečistot a před polypektomií byly pro archivaci pořízeny nejméně dva snímky, jak nativně, tak v NBI světle. Po polypektomii byl každý polyp hned extrahován sakční pumpou a pečlivě označen. Celková zjištěná senzitivita, specificita, PPV, NPV a přesnost hodnocení byla 97, 71, 89 a 91%. V případě prvního v NICE nejzkušenějšího endoskopisty byly všechny statistické ukazatele vyšší, přičemž senzitivita a NPV dokonce 100% (tab. 1). Nižší specificita je ovlivněna výrazně menším počtem hodnocených hyperplastických NICE I polypů. Hodnotili jsme i shodu v postpolypektomickém endoskopickém intervalu, která byla 96 %. Naše data tak výrazně převyšují požadavky na implementaci „observe and leave“ a „resect and discard“ strategií. Pro malý počet hodnocených polypů je však zatím nutné brát tyto výsledky jako předběžné.
1. NICE klasifikace 47 diminutivních polypů zjištěných u 26 pacientů při preventivní kolonoskopii (v závorkách výsledky endoskopistů používajících NICE klasifikaci v běžné praxi). Tab. 1. NICE Classification of 47 diminutive polyps detected in 26 patients during preventive colonoscopy (the results provided by endoscopists using the NICE classification in everyday practice are shown in brackets) 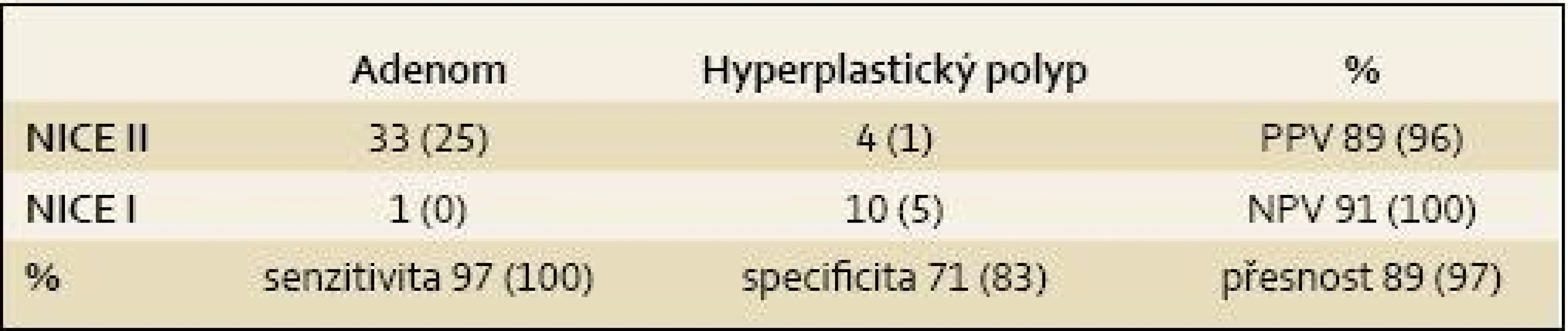
PPV – positive predictive value, NPV – negative predictive value Jsme tedy připraveni na endoskopickou histologizaci a na nové strategie v rutinní endoskopické praxi?
Z klinických studií víme, že endoskopická histologizace je bezpečná u diminutivních polypů a že v případě expertů se vyrovná zlatému standardu – histologickému vyšetření. Pro rozšíření strategií „resect and discard“ a „observe and leave“ je nutné plnění PIVI kritérií, ale také ochota měnit zaběhlá paradigmata. Klinické studie ukazují, že trénink v endoskopické histologizaci vede k rychlému zlepšení endoskopistů a přiblížení se na úroveň expertů [12,13]. Na druhou stranu ne vždy se ex vivo výsledky promítají do endoskopické praxe [14,15]. Udávání míry jistoty hodnocení může zajistit bezpečnost endoskopické histologizace u školících se endoskopistů. Pokud je míra jistoty hodnocení nízká, pak se běžná endoskopická praxe nemění a polyp je po odstranění odeslán na histologické vyšetření. Přesto zůstává otázkou, jak by měli být endoskopisté školeni a jak ověřit jejich erudici.
Jsou vhodnější interaktivní semináře vedené expertem nebo školení pomocí počítačových programů?
Součástí školení je i znalost standardizované klasifikace, v případě NBI se jedná o NICE klasifikaci. Pro úplnost klasifikace NICE bude nutné její rozšíření o serátní léze. Serátní léze mají typické rysy, které vyniknou v NBI, jako je hlenová čepice, neostré okraje, obláčková struktura a široce otevřené krypty. Tyto rysy je odlišují od běžných hyperplastických polypů [16]. Velice důležitým faktorem, který může bránit širšímu rozšíření endoskopické histologizace, je technická vybavenost jednotlivých pracovišť, včetně možnosti fotodokumentace a archivace. Přes některé výhrady a nejasnosti se endoskopická histologizace jeví jako náhrada za histologické vyšetření jako velmi perspektivní a je pravděpodobné, že u diminutivních polypů v blízké době plně nahradí histologické vyšetření.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 20. 8. 2015
Přijato: 14. 9. 2015
MUDr. Robert Procházka
Gastroenterologie
Nemocnice Jablonec nad Nisou, p.o.
Nemocniční 15
466 60 Jablonec nad Nisou
prorobert@seznam.cz
Sources
1. Gupta N, Bansal A, Rao D et al. Prevalence of advanced histological features in diminutive and small colon polyps. Gastrointest Endosc 2012; 75(5): 1022–1030. doi: 10.1016/j.gie.2012.01.020.
2. Costantini M, Sciallero S, Giannini A et al. Interobserver agreement in the histologic diagnosis of colorectal polyps. The experience of the multicenter adenoma colorectal study (SMAC). J Clin Epidemiol 2003; 56(3): 209–214.
3. East JE, Suzuki N, Saunders BP. Comparison of magnified pit pattern interpretation with narrow band imaging versus chromoendoscopy for diminutive colonic polyps: a pilot study. Gastrointest Endosc 2007; 66(2): 310–316.
4. Rastogi A, Bansal A, Wani S et al. Narrow-band imaging colonoscopy – a pilot feasibility study for the detection of polyps and correlation of surface patterns with polyp histologic diagnosis. Gastrointest Endosc 2008; 67(2): 280–286.
5. Sano Y, Ikematsu H, Fu KI et al. Meshed capillary vessels by use of narrow-band imaging for differential diagnosis of small colorectal polyps. Gastrointest Endosc 2009; 69(2): 278–283. doi: 10.1016/j.gie.2008.04.066.
6. Hewett DG, Kaltenbach T, Sano Y et al. Validation of a simple classification system for endoscopic diagnosis of small colorectal polyps using narrow-band imaging. Gastroenterology 2012; 143(3): 599–607. doi: 10.1053/j.gastro.2012.05.006.
7. Hyashi N, Tanaka S, Hewett DG et al. Endoscopic prediction of deep submucosal invasive carcinoma: validation of the narrow-band imaging international colorectal endoscopic (NICE) classification. Gastrointest Endosc 2013; 78(4): 625–632. doi: 10.1016/j.gie.2013.04.185.
8. McGill SK, Evangelou E, Iannidis JP et al. Narrow band imaging to differentiate neoplastic and non-neoplastic colorectal polyps in real time: a meta-analysis of diagnostic operating characteristics. Gut 2013; 62(12): 1704–1713. doi: 10.1136/gutjnl-2012-303965.
9. ASGE Technology Committee, Abu Dayyeh BK, Thosani N et al. ASGE Technology Committee systematic review and meta-analysis assessing the ASGE PIVI thresholds for adopting real-time endoscopic assessment of the histology of diminutive colorectal polyps. Gastrointest Endoscopy 2015; 81(3): doi: 10.1016/j.gie.2014.12.022.
10. Rex DK, Kahi C, O’Brien M et al. The American Society for Gastrointestinal Endoscopy PIVI (Preservation and Incorporation of Valuable Endoscopic Innovations) on real-time endoscopic assessment of the histology of diminutive colorectal polyps. Gastrointest Endosc 2011; 73(3): 419–422. doi: 10.1016/j.gie.2011.01.023.
11. Kamińsky MF, Hassan C, Bisschops R et al. Advanced imaging for detection and differentiation of colorectal neoplasia: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2014; 46(5): 435–449. doi: 10.1055/s-0034-1365348.
12. Raghavendra M, Hewett DG, Rex DK. Differentiating adenomas from hyperplastic colorectal polyps: narrow-band imaging can be learned in 20 minutes. Gastrointest Endosc 2010; 72(3): 572–576. doi: 10.1016/j.gie.2010.03.1124.
13. Ignjatovic A, Thomas-Gibson S, East JE et al. Development and validation of small adenomas from hyperplastic colorectal polyps. Gastrointest Endosc 2011; 73(1): 128–133. doi: 10.1016/j.gie.2010.09.021.
14. Rastogi A, Rao DS, Gupta N et al. Impact of a computer-based teaching module on characterization of diminutive colon polyps by using narrow-band imaging by non-experts in academic and community practice: a video-based study. Gastrointest Endosc 2014; 79(3): 390–398. doi: 10.1016/j.gie.2013.07.032.
15. Ladabaum U, Fioritto A, Mitani A et al. Real-time optical biopsy of colon polyps with narrow band imaging in community practice does not yet meet key thresholds for clinical decisions. Gastroenterology 2013; 144(1): 81–91. doi: 10.1053/j.gastro.2012.09.054.
16. Hazewinkel Y, López-Cerón M, East JE et al. Endoscopic features of sessile serrated adenomas: validation by international experts using high-resolution white-light endoscopy and narrow-band imaging. Gastrointest Endosc 2013; 77(6): 916–924. doi: 10.1016/j.gie.2012.12.018.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2015 Issue 5-
All articles in this issue
-
XXIXth Hildebrand Bardejov gastroenterology days
Inflammatory diseases in case reports and well-arranged lectures - The selection from international journals
- Leaving
- A pilot experimental study of oesophageal stenosis after ESD
- Variable endoscopic appearance of early squamous cell carcinoma of the oesophagus
- First experience with digital Spyglass™ DS in Slovakia from the gastroenterology department of the Trnava University Hospital
- Endoscopic histologisation of diminutive colorectal polyps. Are we ready for a change?
- Quality of biopsies in patients with Barrett’s esophagus – jumbo vs. large capacity forceps
- Screening colonoscopy among elderly patients over 70 years
- Home parenteral nutrition – its importance and use in clinical practice
- Standard diagnostic and therapeutic approaches to chronic hepatitis C virus infection
- Ledipasvir/ sofosbuvir – rapid development of knowledge reduces treatment time
- Hands-on training of advanced endoscopic methods – an international workshop in Athens
- New approaches in the follow-up of patients suffering from inflammatory bowel diseases
-
XXIXth Hildebrand Bardejov gastroenterology days
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Endoscopic histologisation of diminutive colorectal polyps. Are we ready for a change?
- Screening colonoscopy among elderly patients over 70 years
- Home parenteral nutrition – its importance and use in clinical practice
- First experience with digital Spyglass™ DS in Slovakia from the gastroenterology department of the Trnava University Hospital
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

