-
Medical journals
- Career
Exviera, Viekirax
Authors: P. Urbánek
Authors‘ workplace: Interní klinika 1. LF UK a ÚVN, Praha
Published in: Gastroent Hepatol 2015; 69(1): 75-80
Category: Drug Profile
doi: https://doi.org/10.14735/amgh201575Virem hepatitidy C (HCV) je v současné době na celém světě infikováno kolem 170 milionů osob. Poslední a dosud jediný sérologický průzkum provedený v roce 2001 v České republice prokázal prevalenci reaktivity anti‑HCV protilátek u 0,2 % vyšetřeného populačního vzorku [1]. HCV infekce je považována za hlavní příčinu rozvoje jaterní cirhózy a hepatocelulárního karcinomu v ekonomicky vyspělých zemích [2 – 4].
Od roku 2002 byla standardní terapie chronické HCV infekce založena na podání kombinace pegylovaných interferonů alfa (PEG ‑ IFN) s ribavirinem (RBV) [5]. V případech infekce vyvolané genotypem 1 byla délka protivirové terapie 48 týdnů, u genotypů 2 a 3 byla indikována protivirová léčba na dobu 24 týdnů.
Měřítkem účinnosti každé protivirové léčby HCV infekce je tzv. setrvalá virologická odpověď (SVR). Tato je definována jako trvání nedetekovatelné sérové HCV RNA v určitém okamžiku po skončení léčby. Podle okamžiku tohoto vyšetření (a tedy odstupu od skončení léčby) se rozlišuje především tzv. SVR12 a SVR24, které představují prokázanou negativitu sérové HCV RNA ve 12., resp. ve 24. týdnu po skončení léčby. Poslední dobou se stává standardem posouzení odpovědi ve 12. týdnu, protože se ukázalo, že k relapsům infekce mezi 12. a 24. týdnem po skončení léčby prakticky nedochází. I v následujícím textu tedy budeme pracovat především se SVR12. Účinnost kombinace PEG ‑ IFN + RBV u genotypu 1 je 40 – 60 %, u genotypu 2 a 3 kolem 80 % [6,7]. Rokem 2011 vstoupila léčba virové hepatitidy C do zcela nového období. Do protivirové léčby začaly v tomto roce pronikat preparáty ze skupiny přímo působících virostatik (directly acting antivirals – DAA). Jedná se o skupinu nízkomolekulárních látek, které přesně definovaným způsobem inhibují některý z enzymů klíčových pro replikaci HCV v cytoplazmě hepatocytu. Klíčové enzymy jsou tři (schéma 1): NS3/ 4 proteáza, NS5A proteáza a NS5B polymeráza (RNA dependentní RNA polymeráza, RdRp). Dnes tedy rozlišujeme podle cíle inhibice tři třídy virostatik a v rámci každé třídy pak již existuje více (nejčastěji dvě) generací preparátů. Mezi třídami, ale i mezi generacemi jsou velmi významné rozdíly v užití, v nutnosti kombinací, v rizicích vzniku virologické rezistence a v mnoha dalších parametrech.
Schéma 1. Schéma replikačního cyklu viru hepatitidy C. Scheme 1. Hepatitis C virus replication cycle scheme. 
Prvními preparáty ze skupiny DAA, které pronikly do léčebných kombinací, byly boceprevir a telaprevir. Oba představují první generaci inhibitorů NS3/ 4 proteázy, které mají protivirovou účinnost pouze u HCV genotypu 1a které je třeba stále kombinovat s pegylovanými interferony a ribavirinem. Účinnost této trojkombinace je kolem 65 – 70 % [8,9].
Vyšší generace virostatik či virostatika jiných tříd vykazují protivirovou účinnost u většiny (i všech) genotypů HCV, mají menší množství nežádoucích účinků a nevyžadují současné podávání pegylovaného interferonu a často ani ribavirinu. Naopak je třeba je kombinovat mezi sebou, čímž dochází ke snížení rizika vzniku virologické rezistence. Velkou výhodou je také významné zkrácení celkové doby podávání těchto moderních preparátů. Léčebné režimy běžně trvají 12 týdnů. Představiteli těchto moderních DAA jsou všechny tři protivirové látky, kterým se budeme věnovat v následujícím přehledu.
Exviera, Viekirax
Exviera (výrobce AbbVie, USA) potahovaná tableta obsahující dasabuvir 250 mg. Specialita Viekirax (AbbVie,USA) obsahuje v potahované tabletě ombitasvir 12,5 mg, paritaprevir 75 mg a ritonavir 50 mg. Všechny tyto látky byly vždy studovány ve vzájemné kombinaci (tzv. 3D kombinace), proto se všem látkám budeme i dále věnovat současně. Dávkování při léčbě HCV infekce je Exviera 1 tbl dvakrát denně + Viekirax 2 tbl jednou denně.
Farmakologická charakteristika
Dasabuvir je nenukleosidovým inhibitorem RdRp produktu NS5B virového genomu. Není určen k podávání v monoterapii, striktně je třeba jej kombinovat s ombitasvirem/ paritaprevirem/ ritonavirem. Kombinací dochází ke spojení tří přímo působících antivirotik s různými mechanizmy účinku a nepřekrývajícími se profily rezistence vůči cílovému HCV.
Dasabuvir je metabolizován systémem cytochromu, především pomocí CYP2C8 a CYP3A. Proto se při kombinaci dasabuviru s induktory těchto systémů očekává snížení jeho plazmatické koncentrace a snížení jeho protivirového účinku. Níže jsou uvedeny příklady induktorů, které jsou z tohoto důvodu považovány za kontraindikované k současnému podání s dasabuvirem. Naopak podání silných inhibitorů CYP2C8 může vést ke vzestupu plazmatické koncentrace dasabuviru, a v důsledku toho ke zvýšení množství a závažnosti možných nežádoucích účinků.
Induktory CYP3A4/ CYP2C8:
- karbamazepin, fenytoin, fenobarbital
- rifampicin, nevirapin
- efavirenz
- třezalka tečkovaná (Hypericum perforatum)
- enzalutamid
- mitotan
Inhibitor CYP2C8:
- gemfibrozil
Ombitasvir je inhibitorem NS5A proteázy, paritaprevir je inhibitorem NS3/ 4 proteázy viru. Ombitasvir i paritaprevir jsou metabolizovány přes složky cytochromu CYP3A. Další součást preparátu Viekirax ritonavir není látkou s protivirovou účinností. Je silným inhibitorem CYP3A. Jeho zařazení do 3D kombinace umožnilo snížení použité dávky paritapreviru. Při současném zachování optimální protivirové účinnosti paritapreviru tak došlo ke snížení počtu a závažnosti nežádoucích účinků. Tento princip je dobře znám z lékových kombinací užívaných k terapii HIV infekce.
Nicméně závislost na systému cytochromu P450 přináší podobná rizika jako u dasabuviru. Řadu látek je proto třeba i při podávání ombitasviru a paritapreviru považovat za kontraindikované. Patří k nim např. alfuzosin hydrochlorid, amiodaron, astemizol, terfenadin, cisaprid, ergotamin, dihydroergotamin, ergonovin, metylergometrin, kyselina fusidová, lovastatin, simvastatin, perorální midazolam, triazolam, pimozid, quetiapin, salmeterol, sildenafil (při použití k léčbě plicní arteriální hypertenze) a tikagrelor. Mezi substráty CYP3A, které byly hodnoceny ve studiích lékových interakcí a které mohou vyžadovat úpravu dávky a klinické monitorování, patří dále cyklosporin, takrolimus, amlodipin, rilpivirin, alprazolam a ketokonazol. Dalšími příklady substrátů CYP3A4, které mohou vyžadovat úpravu dávky a klinické monitorování, jsou blokátory kalciových kanálů (např. nifedipin) a trazodon. Přestože buprenorfin a zolpidem jsou také metabolizovány přes CYP3A, studie lékových interakcí naznačují, že úprava dávky při společném podávání těchto léčivých přípravků není zapotřebí.
Virologická rezistence
Rezistence in vitro [10]
Rezistence na dasabuvir nesená variantami v NS5B vyselektovanými v buněčné kultuře nebo nalezenými v klinických studiích fáze IIb a III byly fenotypicky charakterizovány v příslušných replikonech genotypu 1a nebo 1b. V genotypu 1a substituce C316Y, M414T, Y448H, A553T, G554S, S556G/ R a Y561H u HCV NS5B snížily citlivost na dasabuvir. V replikonu genotypu 1a byla aktivita dasabuviru snížena u substitucí M414T, S556G nebo Y561H 21–32násobně; u substitucí A553T, G554S nebo S556R 152–261násobně a u substitucí C316Y a Y448H 1 472násobně, resp. 975násobně. Substituce G558R a D559G/ N se objevily při léčbě, ale aktivitu dasabuviru proti těmto variantám nebylo možno kvůli špatné replikační schopnosti posoudit. V genotypu 1b substituce C316N, C316Y, M414T, Y448H a S556G u HCV NS5B snížily citlivost k dasabuviru. Aktivita dasabuviru byla u substitucí C316N a S556G snížena 5násobně a 11násobně, u M414T nebo Y448H 46násobně a u substitucí C316Y v replikonu genotypu 1b 1 569násobně. Dasabuvir si udržel plnou aktivitu proti replikonům obsahujícím substituce S282T na místě vazby nukleosidu, M423T ve spodní části strukturní domény označované jako „palec“ a P495A/ S, P496S nebo V499A v horní části uvedené domény.
Virologická rezistence byla přirozeně studována i u dalších dvou složek kombinace. Genetické varianty asociované s rezistencí byly popsány jak v oblastech NS3/ 4, tak i NS5A virového genomu. U genotypu 1a substituce F43L, R155K, A156T a D168A/ H/ V/ Y u HCV NS3 snížily citlivost vůči paritapreviru. V replikonu genotypu 1a byla aktivita paritapreviru snížena substitucemi F43L, R155K, resp. A156T 20násobně, 37násobně, resp. 17násobně (v uvedeném pořadí). Substitucí D168V byla aktivita paritapreviru snížena 96násobně a každou z dalších substitucí D168V 50násobně až 219násobně. Jednotlivými substitucemi V36A/ M, V55I, Y56H, Q80K nebo E357K nebyla aktivita paritapreviru u genotypu 1a významně ovlivněna. Dvojité varianty zahrnující kombinace substitucí V36LM, F43L, Y56H, Q80K nebo E357K s R155K nebo s D168 snížily aktivitu paritapreviru o další 2–3násobek v porovnání s jednotlivou substitucí R155K nebo D168. U replikonu genotypu 1b byla vlivem D168A, D168H, D168V a D168Y aktivita paritapreviru snížena 76násobně, resp. 159násobně, resp. 337násobně. Samotná substituce Y56H nemohla být kvůli špatné replikační schopnosti hodnocena, ale kombinace Y56H a D168A/ V/ Y snížila aktivitu paritapreviru 700–4 118násobně.
U genotypu 1a substituce M28T/ V, Q30E/ R, L31V, H58D, Y93C/ H/ N a M28V + Q30R u HCV NS5A snížily citlivost k ombitasviru. V replikonu genotypu 1a byla aktivita ombitasviru snížena u substitucí M28T/ V a H58D 896násobně, resp. 58násobně, resp. 243násobně a u substitucí Q30E/ R, L31V a Y93C/ H/ N 1 326násobně, resp. 800násobně, resp. 155násobně, resp. 1 675–66 740násobně. Y93H, Y93N nebo M28V v kombinaci s Q30R snížily aktivitu ombitasviru více než 42 802násobně. V genotypu 1b snížily substituce L28T, L31F/ V i Y93H samy o sobě nebo v kombinaci s L28M, R30Q, L31F/ M/ V nebo P58S u HCV NS5A citlivost vůči ombitasviru. V replikonu genotypu 1b byla aktivita ombitasviru snížena méně než 10násobně variantami na pozicích aminokyselin 30 a 31. V genotypu 1b byla aktivita ombitasviru proti substitucím L28T, Y93H, R30Q v kombinaci s Y93H a L31M v kombinaci sY93H snížena (v uvedeném pořadí) 661násobně, resp. 77násobně, resp. 284násobně, resp. 142násobně. Všechny další dvojité substituce Y93H v kombinaci se substitucemi na pozicích 28, 31 nebo 58 snížily aktivitu ombitasviru více než 400násobně.
Rezistence v klinických studiích
Z 2 510 subjektů infikovaných HCV genotypu 1 léčených v klinických studiích fáze IIb a III režimy obsahujícími dasabuvir, ombitasvir a paritaprevir s ribavirinem či bez něho, (po dobu 8, 12 nebo 24 týdnů) došlo k virologickému selhání celkem u 74 subjektů (3 %) (primárně poléčebný relaps). Varianty, které se objevily při léčbě, a jejich prevalence u uvedených populací s virologickým selháním ukazuje tab. 1. Z 67 subjektů infikovaných genotypem 1a byly varianty NS3 pozorovány u 50 subjektů, varianty NS5A u 46 subjektů, varianty NS5B u 37 subjektů a varianty, které se objevily při léčbě u všech tří cílů léčiv, se vyskytly u 30 subjektů. Ze sedmi subjektů infikovaných genotypem 1b byly varianty, které se objevily při léčbě u NS3, pozorovány u čtyř subjektů, varianty NS5A u dvou subjektů a varianty jak u NS3, tak i NS5A u jednoho subjektu. U žádného ze subjektů infikovaných genotypem 1b se při léčbě neobjevily varianty u všech tří cílů léčiv.
Table 1. Substituce popsané v klinických studií s kombinací 3D (n = 2 510). Tab. 1. Substitutions described in clinical studies with 3D combination (n = 2 510). 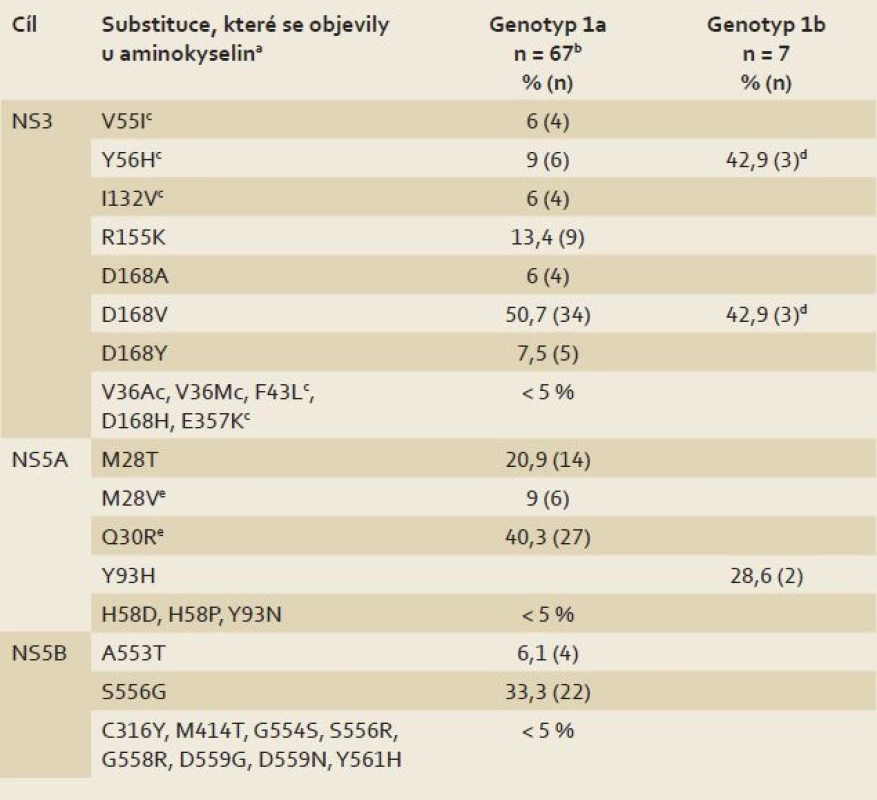
a pozorováno nejméně u dvou subjektů s týmž subtypem b n = 66 pro cíl NS5B c substituce byly pozorovány v kombinaci s jinými substitucemi, které se objevily u aminokyselin u NS3 na pozici R155 nebo D168 d pozorováno u kombinace u subjektů infikovaných genotypem 1b e pozorováno u kombinace u 6 % (4/67) subjektů Účinek výchozích substitucí/ polymorfizmů HCV na výsledek léčby
Byla provedena souhrnná analýza subjektů s infekcí HCV genotypu 1 léčených dasabuvirem, ombitasvirem a paritaprevirem s ribavirinem, nebo bez něho, v klinických hodnoceních fáze IIb a III.Cílem bylo prostudovat spojitost mezi výchozími substitucemi/ polymorfizmy NS3/ 4A, NS5A nebo NS5B a výsledkem léčby u doporučených režimů. Ve více než 500 výchozích vzorcích genotypu 1a v této analýze byly nejčastěji pozorovanými variantami souvisejícími s rezistencí M28V (7,4 %) u NS5A a S556G (2,9 %) u NS5B. Přestože je Q80K polymorfizmem s vysokou prevalencí u NS3 (41,2 % vzorků), působí minimální rezistenci na paritaprevir. Varianty na pozicích R155 a D168 spojované s rezistencí byly u NS3 na počátku pozorovány vzácně (méně než 1 %). Ve více než 200 výchozích vzorcích genotypu 1b v této analýze byly nejčastěji pozorovanými variantami souvisejícími s rezistencí Y93H (7,5 %) u NS5A a C316N (17,0 %) a S556G (15 %) u NS5B. Vzhledem k nízké četnosti selhání pozorované u doporučených léčebných režimů u subjektů infikovaných HCV genotypů 1a a 1b se zdá, že výchozí výskyt variant má na pravděpodobnost dosažení setrvalé virologické odpovědi (SVR) jen malý vliv.
Zkřížená rezistence
Zkřížená rezistence se očekává mezi inhibitory NS5A, inhibitory proteázy NS3/ 4A a nenukleosidovými inhibitory NS5B podle jednotlivých tříd. Dopad předchozí léčby dasabuvirem, ombitasvirem nebo paritaprevirem na účinnost jiných inhibitorů NS5A, inhibitorů proteázy NS3/ 4A nebo inhibitorů NS5B nebyl studován.
Účinnost a bezpečnost
Účinnost dasabuviru v kombinaci s ombitasvirem/ paritaprevirem/ ritonavirem a s ribavirinem. či bez ribavirinu. byla hodnocena v několika registračních studiích. Celkem bylo ve studiích hodnoceno 2 300 osob s genotypem HCV 1.
Bezpečnost podání 3D kombinace
Kumulovaná bezpečnostní data ze všech registračních studií s 3D kombinací shrnuje tab. 2.
Table 2. Kumulativní bezpečnostní data ze studií s kombinací 3D. Tab. 2. Cumulative safety data from studies with 3D combination. 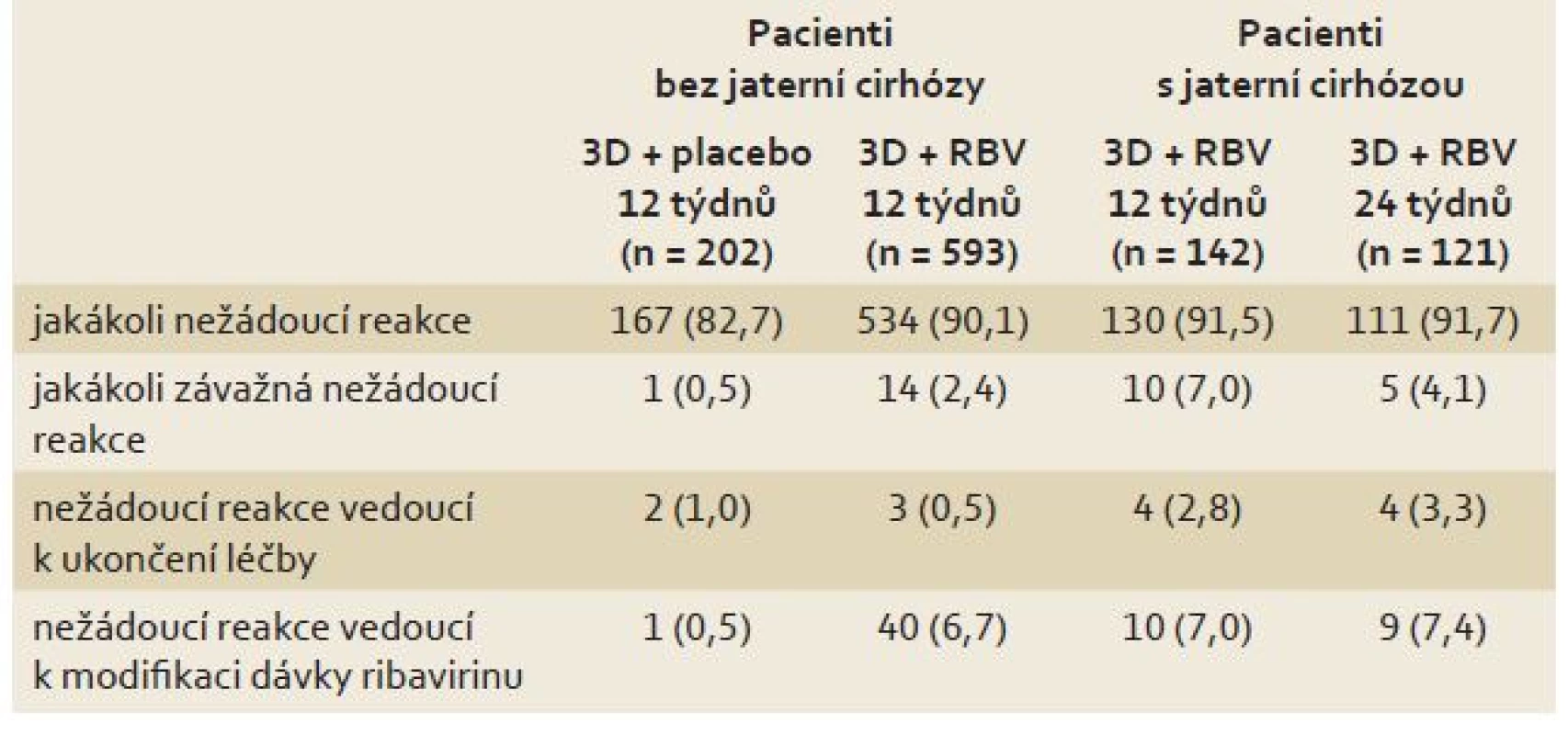
Je dobře vidět, že použité režimy (s ribavirinem i bez ribavirinu) podávané po dobu 12 nebo 24 týdnů byly dobře tolerovány, výskyt nežádoucích reakcí byl velmi nízký. Nositelem největšího množství nežádoucích reakcí byl ribavirin, jehož dávku bylo nutno u cca 7 % pacientů během terapie modifikovat. Podstatné také je, že u < 4 % pacientů musela být léčba z důvodu výskytu nežádoucích reakcí ukončena.
Účinnost
Studie SAPPHIRE ‑ I zkoumala účinnost léčby kombinací 3D u pacientů dosud neléčených (naivních) bez jaterní cirhózy infikovaných genotypem 1 [11]. Mezi pacienty s genotypem HCV1a bylo dosaženo SVR12 v 95 % případů, mezi pacienty s infekcí genotypem 1b byla účinnost 98 %. Účinnostní data léčby u různých podskupin pacientů ukazuje graf 1.
Graph 1. Výsledky studie (ITT) SAPPHIRE-I v různých podskupinách dosud neléčených osob. Graph 1. Results of the (ITT) SAPPHIRE-I study in different subgroups of previously untreated persons. 
Stejné uspořádání jako předchozí studie měla i studie SAPPHIRE ‑ II, která však měla jako cílovou skupinu pacientů osoby, které již byly v minulosti neúspěšně léčeny kombinací PEG ‑ IFN + ribavirin [12]. Účinnost léčby v kategoriích pacientů podle odpovědi na předchozí léčbu ukazuje graf 2.Při analýze účinnosti podle výchozího genotypu byla opět ukázána vysoká účinnost u genotypu 1a i 1b (96 % vs 96,7 %).
Graph 2. Výsledky studie (ITT) SAPPHIRE-II. Graph 2. Results of the (ITT) SAPPHIRE-II study. 
Účinky 3D kombinace s ribavirinem a bez ribavirinu podávané po dobu 12 týdnů u osob dosud neléčených bez jaterní cirhózy zkoumala studie PEARL III. Účinnost v obou větvích byla naprosto stejná, 99 a 99,5 %. Hematologické abnormality byly přitom dle očekávání častější ve větvi s ribavirinem.
Studie TURQUOISE ‑ II zkoumala účinek 12 - a 24týdenní léčby 3D + ribavirin u pacientů s jaterní cirhózou [13]. Léčeni byli pacienti jak naivní, tak pacienti, kteří již byli v minulosti léčeni neúspěšně kombinací PEG ‑ IFNR + ribavirin. Ukázalo se, že u cirhotiků je účinnější režim trvající 24 týdnů než režim trvající pouze 12 týdnů (SVR12 96% vs 92 %). Účinnost 12týdenního režimu u pacientů s genotypem 1a byla 89 %, u genotypu 1b pak 98,5 %. Účinnost půlročního režimu byla u genotypu 1a 94,2 % a u 1b dokonce 100 % (graf 3).
Graph 3. Výsledky studie (ITT) TURQUOISE-II u pacientů s HCV genotypem 1a podle odpovědi na předchozí protivirovou léčbu. Graph 3. Results of the (ITT) TURQUOISE-II study in patients with genotype 1a HCV according to the response to previous antiviral treatment. 
Závěr
Tab. 3 ukazuje doporučovaná schémata použití přípravků Exviera a Viekirax pro pacienty s infekcí vyvolanou genotypem HCV 1. Oba přípravky zatím v ČR nemají stanovenou úhradu, nejsou tudíž běžné dostupné. Stanovení úhrady je očekáváno v druhé polovině roku 2015.
Table 3. Doporučovaná léčebná schémata s preparáty Exviera a Viekirax. Tab. 3. Recommended treatment schemes for Exviera and Viekirax. 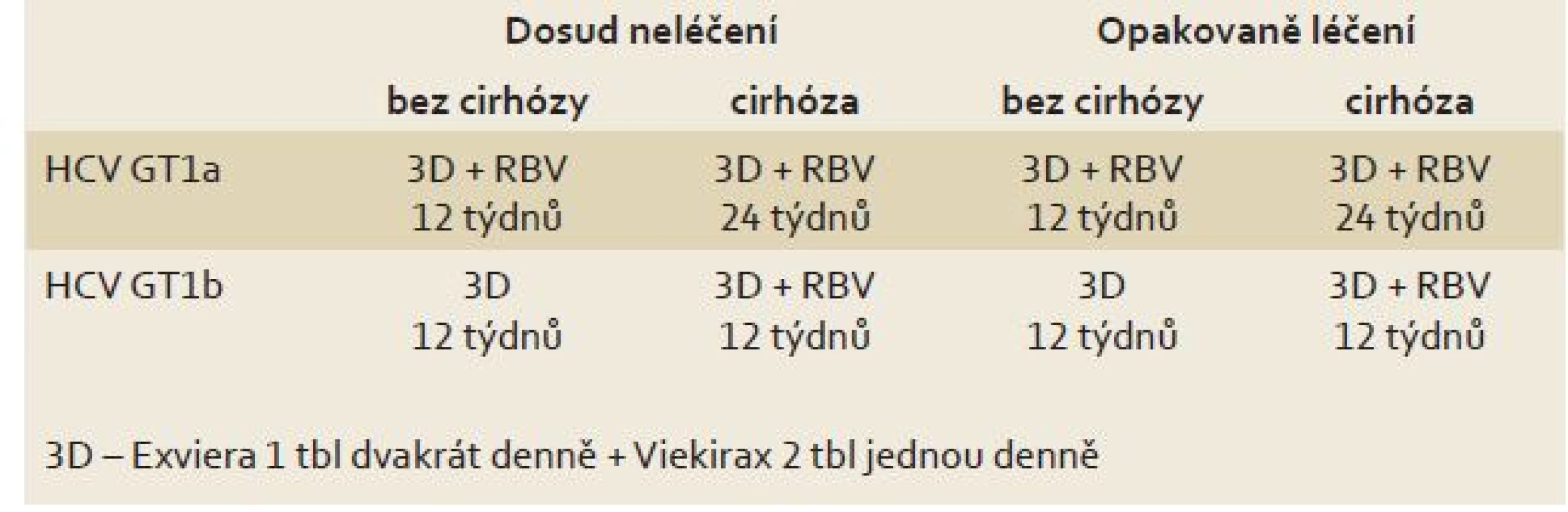
doc. MU Dr. Petr Urbánek, CSc.
Interní klinika 1. LF UK a ÚVN
U Vojenské nemocnice 1200 160 00 Praha 6
petr.urbanek@uvn.cz
Sources
1. Němeček V. Sérologický přehled ČR v roce 2001 – virová hepatitida A, B, C. Zprávy CEM 003; 12 : 55 – 61.
2. World Health Organization. Global alert and response (GAR). Hepatitis C. [online]. Available from: http:/ / www.who.int/ csr/ disease/ hepatitis/ whocdscsrlyo2003/ en/ .
3. Perz JF, Armstrong GL, Farrington LA et al. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide. J Hepatol 2006; 45(4): 529 – 538.
4. Kanwal F, Hoang T, Kramer JR et al. Increasing prevalence of HCC and cirrhosis in patients with chronic hepatitis C virus infection. Gastroenterology 2011; 140(4): 1182 – 1188. doi: 10.1053/ j.gastro.2010.12.032.
5. Urbánek P, Husa P, Galský J et al. Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C (HCV). Čas Lék Čes 2008; 147(5): příloha: I – XII.
6. Fried MW, Shiffman ML, Reddy KR et al.Peginterferon alfa‑2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 347(13): 975 – 982.
7. Hadziyannis SJ, Sette H Jr, Morgan TR et al. Peginterferon‑alfa2a and ribavirin combination therapy in chronic hepatitis C: a randomized study of treatment duration and ribavirin dose. Ann Intern Med 2004; 140(5): 346 – 355.
8. Urbánek P. Novinky v terapii chronické infekce virem hepatitidy C. Remedia 2011, 21 : 380 – 385.
9. Urbánek P, Husa P, Galský J et al. Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV). Gastroent Hepatol 2012; 66(3): 214 – 229.
10. Viekirax SPC. North Chicago, IL: AbbVie 2014.
11. Feld JJ, Kowdley KV, Coakley E et al. Treatment of HCV with ABT ‑ 450/ r ‑ ombitasvir and dasabuvir with ribavirin. N Engl J Med 2014; 370(17):1594 – 1603. doi: 10.1056/ NEJMoa1315722.
12. Zeuzem S, Jacobson IM, Baykal T et al. Retreatment of HCV with ABT ‑ 450/ r ‑ ombitasvir and dasabuvir with ribavirin. N Engl J Med 2014; 370(17): 1604 – 1614. doi: 10.1056/ NEJMoa1401561.
13. Poordad F, Hezode C, Trinh R et al. ABT ‑ 450/ r ‑ ombitasvir and dasabuvir with ribavirin for hepatitis C with cirrhosis. N Engl J Med 2014; 370(21): 1973 – 1982. doi: 10.1056/ NEJMoa1402869.
14. Manns MP, Foster GR, Rockstroh JK et al. The way forward in HCV treatment – finding the right path. Nat Rev Drug Discov 2007; 6(12): 991–1000.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2015 Issue 1-
All articles in this issue
- Novinky v roce 2015
- Nejen anti-TNF živ je IBD pacient
- Doporučené postupy chirurgické léčby pacientů s nespecifickými střevními záněty – 1. část: předoperační příprava
- Eradikace perianálních píštělí u IBD nemocných pomocí metody Advancement Flap a rizikové faktory neúspěšného hojení
- Vedolizumab v léčbě ulcerózní kolitidy
- Topická léčba idiopatických střevních zánětů
- Význam fekálneho kalprotektínu v diagnostike a liečbe nešpecifických črevných zápalových ochorení
- Imunoablační léčba a autologní transplantace hematopoetických kmenových buněk u pacienta s agresivní formou Crohnovy nemoci refrakterní na medikamentózní terapii
- Praktický příspěvek k diagnostice a léčbě fokální nodulární hyperplazie a adenomů v játrech z pohledu hepatologa, radiologa, patologa a chirurga
- Krátkodobé výsledky léčby povrchových neoplastických lézí žaludku endoskopickou submukózní disekcí
- Syndróm bakteriálneho prerastania
- Exviera, Viekirax
- Preparáty firmy Nutricia v enterální výživě u dětí
- Noví členové redakční rady časopisu
- Výzva ke spolupráci
- VIII. beskydský endoskopický workshop
- Biologická léčba nemá vliv na výsledky endoskopické balónkové dilatace u pacientů s Crohnovou nemocí
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Praktický příspěvek k diagnostice a léčbě fokální nodulární hyperplazie a adenomů v játrech z pohledu hepatologa, radiologa, patologa a chirurga
- Syndróm bakteriálneho prerastania
- Topická léčba idiopatických střevních zánětů
- Eradikace perianálních píštělí u IBD nemocných pomocí metody Advancement Flap a rizikové faktory neúspěšného hojení
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

