-
Medical journals
- Career
Srovnání dietních návyků pacientů s kolorektálními neoplaziemi a jejich příbuzných prvního stupně
Authors: I. Mikoviny Kajzrlíková 1; P. Vítek 1,2; J. Chalupa 1; Petr Dítě 2
Authors‘ workplace: Beskydské Gastrocentrum, Interní oddělení, Nemocnice ve Frýdku-Místku, p. o. 1; Katedra interních oborů, Lékařská fakulta, Ostravská univerzita v Ostravě 2
Published in: Gastroent Hepatol 2014; 68(3): 202-206
Category: Digestive Endoscopy: Original Article
Overview
Příbuzní prvního stupně nemocných s kolorektálními neoplaziemi mají vyšší riziko vzniku kolorektálního karcinomu. Kolorektální karcinom má hereditární i nehereditární rizika. Cílem naší práce bylo porovnání dietních návyků pacientů s kolorektálními neoplaziemi a jejich příbuzných prvního stupně spolu s kontrolní skupinou jedinců bez rodinné anamnézy a bez nálezu neoplastické léze.
Metody:
Od června 2008 do dubna 2011 jsme sbírali epidemiologická data týkající se kolorektálních neoplazií jak od pacientů s kolorektálními neoplaziemi, tak od jejich příbuzných prvního stupně a kontrolní skupiny. Ke zhodnocení rizikových faktorů mezi dvěma skupinami byl použit chí-kvadrát a Fisherův exaktní test.Výsledky:
Studijní skupiny tvořilo 242 pacientů s kolorektálními neoplaziemi (143 mužů, 99 žen) a 160 příbuzných prvního stupně (66 mužů, 94 žen), z nich 55 s nálezem neoplastické léze a 105 bez nálezu neoplazie. Kontrolní skupinu tvořilo 123 jedinců (66 mužů, 57 žen). Mezi mužskými i ženskými skupinami pacientů, kontrol a příbuzných s neoplastickou lézí, nebo bez neoplastiké léze srovnávaných podle pohlaví nebylo zjištěno větší množství statisticky významných rozdílů. Ve všech skupinách byly zjištěny statisticky významné rozdíly mezi pohlavími.Závěry:
V našem souboru jsme nezjistili větší množství významných rozdílů mezi jednotlivými skupinami, ovšem výrazné statisticky významné rozdíly mezi pohlavími. Ženy ve všech skupinách mají obecně zdravější dietní návyky než muži. Navrhujeme, že by mohlo být efektivní zacílit mediální kampaň i dietní intervenci zejména na mužskou populaci, kde je větší prostor ke zlepšení dietních návyků.Klíčová slova:
kolorektální neoplazie – dietní návyky – rizikové faktory – rodina – screeningKolorektální neoplazie (KRN) jsou druhou nejčastější příčinou úmrtí na nádorová onemocnění v rozvinutých zemích. V České republice je nejvyšší prevalence kolorektálního karcinomu na světě, v roce 2008 zde byla jeho incidence 94,2/100 000 mužů a 61,8/100 000 žen [1]. Dle dostupných klinických studií snižuje kolonoskopický screening incidenci i mortalitu kolorektálního karcinomu [2]. V roce 2000 byl v České republice zahájen národní screeningový program zahrnující test na okultní krvácení pro občany nad 50 let věku. V roce 2009 byla screeningová doporučení rozšířena o možnost primární screeningové kolonoskopie pro jedince nad 55 let věku [3,4].
KRN jsou asociovány jak s nehereditárními, tak s hereditárními rizikovými faktory. Karcinom tlustého střeva a konečníku je nejčastěji rodinně se vyskytující nádorové onemocnění. Více než 30 % má dědičný podklad, z toho 25 % připadá na tzv. nesyndromové familiární riziko [5]. Příbuzní prvního stupně pacientů s kolorektálními neoplaziemi (PPS) mají čtyřikrát vyšší riziko KRN ve srovnání s běžnou populací a mají také vyšší riziko pokročilých a mnohočetných adenomů [6–9].
Nehereditární rizikové faktory zahrnují vyšší věk, mužské pohlaví, konzumaci alkoholu, kouření, konzumaci červeného masa, nízký příjem ovoce a zeleniny, mléčných výrobků a vlákniny, sedavý životní styl, nespecifické střevní záněty a některá další onemocnění jako akromegalii, diabetes mellitus nebo ischemickou chorobu srdeční [10–17].
Cílem naší studie bylo srovnat dietní návyky pacientů s KRN a kontrolní skupiny s dietními návyky PPS s přihlédnutím k jejich kolonoskopickému nálezu. První testovaná hypotéza byla, že dietní návyky PPS s neoplazií jsou podobné těm pacientů s KRN a dietní návyky PPS bez neoplazie těm kontrolní skupiny. Druhá testovaná hypotéza byla, že v jednotlivých skupinách nejsou statisticky významné rozdíly mezi pohlavími.
Metody
Klinická data
Od června 2008 do dubna 2011 jsme sbírali epidemiologická data týkající se kolorektálního karcinomu od pacientů s KRN, jejich PPS i od kontrolní skupiny. Epidemiologická data zahrnující kouření (kuřák/exkuřák vs nekuřák), příjem tuků (vysoký vs nízký), body mass index (BMI < 30 vs ≥ 30), konzumaci piva (denně/příležitostně vs nikdy), konzumaci mléčných výrobků, ovoce a zeleniny a červeného masa (denně vs méně často) a stupeň vzdělání (základní a střední bez maturity vs vyšší) byla získávána od skupin pacientů s KRN, PPS a kontrol lékařem. Lékař specializovaný v gastroenterologii a výživě vyplnil dotazník na základě rozhovoru s pacientem. Sběr epidemiologických dat byl součástí projektu Jako jedna rodina, což byl unikátní projekt oslovující PPS probíhající v nemocnici ve Frýdku-Místku. Cílem projektu bylo poskytnout PPS řádnou kolonoskopickou dispenzarizaci, určit u nich prevalenci neoplastických lézí a identifikovat PPS v nejvyšším riziku. Projekt byl schválen etickou komisí a všichni zúčastnění podepsali informovaný souhlas.
PPS byli indikováni ke kolonoskopickému vyšetření a na základě nálezu byli rozděleni do dvou skupin: s neoplazií/bez neoplazie. Kontrolní skupina zahrnovala jedince s negativní rodinnou anamnézou KRN bez nálezu neoplastické léze na kolonoskopii.
Statistická analýza
Do statistické analýzy jsme zahrnuli jedince, od kterých jsme získali kompletní epidemiologická data. Věk zúčastněných je prezentován jako průměr ± standardní odchylka (standard deviation – SD). Dietní návyky ve všech skupinách (pacienti s KRN, PPS s neoplazií, PPS bez neoplazie, kontroly) byly porovnány pomocí chí-kvadrátu (χ2), popřípadě Fisherova exaktního testu. Vzhledem k heterogennímu zastoupení mužů a žen ve skupině PPS bez neoplazií byli muži a ženy v jednotlivých skupinách porovnáváni odděleně.
Výsledky
Studijní skupiny sestávaly z 242 pacientů s KRN (143 mužů, 99 žen; 64 ± 12 let) a 160 PPS (66 mužů, 94 žen; 48 ± 11 let). Padesát pět PPS mělo na kolonoskopii nález neoplastické léze, 105 PPS bylo bez nálezu neoplazie. Kontrolní skupinu tvořilo 123 jedinců s negativní rodinnou anamnézou KRN a bez nálezu neoplazie při kolonoskopii (66 mužů, 57 žen; 54 ± 12 let). Charakteristiky jednotlivých skupin jsou rozepsány v tab. 1.
Table 1. Charakteristika jednotlivých skupin účastníků. Tab. 1. Characteristics of the study groups. 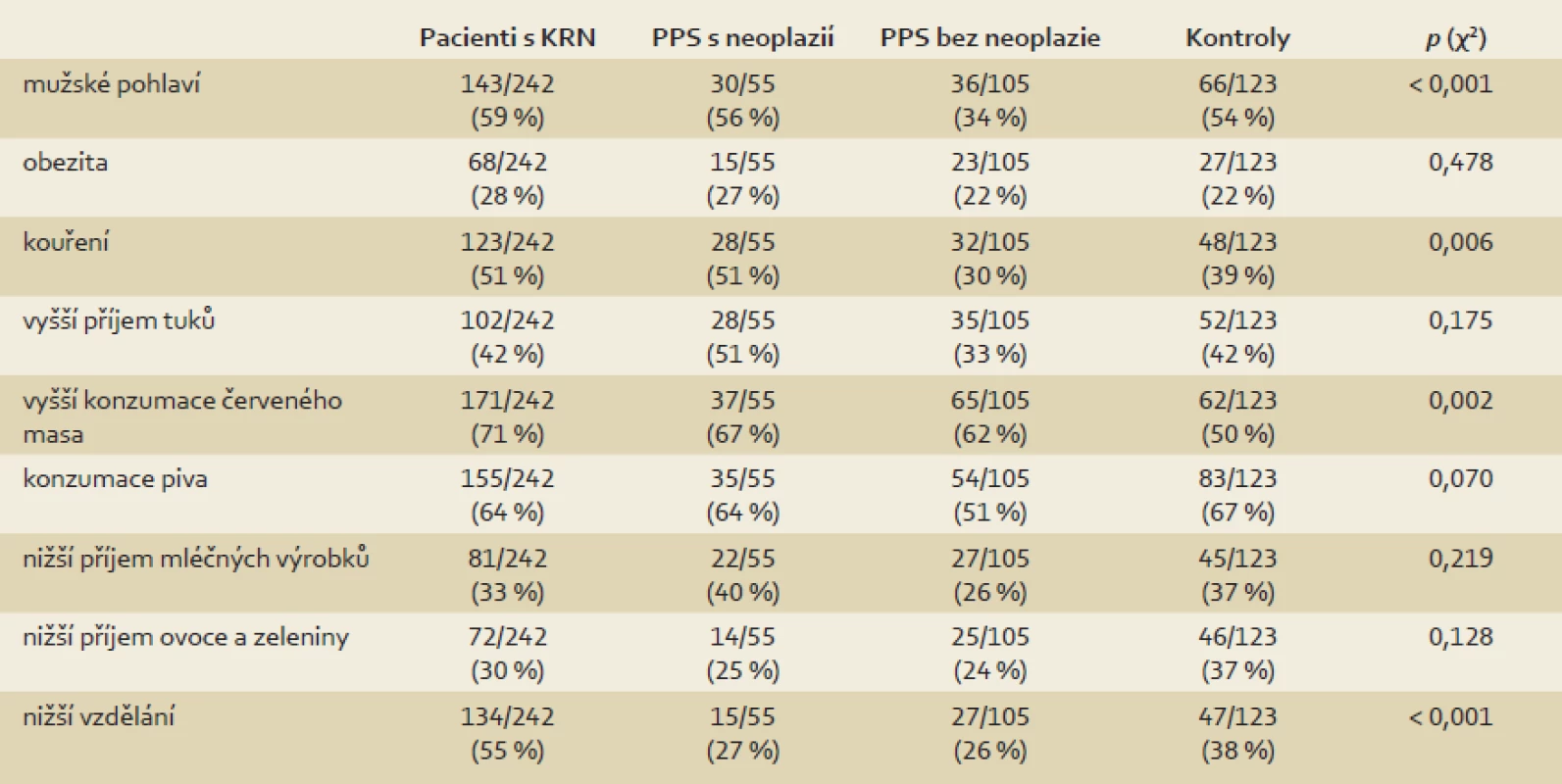
Nejprve jsme testovali hypotézu, že dietní návyky PPS s neoplazií jsou podobné návykům pacientů s KRN a dietní návyky PPS bez neoplazie jsou podobné návykům kontrolní skupiny. Následně jsme testovali hypotézu, že v jednotlivých skupinách nejsou statisticky významné rozdíly mezi pohlavími. Srovnání všech skupin jsou prezentována v tab. 2 a 3. Srovnání mužů a žen v jednotlivých skupinách je prezentováno v tab. 4.
Table 2. Porovnání dietních návyků pacientů s KRN a PPS s/bez neoplazie (χ<sup>2</sup>/ Fisherův exaktní test). Tab. 2. Comparison of dietary habits between colorectal neoplasia patients and first-degree relatives with/without neoplasia (χ<sup>2</sup>/ Fisher’s exact test). 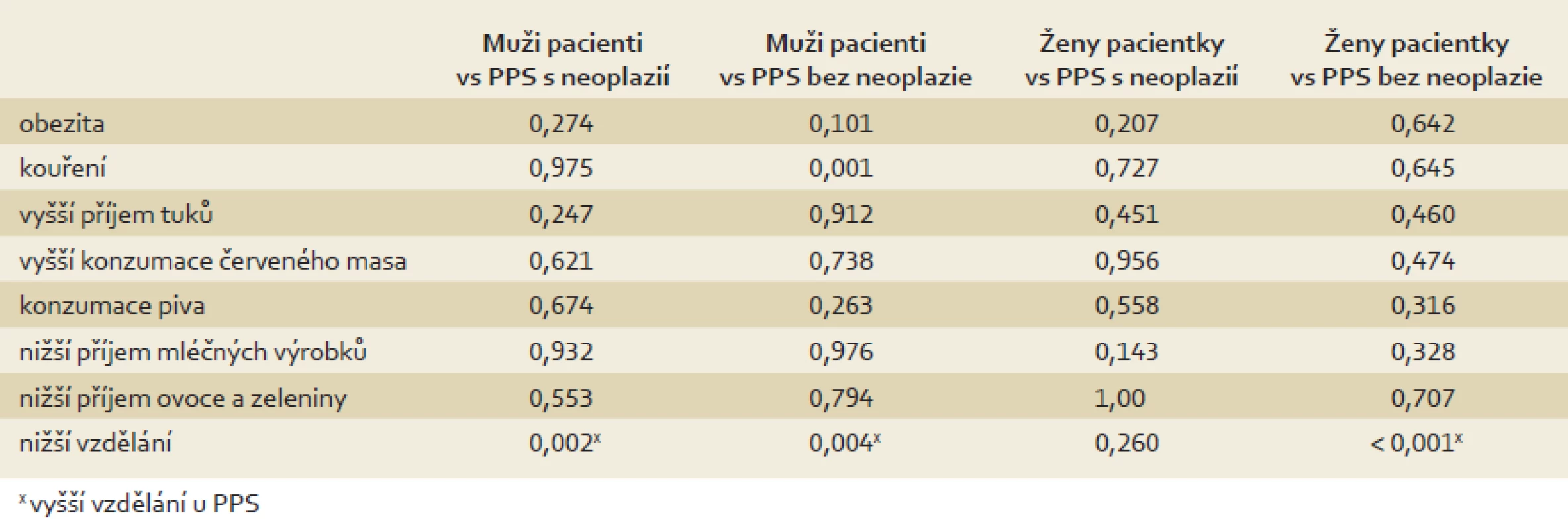
Table 3. Porovnání dietních návyků kontrol a PPS s/bez neoplázie (χ<sup>2</sup>/ Fisherův exaktní test). Tab. 3. Comparison of dietary habits between controls and first-degree relatives with /without neoplasia (χ<sup>2</sup>/ Fisher’s exact test). 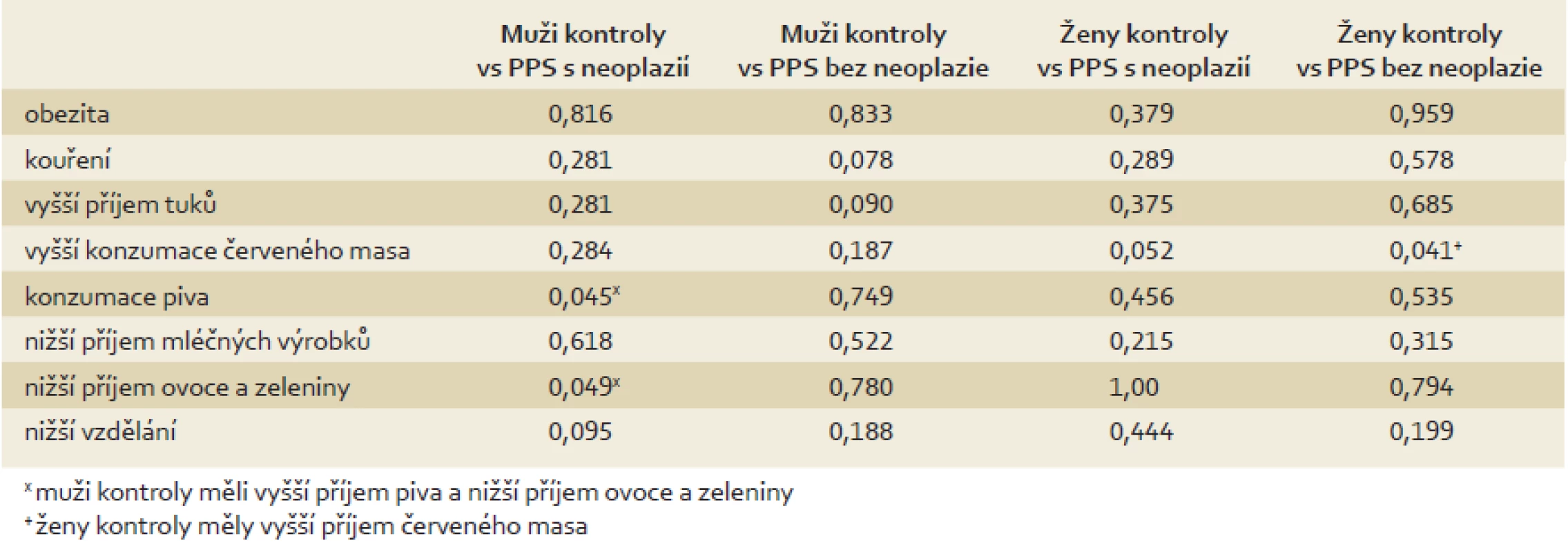
Table 4. Porovnání dietních návyků ve všech skupinách: muži vs ženy (χ<sup>2</sup>/ Fisherův exaktní test). Tab. 4. Comparison of dietary habits in all groups: males vs females (χ<sup>2</sup>/ Fisher’s exact test). 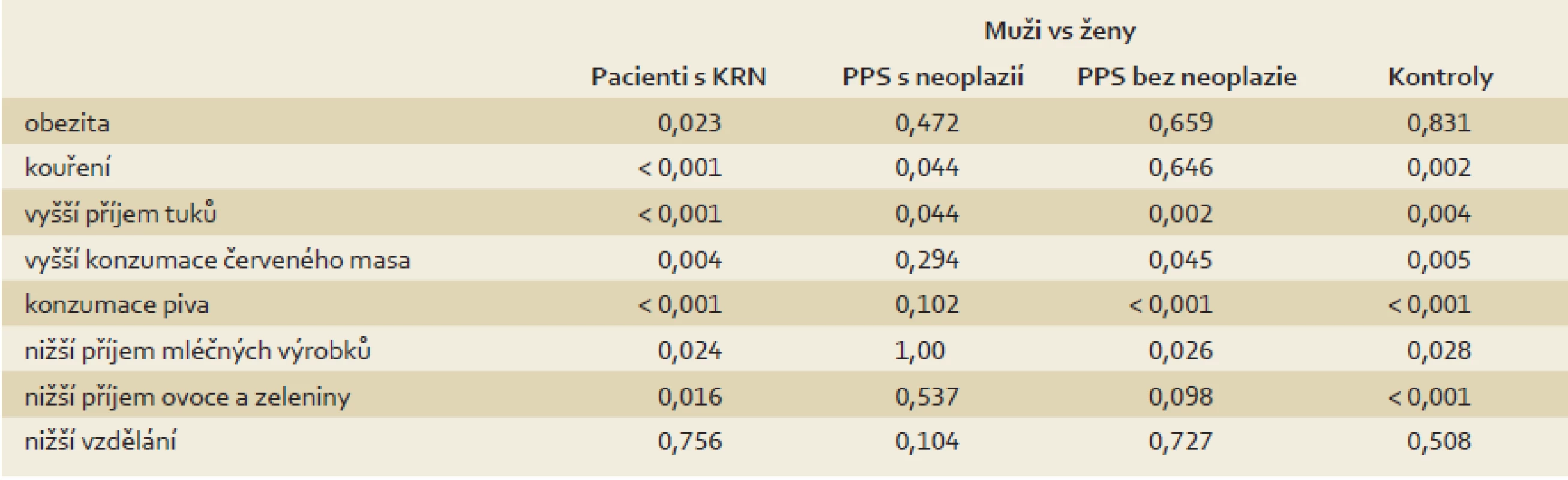
Obě naše hypotézy byly vyvráceny. Nebyly prokázány významné rozdíly v dietních návycích mezi skupinami pacientů, kontrol a PPS s neoplazií/bez neoplazie. Zato však byly ve všech skupinách prokázány významné rozdíly v dietních návycích mezi muži a ženami, a to i přes to, že mezi muži a ženami nebyl významný rozdíl ve stupni vzdělání.
Diskuze
Naše práce vycházela z epidemiologických dat týkajících se kolorektálního karcinomu, která byla získána od pacientů s KRN, jejich PPS s neoplazií/bez neoplazie a od kontrolní skupiny.
Je velmi dobře zdokumentováno, že rizika kolorektálního karcinomu jsou jak hereditární, tak nehereditární. Nehereditární rizikové faktory jsou podrobně zmíněny v úvodu. Dále je popsána asociace kolorektálního karcinomu se střevním mikrobiomem. Střevní mikrobiota mohou transformovat složky potravy v genotoxické působky, aktivovat protoonkogeny nebo inaktivovat tumor supresorové geny [18–20].
Genetické faktory spojené s vyšším rizikem KRN zahrnují větší počty rizikových genů s nízkou penetrancí a specifické polymorfizmy. Některé genetické varianty či polymorfizmy genů byly již asociovány se zvýšeným rizikem kolorektálního karcinomu, mezi ně patří APC-I1307K, HRAS1-VNTR a MTHFR varianty [21,22]. V genomových studiích bylo dále zjištěno, že dispozice ke vzniku KRN může být následkem až 170 genetických variací [23]. V současné době rozeznáváme tři hlavní cesty kolorektální karcionogeneze: chromozomální instabilitu, mikrosatelitní instabilitu a hypermetylaci [24,25].
Důležitou otázkou zůstává, jak mohou být hereditární rizika ovlivněna či zaměněna s rodinnými podobnostmi a zvyklostmi ve stravování, fyzické aktivitě a životním stylu obecně.
Naše první testovaná hypotéza byla, že dietní zvyklosti PPS s neoplazií budou podobné jako pacientů s KRN, zatímco zvyklosti PPS bez neoplazie budou podobné spíše kontrolní skupině. Předpokládali jsme, že jak zdravé kontroly, tak PPS bez neoplazie sdílí podobný zdravější životní styl. Vzhledem k heterogennímu zastoupení mužů a žen ve skupině PPS bez neoplazií byli muži a ženy v jednotlivých skupinách porovnáváni odděleně. K našemu překvapení však mezi jednotlivými skupinami nebyly větší rozdíly. Pouze jsme zaznamenali více kuřáků u pacientů s KRN ve srovnání s PPS bez neoplazie. Bylo prokázáno, že kouření zvyšuje riziko kolorektálního karcinomu až o 18 % [12]. Paradoxně muži v kontrolní skupině konzumovali více piva a méně ovoce a zeleniny než PPS s neoplazií a ženy v kontrolní skupině měly vyšší spotřebu červeného masa než PPS bez neoplazie. Je překvapivé, že jsme v naší práci nezaznamenali vážnější asociaci mezi horšími dietními návyky a výskytem neoplazií u pacientů s KRN a jejich PPS s neoplazií i přes všechny zdokumentované rizikové faktory.
Druhá testovaná hypotéza byla, že v jednotlivých skupinách nejsou rozdíly v dietních návycích mezi pohlavími. Bez ohledu na kolonoskopický nález a bez ohledu na stupeň vzdělání mají muži ve všech skupinách horší dietní návyky než ženy. Je dobře známé, že ženy čerpají více prostředků ze screeningových programů a toto s prokázanou vyšší incidencí KRN v mužské populaci muže dále znevýhodňuje. Můžeme se pouze domnívat, že o třetinu vyšší incidence kolorektálního karcinomu v mužské populaci může být na vrub jejich horšímu životnímu stylu. Nabízí se tudíž zacílit mediální kampaň na mužskou populaci, protože je zde větší prostor k úpravě životního stylu.
Práce má několik limitací. Počty jedinců v jednotlivých skupinách jsou relativně malé a vybrané z populace České republiky, která je specifická nejvyšším výskytem kolorektálního karcinomu na světě. Výskyt diabetes mellitus byl zaznamenáván pouze ve skupině pacientů s KRN, takže nemůžeme hodnotit obezitu a dietní zvyky ve vztahu k diabetu. Rozdílný věkový průměr jednotlivých skupin představuje další slabinu studie.
Závěr
V naší práci nebyly prokázány významné rozdíly v dietních návycích mezi pacienty, kontrolami a PPS s neoplazií/bez neoplazie, zato však byly prokázány významné rozdíly mezi muži a ženami v jednotlivých skupinách. Ženy ve všech skupinách měly obecně zdravější dietní návyky. Proto navrhujeme zacílit mediální kampaň na mužskou populaci, kde je větší prostor k úpravě životního stylu. Modifikace screeningových doporučení podle pohlaví by mohla zvýšit efektivitu screeningových programů, ale ověření této hypotézy zatím vyžaduje provedení dalších studií.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 30. 4. 2014
Přijato: 27. 5. 2014
MUDr. Ivana Mikoviny Kajzrlíková
Nemocnice ve Frýdku-Místku, p. o.
El. Krásnohorské 321738 01 Frýdek-Místek
kajzrlikova@kolonoskopie.cz
Sources
1. Ústav zdravotnických informací a statistiky ČR. Novotvary 2008. [online]. Dostupné z: http://www.uzis.cz/katalog/zdravotnicka--statistika/novotvary.
2. Manser CN, Bachmann LM, Brunner J et al. Colonoscopy screening markedly reduces the occurrence of colon carcinomas and carcinoma-related death: a closed cohort study. Gastrointest Endosc 2012; 76(1): 110–117. doi: 10.1016/j.gie.2012.02.040.
3. Zavoral M, Suchanek S, Zavada F et al. Colorectal cancer screening in Europe. World J Gastroenterol 2009; 15(47): 5907–5915.
4. Zavoral M, Suchánek Š, Májek O et al. Národní program screeningu kolorektálního karcinomu v České republice – minulost, přítomnost a budoucnost. Gastroent Hepatol 2012; 66(5): 345–349.
5. Winawer SJ, Schottenfeld D, Flehinger BJ. Colorectal cancer screening. J Natl Cancer Inst 1991; 83(4): 243–253.
6. Johns LE, Houlston RS. A systematic review and meta-analysis of familial colorectal cancer risk. Am J Gastroenterol 2001; 96(10): 2992–3003.
7. Neklason DW, Thorpe BL, Ferrandez A et al. Colonic adenoma risk in familial colorectal cancer – a study of six extended kindreds. Am J Gastroenterol 2008; 103(10): 2577–2584. doi: 10.1111/j.1572-0241.2008.02019.x.
8. Wark PA, Wu K, van't Veer P et al. Family history of colorectal cancer: a determinant of advanced adenoma stage or adenoma multiplicity? Int J Cancer 2009; 125(2): 413–420. doi: 10.1002/ijc.24288.
9. Cottet V, Pariente A, Nalet B et al. Colonoscopic screening of first-degree relatives of patients with large adenomas: increased risk of colorectal tumors. Gastroenterology 2007; 133(4): 1086–1092.
10. Brenner H, Altenhofen L, Hoffmeister M. Sex, age, and birth cohort effects in colorectal neoplasms: a cohort analysis. Ann Intern Med 2010; 152(11): 697–703. doi: 10.7326/0003-4819-152-11-201006010-00002.
11. Norat T, Bingham S, Ferrari P et al. Meat, fish, and colorectal cancer risk: the European Prospective Investigation into cancer and nutrition. J Natl Cancer Inst 2005; 97(12): 906–916.
12. Botteri E, Iodice S, Bagnardi V et al. Smoking and colorectal cancer: a meta-analysis. JAMA 2008; 300(23): 2765–2778. doi: 10.1001/jama.2008.839.
13. Cho E, Smith-Warner SA, Ritz J et al. Alcohol intake and colorectal cancer: a pooled analysis of 8 cohort studies. Ann Intern Med 2004; 140(8): 603–613.
14. Renehan AG, Tyson M, Egger M et al. Body-mass index and incidence of cancer: a systematic review and meta-analysis of prospective observational studies. Lancet 2008; 371(9612): 569–578. doi: 10.1016//S0140-6736(08)60269-X.
15. Chan AO, Jim MH, Lam KF et al. Prevalence of colorectal neoplasm among patients with newly diagnosed coronary artery disease. JAMA 2007; 298(12): 1412–1419.
16. Ma J, Pollak MN, Giovannucci E et al. Prospective study of colorectal cancer risk in men and plasma levels of insulin-like growth factor (IGF)-I and IGF-binding protein-3. J Natl Cancer Inst 1999; 91(7): 620–625.
17. Delhougne B, Deneux C, Abs R et al. The prevalence of colonic polyps in acromegaly: a colonoscopic and pathological study in 103 patients. J Clin Endocrinol Metab 1995; 80(11): 3223–3226.
18. Rowland IR. The role of the gastrointestinal microbiota in colorectal cancer. Curr Pharm Des 2009; 15(13): 1524–1527.
19. Bures J, Horák V, Fixa B et al. Colicinogeny in colorectal cancer. Neoplasma 1986; 33(2): 233–237.
20. Davis CD, Milner JA. Gastrointestinal microflora, food components and colon cancer prevention. J Nutr Biochem 2009; 20(10): 743–752. doi: 10.1016/j.jnutbio.2009.06.001.
21. Jasperson KW, Tuohy TM, Neklason DW et al. Hereditary and familial colon cancer. Gastroenterology 2010; 138(6): 2044–2058. doi: 10.1053/j.gastro.2010.01.054.
22. Houlston RS, Tomlinson IP. Polymorphisms and colorectal tumor risk. Gastroenterology 2001; 121(2): 282–301.
23. Tenesa A, Dunlop MG. New insights into the aetiology of colorectal cancer from genome-wide association studies. Nat Rev Genet 2009; 10(6): 353–358. doi: 10.1038/nrg2574.
24. Grady WM. Genomic instability and colon cancer. Cancer Metastasis Rev 2004; 23(1–2): 11–27.
25. Weisenberger DJ, Siegmund KD, Campan M et al. CpG island methylator phenotype underlies sporadic microsatellite instability and is tightly associated with BRAF mutation in colorectal cancer. Nat Genet 2006; 38(7): 787–793.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2014 Issue 3-
All articles in this issue
- Neobvyklá komplikace ERCP
- Profesor Zdeněk Mařatka
- 100 let od narození profesora Zdeňka Mařatky
- Ideo centisimi
- Porovnání účinnosti kolonické kapslové endoskopie a kolonoskopie v detekci polypů a karcinomů tlustého střeva a konečníku – multicentrická, prospektivní, cross-over studie
- Perspektivy biologické léčby u idiopatických střevních zánětů
- Rifaximin v léčbě gastrointestinálních onemocnění
- Experimentální elektrogastrografie
- Akútne krvácanie do horného gastrointestinálneho traktu – zriedkavá manifestácia adenokarcinómu pankreasu
- Rostliny v terapii idiopatických střevních zánětů
- 4th Prague endoscopic day and 15th endoscopic day IKEM
- 87th congress of Japan Gastroenterological Endoscopy Society, Fukuoka, 15.–17. 5. 2014, Japan
- XVIIIth gastroenterology and hepatology days in Hradec Králové and VIIIth international endoscopic workshop
- Looking back at the 10th Congress EAGEN Postgraduate School in Prague
- Golimumab – nové biologikum v léčbě ulcerózní kolitidy
- K odchodu pana prof. MUDr. Bohumila Fixy, DrSc.
- Citrafleet® – jednoduchá a efektivní příprava tlustého střeva před vyšetřením
- Digestivní endoskopie
- Vodou asistovaná kolonoskopie
- Srovnání dietních návyků pacientů s kolorektálními neoplaziemi a jejich příbuzných prvního stupně
- Kombinovaná endoskopická a laparoskopická terapie akutního krvácení z žaludečních metastáz renálního karcinomu – videokazuistika
- Bezbolestná kolonoskopie
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Rifaximin v léčbě gastrointestinálních onemocnění
- Citrafleet® – jednoduchá a efektivní příprava tlustého střeva před vyšetřením
- Akútne krvácanie do horného gastrointestinálneho traktu – zriedkavá manifestácia adenokarcinómu pankreasu
- Neobvyklá komplikace ERCP
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

