-
Medical journals
- Career
Nitrergická inervácia tenkého čreva potkana po ischemicko-reperfúznom poškodení
Authors: A. Boleková 1; T. Špakovská 1; D. Kluchová 1; Š. Tóth 2; J. Veselá 2
Authors‘ workplace: Ústav anatómie LF UPJŠ v Košiciach 1; Ústav histológie a embryológie LF UPJŠ v Košiciach 2
Published in: Gastroent Hepatol 2013; 67(3): 202-206
Category: Clinical and Experimental Gastroenterology: Original Article
Overview
Syndróm multiorgánovej dysfunkcie spôsobuje vo väčšine prípadov úmrtie pacienta, a preto si vyžaduje zvýšenú pozornosť. Spúšťajúcim faktorom a cieľovou štruktúrou patofyziologických dejov vedúcich k tomuto syndrómu je endotel čreva. Oxid dusnatý pôsobí ako nonadrenergný a noncholinergný neurotransmiter v hladkej svalovine tenkého čreva a hrá významnú úlohu pri takomto type poškodenia.
Metodika:
Experimentálne zvieratá, samce dospelých potkanov kmeňa Wistar boli rozdelené do troch skupín v závislosti od trvania reperfúzie po predchádzajúcej hodinovej ischémii. Výsledky sme porovnávali s kontrolnou skupinou zvierat bez ischemicko-reperfúzneho poškodenia. Vzorky jejuna sme analyzovali histochemickou metódou na stanovenie nikotínamidadeníndinukleotidfosfát diaforázovej aktivity, ktorá zodpovedá prítomnosti oxidu dusnatého v nervových štruktúrach.Výsledky:
Aktivita nitrergických neurónov enterického nervového systému jejuna sa prudko znížila v skupine s hodinovou reperfúziou, následne sa v skupine potkanov po 24-hodinovej reperfúzii zvýšila a v skupine po 30-dňovej reperfúzii dosiahla hodnoty rovnaké, aké sme získali analýzou rezov jejuna kontrolnej skupiny.Záver:
Z výsledkov vyplýva, že ischemicko-reperfúzne poškodenie výrazne ovplyvňuje neuróny enterického nervového systému znížením aktivity neurotransmiteru oxidu dusnatého hneď po ischemicko-reperfúznom poškodení. Následné zvýšenie jeho aktivity 24 hod po zásahu svedčí o kompenzačnej reakcii neurónov na poškodenie, ktorá sa pri udržaní kompenzačných mechanizmov ustáli do 30 dní po ischémii návratom do stavu, aký bol pred ischemicko-reperfúznym poškodením. Pri zlyhaní kompenzačných mechanizmov nastáva smrť do 1 týždňa po navodenej ischémii.Kľúčové slová:
ischemicko-reperfúzne poškodenie – jejunum – inervácia
Pohyb, prekrvenie a exkrécia orgánov tráviaceho traktu podliehajú inervácii enterického nervového systému, ktorý je časťou autonómneho nervového systému. Pozostáva z ganglií a nervových vlákien tvoriacich plexus submucosus a plexus myentericus. Plexus submucosus Meissneri leží v podslizničnej vrstve čreva, obsahuje parasympatikové gangliá, ktorými stimuluje sekréciu epitelových buniek žliazok z Lieberkühnových krýpt a spája sa s motorickými neurónmi plexus myentericus. Plexus myentericus Auerbachi je rozsiahlejší ako plexus submucosus, nachádza sa medzi vrstvami tunica muscularis a obsahuje multipolárne viscerálne neuróny, ktorými riadi pohyb čreva a exkréciu tráviacich štiav [1]. Syndróm multiorgánovej dysfunkcie je napriek pokroku v intenzívnej medicíne najčastejšou príčinou smrti pacientov na jednotkách intenzívnej starostlivosti [2]. Spúšťajúcim momentom je najčastejšie trauma, popáleniny, sepsa a ostatné formy šoku, pri ktorých dochádza k redistribúcii krvi do životne dôležitých orgánov (srdce, pľúca, pečeň, obličky), pričom dochádza k hypoperfúzii čreva. Keďže sú črevné klky vysoko citlivé na ischémiu, veľmi rýchlo dochádza k ich poškodeniu, črevný epitel stráca funkciu bariéry, dochádza k prestupu baktérií a endotoxínov do portálnej a systémovej cirkulácie a vzniká systémová zápalová reakcia [3]. V závislosti od povahy a intenzity narušenia homeostázy môžu byť bunky v čreve, pľúcach a pečeni poškodené reverzibilne, zareagujú adaptáciou; alebo pri zlyhaní kompenzačných mechanizmov môže nastať bunková smrť a zlyhanie týchto orgánov končiace sa smrťou jedinca [4].
Cieľom práce bolo na modeli ischemicko-reperfúzneho poškodenia (IRP) u potkanov analyzovať zmeny nitrergickej inervácie jejuna z histochemického hľadiska. Sledovali sme aktivitu nikotínamidadeníndinukleotidfosfát diaforázy (NADPH-d), ktorá zodpovedá prítomnosti syntázy oxidu dusnatého (nitric oxide synthase – NOS), enzýmu potrebného pre vznik neurotransmitera oxidu dusnatého (nitric oxide – NO) [5,6]. Táto metodika sa veľmi často využíva vo výskume nervového systému na znázornenie nitrergických štruktúr [7]. Nitrergické neuróny predstavujú 1/3 zo všetkých myenterických neurónov tenkého čreva a selektívne regulujú črevnú perfúziu. 90 % týchto neurónov je motorických, pôsobia inhibične na svalovinu čreva, zvyšných 10 % tvoria interneuróny [8].
Materiál a metodika
V experimente sme použili 60 dospelých potkaních samcov kmeňa Wistar o priemernej hmotnosti 350 g, chovaných za štandardných podmienok. Pokus bol schválený Etickou komisiou LF UPJŠ a Štátnou veterinárnou a potravinovou správou pod č. 2843/08-221a. Potkany sme rozdelili do 4 skupín. Skupinu R1 (n = 14) tvorili zvieratá určené na 1-hodinovú perfúziu, R24 (n = 14) na 24-hodinovú perfúziu a R30 (n = 14) na 30-dňovú perfúziu, všetky po predchádzajúcej hodinovej ischémii. Skupina K (n = 18) bola kontrolná, ktoré bola vykonaná iba laparotómia bez ischémie. Zvieratá sme anestetizovali intraperitoneálne zmesou Xylariemu (8–10 mg/kg) a Narketanu (60–80 mg/kg). V skupinách R1, R24 a R30 sme za sterilných podmienok po vykonaní strednej laparotómie (6 cm) navodili hodinovú ischémiu založením cievnej svorky na a. mesenterica cranialis. Počas ischémie nebola brušná dutina zvierat zašitá, orgány boli iba upravené do anatomickej polohy, operačná rana bola sterilne prikrytá a telesná teplota zvierat sa udržovala na 37 °C. Po ukončení ischémie sme brušnú dutinu zašili v dvoch vrstvách pomocou Silonu 2.0 EP. Zvieratá sme nechali prežívať po zákroku 1 hod, 24 hod a 30 dní podľa skupiny. V deň odberu sme ich usmrtili letálnou dávkou anestetika a vzorky jejuna vo veľkosti 1 cm sme uložili na 24 hod do fixačného roztoku (4% paraformaldehyd s 0,1% glutaraldehydom v 0,1 M fosfátovom tlmivom roztoku, pH 7,4), potom na 1 hod do 15% roztoku sacharózy. Na zmrazovacom mikrotóme sme vzorky narezali na priečne rezy hrúbky 35 µm, ktoré sme ďalej spracovali modifikovanou histochemickou metódou podľa Scherera-Singlera na dôkaz NADPH-diaforázy [9]. Podľa nej sme rezy inkubovali 1 hod pri 37 °C v roztoku 1,5 mM nitroblue tetrazólia (NBT), 1,0 mM b-nikotínamiddinukleotidfosfátu (NADPH), 10,0 mM monosodiummalátu (malic acid), 0,5% Tritonu X-100 rozpusteného v 0,1 fosfátovom tlmivom roztoku, pH 8,0. Rezy sme montovali na sklíčka, pokrývali Entellanom a preparáty sme vyhodnocovali svetelným mikroskopom Olympus CH20. Mikrofotografie jednotlivých rezov sme nafotili pomocou mikroskopu Optika, model B600 TI s digitálnym kamerovým systémom Moticam 2300.
Výsledky
Po založení svorky na a. mesenterica cranialis nastalo kompletné zastavenie krvného prietoku a vymiznutie pulzácie na tejto artérii. Počas doby ischémie sme pozorovali farebné zmeny na nedokrvenej časti čreva. Sprvu edematózne časti jejuna zmenili farbu zo svetlej na hemoragickú tmavo červenú, ktorá napovedá o ischémii. Nedokrvené časti čreva boli jednoznačne odlíšiteľné od častí nepostihnutých ischémiou. Po ukončení hodinovej ischémie, sme svorku z artérie odstránili, čím sme obnovili prietok krvi postihnutými oblasťami. Revaskularizácia bola viditeľná okamžite, a to zmenou farby a obnovením pulzácie a. mesenterica cranialis.
Histochemický obraz aktivity NADPH-diaforázy sa vo vzorkách jejuna znázornil tmavomodrým sfarbením v plexus myentericus (na dne Lieberkühnových krýpt a v cievach tunica mucosa a submucosa), slabšie v plexus submucosus. Vo vzorkách kontrolnej skupiny bola výrazná NADPH-d pozitivita v plexus myentericus, neuróny boli pravidelného tvaru, ostro ohraničené, s oválnym svetlým jadrom a vytvárali homogénne zoskupenia prevažne v jednom rade za sebou. NADPH-d pozitivita bola aj na dne Lieberkühnových krýpt a po ich obvode (obr. 1).
Image 1. Histologický obraz jejuna v kontrolnej skupine. n – NADPH-d pozitívne neuróny silne pozitívne, šípky – nervové vlákna silne pozitívne, k – Lieberkühnove krypty s NADPH-d aktivitou na ich dne, m – mukóza, sm – submukóza, tm – tunica muscularis; scale bar = 40 μm Fig. 1. Histological picture of jejunum in the control group. n – neurons fully NADPH-d positive, arrows – positive nerve fibres, k – positivity in Lieberkühn's crypts, m – mucosa, sm – submucosal layer, tm – tunica muscularis; scale bar = 40 μm 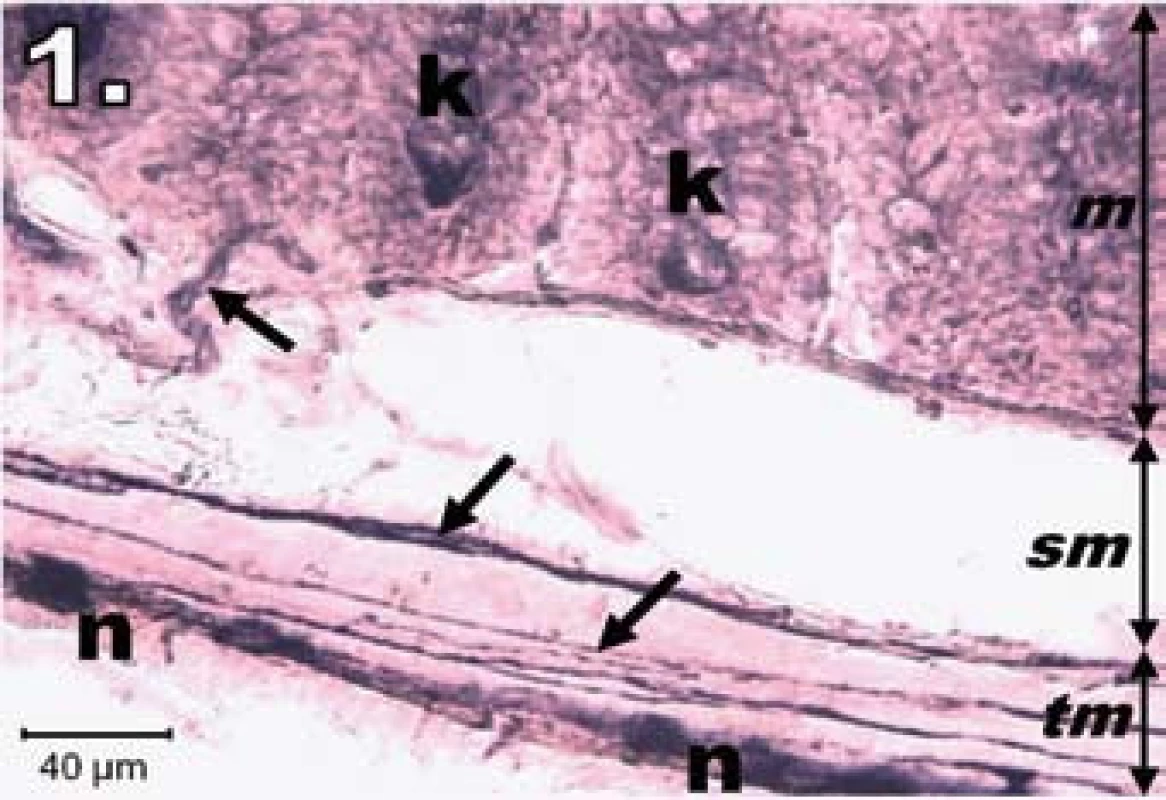
Vzorky jejuna v skupinách s IRP (hodinová ischémia a následná reperfúzia v troch rôznych časových intervaloch) vykazovali rôzny histochemický obraz NADPH-d aktivity. V skupine R1 (hodinová ischémia a hodinová reperfúzia) boli zmeny najvýraznejšie. Stena jejuna vykazovala známky poškodenia, sliznica bola stenčená, klky boli nepravidelne usporiadané, miestami úplne chýbali. Výrazný pokles NADPH-d aktivity sme zaznamenali v plexus myentericus a tunica submucosa. Neuróny boli slabo NADPH-d sfarbené, neostro kontúrované, rôznej veľkosti a nepravidelného tvaru, mali tendenciu k vytváraniu nehomogénnych zoskupení. Na dne Lieberkühnových krýpt sme nezistili známky NADPH-d pozitivity. Naopak, výraznejšia NADPH-d aktivivta bola prítomná v stróme klkov, čo je charakteristické pre neovaskularizáciu (obr. 2).
Image 2. Histologický obraz jejuna v skupine R1. n – poškodené NADPH-d pozitívne neuróny slabo ofarbené, šípky – nervové vlákna slabo ofarbené, k – Lieberkühnove krypty negatívne, m – mukóza, sm – submukóza, tm – tunica muscularis; scale bar = 40 μm Fig. 2. Histological picture of jejunum in group R1. n – damaged lightly stained NADPH-d positive neurons, arrows – lightly stained nerve fibres, k – negativity in Lieberkühn's crypts, m – mucosa, sm – submucosal layer, tm – tunica muscularis; scale bar = 40 μm 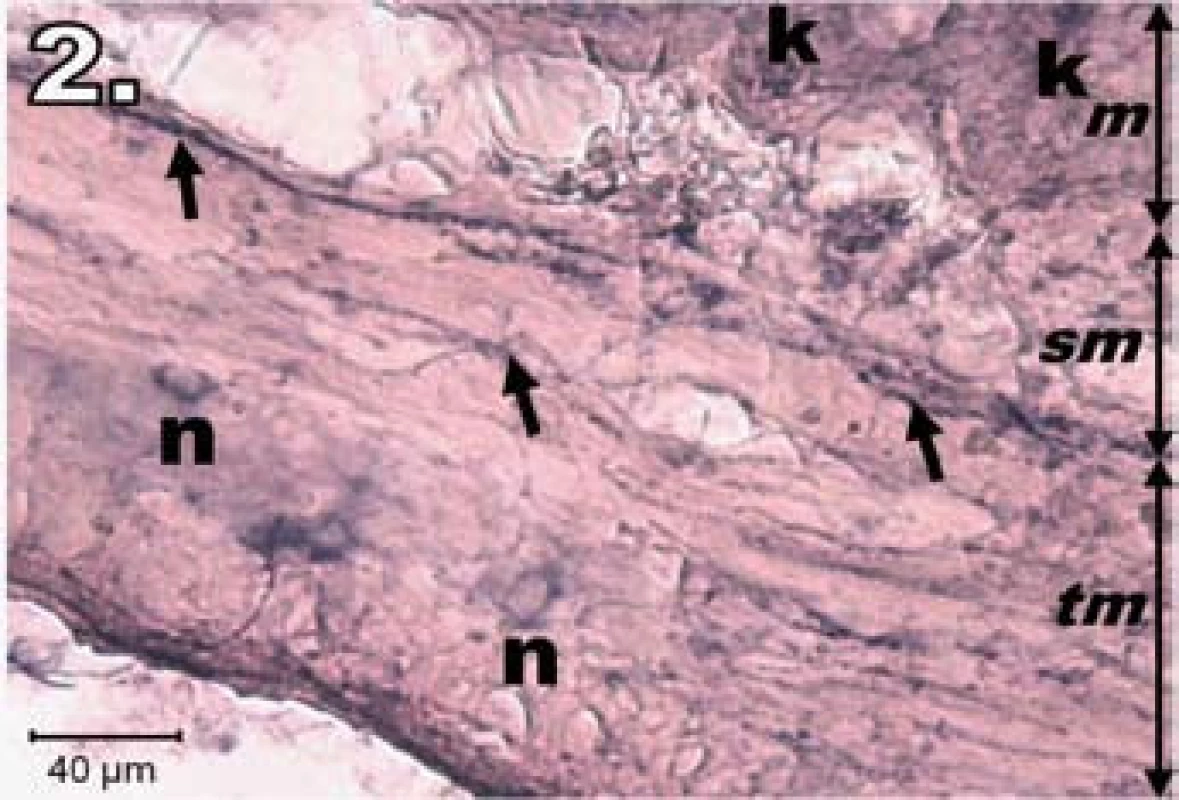
V skupine R24 (hodinová ischémia a 24-hodinová reperfúzia) sme na vzorkách jejuna zaznamenali vzostup NADPH-d pozitivity v plexus myentericus, tunica submucosa, v stróme aj na povrchu klkov. V neurónoch plexus myentericus bola NADPH-d pozitivita oproti R1 intenzívnejšia, avšak nedosiahla úroveň kontrolnej skupiny. Neuróny nadobudli pravidelnejší tvar a ostrejšie kontúry, aj keď ich usporiadanie nebolo celkom pravidelné. Na dne Lieberkühnových krýpt neboli prítomné známky NADPH-d pozitivity (obr. 3).
Image 3. Histologický obraz jejuna v skupine R24. n – regenerujúce sa NADPH-d pozitívne neuróny, šípky – nervové vlákna, k – negatívne Lieberkühnove krypty, m – mukóza, sm – submukóza, tm – tunica muscularis; scale bar = 40 μm Fig. 3. Histological picture of jejunum in group R24. n – regeneration in NADPH-d positive neurons, arrows – nerve fibres, k – negativity in Lieberkühn's crypts, m – mucosa, sm – submucosal layer, tm – tunica muscularis; scale bar = 40 μm 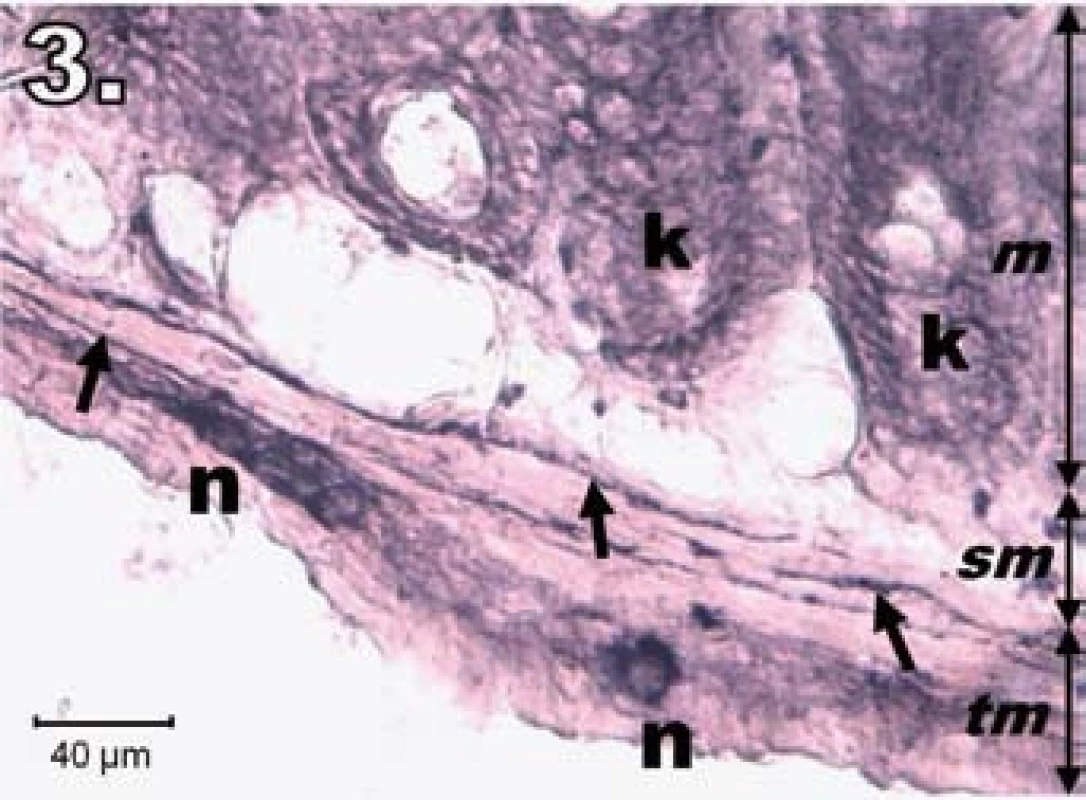
V skupine R30 (hodinová ischémia a 30-dňová reperfúzia) sa 30. dňa po zákroku dožilo 10 zo 14 experimentálnych zvierat. U preživších zvierat bola sliznica jejuna pravidelne usporiadaná a vyzerala ako pred zákrokom. Neuróny v plexus myentericus boli výrazne NADPH-d pozitívne, ostro kontúrované a pravidelne usporiadané. Na dne a po obvode Lieberkühnovych krýpt boli prítomné známky NADPH-d pozitivity. Histologický obraz bol podobný ako v kontrolnej skupine (obr. 4).
Image 4. Histologický obraz jejuna v skupine R30. n – NADPH-d pozitívne neuróny opäť silne pozitívne, šípky – nervové vlákna silne pozitívne, k – Lieberkühnove krypty pozitívne, m – mukóza, sm – submukóza, tm – tunica muscularis; scale bar = 40 μm Fig. 4. Histological picture of jejunum in group R30. n – neurons fully NADPH-d positive, arrows – positive nerve fibres, k – positivity in Lieberkühn's crypts, m – mucosa, sm – submucosal layer, tm – tunica muscularis; scale bar = 40 μm 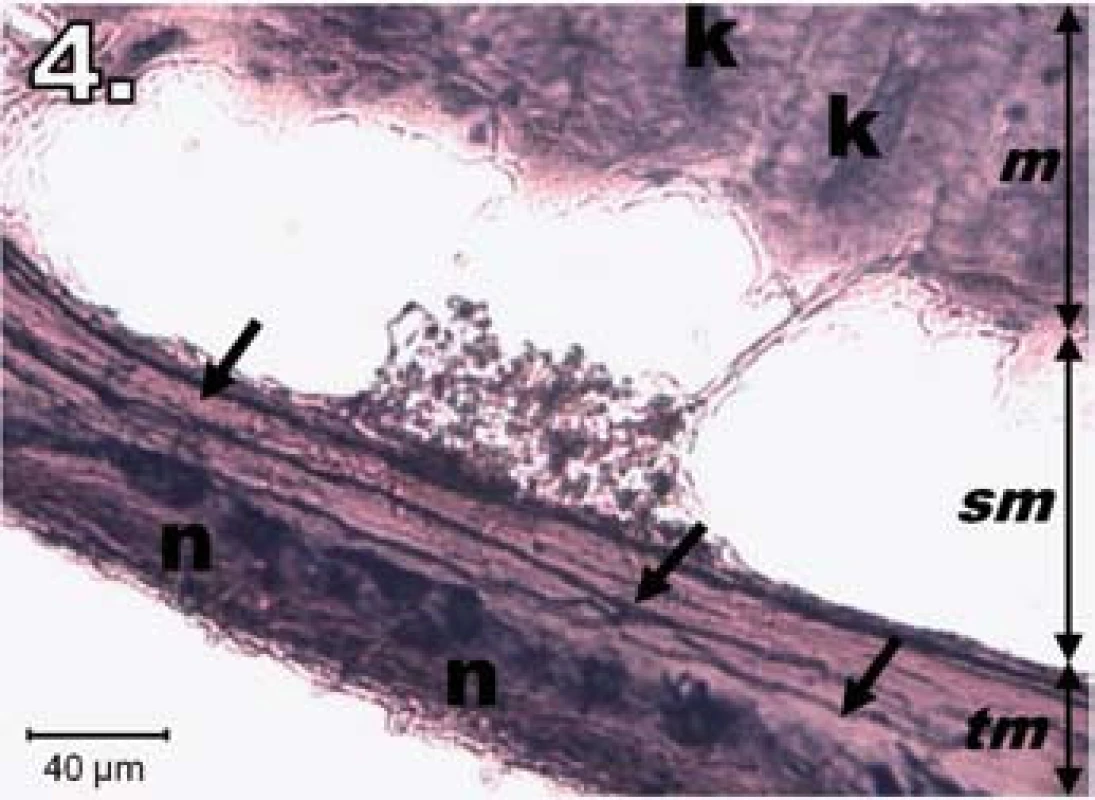
U všetkých experimentálnych zvierat bolo jejunum po hodinovej ischémii výrazne edematózne a cyanotické (obr. 5). V skupinách R1 sme po ischémii a hodinovej reperfúzii zaznamenali na jejune známky edému s viditeľnými hemorágiami, pričom obsah čreva bol vodnatý, serózny až hemoragický, s prítomnosťou tkanivového dentritu. V skupinách R24 a R30 bola po uplynutí reperfúzie stena čreva bez známok edému a hemorágií, črevný obsah bol bez patologického nálezu hlienovitej konzistencie a prímesi krvi.
Image 5. Makroskopický obraz jejuna pred a po ischémii. Vľavo – jejunum pred ischémiou, vpravo – obraz jejuna po uplynutí hodinovej ischémie, šípky – črevné kľučky s hemorágiou, cyanózou a edémom. Fig. 5. Macroscopic view of jejunum before and after ischemia. Left – jejunum before ischemia, right – jejunum after ischemia, arrows – intestine with haemorrhage, cyanosis and oedema. 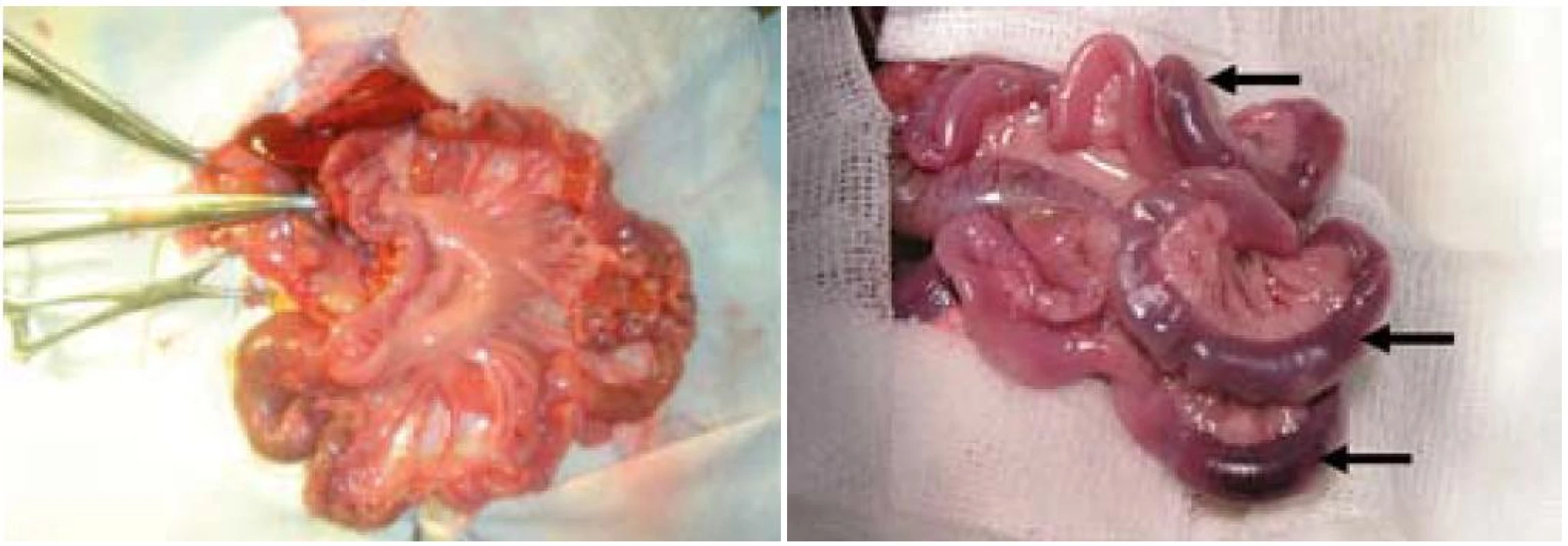
Štyri experimentálne zvieratá skupiny R30 exitovali v priebehu prvých 10 dní, pitva odhalila patologické zmeny na pľúcach a v brušnej dutine. Na pľúcach sme zaznamenali edém, hemorágie a fibrínové nálepy k stene pleurálnej dutiny, patologické zmeny v brušnej dutine sa týkali zrastov črevných slučiek s fibrínovymi nálepmi a na zväčšenej pečeni boli viditeľné hemorágie.
Diskusia
NO má dôležitú úlohu vo fyziologických procesoch v tenkom čreve, reguluje jeho krvné zásobenie a kontrakciu hladkej svaloviny. V našej práci sme sa zamerali na zmeny v nitrergickej inervácii jejuna potkana po predchádzajúcom IRP.
NADPH-d pozitívne neuróny v tenkom čreve patria medzi inhibičné motoneuróny a interneuróny, ktoré sa nachádzajú najmä v gangliách plexus myentericus obklopené ďalšími neurónmi [10]. Usporiadanie neurónov do ganglií je typické pre neuróny čreva. Gangliá plexus myentericus u potkana sú podlhovastého tvaru v smere cirkulárnej vrstvy tunica muscularis. Podobná distribúcia neurónov bola popísaná aj v tenkom čreve iných cicavcov [11]. Pozitívne gangliové bunky a nervové vlákna sa nachádzajú aj v plexus submucosus, avšak v menšej miere ako v plexus myentericus. NADPH-d pozitívne nervové štruktúry v submukóze ležia okolo pozitívne sfarbených krvných ciev, regulujú prietok krvi a sekréciu žliaz. V sliznici ležia nervové vlákna pri báze klkov a Lieberkühnových krýpt. Tieto výsledky sa zhodujú aj so zisteniami Altdorfera et al [12].
Zvierací model, pri ktorom sme navodili IRP oklúziou a reperfúziou a. mesenterica cranialis, je vhodný na objasnenie mechanizmov, ktoré vedú k multiorgánovému zlyhaniu [13]. Ischemické poškodenie môže byť spôsobené okluzívnou alebo neokluzívnou obštrukciou arteriálneho alebo venózneho cievneho zásobenia v dôsledku prerušenia krvného prietoku [14]. Jeho obnovenie paradoxne spôsobuje ďalšie poškodenie, nazývané reperfúzne poškodenie. IRP postihuje v porovnaní s inými vnútornými orgánmi najviac tenké črevo, jeho sliznicu a neuróny [15]. Epitel sliznice tenkého čreva regeneruje rýchlo, za 2–3 dni. Nitrergické neuróny v skupine R1 boli značne postihnuté, ale už v skupine R24 javili známky regenerácie, čo potvrdili aj Osborne et al [16]. V našom experimente sme dokázali, že pri udržaní kompenzačných mechanizmov sa nitrergické neuróny v plexus myentericus úplne zregenerujú do jednoho mesiaca po poškodení. Pri IRP sa zvyšuje permeabilita črevnej sliznice, endotoxíny, baktérie a zápalové mediátory sú transportované portálnou krvou a lymfatickými cievami ku vzdialeným životne dôležitým orgánom, môžu spôsobiť ich ireverzibilné poškodenie a syndróm multiorgánovej dysfunkcie [17].
Pľúca sú orgánom najzávažnejšie poškodeným po IRP, ich nízka regeneračná kapacita sa prejavuje aj v skupine R30, kedy vykazujú vysoký stupeň histologického poškodenia. Počet apoptotických buniek v interstíciu pľúc bol 10-násobne vyšší ako v pľúcnom parenchýme kontrolných zvierat. Veľmi často sa po 30. dni po reperfúzii pridruží sekundárna respiračná infekcia a zmení celkový zdravotný stav zvierat [18]. Z ďalších vzdialených orgánov na IRP reagujú pečeň, obličky a srdce. Najväčšie histopatologické zmeny na obličkách sa prejavia v 4. dni po ischémii akútnou tubulárnou nekrózou, ktorá môže vyústiť až do zlyhania obličiek. IRP však nemá žiaden vplyv na morfologický obraz hrubého čreva, čo môže vyplývať z jeho vysokej imunologickej schopnosti [19].
Nitrergické neuróny a ich vlákna bohato zastúpené v tenkom čreve potkana majú dôležitú úlohu v procese regenerácie po IRP. Jejunum je po 30-dňovej regenerácii plne funkčné, aj keď zostáva signifikantným zvýšený počet Panethových buniek a znížený počet serotonín-produkujúcich buniek v lamina propria [20]. Predpokladáme, že NO má v čreve dôležitú úlohu nielen ako neurotransmiter pri relaxácii hladkej svaloviny a vazodilácii, ale je zapojený aj do komunikácie medzi neurónmi oboch enterických nervových spletí a vplýva na viaceré dôležité procesy tráviaceho systému.
Práca bola podporená grantmi APVV-0252-07 a VEGA 1/0154/11.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 10. 11. 2012
Přijato: 28. 4. 2013
doc. MUDr. Adriana Boleková, PhD.
Ústav anatómie LF UPJŠ v Košiciach
Šrobárova 2, 041 80 Košice
adriana.bolekova@upjs.sk
Sources
1. Furness JB. The enteric nervous system. Oxford, UK: Blackwell Publishing 2006.
2. Bone RC, Balk RA, Cerra FB et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest 1992; 101(6): 1644–1655.
3. Swank GM, Deitch EA. Role of the gut in multiple organ failure: bacterial translocation and permeability changes. World J Surg 1996; 20(4): 411–417.
4. Záhorec R, Veselovský T. Syndróm multiorgánovej dysfunkcie – 1. časť: definícia, patofyziológia a klinické príznaky. Interná Med 2008; 8(10): 529–534.
5. Hope BT, Michael GJ, Knigge KM et al. Neuronal NADPH diaphorase is a nitric oxide synthase. Proc Natl Sci USA 1991; 88(7): 2811–2814.
6. Kimáková T, Krištúfek P, Bernadič M. Problematika voľných radikálov, oxidačného stresu a antioxidantov vo vzťahu k neinfekčným ochoreniam, 1. časť. Monitor medicíny SLS 2011; 3–4 : 13–16.
7. Lovásová K, Miklošová M. The enzymatic activity of NADPH-diaphorase in the sciatic nerve of the healthy rat. Folia Veterinaria 2000; 44(1): 35–38.
8. Qu ZD, Thacker M, Castelucci P et al. Immunohistochemical analysis of neuron types in the mouse small intestine. Cell Tissue Res 2008; 334(2): 147–161.
9. Scherer-Singler U, Vincent SR, Kimura H et al. Demonstration of a unique population of neurons with NADPH-diaphorase histochemistry. J Neurosci Methods 1983; 9(3): 229–234.
10. Rivera LR, Thacker M, Castelucci P et al. The reactions of specific neuron types to intestinal ischemia in the guinea pig enteric nervous system. Acta Neuropathol 2009; 118(2): 261–270.
11. Bódi N, Battonyai I, Talapka P et al. Spatial pattern analysis of nitrergic neurons in the myenteric plexus of the duodenum of different mammalian species. Acta Biol Hung 2009; 60(4): 347–358.
12. Altdorfer K, Fehér E, Fehér J. Distribution and localization of nitric oxide containing neural elements in the digestive tract. Orv Hetil 1996; 137(16): 857–860.
13. Cerqueira NF, Hussni CA, Yoshida WB. Pathophysiology of mesenteric ischemia//reperfusion: a review. Acta Cir Bras 2005; 20(4): 336–343.
14. Radwan K, Bátovský M. Akútna mezenteriálna ischemia. Gastroent Hepatol 2011; 65(1): 9–14.
15. Pontell L, Sharma P, Rivera LR et al. Damaging effects of ischemia/reperfusion on intestinal muscle. Cell Tissue Res 2011; 343(2): 411–419.
16. Osborne DL, Aw TY, Cepinskas G et al. Development of ischemia/reperfusion tolerance in the rat small intestine. J Clin Invest 1994; 94(5): 1910–1918.
17. Vollmar B, Menger MD. Intestinal ischemia/reperfusion: microcirculatory pathology and functional consequences. Langenbecks Arch Surg 2011; 396(1): 13–29.
18. Varga J, Staško P, Tóth Š et al. Morphological and apoptotic changes in the intestinal mucosa and lung parenchyma after ischemic/reperfusion injury of the jejunum. Acta Vet Hung 2010; 58(2): 243–256.
19. Varga J, Tóth Š, Staško P et al. Intestinal ischemia-reperfusion injury – the histopathological status of remote vital organs in acute and subacute phases. Ann Transplant 2012; 17(1): 11–20.
20. Tóth Š, Jonecová Z, Varga J et al. Mesenteric ischemia-reperfusion injury: specific impact on different cell populations within the jejunal wall in rats. Acta Histochem 2012; 114(3): 276–284.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2013 Issue 3-
All articles in this issue
- Novinky v digestivní endoskopii
- Praktická realizace kontroly kvality kolonoskopie – zkušenosti z Beskydského Gastrocentra
- Multiband mukozektómia včasného spinocelulárneho karcinómu pažeráka
- Oddelenie digestívnej endoskopie Univerzitnej polikliniky Agostina Gemelliho v Ríme: niekoľko postrehov zo študijného pobytu
- Nitrergická inervácia tenkého čreva potkana po ischemicko-reperfúznom poškodení
- Inkontinence stolice
- Současnost a budoucnost v léčbě ulcerózní kolitidy
- Ohlédnutí za Kazuistikami 2013
- Zpráva o endoskopickém workshopu Iscare 2013
- 8th ECCO Congress in Vienna
- ESGE + ESDO workshop, Lisabon 2013: hold Mařatkovi, kvalita endoskopie a revoluční přístup k neoplaziím jícnu a žaludku
- XVII. Hradec gastroenterology and hepatology days and 7th international endoscopic workshop
- Asacol™ 800 mg tablety
- Zdravotní rizika endoskopie pro endoskopisty v České republice – pilotní studie
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Inkontinence stolice
- Asacol™ 800 mg tablety
- Současnost a budoucnost v léčbě ulcerózní kolitidy
- Zdravotní rizika endoskopie pro endoskopisty v České republice – pilotní studie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

