-
Medical journals
- Career
Somatostatin a jeho využití
: J. Špičák
: Klinika hepatogastroenterologie, IKEM, Praha
: Gastroent Hepatol 2012; 66(6): 458-464
: Clinical and Experimental Gastroenterology: Review Article
Somatostatin byl objeven před více než 40 lety. Jedná se o peptid s různým převážně inhibičním působením. Dvě základní molekuly somatostatinu se od sebe liší zejména distribucí a délkou působení. Somatostatin působí hormonálně, parakrinně, apokrinně i jako neurotransmiter. Největší koncentrace buněk produkujících somatostatin je v oblasti žaludku, duodena a pankreatu. Somatostatin snižuje veškerou, zejména pankreatickou a žaludeční zevní i vnitřní sekreci, modifikuje imunitu a zasahuje do diferenciace i funkcí centrálního nervového systému (CNS). V klinické praxi je indikován spolu s jeho déle působícími analogy u krvácení z jícnových varixů. Snižuje prokrvení splanchniku přímým působením na buňky hladké svaloviny. Snížením pankreatické sekrece jej lze využít v hojení píštělí a jejich prevenci po operaci pankreatu. Somatostatin snižuje riziko pankreatitidy po ERCP. Působí symptomaticky i inhibičně u neuroendokrinních tumorů. Zde se uplatňuje v podobě OctreoScanu i v diagnostice. Somatostatin se dále využívá u akromegalie, meningiomu, polycystózy jater a ledvin, angiodysplasie, Cushingova syndromu a ascitu nejasného původu.
Klíčová slova:
somatostatin – portální hypertenze – prevence pankreatitidy po ERCP – inhibice pankreatické sekrece – prevence pankreatického leaku – abdominální píštěleBiologie somatostatinu
Biologie somatostatinu není plně objasněna ani téměř 40 let po jeho objevení. Jedná se o peptid s různým většinou inhibičním působením v závislosti na lokaci. Působí hormonálně, parakrinně, autokrinně i jako neurotransmiter. Jeho distribuční prostor zahrnuje zejména trávicí trakt a nervový systém. Vyskytuje se na široké škále živočichů včetně bezobratlých. Somatostatin byl izolován z hypothalamu v roce 1972, v roce 1973 byl syntetizován a o rok později byl objeven v Langerhansových ostrůvcích pankreatu. Primárně objevený somatostatin-14 je součástí rodiny peptidů podobné struktury zahrnující také somatostatin-28, několik druhově specifických variant a několik specifických prohormonů (obr. 1). Somatostatin-28 byl identifikován v roce 1980. Obsahuje sekvenci somatostatinu 14 a extenduje na N-terminalu dalšími 14 aminokyselinami (obr. 1). Obě formy somatostatinu vykazují specifickou tkáňovou distribuci i působení. Somatostatin-14 dominuje v duodenu a pankreatu, zatímco somatostatin-28 se nachází v D-buňkách žaludku a tenkého střeva. Inhibuje sekreci pankreatu, ale nemá vliv na sekreci žaludku. Somatostatin-14 dominuje v hypofyzeální portální krvi, zatímco somatostatin-28 v periferii a cerebrospinálním moku. Somatostatinový gen se nachází na dlouhém raménku chromozomu 3. Poločas somatostatinu-14 je přibližně dvě minuty, zatímco u somatostatinu-28 přesahuje šest minut. Jeho koncentrace oscilují v cirkadiálním rytmu s vrcholem v prvních hodinách nočního spánku. Působení somatostatinu zahrnuje snížení veškeré endokrinní a exokrinní sekrece, modulaci jiných neuropeptidů a neurotransmiterů, motility, tonu hladké svaloviny a střevní absorpci. Na buněčné úrovni se jedná o neutrotransmisi, sekreci, kontraktilitu a proliferaci. Vliv na kontraktilitu se uskutečňuje přes působení acetylcholinu. Ostatní účinky se uskutečňují pomocí glykoproteinových membránových receptorů (Somatostatin Transmembrane Receptor – SSTR), který se vyskytuje v širokém distribučním prostoru v pěti modifikacích (obr. 2).
1. Struktura molekul obou forem somatostatinu. Fig. 1. Molecular structure of both forms of somatostatin. 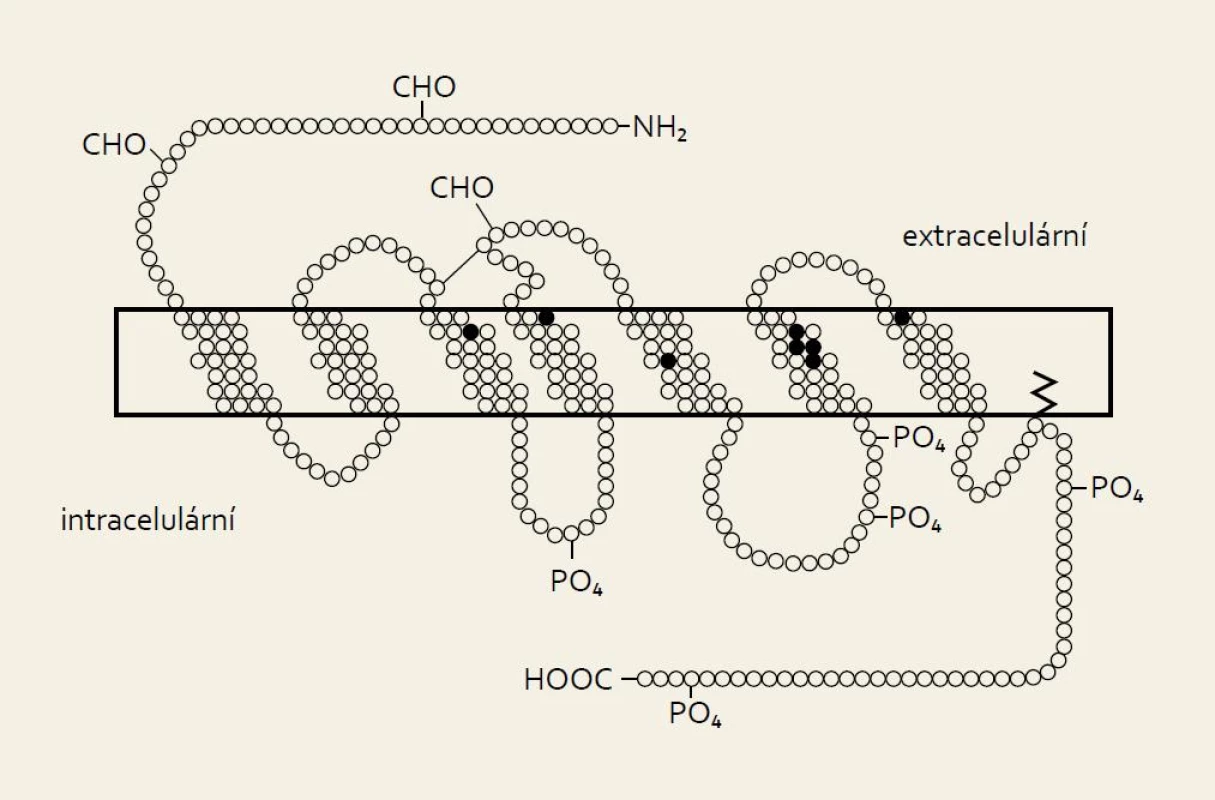
2. Somatostatinový receptor. Fig. 2. Somatostatin receptor. 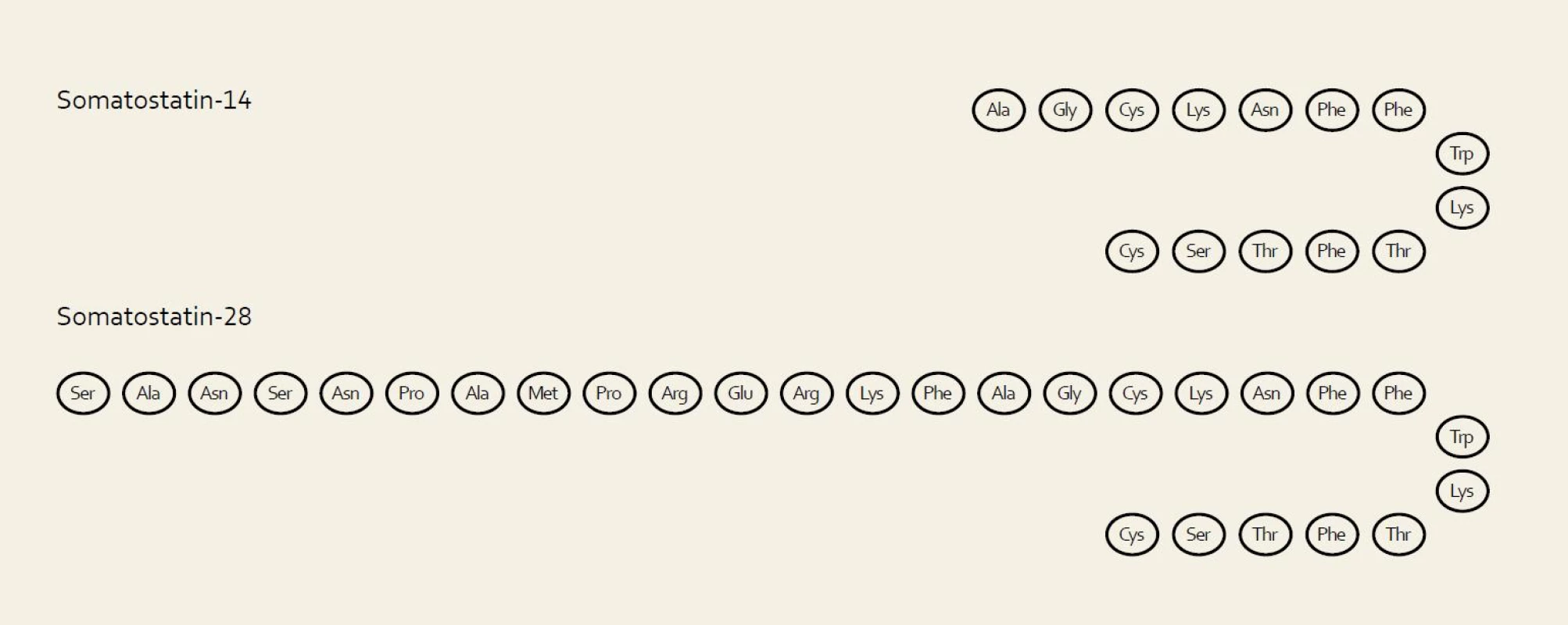
Buňky secernující somatostatin se vyskytují v celém trávicím traktu s největší koncentrací D-buněk v antru, duodenu a pankreatu. Uvolnění somatostatinu je regulováno kombinací nutričních, humorálních, nervových a parakrinních signálů. V žaludku působí somatostatin snížení bazální i stimulované sekrece spolu se snížením sekrece pepsinu endokrinním i parakrinním způsobem na G - a parietální buňky. U vředové nemoci je poměr G - a D-buněk zvýšen. Význam fyziologických koncentrací je méně jasný, soudí se na zpětnovazebné působení v rámci regulace žaludeční sekrece.
Somatostatin je mocným inhibitorem pankreatické sekrece. Jeho působení na SSTR receptory acinárních buněk je přímé i nepřímé inhibicí sekretinu (inhibice bazální sekrece) a cholecystokininu (inhibice postprandiální sekrece). Somatostatin také inhibuje vagem stimulovanou sekreci prostřednictvím inhibice Vasoactive Intestinal Peptide (VIP). Snižuje také sekreci inhibičně pankreatického polypeptidu, ale tento hypoteticky stimulační efekt se neuplatňuje. Somatostatin také přímou cestu inhibuje sekreci inzulinu a glucagonu. Somatostatin snižuje průtok splanchnickou oblastí a tlak v portálním řečišti patrně přímým působením na hladkou svalovinu cév (tab. 1).
1. Farmakodynamické působení somatostatinu v trávicím systému. Tab. 1. Pharmacodynamic effect of somatostatin in the digestive tract. 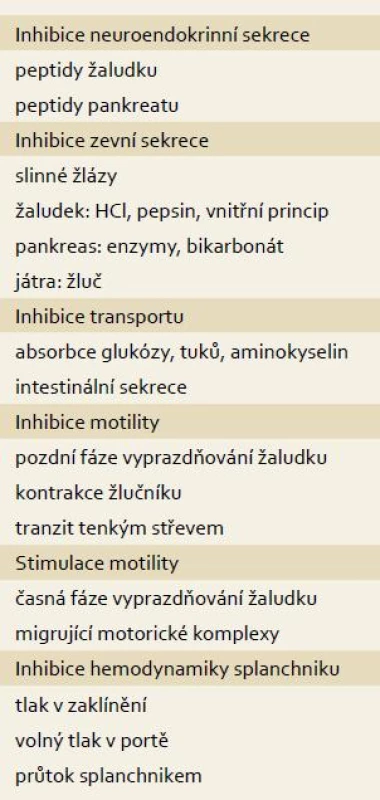
Somatostatin se vedle funkce neurotransmiteru projevuje regulací proliferace neuroblastů a vlivem na zrání mozku. Podílí se na kontrole teploty, pocitu hladu a sytosti, vnímání bolesti, spánku, učení a paměti. U Alzheimerovy nemoci není v kortexu přítomen a tato ztráta koreluje s kognitivní funkcí. Působí inhibičně na sekreci hypofýzy, alteruje s funkcí dalších neurotransmiterů jako dopamin, serotonin a noradrenalin.
Interakce mezi nervovým a hemopoetickým systémem zahrnují i somatostatin. Monocyty a lymfocyty exprimují SSTR analogicky s jejich mitogenní aktivací. Přibližně 50 % lymfocytů Peyerských plátů a 30 % lymfocytů sleziny exprimují SSTR. Somatostatin zasahuje do imunitního systému alterací s produkcí imunoglobulinů, proliferací lymfocytů, produkcí cytokinů a uvolňováním mediátorů. Jeho vliv na sekreci IgA je bifázický (stimulace v nízké koncentraci, inhibice ve vysoké). Lymfatická tkáň lymfomů a granulomatózních chorob exprimuje SSTR, což mizí po úspěšné léčbě kortikoidy.
U ledvin snižuje somatostatin krevní průtok a glomerulární filtraci. Snižuje produkci moči, exkreci natria a kalia, reabsorbci fosfátů a zvyšuje osmolalitu moči. Nemá vliv na ateriální natriuretický faktor, vasopresin a katecholaminy, ale výrazně snižuje hladinu reninu potlačením stimulace systému renin-angiotensinu. Tento efekt je patrný i u diabetu a jaterní cirhózy.
Somatostatin ovlivňuje také respirační systém prostřednictvím neurotransmiterů a dále zasahuje do produkce hormonů v těhotenství a při laktaci [1,2].
Somatostatin a portální hypertenze
Krvácení z jícnových varixů zůstává nejčastější vážnou komplikací portální hypertenze při jaterní cirhóze, byť jeho mortalita během třiceti let poklesla ze 40 na 15–20 %. V léčbě akutního krvácení z jícnových varixů se uplatňují dvě skupiny léků: vasopresin a somatostatin s jejich analogy. Vasopresin, endogenní nanopetid, je velmi potentní splanchnický vasokonstriktor, který redukuje prokrvení splanchnických orgánů, a tím i portální tlak působením na receptory V 1 hladké arteriální svaloviny. Jeho podávání je však zatíženo reálným rizikem zejména kardiální, akrální a splanchnické ischemie. Tyto vedlejší účinky lze částečně ovlivnit podáváním nitrátů, což ovšem může vést k dalším komplikacím. Terlipressin (triglycyl-lysin-vasopressin) je analog vyznačující se delší biologickou aktivitou a poněkud nižším rizikem ischemických vedlejších účinků. Somatostatin a jeho analogy octreotide a vapreotide způsobují splanchnickou vazokonstrikci inhibicí uvolnění vazodilatačních enzymů například glukagonu i přímým působením na arteriální svalovinu a jejich podávání je relativně bezpečné. Působení jednotlivých analogů obou základních molekul i kromě různého biologického poločasu není zcela identické. Somatostatin i octreotide způsobují pokles portálního tlaku po jednorázovém podání, avšak zatímco kontinuální podávání somatostatinu snížený tlak udržuje, o octreotidu to neplatí. Somatostatin blokuje vzestup hepato-porto venózního gradientu po endoskopické léčbě jícnových varixů, zatímco octreotide nikoli [3]. Dalším významným účinkem je snížení postprandiální hyperemie. Somatostatin se podává v intravenózní bolusové dávce 250 µg následovanou kontinuální infuzí v dávce 250 µg/hod po pět dnů. Dvojnásobná dávka se ukázala být účinnější ve studii, kde byla endoskopická léčba neúspěšná [4]. Vážnější komplikace při podání somatostatinu nebyly zaznamenány, z obvyklých a málo závažných vedlejších účinků se popisují nauzea, zvracení a hyperglykemie objevující se až u 30 % léčených [5]. Léčba krvácení z jícnových varixů byla cílem mnoha kontrolovaných studií a následných metaanalýz (tab. 2). Jejich poněkud inkonzistentní výsledky byly ovlivněny některými metodickými problémy, jakými byly příliš dlouhý interval sledování, kdy mortalita mohla být ovlivněna tíží cirhózy a komorbiditami, a srovnání s intervenční léčbou v kontrolních skupinách. Jedna z novějších studií zahrnující 98 nemocných srovnává v prospektivní randomizované studii podávání terlipressinu a somatostatinu. Kumulativní šestitýdenní mortalita u obou skupin činila 16,3 % a 15,8 %, selhání léčby během prvních pěti dnů 12,0 % a 20,8 %. Rizikovými faktory byla přítomnost hepatocelulárního karcinomu a renální insuficience [6]. Předchozí studie jsou již letité, a proto zatíženy několika zkreslujícímji faktory, jakými jsou zejména nestejná obvykle krátká doba podávání a vysoká mortalita způsobená dobovou kvalitou intenzivní péče (tab. 1). Významná je meatanalýza Cochrane Database z roku 2010 zahrnující 17 studií (pět se somatostatinem) a srovnávající působení vazoaktivních látek ve srovnání s urgentní sklerotizací. Účinnost léčby ve smyslu kontroly krvácení, zabránění opakovaného krvácení a mortality nebyla rozdílná, sklerotizace byla zatížena významně vyšším rizikem komplikací (p = 0,08) [7]. Podle poslední metaanalýzy z dosud publikovaných autoři primárně identifikovali 3 011 citací, z nichž 57 studií zahrnujících 3 111 nemocných splnilo daná kritéria, kterými byly srovnání všech vazoaktivních látek s placebem a mezi sebou navzájem. Jednotlivé léky byly hodnoceny následujícím způsobem: octreotid vs placebo 12 studií, somatostatin vs placebo 7, vasopresin vs placebo 3, teplipressin vs placebo 7, vapreotid vs placebo 1, kombinace somatostatinu a octreotidu vs placebo 1, terlipressin vs vasopresin 5, octreotid vs terlipressin 6, octreotide vs vasopresin 2 a vasopresin vs somatostatin 1 studie. Ve srovnání s placebem podání vazoaktivních látek provázelo snížení krátkodobé (do sedmého dne) mortality (RR 0,74) a snížení mortality v období mezi 8. a 42. dnem (RR 0,80), zvýšení zástavy krvácení (RR 1,21) a snížení rizika opakovaného krvácení (RR 0,68). Byla také snížena potřeba krevních transfuzí a zkrácena doba hospitalizace. Srovnání mezi jednotlivými látkami neupřednostnilo přesvědčivě žádnou z nich. Hemostáza byla vyšší u octreotidu i somatostatinu ve srovnání s vasopresinem‚ (RR 1,31 a 1,25) bez ovlivnění mortality [8]. Naději zde nenaplněnou slibuje kombinace různě účinných molekul, společné podávání somatostatinu s terlipressinem se nedoporučuje [9]. Výsledky kontrolovaných studií a metaanalýzy reflektují doporučené postupy, z nichž pro nás nejzávaznější jsou doporučené postupy České hepatologické společnosti, které doporučují terlipressin a somatostatin [10], Americké hepatologické společnosti (American Association for the Study of Liver – AASLD) doporučující somatostatin nebo jeho analogy, zdůrazňující, že mezi vazoaktivními látkami nebyly shledány rozdíly v účinnosti a nedoporučující vasopresin vzhledem k vedlejším účinkům [11]. Mimořádně respektovaný, precizní a konzistentní konsenzus sympozia konaného pravidelně v Bavenu udává, že vazoaktivní látka (terlipressin, somatostatin, octreotid, valprotid) by měla být aplikována při krvácení co nejdříve ještě před endoskopickou léčbou a podávána po pět dnů [12].
2. Randomizované studie srovnávající somatostatin s vasopresinem. Tab. 2. Randomised studies comparing somatostatin with vasopressin. 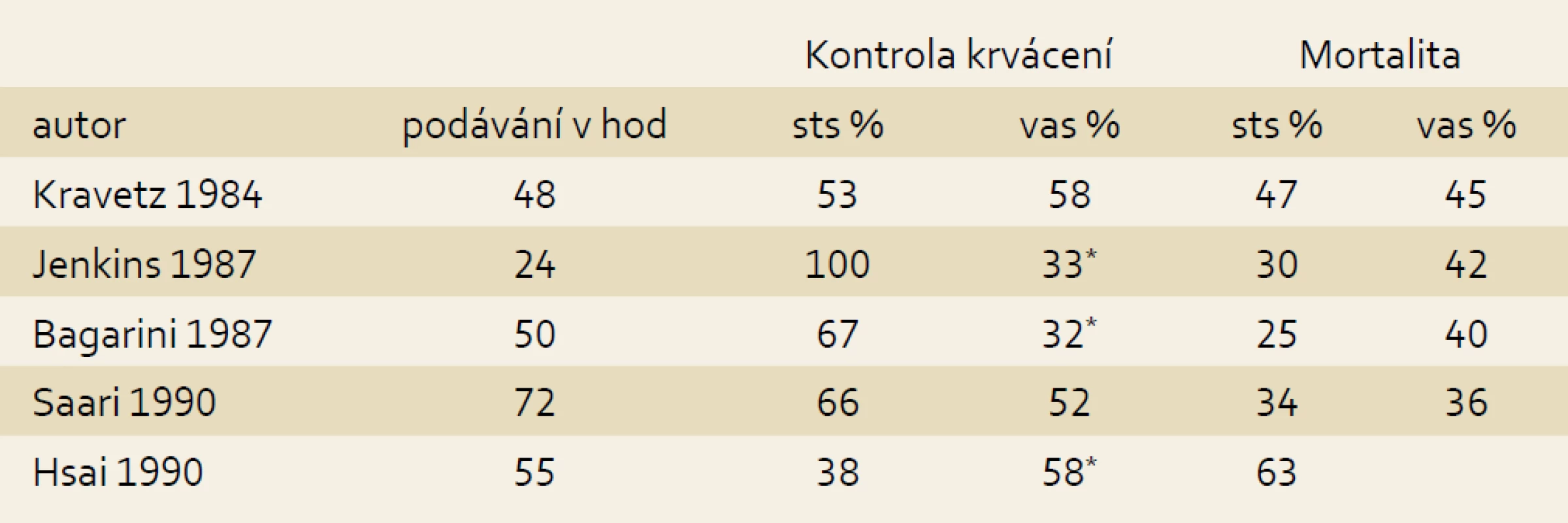
sts – somatostatin, vas – vasopressin, *statisticky významný rozdíl Somatostatin a akutní pankreatitida po ERCP
Akutní pankreatitida zůstává obávanou komplikací po ERCP (endoskopická retrográdní cholangiopankreatografie) pankreatitidy s frekvencí výskytu kolem 5 %. Multifaktoriální etiologie zahrnuje rizikové faktory vztažené k indikaci a nemocnému (mladší věk, ženské pohlaví, dysfunkce Oddiho svěrače a pankreatitida po ERCP) a k technice výkonu (precut, opakovaná injektáž pankreatiku, balonková dilatace). V prevenci byla vyzkoušena řada molekul a technických opatření (kanylace pomocí vodicího drátu). Testy na zvířatech byly vesměs slibné, o klinických studiích to většinou neplatí. Somatostatin a jeho analog octreotide vzhledem k svým inhibičně-sekrečním a relaxačním vlastnostem byly přirozeně testovány v mnoha studiích. V tomto roce publikované dvouslepé randomizované studii byl podáván diclofenac se somatostatinem vs placebo u 540 nemocných. Výskyt post-ERCP pankreatitidy byl v obou skupinách 4,7 % a 10,4 % a rozdíl byl statisticky významný ve prospěch aktivní skupiny; p = 0,015 [13]. Podle recentní metaanalýzy zahrnující 17 publikací a 3 818 pacientů se riziko pankreatitidy snižovalo v následujících souvislostech: somatostatin jako takový: RR 0,30, somatostatin ve vysokých dávkách: RR 0,27, somatostatin ITT (Intent To Treat): RR 0,42 a ocreotid ITT: RR 0,83 [14]. Přesto jejich podávání doporučené postupy evropských a amerických společností nedoporučují, protože efekt zejména v prevenci těžké pankreatitidy a mortality není přesvědčivý natolik, aby ospravedlnil navýšení ceny výkonů. Asijské doporučené postupy jsou obecně vzhledem k užívání inhibičních látek při pankreatitidě vstřícnější. Kontrolované studie zaměřené na těžké případy nejsou vzhledem k heterogenitě a malému počtu těchto případů reálné. Osobně doporučuji podávat somatostatin po papilosfinkterotomii v indikaci dysfunkce Oddiho svěrače (SOD).
Somatostatin v prevenci a léčbě chirurgických komplikací
Pankreatická fistula spojující oblast pankreatu s povrchem těla je obávanou komplikací operací na pankreatu, abdominálního traumatu a někdy i těžké akutní pankreatitidy. Vzhledem k přirozeně agresivnímu působení aktivovaných pankreatických enzymů bývají pankreatické fistuly mimořádně rezistentní na léčbu, jsou zatíženy nezanedbatelnou morbiditou a mortalitou a významně prodlužují hospitalizaci. Incidence pankreatických píštělí po pankreatoduodenektomii se pohybuje mezi 5 a 35 % a snížení sekrece může teoreticky významně přispět k úspěšné léčbě [15]. Jedna z recentních metaanalýz zahrnula 7 studií a 297 nemocných, z nichž se u 102 jednalo o výlučně pankreatickou fistulu. Metaanalýza prospěšnost podávání somatostatinu a jeho analogů neprokázala [16].
Somatostatin může snížením sekrece přispět k hojení enterokutánních fistul bez ohledu na původ. Komplexní léčba zahrnuje omezení orálního příjmu, kožní péči, chirurgii, antibiotika a léky typu somatostatinu snižující digestivní sekreci. Jednotlivé studie zaměřené na účinnost somatostatinu a jeho analogů vykazují inkonzistentní výsledky zejména z důvodu heterogenních a málo početných souborů. Podle nedávno publikované metaanalýzy zahrnující osm studií somatostatin a jeho analogy významně snížily dobu uzavření píštěle (o 6,37 dne), dobu hospitalizace (4,53 dne), aniž by byla ovlivněna mortalita (RR 0,87) [17].
Častý výskyt pankreatických fistul navozuje možnost preventivního podávání somatostatinu či jeho analogů před plánovanou operací pankreatu. Postupně byla publikována řada studií, které byly shrnuty v několika přehledech. Poslední kontrolovaná studie srovnávající preventivní podávání somatostatinu s placebem byla publikována v posledních týdnech. 67 nemocných bylo randomizováno do dvou skupin a kromě výskytu komplikací byla zkoumána mikroskopie se zaměřením na sekreční útlum. Ten byl v aktivní skupině prokázán a tomu odpovídal rozdíl v morbiditě: 17,14 vs 56,25 % ve prospěch léčby somatostatinem [18]. Velmi recentní je též Cochrane metaanalýza zahrnující 19 studií a 2 245 pacientů. Celkový počet komplikací a výskyt fistul byly významně nižší v aktivní skupině (RR 0,69 a RR 0,63) bez vlivu na mortalitu a dobu hospitalizace. Kvalita života nebyla analyzována. Autoři doporučují předoperační preventivní podávání somatostatinu a jeho analogů jako rutinní opatření [19].
Somatostatin a neuroendokrinní tumory
Gastroenteropankreatické neuroendokrinní tumory jsou poměrně vzácné nádory charakterizované heterogenní biologickou povahou a variabilním klinickým průběhem. Funkční tumory secernují v nadbytku hormony, zatímco nefunkční nádory vykazují v době diagnózy často metastázy. Prognostické faktory zahrnují histologické odstupňování, diferenciaci, stadium a lokalizaci. Diagnostika neuroendokrinních tumorů zůstává často svízelným a zdlouhavým procesem. Ke zvýšení příslušných hormonů dochází nepravidelně a nevypovídá o lokalizaci tumorů. Selhání obvyklých zobrazovacích metod je běžné. Arteriografie a selektivní měření hladin jsou zatíženy technickými problémy a interindividuální variabilitou. Tumory bez ohledu na jejich sekreční potenciál mohou být úspěšně lokalizovány SSTR scintigrafií. Detekční agens se sestává buď z octreotidu, či lanreotidu v konjugaci s chelátovým činidlem, který pevně váže radioizotop. K usnadnění vazby radioaktivního jodu byl octreotid modifikován výměnou fenylalaninu za tyrozin. Nejčastěji užívaným radiopeptidem je [¹¹¹In-DTPA-D-Phel] octreotide (OctreoScan, Novartis). Senzitivita přesahuje 80 % a převyšuje senzitivitu CT o 10–20 %. Specificita se pohybuje kolem 50 %, neboť zobrazí všechny tkáně s expresí SSTR bez ohledu na jejich biologickou povahu, například granulomy u tuberkulózy a sarkoidózy, meningiom, astrocytom, karcinom prsu, lymfomy aj. 68Ga-DOTAT octreotid a nověji octrotate se uplatňují podobným způsobem u emisní pozitronové tomografie, jejíž senzitivita i specificita jsou vyšší. Obě metody dávají definitivní diagnózu včetně určení stadia komplementárně s CT a magnetickou rezonancí [20,21]. Somatostatin značený indiem jako první radiopeptid využívaný v diagnostice stimuloval výzkum dalších radiopeptidů jako analogy cholecystokininu, gastrinu, bombesinu, glucagon-like peptidu a dalších [22].
V léčbě se vedle chirurgické léčby uplatňují na prvním místě somatostatin a jeho analogy, které vedou jak k potlačení symptomů, tak inhibici nádorového růstu [23].
Vícečetné endokrinní neoplazie 1 (Multiple Endocrine Neoplasia – MEN 1) zahrnují neuroendokrinní tumory vznikající v rámci vrozené autozomálně dominantní genetické poruchy (gen je lokalizován na dlouhém raménku chromozomu 17) v různých lokalitách zahrnujících oblast trávicí trubice. Gastrinomy a inzulinomy (50–60 % všech MEN 1 tumorů) vznikají nejčastěji v oblasti duodena a pankreatu. Primárně chirurgická léčba vyžaduje precizní lokalizaci a zhodnocení přítomnosti metastáz. Diagnostika zahrnuje obvyklé zobrazovací metody a sekreční stimulační testy. V případě neresektabilních tumorů somatostatin a jeho analogy zajišťují kontrolu symptomů v důsledku inhibice excesivní sekrece i růstu. Systémová chemoterapie dále zahrnuje streptozocin, dacarbazin, temozolamid, mTOR inhibitor everolimus a inhibitor tyrosinkinázy sunitinib [24].
Další využití somatostatinu
Díky svým unikátním vlastnostem se somatostatin a jeho analogy uplatňují v léčbě řady jiných onemocnění. Angiodysplazie jsou abnormálně dilatované venuly. Nejčastěji se vyskytují v oblasti pravého tračníku, ale obecně mohou být zdrojem krvácení z jakékoli lokalizace. Výjimečně se objevují před 50. rokem věku, naopak nad 70 let jsou jednou z nejčastějších příčin krvácení do trávicí trubice a jsou dále zdrojem až 23 % okultního krvácení diagnostikovaného kapslovou nebo balonkovou enteroskopií. Rizikovými faktory jsou jaterní cirhóza, renální insuficience a stenóza aorty. Léčba spočívá v ablaci zdroje radiofrekvenční, laserovou nebo argonovou koagulací. Recidivy stejně jako vícečetné zdroje krvácení jsou běžné a v léčbě jsme někdy odkázáni na opakované transfuze. V medikaci se zkoušely molekuly s předpokládanou antiangiogenní aktivitou jako estrogeny a thalidomid. Somatostatin a jeho analogy působí inhibicí vaskulárního růstového endoteliálního faktoru, snížením střevní perfuze, zvýšením vaskulární rezistence a zvýšenou agregabilitou trombocytů. Recentní multicentrická studie zahrnovala 15 nemocných a prokázala snížení potřeby transfuzí (2 vs 10) stejně jako recidiv krvácení (20 vs 73 %) proti období bez medikace [25]. Dalšími chorobami s potenciálním využitím jsou karcinom prostaty, akromegalie, Cushingův syndrom, endometrióza, meningiom, polycystóza jater a ledvin, průjmy po operaci nespecifických střevních zánětů (pouch) a idiopatický ascites (tab. 3) [26–34].
3. Potenciální využití somatostatinu a jeho analogů v léčbě gastrointestinálních i jiných chorob. Tab. 3. Potential use of somatostatin and its analogues in the treatment of gastrointestinal and other diseases. 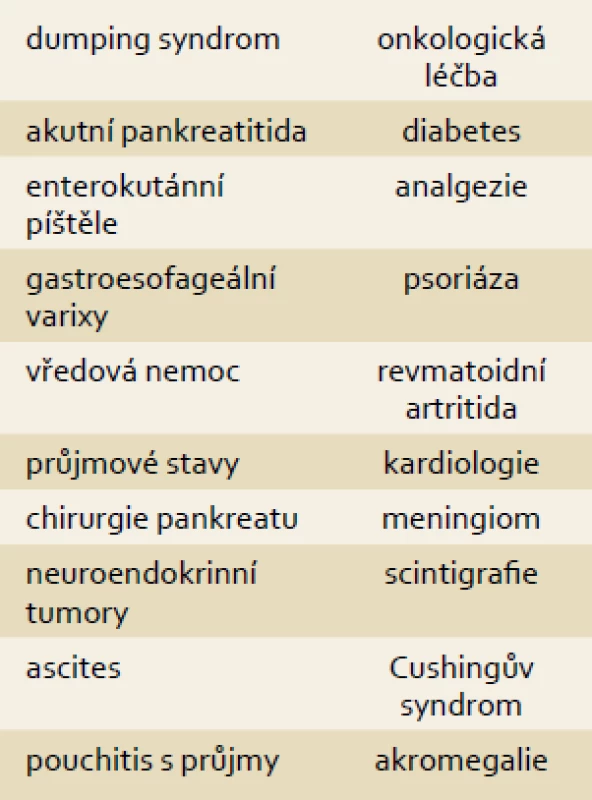
Závěr
Somatostatin je vzhledem k široké distribuci v organizmu a převažující fyziologické inhibiční povaze využitelný v řadě různých klinických situací. Jeho účinnost je podpořena řadou kvalitních klinických studií. Uplatňuje se v léčbě krvácení při portální hypertenzi. U vybraných nemocných snižuje riziko vzniku pankreatitidy po ERRCP. Inhibicí sekrece se podílí na léčbě abdominálních píštělí a přesvědčivě snižuje riziko komplikací po operacích pankreatu. Potlačuje symptomy u neuroendokrinních tumorů a inhibuje jejich růst. Dalšími možnostmi uplatnění jsou v gastroenterologii střevní angiodysplazie, polycystóza jater, průjmy po operaci pro nespecifické střevní záněty a idiopatický ascítes. Určitá inkonzistence výsledků v jednotlivých oblastech vyplývá z přirozeně nejednotné selekce nemocných, jak vyplývá z kontextu komplikovaných klinických situací.
Zkratky
SSTR – somatostatin transmembrane receptor
CNS – centrální nervový systém
ERCP – endoskopická retrográdní cholangiopankreatografie
SOD – dysfunkce Oddiho svěrače
VIP – vasoactive intestinal polypeptide
MEN – multiple endocrine neoplasia
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 22. 8. 2012
Přijato: 30. 8. 2012
prof. MUDr. Julius Špičák, CSc.
Klinika hepatogastroenterologie, IKEM
Vídeňská 195/9, 140 21 Praha 4
julius.spicak@ikem.cz
Sources
1. Holt RIG, McGregor AM. Somatostatin: from basic science to clinical application. Hong Kong: Excerpta Medica 1997 : 3–146.
2. Low MJ. Somatostatin. In Henry HL, Norman AW. Encyclopedia of hormones. San Diego: Elsevier Science 2003 : 379–388.
3. Vlachogiannakos J, Kougioumtzian A, Triantos C et al. Clinical trial: The effect of somatostatin vs octreotide in preventing post-endoscopic increase in hepatic venous pressure gradient in cirrhotics with bleeding varices. Aliment Pharmacol Ther 2007; 26(11–12): 1479–1487.
4. Palazón JM, Such J, Sánchez-Payá J et al. A comparison two different dosages of a somatostatin combined with sclerotherapy for the treatment of acute esophageal variceal bleeding: a prospective randomized trial. Rev Esp Enferm Dig 2006; 98(4): 249–254.
5. Moitinho E, Planas R, Banares R et al. Multicenter randomized trial comparing different schedule of somatostatin in the treatment of acute variceal bleeding. J Hepatol 2001; 35(6): 712–718.
6. Seo YS, Um SH, Hyun JJ et al. A prospective study comparing the efficacy of early administration of terlipressin and somatostatin for the control of acute variceal bleeding in patiens with cirrhosis. Korean J Hepatol 2006; 12(3): 373–384.
7. D´Amico G, Pagliaro L, Pietrosi G et al. Emergency sclerotherapy versus vasoactive drug for bleeding oesophageal varices in cirrhotic patiens. Cochrane Database Syst Rev 2010; (3): CD002233.
8. Wells M, Chande N, Adams P et al. Meta-analysis: vasoactive medications for the management of acute variceal bleeds. Aliment Pharmacol Ther 2012; 35(11): 1267–1278.
9. Kalambokis G, Economou M, Paraskevi K et al. Effects of somatostatin, terlipressin and somatostatin plus terlipressin on portal and systemic hemodynamics and renal sodium excretion in patiens with cirrhosis. J Gastroenterol Hepatol 2005; 20(7): 1075–1081.
10. Pracovní skupina pro portální hypertenzi. Doporučený postup ČHS pro diagnostiku a léčbu krvácení do zažívacího traktu při portální hypertenzi. www.ces-hep.cz
11. García-Tsao G, Lim J. Management and treatment of patients with cirrhosis and portal hypertension: Recommendations from the department of veterans affairs hepatitis-C resource center program and the national hepatitis C program. Am J Gastroenterol 2009; 104(7): 1802–1829.
12. de Franchis R. Revising consensus in portal hypertension: Report of the Baveno V consensus workshop on metodology of diagnosis and therapy in portal hypertension. J Hepatol 2010; 53(4): 762–768.
13. Katsinelos P, Fasoulas K, Paroutoglou G et al. Combination of diclofenac plus somatostatin in the prevention of post-ERCP pancreatits: a randomized, double blind, placebo-controlled trial. Endoscopy 2012; 44(1): 53–59.
14. Omata F, Deshpande G, Tokuda Y et al. Meta-analysis: Somatostatin or its long--lasting analogue, octreotide, for prophylaxis against post-ERCP pancreatitis. J Gastroenterol 2012; 45(8): 885–895.
15. Ramos-De la Medina A, Sarr MG. Somatostatin analogues in prevention of pancreas-related complications after pancreatic resection. J Hepatobiliary Pancreas Surg 2006; 13(3): 190–193.
16. Gans SL, van Westreenen HL, Kiewiet JJ et al. Systematic review and meta-analysis of somatostatin analogues for the treatment of pancreatic fistula. British J Surg 2012; 99(6): 754–760.
17. Coughlin S, Roth L, Lurati G et al. Somatostatin analogues for the treatment of enterocutaneous fistulas: a systematic review and metaanalysis. World J Surg 2012; 36(5): 1016–1029.
18. Katsourakis A, Zezos P, Noussios G et al. Does prophylactic administration of somatostatin decrease the rate of complications after pancreatic resection? A clinical and electron microscopy study. Pancreas 2012; Epub ahead of print.
19. Gurusamy KS, Koti R, Fusai G et al. Somatostatin analogues for pancreatic surgery. Cochrane Database Syst Rev 2012; 6: CD008370.
20. Low MJ. The somatostatin neuroendoscrinne system: physiology and clinical relevance in gastrointestinal and pancreatic disorders. Best Practice Res Clin Endocrin Metabolism 2004; 18(4): 607–622.
21. Koopmans KP, Glaudemans AW. Rationale for the use of radiolabelled peptides kin diagnosis and therapy. Eur J Nucl Med Mol Imaging 2012; 39 (SupplI): S4–S10.
22. Laverman P, Sosabowski JK, Boerman OC et al. Radiolabeled peptides for oncological diagnosis. Eur J Nucl Med Mol Imaging 2012; 39 (Suppl I): S78–S92.
23. Rossi RE, Massironi S, Spampatii MP et al. Treatment of liver metastases in patiens with digestive neuroendocrine tumors. J Gastrointest Surg 2012; Epub ahead of print.
24. Niina Y, Fujimori N, Nakamura T et al. The current strategy for managing pancreatic neuroendocrine tumors in multiple endocrine neoplasia type 1. Gut Liver 2012; 6(3): 287–294.
25. Bon C, Aparicio T, Vincent M et al. Long-acting somatostatin analogues decrease blood transfusion requirements in patients with refractory gastrointestinal bleeding associated with angiodysplasia. Aliment Pharmacol Ther 2012; 36(6): 587–593.
26. Annunziata M, Luque RM, Durán-Prado M et al. Somatostatin and somatostatin analogues reduce PDGF-induced endometrial cell proliferation and motility. Hum Reprod 2012; 27(7): 2117–2129.
27. Grasso LFS, Pivonello R, Colao A. Somatostatin analogs as a first-line treatment in acromegaly. When is it appropriate? Curr Opin Endocrinol Diabetes Obes 2012; 19(4): 288–294.
28. Toulis KA, Goulis DG, Msaouel P et al. Dexamethasone plus somatostatin-analog manipulation as bone metastasis microenvironment-targeting therapy for the treatment of castration-resistant prostate cancer: A meta-analysis of uncontrolled studies Anticancer Research 2012; 32(8): 3283–3290.
29. Chamberlain MC, Barnholz-Sloan JS. Medical treatment of recurrent meningiomas. Expert Rev Neurother 2011; 11(10): 1425–1432.
30. Fleseriu M, Petersenn S. Medical treatment of Cushing´s disease: chat is the future? Pituitary 2012; Epub ahead of print.
31. Hogan MC, Masyuk TV, Page L et al. Somatostatin analog therapy for severe polycystic liver disease: results after 2 years. Nephrol Dial Transplant 2012; Epub ahead of print.
32. Chrispijn M, Nevens F, Gevers TJG et al. The long-term outcome of patiens with polycystic liver disease treated with lanreotide. Aliment Pharmacol Ther 2012; 35(2): 266–274.
33. Van Assche G, Ferrante M, Vermeire S et al. Octreotide for the treatment of diarrhoe in patients with ileal pouch anal anastomosis. Colorectal Dis 2012; 14(4): 181–186.
34. Yildirim AE, Altun R, Can S et al. Idiopathic chylous ascites treated with total parenteral nutrition and octreotide. Eur J Gastroenterol Hepatol 2011; 23(10): 961–963.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2012 Issue 6-
All articles in this issue
- Autumn of congress
- Inflammatory bowel diseases in Karlovy Vary 2012
- Report from 7th CEURGEM (Central European Gastroenterology Meeting)
- Look back at UEGW 2012: The European Gastroenterological Fedaration is a successful project
- OESO – 11th world conference, COMO, Italy, September 1–4th 2012
- EURO-NOTES 2012, August 4–6th 2012, Prague
- VI. Beskydy Endoscopic Workshop
- Epidemiology of Helicobacter pylori infection in the Slovak Republic
- Clostridium difficile – a rising threat?
- Changes in body weight and eating habits of obese patients after sleeve gastrectomy – a pilot study
- Selected gastrointestinal diseases and nutritional disorders associated with osteoporosis
- Somatostatin and its use
- Does golimumab extend the spectrum of anti-TNFα inhibitors for inflammatory bowel diseases?
- Comparison of the tolerance and quality of bowel preparation before colonoscopy using picosulphate / magnesium citrate or polyethylene glycol in different dosing regimens
- First ”POEM“ (Per Oral Endoscopic Myotomy) in the Czech Republic
- Spontaneous intramural hematoma of the small bowel is a rare complication due to an oral anticoagulation therapy
- Rare mycotic complications following liver transplant
- Evening with a genius
- 30 years since the first endoscopic papillosphincterotomy in the then Czechoslovakia
- Omeprazole
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Somatostatin and its use
- Omeprazole
- Clostridium difficile – a rising threat?
- Selected gastrointestinal diseases and nutritional disorders associated with osteoporosis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

