-
Medical journals
- Career
Liečba spontánnej baktériovej peritonitídy
Authors: M. Janičko; E. Veseliny; G. Senajová; P. Jarčuška
Authors‘ workplace: I. interná klinika Univerzity Pavla Jozefa Šafárika v Košiciach
Published in: Gastroent Hepatol 2012; 66(4): 298-302
Category: Hepatology: Review article
Overview
Spontánna baktériová peritonitída je častá infekcia pacientov s cirhózou pečene s mortalitou približne 20 %. K jej vzniku vedie reťaz procesov začínajúca cirhózou a zlyhávaním pečene pokračujúca bakteriálnym prerastaním a črevnou translokáciou a končiaca infekciou regionálnych lymfatických uzlín a ascitu. Najčastejšie etiologické agens sú črevné baktérie, E. coli a enterokoky, ale aj streptococcus sp. Napriek pomerne presne popísanej etiológii boli jednoznačné liečebné odporúčania zavedené Európskou asociáciou pre štúdium pečene až v roku 2010. Jedným z hlavných dôvodov bol nedostatok dôkazov pochádzajúcich z klinických štúdií o liečbe spontánnej baktériovej peritonitídy. V článku uvádzame prehľad publikovanej literatúry a zároveň aj odporúčania európskej asociácie pre štúdium pečene, zamerané na liečbu, primárnu a sekundárnu prevenciu spontánnej baktériovej peritonitídy.
Kľúčové slová:
spontánna baktériová peritonitída – liečba – prehľadDefinícia
Spontánna baktériová peritonitída (SBP) je veľmi častá infekcia pacientov s cirhózou pečene a ascitom. Jej mortalita klesla z 90 % v čase jej popísania na asi 20 % v súčasnosti [3]. Prvé zmienky sa v medicínskej literatúre vyskytujú od roku 1893, avšak samotný termín zaviedol do praxe Conn v roku 1964. Zo samotného názvu vyplýva, že ide o infekciu ascitu bez prítomnosti jednoznačného intraabdominálneho zdroja infekcie [4].
Etiopatogenéza
Kľúčovým procesom pri vzniku SBP je baktériová translokácia, ktorá má za následok prienik črevnej flóry do regionálnych lymfatických uzlín a následne do ascitu [5]. Porucha črevnej motility vytvára vhodné prostredie na premnoženie patologickej črevnej mikroflóry, čo spolu s (ultra)štrukturálnymi zmenami črevnej steny a zlyhaním obranných mechanizmov pečene umožňuje prienik baktérií do mezenteriálnych lymfatických uzlín (obr. 1). Ich prežívanie a ďalšiu propagáciu sprevádzanú epizódami bakteriémie podporuje široký a multifaktoriálny deficit imunity pri cirhóze pečene [6].
Image 1. Pyramída dejov vedúcich k infekcii ascitu v prípade SBP. Fig. 1. Pyramid of events resulting in ascites infection in the case of SBP. 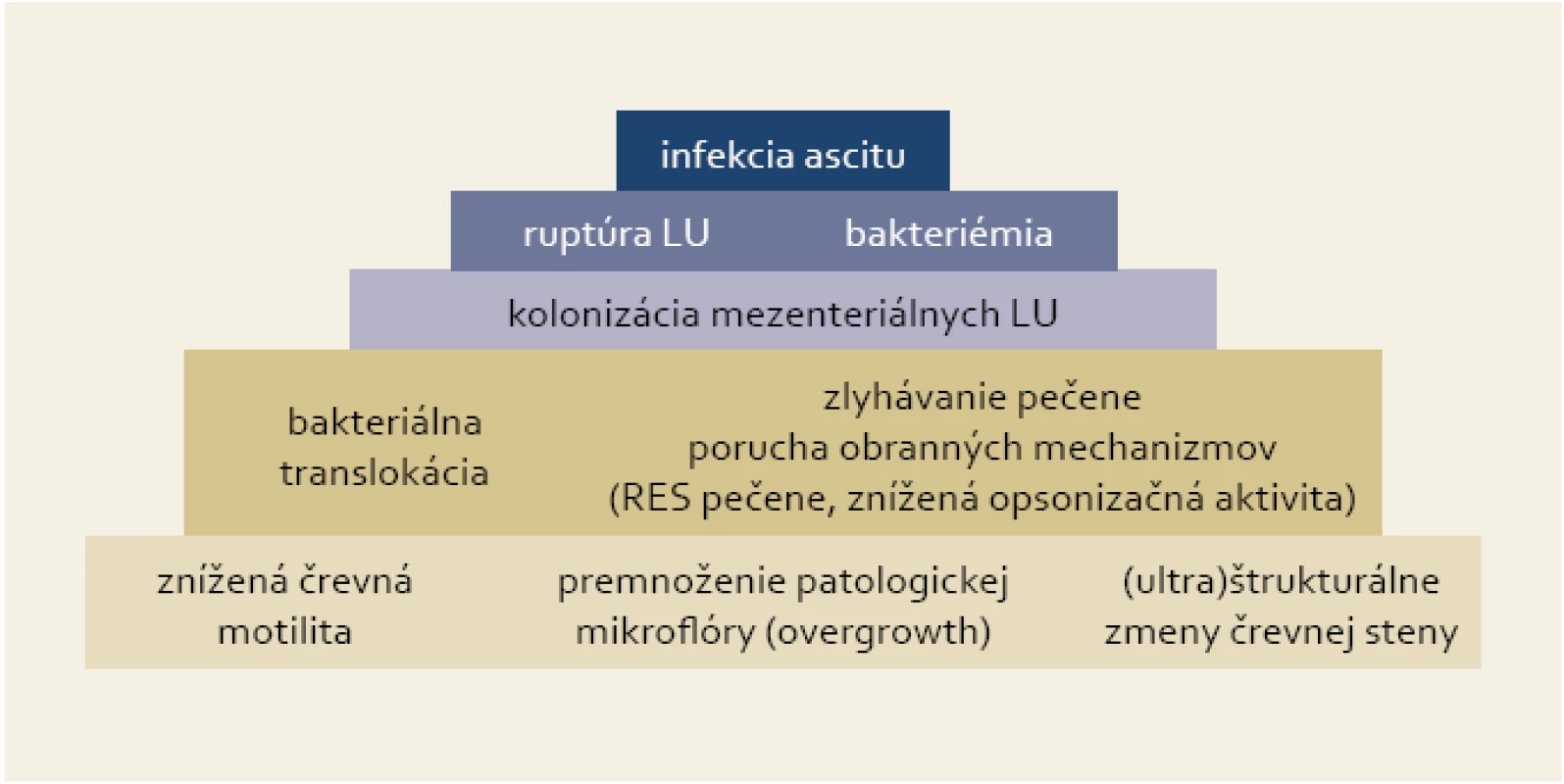
Prevalencia SBP v neselektovanej populácii cirhotikov sa pohybuje od 10–30 %. Približne v polovici prípadov je pacient s infekciou už prijatý do nemocnice, v druhej polovici sa infekcia rozvinie počas hospitalizácie [7].
Konkrétny patogén vyvolávajúci infekciu sa zistí len v cca 40 % prípadov, hoci záchyt sa dá zvýšiť až do 80 %, naočkovaním ascitickej tekutiny do fľaštičiek na odber hemokultúry už pri lôžku. Napriek naočkovaniu ascitu do média pre hemokultúru nebol zistený žiadny patogén v 23 % prípadov [8]. Sľubnou metódou na jednoznačnú identifikáciu patogénu sú molekulárno genetické metódy. V experimente bola prítomnosť bakteriálnej DNA PCR reakciou zachytená kvantitatívne v 100 % prípadov, identifikácia jednotlivých kmeňov takmer vždy dokázala viacnásobnú infekciu [9]. V prípade zachytenia patogénu sa najčastejšie jedná o gram-negatívne baktérie s prevahou E. coli (cca 37 %), alebo gram--pozitívne koky (najmä streptococcus sp., a enterokoky) (cca 20 %). Tieto údaje je potrebné považovať za orientačné, nakoľko sú predpokladané výrazné rozdiely vo vykultivovanej flóre u komunitných pacientov, hospitalizovaných pacientov, pacientov podstupujúcich invazívne výkony a nezanedbateľný je aj geografický faktor. Nedávno publikovaná dánska štúdia udáva výskyt gram-pozitívnych kokov až v 45,9 %, nasledovaných čeľaďou Enterobacteriaceae (31,7 %), výskyt E. coli bol udávaný len v 7,5 % [10]. Navyše až 30 % gram-negatívnych baktérií je zvyčajne rezistentných voči chinolónom (najmä u pacientov podstupujúcich profylaktickú liečbu chinolónmi) a ďalších 30 % voči trimetoprim-sulfametoxazolu. Výskyt rezistencie voči cefalosporínu je v súčasnosti pomerne nízky a nezávisí od profylaxie norfloxacínom [11]. Infekcia gram-pozitívnymi kokmi prevláda u pacientov na profylaktickej terapii norfloxacínom a infekcia týmito patogénmi je častá aj v rámci nozokomiálnej nákazy [11].
Klinický priebeh
Klinická symptomatológia pacientov so SBP je veľmi rôznorodá jednak samotným výskytom príznakom a zároveň aj ich intenzitou. Najčastejšie sú prítomné: 1. lokálne príznaky zápalu peritonea – bolesť brucha, palpačná citlivosť, vracanie, hnačka, ale aj ileus; 2. systémové príznaky infekcie ako hyper alebo hypotermia, triaška, tachykardia a/alebo tachypnoe; 3. zhoršenie hepatálnych funkcií; 4. hepatálna encefalopatia; 5. renálne zlyhanie; 6. krvácanie do gastrointestinálneho traktu; 7. rozvoj sepsy až septického šoku. Veľké percento pacientov je však asymptomatických [3].
Diagnostika
Diagnostika SBP je postavená na punkcii ascitu. Typické biochemické zloženie ascitu pri cirhóze pečene poukazuje na transsudatívny pôvod ascitu s nízkou celularitou, hladinou celkových bielkovín a gradientom sérového a ascitického albumínu viac ako 11 g/l. V prípade infekcie dochádza k zmnoženiu bunkových elementov, najmä neutrofilných granulocytov. V súčasnosti je možné na stanovenie množstva týchto buniek použiť aj automatické bunkové analyzátory, nakoľko medzi ručným a automatickým počítaním bola nájdená silná korelácia [12]. Vzhľadom k nízkej špecificite a vyplývajúcemu vysokému riziku falošne negatívnych výsledkov nie je možné v diagnostike SBP odporučiť použitie rýchlych reagenčných pásikov ako pri vyšetrení moču [3]. Najvyššiu senzitivitu pri diagnostike SBP má hraničná hodnota 250 granulocytov v mm3. Na základe kombinácie cytologického a mikrobiologického vyšetrenia môžeme identifikovať tri druhy spontánnej baktériovej peritonitídy. Klasický typ vyžaduje pozitivitu kultivačného nálezu zároveň s nálezom leukocytózy v ascite. Jeho variantom je leukocytóza v ascite bez záchytu patogénu pri kultivácii – kultivačne negatívny neutrofilový ascites. Nakoľko je klinický priebeh aj mortalita týchto typov podobná, nie sú ani odlišnosti v liečbe. Pri pozitivite kultivačného vyšetrenia ascitu, avšak bez nálezu leukocytózy, hovoríme o tzv. bacterascite. Manažment takéhoto pacienta nie je určený direktívne. Nakoľko však existujú údaje naznačujúce, že prítomnosť bakteriálnej DNA v ascite zhoršuje prognózu pacientov s cirhózou pečene [13], alebo sa môže jednať o predstupeň, SBP je indikovaný opakovaný odber vzorky a pri pozitivite kultivačného nálezu aj antibiotická liečba [7]. V rámci diferenciálnej diagnostiky je nutné vylúčiť sekundárnu peritonitídu získanú v komunite (apendicitída, cholecystitída, perforácia čreva) alebo iatrogénne (pri operácii, paracentéze alebo peritoniálnej dialýze) [14,15].
Liečba
Podľa odporúčaní Európskej asociácie pre štúdium pečene (EASL) je ihneď po zistení leukocytózy (> 250 neutrofilov/mm3) v ascite nutné začať empirickú antibiotickú liečbu [3]. Napriek stupňu odporúčania A1, nie je však z pochopiteľných etických dôvodov realizovaná placebom kontrolovaná štúdia.
V rokoch 1984–2008 bolo realizovaných minimálne 13 štúdií porovnávajúcich efektivitu jednotlivých antibiotík v empirickej liečbe SBP. Prakticky v každej štúdii bola porovnávaná odlišná dvojica antibiotík (najčastejšie aminopenicilíny +/ − klavulanát, chinolóny, cefalosporíny tretej generácie, kolistín, tobramycín), preto je metaanalýza týchto štúdií nerealizovateľná. Napriek tomu, v žiadnej zo štúdií nebol zistený významný rozdiel v mortalite pacientov. V jedinej štúdii, ktorá ako hlavný cieľ sledovala pomer pacientov vyliečených zo SBP, bol zistený benefit cefotaximu oproti kombinácii ampicilín + tobramycín [16], avšak bez odlišnosti v mortalite. V ďalších štúdiách nebol zistený: a) rozdiel v dávke cefotaximu 8 vs 4 mg/d pri sledovaní dĺžky liečby či nežiaducich účinkov [17]; b) v dĺžke trvania liečby 5 vs 10 dní [18]. Na základe týchto dôkazov je liekom voľby cefotaxime 2 g á 12 h i.v. v trvaní 5 dní (stupeň odporúčania A1). Alternatívou je ciprofloxacín p.o. 500 mg á 12 hod po dobu 7 dní (úroveň B1) za predpokladu, že u pacienta je vhodný p.o. príjem a chinolón, nebol užívaný profylakticky. Ampicilín klavulanát i.v. s prechodom na p.o. formu v plnej dávke je tiež vhodný pri empirickej liečbe SBP (úroveň B1). Antibiotická liečba môže byť v prípade potreby upravená po získaní výsledkov kultivačného vyšetrenia. V prípade negatívnej kultivácie je vhodné sledovať terapeutickú odpoveď pri kontrolnej paracentéze po 48 hod od začatia antibiotickej liečby, kedy očakávame pokles hladiny neutrofilov o minimálne 25 % [3].
Prítomnosť infekcie u cirhotického pacienta, s hranične kompenzovanou hepatálnou a renálnou funkciou už za optimálnych podmienok, mnohokrát vedie, prostredníctvom poruchy mikrocirkulácie, k progresii zlyhávania hepatálnej, renálnej funkcie, ale aj zlyhania ďalších orgánov. Z dostupných údajov vyplýva, že infekcia v teréne cirhózy je závažným, nezávislým rizikovým faktorom vzniku ARDS [19], spontánna baktériová peritonitída zapríčiní v zhruba tretine pacientov vznik renálneho zlyhania [20], infekcia môže zapríčiniť manifestáciu alebo zhoršenie hepatálnej encefalopatie [21] a v neposlednom rade sú infekcie jednou z častých príčin akútneho zlyhania pečene nasadajúceho na chronické zlyhávanie (acute on chronic liver failure) [22]. Dôležitou súčasťou liečby je preto, okrem razantnej a cielenej liečby samotnej infekcie, snaha o zmiernenie dôsledkov poruchy mikrocirkulácie a ovplyvnenie systémovej zápalovej odpovede.
Pribúdajú údaje dokumentujúce benefit intravenózneho podávania albumínu pacientom so spontánnou baktériovou peritonitídou. Randomizovaná kontrolovaná štúdia u pacientov (63 pacientov v experimentálnej a 63 v kontrolnej skupine) so SBP liečených cefotaximom ukázala, že albumín (v dávke 1,5 g/kg telesnej hmotnosti pri diagnóze a 1 g/kg po troch dňoch) významne znížil výskyt hepatorenálneho syndrómu prvého typu (30 vs 10 %) a zároveň redukoval hospitalizačnú mortalitu (29 vs 10 %). Na týchto výsledkoch sa podieľal najmä výrazný efekt albumínu vo vysoko rizikovej skupine (definovanej ako pacienti s hodnotami bilirubínu > 68 µmol/l a kreatinínu viac ako 88 µmol/l). Nakoľko bol výskyt HRS v skupine s nízkym rizikom minimálny (7 % v skupine bez albumínu a 0 % v skupine s albumínom), nie je jasné, či je tento pozitívny účinok prítomný aj v tejto skupine [23]. Podobné výsledky priniesla aj aktuálna retrospektívna observačná štúdia, ktorá zahŕňala 216 epizód SBP rozdelených do kategórií pacientov s nízkym rizikom (urea < 11 mmol/L a bilirubín < 68 µmol/L) bez pridania albumínu k liečbe (64 epizód), ďalej pacientov s vysokým rizikom bez pridania albumínu (79 epizód) a pacientov s vysokým rizikom liečených pridaním albumínu (73 epizód). Nemocničná mortalita medzi skupinami bola 3,1 vs 46,8 vs 28,8 % (podľa uvedeného poradia) a trojmesačné prežívanie 93 vs 45 vs 62 %. Dôležitým výsledkom tejto štúdie je skutočnosť, že albumín znižuje mortalitu vysokorizikových pacientov so SBP, avšak táto mortalita je stále vyššia ako u nízkorizikových pacientov, preto zrejme pacienti s nízkym rizikom nevyžadujú doplnok intravenózneho albumínu [24]. Alternatívou k albumínu sú mnohokrát syntetické koloidné roztoky, avšak priame porovnanie hydroxyetyl škrobu s albumínom, na rozdiel od albumínu, nepreukázalo efekt syntetického koloidu na zlepšení cirkulačnej dysfunkcie [25].
Na základe uvedených dôkazov je albumín naďalej preferovaný v liečbe SBP v kombinácii s antibiotikom v odporúčaniach EASL z roku 2010 [3].
Profylaxia
Pre vysoké riziko vzniku alebo recidívy SBP je u určitých, presne špecifikovaných skupín pacientov indikovaná primárna alebo sekundárna profylaxia SBP. Primárna profylaxia je indikovaná u pacientov s
- gastrointestinálnym krvácaním,
- s nízkou hladinou celkových bielkovín v ascite (< 10 g/l).
Sekundárna profylaxia je indikovaná u každého pacienta po prekonanej SBP. Riziko vzniku infekcie u cirhotika s prebiehajúcim gastrointestinálnym krvácaním sa pohybuje od 25–65 %. Efektivita primárnej profylaxie s ohľadom na mortalitu pacientov v týchto podmienkach bola hlavným cieľom metaanalýzy realizovanej skupinou Cochrane Collaboration, ktorá zahŕňala 12 štúdií realizovaných v rokoch 1985–2010, zahŕňajúcich 1 241 pacientov (obr. 2). Podávanie antibiotickej terapie počas krvácania z gastrointestinálneho traktu redukovalo súhrnnú mortalitu v 12 štúdiách o takmer 50 % [1]. Na základe dostupných dôkazov preto EASL odporúča začať u každého pacienta s gastrointestinálnym krvácaním antibiotickú liečbu (stupeň odporúčania A1). Ako vhodné antibiotikum je odporúčaný ceftriaxon v dávke 1 g denne, avšak vhodné je aj p.o. podanie norfloxacínu [3].
Image 2. Vplyv antibiotickej liečby na mortalitu pacientov s krvácaním z gastrointestinálneho traktu. Upravené podľa [1]. Fig. 2. Influence of antibiotic treatment on the mortality of patients with gastrointestinal tract bleeding. Adjusted according to [1]. ![Vplyv antibiotickej liečby na mortalitu pacientov s krvácaním z gastrointestinálneho traktu. Upravené podľa [1].
Fig. 2. Influence of antibiotic treatment on the mortality of patients with gastrointestinal tract bleeding. Adjusted according to [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/4a6e58d7faca3984ca19a94b092b6fcb.png)
Pacienti s hladinou bielkovín v ascite nižšou ako 10 g/l majú zvýšené riziko vzniku SBP [26]. Do februára 2009 bolo publikovaných 7 štúdií zahrňajúcich 538 pacientov, porovnávajúcich efektivitu antibiotickej profylaxie voči placebu alebo žiadnej liečbe (obr. 3). Súhrnne mali pacienti zaradení do antibiotikej profylaxie zhruba 5× nižšie riziko vzniku SBP oproti pacientom v kontrolných skupinách. Podobný efekt bol pozorovaný aj pri mortalite pacientov [2], preto je u pacientov s hladinou bielkovín v ascite pod 10 g/l odporúčaná profylaxia norfloxacínom 400 mg/d [3].
Image 3. Vplyv antibiotickej liečby na vznik SBP u pacientov s hladinou bielkovín v ascite < 10 g/l. Upravené podľa [2]. Fig. 3. Antibiotic profylaxis outcome in cirrhotics with ascitic protein levels < 10 g/l. Modified according to [2]. ![Vplyv antibiotickej liečby na vznik SBP u pacientov s hladinou bielkovín v ascite < 10 g/l. Upravené podľa [2].
Fig. 3. Antibiotic profylaxis outcome in cirrhotics with ascitic protein levels < 10 g/l. Modified according to [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/3bb697723fb1fae493561adc06f6f821.png)
Miera rekurencie u pacientov po prekonanej SBP je zhruba 70 % v priebehu jedného roka [27]. Ročné prežívanie týchto pacientov je iba 30–50 %, preto by mal byť každý pacient s cirhózou pečene po prekonaní SBP posúdený v súvislosti so zaradením do transplantačného programu. Sekundárna profylaxia spontánnej baktériovej peritonitídy je odporúčaná na základe jednej placebom kontrolovanej, randomizovanej štúdie porovnávajúcej efektivitu sekundárnej profylaxie SBP u pacientov po prekonaní predchádzajúcej epizódy SBP. Gines et al v tejto štúdii zistili, že norfloxacín 400 mg p.o. redukoval riziko vzniku SBP zo 68 na 20 % [28]. Pacienti po prekonanej SBP majú podľa odporúčaní EASL dostávať profylaktickú antibiotickú liečbu norfloxacínom v dávke 400 mg denne p.o. (stupeň odporúčania A1), alternatívou je aj ciprofloxacín 750 mg p.o. 1× týždenne alebo trimetoprim/sulfametoxazol (stupeň odporúčania A2) [3].
Záver
Spontánna baktériová peritonitída je závažná infekcia pacientov s cirhózou pečene s vysokou pridanou morbiditnou a mortalitnou záťažou. Antibiotická liečba je však dobre účinná a redukuje riziko vzniku SBP, komplikácií a smrti. Tieto skutočnosti sú reflektované aj v odporúčaniach EASL pre manažment ascitu, spontánnej baktériovej peritonitídy a hepatorenálneho syndrómu z roku 2010 (tab. 1).
Table 1. Profylaxia spontánnej baktériovej peritonitídy [3]. Tab. 1. Prophylaxis of spontaneous bacterial peritonitis [3]. ![Profylaxia spontánnej baktériovej peritonitídy [3].
Tab. 1. Prophylaxis of spontaneous bacterial peritonitis [3].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/9b2e3811b38cf1673806eb850e015f96.png)
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 28. 2. 2012
Přijato: 17. 3. 2012
MUDr. Martin Janičko, PhD.
I. interná klinika UPJŠ v Košiciach
Trieda SNP 1, 040 01 Košice
Martin.janicko@gmail.com
Sources
1. Chavez-Tapia NC, Barrientos-Gutierrez T, Tellez-Avila FI et al. Antibiotic prophylaxis for cirrhotic patients with upper gastrointestinal bleeding. Cochrane database of systematic reviews (Online) 2010(9): CD002907.
2. Cohen MJ, Sahar T, Benenson S et al. Antibiotic prophylaxis for spontaneous bacterial peritonitis in cirrhotic patients with ascites, without gastro-intestinal bleeding. Cochrane database of systematic reviews (Online) 2009(2): CD004791.
3. European Association fo study of the Liver. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol 2010; 53(3): 397–417.
4. Conn HO. Spontaneous Peritonitis and Bacteremia in Laennec's Cirrhosis Caused by Enteric Organisms. a Relatively Common but Rarely Recognized Syndrome. Ann Intern Med 1964; 60 : 568–580.
5. Guarner C, Runyon BA, Young S et al. Intestinal bacterial overgrowth and bacterial translocation in cirrhotic rats with ascites. J Hepatol 1997; 26(6): 1372–1378.
6. Koulaouzidis A, Bhat S, Saeed AA. Spontaneous bacterial peritonitis. World J Gastroenterol 2009; 15(9): 1042–1049.
7. Rimola A, Garcia-Tsao G, Navasa M et al. Diagnosis, treatment and prophylaxis of spontaneous bacterial peritonitis: a consensus document. International Ascites Club. J Hepatol 2000; 32(1): 142–153.
8. Castellote J, Xiol X, Verdaguer R et al. Comparison of two ascitic fluid culture methods in cirrhotic patients with spontaneous bacterial peritonitis. Am J Gastroenterol 1990; 85(12): 1605–1608.
9. Rogers GB, Russell LE, Preston PG et al. Characterisation of bacteria in ascites-reporting the potential of culture-independent, molecular analysis. Eur J Clin Microbiol Infect Dis 2010; 29(5): 533–541.
10. Novovic S, Semb S, Olsen H et al. First--line treatment with cephalosporins in spontaneous bacterial peritonitis provides poor antibiotic coverage. Scand J Gastroenterol 2012; 47(2): 212–216.
11. Fernández J, Navasa M, Gómez J et al. Bacterial infections in cirrhosis: epidemiological changes with invasive procedures and norfloxacin prophylaxis. Hepatology 2002; 35(1): 140–148.
12. Angeloni S, Nicolini G, Merli M et al. Validation of automated blood cell counter for the determination of polymorphonuclear cell count in the ascitic fluid of cirrhotic patients with or without spontaneous bacterial peritonitis. Am J Gastroenterol 2003; 98(8): 1844–1848.
13. Zapater P, Francés R, González-Navajas JM et al. Serum and ascitic fluid bacterial DNA: a new independent prognostic factor in noninfected patients with cirrhosis. Hepatology 2008; 48(6): 1924–1931.
14. Belghiti J, Durand F. Abdominal wall hernias in the setting of cirrhosis. Semin Liver Dis 1997; 17(3): 219–226.
15. Selgas R, Bajo MA, Jimenez C et al. Peritoneal dialysis in liver disorders. Perit Dial Int 1996; 16 (Suppl 1): S215–S219.
16. Felisart J, Rimola A, Arroyo V et al. Cefotaxime is more effective than is ampicillin-tobramycin in cirrhotics with severe infections. Hepatology 1985; 5(3): 457–462.
17. Rimola A, Salmerón JM, Clemente G et al. Two different dosages of cefotaxime in the treatment of spontaneous bacterial peritonitis in cirrhosis: results of a prospective, randomized, multicenter study. Hepatology 1995; 21(3): 674–679.
18. Runyon BA, McHutchison JG, Antillon MR et al. Short-course versus long-course antibiotic treatment of spontaneous bacterial peritonitis. A randomized controlled study of 100 patients. Gastroenterology 1991; 100(6): 1737–1742.
19. TenHoor T, Mannino DM, Moss M. Risk factors for ARDS in the United States: analysis of the 1993 National Mortality Followback Study. Chest 2001; 119(4): 1179–1184.
20. Salerno F, Gerbes A, Ginés P et al. Diagnosis, prevention and treatment of hepatorenal syndrome in cirrhosis. Gut 2007; 56(9): 1310–1318.
21. Blei AT. Infection, inflammation and hepatic encephalopathy, synergism redefined. J Hepatol 2004; 40(2): 327–330.
22. Sen S, Davies NA, Mookerjee RP et al. Pathophysiological effects of albumin dialysis in acute-on-chronic liver failure: a randomized controlled study. Liver Transpl 2004; 10(9): 1109–1119.
23. Sort P, Navasa M, Arroyo V et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Engl J Med 1999; 341(6): 403–409.
24. Poca M, Concepción M, Casas M et al. Role of albumin treatment in patients with spontaneous bacterial peritonitis. Clin Gastroenterol Hepatol 2012; 10(3): 309–315.
25. Fernández J, Monteagudo J, Bargallo X et al. A randomized unblinded pilot study comparing albumin versus hydroxyethyl starch in spontaneous bacterial peritonitis. Hepatology 2005; 42(3): 627–634.
26. Guarner C, Solà R, Soriano G et al. Risk of a first community-acquired spontaneous bacterial peritonitis in cirrhotics with low ascitic fluid protein levels. Gastroenterology 1999; 117(2): 414–419.
27. Garcia-Tsao G. Current management of the complications of cirrhosis and portal hypertension: variceal hemorrhage, ascites, and spontaneous bacterial peritonitis. Gastroenterology 2001; 120(3): 726–748.
28. Ginés P, Rimola A, Planas R et al. Norfloxacin prevents spontaneous bacterial peritonitis recurrence in cirrhosis: results of a double-blind, placebo-controlled trial. Hepatology 1990; 12 (4 Pt 1): 716–724.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2012 Issue 4-
All articles in this issue
-
Kvalita života je důležitým faktorem indikační rozvahy u nemocných s karcinomem pankreatu
Multicentrická prospektivní studie - Nová sekce Diskuzní fórum
- Vleklé dyspepsie: co a jak v běžné praxi
- 44th congress of the European Pancreatic Club (EPC) and PROMED symposium in 2012
- Dulcolax® čípky
- Zácpa na okraji?
- Zácpa a přežívající mýty. Laxativa
- Zácpa a hypofunkce štítné žlázy. Mýtus nebo skutečnost?
- Syndrom solitárního rektálního vředu
- Defekografie
- Radioizotopové vyšetření segmentální pasáže tlustým střevem pomocí 67Ga-citrátu
- Úspěšná léčba pacientky s obstrukčním defekačním syndromem
- Mezenteriálna fibromatóza ako príčina náhlej príhody brušnej
- Doporučený postup pro diagnostiku a léčbu anémie u IBD
-
Dlouhodobé výsledky terapie infliximabem u pacientů s ulcerózní kolitidou
Pokračování studií ACT-1 a ACT-2 - Flexibilní ezofagogastroskopie – jakých nálezů si má všímat gastroenterolog v hypofaryngu a hrtanu?
- Endoskopická polypektomie – jak dosáhnout standardu kvality v roce 2012?
- Liečba spontánnej baktériovej peritonitídy
-
Kvalita života je důležitým faktorem indikační rozvahy u nemocných s karcinomem pankreatu
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Defekografie
- Zácpa a hypofunkce štítné žlázy. Mýtus nebo skutečnost?
- Syndrom solitárního rektálního vředu
- Liečba spontánnej baktériovej peritonitídy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

