-
Medical journals
- Career
Mezenteriálna fibromatóza ako príčina náhlej príhody brušnej
Authors: P. Kružliak 1; D. Mištuna 2; K. Macháleková 3
Authors‘ workplace: Interné odd. NsP Zvolen, Vaše zdravie, n. o. 1; Chirurgická klinika Jesseniovej lekárskej fakulty UK a Martinskej fakultnej nemocnice, Martin 2; Ústav patologickej anatómie Jesseniovej lekárskej fakulty UK a Martinskej fakultnej nemocnice, Martin 3
Published in: Gastroent Hepatol 2012; 66(4): 276-279
Category: Clinical and Experimental Gastroenterology: Case Report
Overview
Intraabdominálna fibromatóza je lokálne agresívna, ale nie metastázujúca proliferácia väzivovového tkaniva. Je to benígny tumor, ktorý sa vyskytuje vo väčšine prípadov v brušnej stene, v mezentériu a retroperitoneu. Vyskytuje sa buď v asociácii s Gardnerovým syndrómom, alebo sporadicky, spôsobujúc v mnohých prípadoch diferenciálno-diagnostické problémy s myofibroblastickými tumormi a gastrointestinálnymi stromálnymi tumormi, ktoré sú však charakteristické oveľa agresívnejším biologickým správaním a tiež metastázovaním. Autori popisujú prípad 82-ročného pacienta s príznakmi akútneho brucha, ktorý bol operovaný s nálezom difúznej peritonitídy na podklade perforácie tumoru ilea s rozsiahlym nálezom difúzneho, neostro ohraničeného šírenia do mezentéria a s penetráciou do brušnej steny.
Kľúčové slová:
mezenteriálna fibromatóza – Gardnerov syndróm – gastrointestinálne stromálne tumory (GIST) – imunohistochemické vyšetreniaPojem fibromatóza zaviedol do svetovej literatúry Stout v roku 1954. Fibromatózy majú zvláštne postavenie medzi mezenchymálnymi nádormi a sú aj označované za „benígnu malignitu“. Vyplýva to z ich patologicko-anatomických charakteristík, biologického správania a klinického obrazu. Ide o nádory mäkkých tkanív, ktoré sú dobre ohraničené, pozostávajú z fibroblastov a myofibroblastov, produkujú veľké množstvo kolagénu, vykazujú infiltratívny spôsob rastu voči okolitým štruktúram a tkanivám, nedostatok cytologických ukazovateľov malignity, nedostatočnú alebo absentujúcu mitotickú aktivitu a agresívny klinický obraz charakterizovaný opakujúcimi sa lokálnymi rekurenciami bez tendencie k metastázovaniu. Je možné ich diagnostikovať takmer vo všetkých vekových kategóriách.
V súčasnosti platná patologicko-anatomická klasifikácia rozlišuje nasledujúce formy fibromatóz (tab. 1).
Table 1. Rozdelenie fibromatóz. Tab. 1. Fibromatosis classification. 
Intraabdominálna fibromatóza, tiež známa ako intraabdominálny desmoid, je vzácny lokálne agresívny, ale nie metastázujúci, mezenchymálny tumor, ktorý zvyčajne postihuje mezentérium alebo retroperitoneum [1,2,4]. Vyskytuje sa sporadicky alebo v asociácii so syndrómom familiárnej adenomatóznej polypózy, známej ako Gardnerov syndróm. Mezenterická fibromatóza (MF) je veľmi vzácna, lokálne agresívna neoplázia, ktorá sa môže klinicky manifestovať abdominálnym dyskomfortom, až abdominálnou bolesťou, hmotnostným úbytkom alebo symptómami ureterálnej obštrukcie, mezenteriálnej ischémie, alebo črevnej obštrukcie s rozvojom subileózneho až ileózneho stavu, zriedkavejšie, tak ako aj v našom klinickom prípade, perforáciou čreva so vznikom difúznej peritonitídy [1–4]. Klinicky, makroskopicky a v histologickom obraze MF môže pripomínať GIST. Napriek tomu, kým GIST môže často mať malígny potenciál, MF z hľadiska biologického správania zostáva v podstate benígnou léziou. Diferenciálna diagnóza medzi týmito dvomi entitami má veľký klinický význam a v niektorých prípadoch je to možné len na základe imunohistochemického vyšetrenia [1,2,4,5].
Kazuistika
82-ročný pacient 10. 11. 2008 hospitalizovaný na internom oddelení s anamnézou cca 10 dní trvajúcich bolestí brucha kŕčovitého charakteru, pričom bolesti sa zvýrazňovali postprandiálne, preto aj obmedzoval príjem potravy. Posledných 7 dní pred prijatím mal febrility do 39 °C, pociťoval nauzeu a opakovane zvracal. V laboratórnom obraze bola prítomná výrazná elevácia zápalových parametrov (FW 75/100, leukocytóza 17,3 × 109/l; CRP 226,7 mg/l). Bilirubín, hepatálne enzýmy, amylázy boli v norme, urea, kreatinín a mineralogram taktiež v referenčnom rozmedzí. Prostredníctvom pomocných zobrazovacích vyšetrení (USG, CT, CT-enteroklýza) bol verifikovaný hypoechogénny útvar (resp. hypodenzný útvar na CT) mediálne od céka rozmerov 77 × 64 × 37 mm (obr. 1). Konzultovaný chirurg odporučil doplniť gastrofibroskopické a kolonoskopické vyšetrenie s následnou realizáciou exploratívnej laparotómie. Pacient však s uvedeným diagnostickým postupom, ako aj s ďalšou hospitalizáciou, nesúhlasil a aj napriek poučeniu o možných následkoch z rodinných dôvodov odmietol ďalšiu hospitalizáciu a liečbu. Dňa 10. 12. 2008 bol vyšetrený a hospitalizovaný na I. chirurgickej klinike pre výrazné zhoršenie zdravotného stavu. Pri príjme udával od predchádzajúceho dňa pretrvávajúce intenzívne kŕčovité bolesti v epigastriu, zástavu vetrov a stolice. Bol febrilný, TT 38,5 st., cítil sa veľmi slabý, malátny, v noci nespal. Hmotnostný úbytok za posledné 2 týždne činil asi 7 kg. Pri fyzikálnom vyšetrení boli prítomné známky miernej dehydratácie, brucho bolo nad niveau hrudníka, distendované a meteoristicky zdvihnuté. Palpačná bolestivosť s maximom v epigastriu a mesogastriu, s napínaním brušného svalstva pri vyšetrení, bez hmatnej rezistencie. Naznačená bola aj poklopová citlivosť a auskultačne prítomná hyperperistaltika. Následne bolo realizované RTG vyšetrenie hrudníka a brucha s nálezom voľného plynu v subfréniu a subileózneho stavu. Pacient bol urgentne operovaný pre známky difúznej peritonitídy pri suspektnej perforačnej príhode v oblasti GITu. Peroperačný nález potvrdil difúznu purulentnú peritonitídu, pri perforovanom tumore ilea s rozsiahlym nálezom difúzneho, neostro ohraničeného šírenia do mezentéria a s penetráciou do brušnej steny. Zrealizovala sa extenzívna resekcia ilea (cca 100 cm) a priľahlého mezentéria s end-to-end anastomózou, lavážou a drenážou dutiny brušnej. Pri histopatologickom vyšetrení makroskopicky bol opísaný tumoriformný útvar veľkosti 74 × 65 × 47 mm, rastúci prevažne v tukovom tkanive mezentéria, v časti však infiltrujúci aj steny zavzatých kľučiek tenkého čreva (obr. 1). Mikroskopicky išlo o neostro ohraničenú, infiltratívnu léziu s vretenovitými, oválnymi aj hviezdicovitými fibroblastami uloženými v kolagénnej stróme, pričom bunková populácia bola bez atypií a bez mitotickej aktivity (obr. 2). V časti lézie bola popísaná akcentácia regresívnych zmien v zmysle chronickej zápalovej celulizácie, starších krvácaní a ložiskovej tvorby granulačného spojiva. Imunohistochemicky bol vimentin difúzne pozitívny, hladko-svalový aktín v ojedinelých bunkách pozitívny, dezmín negatívny, svalovo-špecifický aktín negatívny, S-100 proteín negatívny, CD 117 a CD 34 negatívne. Na základe histopatologického vyšetrenia podporeného imunohistochemickými nálezmi bola diagnostikovaná mezenteriálna fibromatóza dezmoidného typu. Priebeh pooperačného obdobia bol excelentný, pacient sa pomerne rýchlo zotavil, bolesti brucha, ako aj ostatné dyspeptické ťažkosti, zmizli. V priebehu 3 mesiacov bol pozorovaný hmotnostný prírastok 12 kg. Keďže ide o ochorenie s vysokým rizikom recidívy, pacient je naďalej dispenzarizovaný na onkochirurgickej ambulancii.
Image 1. Nález pri CT vyšetrení – hypodenzný útvar mediálne od céka rozmerov 77 × 64 × 37 mm. Fig. 1. Intra-abdominal CT imaging proved a low density mass 77 × 64 × 37 mm at the medial site of the caecum. 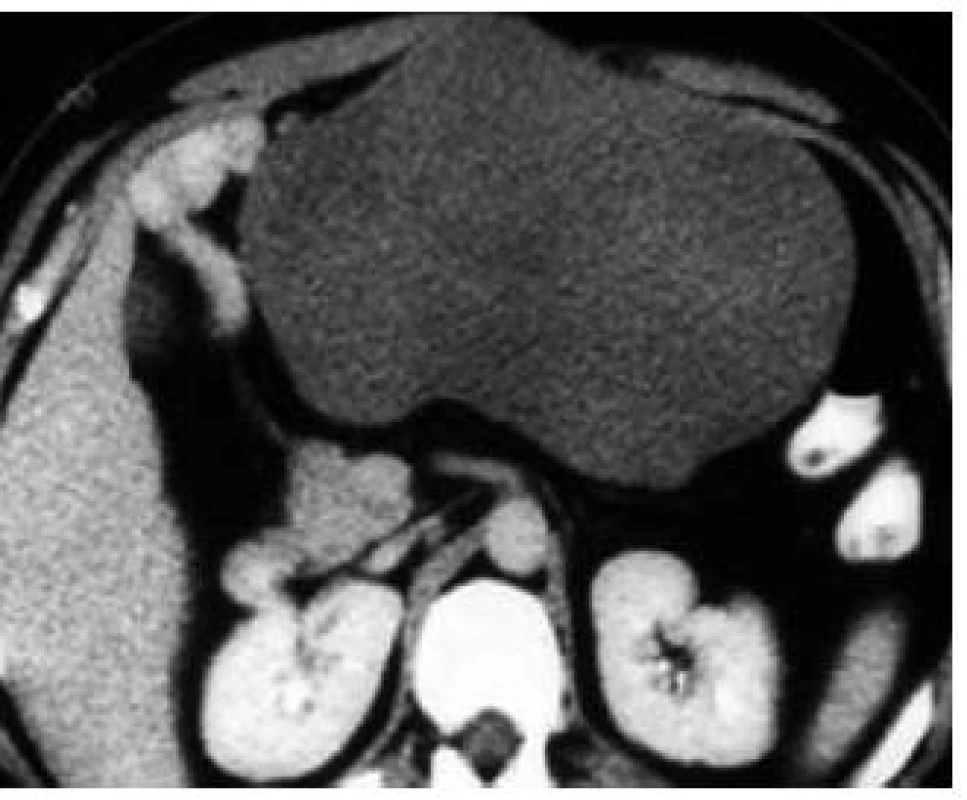
Image 2. Peroperačný resekát tumoru so zavzatými kľučkami tenkého čreva. Fig. 2. The surgical resection specimen of a tumour with small intestine loops. 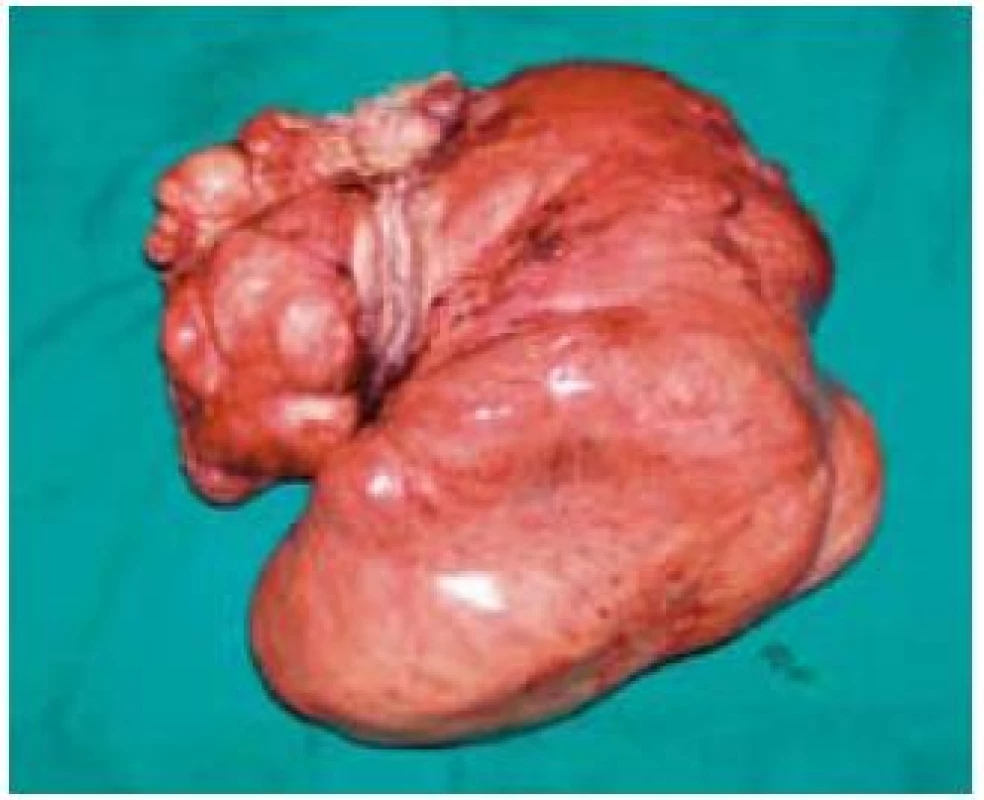
Image 3. Histologický nález, farbivo hematoloxylin-eosin – neostro ohraničená, infiltratívna lézia s vretenovitými fibroblastami uloženými v kolagénnej stróme. Fig. 3. Histological investigation suggested poorly demarcated infiltration with spindle fibroblasts on the collagenous tumour stroma (hematoxyline-eosine staining). 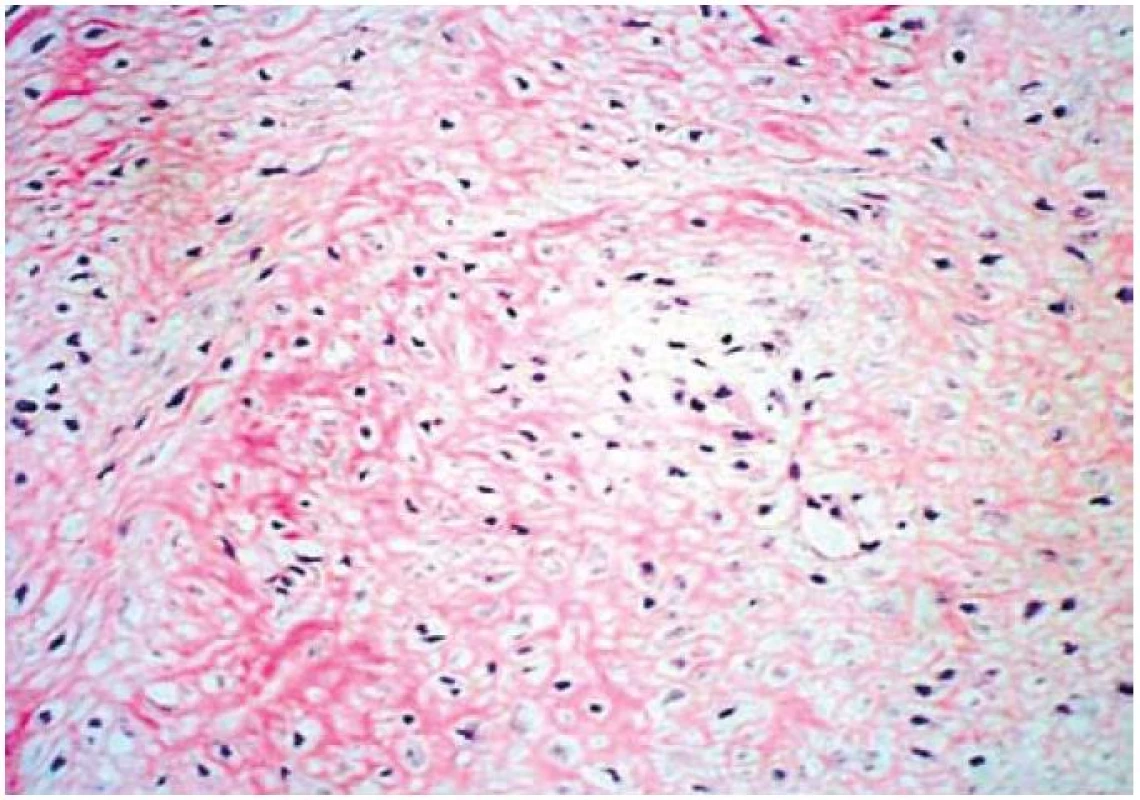
Diskusia
Mezenteriálna fibromatóza je veľmi raritné, lokálne agresívne, proliferatívne, ale nie metastázujúce ochorenie. Incidencia sa pohybuje medzi 2–4/1 0000 000/rok, pričom častejšie sú postihnuté ženy. Vyskytuje sa buď sporadicky, alebo v asociácii s Gardnerovým syndrómom, u ktorých je až 850× vyššie riziko vzniku ochorenia než v bežnej populácii a je druhou najčastejšou príčinou smrti po kolorektálnom karcinóme u týchto pacientov. Na základe epidemiologických štúdií u pacientov s Gardnerovým syndrómom sa zistilo, že rizikovým faktorom vzniku mezenteriálnej fibromatózy je abdominálna operácia (napríklad aj profylaktická kolektómia pri mnohopočetnom výskyte adenomatóznych polypov), alebo abdominálna trauma [1,3,4,6,7,10]. Pri sporadickom výskyte ochorenia sa predpokladá väčší význam endokrinnej príčiny, ktorá je podporená relatívne vyššou prevalenciou ochorenia u gravidných žien a u žien užívajúcich hormonálnu antikoncepciu a regresiou tumoru po menopauze, resp. aj regresiou po terapii tamoxifenom [8,9]. V našom klinickom prípade išlo o sporadickú, pomerne atypickú formu MF u muža bez Gardnerovho syndrómu.
Klinicky sa mezenteriálna fibromatóza môže manifestovať abdominálnym dyskomfortom, až abdominálnou bolesťou, hmotnostným úbytkom, alebo v niektorých prípadoch, v závislosti od veľkosti a lokalizácie, aj symptómami ureterálnej obštrukcie, mezenteriálnej ischémie, alebo črevnej obštrukcie s rozvojom subileózneho až ileózneho stavu, zriedkavejšie, tak ako aj v našom klinickom prípade, perforáciou čreva so vznikom difúznej peritonitídy [1,3,11–14]. V niektorých prípadoch je mezenteriálna fibromatóza diagnostikovaná pri operáciách, exploratívnych laparotómiách, ktoré sú indikované z iných dôvodov [10,14]. U nášho pacienta bol klinický obraz MF spočiatku veľmi chudobný a necharakteristický. Dominoval dyspeptický syndróm s bolesťami v epigastriu a nechutenstvom. Postupne došlo veľmi rýchlo a dramaticky k progresii ochorenia so vznikom život ohrozujúcej komplikácie – perforácie čreva s difúznou peritonitídou. V diagnostike tohto ochorenia majú veľký význam zobrazovacie metódy – USG, CT, CT-angiografia, NMR, ktoré umožňujú posúdiť rozsah lézie a prípadne aj infiltráciu do okolitých štruktúr [14,15].
Histologické vyšetrenie vzorky s imuhistochemickými metódami definitívne stanoví diagnózu MF. V diferenciálnej diagnostike je najväčším problémom odlíšiť mezenteriálnu fibromatózu od GIST. Panel vyšetrení, zahrňujúci mikroskopické, imunohistochemické a ultraštruktúrne vyšetrenia umožňuje vo väčšine prípadov korektnú identifikáciu. Na základe referencií imunohistochemických štúdií mezenteriálna fibromatóza v porovnaní s GIST vykazuje negativitu pre CD34 a S100 proteín, kým expresia vimentínu, CD 117, hladko-svalového aktínu, svalovo špecifického aktínu a desmínu nevykazuje rozdiely medzi týmito dvomi neopláziami [16–18]. Príležitostne, v neistých prípadoch, môže mať veľký diagnostický význam stanovenie expresie nukleárneho proteínu beta-cateninu, ktorý je špecificky exprimovaný bunkami MF, pričom bunky benígnych a malígnych fibroblastických a myofibroblastických lézií, ako aj GIST-ov, ho neexprimujú [19]. Pokiaľ nález nie je veľmi rozsiahly a je resekovateľný, pričom pacient nemá kontraindikáciu operačného výkonu, je jednoznačne terapiou prvej voľby radikálna lokálna resekcia tumoru. Podľa histologického nálezu (v prípade pozitívneho nálezu tumoru v marginálnej zóne resekátu) sa indikuje adjuvantná rádioterapia. U pacientov, u ktorých je operácia z rôznych príčin kontraindikovaná, resp. u pacientov s lokálne pokročilým, neresekovateľným ochorením, je indikovaná systémová chemoterapia, avšak účinnosť tejto liečby je oveľa menšia v porovnaní s operačnou liečbou. Používajú sa predovšetkým chemoterapeutické režimy založené na kombinácii metothrexátu s vinerelbinom, ďalej tamoxifen, doxorubicin, interferon γ. V súčasnosti prebiehajú štúdie fázy III s imatinibom v tejto indikácii. Vzhľadom k agresívnemu správaniu tohto tumoru až v 16 % dochádza k recidíve ochorenia a v 6 % vedie ochorenie k smrti. Preto je nesmierne dôležité pacientov po radikálnych resekciách naďalej dispenzarizovať a sledovať na onkochirurgických ambulanciách. Lokálne rekurencie sú častejšie v prípadoch, keď je mezenteriálna fibromatóza asociovaná s Gardnerovým syndrómom. V svetovej literatúre boli popísané veľmi zriedkavé ojedinelé spontánne regresie neoplázie [1,4,5,10,20,21].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 20. 7. 2011
Přijato: 20. 9. 2011
MUDr. Peter Kružliak
Interné oddelenie NsP Bojnice
Nemocničná 2, 972 01, Bojnice
peter-kruzliak@post.sk
Sources
1. Yannopoulos K, Stout AP. Primary solid tumours of the mesentery. Cancer 1963; 16 : 914–927.
2. Yantiss RK, Spiro IJ, Compton C et al. Gastrointestinal stromal tumor versus Intraabdominal fibromatosis of the bowel wall: a clinically important differential diagnosis. Am J Surg Pathol 2000; 24(7): 947–957.
3. Gardner EJ. Follow-up study of family group exhibiting dominant inheritance for a syndrome including intestinal polyps, osteomas, fibromas and epidermal cysts. Am J Hum Genet 1962; 14 : 376–390.
4. Burke A, Sobin LH, Shekitka KM. Intraabdominal fibromatosis. A pathologic analysis of 130 tumors with comparison of clinical subgroups. Am J Surg Pathol 1990; 14(4): 335–341.
5. Miettinen M, Monihan J, Sarlomo-Rikala M. Gastrointestinal stromal tumors, Smooth muscle tumors (GISTs) primary in the omentum and mesentery clinicopathologic and immunohistochemical study of 26 cases. Am J Surg Pathol 1999; 23(9): 1109–1118.
6. Gurbuz AK, Giardello FM, Peterson GM et al. Desmoid tumours in familial adenomatous polyposis. GUT 1994; 35(3): 377–381.
7. Chen FJ, Jeng KS. Intraabdominal fibromatosis. A rare complication of previous abdominal surgery. J Surg 1999; 32 : 97–100.
8. Lim CL, Walker MJ, Mehta RR et al. Estrogen and antiestrogen binding sites in desmoid tumors. Eur J Cancer Clin Oncol 1986; 22(5): 583–587.
9. Gansar GF, Markowitz IP, Cerise EJ. Thirty years of experience with desmoid tumors at Charity Hospital. Am Surg 1987; 53(6): 318–319.
10. Smith AJ, Lewis JJ, Merchant NB et al. Surgical management of intraabdominal desmoid tumours. Br J Surg 2000; 87(5): 608–613.
11. Jalini L, Hemming D, Bhattacharaya V. Intraabdominal desmoid tumour presenting with perforation. Surgeon 2006; 4(2): 114–116.
12. Hailemariam S, Jaeger P, Goebel N. Mesenteric fibromatosis with ureteric stenosis. Postgrad Med J 1988; 64(747): 79–81.
13. Messiou C, Chalmers AG, Dexter S. An unusual case of ureteric obstruction. Br J Radiol 2005; 78(933): 848–850.
14. Tsamandas AC, Tzanakakis GN, Karatzas T et al. Mesenteric fibromatosis. Br J Clin Pract 1994; 48(2): 79–81.
15. Casillas J, Sais GJ, Greve JL et al. Imaging of intra - and extraabdominal desmoid tumours. Radiographics 1991; 11(6): 959–968.
16. Monihan JM, Carr NJ, Sobin LH. CD34 immunoexpresion in stromal tumours of the gastrointestinal tract and in mesenteric fibromatoses. Histopathology 1994; 25(5): 469–473.
17. Sarlomo-Rikala M, Kovatich A, Barusevicius A et al. CD117: a sensitive marker for gastrointestinal stromal tumors that is more specific than CD34. Mod Pathol 1998; 11(8): 728–734.
18. Miettine M, Lasota J. Gastrointestinal stromal tumors-definition, chemical, histological, Immuno-histochemical, and molecular genetic features and differential diagnosis. Virchows Arch 2001; 438(1): 1–12.
19. Montgomery E, Torbenson MS, Kaushal M et al. Beta-catenin Immunohistochemistry separates mesenteric fibromatosis from gastrointestinal stromal tumor and sclerosing mesenteritis. Am J Surg Pathol 2002; 26(10): 1296–1301.
20. Nuyttens JJ, Rust PF, Thomas CR Jr. et al. Surgery versus radiation therapy for patients with aggresive fibromatosis or desmoid tumors. A comparative review of 22 articles. Cancer 2000; 88(7): 1517–1523.
21. Janinis J, Patriki M, Vini L et al. The pharmacological treatment of aggresive fibromatosis: a systematic review. Ann Oncol 2003; 14(2): 181–190.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2012 Issue 4-
All articles in this issue
-
Kvalita života je důležitým faktorem indikační rozvahy u nemocných s karcinomem pankreatu
Multicentrická prospektivní studie - Nová sekce Diskuzní fórum
- Vleklé dyspepsie: co a jak v běžné praxi
- 44th congress of the European Pancreatic Club (EPC) and PROMED symposium in 2012
- Dulcolax® čípky
- Zácpa na okraji?
- Zácpa a přežívající mýty. Laxativa
- Zácpa a hypofunkce štítné žlázy. Mýtus nebo skutečnost?
- Syndrom solitárního rektálního vředu
- Defekografie
- Radioizotopové vyšetření segmentální pasáže tlustým střevem pomocí 67Ga-citrátu
- Úspěšná léčba pacientky s obstrukčním defekačním syndromem
- Mezenteriálna fibromatóza ako príčina náhlej príhody brušnej
- Doporučený postup pro diagnostiku a léčbu anémie u IBD
-
Dlouhodobé výsledky terapie infliximabem u pacientů s ulcerózní kolitidou
Pokračování studií ACT-1 a ACT-2 - Flexibilní ezofagogastroskopie – jakých nálezů si má všímat gastroenterolog v hypofaryngu a hrtanu?
- Endoskopická polypektomie – jak dosáhnout standardu kvality v roce 2012?
- Liečba spontánnej baktériovej peritonitídy
-
Kvalita života je důležitým faktorem indikační rozvahy u nemocných s karcinomem pankreatu
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Defekografie
- Zácpa a hypofunkce štítné žlázy. Mýtus nebo skutečnost?
- Syndrom solitárního rektálního vředu
- Liečba spontánnej baktériovej peritonitídy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

