-
Medical journals
- Career
Endoskopická polypektomie – jak dosáhnout standardu kvality v roce 2012?
Authors: I. Mikoviny Kajzrlíková 1; P. Vítek 1,2
Authors‘ workplace: Beskydské gastrocentrum, Interní oddělení, Nemocnice ve Frýdku-Místku, p. o., Frýdek-Místek 1; Katedra interních oborů, LF OU v Ostravě 2
Published in: Gastroent Hepatol 2012; 66(4): 294-297
Category: Digestive Endoscopy: Review Article
Overview
Standardem kvality endoskopické polypektomie jsou správná detekce a makroskopická evaluace polypů, vlastní endoskopické odstranění polypu a adekvátní následná dispenzarizace. V následujícím přehledu jsou diskutovány současné trendy a doporučení.
Klíčová slova:
polypektomie – biopsie – standardy kvalityStandardem kvality endoskopické polypektomie jsou správná detekce a makroskopická evaluace polypů, vlastní endoskopické odstranění polypu a adekvátní následná dispenzarizace.
Detekce polypů
Polypektomie je velmi účinný nástroj ke snížení incidence, mortality i morbidity kolorektálního karcinomu [1,2]. Za hlavní indikátor kvality detekce neoplazií je v současnosti považována dostatečná detekce adenomů při screeningové kolonoskopii. Detekce je obvykle kvantifikována procentem nalezených adenomů (tzv. adenoma detection rate), které by mělo být více než 25 % u mužů a více než 15 % u žen nad 50 let [3]. Je tedy nezbytné, abychom adenom nalezli nejméně u pětiny screenigových kolonoskopií. Kaminski et al prokázali, že nejvyšší riziko intervalového karcinomu mají pacienti vyšetření endoskopistou s nejnižším adenoma detection rate [4].
Jak v běžné praxi zvýšit záchyt adenomů? Kromě důrazu na kvalitní dělenou přípravu střeva [5] bylo zjištěno, že prodloužení prohlížecího času nad 6 min signifikantně zvyšuje záchyt adenomů, Lee dokonce navrhuje optimální vytahovací čas až 10 min, neboť kolonoskopista s průměrným časem kolem 10 min má o až 11 % vyšší adenoma detection rate v porovnání s kolonoskopistou s průměrem kolem 6 min. Prodlužování prohlížecího času nad 10 min pak již nevede k dalšímu zvýšení adenoma detection rate [6,7].
Praktický přínos může mít též změna polohy pacienta během prohlížení tračníku. East et al porovnávali změnu pozic během kolonoskopie. Prohlíželi cékum a ascendens až k hepatální flexuře na levém boku, transverzum vleže na zádech a descendens i sigmoideum na pravém boku. V porovnání s konstantní polohou na levém boku zjistili 11% nárůst počtu pacientů s adenomem v transverzu, lienální flexuře a descendens. Největší přínos polohy pak byl prokázán u vyšetření transverza v poloze na zádech [8].
Použití HD-WL (High-Definition, White-Light, tedy endoskopie s vysokým rozlišením čipu) a NBI (Narrow Band Imaging) zlepšuje adenoma detection rate a detekuje více plochých a pravostranných lézí, NBI má v porovnání se zobrazením v bílém světle lepší predikci neoplastického charakteru léze během kolonoskopie [9].
V červnu 2011 byla publikována souhrnná analýza American Society for Gastrointestinal Endoscopy (ASGE) hodnotící technické inovace v kolonoskopii a jejich vliv na záchyt adenomů [10]. Při použití širokoúhlého (wide-angle) kolonoskopu nebylo prokázáno zvýšení záchytu adenomů. Pro použití průhledného nástavce na konci kolonoskopu (cap) byly výsledky vyhodnoceny jako smíšené. Zvýšení počtu detekovaných adenomů bylo prokázáno při použití Third Eye retroskopu, což je akcesorium zaváděné pracovním kanálem endoskopu sloužící k retrográdnímu prohlédnutí oblastí za řasami. Nevýhodou tohoto akcesoria je nutnost odsávání zbytků stolice již během zavádění přístroje a nutnost jeho extrakce před provedením vlastní polypektomie, pokud ovšem nepracujeme s dvoukanálovým endoskopem [11–14].
Makroskopická evaluace versus histologické vyšetření
Pokud se nám podaří uvedenými technikami a prodloužením prohlížecího času zvýšit počet nalezených lézí v tračníku, je zcela na místě otázka potřebnosti histologického vyšetření všech detekovaných lézí. V posledním roce se diskutuje o úspoře zdrojů používáním „resect and discard“ strategie. Tato strategie zahrnuje odstranění určitých diminutivních lézí bez histologického vyšetření [15]. Denis et al na základě svých výsledků tvrdí, že správná predikce dispenzárního intervalu bez znalosti histologie je možná u 67 % pacientů. Od histologického vyšetření pak může být upuštěno až u 44 % diminutivních, a tedy 33 % všech polypů. Na základě své práce navrhují tento algoritmus: histologické vyšetření všech polypů nad 5 mm, polypů do 5 mm s podezřelým vzhledem, přítomnou depresí či ulcerací, u pacientů s více než 3 polypy a u pacientů s 1–2 diminutivními polypy, kteří mají negativní anamnézu kolorektální neoplazie. Naopak od histologického vyšetření může být bezpečně upuštěno u velmi starých pacientů (osoby pokročilého věku nebo s komorbiditami, u kterých je dle hodnocení endoskopisty předpokládaná délka života pod 10 let), u nemocných, kteří mají diminutivní polyp společně s karcinomem či polypem nad 6 mm a u pacientů s 1–2 diminutivními polypy s anamnézou kolorektální neoplazie [16].
Vzhledem k tomu narůstají nároky na přesné makroskopické zhodnocení léze endoskopistou. Sato et al ve své práci prokázali, že k rozlišení neoplastické a hyperplastické léze slouží stejně dobře AFI (autofluorescence) i NBI [17].
Technika polypektomie a minimalizace rizik komplikací
Správné technické provedení polypektomie bez ponechání reziduí je nezbytné ke snížení incidence intervalových karcinomů. K polypektomii lze použít bioptické kleště (cold/hot) nebo kličku (cold/hot), u větších lézí je nejlepším řešením tzv. injection-assisted polypectomy. Při této technice aplikujeme do báze či stopky polypu fyziologický roztok s adrenalinem (obvyklé ředění 10 000–20 000 : 1) analogicky jako při technice endoskopické mukózní resekce. Efthymiou et al ve své studii s 54 polypektomiemi diminutivních lézí prokázali, že často používaná studená polypektomie bioptickými kleštěmi je pro tyto léze neadekvátní. Po vyšetření endoskopickou mukózní resekcí snesených spodin po polypektomii s 1–2mm okrajem prokázal reziduum u 38 % adenomů a u 76 % hyperplastických lézí. Použití hot-biopsy kleští sice zvyšuje procento kompletní resekce, ovšem zvyšuje riziko opožděného krvácení a perforace. Jako ideální se tak pro resekci diminutivních lézí dle současných poznatků jeví resekce kličkou [18].
Součástí výkonu je i snaha o minimalizaci komplikací, tedy především perforace a krvácení. Krvácení se vyskytuje až po 2,9 % polypektomií, v 1,1 % jsou krvácení závažná, vyžadující krevní transfuze, hospitalizaci, chirurgický zákrok nebo končící letálně [19]. Dle recentních doporučení European Society of Gastrointestinal Endoscopy (ESGE) riziko krvácení nejvíce zvyšuje věk nad 65 let, antikoagulační terapie, kardiovaskulární onemocnění a velikosti polypu [20]. Zvláštní pozornost vyžadují pacienti s protidestičkovou či antikoagulační terapií. ESGE guidelines pro polypektomii u pacientů s protidestičkovou léčbou doporučují nepoužívat čistý řezací proud, nepřerušovat terapii kyselinou aminosalicylovou bez ohledu na velikost polypu a u resekce polypu nad 1 cm vysadit thienopyridiny. Pokud nelze vysadit thienopyridiny a zároveň nelze polypektomii odložit, je na místě použít preventivní opatření jako endoloop u stopkatých polypů a submukozní injekci ředěného adrenalinu u přisedlých polypů (obr. 1,2).
Image 1. Endoloop. Fig. 1. Endoloop. 
Image 2. Submukózní injekce ředěného adrenalinu. Fig. 2. Submucosal injection of diluted epinephrine. 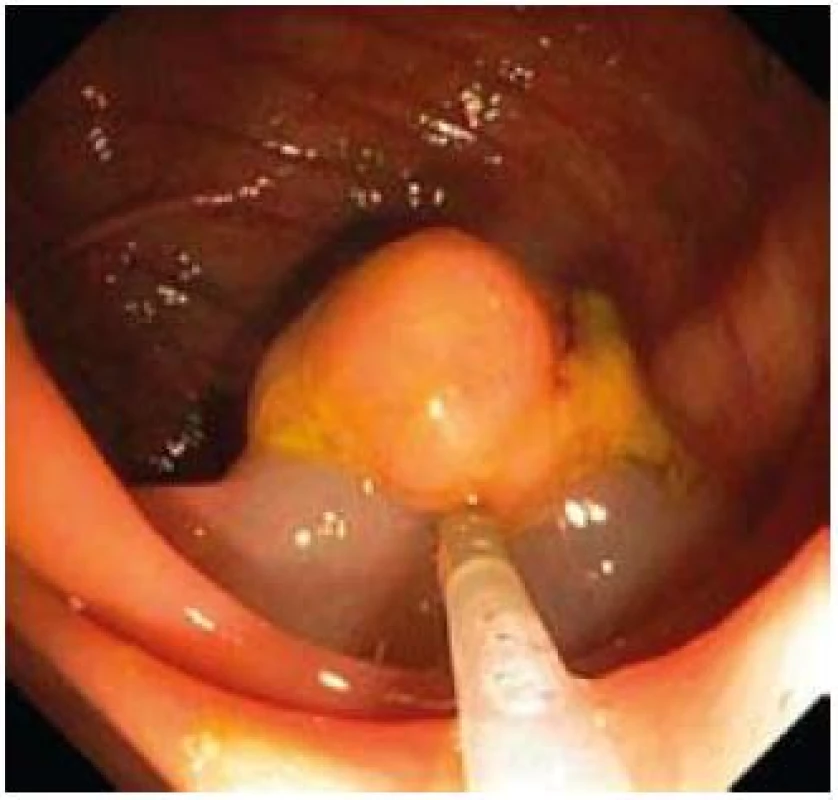
U pacientů s antikoagulační terapií je polypektomie považována za vysokorizikový výkon. Tyto nemocné můžeme rozdělit dle rizika trombembolické komplikace na dvě skupiny. U pacientů s nízkým rizikem trombembolie (po žilní trombóze, s fibrilací síní bez onemocnění chlopní, náhradou chlopně bioprotézou, mechanickou náhradou aortální chlopně) je doporučeno přerušit užívání warfarinu 3–5 dní před výkonem, současné podávání nízkomolekulárního heparinu není nutné. U nemocných s vysokým rizikem trombembolie (fibrilace síní s mechanickou náhradou chlopně, mechanická náhrada mitrální chlopně, mechanické náhrady u pacientů s trombembolií v anamnéze) je možné vysazení warfarinu pouze za současného podávání nízkomolekulárního heparinu [21].
Endoskopista by měl být schopen posoudit jak riziko krvácení, tak riziko trombotických komplikací a podle toho se rozhodnout o načasování polypektomie, adekvátním ošetření spodiny či stopky po polypektomii a opětovném zahájení antikoagulace. Vyjádření k případným úpravám protidestičkové a antikoagulační terapie by mělo být součástí závěru endoskopického vyšetření.
Správná dispenzarizace po polypektomii
Nemocní s nálezem neoplastické léze v tračníku a rektu jsou ohroženi rekurencí neoplazie. Hlavními rizikovými faktory zvyšujícími pravděpodobnost rekurence adenomu jsou nález pokročilého adenomu, více než 3 adenomy a věk nad 60 let [22]. Jedinou změnou oproti doporučením z roku 2006 [23,24] je prodloužení dispenzárního intervalu u pacientů s 1–2 tubulárními adenomy do 10 mm na 5–10 let a definování intervalů po resekci serrated adenomů (tab. 1).
Table 1. Doporučené dispenzární intervaly kolonoskopického vyšetření. Převzato z [23,24]. Tab. 1. Recommended dispensary intervals for colonoscopic examinations [23,24]. ![Doporučené dispenzární intervaly kolonoskopického vyšetření. Převzato z [23,24].
Tab. 1. Recommended dispensary intervals for colonoscopic examinations [23,24].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/613d9551d1e5baa7c4bb8f198f379938.png)
I přes celkem jednoznačná doporučení by však určování dispenzárních intervalů mělo být u každého pacienta individuální s přihlédnutím k jeho biologickému věku, komorbiditám, rodinné anamnéze i ke kvalitě provedené kolonoskopie.
Všechny výše zmíněné intervaly jsou dané pro vyšetření s optimální přípravou střeva. Problémem je ovšem rozhodnutí o dispenzarizaci po vyšetření nemocného se suboptimální střevní přípravou, která představuje až pětinu všech kolonoskopií. Ani mezi experty není shoda, zda po kolonoskopii s nedostatečnou přípravou časně zopakovat vyšetření nebo pouze zkrátit dispenzární interval. Lebwohl et al ve své studii opakující vyšetření po kolonoskopii se suboptimální přípravou střeva zaznamenali 42 % přehlédnutých adenomů a 27 % přehlédnutých pokročilých adenomů. Proto dopopručují po polypektomii při suboptimální přípravě střeva vyšetření do jednoho roku zopakovat [25].
V tab. 2 jsou přehledně shrnuty standardy kvality kolonoskopie Španělské gastroenterologické společnosti publikované v dubnu 2012 [26]. Standardem všech pracovišť provádějících polypektomii by mělo být sledování adenoma detection rate, procento dosažení céka, foto - či videodokumentace výkonu a zaznamenávání komplikací [27].
Table 2. Indikátory kvality kolonoskopického vyšetření. Převzato z [26]. Tab. 2. Quality indicators for colonoscopic examinations [26]. ![Indikátory kvality kolonoskopického vyšetření. Převzato z [26].
Tab. 2. Quality indicators for colonoscopic examinations [26].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/5f5456d4ffc010e954bd8042f1446168.png)
Závěr
Sledování parametrů kvality polypektomie je v současnosti nezbytné na každém endoskopickém pracovišti. Kromě sledování komplikací výkonu je nově nutné sledovat počet kolonoskopií s detekovaným adenomem, tzv. adenoma detection rate. Stoupají nároky na endoskopistu jak v makroskopickém hodnocení charakteru polypů během vyšetření, tak v hodnocení komorbidit nemocného a jeho medikace. Součástí endoskopického nálezu musí být v současnosti kromě doporučení režimu po výkonu i uvedení strategie následné protidestičkové a antikoagulační terapie. Určení správného dispenzárního intervalu po polypektomii pak minimalizuje riziko vzniku intervalového karcinomu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 19. 4. 2012
Přijato: 30. 5. 2012
MUDr. Ivana Mikoviny Kajzrlíková
Beskydské Gastrocentrum, Interní oddělení Nemocnice ve Frýdku-Místku, p.o.
El. Krásnohorské 321, 738 18 Frýdek-Místek
kajzrlikova@kolonoskopie.cz
Sources
1. Winawer SJ, Zauber AG, Ho MN et al. Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Workgroup. N Engl J Med 1993; 329(27): 1977–1981.
2. Rex DK. Colonoscopy. Gastrointest Endosc Clin N Am 2000; 10(1): 135–160.
3. Rex DK, Bond JH, Winawer S et al. Quality in the technical performance of colonoscopy and the continuous quality improvement process for colonoscopy: recommendations of the U.S. Multi-Society Task Force on Colorectal Cancer. Am J Gastroenterol 2002; 97(6): 1296–1308.
4. Kaminski MF, Regula J, Kraszewska E et al. Quality indicators for colonoscopy and the risk of interval cancer. N Engl J Med 2010; 362(19): 1795–1803.
5. Vepřeková G, Suchánek Š, Martínek J et al. Příprava střeva ke kolonoskopii. Gastroent Hepatol 2012; 66(1): 55–62.
6. Lee TJ, Rutter MD, Blanks RG et al. Colonoscopy quality measures: experience from the NHS Bowel Cancer Screening Programme. Gut 2011; 61(7): 1050–1057.
7. Barclay RL, Vicari JJ, Doughty AS et al. Colonoscopic withdrawal times and adenoma detection during screening colonoscopy. N Engl J Med 2006; 355(24): 2533–2541.
8. East JE, Bassett P, Arebi N et al. Dynamic patient position changes during colonoscope withdrawal increase adenoma detection: a randomized, crossover trial. Gastrointest Endosc 2011; 73(3): 456–463.
9. Rastogi A, Early DS, Gupta N et al. Randomized, controlled trial of standard-definition white-light, high-definition white-light, and narrow-band imaging colonoscopy for the detection of colon polyps and prediction of polyp histology. Gastrointest Endosc 2011; 74(3): 593–602.
10. Mamula P, Tierney WM, Banerjee S et al. Devices to improve colon polyp detection. Gastrointest Endosc 2011; 73(6): 1092–1097.
11. Hewett DG, Rex DK. Cap-fitted colonoscopy: a randomized, tandem colonoscopy study of adenoma miss rates. Gastrointest Endosc 2010; 72(4): 775–781.
12. Kondo S, Yamaji Y, Watabe H et al. A randomized controlled trial evaluating the usefulness of a transparent hood attached to the tip of the colonoscope. Am J Gastroenterol 2007; 102(1): 75–81.
13. Harada Y, Hirasawa D, Fujita N et al. Impact of a transparent hood on the performance of total colonoscopy: a randomized controlled trial. Gastrointest Endosc 2009; 69 (3 Pt 2): 637–644.
14. Lee YT, Lai LH, Hui AJ et al. Efficacy of cap-assisted colonoscopy in comparison with regular colonoscopy: a randomized controlled trial. Am J Gastroenterol 2009; 104(1): 41–46.
15. Kessler WR, Imperiale TF, Klein RW et al. A quantitative assessment of the risks and cost savings of forgoing histologic examination of diminutive polyps. Endoscopy 2011; 43(8): 683–691.
16. Denis B, Bottlaender J, Weiss AM et al. Some diminutive colorectal polyps can be removed and discarded without pathological examination. Endoscopy 2011; 43(2): 81–86.
17. Sato R, Fujiya M, Watari J et al. The diagnostic accuracy of high-resolution endoscopy, autofluorescence imaging and narrow-band imaging for differentially diagnosing colon adenoma. Endoscopy 2011; 43(10): 862–868.
18. Efthymiou M, Taylor AC, Desmond PV et al. Biopsy forceps is inadequate for the resection of diminutive polyps. Endoscopy 2011; 43(4): 312–316.
19. Heldwein W, Dollhopf M, Rösch T et al. The Munich Polypectomy Study (MUPS): prospective analysis of complications and risk factors in 4000 colonic snare polypectomies. Endoscopy 2005; 37(11): 1116–1122.
20. Boustière C, Veitch A, Vanbiervliet G et al. Endoscopy and antiplatelet agents. European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2011; 43(5): 445–461.
21. Zádorová Z. Gastrointestinální endoskopie u nemocných s antikoagulační a antiagregační terapií. Čes a Slov Gastroent a Hepatol 2007; 61(6): 314–317.
22. de Jonge V, Sint Nicolaas J, van Leerdam ME et al. Systematic literature review and pooled analyses of risk factors for finding adenomas at surveillance colonoscopy. Endoscopy 2011; 43(7): 560–572.
23. Winawer SJ, Zauber AG, Fletcher RH et al. Guidelines for colonoscopy surveillance after polypectomy: a consensus update by the US Multi-Society Task Force on Colorectal Cancer and the American Cancer Society. Gastroenterology 2006; 130(6): 1872–1885.
24. Rex DK, Kahi CJ, Levin B et al. Guidelines for colonoscopy surveillance after cancer resection: a consensus update by the American Cancer Society and the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology 2006; 130(6): 1865–1871.
25. Lebwohl B, Kastrinos F, Glick M et al. The impact of suboptimal bowel preparation on adenoma miss rates and the factors associated with early repeat colonoscopy. Gastrointest Endosc 2011; 73(6): 1207–1214.
26. Jover R, Herráiz M, Alarcón O et al. Clinical practice Guidelines: quality of colonoscopy in colorectal cancer screening. Endoscopy 2012; 44(4): 444–451.
27. Lin OS, Kozarek RA, Arai A et al. The effect of periodic monitoring and feedback on screening colonoscopy withdrawal times, polyp detection rates, and patient satisfaction scores. Gastrointest Endosc 2010; 71(7): 1253–1259.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2012 Issue 4-
All articles in this issue
-
Kvalita života je důležitým faktorem indikační rozvahy u nemocných s karcinomem pankreatu
Multicentrická prospektivní studie - Nová sekce Diskuzní fórum
- Vleklé dyspepsie: co a jak v běžné praxi
- 44th congress of the European Pancreatic Club (EPC) and PROMED symposium in 2012
- Dulcolax® čípky
- Zácpa na okraji?
- Zácpa a přežívající mýty. Laxativa
- Zácpa a hypofunkce štítné žlázy. Mýtus nebo skutečnost?
- Syndrom solitárního rektálního vředu
- Defekografie
- Radioizotopové vyšetření segmentální pasáže tlustým střevem pomocí 67Ga-citrátu
- Úspěšná léčba pacientky s obstrukčním defekačním syndromem
- Mezenteriálna fibromatóza ako príčina náhlej príhody brušnej
- Doporučený postup pro diagnostiku a léčbu anémie u IBD
-
Dlouhodobé výsledky terapie infliximabem u pacientů s ulcerózní kolitidou
Pokračování studií ACT-1 a ACT-2 - Flexibilní ezofagogastroskopie – jakých nálezů si má všímat gastroenterolog v hypofaryngu a hrtanu?
- Endoskopická polypektomie – jak dosáhnout standardu kvality v roce 2012?
- Liečba spontánnej baktériovej peritonitídy
-
Kvalita života je důležitým faktorem indikační rozvahy u nemocných s karcinomem pankreatu
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Defekografie
- Zácpa a hypofunkce štítné žlázy. Mýtus nebo skutečnost?
- Syndrom solitárního rektálního vředu
- Liečba spontánnej baktériovej peritonitídy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

