-
Medical journals
- Career
Přínos autofluorescence v diagnostice lehké intraepiteliální neoplazie u pacientů s Barrettovým jícnem
Authors: M. Stefanová 1; M. Zavoral 1; F. Závada 1; Š. Suchánek 1; I. Tučková 2; P. Hrabal 2; J. Martínek 1
Authors‘ workplace: Interní klinika 1. LF UK a ÚVN Praha 1; Oddělení patologie, ÚVN Praha 2
Published in: Gastroent Hepatol 2011; 65(5): 249-254
Category: Clinical and Experimental Gastroenterology: Original Article
Overview
Úvod:
Pacienti s Barrettovým jícnem (BJ) mají zvýšené riziko vzniku adenokarcinomu jícnu, proto musí být pravidelně dispenzarizováni. Cílem dispenzarizace je časná diagnostika BORN (Barrett’s Esophagus Related Neoplasia). Moderní přídatné endoskopické metody jako např. narow band imaging (NBI), endoskopie s vysokým rozlišením (HRE) a autofluorescence (AFI) jsou užitečné při časné diagnostice high grade intraepiteliální neoplazie (HGIN) nebo časného adenokarcinomu (EAC), nicméně jejich role při detekci low grade intraepiteliální neoplazie (LGIN) zůstává nejasná.Cíl:
Zhodnotit přínos AFI v detekci low grade intraepiteliální neoplazie u pacientů s Barrettovým jícnem.Metodika:
Prospektivní studie zahrnující 53 pacientů s Barrettovým jícnem (průměrný věk 63 let, rozsah 22–98). Vstupní diagnóza byla následující: 10× HGIN, 28× LGIN a 15× dlouhý segment Barrettova jícnu s podezřením na LGIN. Všichni pacienti byli vyšetřeni standardní endoskopií a dále s pomocí NBI a AFI. Cílené biopsie byly odebrány z makroskopicky podezřelých oblastí. U pacientů, kde nebyly patrny žádné podezřelé okrsky, byly odebrány standardní „náhodné“ biopsie. Výsledky získané z cílených biopsií byly považovány za konečnou diagnózu.Výsledky:
Časný adenokarcinom (EAC) byl diagnostikován u pěti pacientů, třem pacientům byla diagnostikována HGIN a čtrnácti pacientům LGIN. U zbývajících 31 pacientů jsme nepotvrdili žádnou intraepiteliální neoplazii. AFI byla pozitivní u sedmi pacientů s EAC a HGIN (7/8; 87 %) a u šesti pacientů s LGIN (7/14; 50 %). AFI byl falešně pozitivní u sedmi pacientů bez intraepiteliální neoplazie (7/31; 23 %). Senzitivita, specificita, pozitivní prediktivní hodnota (PPV) a negativní prediktivní hodnota (NPV) AFI pro detekci HGIN byly 90 %, 93 %, 80 % a 96 %. Odpovídající hodnoty pro detekci LGIN byly 50 %, 77 %, 50 % a 77 %.Závěr:
AFI není přínosná pro detekci LGIN u pacientů s Barrettovým jícnem především vzhledem k vysoké míře falešně pozitivity. AFI se zdá být přínosná u pacientů s HGIN, i když je soubor pacientů s HGIN v naší studii malý.Klíčová slova:
Barrettův jícen – autofluorescence – intraepiteliální neoplazieBJ je onemocnění, kdy je část původního dlaždicobuněčného epitelu jícnu nahrazena metaplastickým cylindrickým epitelem. Tato část musí být makroskopicky jednoznačně patrná a histologicky by měla obsahovat intestinální metaplazii nekardiálního původu. Tato podmínka nemusí být podle Montrealského konsenzu splněna [1], ale Americká gastroenterologická společnost (AGA) ve svých guidelines na přítomnosti intestinální metaplazie trvá [2]. Patogeneze přeměny dlaždicového epitelu na epitel metaplastický není doposud detailně známa.
Hlavním etiologickým faktorem vzniku BJ je gastroezofageální reflux. Mezi další rizikové faktory patří mužské pohlaví, bílá rasa, obezita (BMI nad 30), hiátová hernie, spolupodíl alkalického duodenálního refluxu s obsahem žlučových kyselin a lyzolecitinu, kouření, nadměrné užívání alkoholu, snížený tonus dolního jícnového svěrače a genetická predispozice.
Pacienti s BJ mají zvýšené riziko vzniku adenokarcinomu jícnu, proto musí být dlouhodobě dispenzarizováni. Riziko vzniku adenokarcinomu jícnu u nedysplastického epitelu v BJ je 0,2–0,5 %, u dysplastického je toto riziko větší [4]. Cílem dispenzarizace pacientů s BJ je časná diagnostika, tzv. BORN (Barrett´s Esophagus Related Neoplasia).
Moderní přídatné endoskopické metody, mezi které patří tzv. narrow band imaging (NBI), autofluorescence (AFI) a endoskopie s vysokým rozlišením (HRE), přispívají ke zlepšení makroskopické vizualizace patologických suspektních oblastí s tzv. BORN a umožňují cílený odběr biopsie z těchto suspektních okrsků (obr. 1–3).
Image 1. Časný adenokarcinom, standardní zobrazení. Fig. 1. Early adenocarcinoma, white light endoscopy. 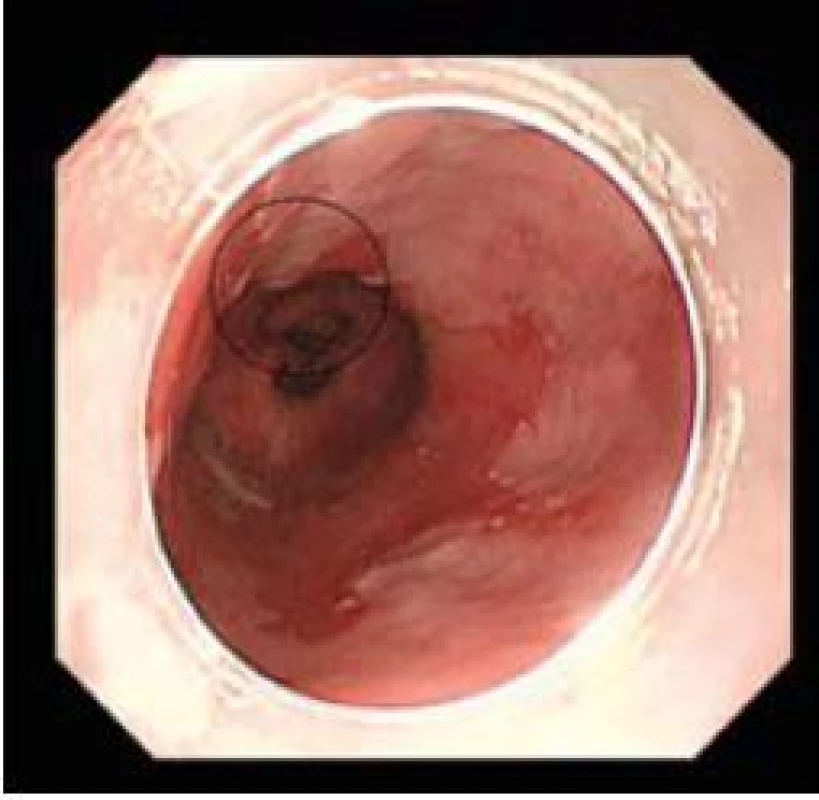
Image 2. Stejné zobrazení jako obr. 1 v NBI. Fig. 2. Imaging as in Fig. 1 in NBI. 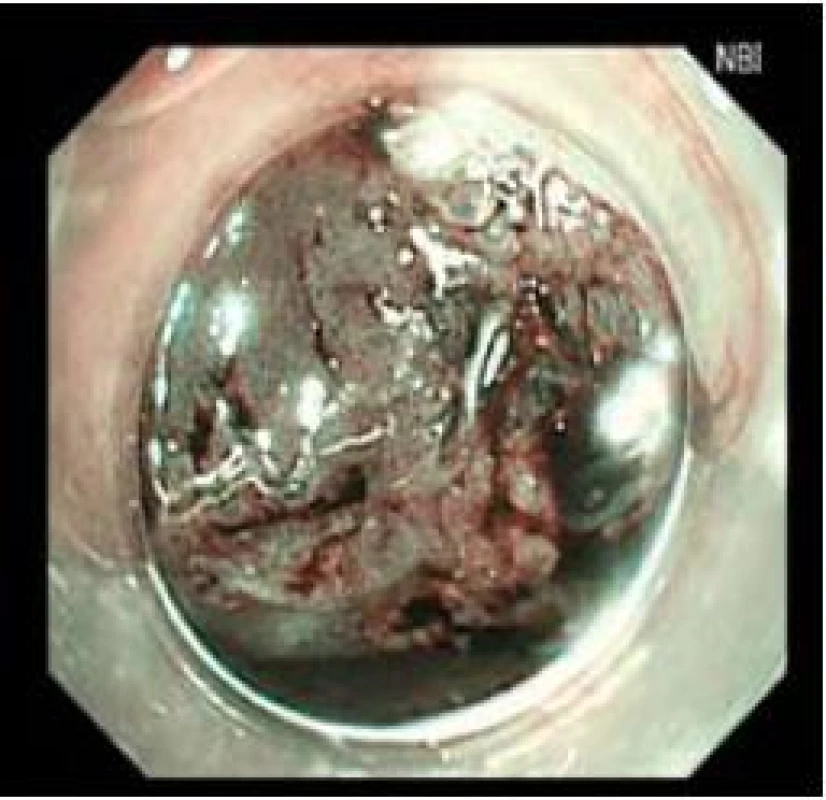
Image 3. Stejné zobrazení časného adenokarcinomu jako obr. 1 a 2 v AFI. Fig. 3. Imaging of early adenocarcinoma as in Figs. 1 and 2 in AFI. 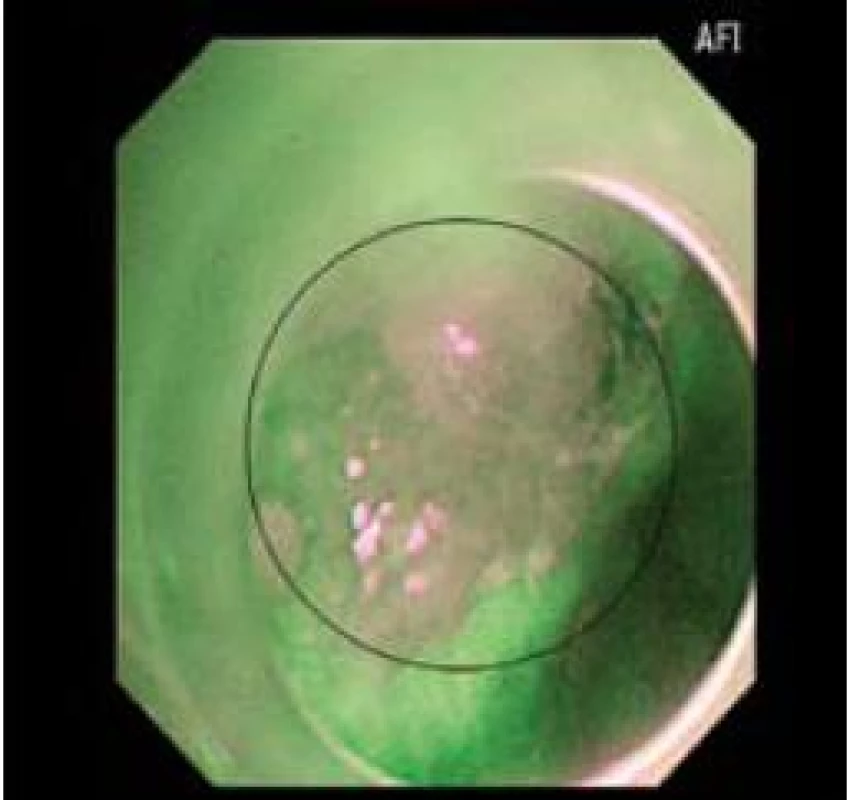
NBI pracuje na principu modrého excitačního světla, které má krátkou vlnovou délku a proniká jen povrchně do sliznice. Toto světlo je absorbováno hemoglobinem. Na základě tohoto jevu jsou více patrné jednak různé slizniční nerovnosti a též patologická cévní kresba a vaskulární abnormality, které mohou svědčit pro dysplazii [5].
Autofluorescence je založena na schopnosti různých tkání spontánně emitovat světlo o jiných vlnových délkách, než je vlnová délka světla, které tyto buňky osvěcuje. V oblastech dysplastické sliznice nebo carcinoma in situ je fluorescence snížena až desetinásobně a pozorujeme posun v proporci od zeleného k červenému světlu. Přesný podklad tohoto jevu dosud není objasněn, ale nejdůležitějšími faktory jsou zřejmě zesílení epitelu a zvýšená koncentrace hemoglobinu [6].
Cíl studie
Cílem naší prospektivní studie bylo zhodnotit diagnostický přínos AFI v diagnostice LGIN u pacientů s BJ.
Metodika práce
Soubor pacientů
Do studie bylo zařazeno 53 konsekutivních pacientů odeslaných k AFI a NBI vyšetření pro možnou suspekci na BORN (LGIN, HGIN, EAC, prominující léze). Diagnóza, s kterou byli tito pacienti odesláni, je považována za diagnózu „vstupní“. Definitivní diagnózu jsme následně stanovili na základě cílených biopsií při použití AFI a NBI, které hodnotil specializovaný jícnový patolog.
Endoskopie a odběr biopsií
Všichni pacienti byli vyšetřeni trimodálním endoskopem Olympus Q 260 FZ, který umožňuje až pětinásobné zvětšení obrazu a obsahuje světelné filtry pro NBI a AFI. Na konec tubusu endoskopu standardně nasazujeme plastikový cap. Pomocí tohoto capu lze lépe prohlížet jednotlivé metaplastické ostrůvky BJ a precizněji hodnotit cévní kresbu a slizniční nerovnosti. Plastikový cap rovněž umožňuje lepší cílený odběr biopsií [7]. Důkladné prohlížení jednotlivých metaplastických jazýčků trvalo minimálně 7 min. Po zavedení endoskopu jsme nejprve celý jícen očistili rozprašovací kanylou s mukolytikem a deflatulanciem (Sab simplex). Po základní makroskopické diagnostice a klasifikaci BE jsme k detailnímu vyšetření použili pětinásobné zvětšení. S NBI jsme důkladně prohlédli patologickou cévní kresbu a vaskulární abnormality v metaplastickém segmentu. Jícen jsme dále prohlíželi pomocí AFI a hodnotili přítomnost pozitivního fialového zbarvení.
Cílené biopsie byly odebrány kvalitními kleštěmi kleštěmi (Olympus Alligator Jaw FB-220K a Boston Scientific Radial Jaw 4) do formolové zkumavky. Místa bioptického odběru byla zdokumentována. U některých pacientů zvláště s dlouhým segmentem Barrettova jícnu jsme před odběrem cílených biopsií na sliznici jícnu aplikovali ředěný adrenalin pomocí rozprašovací kanyly, abychom předešli krvácení po odběru prvních vzorků. Biopsie byly odebrány ze suspektních AFI pozitivních okrsků. U pacientů, kde nebyly makroskopicky patrné žádné podezřelé oblasti ani při použití AFI a NBI, jsme odebrali standardní „náhodné“ biopsie. Bioptické vzorky byly odečítány v naší laboratoři. Vzorky z jiných laboratoří, především biopsie obsahující HGIN, byly předány k druhému čtení vzhledem k častým diskrepancím histologické interpretace. Výsledné cílené biopsie byly považovány za konečnou diagnózu.
Statistické hodnocení
V naší studii bylo použito standardní statistické deskriptivní hodnocení.
Výsledky
Celkově jsme vyšetřili pomocí trimodální endoskopie 53 pacientů s BJ (tab. 1). Z toho bylo 37 mužů a 16 žen. Věkový průměr pacientů byl 63 let, nejmladšímu bylo 22 let, nejstaršímu 98 let. Vstupní diagnózy u pacientů s BJ zařazených do této studie byly následující: EAC/HGIN 10×, LGIN 28× a dlouhý segment BJ s podezřením na LGIN 15×.
Table 1. Charakteristika souboru. Tab. 1. Characteristics of the cohort. 
Definitivní diagnóza, která byla stanovena z cílených biopsií s použitím AFI, byla následující: EAC 5×, HGIN 3×, LGIN 14× a u 31 pacientů se intraepiteliální neoplazie neprokázala (tab. 2).
Table 2. Porovnání vstupní a definitivní diagnózy. Tab. 2. Comparison between the initial and final diagnosis. 
Table 3. Senzitivita a specificita AFI v diagnostice LGIN a HGIN. Tab. 3. AFI sensitivity and specificity in the LGIN and HGIN diagnostics. 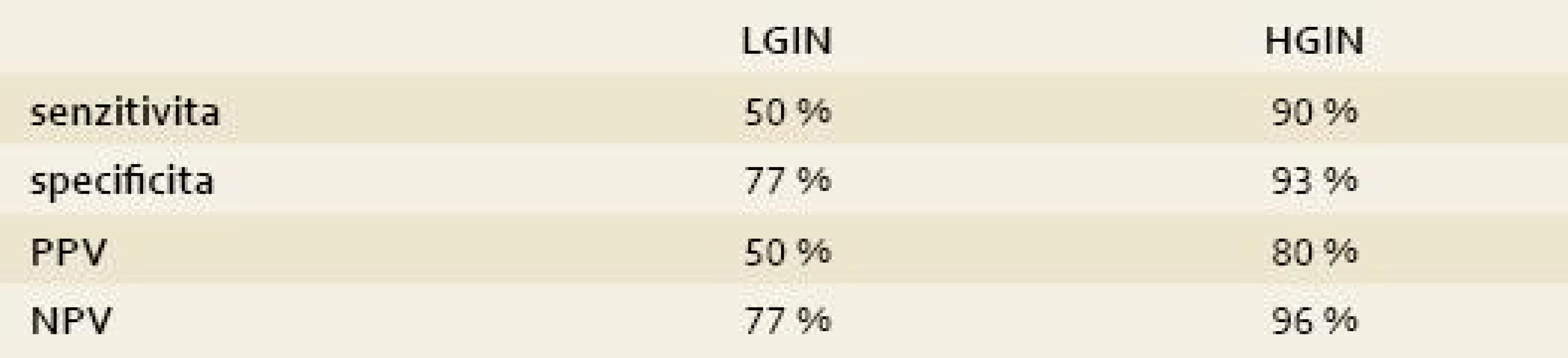
PPV = pozitivní prediktivní hodnota; NPV = negativní prediktivní hodnota AFI byla pozitivní u sedmi pacientů s EAC a HGIN (7/8) a u sedmi pacientů s LGIN (7/14, 50 %). Na druhou stranu AFI byl falešně pozitivní u sedmi pacientů, u kterých se intraepiteliální neoplazie z AFI pozitivních okrsků nepotvrdila (7/31). Senzitivita AFI pro detekci HGIN v naší studii byla 90 %, specificita 93 %, pozitivní prediktivní hodnota (PPV) byla 80 % a negativní prediktivní hodnota byla 96 %. Senzitivita AFI pro detekci LGIN byla 50 %, specificita 77 %, PPV 50 % a NPV 77 %.
Diskuze
Cílem pravidelné dispenzarizace pacientů s Barrettovým jícnem je časná detekce BORN. Vzhledem k současnému rozvoji a možnostem terapeutické endoskopie obzvláště endoskopické resekce (ER) a radiofrekvenční ablace (RFA) a ústupu od radikálních chirurgických výkonů u časných adenokarcinomů je kladen velký důraz na precizní diagnostiku BORN. Podle některých současných multicentrických studií mají endoskopické zobrazovací metody NBI, HRE a AFI větší význam v diagnostice EAC a HGIN [9]. Diagnostika EAC a HGIN je v těchto studiích udávána až 100 % oproti 61 % při použití standardní endoskopie [10].
Naše studie je první prospektivní studií zabývající se přínosem AFI v cílené diagnostice LGIN u pacientů s BJ. Velké multicentrické studie diagnostiku LGIN pomocí AFI ve velké míře opomíjejí. Existují studie, které se zabývají pouze přínosem NBI v diagnostice LGIN a poukazují na nízkou senzitivitu tohoto vyšetření [11]. Diagnóza LGIN je u pacientů s BJ zásadní pro další intenzivní sledování pacientů, protože riziko vzniku adenokarcinomu u těchto pacientů je vyšší než u nedysplastického BJ [4].
Image 4. Výsledky cílených biopsií z AFI pozitivních okrsků u pacientů s HGIN/EAC . Fig. 4. Results of targeted biopsies from AFI-positive areas in patients with HGIN/EAC. 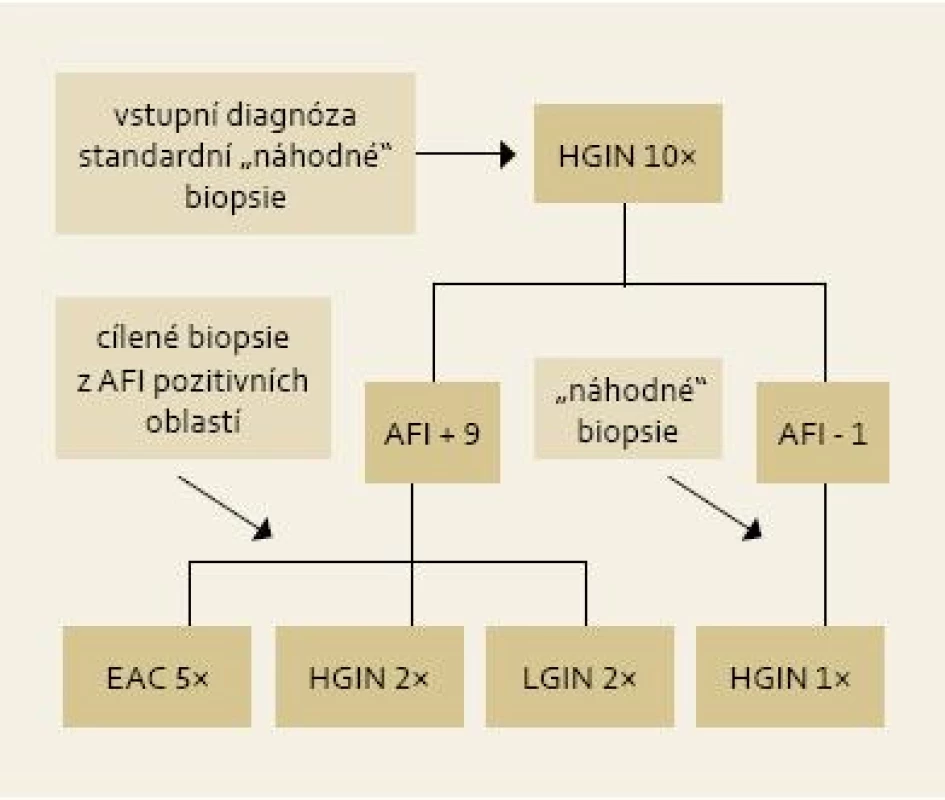
Image 5. Výsledky cílených biopsií z AFI pozitivních lézí u pacientů s LGIN. Fig. 5. Results of targeted biopsies from AFI-positive area in patients with LGIN. 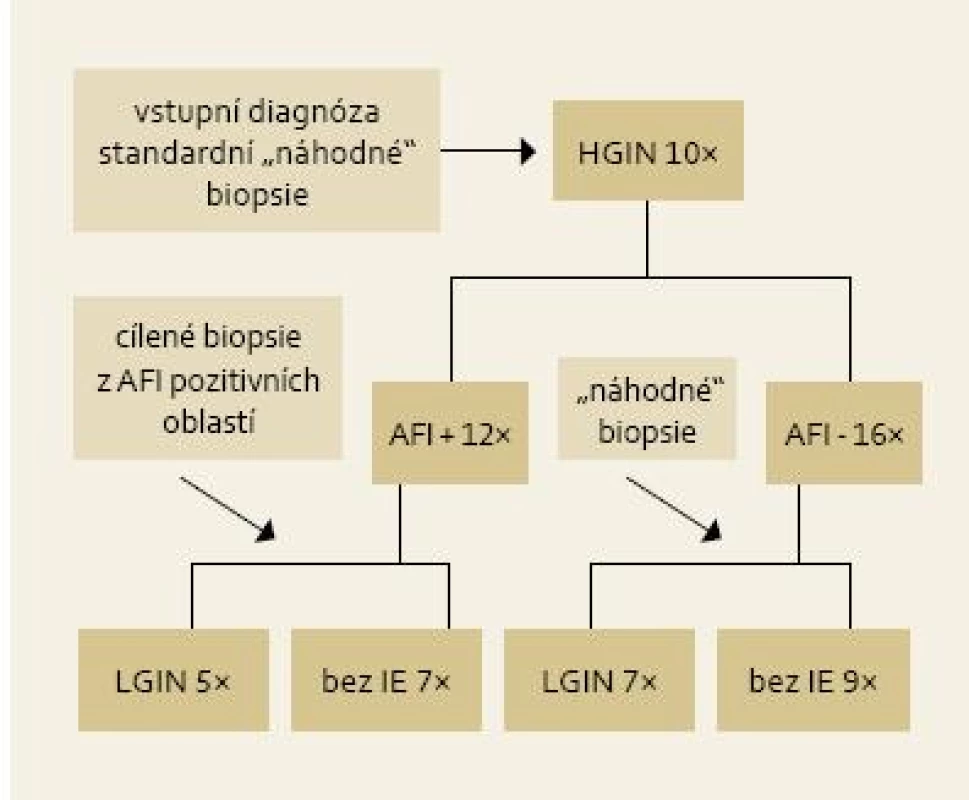
Patologické oblasti s LGIN nejsou ve většině případů při vyšetřování standardní endoskopií makroskopicky patrné a použití NBI nedokáže odlišit vaskulární abnormality v metaplastickém epitelu s LGIN [12] na rozdíl od oblastí s HGIN a EAC, kde mohou být viditelné prominence, a v obraze NBI jsou ve většině případů patrné vaskulární abnormality [10]. Pozitivita AFI v diagnostice HGIN/EAC je téměř 100 % [9] (obr. 6,7).
Image 6. AFI zobrazení intramukózního karcinomu. Fig. 6. AFI of intramucosal carcinoma. 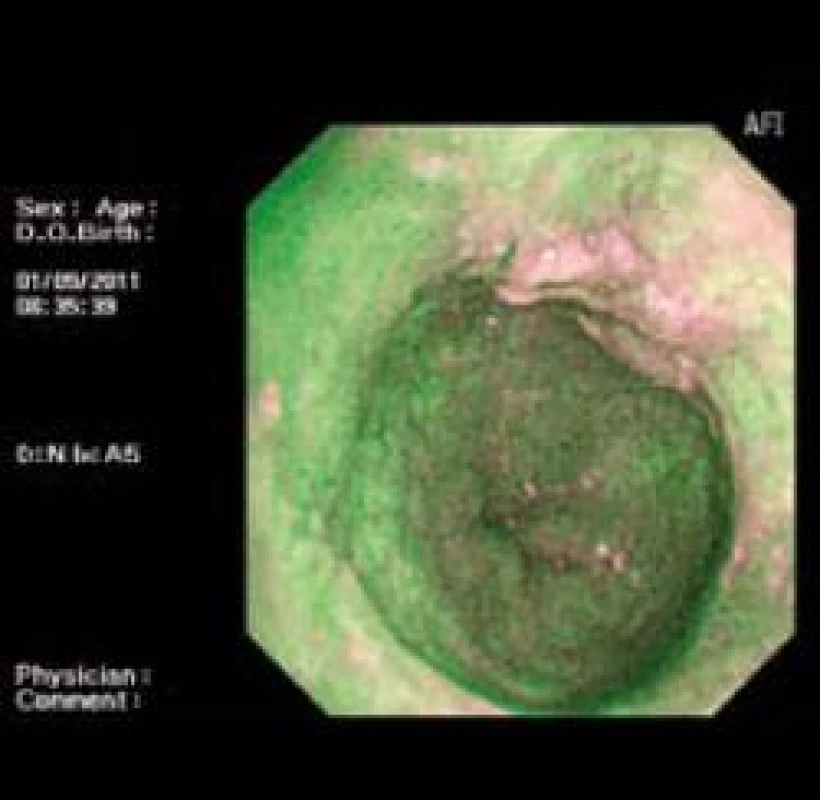
Image 7. Pozitivní AFI zobrazení skutečné LGIN. Fig. 7. Positive AFI with LGIN. 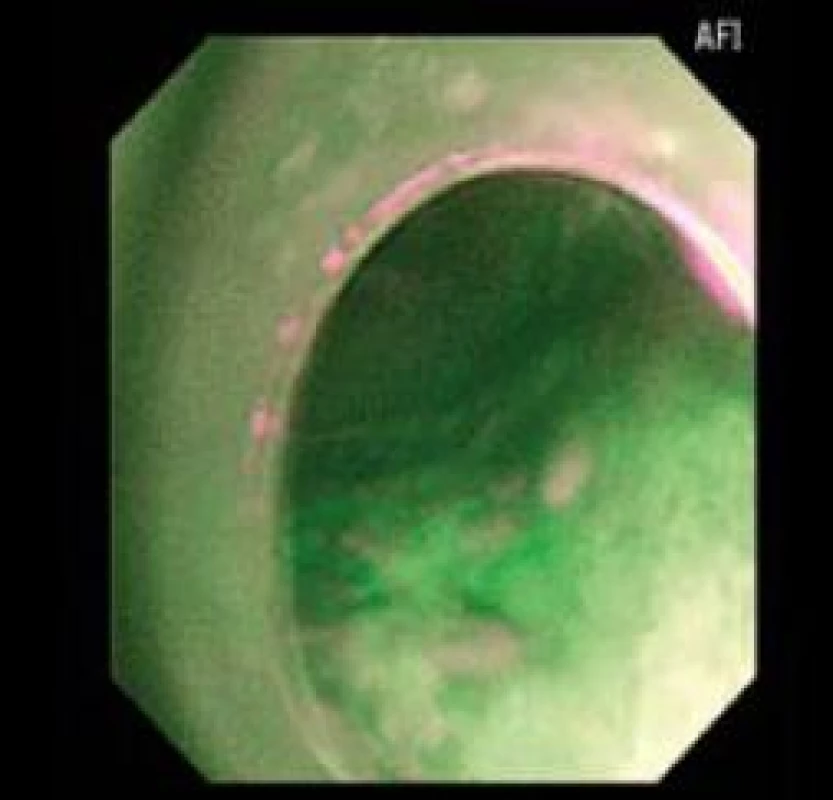
Z výsledků naší studie vyplynulo, že AFI bylo pozitivní pouze u sedmi pacientů s definitivní diagnózou LGIN, což je jen 50 %. Naopak u sedmi pacientů z celkového počtu 31, u kterých definitivní diagnóza nepotvrdila intraepiteliální neoplazii (23 %), bylo AFI falešně pozitivní.
U sedmi pacientů s definitivní diagnózou LGIN bylo AFI vyšetření negativní a NBI rovněž nepotvrdilo žádné vaskulární abnormality. Diagnóza byla potvrzena ze standardních „náhodných“ biopsií. Vysokému procentu falešné pozitivity jsme se nevyvarovali ani při současném použití HRE a NBI.
Endoskopie s AFI vyžaduje jistou míru praxe vzhledem k tomu, že dochází k neustálému problikávání světelného filtru. Je nutné vědět, že okraje dlaždicového epitelu a zbytky hlenu někdy problikávají růžově až fialově, a tím mohou imitovat suspektní oblast s BORN (obr. 8).
Image 8. Falešně pozitivní AFI u nedysplastického BJ. Fig. 8. Falsely positive AFI with non-dysplastic BJ. 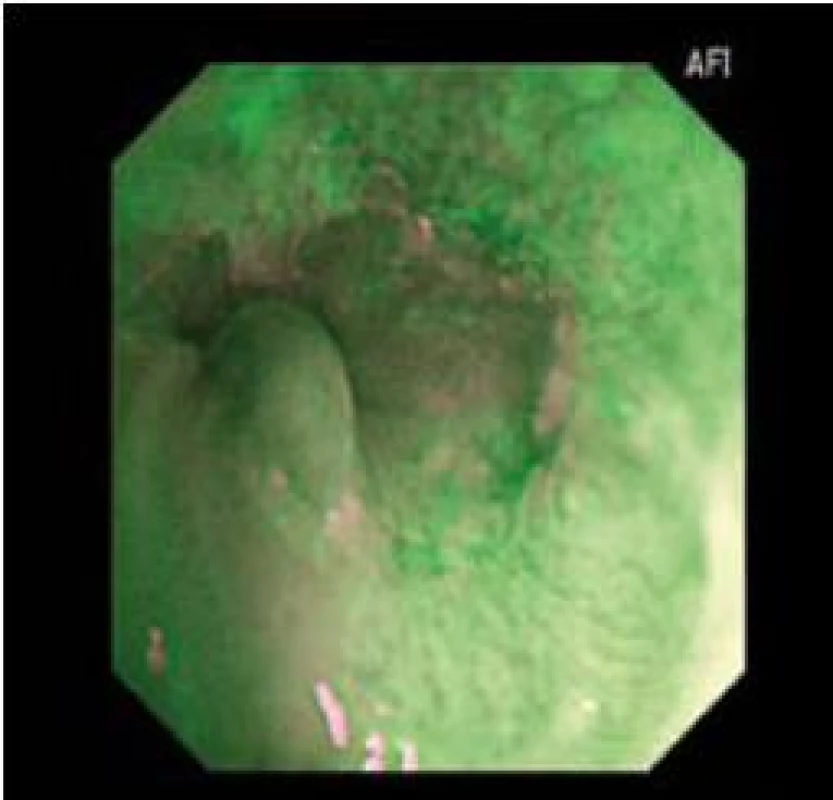
Pro zmenšení procenta falešné pozitivity bylo AFI vyšetření prováděno jen dvěma zkušenými lékaři. Na vysokou falešnou pozitivitu AFI poukazuje i studie holandských kolegů zabývající se diagnostikou HGIN a EAC, ve které je doporučováno použití AFI a NBI v jednom sezení. Při současném použití NBI při endoskopickém vyšetření dochází ke zmenšení procenta falešné pozitivity AFI [13].
Naše studie dále poukázala na fakt, že definitivní diagnóza LGIN byla potvrzena jen u čtrnácti pacientů, z toho dvanáct pacientů mělo vstupní diagnózu LGIN a u dvou pacientů byla vstupní HGIN překlasifikována na LGIN. Definitivní diagnóza LGIN byla tedy potvrzena pouze u 47 % pacientů se vstupní diagnózou LGIN. Z tohoto výsledku plyne značné nadhodnocení diagnózy LGIN u pacientů s BJ. Potvrdit diagnózu LGIN v metaplastickém epitelu BJ není snadné, často je těžké odlišení zánětlivých a reparativních změn od změn již dysplastických, a proto by měla být diagnostika LGIN u pacientů s BJ potvrzena patologem specialistou na gastrointestinální onemocnění. Zejména tehdy, pokud se u takového pacienta plánuje endoskopická léčba. Na tento fakt poukazuje i studie, která porovnává shodu v diagnóze LGIN u pacientů s BJ odečtenou obecným patologem a specialistou zabývajícím se gastrointestinální tematikou [14]. V této studii byla shoda v diagnóze LGIN potvrzena pouze u 50 % pacientů. Výsledek zmíněné práce stejně jako výsledky naší práce poukazují na nadhodnocení diagnózy LGIN u pacientů s BJ. Riziko maligního zvratu u pacientů s LGIN není přesně stanoveno. Je třeba vědět, že LGIN může až u dvou třetin regredovat do nedysplastického stavu, ale i přes tuto skutečnost je nutná pečlivá diagnostika a sledování pacientů s LGIN [4]. Správná diagnostika LGIN je zásadní pro další dispenzarizaci.
Ve srovnání s prací Curverse et al, která sledovala 99 pacientů se vstupní diagnózu LGIN a porovnávala definitivní diagnózu EAC, HGIN, LGIN ze standardních „náhodných biopsií“ a biopsií ze suspektních okrsků zachycených pomocí AFI, HRE a NBI, jsme v naší studii zachytili méně makroskopicky suspektních oblastí [15]. Curves et al zachytili s pomocí AFI a NBI o 22 makroskopicky suspektních oblastí více při AFI vyšetření v porovnání se standardní endoskopií. Nicméně definitivní diagnóza EAC, HGIN, LGIN byla prakticky shodná jako při odběru standardních „náhodných“ biopsií. V naší studii pozitivní AFI, HRE a NBI oblasti byly vizualizovány u 21 pacientů z celkového počtu 38. Ve zbylých případech byla definitivní diagnóza stanovena na základě standardních „náhodných“ biopsií.
Ve shodě s ostatními multicentrickými světovými studiemi jsme i my prokázali vysoký záchyt HGIN a EAC s pomocí AFI [10]. Senzitivita AFI v diagnóze HGIN a EAC byla 90 %, specifita 93 %. Ani v jednom případě nebylo AFI vyšetření falešně pozitivní v diagnostice HGIN a EAC. Abychom zmenšili falešnou pozitivitu AFI, vždy jsme současně použili i NBI [11]. Pouze v jednom případě nebyla patrná žádná viditelná léze či patologická vaskulární struktura a AFI vyšetření bylo negativní. Diagnóza HGIN byla v tomto případě potvrzena standardními kvadrantovými biopsiemi.
Hlavní přínos kombinace AFI vyšetření společně s NBI a HRE je dán v jeho vysoké senzitivitě v diagnostice a HGIN/EAC. V případě pozitivity AFI vyšetření, která je potvrzena i patologickou cévní kresbou či strukturální nerovností v NBI obraze, již neodebíráme biopsie a pacienta rovnou indikujeme k ER.
Z výsledků naší studie vyplývá, že AFI není přínosná pro detekci LGIN u pacientů s Barrettovým jícnem. Senzitivita a prediktivní pozitivní hodnota cílených biopsií při AFI vyšetření je nízká. Velkým úskalím AFI v diagnóze LGIN je vysoké procento falešné pozitivity.
I přes negativní výsledek naší práce vyšetřujeme všechny pacienty s BJ trimodálním endoskopem. Hlavním důvodem je včasný záchyt EAC/HGIN. Nezanedbatelným důvodem je též skutečnost, že při tomto pečlivém vyšetřování stráví endoskopista více času v jícnu. Vyšetření provádí zkušení lékaři s plastikovým „capem“ na konci endoskopu a po důkladném oplachu. Minimální doba prohlížení metaplastického epitelu BJ je 7 min. Domníváme se, že precizní prohlížení metaplastického epitelu a správný odběr bioptických vzorků může přispět k vyšší diagnostice BORN.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Doručeno/Submitted: 28. 9. 2011
Přijato/Accepted: 3. 10. 2011
MUDr. Magdalena Stefanová
Interní klinika 1. LF UK a ÚVN
U Vojenské nemocnice 1200
169 02 Praha 6
magdalena.stefanova@uvn.cz
Sources
1. Riddell RH, Odze RD. Definition of Barrett's esophagus: time for a rethink--is intestinal metaplasia dead? Am J Gastroenterol 2009; 104(10): 2588–2594.
2. American Gastroenterological Association, Spechler SJ, Sharma P et al. American Gastroenterological Association medical position statement on the management of Barrett's esophagus. Gastroenterology 2011; 140(3): 1084–1091.
3. Martinek J, Suchanek S, Stefanová M et al. Radiofrekvenční ablace Barrettova jícnu. Současný stav a první vlastní zkušenosti. Folia gastroent hepatol 2009; 7(3–4): 105–111.
4. Martínek J, Beneš M, Brandtl P et al. Low incidence of adenocacinoma and high-grade intraepithelial neoplasia in patients with Barrett´s esophagus: a prospective cohort study. Endoscopy 2008; 40(9): 711–716.
5. Hamamoto Y, Endo T, Nosho K et al. Usefulness of narrow-band imaging endoscopy for diagnosis of Barrett's esophagus. J Gastroenterol 2004; 39(1): 14–20.
6. Uedo N, Iishi H, Tatsuta M et al. „A novel videoendoscopy system by using autofluorescence and reflectance imaging for diagnosis of esophagogastric cancers“. Gastrointest Endosc 2005; 62(4): 521–528.
7. Curvers WL, Herrero LA, Wallace MB et al. Endoscopic tri-modal imaging is more effective than standard endoscopy in identifying early-stage neoplasia in Barrett's esophagus. Gastroenterology 2010; 139(4): 1106–1114.
8. Filip M, Iordache S, Săftoiu A et al. Autofluorescence imaging and magnification endoscopy. World J Gastroenterol 2011; 17(1): 9–14.
9. Mannath J, Subramanian V, Hawkey CJ et al. Narrow band imaging for characterization of high grade dysplasia and specialized intestinal metaplasia in Barrett's esophagus: a meta-analysis. Endoscopy 2010; 42(5): 351–359.
10. Kara MA, Bergman JJ. Autofluorescence imaging and narrow-band imaging for the detection of early neoplasia in patients with Barrett's esophagus. Endoscopy 2006; 38(6): 627–631.
11. Wang KK, Okoro N, Prasad G et al. Endoscopic evaluation and advanced imaging of Barrett's esophagus. Gastrointest Endosc Clin N Am 2011; 21(1): 39–51.
12. Sharma P, Bansal A, Mathur S et al. The utility of a novel narrow band imaging endoscopy system in patients with Barrett's esophagus. Gastrointest Endosc 2006; 64(2): 167–175.
13. Kara MA, Peters FP, Ten Kate FJ et al. Endoscopic video autofluorescence imaging may improve the detection of early neoplasia in patients with Barrett's esophagus. Gastrointest Endosc 2005; 61(6): 679–685.
14. Pech O, Vieth M, Schmitz D et al. Conclusions from the histological diagnosis of low-grade intraepithelial neoplasia in Barrett's oesophagus. Scand J Gastroenterol 2007; 42(6): 682–688.
15. Curvers WL, van Vilsteren FG, Baak LC et al. Endoscopic trimodal imaging versus standard video endoscopy for detection of early Barrett's neoplasia: a multicenter, randomized, crossover study in general practice. Gastrointest Endosc 2011; 73(2): 195–203.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2011 Issue 5-
All articles in this issue
- Natural Orifice Transluminal Endoscopic Surgery (NOTES) – současný stav, vlastní zkušenosti
- Eozinofilní ezofagitida
- Radiofrekvenční ablace v gastrointestinálním traktu – aktuální stav ve světě a v ČR
- Prognostické faktory a načasovanie endoskopie u akútneho nevarikózneho krvácania z horného gastrointestinálneho traktu
- Spontánní retroperitoneální perforace vzestupného tračníku a trombóza portálního řečiště u pacienta s ulcerózní kolitidou
- Za profesorkou MUDr. Dagmar Hauftovou, CSc.(2. 6. 1927–18. 7. 2011)
- Globální problémy s financováním zdravotní péče
- Biologická léčba IBD 2011
- Tento štát nie je pre lekárov
- Společnost gastrointestinální onkologie vás zve na I. národní kongres o kolorektálním karcinomu
- Bude naše cesta bez vizí?
- Vítejte na palubě
- Přínos autofluorescence v diagnostice lehké intraepiteliální neoplazie u pacientů s Barrettovým jícnem
- Dvojí tvář rakoviny jícnu – epidemiologie a etiologie
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Eozinofilní ezofagitida
- Dvojí tvář rakoviny jícnu – epidemiologie a etiologie
- Radiofrekvenční ablace v gastrointestinálním traktu – aktuální stav ve světě a v ČR
- Prognostické faktory a načasovanie endoskopie u akútneho nevarikózneho krvácania z horného gastrointestinálneho traktu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

