-
Medical journals
- Career
Jak postupovat v případě nálezu karcinomu v endoskopickém resekátu z tlustého střeva a rekta?
Authors: P. Vítek 1,2; I. Kajzrlíková 2; J. Chalupa 2; V. Hořava Jr. 3; A. Hájek 4
Authors‘ workplace: Lékařská fakulta, Ostravská Univerzita, Ostrava2Beskydské gastrocentrum, Interní oddělení, Nemocnice ve Frýdku-Místku, p. o. 3Oddělení patologie, Nemocnice ve Frýdku-Místku, p. o. 4Chirurgicko-traumatologické oddělení, Nemocnice ve Frýdku-Místku, p. o. 1
Published in: Gastroent Hepatol 2011; 65(4): 202-206
Category: Endoscopy: Review Article
Overview
Nález invazivního karcinomu v endoskopickém resekátu musí vést endoskopistu ke kompletní evaluaci histologických a endoskopických parametrů léze, osobního rizika nemocného a případného operačního rizika. Ve většině případů je dostatečná endoskopická resekce případně doplněna lokálními ablačními technikami a následným sledováním. Chirurgická resekce zůstává volbou pro nemocné s nízkým operačním rizikem a nepříznivými histologickými a endoskopickými charakteristikami léze.
Klíčová slova:
endoskopie – trávicí systém – resekce – kolorektální karcinomVzhledem k vysoké úspěšnosti metod endoskopické resekce v léčbě časných neoplazií tlustého střeva a rekta se v posledních letech endoskopisté častěji setkávají s histopatologickým nálezem invazivního karcinomu uvnitř resekátu. V minulosti byla na základě tohoto nálezu velmi často bez dalších klinických rozvah indikována následná chirurgická resekce pro obavy z recidivy tumoru, případně z jeho možných metastáz v lymfatických uzlinách. Toto sdělení je zaměřeno na rozbor základních kritérií, na kterých je postavena rozvaha a stanovení další strategie léčby u těchto nemocných.
V případě nálezu karcinomu v resekátu je pro optimální stanovení dalšího postupu rozhodující správně vyhodnotit rizika recidivy či progrese neoplazie u nemocného a porovnat je s riziky dalšího invazivního řešení (endoskopického či chirurgického). Nezbytné je také přesně posoudit rizika nekurativní terapie. Recidiva neoplazie či její lokální progrese může být u části nemocných v budoucnu opět kurativně řešena endoskopicky nebo chirurgicky. K správné evaluaci rizik se zaměřujeme na posouzení následujících parametrů: histologické a endoskopické charakteristiky léze, komorbidity nemocného, typ a rizika případného endoskopického a operačního výkonu.
Histologické parametry léze
Klíčové je správné posouzení histologického preparátu dle revidované Vídeňské klasifikace gastrointestinálních neoplazií (tab. 1) [1]. Pro tlusté střevo a rektum platí, že pouze nález submukózně invadujícího karcinomu (kategorie 5) přináší riziko možného vzniku lymfatických metastáz. V popisech patologů jsou stále užívány termíny jako „karcinoma in situ“ nebo „intramukózní karcinom“ přesto, že by měly být pro posuzování rizika lymfatických metastáz řazeny zásadně do kategorie 4 jako ekvivalenty high-grade dysplazie. K těmto lézím je tedy třeba přistupovat jako k lokální neoplazii bez možnosti šíření mimo lumen střeva.
Table 1. Revidovaná Vídeňská klasifikace gastrointestinálních epiteliálních neoplazií. Tab. 1. The revised Vienna classification of gastrointestinal epithelial neoplasia. 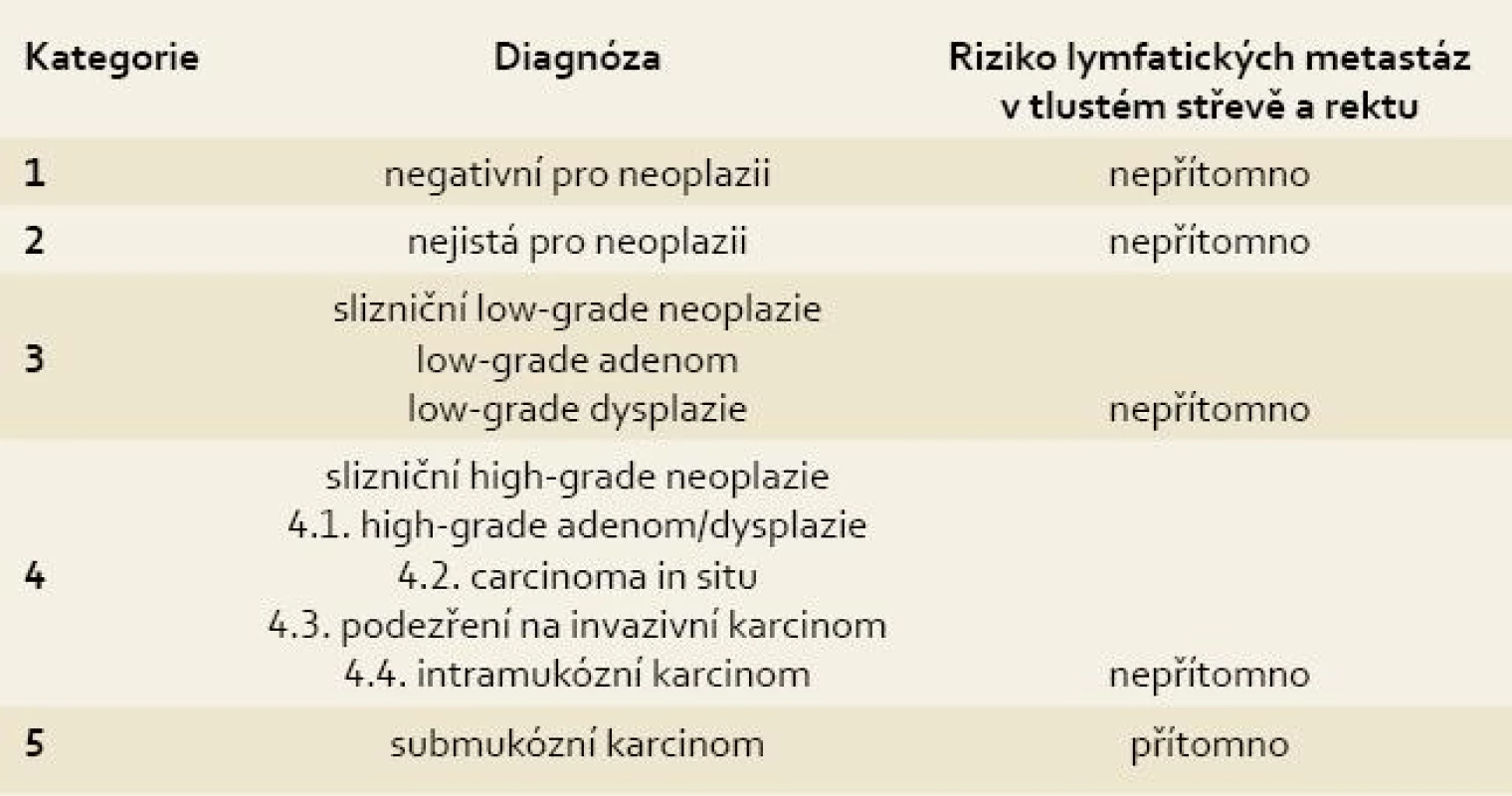
V případě submukózně invadujícího karcinomu (kategorie 5) je riziko metastáz v lymfatických uzlinách závislé na hloubce invaze neoplazie do submukózy. Při invazi pouze do svrchních vrstev submukózy (sm1, < 1000 µm) je riziko metastáz do 1 % [2]. Při hluboké submukózní invazi pak pravděpodobnost vzrůstá až na 23 % [3,4]. Pro klinickou praxi je velmi přínosné, pokud patolog dokáže v preparátu hloubku invaze změřit a dokumentovat (obr. 1). Toto měření samozřejmě může být nepřesné především v případech, kdy endoskopista nesprávně označil bázi resekátu.
Image 1. Dobře diferencovaný karcinom se submukózní invazí 520 μm (sm1). Fig. 1. Well-differentiated carcinoma with submucosal invasion 520 μm (sm1). 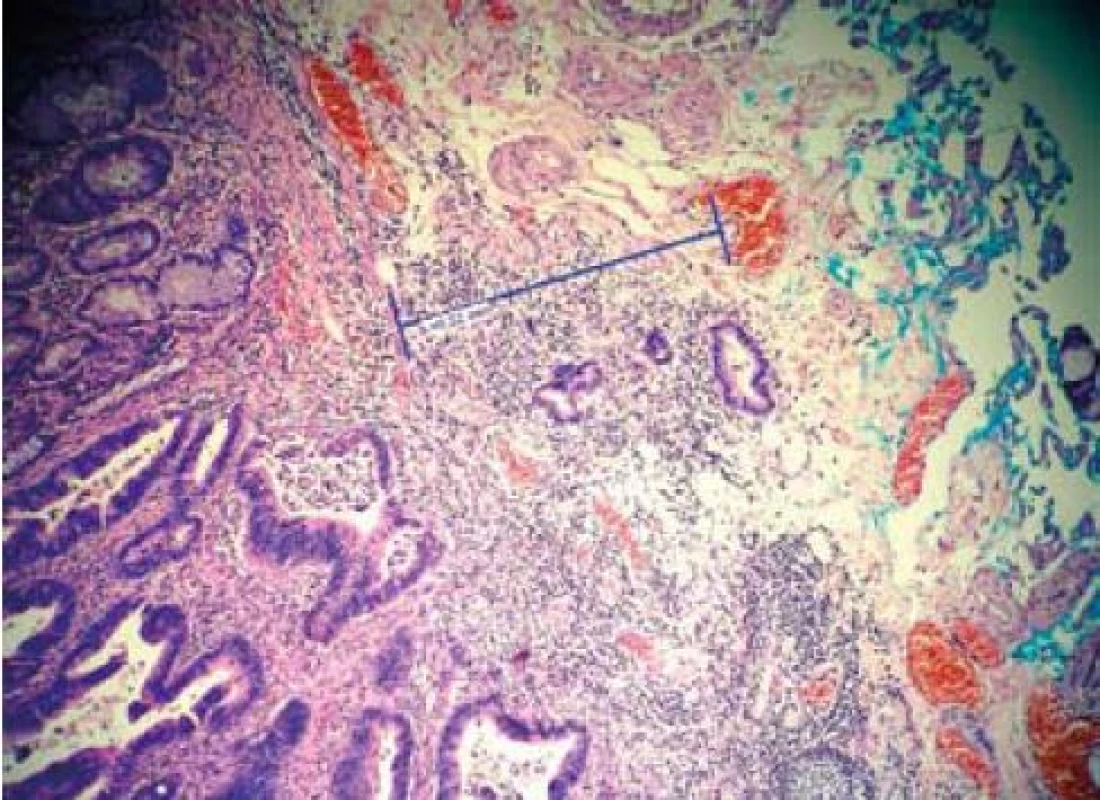
Další nepříznivé histopatologické znaky zahrnují nízký stupeň diferenciace, přítomnost lymfangioinvaze (obr. 2) a infiltraci resekční linie preparátu karcinomem. Resekční linie může být změněna koagulačním proudem, proto jsou na rozsah bezpečného lemu bez karcinomu v okolí resekce různé názory. Někteří autoři vyžadují 1–3 mm, jiným stačí čistá resekční linie [5,6]. Ko et al v souboru 38 nemocných s histologicky pozitivní resekční linií, avšak endoskopicky hodnocenou kompletní resekcí, neprokázali při dvouletém sledování žádnou recidivu ani vzdálenou metastázu [7]. V novějších pracích se objevuje nový nepříznivý patologický parametr pro predikci lymfatických metastáz kolorektálního karcinomu, tzv. „tumor budding“ (pučení tumoru). Jedná se o ztrátu koheze epiteliálních buněk a mesenchymální dediferenciaci buněk na okraji karcinomu [8]. Rutinní posuzování tohoto histologického parametru není v ČR zatím zavedeno. Histologické rizikové znaky a jejich prognostický význam jsou uvedeny v tab. 2. V přítomnosti příznivých znaků je riziko recidivy karcinomu dle recentních dat Winawera v současnosti velmi nízké a je odhadováno na 0,6 % u polypoidních (Ip) a na 1,6 % u přisedlých (Is) karcinomů [9].
Image 2. Lymfagioinvaze – struktury karcinomu patrné uvnitř lymfatické cévy – viz šipka. Fig. 2. Lymphatic vessel invaded by carcinoma – see arrow. 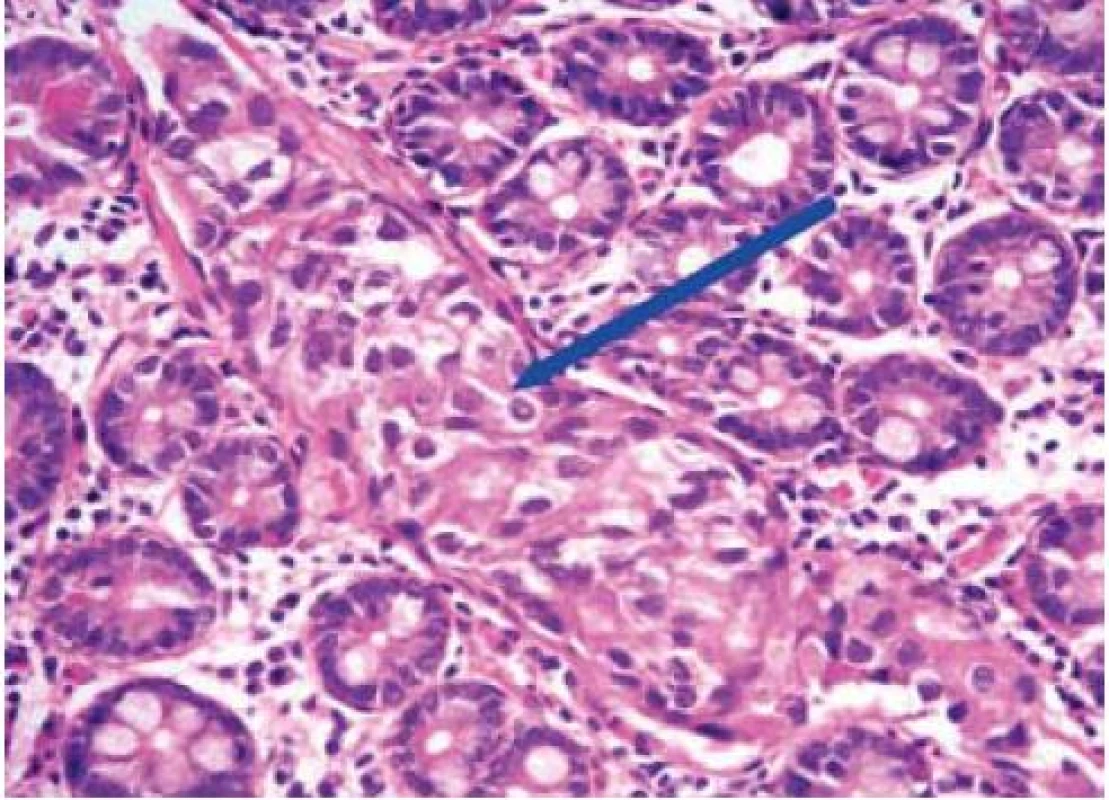
Table 2. Histologické rizikové znaky v resekátu. Tab. 2. Histopathological risk criteria in specimen. 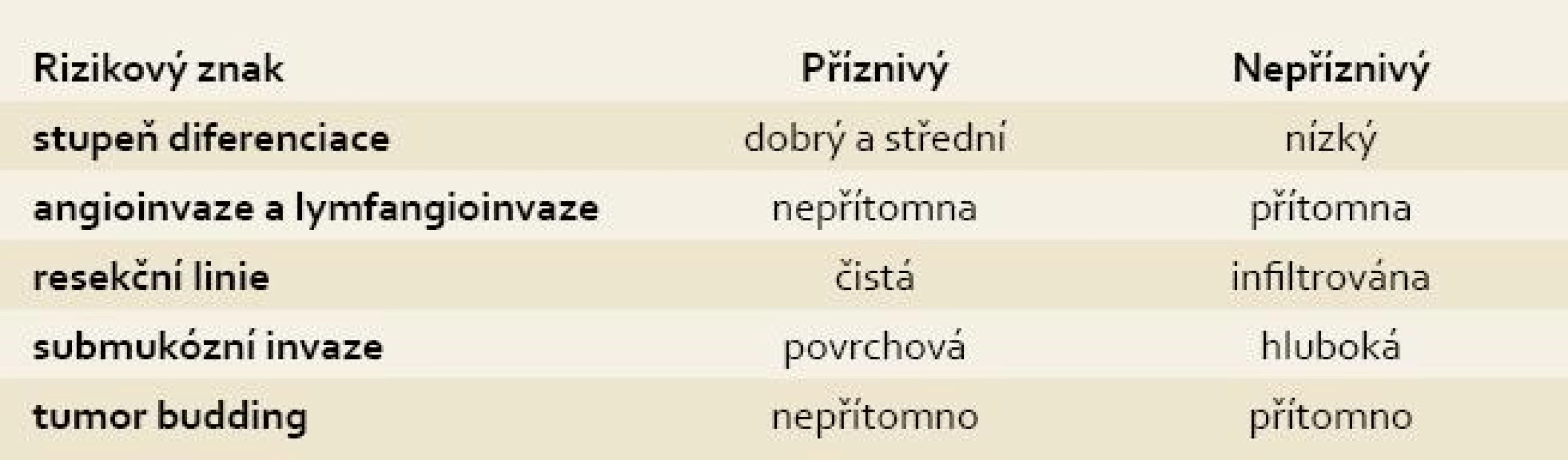
Endoskopické parametry léze
U pacientů průměrného rizika je malignizovaný polyp nebo plošná léze nálezem relativně vzácným a nepřesahuje počet 1 % kolonoskopií [10]. Nejspolehlivějším prediktorem rizika invazivního karcinomu je velikost léze [11]; z makroskopického vzhledu léze je riziková morfologie 0-IIc u plochých lézí a pokročilé invazivní typy pit pattern (IIIs a V). Cílem endoskopické léčby je kompletní odstranění neoplazie metodou endoskopické resekce. Nejčastěji používanou metodou je v případě stopkatého polypu endoskopická polypektomie, v případě přisedlého polypu či ploché léze metody endoskopické mukózní resekce či endoskopické submukózní disekce a jejich varianty [12]. Pokud nepoužíváme metodu endoskopické submukózní disekce, jejíž použití v tlustém střevě a rektu je v ČR doposud výjimečné [13], pak u endoskopické mukózní resekce lézí větších než 20 mm provádíme obvykle resekci po částech [14] (obr. 3,4). Pro histopatologické vyšetření je pak nezbytná extrakce a mikroskopická evaluace „nejpokročilejších“ částí léze (obr. 5), kterými jsou obvykle její vkleslá, nebo naopak vyvýšená část [4].
Image 3. Endoskopická resekce kličkou po částech. Fig. 3. Endoscopic piecemeal resection, lift-and-cut by snare. 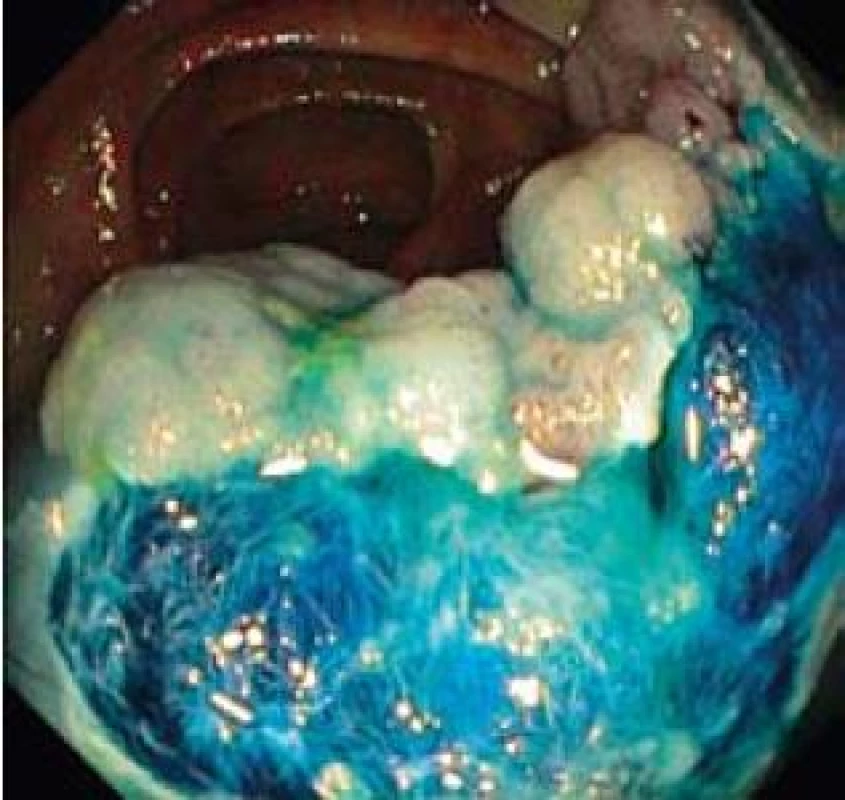
Image 4. Endoskopická resekce kličkou po částech. Fig. 4. Endoscopic piecemeal resection, lift-and-cut by snare. 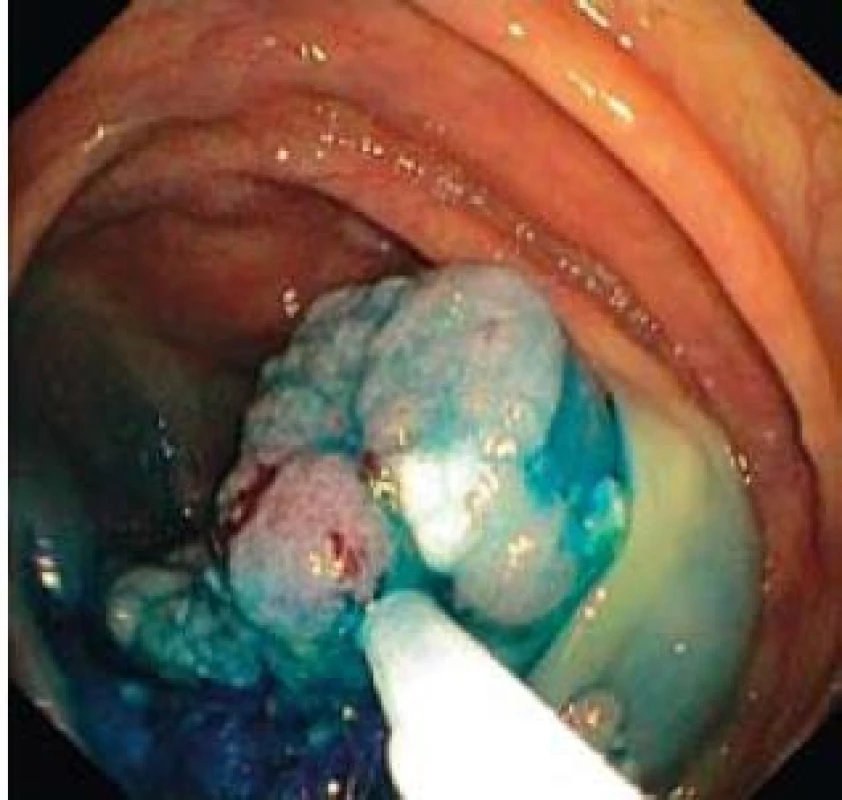
Image 5. Fixace podstatných částí resekátu. Fig. 5. Fixation of substantial parts of resected specimen. 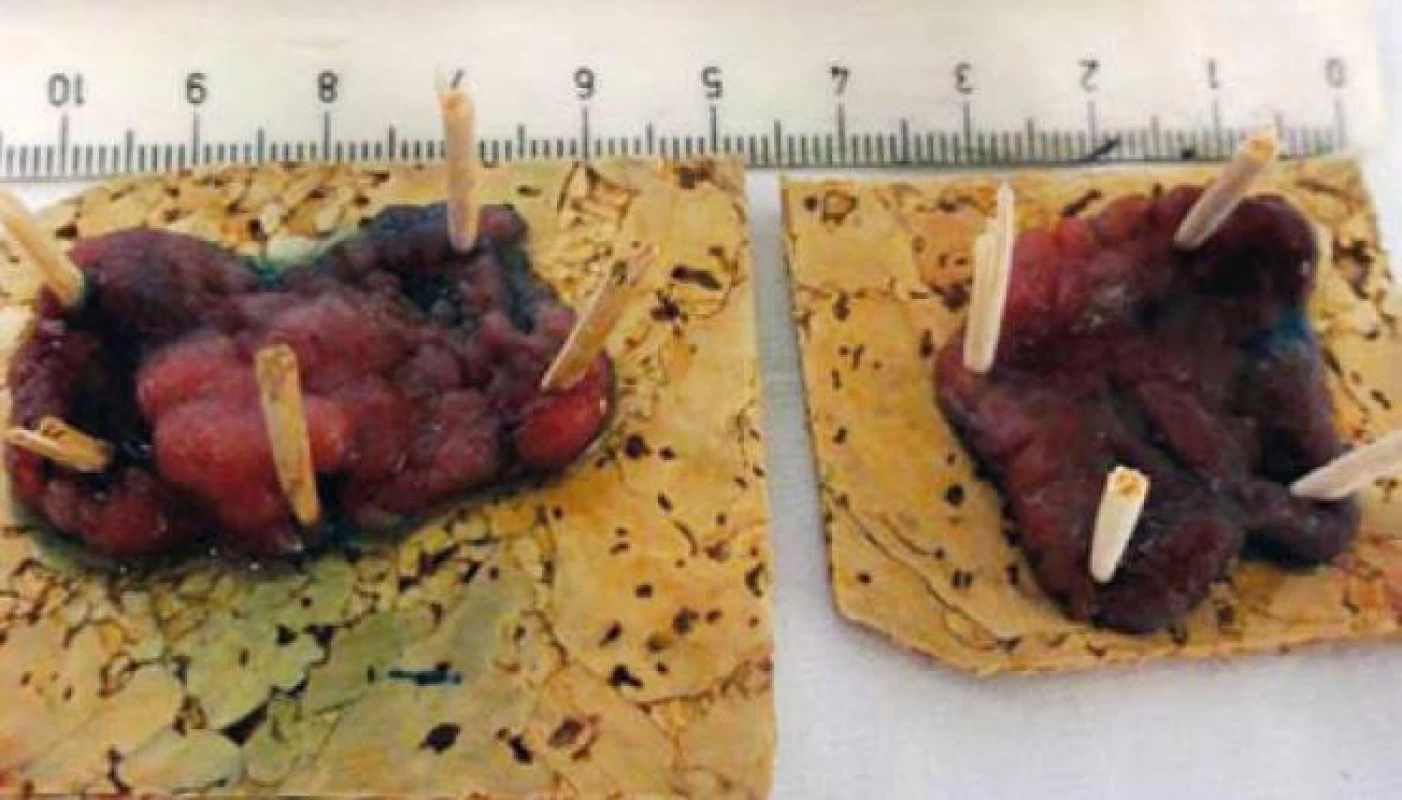
K posouzení resekability lézí s plošnou komponentou je v tlustém střevě a v rektu rutinně používána přítomnost elevace léze po submukózní injekci fyziologického roztoku (tzv. „lifting sign“) (obr. 6) [15]. K přesnému posouzení hloubky invaze před endoskopickou léčbou lze rovněž úspěšně použít ultrazvukové miniproby [16]. Po provedení výkonu je třeba zhodnotit, zda bylo kompletní odstranění karcinomu (resekce R0). To je obvykle možné jednoznačně prohlásit pouze při en-bloc resekci. V případě resekcí po částech je rozhodující, jestli byla alespoň provedena R0 resekce karcinomu uvnitř adenomatózní léze. K tomuto posouzení nám může velmi pomoci analýza provedených endoskopických snímků spodiny po resekci (obr. 7), nebo bezprostředně odebrané klešťové biopsie ze spodiny léze. Pokud má endoskopista podezření na možnost invazivního karcinomu v resekátu, je také výhodné označit místo v tlustém střevě tetováží pro orientaci endoskopisty při následující kontrole a chirurga při případné resekci. Pro plánování další strategie léčby a dispenzarizace je samozřejmě důležitá lokalizace neoplazie (endoskopicky invazivnější postupy lze při případném ošetření recidivy obvykle dobře uplatnit v rektu, hůře pak v proximálním tlustém střevě).
Image 6. Příznak liftingu léze po submukózní injekci fyziologického roztoku. Fig. 6. Positive lifting sign after submucosal injection of saline. 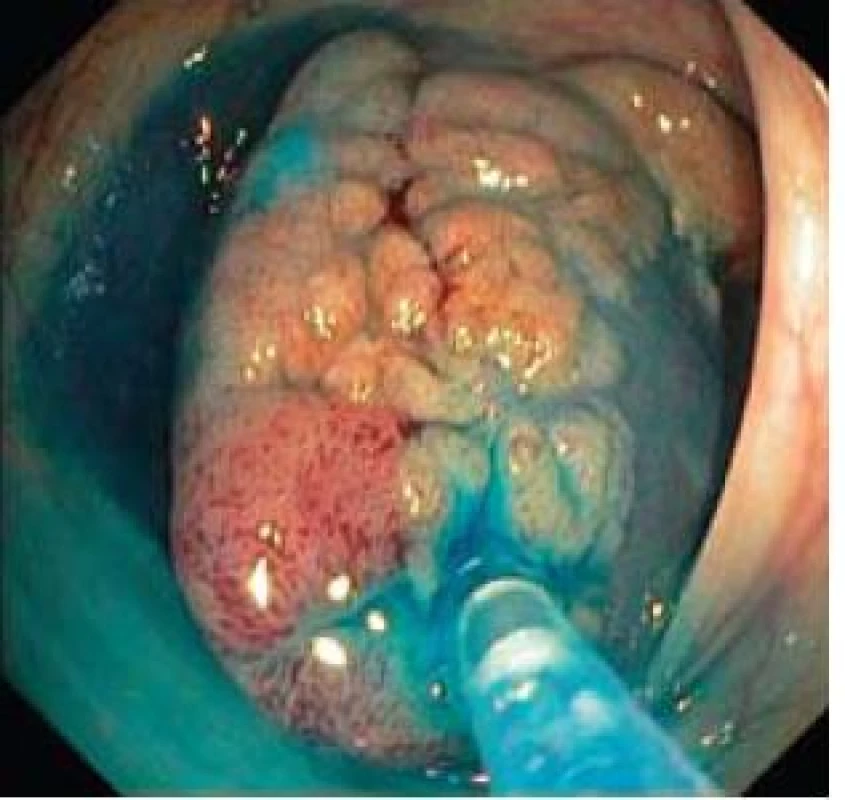
Image 7. Spodina po kompletní endoskopické resekci. Fig. 7. Resection base after complete endoscopic resection. 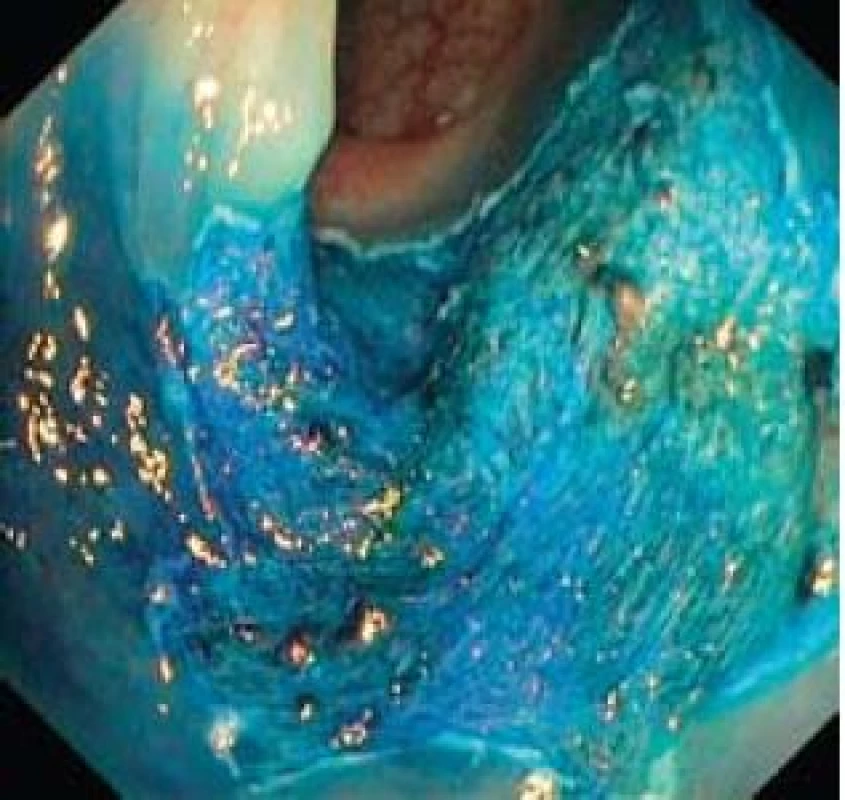
Rizika operačního výkonu a komorbidity nemocného
Resekce tlustého střeva a rekta pro kolorektální karcinom jsou výkony s nezanedbatelnou morbiditou a mortalitou. Tyto výkony jsou Evropskou kardiologickou společností řazeny mezi operace se středním kardiovaskulárním rizikem s 30denní kardiovaskulární mortalitou 1–5 % [17]. Mortalita resekce u padesátiletého nemocného bez dalších komorbidit je odhadována na 0,2–2 % [18]. Ve velkém souboru Longa z 90. let byla morbidita kolektomie 28 % a mortalita 5,7 % [19]. Recentní data Hinojosy ukazují pokles pooperační mortality v minulé dekádě až na 1,4 %, morbidita však zůstává stále stejně vysoká [20]. Laparoskopická i klasická operativa má v této indikaci obdobnou mortalitu i morbiditu. Laparoskopická resekce má výhodu menší invazivity a kratšího pobytu v nemocnici, avšak nevýhodou je delší operační čas [21]. Specifickou skupinou s horší prognózou jsou staří nemocní. Faiz et al ve svém souboru 90letých nemocných s elektivní resekcí kolorektálního karcinomu zaznamenali 30denní mortalitu 13 % a roční pak přes 30 % [22]. U všech nemocných s komorbiditami je před endoskopickou nebo chirurgickou léčbou potřeba pečlivě zvážit i rizika předoperačních a peroperačních úprav protidestičkové a antikoagulační terapie [23]. Samostatnou problematikou je nutriční příprava a rehabilitace nemocného před nitrobřišním chirurgickým výkonem a po něm [24].
Osobní riziko nemocného
Specifický postup s důrazem na invazivní řešení a intenzivní pooperační endoskopické a klinické sledování je nutno volit u nemocných z vysokorizikových skupin. Jedná se o nemocné s osobní či rodinnou anamnézou kolorektálního karcinomu, nemocné s Lynchovým syndromem a nemocné se sneseným karcinomem v terénu nespecifického střevního zánětu (obr. 8) [25].
Image 8. Submukózně invadující karcinom dosahující téměř až k resekční linii u pacienta s ulcerózní kolitidou. Fig. 8. Submucosal carcinoma extending close to the resection line in patient with ulcerative colitis. 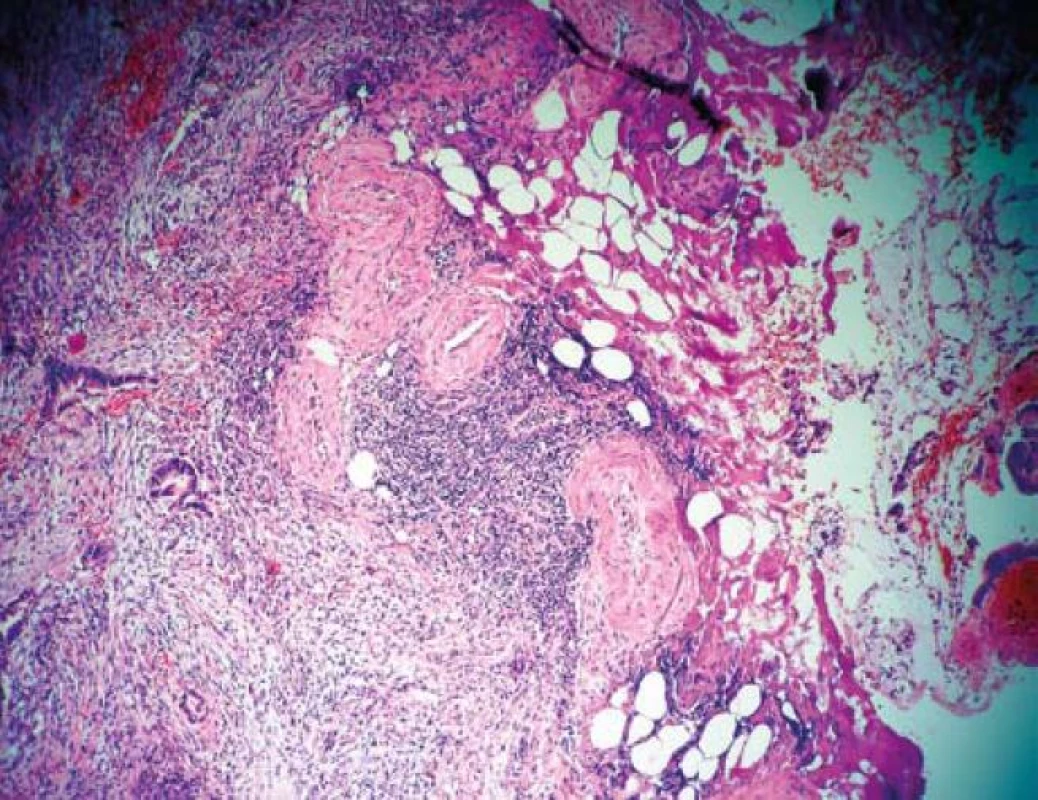
Doporučený klinický postup
Zhodnocení všech rizik a volba dalšího postupu by vždy měla být mezioborovou záležitostí s centrálním postavením endoskopisty-gastroenterologa, který podává nemocnému finální doporučení. Klinický stav nemocného a riziko operačního výkonu by měly být posouzeny internistou (kardiologem), chirurgem a onkologem. Pro přesné objasnění rozsahu provedeného endoskopického výkonu je pak velmi přínosné posouzení fotodokumentace endoskopického výkonu i histopatologického nálezu. Na základě těchto konzultací na našem pracovišti postupujeme následujícím způsobem:
- Nemocní s high-grade dysplazií [synonyma: karcinom in situ, intramukózní karcinom (kategorie 4 dle Vídeňské klasifikace)]: jde o „nepravou maligní lézi“, a proto preferujeme vždy endoskopickou resekci, případně doplněnou lokálními ablativními technikami (argonová plazmakoagulace), a to i v případě recidivy nebo reziduálního ložiska. Chirurgická resekce je indikována pouze tehdy, pokud je endoskopické řešení technicky nemožné a nemocný má současně nízké operační riziko.
- Nemocní s maligními lézemi (T1 karcinomy) s příznivými histologickými a endoskopickými parametry a kompletní endoskopickou (R0) resekcí: preferujeme endoskopickou léčbu a následné endoskopické sledování. Chirurgickou resekci doporučujeme pouze v případech vysokého osobního rizika nemocného a současně nízkého operačního rizika.
- Nemocní s maligními lézemi (T1 karcinomy) s nepříznivými histologickými a endoskopickými parametry a/nebo inkompletní endoskopickou resekcí: preferujeme vždy chirurgickou resekci, pokud ji ovšem umožňuje klinický stav nemocného.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Doručeno/Submitted: 8. 7. 2011
Přijato/Accepted: 25. 7. 2011MUDr. Petr Vítek
Beskydské gastrocentrum Interní oddělení Nemocnice ve Frýdku-Místku, p. o.
El. Krásnohorské 321 738 01 Frýdek-Místek
vitek-petr@seznam.cz
Sources
1. Dixon MF. Gastrointestinal epithelial neoplasia: Vienna revisited. Gut 2002; 51(1): 130–131.
2. Ueno H, Mochizuki H, Hashiguchi Y et al. Risk factors for an adverse outcome in early invasive colorectal carcinoma. Gastroenterology 2004; 127(2): 385–394.
3. Yokoyama J, Ajioka Y, Watanabe H et al. Lymph node metastasis and micrometastasis of submucosal invasive colorectal carcinoma: an indicator of the curative potential of endoscopic treatment. Acta Medica Biologica 2002; 50 : 1–8.
4. Inoue H, Kashida H, Kudo S et al. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002. Gastrointest Endosc 2003; 58 (6 Suppl): S3–43.
5. Cranley JP, Petras RE, Carey WD et al. When is endoscopic polypectomy adequate therapy for colonic polyps containing invasive carcinoma? Gastroenterology 1986; 91(2): 419–427.
6. Sugihara K, Muto T, Morioka Y. Management of patients with invasive carcinoma removed by colonoscopic polypectomy. Dis Colon Rectum 1989; 32(10): 829–834.
7. Ko OB, Byeon JS, Kim MJ et al. The clinical outcome of colonic mucosal cancer with histologically uncertain resection margin after endoscopic resection. Gut 2010; 59 (Suppl III): A418.
8. Prall F. Tumour budding in colorectal carcinoma. Histopathology 2007; 50(1): 151–162.
9. Winawer SJ, O´Brien MJ. Management of malignant polyps. In: Colonoscopy: Principles and Practice 2nd edition Edited by Jerome D Waye Douglas K Rex and Christopher B Williams, Blackwell Publishing Ltd. 2009: 401–411.
10. Lieberman DA, Weiss DG, Bond JH et al. Use of colonoscopy to screen asymptomatic adults for colorectal cancer. Veterans Affairs Cooperative Study Group 380. N Engl J Med 2000; 343(3): 162–168.
11. Winawer SJ, Zauber AG, O‘Brien MJ et al. The National Polyp Study. Design, methods, and characteristics of patients with newly diagnosed polyps. The National Polyp Study Workgroup. Cancer 1992; 70 (5 Suppl): 1236–1245.
12. Urban O, Vítek P, Fojtík P et al. Endoskopická diagnostika a léčba povrchových nepolypózních neoplazií trávicí trubice. Folia Gastroenterol Hepatol 2004; 2(4): 165–173.
13. Urban O, Fojtík P, Kliment M et al. Endoskopická submukózní disekce v léčbě recidivující high-grade neoplazie v rektu. Gastroent Hepatol 2011; 65(2): 80–83.
14. Urban O, Vítek P, Fojtík P et al. Laterally spreading tumors--experience based on 138 consecutive cases. Hepatogastroenterology 2008; 55(82–83): 351–355.
15. Bergmann U, Beger HG. Endoscopic mucosal resection for advanced non-polypoid colorectal adenoma and early stage carcinoma. Surg Endosc 2003; 17(3): 475–479.
16. Urban O, Kliment M, Fojtík P et al. High-frequency ultrasound probe sonography staging for colorectal neoplasia with superficial morphology: its utility and impact on patient management. Surg Endosc 2011; May 18. [Epub ahead of print].
17. Poldermans D, Bax JJ, Boersma E et al. Guidelines for pre-operative cardiac risk assessment and perioperative cardiac management in non-cardiac surgery. Eur Heart J 2009; 30(22): 2769–2812.
18. Wilcox GM, Beck JR. Early invasive cancer in adenomatous colonic polyps („malignant polyps“). Evaluation of the therapeutic options by decision analysis. Gastroenterology 1987; 92 (5 Pt 1): 1159–1168.
19. Longo WE, Virgo KS, Johnson FE et al. Risk factors for morbidity and mortality after colectomy for colon cancer. Dis Colon Rectum 2000; 43(1): 83–91.
20. Hinojosa MW, Konyalian VR, Murrell ZA et al. Outcomes of right and left colectomy at academic centers. Am Surg 2007; 73(10): 945–948.
21. Group COoSTS: A comparison of laparoscopically assisted and open colectomy for colon cancer. N Engl J Med 2004; 350(20): 2050–2059.
22. Faiz O, Haji A, Bottle A et al. Elective colonic surgery for cancer in the elderly: an investigation into postoperative mortality in English NHS hospitals between 1996 and 2007. Colorectal Dis 2010; 13(7): 779–785.
23. Boustiere C, Veitch A, Vanbiervliet G et al. Endoscopy and antiplatelet agents. European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2011; 43(5): 445–461.
24. Šerclová Z, Dytrych P, Marvan J et al. Fast-track in open intestinal surgery: prospective randomized study (Clinical Trials Gov Identifier no. NCT00123456). Clin Nutr 2009; 28(6): 618–624.
25. Vasen HF, Abdirahman M, Brohet R et al. One to 2-year surveillance intervals reduce risk of colorectal cancer in families with Lynch syndrome. Gastroenterology 2010; 138(7): 2300–2306.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2011 Issue 4-
All articles in this issue
- Standard ČGS pro kapslovou endoskopii tenkého střeva
- Jak postupovat v případě nálezu karcinomu v endoskopickém resekátu z tlustého střeva a rekta?
- Nový jednoduchý uzávěr gastrotomie typu loop-and-clip („King’s closure“) využitelný při NOTES výkonech v experimentu
- Autoimunitní pankreatitida u pacientky s Crohnovou nemocí
- Jednobalonová enteroskopie u nemocných s Crohnovou chorobou – zkušenosti jednoho centra
- Léčba jaterního selhání při Wilsonově chorobě
- Professor C. Mulder, guest at the 5th International Endoscopy Workshop in Hradec Králové
- 12th Endoscopic day in IKEM
- Jsme stále průkopníky screeningu kolorektálního karcinomu? Zpráva ze zasedání WEO/OMED/IDCA Colorectal Cancer Screening Committee
- XXXIXth may hepatologic days
- Rozhovor s čerstvým šedesátníkem prof. MUDr. Václavem Mandysem, CSc.
- Vďaka pánu profesorovi Vavrečkovi!
- Od Dítěte ke Špičákovi
- Digestivní endoskopie odborně, prakticky a ekonomicky
- Postavení a výtěžnost koloskopie v rámci screeningového programu založeného na testu na okultní krvácení (TOK) ve stolici
- Trénink endoskopických metod na neživém prasečím modelu – hodnocení účastníky
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Standard ČGS pro kapslovou endoskopii tenkého střeva
- Autoimunitní pankreatitida u pacientky s Crohnovou nemocí
- Jak postupovat v případě nálezu karcinomu v endoskopickém resekátu z tlustého střeva a rekta?
- Léčba jaterního selhání při Wilsonově chorobě
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

