-
Medical journals
- Career
Doporučení pro vakcinaci nemocných s Crohnovou chorobou a ulcerózní kolitidou na imunosupresivní a biologické léčbě
: J. Stehlík 1; K. Mareš 2; M. Lukáš 3; M. Bortlík 3; D. Ďuricová 3; Pracovní Skupina Pro Idiopatické Střevní Záněty Čgs
: Interní oddělení, Masarykova nemocnice, Ústí nad Labem 1; Interní oddělení Nemocnice na Homolce, Praha 2; ISCARE IVF a. s. a 1. LF UK v Praze 3
: Gastroent Hepatol 2010; 64(1): 40-48
: IBD
Nemocní s Crohnovou chorobou a ulcerózní kolitidou, kteří jsou léčeni imunosupresivy nebo biologickou léčbou, jsou ve významně vyšším riziku vzniku infekčních komplikací. Proto je u těchto pacientů nutná komplexní péče, která je zaměřená na prevenci, časnou detekci a cílenou léčbu těchto potenciálně závažných komplikací. Vakcinace v době stanovení diagnózy idiopatického střevního zánětu, nebo před zahájením imunosupresivní nebo biologické léčby nabývá mimořádné významnosti. Klinický význam má očkování proti hepatitidě B, lidskému papilomaviru, varicele zoster, chřipce a pneumokoku. Očkování živou vakcínou je možné provést za tři měsíce po ukončení imunosupresivní nebo biologické léčby. Imunosupresivní nebo biologická léčba může být zahájena nejdříve za tři týdny po provedeném očkování živou vakcínou. Zmíněná doporučení vycházejí z konsenzu Pracovní skupiny pro střevní záněty ČGS a z doporučení mezinárodní organizace ECCO.
Klíčová slova:
Crohnova nemoc – ulcerózní kolitida – idiopatické střevní záněty – očkování – biologická terapie – imunosupresivní léčbaMedikamentózní léčba pacientů s idiopatickými střevními záněty (IBD), Croh-novou nemocí a ulcerózní kolitidou prodělala v posledních deseti letech přímo revoluční změnu. Kromě kortikosteroidů jsou v mnohem větší míře a časněji zařazována do léčebných schématů imunosupresiva, především thiopuriny (azathioprin a 6-merkaptopurin) a methotrexát. Od roku 1999 se v evropských zemích zavedla biologická léčba, nejprve infliximabem a později také adalimumabem. Jde o léčiva struktury imunoglobulinů, která jsou zaměřena proti tumor nekrozujícímu faktoru α (TNF α), důležitému mediátoru zánětlivé reakce ve tkáních. Tato nová léčba je spojena s velmi rychlým a dramatickým nástupem protizánětlivých účinků, jež se dostavují v řádech několika hodin po aplikaci léčiva [1]. V klinické praxi odpovídá na biologickou terapii cca 80 % dospělých a přes 90 % dětských pacientů [2–3]. Polovina z nich je po zavedení indukční fáze v klinické, laboratorní a endoskopické remisi. Efektivita obou léčiv je srovnatelná [4–5], i když klinické zkušenosti a indikační spektrum jsou větší u infliximabu. Jde o léčebnou strategii, která nepochybně významně posunula naše léčebné možnosti, avšak problém vzniku recidivujícího průběhu střevních zánětů nevyřešila. Navíc je spojena s postupnou ztrátou účinnosti a možnými vedlejšími a nežádoucími účinky [6–7]. Vznik infekčních komplikací, včetně oportunních infekcí v důsledku imunosupresivního účinku, patří z klinického hlediska k nejzávažnějším vedlejším dopadům této léčby. Pacienty na imunosupresivní, biologické a/nebo kombinované léčbě je nutné trvale monitorovat a poskytnout jim komplexní péči zaměřenou na prevenci, časnou detekci a cílenou léčbu vzniklých infekčních komplikací. To si dobře uvědomuje většina specialistů, kteří s biologickou a imunosupresivní terapií u těchto pacientů pracují. Důsledkem toho je vytvoření konsenzu Pracovní skupiny pro idiopatické střevní záněty, kterého bylo postupně dosaženo při opakovaných jednáních v průběhu roku 2009. Definitivní verze byla prezentována gastroenterologické obci v rámci Českého gastroenterologického kongresu v Praze v prosinci 2009. Na mezinárodním poli se touto problematikou zabývala v posledních dvou letech zvláštní skupina odborníků ustanovená v organizaci ECCO (European Crohn´s Colitis Organisation) a vzniklá doporučení byla opakovaně prezentována na kongresech ECCO v Lyonu v roce 2008 a v Hamburku v roce 2009 a publikována v časopisu JCC (Journal of Crohn´s & Colitis) v roce 2009 [8]. Problematika vakcinace je pouze jednou částí komplexní péče zaměřené na prevenci, detekci a časnou léčbu komplikací při imunosupresivní a biologické léčbě. Další doporučení budou publikována v následujících číslech tohoto časopisu.
Efektivitu opatření s cílem minimalizovat infekční komplikace při biologické léčbě je možné demonstrovat na případu mykobakteriálních infekcí v evropské populaci. V roce 2001 se zcela neočekávaně objevily případy tuberkulózních infekcí, z nichž polovina byla extrapulmonálních a miliárních [9]. Vypočtená prevalence tuberkulózy u nemocných na biologické léčbě byla stanovena na 110–120 případů na 100 000 léčených pacientů, tedy mnohonásobně vyšší, než je výskyt v naší a západoevropské populaci (5–15 případů na 100 000 obyvatel). Po zavedení screeningu na latentní tuberkulózu je výskyt v populaci IBD pacientů na biologické léčbě minimální a nepřevyšuje počty v běžné populaci.
Ve spojení s imunokompromitovanými IBD pacienty léčenými imunosupresivy a/nebo biologickou léčbou bývá uváděn dlouhý seznam možných oportunních infekcí [10]. Jde o virová onemocnění jako je hepatitida B a C, herpetické viry – cytomegalovirus (CMV), herpes simplex (HSV 1, 2, 6), varicella zoster virus (VZV), virus Epstein-Barrové (EBV), dále lidský papilomavirus (HPV), polyoma virus (JC) a viry chřipky. Vzácné, avšak mimořádně závažné jsou bakteriální infekce způsobené Streptococcem pneumonie, Legionellou pneumophillou, Salmonelou, Listerií monocytogenes, Nocardií a nejčastěji z nich se vyskytující Clostridium difficile. Dalšími infekčními agens je možné se infikovat při cestách do zahraničí. Ne vždy jsou možná preventivní opatření a ne vždy má smysl je provádět. Proti některým infekcím však existují očkovací látky. Cílem sdělení je zmínit nejvýznamnější infekce a možnosti očkování.
Imunokompetence a imunosuprese
Podle mezinárodních doporučení [11] je možné vyčlenit tři skupiny imunokompromitovaných pacientů:
- těžce imunokompromitované osoby s vrozenou imunodeficiencí, leukémií, lymfomem, generalizovanou malignitou nebo pacienty na cytostatické léčbě antimetabolity, při aplikaci radioterapie nebo při léčbě vysokými (pulzními) dávkami kortikosteroidů
- osoby se získanou nebo vrozenou HIV infekcí
- pacienti s částečným imunodeficitem, jako je hyposplenismus, ledvinné selhání a další stav
Pacienty s IBD na imunosupresivní a/nebo biologické léčbě zařazujeme do první skupiny.
Oportunní infekce
Za oportunní infekci považujeme takovou, která je vážná, často progredující, způsobená mikroorganizmem, který má za obvyklých podmínek omezenou nebo téměř žádnou patogenní kapacitu, ale který je schopen u imunodeficitního jedince způsobit závažné onemocnění [12]. U pacientů s Crohnovou chorobou a ulcerózní kolitidou, kteří nejsou léčeni vysokými dávkami kortikoidů, nemají imunosupresivní ani biologickou léčbu, nebyl nikdy potvrzen významný defekt obrany proti infekci (imunodeficience). Tento stav u nich vzniká vlivem intenzivní medikamentózní terapie, svůj podíl má také vysoká aktivita nemoci a progredující malnutrice.
Rizikové faktory pro vznik oportunní infekce
Ve zvýšeném riziku vzniku oportunní infekce jsou všichni pacienti léčení imunosupresivní léčbou, zvláště pak ti na kombinované léčbě zahrnující dva a více imunosupresivně působících preparátů [13]. Významná malnutrice (BMI < 20 kg/m2) a vyšší věk (nad 50 ro-ků) jsou dalším nezávislými faktory pro vznik oportunní infekce [14–15].
Dalšími používanými preparáty v terapii IBD s imunosupresivním účinkem jsou kortikoidy, thiopuriny (azathioprin, 6-merkaptopurin), methotrexát, calcineurinové inhibitory (ciclosporin, tacrolimus), anti-TNF alfa preparáty a jiné biologické léky. V případě kortikoidů je dávka ≥ 20 mg/d prednisolonu po dobu nejméně dvou týdnů asociována se zvýšeným rizikem infekčních komplikací. I přes rozdílný mechanizmus účinků mezi jednotlivými imunosupresivními preparáty neexistuje přesná korelace mezi typem léku a určitým druhem infekce a každý z těchto léků může vést k jakékoli infekci. V praxi pozoru-jeme, že léčba kortikosteroidy je častěji spojena s mykotickými (kandidovými) infekcemi; léčba azathiopri-nem s virovými infekcemi a léčba anti-TNFα preparáty s intracelulárními (mykobakteriální, listeriové, histoplasmové), mykotickými a virovými infekcemi. K podobným závěrům dospěli Toruner et al [13] ve studii z Mayo kliniky. Jak jsme již uvedli, imunosupresivní efekt se u kombinované léčby kumuluje a relativní riziko oportunní infekce stoupá exponenciálně. U jednoho preparátu je asi třikrát vyšší (OR 2,9; 95 % CI 1,5–5,3), u kombinace dvou a více se zvyšuje více než čtrnáctkrát (OR 14,5, 95 % CI 4,9–43) [13].
Obecné principy
Očkování a očkovací látky
V České republice je očkování upraveno vyhláškou 537/2006 Sb., ve které je stanoveno členění a podmínky očkování a pasivní imunizace, způsoby vyšetřování imunity. Souhrnně lze říci, že rozlišujeme očkování povinné a nepovinné. Povinné je stanoveno očkovacím kalendářem a dále podmínkami při cestách do zahraničí a výše uvedenou vyhláškou. V rámci očkovacího kalendáře, poslední úprava je z března 2009 (tab. 1), je většina populace očkována v dětském věku. Pro dospělý věk zůstává přeočkování proti tetanu, očkování proti virovým hepatitidám a proti lidskému papilomaviru.
1. Očkovací kalendář platný v ČR (od března 2009) – obecná verze. Tab. 1. Vaccination schedule valid in Czech Republic from March 2009 – general version. 
Očkovací látky mohou mít podobu inaktivované (usmrcené) vakcíny, živé atenuované (oslabené) vakcíny a subjednotkové vakcíny získané přirozenou izolací nebo syntetické peptidové (epitopové) vakcíny s rekombinantně připravenými antigeny a DNA vakcíny. Důležité je, že pro některá onemocnění existuje více typů vakcín. Typy očkovacích látek shrnuje tab 2.
2. Typy očkovacích látek. Tab. 2. Types of vaccines. 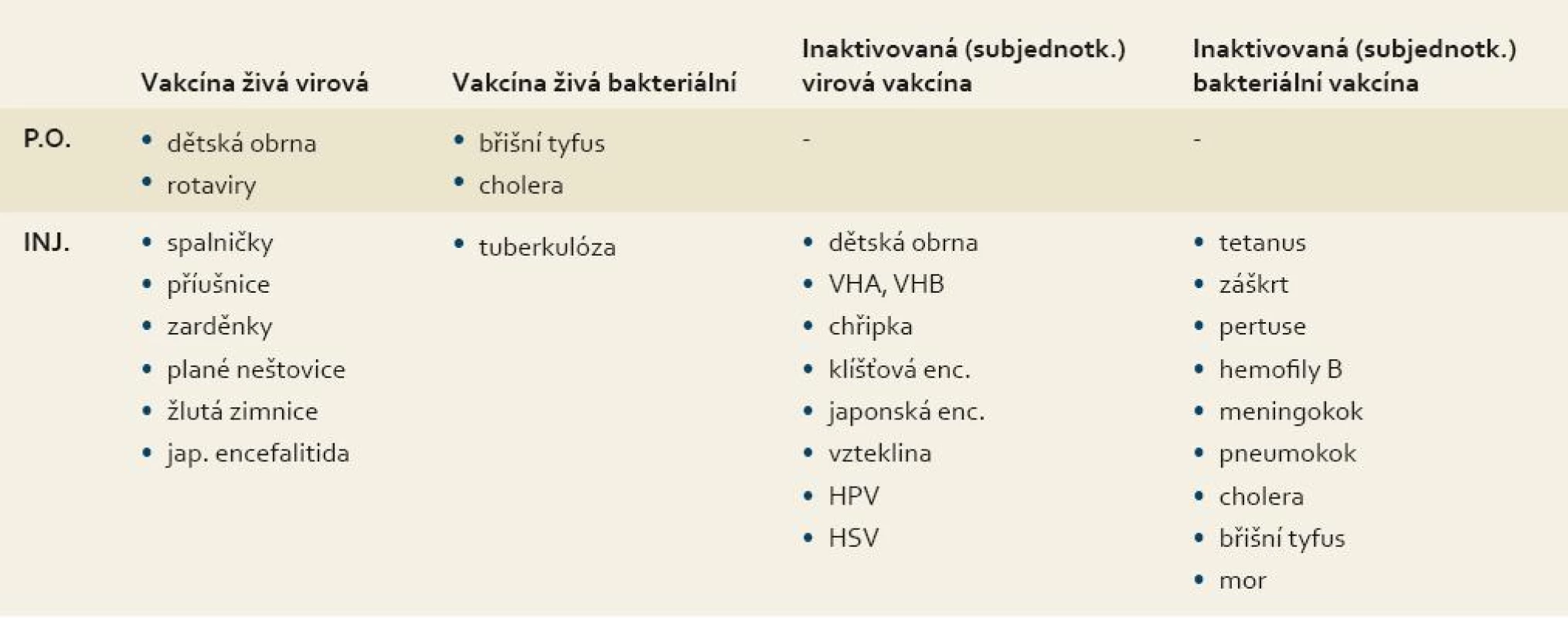
Očkování imunosuprimovaných pacientů
Asi 40–60 % nemocných s idiopatickými střevními záněty se během svého života dočká medikamentózní léčby, která ovlivňuje imunitní systém. Nejčastěji užívanými léky, které ovlivňují imunitní systém, jsou stále kortikoidy. Očkování imunosuprimovaných pacientů má určitá specifika. V naší zemi není stanoven oficiálně doporučený postup ani jej neupravuje žádná vyhláška. Před volbou imunoprofylaxe pro daného jedince je nutno posoudit, zda se imunosupresivní léčba plánuje, nebo je již zavedená, jaká bude intenzita a délka doby imunosuprese, dále je nutno zvážit, jaká jsou rizika onemocnění, prospěch a rizika očkování, eventuálně plánované cesty do zahraničí. Je také třeba zhodnotit předešlé zkušenosti s použitím imunologických přípravků u konkrétního pacienta. Obecně platí, že inaktivované vakcíny a anatoxiny lze podávat imunokompromitovaným pacientům podobně jako zdravým jedincům. Živé vakcíny (virové i bakteriální) jsou však v průběhu imunosupresivní terapie kontraindikovány. Očkování živou vakcínou je možné provést až za tři měsíce po ukončení imunosupresivní nebo biologické léčby a za dva až čtyři týdny po přerušení kortikoterapie. V případě plánovaného zahájení imunosupresivní nebo biologické léčby, může být tato podána až tři týdny po očkování živou vakcínou. Musíme mít na zřeteli i možnost přenosu infekce na nemocného při očkování osob příbuzných či blízkých.
Je potřeba zdůraznit, že efekt vakcinace může být u pacientů na imunosupresivní terapii změněný. Často dochází k tomu, že tvorba protilátek je snížená a při přeočkování bývá tzv. „booster efekt“ nedostatečný. Proto se u těchto pacientů doporučuje odložit vakcinaci o dva až čtyři týdny po přerušení imunosupresivní léčby, nebo sérologicky ověřit titry protilátek anebo plánovaně posílit očkování a přeočkovat dávkou navíc.
Speciální situace
Infekce viry sezónní chřipky
Pacienti s imunosupresivní léčbou mají zvýšené riziko onemocnět sezónní chřipkou. Je doporučeno pravidelné preventivní očkování polyvalentní (trivalentní) subjednotkovou vakcínou jednou ročně. Vliv imunosupresivní a biologické terapie na očkování proti virům chřipky je v současné době nejednoznačný. Některé práce prokazují, že efektivita očkování není změněna u pacientů léčených imunosupresivní terapií [16], jiné práce zase svědčí pro negativní vliv imunosupresivní a biologické léčby na účinnost očkování [17–18]. Doporučuje se očkovat nejméně dva týdny před blížící se vlnou infekce. Při pozdním očkování se u vysoce rizikových osob podávají dva až čtyři týdny profylakticky také antivirotika (amantadin nebo rimantadin).
Infekce virem chřipky A (H1N1)
V současnosti se zdá, že většina případů onemocnění virem chřipky A (H1N1) má nekomplikovaný průběh, s kašlem a horečkou jako nejčastějšími přízna-ky. Z prozatímních pozorování vyplývá, že děti a mladí dospělí jsou více náchylní k infekci virem H1N1 než starší osoby [19]. Těhotné ženy a pacienti s přidruženými onemocněními respiračního traktu, kardiálním onemocněním, diabetem, obezitou nebo imunosuprimování jedinci mají zvýšené riziko rozvoje komplikací při infekci virem H1N1 [19–21].
Strategie prevence infekce virem H1N1
Evropská léková agentura (EMEA) povolila autorizaci dvou vakcín proti viru chřipky A (H1N1) – Focetria, Pandemrix. Jde o neživou vakcínu, předpokládá se její bezpečnost i u imunokompromitovaných pacientů podobně jako u vakcíny proti viru sezónní chřipky. Avšak vzhledem k nedostatku informací ohledně bezpečnosti a účinnosti těchto vakcín je nadále potřebná monitorace jejích účinnosti a bezpečnosti.
- Pacienti s IBD bez imunosupresivní nebo biologické terapie: tito pacienti se obecně nepovažují za imunokompromitované a vakcinace proti viru H1N1 by se měla řídit dle doporučení pro běžnou populaci [22].
- Pacienti na imunosupresivní nebo biologické terapii: doporučuje se co nejčasnější vakcinace proti viru H1N1. Vakcinace proti viru sezónní chřipky nechrání proti viru H1N1, avšak vzhledem k riziku nákazy tímto typem viru je vakcinace taktéž doporučena u všech imunokompromitovaných pacientů. Dále je doporučena pneumokoková vakcinace, která by mohla snížit riziko komplikací při nákaze virem H1N1 u této rizikové imunokompromitované populace [22].
- Antivirová chemoprofylaxe po expozici virem H1N1 (blízký kontakt s osobou s prokázanou nebo pravděpodobnou infekcí virem H1N1): virus H1N1 je citlivý na neuraminidasové inhibitory – oseltamivir (Tamiflu) a zanamivir (Relenza). Není známa interakce mezi neuraminidasovými inhibitory a preparáty určenými pro léčbu IBD. Možné zvýšení plazmatických hladin bylo pozorováno jenom v případě methotrexatu při současném podávaní oseltamiviru (oba léky jsou metabolizovány podobnou cestou). In vitro studie však prokazují minimální efekt této interakce, bez klinických důsledků při léčbě nízkými dávkami methotrexatu jako v případě IBD [23].
- Pacienti s IBD bez imunosupresivní nebo biologické terapie: profylaktické podávaní antivirotik není doporučeno [22].
- Pacienti na imunosupresivní nebo biologické terapii: doporučeno podávaní antivirotik: oseltamivir (75 mg 1× denně) nebo zanamivir (inhalace â 5 mg 2× denně); antivirová profylaxe by měla být zahájená do 48 hod po expozici a podávaná po dobu deseti dnů.
Profylaktické podávaní antivirotik v případě, že pacient nebyl vystaven expozici H1N1, se nedoporučuje [22].
Léčba potvrzené nebo suspektní infekce virem H1N1
- Pacienti s IBD bez imunosupresivní nebo biologické terapie: u nekomplikovaných forem onemocnění se antivirotická terapie nedoporučuje; u těžce probíhajících případů je nutno zahájit časnou antivirovou terapii bez ohledu na imunosupresivní terapii [22].
- Pacienti na imunosupresivní nebo biologické terapii: doporučena antivirová terapie: oseltamivir (75 mg 2× denně) nebo zanamivir (inhalace â 5 mg 2× denně); terapie by měla být zahájená do 48 hod od počátku onemocnění a podávaná po dobu pěti dnů. Některá data u léčby sezonní chřipky ukazují na benefit antivirové terapie i v případě zahájení léčby po 48 hod od počátku onemocnění. U pacientů na kombinované imunosupresivní terapii by se mělo zvážit podávání vyšších dávek oseltamiviru a delší doba léčby. I přes chybějící evidenci se doporučuje dočasné vysazení imunosupresivní terapie, nejméně po dobu symptomatické fáze onemocnění a do 24 hod od ústupu příznaku [22].
Shrnutí
- IBD pacienti na imunosupresivní nebo biologické terapii mají zvýšené riziko komplikací při onemocnění virem chřipky A (H1N1).
- Pacientům na imunosupresivní nebo biologické terapii by měla být aplikována vakcína proti viru sezónní chřipky, viru H1N1 a pneumokoková polysacharidová vakcína.
- Pacienti na imunosupresivní nebo biologické terapii, kteří přišli do kontaktu s osobou s potvrzenou nebo suspektní infekcí virem H1N1, by měli dostat profylaktickou antivirovou terapii.
- Antivirová terapie by měla být zahájena u všech pacientů s infekcí H1N1, kteří jsou na imunosupresivní nebo biologické terapii; u pacientů s IBD bez imunosupresivní terapie jen v případě závažného průběhu.
Virové hepatitidy B a C
HBV infekce
Virus hepatitidy B je hepatotropní DNA virus, který se řadí mezi hepadna viry. Hepatitida může přejít z akutní v chronickou u perinatálně získané infekce až u 90 % případů, v dospělosti získaná infekce přechází v chronickou infekci v 5–10 % akutních onemocnění [24]. Aktivní infekce je charakterizovaná virovou replikací v hepatocytech a následnou imunitní odpovědí proti viru, která vede k nekróze hepatocytů a zánětlivým změnám v jaterním parenchymu. U chronické hepatitidy je v prvních fázích nemoci vysoká virová replikace provázená aktivním onemocněním jater, později je replikace nízká, charakterizovaná remisí jaterní nemoci. Virová replikace může probíhat roky, bez projevů jaterního poškození. HBV-DNA je často detekovatelná v hepatocytech i u pacientů, kteří se uzdravili a nemají projevy chronické hepatitidy [26]. U některých z těchto pacientů lze po letech prokázat stopy HBV-DNA i v periferní krvi [27–28]. Aktivace HBV infekce u pacientů s chronickou hepatitidou odráží zvýšení imunitní odpovědi proti viru. Tím lze vysvětlit spojitost reaktivace virové infekce po vysazení imunosupresivní léčby. Naopak k aktivaci dochází vzácně v průběhu kortikoterapie či imunosuprese. Nicméně, vzplanutí aktivity nemoci při imunosupresivní terapii může být spojeno s rozvojem jaterního selhání.
V současnosti chybí prospektivní data ohledně efektu imunosupresivní terapie na průběh HBV infekce u pacientů s IBD. Proto většina poznatků a doporučení ohledně terapie chronické HBV infekce u imunosuprimovaných pacientů vychází z pozorování u jiných chronických zánětlivých onemocnění nebo od pacientů s hematologickými/solidními malignitami.
Podle AASLD (American Association for the Study of Liver Disease) [29] dochází k reaktivaci HBV replikace u 20–50 % HBsAg+ pacientů léčených imunosupresivní terapií nebo cytostatiky. Většina reaktivací má asymptomatický průběh, byl však popsán i rozvoj žloutenky a v nejtěžších případech jaterní selhání a následné úmrtí [29]. U pacientů léčených pro lymfomy dochází častěji k replikaci viru, pokud chemoterapie zahrnuje kortikosteroidy [30]. Podobná kazuistická sdělení zahrnují případy vzplanutí HBV infek-ce u HBsAg+ pacientů s IBD léčených infliximabem. V naší literatuře podal podrobnou informaci o vztahu viru hepatitidy B u nemocných léčených biologickou terapií Šperl [31].
Z výše uvedeného vyplývá nutnost rutinně vyšetřovat přítomnost HBV infekce u každého IBD pacienta před zahájením imunosupresivní terapie (včetně kortikoidů) a/nebo biologické terapie. U všech seronegativních pacientů je následně doporučena vakcinace před zahájením této terapie z důvodů možného vzplanutí virového onemocnění v průběhu léčby. Účinnost očkování proti viru hepatitidy B u nemocných s IBD na zavedené imunosupresi je nepříznivě ovlivněna. V těchto případech je nutné podávat vyšší dávky imunizační látky a je doporučováno vyšetřit titr anti-HBsAg po ukončení očkování.
Chronická HBV infekce
U chronických nosičů HBsAg se doporučuje profylaktická léčba antivirotiky (nukleotidy/nukleosidy) bez ohledu na stupeň viremie. Měla by začít dva týdny před podáním kortikosteroidů, azathioprinu nebo anti-TNF α, trvat po celou dobu léčby a být ukončena až za šest měsíců po vysazení imunosuprese. Vzhledem k dobré dostupnosti a bezpečnosti je preferován lamivudin, ale lze použít i další antivirotika z uvedené skupiny. Při předpokladu imunosupresivní léčby trvající více než 12 měsíců se zvažují jiná antivirotika než lamivudin, které mají nižší potenciál navození lékové rezistence z důvodů mutace HBV DNA. Interferonu-α (IFN-α) je lépe se vyhnout, protože se může podílet na exacerbaci Crohnovy nemoci a také je obviňován z útlumu kostní dřeně. U pacientů s ulcerózní kolitidou je nepříznivý účinek IFN-α na průběh střevního onemocněni méně pravděpodobný [32].
Akutní HBV infekce
V současnosti nejsou zprávy o nově získané akutní hepatitidě B v průběhu imunosupresivní nebo biologické léčby. Kromě fulminantního průběhu hepatitidy, kde je léčba antivirotiky doporučována, není ustanovena žádná specifická léčba. Převážná většina pacientů se uzdraví spontánně. Je však třeba podotknout, že podávání kortikosteroidů může vést k potlačení imunitní odpovědi a větší replikaci viru, a tím i zvýšenému riziku přechodu do chronické hepatitidy. Imunosupresivní léčba by měla být vysazena, dokud není akutní hepatitida vyřešena.
HCV infekce
Imunizace proti virové hepatitidě C ani chemoprofylaxe v současné době neexistuje. Proto nelze všeobecně doporučit jakákoli preventivní opatření. Nicméně dle současných poznatků imunosupresivní a biologická léčba nemá zásadní efekt na průběh HCV infekce a tato terapie není kontraindikována ani u aktivní chronické HCV infekce (anti-HCV+, HCV RNA+) [8].
Virus varicella zoster (VZV)
Pokud onemocní pacient na imunosupresivní léčbě nebo dojde k reaktivaci latentní infekce (pásový opar), hrozí vždy riziko závažných orgánových komplikací, jako jsou pneumonie, hepatitida, encefalitida, trombocytopenie, které mohou být spojeny s fatálním průběhem. Proto je před zahájením imunosupresivní léčby žádoucí vědět, zda byl nemocný očkovaný proti planým neštovicím nebo jestli je (nebo pásový opar) v minulosti již prodělal.
- Pokud je anamnéza v tomto ohledu negativní, měl by být předem každý takový pacient očkovaný dvěma dávkami vakcíny. Protože se jedná o živou vakcínu, imunosupresivní terapie může být zahájena až po třech týdnech od poslední dávky vakcíny.
- V případě, že pacient má příznaky infekce (např. pásový opar), měl by podstoupit antivirovou terapii a přerušit imunosupresivní léčbu.
- Jestliže nebyl imunokompromitovaný pacient imunizovaný proti VZV a ocitl se v kontaktu s pacientem s pásovým oparem, doporučuje se do čtyř dnů od expozice jeho pasivní imunizace hyperimunním imunoglobulinem VZV-IgG (VZIG) a následně ho měsíc zvýšeně observovat, protože VZIG může prodloužit inkubační periodu nemoci.
- Pokud neznáme u imunosuprimovaného pacienta jeho imunitní status, je očkování osoby žijící s ním ve stejné domácnosti žádoucí, neboť se tím snižuje riziko nákazy pro pacienta.
Infekce lidským papilomavirem (HPV)
Infekce HPV je nejčastěji sexuálně přenášená infekce na světě [33]. Jde celkem o více než 40 sérotypů HPV. Od roku 2006 je k dispozici profylaxe složenými, neživými vakcínami. Očkování HPV je určeno ženám ve věku od 9 do 26 let pro prevenci prekancerózních nebo dysplastických lézí, jako jsou cervikální adenokarcinom in situ, dále cervikální intraepiteliální neoplazie, vulvární intraepiteliální neoplazie a vaginální intraepiteliální neoplazie, které jsou způsobené HPV virem typu 1, 6, 11 a 16. Vakcína nevyvolává protektivní účinek vůči onemocněním způsobeným nevakcinačními typy HPV. V ideálním případě je vhodné zahájit toto očkování u dívek a žen ještě před prvním sexuálním kontaktem, tj. před první možnou expozicí HPV nákazy. Očkování není doporučeno mužům, dívkám mladším devíti let nebo ženám starším 26 let, protože účinnost a bezpečnost vakcinace v této populaci nebyla dostatečně zkoumána [34–36].
Imunosupresivní terapie pravděpodobně neovlivňuje průběh infekce a současná ani prodělaná infekce není kontraindikací k této léčbě. Výjimkou jsou pochopitelně s HPV asociované tumory, které se mohou vyskytnout po mnohaleté imunosupresivní léčbě.
Tuberkulóza (TBC)
Problematika očkováni proti TBC v souvislosti s imunosupresivní a biologickou terapií se týká dvou skupin pacientů. První jsou novorozenci matek léčených v průběhu gravidity biologickou léčbou. Jde především o situace, kdy matka byla léčena ve 3. trimestru gravidity, kdy dochází k aktivnímu přenosu infliximabu a pravděpodobně též adalimumabu do krevního oběhu novorozence [37]. Druhou skupinu tvoří dětští pacienti s IBD, u nichž je doporučeno přeočkování proti TBC.
- Doporučení pro očkování novorozenců: za nejvhodnější považujeme stanovení hladiny biologického léčiva v séru novorozence a vakcinaci provést až v případě negativních hladin léčiva. V případě, že stanovení hladin léků není k dispozici, doporučujeme odložit očkování na konec 6. měsíce života. Toto doporučení vychází z výsledků pozorování u dětí exponovaných infliximabem in utero, u nichž došlo k vymizení léku v průběhu 2–6 měsíců po porodu [38–39].
- Doporučení pro přeočkování dětských pacientů: přeočkování není v současné době povinné a jeho případná aplikace by se měla řídit zásadami pro podání živé vakcíny u pacientů léčených imunosupresivy a biologickou léčbou.
Očkování při cestách do zahraničí
Při cestách do vzdáleného zahraničí a především do rizikových oblastí Střední Ameriky, rovníkové Afriky a jihovýchodní Asie je doporučeno očkování proti břišnímu tyfu, choleře a enterotoxigennímu kmenu Escherichia coli, japonské encefalitidě, moru, a jako profylaxe malárie. Povinné je očkování proti žluté zimnici při cestách do zemí Afriky a Střední a Jižní Ameriky, a také proti meningokokové meningitidě (A, C, Y, W – 135) při cestách do Saudské Arábie.
Břišní tyfus
Původcem onemocnění je bakterie Salmonella typhi a patří do skupiny nemocí „špinavých rukou“. Postihuje hlavně indický subkontinent, Afriku, Střední a Jižní Ameriku. Lze provést sérologické ověření imunitní odpovědi stanovením hladiny specifických protilátek. Kontraindikací je podání živé vakcíny Ty21a [40].
Cholera
Choleru způsobuje bakterie Vibrio cholerae. Ve světě se cholera vyskytuje v Indii, v jihovýchodní Asii, Africe, na Středním východě, v Oceánii, v Jižní Americe a v některých zemích bývalého Sovětského svazu (Ukrajina, Azerbajdžán a Arménie). Pro vakcinaci se u nás používá inaktivovaná perorální vakcína. Účinnost vakcinace lze kontrolovat stanovením anti-toxinových protilátek IgA, IgG nebo vibricidních (antibakteriálních) protilátek, které jsou pro správnou obranyschopnost důležitější [40].
Japonská encefalitida
Jedná se o virové onemocnění, které postihuje zejména oblasti jihovýchodní a severovýchodní Asie. Očkování se doporučuje všem osobám, které cestují do asijských oblastí se zvýšeným výskytem japonské encefalitidy, které předpokládají pobyt delší než 30 dní a které budou pobývat především ve volné přírodě nebo na venkově. U nás se očkuje neživou vakcínou, živá vakcína není u nás registrovaná [40].
Mor
Mor je způsoben bakterií Yersinia pestis. Vyskytuje se v jihozápadní části Spojených států amerických, v některých lokalitách bývalého Sovětského svazu, Jižní Americe, jižní Africe a Asii. Očkování (neživou vakcínou) se nedoporučuje u lidí žijících v endemických oblastech. Je doporučeno pouze u vysoce rizikových skupin přicházejících do styku s hlodavci [40].
Žlutá zimnice
Žlutá zimnice se vyskytuje především v rovníkové oblasti Jižní Ameriky a Afriky. Očkuje se živou vakcínou, která je pro imunosuprimované pacienty kontraindikovaná. Inaktivované vakcíny obsahovaly většinou zbytkové živé viry, naštěstí již nejsou k dispozici [40].
Meningokoková meningitida
U nás se očkuje purifikovanými polysacharidovými antigeny proti meningitidě A a C. Toto očkování nechrání před onemocněním vyvolaným meningokoky skupiny B ani jinými séro-skupinami Neisseria meningitidis. Očkování proti meningitidě C nese rizika zkřížené reakce proti tetanu a diphterii. Pro cestovatele mířící do Saudské Arábie do Mekky a Mediny je povinné očkování proti meningokokovému onemocnění kvadrivalentní vakcínou Menomune, která není v ČR registrovaná, ale lze ji obstarat individuálním dovozem [40].
Malárie
Rozlišují se čtyři druhy malárie, vyvolavatelem je Plasmodium falciparum, P. vivax, P. ovale a P. malariae. Proti malárii zatím neexistuje žádná očkovací látka, v chemoprofylaxi vzniku onemocnění lze použít „pouze“ expoziční profylaxi – ochranu před komářím bodnutím a chemoprofylaxí – pravidelné užívání léků před, během a po skončení cesty.
Za oblasti s rizikem malárie jsou považovány oblasti Střední a Jižní Ameriky, Afriky a jižní Asie a Středního východu, Oceánie. Prevencí jsou repelenty, nejúčinnější je se složkou DEET (N, N-dietylmetatoluamid), insekticidy, oblečení světlé barvy s dlouhými rukávy a nohavicemi. Důležitým opatřením je omezení pohybu venku za soumraku. V některých oblastech se úspěšně brání pomocí osvětlení prostoru červeným světlem. Chemoprofylaxe je různá podle oblastí, do kterých cestujeme, a ročního období, užívá se dlouhodobě. Alternativou je pohotovostní medikace, která se použije v případě onemocnění. Léky jsou chlorochin, proguanol, meflochin, atovaquon, doxycyklin [40].
Závěr
- Pacienti s IBD bez imunosupresivní terapie nejsou obecně považováni za imunokompromitované. Imunokompromitovanými se stávají až po zavedení imunosupresivní léčby, míra imunosupresivního účinku prudce narůstá při kombinovaném užívání imunosupresiv a biologické léčby.
- Očkování je legislativně upraveno vyhláškou, v současné době neexistuje platná směrnice pro očkování imunokompromitovaných jedinců.
- U IBD pacientů s imunosupresivní či biologickou léčbou je kontraindikace podávání živých vakcín.
- Neživé vakcíny je možné podávat v jakékoli fázi imunosupresivní a biologické léčby. Je nutné mít na paměti, že jejich efektivita může být snížena a bývá vhodné ji sérologicky ověřit a případně pacienty přeočkovat.
- Před zavedením imunosupresivní nebo biologické léčby je vhodné zvážit očkování proti hepatitidě B, lidskému papilomaviru, varicele zoster, chřipce a pneumokoku.
- Očkování živou vakcínou je možné provést za tři měsíce po ukončení imunosupresivní nebo biologické léčby.
- Imunosupresivní nebo biologická léčba může být zahájena tři týdny po očkování živou vakcínou.
prof. MUDr. Milan Lukáš, CSc.
Klinické a výzkumné centrum pro idiopatické střevní záněty
ISCARE IVF, a. s. Lighthouse a 1. LF UK
Jankovcova 1569/2c
Praha 7, 170 00
e-mail: milan.lukas@email.cz
Sources
1. Rutgeerts P, Vermeire S, Van AG. Biological therapies for inflammatory bowel diseases. Gastroenterology 2009; 136(5): 1182–1197.
2. de Ridder L, Escher JC, Bouquet J et al. Infliximab therapy in 30 patients with refractory pediatric crohn disease with and without fistulas in The Netherlands. J Pediatr Gastroenterol Nutr 2004; 39(1): 46–52.
3. Caspersen S, Elkjaer M, Riis L et al. Infliximab for inflammatory bowel disease in Denmark 1999-2005: clinical outcome and follow-up evaluation of malignancy and mortality. Clin Gastroenterol Hepatol 2008; 6(11): 1212–1217.
4. Hanauer SB, Feagan BG, Lichtenstein GR et al. Maintenance infliximab for Crohn‘s disease: the ACCENT I randomised trial. Lancet 2002; 359(9317): 1541–1549.
5. Sandborn WJ, Hanauer SB, Rutgeerts P et al. Adalimumab for maintenance treatment of Crohn‘s disease: results of the CLASSIC II trial. Gut 2007; 56(9): 1232–1239.
6. Fidder H, Schnitzler F, Ferrante M et al. Long-term safety of infliximab for the treatment of inflammatory bowel disease: a single-centre cohort study. Gut 2009; 58 : 501–508.
7. Schnitzler F, Fidder H, Ferrante M et al. Long-term outcome of treatment with infliximab in 614 patients with Crohn‘s disease: results from a single-centre cohort. Gut 2009; 58(4): 492–500.
8. Rahier J, Ben-Horin S, Chowers Y et al. Europen evidence-based Consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. Journal of Crohn´s and Colitis 2009; 3 : 47–91.
9. Keane J, Gershon S, Wise RP et al. Tuberculosis associated with infliximab, a tumor necrosis factor alpha-neutralizing agent. N Engl J Med 2001; 345(15): 1098–1104.
10. Lichtenstein GR, Feagan BG, Cohen RD et al. Serious infections and mortality in association with therapies for Crohn‘s disease: TREAT registry. Clin Gastroenterol Hepatol 2006; 4(5): 621–630.
11. Recommendations of the Advisory Committee on Immunization Practices (ACIP): use of vaccines and immune globulins for persons with altered immunocompetence. MMWR Recomm Rep 1993; 42 : 1–18.
12. Symmers WS. Opportunistic infections. The concept of „opportunistic infections“. Proc R Soc Med 1965; 58 : 341-346.
13. Toruner M, Loftus EV jr., Harmsen WS et al. Risk factors for opportunistic infections in patients with inflammatory bowel disease. Gastroenterology 2008; 134(4): 929–936.
14. Castle SC. Clinical relevance of age-related immune dysfunction. Clin Infect Dis 2000; 31(2): 578–585.
15. Ainley C, Cason J, Slavin BM et al. The influence of zinc status and malnutrition on immunological function in Crohn‘s disease. Gastroenterology 1991; 100(6): 1616–1625.
16. Lu Y, Jacobson DL, Ashworth LA et al. Immune response to influenza vaccine in children with inflammatory bowel disease. Am J Gastroenterol 2009; 104(2): 444–453.
17. Brezinschek HP, Hofstaetter T, Leeb BF et al. Immunization of patients with rheumatoid arthritis with antitumor necro-sis factor alpha therapy and methotre-xate. Curr Opin Rheumatol 2008; 20(3): 295–299.
18. Mamula P, Markowitz JE, Piccoli DA et al. Immune response to influenza vaccine in pediatric patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2007; 5(7): 851–856.
19. Dawood FS, Jain S, Finelli L et al. Emergence of a novel swine-origin influenza A (H1N1) virus in humans. N Engl J Med 2009; 360(25): 2605–2615.
20. Baker MG, Wilson N, Huang QS et al. Pandemic influenza A(H1N1)v in New Zealand: the experience from April to August 2009. Euro Surveill 2009; 14.
21. Vaillant L, La RG, Tarantola A et al. Epidemiology of fatal cases associated with pandemic H1N1 influenza 2009. Euro Surveill 2009; 14.
22. Rahier JF, Yazdanpanah Y, Viget N et al. Review article: influenza A (H1N1) virus in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2010; 31(1): 5–10.
23. Medicines Q&A: Use of Oseltamivir in Patients Taking Methotrexate. 2009.
24. Beasley RP, Hwang LY, Lin CC et al. Incidence of hepatitis B virus infections in preschool children in Taiwan. J Infect Dis 1982; 146(2): 198–204.
25. Coursaget P, Yvonnet B, Chotard J et al. Age - and sex-related study of hepatitis B virus chronic carrier state in infants from an endemic area (Senegal). J Med Virol 1987; 22(1): 1–5.
26. Marusawa H, Uemoto S, Hijikata M et al. Latent hepatitis B virus infection in healthy individuals with antibodies to hepatitis B core antigen. Hepatology 2000; 31(2): 488–495.
27. Rehermann B, Ferrari C, Pasquinelli C et al. The hepatitis B virus persists for decades after patients‘ recovery from acute viral hepatitis despite active maintenance of a cytotoxic T-lymphocyte response. Nat Med 1996; 2(10): 1104–1108.
28. Yotsuyanagi H, Yasuda K, Iino S et al. Persistent viremia after recovery from self-limited acute hepatitis B. Hepatology 1998; 27(5): 1377–1382.
29. Lok AS, McMahon BJ. Chronic hepatitis B. Hepatology 2007; 45(2): 507–539.
30. Cheng AL, Hsiung CA, Su IJ et al. Steroid-free chemotherapy decreases risk of hepatitis B virus (HBV) reactivation in HBV-carriers with lymphoma. Hepatology 2003; 37(6): 1320–1328.
31. Šperl J, Špičák J. Problematika virových hepatitid v průběhu léčby preparáty s antiTNFa aktivitou. Biol Lecbva 2010; 2 : 69.
32. Tilg H, Vogelsang H, Ludwiczek O et al. A randomised placebo controlled trial of pegylated interferon alpha in active ulcerative colitis. Gut 2003; 52(12): 1728–1733.
33. Palefsky J. Human papillomavirus infection in HIV-infected persons. Top HIV Med 2007; 15(4): 130–133.
34. Arbyn M, Dillner J. Review of current knowledge on HPV vaccination: an appendix to the European Guidelines for Quality Assurance in Cervical Cancer Screening. J Clin Virol 2007; 38(3): 189–197.
35. Markowitz LE, Dunne EF, Saraiya M et al. Quadrivalent Human Papillomavirus Vaccine: Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2007; 56 : 1–24.
36. Saslow D, Castle PE, Cox JT et al. American Cancer Society Guideline for human papillomavirus (HPV) vaccine use to prevent cervical cancer and its precursors. CA Cancer J Clin 2007; 57(1): 7–28.
37. Saunders W. The Imunology of Pregnancy. Maternal-fetal Medicine: Principles and Practice. Philadelphia, PA: 1994.
38. Mahadevan U, Terdiman J, Church J et al. Infliximab levels in infants born to women with inflammatory bowel disease. Gastroenterology 2010; 132: A144.
39. Vasiliauskas EA, Church JA, Silverman N et al. Case report: evidence for transplacental transfer of maternally administered infliximab to the newborn. Clin Gastroenterol Hepatol 2006; 4(10): 1255–1258.
40. Hill DR, Ericsson C, Pearson R et al. The practice of travel medicine: guidelines by the Infectious Disease Society of America. Clin Infect Dis 2006; 43 : 1499–1539.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology

2010 Issue 1-
All articles in this issue
- Annual report of the Editor-in-Chief of the journal Czech and Slovak Gastroenterology and Hepatology for the year 2009
- What is the reason for a new journal section called IBD?
- Enteropathy-Associated Non-Hodgkin T-Lymphoma as a Complication of Late Diagnosis of Celiac Disease in a Geriatric Patient
- Multiple Gastrointestinal Cancers in the Czech Republic 1976–2005
- Neuroendocrine Tumors of the Large Bowel
- The Diagnosis and Treatment of Globus Pharyngeus
- Commentary to some posters presented on the UEGW 2009 London about IBD
- Recommendation for Vaccinations in Patients with Crohn’s Disease and Ulcerative Colitis on Immunosuppressive and/or Biological Therapy
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- The Diagnosis and Treatment of Globus Pharyngeus
- Recommendation for Vaccinations in Patients with Crohn’s Disease and Ulcerative Colitis on Immunosuppressive and/or Biological Therapy
- Neuroendocrine Tumors of the Large Bowel
- Enteropathy-Associated Non-Hodgkin T-Lymphoma as a Complication of Late Diagnosis of Celiac Disease in a Geriatric Patient
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

