-
Medical journals
- Career
Diabetická retinopatia 3: Chirurgická liečba
: Jana Štefaničková; Vladimír Krásnik
: Klinika oftalmológie LF UK a UN Bratislava, prednosta doc. MUDr. Vladimír Krásnik, PhD.
: Forum Diab 2013; 2(3): 170-175
: Main Theme: Review
Milióny ľudí na celom svete sú každoročne postihnuté znížením zrakovej ostrosti kvôli diabetu. Diabetická retinopatia je najčastejšou príčinou zhoršenia zrakovej ostrosti u populácie v produktívnom veku v rozvinutých krajinách. V niektorých prípadoch len chirurgická liečba je schopná zachrániť pacientovi videnie. Typickými indikáciami k pars plana vitrektómii sú: krvácanie do sklovca, trakčné odlúčenie sietnice, kombinované trakčné a regmatogénne odlúčenie sietnice a trakčný diabetický edém makuly. Vitreoretinálni chirurgovia sú v súčasnosti modernými technikami schopní zvládnuť aj pokročilé štádia proliferatívnej diabetickej retinopatie. Niekedy môže byť nespokojnosť s výsledkom liečby, aj napriek anatomicky úspešnej operácii. Funkčné výsledky závisia od rozsahu ischémie sietnice, najmä makuly. Rozhodnutie o operácii pacienta s diabetickou retinopatiou vždy vyžaduje zváženie rizika a benefitu z operácie.
Kľúčové slová:
diabetický edém makuly – diabetická retinopatia – pars plana vitrektómiaÚvod
Prvé dokumentované pokusy vo vitreoretinálnej chirurgii sa datujú do obdobia Albrechta von Graefeho v roku 1863 [24], ktorý už vtedy predpovedal veľkú budúcnosť chirurgickej liečbe ochorení sietnice a sklovca. Trvalo to skoro až storočie, keď v roku 1972 Machemer a Norton [17] publikovali prvé výsledky po úspešne pars plana vitrektómii (PPV) pri proliferatívnej diabetickej retinopatii (DR). V 70. rokoch minulého storočia boli indikácie k PPV zdržanlivejšie a opatrnejšie: neresorbujúce sa krvácanie do dutiny sklovca trvajúce dlhšie ako 6 mesiacov, trakčné odlúpenie sietnice s postihnutím makuly a kombinované trakčné a regmatogénne odlúpenie sietnice. Operovaní boli len pacienti s veľmi nízkou najlepšie korigovanou centrálnou ostrosťou zraku (NKCOZ) [17].
Postupne s rozvojom poznatkov o patofyziológii diabetu sa začal dávať väčší dôraz na dobrú metabolickú kompenzáciu ochorenia, ktorá spolu so zavedením laserkoagulácie sietnice do liečby, sa ukázala ako veľmi účinná prevencia pokročilých štádií DR. O niečo neskôr pribudli do liečby kortikoidy a blokátory vaskulárneho endoteliálneho rastoveho faktoru (VEGF – vascular endothelial growth factor), ktoré dokážu u niektorých pacientov, najmä s diabetickým edémom makuly (DEM), NKCOZ nielen stabilizovať ale aj zlepšiť. Aj napriek týmto pokrokom je stále dosť pacientov indikovaných na chirurgickú intervenciu. Počas PPV nielen uvoľňujeme všetky trakčné sily z povrchu sietnice, ale aj eliminujeme faktory zvyšujúce priepustnosť, ako napríklad VEGF, a pravdepodobne aj zlepšujeme transport a penetráciu kyslíka a výživových látok cez dutinu sklovca k makule [12].
V posledných rokoch sa indikácie chirurgickej liečby DR stále rozširujú [2,5,7]:
- neresorbujúce sa krvácanie do sklovca – podľa dĺžky trvania a zrakových potrieb pacienta
- trakčné odlúpenie sietnice s postihnutím makuly
- kombinované trakčné a regmatogénne odlúpenie sietnice
- prítomnosť progresívnych fibrovaskulárnych proliferacií na sietnici nereagujúcich na laserkoaguláciu
- neresorbujúce sa retrohyaloidné krvácanie pred makulou
- rubeóza dúhovky so zákalmi optických médií znemožňujúcich prevedenie laserkoagulácie sietnice
- hemolytický glaukóm
Zákaly sklovca
Hemoragické zákaly sklovca, ktoré vznikajú krvácaním z novovytvorených ciev na terči zrakového nervu (NVD) alebo na samotnej sietnici (NVE), sú veľmi častou komplikáciou pri DR. Novovytvorené cievy obsahujú aj fibróznu zložku, ktorá ak je fixovaná k sietnici, môže spôsobiť trakciu na sietnicu a trakčné odlúčenie sietnice. Pomocou PPV vieme odstrániť zákaly sklovca a trakčné odlúčenie sietnice znovu priložiť. Navyše odstránenie sklovca má stabilizujúci efekt na rozvoj proliferatívnych procesov na povrchu sietnice [2,11,12].
Neovaskularizácie na zadnom segmente oka sa objavujú najčastejšie u očí s priloženou zadnou kôrou sklovca (ZKS), obr. 1. Fibrovaskulárne proliferácie rastú pozdĺž vitreoretinálneho rozhrania, spôsobujú kontrakcie a čiastočné odlúčenie ZKS. Tieto kontrakcie môžu spôsobovať krvácanie z novovzniknutých ciev a následne krvácanie do sklovca a subhyaloidného priestoru. Uvoľnenie trakcií z povrchu ciev zlepšuje prietok krvi v cievach a redukuje presakovanie. Taktiež neporušená cirkulácia zlepšuje zásobovanie vnútorných častí sietnice kyslíkom a zabraňuje akumulácii vazoaktívnych cytokínov v sietnici. U očí s hemoragickými zákalmi alebo trakčným odlúčením sietnice často nie je možné aplikovať laserkoagulačnú liečbu sietnice. Použitie endolaserkoagulácie počas operácie dokáže stabilizovať proliferatívny proces [12].
1. Proliferatívna diabetická retinopatia. Rozsiahla fibrovaskulárna proliferácia z terča zrakového nervu s početnými úponmi na okolitú sietnicu a s retrohyaloidným krvácaním (šípka). 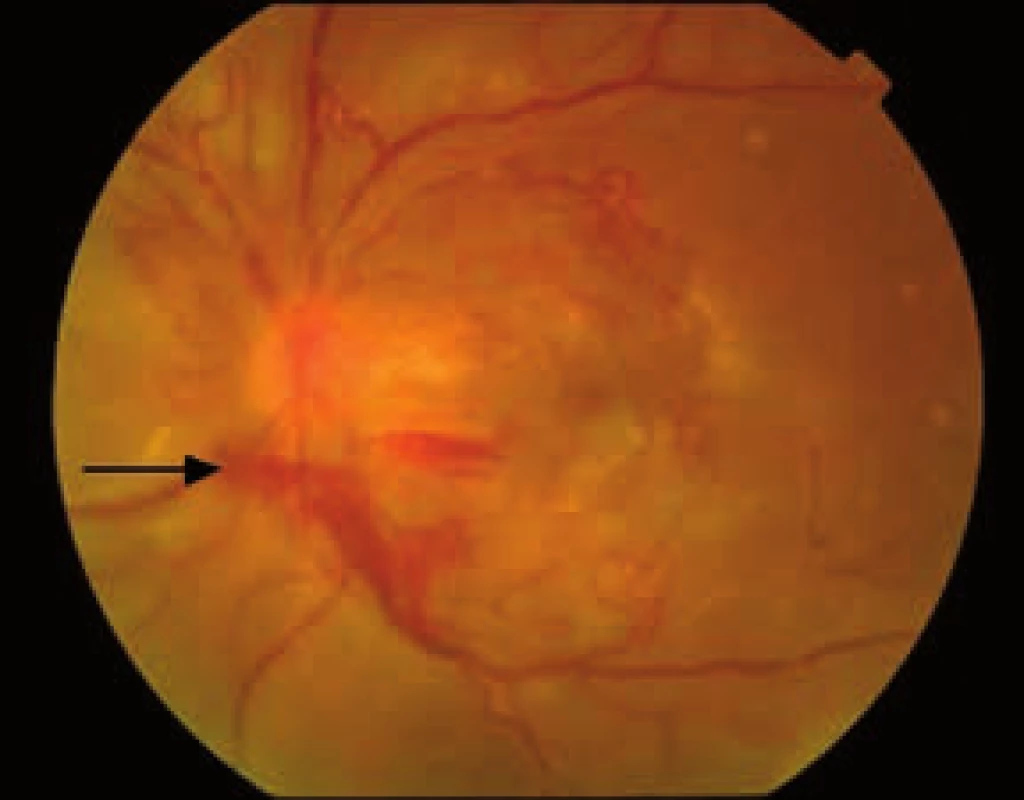
V minulosti sa doporučovalo s chirurgickým zákrokom najprv čakať 6–12 mesiacov a až potom indikovať PPV a odstránenie hemoragických zákalov. Štúdia Diabetic Retinopathy Vitrectomy Study Research Group publikovaná v roku 1988 [27] zistila priaznivý efekt PPV na stabilizáciu zrakových funkcií aj u pacientov s proliferatívnou DR a „dobrou“ NKCOZ pred operáciou a preukázala jednoznačný benefit včasnej PPV u pacientov s DM1T, u ktorých je vyššie riziko vzniku agresívnejších fibrovaskulárnych proliferácií. U takýchto očí sa veľmi často objavujú masívne proliferácie, ktoré môžu byť komplikované, a to až vznikom trakčneho odlúčenia sietnice, ktoré nie je viditeľné pri biomikroskopickom vyšetrení pre krvácania v sklovci. Trakčné odlúčenie sietnice pri dlhšom trvaní môže spôsobiť až slepotu [2].
Pri diagnostike zákalov sklovca, a najmä hemoftalmu si pomáhame ultrasonografickým B-skenom, ktorý je schopný veľmi presne zachytiť proliferácie pod krvácaniami, ich adhézie na sietnice a trakčné odlúčenie sietnice. Rozsiahle subhyaloidné krvácanie je znakom neporušenej ZKS. Je to krvácanie typicky polmesiačikovitého tvaru lokalizované medzi sietnicu a ZKS. Ak sa nachádza v oblasti makuly, pacientovi sa môže rapídne znížiť NKCOZ. Neodlúčená ZKS je akoby lešením pre rast neovaskularizácií. U týchto pacientov je indikovaná včasná PPV, ktorá môže pacientom zachrániť zrakovú ostrosť [5,12].
U očí s krvácaním do sklovca, a neovaskularizáciou dúhovky čakanie na spontánne vstrebanie krvácaní tiež môže spôsobiť ireverzibilné poškodenie. Aj u týchto očí je doporučovaná včasná PPV s endolaserkoaguláciou a kryokoaguláciou na ischemické oblasti sietince, aby sa zabránilo uzáveru iridokorneálneho uhla fibrovaskulárnym tkanivom a vzniku neovaskulárneho glaukómu.
Vitreoretinálna trakcia
Vo všeobecnosti trakčné odlúčenie sietnice nie je urgentnou indikáciou k operácii, ak nepostihuje makulu. Ak je lokalizované nazálne, môže byť bezpečne kontrolované aj niekoľko rokov. Ak trakčné odlúčenie sietnice postihuje makulu, je to urgentná indikácia k operácii. Oči s trvaním odlúčenia sietnice dlhšie aj napriek dobrým anatomickým výsledkom po operácii, nemajú dobré funkčné výsledky. Rizikovými faktormi pre stratu zraku sú aktívne neovaskularizácie spojené s krvácaním do sklovca a pokračujúcim odlúčením sietnice [5].
Laserkoagulácia sietnice indukuje regresiu aktivity neovaskularizácií. Vzniká tu fibróza, ktorá môže ešte zvýrazniť trakciu na sietnicu. Preto oči s rozsiahlymi aktívnymi neovaskularizáciami by mali byť po laserkoagulácii kontrolované veľmi často.
Kombinované trakčné a regmatogénne odlúčenie sietnice sa objaví, ak kontrakčné sily fibrovaskulárnych neovaskularizácií spôsobia svojim ťahom vznik trhliny na sietnici. Tento typ odlúčenia sietnice progreduje veľmi rýchlo, odlúčená sietnica je mobilná a môže mať až bulózny alebo konvexný tvar. Rýchly chirurgický zásah je nevyhnutnosťou. V niektorých prípadoch, ak fibrovaskulárne neovaskularizácie pevne adherujú na sietnicu a spôsobujú trakčné odlúčenie sietnice, môže ísť o veľmi náročný chirurgický výkon a na konci operácie je veľmi často nutná aplikácia silikónového oleja do dutiny sklovca.
Diabetický edém makuly
Význam sklovca v patogenéze DEM, obr. 2, popísali Nasrallah et al v roku 1988 [21] a zistili signifikantne vyšší výskyt odlúčenia ZKS u pacientov s DR a bez prítomnosti DEM. Hikichi et al [13] sledovali vývoj DEM spojeného s vitreomakulárnou trakciou. Spontánne vstrebanie edému bolo u 55 % pacientov, u ktorých nastalo uvoľnenie vitreomakulárnej trakcie. Pri pretrvávajúcej trakcii na makulu sa edém vstrebal len u 25 %.
2. Neproliferatívna DR s difúznym edémom makuly, stopy po laserkoagulácii v makule a na strednej periférii, žlté ložiská sú tvrdé exsudáty (šípka) u 62-ročného pacienta s DM2T, trvanie DEM 2 roky. 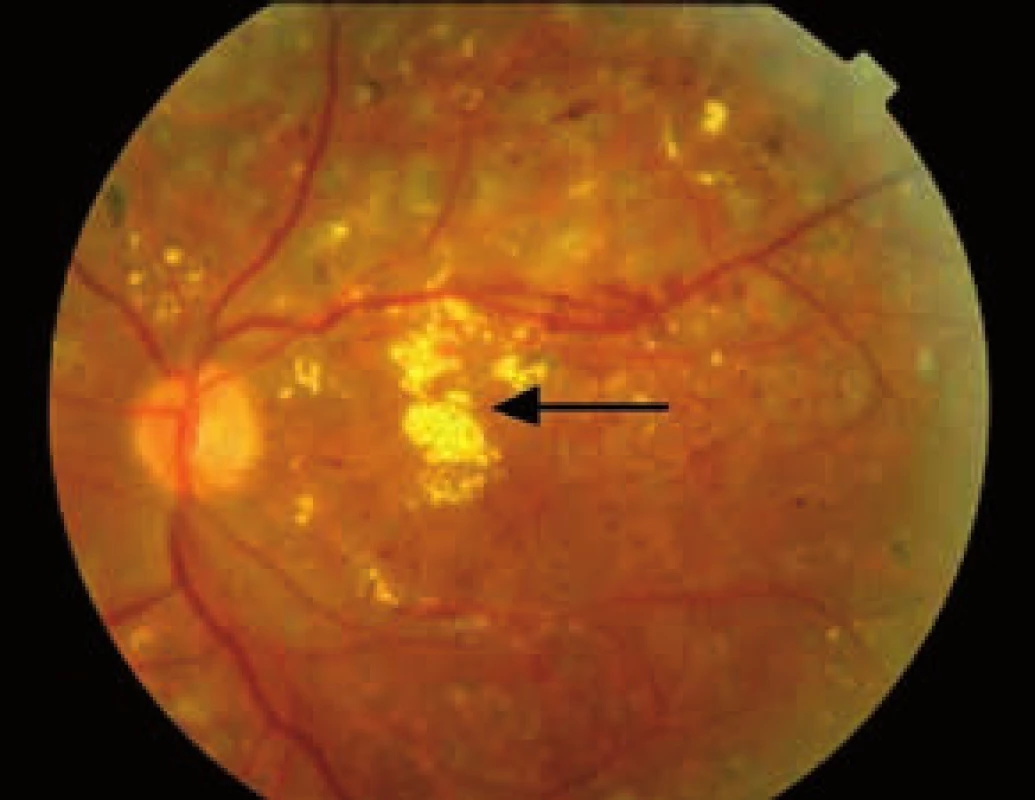
V roku 1992 Lewis et al [16] ako prvý pozorovali dobrý efekt PPV na resorpciu DEM so zhrubnutou a natiahnutou zadnou kôrou sklovca. Následne bolo publikovaných viacero retrospektívnych klinických štúdií, ktoré potvrdili, že PPV s odstránením ZKS môže viesť k zmenšeniu edému a zlepšeniu zrakových funkcií [6,18,22,23]. Na druhej strane PPV môže viesť k zmenšeniu DEM aj bez prítomnosti vitreomakulárnej trakcie. La Heij et al [15] popísali vstrebanie DEM po PPV na očiach bez prítomnosti vitreomakulárnej trakcie pred operáciou. Tiež Tachi a Ogino [26] po 12 mesiacoch od PPV sledovali vstrebanie edému u 92 % očí a zlepšenie NKCOZ u 53 % očí.
Medzi hlavné indikácie k PPV pri DEM patrí [5,6, 7,10,18]:
- prítomnosť trakcie na makulu
- difúzny edém makuly nereagujúci na liečbu blokátormi cievneho endotelového rastového faktoru (anti-VEGF), kortikosteroidmi, laserkoaguláciu a inú liečbu
U pacientov s DEM sa vyskytujú pomerne často epimakulárne membrány. Yamamoto et al [28] vo svojej práci udávajú prítomnosť epimakulárnej membrány u 27 % očí. Imunohistochemickou analýzou epimakulárnych membrán zistili zvýšenú expresiu VEGF-faktorov a interleukínu 6.
Pri diagnostike patologických zmien na sietnici je veľmi často používaný prístroj optická koherentná tomografia (OCT). Je to neinvazívna moderná diagnostická zobrazovacia technika na zobrazenie tkanív s vysokou axiálnou rozlišovacou schopnosťou. Funguje na podobnom princípe ako ultrasonografický B-sken, ale namiesto zvuku používa svetlo. Je približne 10 - až 20-krát citlivejší ako ultrasonografia. Na detekciu rozdielu odrazovej schopnosti svetla rôznymi tkanivami využíva koherenčné vlastnosti svetla – princíp interferometrie [1].
Pri vyšetrení pacienta s DR na OCT si všímame najmä zhrubnutie sietnice, výskyt cystoidného edému makuly, stratu foveolárnej depresie, odlúčenie neurosenzória, výskyt epiretinálnych membrán, vznik dier makuly, vitreomakulárnu a vitreoretinálnu trakciu a preretinálne neovaskularizácie (obr. 3) [14,18].
3. Diabetický edém makuly s trakciou v makule. OCT-obraz 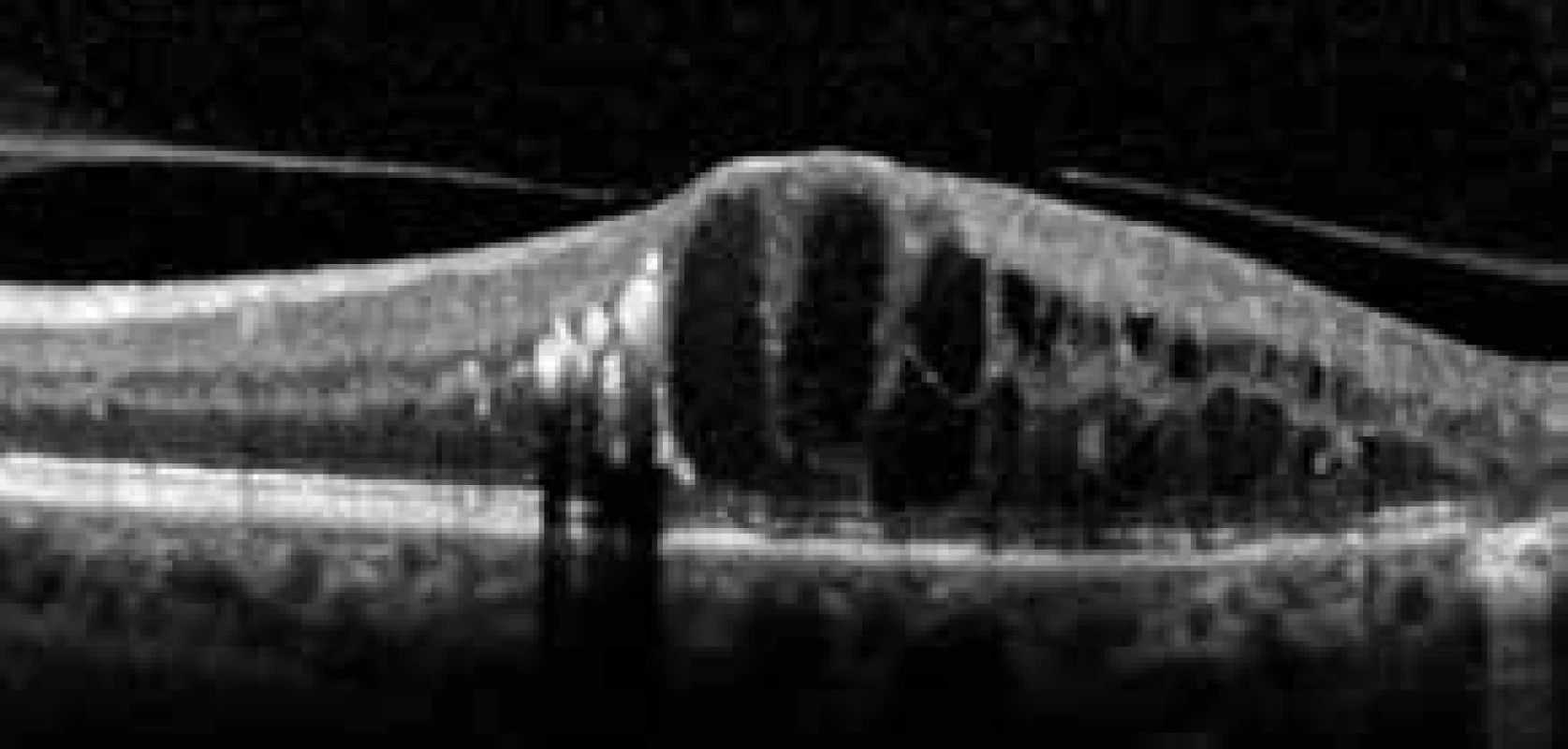
Veľmi dôležité je aj správne načasovanie operácie. Pri dlhodobom trvaní DEM dochádza k postupnému ireverzibilnému poškodeniu fotoreceptorov a výraznejšiemu zhoršovaniu NKCOZ. Medzi faktory ovplyvňujúce pooperačný výsledok patrí: chýbanie adekvátnej laserkoagulácie pred operáciou, dlhý časový interval medzi vznikom DEM a PPV, neprimeraná manipulácia chirurgickými inštrumentami pri odstraňovaní sklovca a vitreomakulárnych trakcií, prítomnosť epiretinálnych membrán po operácii a ischemická makulopatia [5].
Pars plana vitrektómia
Samotná technika PPV pri DR sa nelíši od techniky bežnej pri iných vitreoretinálnych výkonoch (obr. 4).
4. Pars plana vitrektómia – pohľad chirurga počas odsekávania sklovca 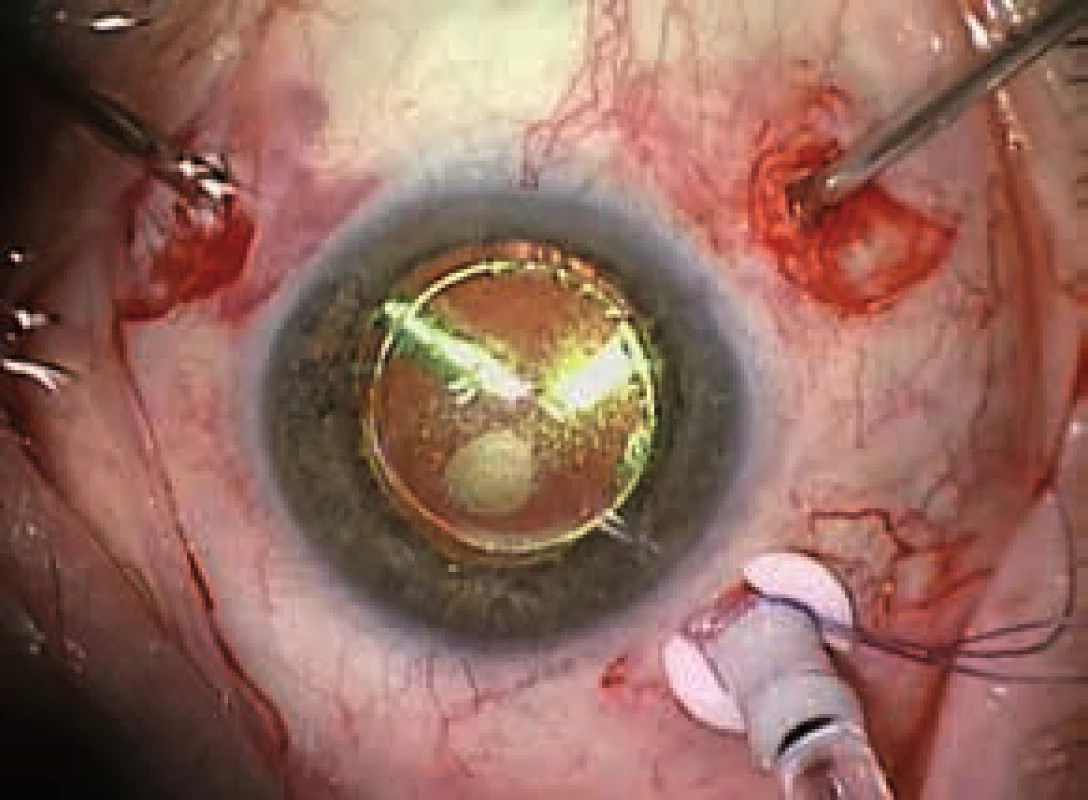
Hlavným cieľom pars plana vitrektómie u diabetického pacienta je odstrániť opacity zo sklovca, odstrániť a uvoľniť všetky trakčné sily pôsobiace na povrch sietnice a ak je to potrebné, je možná laserkoagulácia sietnice. Môžu byť použité dva postupy na odstránenie membrán – delaminácia, pri ktorej adhézie medzi membránami a sietnicou sú uvoľňované pomocou nožníc a pinziet a sú odstránené v jednom kuse, alebo segmentácia, pri ktorej sú jednotlivé membrány nožnicami uvoľňované a rozdeľované na menšie kusy a potom vitrektómom odstránené [5].
Na konci operácie do dutiny sklovca aplikujeme buď infúzny roztok, plyn, alebo silikónový olej podľa rozsahu poškodenia sietnice [5].
Tamponádu plynmi spolu s laserkoaguláciou alebo kryokoaguláciou sietnice používame pri výskyte malých defektov sietnice vzniknutých počas odstraňovania membrán alebo pri lokalizovanom trakčnom odlúčení sietnice. Plyn sa po 6–12 týždňoch vstrebe. Silikónový olej je trvalá tamponáda dutiny sklovca. Používa sa u očí s rekurentnými krvácaniami do dutiny sklovca po pars plana vitrektómii, aby sme zabránili krvácaniam. Ďalej sa používa u očí s početnými defektmi na sietnici, ktoré sa môžu vyskytnúť pri separovaní pevne adherujúcich membrán k tenkej atrofickej sietnici alebo vzniknuté pôsobením trakcie pri rozsiahlych neovaskularizáciach. U takýchto očí môže aplikácia silikónového oleja napomôcť znovu priloženiu sietnice k pigmentovému epitelu sietnice. V takýchto prípadoch je veľmi dôležité odstrániť všetky trakčné sily z povrchu sietnice, aby sa silikónový olej nedostal pod sietnicu [2,25]. Ďalšou indikáciou k aplikácii silikónového oleja je progresívna ischémia na prednom segmente, najmä u afakických očí a po PPV [5]. U týchto očí ľahšie prechádzajú rastové faktory z ischemickej sietnice do dúhovky a napomáhajú vzniku rubeózy dúhovky a následne neovaskulárneho glaukómu. Aplikácia silikónové oleja znižuje difúziu medzi sietnicou a predným segmentom oka a spolu s peroperačnou laserkoaguláciou alebo kryokoaguláciou zabraňuje vzniku progresívnej neovaskularizácie na prednom segmente.
Od roku 2002, kedy bola prvýkrát spomenutá transkonjunktiválna bezstehová PPV Fujii et al [9] a neskôr zdokonalená Eckhardtom [3], získava stále viac priaznivcov. Výhodou tejto techniky je neprítomnosť stehov na spojovke po operácii, menšia pooperačná reakcia, rýchlejšie pooperačné hojenie rán, intaktná spojovka v prípade nutnosti inej intraokulárnej operácie, napríklad filtračnej operácie pri glaukómovom ochorení, menšia pravdepodobnosť inkarcerácie vlákien sklovca do sklerotómie a skrátenie doby operácie. Nevýhodou môže byť pooperačná hypotónia, ak sú sklerotómie nedostatočne uzatvorené. Priemer inštrumentov sa oproti pôvodnej 20G PPV podstatne zmenšil, pri 23G PPV 0,64 mm a pri 25G PPV 0,51 mm. Pri tomto operačnom výkone sa 3 polyamidové kanyly alebo kovové trokáre zasúvajú transkonjunktiválne cez skléru v oblasti pars plana intravitreálne. Závádzajú sa cez ne do dutiny sklovca inštrumenty a infúzia. Po vytiahnutí inštrumentov miesto incízií nie je potrebné šiť. Uzatvárajú sa jednoduchou „masážou“ bez nutnosti šitia spojovky. Stále viac chirurgov sa prikláňa k 23G alebo 25G PPV a sú pracoviská, na ktorých počet operácii touto metódou dosahuje 100 %.
Pars plana vitrektómia so zlúpnutím vnútornej hraničnej membrány
V roku 2000 Gandorfer [10] ako prvý popísal zlepšenie videnia u 12 pacientov s DEM po PPV a zlúpnutí vnútornej hraničnej membrány sietnice (membrana limitans interna MLI). Zmenšenie alebo vymiznutie edému makuly pozoroval u všetkých 12 očí a zlepšenie videnia o 2 a viac riadkov bolo u 11 z 12 pacientov po 12 mesiacoch sledovania.
Význam zlúpnutia MLI v mikrochirurgickej liečbe DEM zatiaľ nie je presne známy. Matsunaga et al [19] v histopatologických vzorkách získaných počas operácie namerali až 2,5-krát väčšiu hrúbku MLI u pacientov operovaných pre DEM ako pre dieru makuly. Nastáva tu fibrocelulárna a fibrovaskulárna proliferácia a boli nájdené kontraktilné elementy – myofibroblasty, ktoré sú schopné tangenciálnej trakcie [19]. Zlúpnutie MLI nielen uvoľňuje trakčné sily z oblasti makuly, ale aj uľahčuje vstrebanie tekutiny zo sietnice a odstraňuje bariéru pre difúziu [10].
Najčastejšie používanou technikou zlúpnutia MLI je technika „šúpania jablka“. Rozsah zlúpnutia by nemal byť menší ako 2PD, 3 000 µm (obr. 5) [20].
5. Zlúpnutie vnútornej hraničnej membrány po ofarbení trypánovou modrou 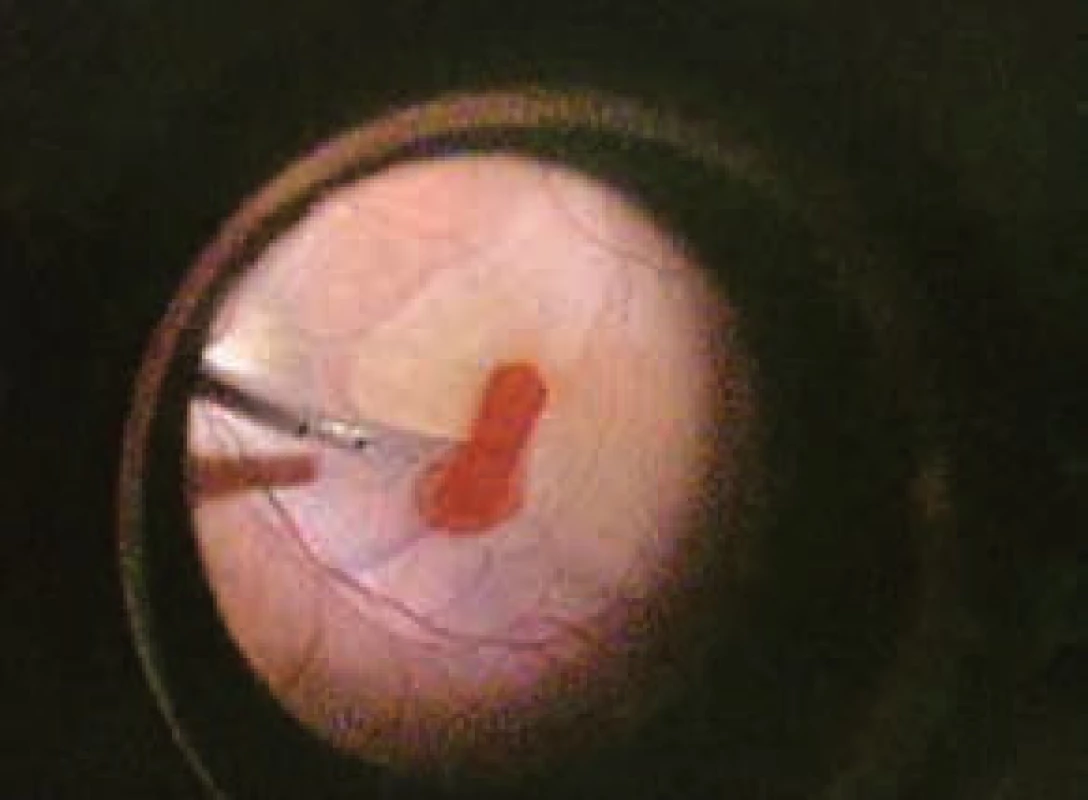
Peroperačne často len veľmi ťažko viditeľná MLI môže byť vizualizovaná intravitreálnou aplikáciou farbív ako je indocyanínová zelená, trypánová modrá, briliantová modrá a iné. Tieto farbivá nielen umožňujú zlúpnutie MLI, ale uľahčujú aj disekciu membrán alebo resekciu zbytkov sklovca [2,4,11].
Výskyt peroperačných komplikácií po PPV pri DR je porovnateľný s ostatnými vitreoretinálnymi výkonmi pri iných diagnózach. Najčastejšie peroperačné komplikácie sú trhliny a diery sietnice s pooperačným odlúčením sietnice a krvácanie do dutiny sklovca, ktoré sa vyskytuje u diabetických pacientov častejšie. Pooperačne najmä zvýšenie vnútroočného tlaku, vznik a progresia sivého zákalu, krvácanie do dutiny sklovca, odlúčenie sietnice a neovaskularizácia dúhovky . U pacientov po PPV bez zlúpnutia MLI bol popisovaný vznik epimakulárnej membrány v 10–12 % [10,28]. V prácach, v ktorých pacienti podstúpili PPV so zlúpnutím MLI, nebol pozorovaný vznik epimakulárnej membrány v pooperačnom obodbí. Vnútorná hraničná membrána funguje ako „lešenie“ pre proliferáciu astrocytov. Jej odstránením je možné predísť formovaniu epimakulárnej membrány v pooperačnom období [9]. Ako nežiadúce účinky zlúpnutia MLI môžu vzniknúť paramakulárne diery, defekt v perimetri, krvácania, či chorioretinopatia punctata [12].
Zlým prognostickým faktorom sú aj masívne tvrdé exsudáty (TE) v makule. U očí s rozsiahlymi TE je vysoké riziko vzniku subretinálnej fibrózy. Fong [8] u 264 očí s rozsiahlymi TE pozoroval subretinálnu fibrózu u 30,7 %, ale len u 0,05 % z 5 498 očí s DEM bez rozsiahlych TE.
Blokátory cievne endotelového rastového faktoru indukujú regresiu neovaskularizácií. Pred PPV sa používajú na zmenšenie intraoperačného krvácania, uľahčenie disekcie fibrovaskulárnych membrán, zníženie výskytu postoperačného krvácania do dutiny sklovca, ale aj na potenciálne zlepšenie NKCOZ. Aplikujú sa do dutiny sklovca najčastejšie 3–10 dní pred plánovanou operáciou. Opatrnosť sa odporúča pri očiach s trakčným odlúčením sietnice, u ktorých môže po aplikácii blokátora dôjsť ku kontrakcii týchto membrán a zvýšeniu ťahu na sietnicu [2,12].
Za posledné roky sa veľmi výrazne zmenil prístup k šošovke pri PPV u očí s diabetickou retinopatiou. U očí so šošovkou nie je možné dosiahnuť kompletné odstránenie prednej časti sklovca a po PPV veľmi často nastane vznik a progresia sivého zákalu. Niektorí chirurgovia najmä u starších ľudí odporúčajú v jednom sedení extrakapsulárnu extrakciu šošovky s implantáciou umelej vnútroočnej šošovky a následne PPV. Iní preferujú tento operačný postup zrealizovať v 2 krokoch. Najprv operáciu šošovky s implantáciou umelej vnútroočnej šošovky a v druhom kroku s odstupom času niekoľko týždňov zrealizovať PPV. U očí s progredujúcim zákalom šošovky nie je možné dobre vizualizovať sietnicu a adekvátne ju ošetriť.
Záver
Súčasné pokroky v prístrojovom vybavení, lepšie pochopenie patofyziológie a používanie nových medikamentov v liečbe stále zlepšujú výsledky chirurgickej liečby DR. Je veľmi dôležité, aby pacienti boli odosielaní na očné vyšetrenie včas a zabránilo sa tak vzniku neskorých ťažko liečbou ovplyvniteľných štádií diabetickej retinopatie, ktoré môžu spôsobiť až slepotu.
MUDr. Jana Štefaničková
jstefanicka@gmail.com
doc. MUDr. Vladimír Krásnik, PhD.
Klinika oftalmológie LF UK a UN Bratislava
www.fnspba.sk
Doručené do redakcie 24. júna 2013
Prijaté do tlače po recenzii 2. septembra 2013
Sources
1. Brancato R, Lumbroso, B. Guide to optical coherence tomography interpretation. I.N.C.Innovation – News – Communication: Roma 1994. ISBN 978–888–6193–4-12.
2. Colagross CT, Vail R et al. Diabetic vitrectomy: risks, prognosis, future trends. Curr Opin Opthalmol 2006; 17(3): 281–285.
3. Eckartd C. Transconjuctival sutureless 23-guage vitrectomy. Retina 2005; 25(2): 208–211.
4. Fišer I, Handlová R, Bedrich P et al. Peeling MLI v léčbe chorob vitreomakulárního rozhraní. In: Sborník abstrakt (8. Vejdovského olomoucký vědecký den, Olomouc, ČR, 24.3. 2007): 38–42.
5. Fišer I. Vitrektomie. In: Sosna T, Bouček P, Fišer I. Diabetická retinopatie: diagnostika, prevence a léčba. J. Cendelín: Praha 2001 : 209–229.
6. Flaxel CJ, Edwards AR, Aiello LP et al. Factors associated with visual acuity outcomes after vitrectomy for diabetic macular edema: diabetic retinopathy clinical research network. Retina 2010; 30(9): 1488–1495.
7. Fong DS, Aiello LP, Ferris FL 3rd et al. Diabetic Retinopathy. Diabetes Care 2004; 27(10): 2540–2553.
8. Fong DS, Segal PP, Myers F et al. Subretinal fibrosis in diabetic macular edema. EDTRS report 23. Arch Ophthalmol 1997; 115(7): 873–877.
9. Fuji GY, de Juan E jr, Humayun MS et al. A new 25-guage instrument system for transconjuctival sutureless vitrectomy surgery. Ophthalmology 2002; 109(10): 1807–1813.
10. Gandorfer A, Messmer E, Ulbig MW, Kampik A. Resolution of diabetic macular edema after surgical removal of the posterior hyaloid and the inner limiting membrane. Retina 2000; 20(2): 123–133.
11. Gandorfer A, Haritoglu C, Kampik A et al. Ultrastructure of the vitreoretinal interface following removal of the internal limiting membrane using indocyanine green. Curr Eye Res 2004; 29(4–5): 319–320.
12. Helbig H. Surgery for diabetic retinopathy. Ophthalmologica 2007; 221(2): 103–111.
13. Hikichi T, Fujio N, Akiba Y et al. Association between the short-term natural history of diabetic macular edema and the vitreomacular relationship in type II diabetes mellitus. Ophthalmology 1997; 104(3): 473–478.
14. Lang, GE. Optical coherence tomography findings in diabetic retinopathy. Dev Ophthalmol 2007; 39 : 31–47.
15. La Heij EC, Hendrikse F, Kessels AG et al. Vitrectomy results in diabetic macular edema without evident vitreomacular traction. Graefes Arch Clin Exp Ophthalmol 2001; 239(4): 264–270.
16. Lewis H, Abrams GW, Blumenkraz MSet al. Vitrectomy for diabetic macular traction and edema associated with posterior hyaloid traction. Ophthalmology 1992; 99(5): 753–759.
17. Machemer R, Norton EDW. A new concept for vitreous surgery. 3. Indications and results. Am J Ophtrhalmol 1972; 74(6): 1034–1056.
18. Massin P, Duguid G, Erginay A et al. Optical coherence tomography for evaluating diabetic macular edema before and after vitrectomy. Am J Ophthalmol 2003; 135(2): 169–177.
19. Matsunaga N, Ozeki H, Hirabayashi Y. Histopathologic evaluation of the internal limiting membrane surgically excised from eyes with diabetic maculopathy. Retina 2005; 25(3): 311–316.
20. Morris R, Witherspoon CD, Kuhn F et al. Forceps removal of the retina internal limiting membrane in surgery for macular hole and macular pucker. American Academy of Ophthalmology, Annual Meeting, Dallas, Texas, 22 - 25 október, 2000.
21. Nasrallah FP, Jalkh AE, van Coppenrolle F et al. The role of the vitreous in diabetic macular edema. Ophthalmology 1988; 95(10): 1335–1339.
22. Otani T, Kishi S. A controlled study of vitrectomy for diabetic macular edema. Am J Ophthalmol 2002; 134(2): 214–219.
23. Pendergast SD, Hassan TS, Williams GA et al. Vitrectomy for diffuse diabetic macular edema associated with a taut premacular posterior hyaloid. Am J Opthalmol 2000; 130(2): 178–186.
24. Rintelen F. Albrecht von Graefe, seine Persönlichkeit, seine Zeit” [Albrecht von Graefe, his personality and his times]. Albrecht Von Graefes Archiv Für Klinische Und Experimentelle Ophthalmologie 1971; 181 (2): 79–93.
25. Quiroz-Mercado H, Alfaro III DV, Ligget PE et al. Macular surgery. 2nd. ed. Lippincott Williams &Wilkins: Philadelphia 2011. ISBN 978-078-1797-1-53.
26. Tachi N, Ogino N. Vitrectomy for diffuse macular edema in cases of diabetic retinopathy. Am J Ophthalmol 1996; 122(2): 258–260.
27. The Diabetic Retinopathy Vitrectomy Study Research Group: Early vitrectomy for severe proliferative diabetic retinopathy in eyes with useful vision. Results of a randomized trial. Diabetic Retinopathy Vitrectomy Study Report Number 3. Ophthalmology 1988; 95(10): 1307–1320.
28. Yamamoto T, Akabane N, Takeuchi S. Vitrectomy for diabetic macular edema: The role of posterior vitreous detachment and epimacular membrane. Am J Ophthalmol 2001; 132(3): 369–377.
Labels
Diabetology Endocrinology Internal medicine
Article was published inForum Diabetologicum

2013 Issue 3-
All articles in this issue
- Uncomplicated course of diabetic retinopathy during pregnancy: case report
- Anti-VEGF treatment of diabetic 1. type: case report
- Diabetes mellitus and glaucoma
- First outcomes of The First Ophthalmological Reading Centre
- Index of key words
- Why is the treatment of diabetes important a how can be achieved?
- Diabetic retinopathy 3: surgical treatment
- Pregnancy and diabetic retinopathy – screening and therapy: case report
- Forum Diabetologicum
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diabetic retinopathy 3: surgical treatment
- Diabetes mellitus and glaucoma
- Anti-VEGF treatment of diabetic 1. type: case report
- Why is the treatment of diabetes important a how can be achieved?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

