-
Medical journals
- Career
Autozápalový proces v patogenéze generalizovanej pustulárnej psoriázy a perspektívy jej cielenej liečby
Authors: J. Javor; M. Buc; M. Bucová
Authors‘ workplace: Imunologický ústav, Lekárska fakulta Univerzity Komenského v Bratislave
Published in: Epidemiol. Mikrobiol. Imunol. 70, 2021, č. 3, s. 199-207
Category: Review Article
Overview
Dysregulovaný zápalový proces zohráva významnú úlohu nielen pri rozvoji chronickej plakovej psoriázy, ale je aj hlavným patogenetickým mechanizmom pri vzniku generalizovanej pustulárnej psoriázy a ďalších zriedkavých pustulárnych foriem choroby. Kľúčovými hráčmi v tomto procese sú cytokíny interleukín (IL)-1β, IL-6, faktor nekrotizujúci nádory (TNF), IL-12/23, IL-17A a najmä IL-36. Príčinou ich nadmernej aktivity alebo tvorby sú u niektorých pacientov s generalizovanou pustulárnou psoriázou mutácie v génoch, ktoré kódujú molekuly podieľajúce sa na inhibícii pôsobenia IL-36 (IL-36Ra) alebo na vnútrobunkovej zápalovej signalizácii (CARD14, AP1S3). Poznatky o patologickej úlohe zápalových cytokínov pri vzniku pustulárnych foriem psoriázy našli svoje uplatnenie aj v ich biologickej liečbe pomocou monoklonových protilátok, ktoré neutralizujú pôsobenie IL-12/23, IL-17A, TNF či IL-1β. Ako nádejné sa ukazujú aj monoklonové protilátky proti receptoru pre interleukín 36, ktoré už majú úspešne za sebou prvé fázy klinických skúšok a momentálne sa testuje ich dlhodobá účinnosť, bezpečnosť a tolerovateľnosť.
Klíčová slova:
autozápalová choroba – biologická liečba – generalizovaná pustulárna psoriáza – interleukín 36 – spesolimab
ÚVOD
Autoimunitné choroby sú prototypom patologických stavov, pri ktorých imunitný systém pacienta cielene napáda vlastné tkanivá v dôsledku straty schopnosti buniek adaptívnej zložky imunity tolerovať vlastné antigény. V posledných rokoch pribudli poznatky aj o ďalšej skupine imunitne podmienených chorôb s prívlastkom „auto“. Tieto tzv. autozápalové choroby sa líšia od autoimunitných predovšetkým tým, že rozhodujúcu úlohu v ich patogenéze zohrávajú mechanizmy prirodzenej imunity v podobe abnormálnej aktivácie zápalového procesu. Hranica medzi oboma skupinami chorôb však nie je ani zďaleka jednoznačná a v mnohých prípadoch sa na vzniku konkrétnej choroby podieľajú spoločne autoimunitné aj autozápalové mechanizmy [1, 2]. Jedným z takýchto príkladov je aj psoriáza, čo je chronická zápalová choroba kože vyznačujúca sa abnormálnou diferenciáciou a proliferáciou keratinocytov a infiltráciou postihnutej kože rôznymi populáciami leukocytov v dôsledku aktivácie mechanizmov adaptívnej a prirodzenej imunity [3].
Psoriáza je vo svojej podstate heterogénna skupina patologických stavov, u ktorých sa podiel autoimunitných a autozápalových procesov na ich rozvoji líši v závislosti od klinického podtypu choroby [2, 4]. Najčastejšou a najznámejšou formou choroby je chronická plaková psoriáza (psoriasis vulgaris – PV), ktorá postihuje približne 2–3 % kaukazoidnej populácie a prejavuje sa tvorbou charakteristických vyvýšených a dobre ohraničených ložísk zapálenej kože so striebristým ošupovaním [5]. V patogenéze tejto formy psoriázy dominuje autoimunitný proces vznikajúci na podklade komplexnej interakcie množstva genetických, epigenetických a environmentálnych faktorov. Rozpoznanie autoantigénov exprimovaných najmä na keratinocytoch a následná aktivácia autoreaktívnych pomocných (Th) a cytotoxických T-lymfocytov (Tc), ale aj prirodzených lymfoidných buniek (ILC), NKT-lymfocytov a ďalších buniek imunitného systému vedú k tvorbe viacerých cytokínov, ktoré pôsobia priamo na keratinocyty a zodpovedajú za vznik zápalu a charakteristických zmien v epiderme a derme [5–8]. Poznatky o rozhodujúcej úlohe imunitného systému pri rozvoji plakovej psoriázy našli svoje uplatnenie aj v jej liečbe, ktorej neoddeliteľnou súčasťou sa stali biologické preparáty (monoklonové protilátky a fúzne proteíny) neutralizujúce pôsobenie kľúčových cytokínov, ako sú interleukín (IL)-12/23, faktor nekrotizujúci nádory (TNF) a IL-17A [7]. Na opačnom konci psoriázového spektra sa nachádza pustulárna psoriáza (PP) a jej jednotlivé subtypy, ktoré sa v mnohých ohľadoch výrazne líšia od klasickej plakovej psoriázy a môžu sa preto považovať za samostatnú klinickú entitu [8, 9].
Cieľom tohto článku je predostrieť čitateľom aktuálne poznatky o imunopatogenéze generalizovanej pustulárnej psoriázy (GPP), čo je vzácna, ale klinicky najzávažnejšia forma psoriázy. Na nasledujúcich stranách sa okrem iného zameriavame najmä na úlohu autozápalového procesu a kľúčových cytokínov pri jej rozvoji, ale pozornosť venujeme aj prehľadu súčasných a perspektívnych možností cielenej liečby s dôrazom na biologickú liečbu GPP pomocou monoklonových protilátok.
PUSTULÁRNA PSORIÁZA A JEJ SUBTYPY
GPP je zriedkavá multisystémová choroba charakterizovaná tvorbou sterilných subkorneálnych pustúl, ktoré vznikajú na erytematóznom podklade a postihujú rozsiahle plochy kože [10–12]. V kaukazoidných populáciách sa vyskytuje u približne jedného až dvoch z milióna obyvateľov, pričom u žien je o niečo častejšia ako u mužov [9, 10, 13]. U dvoch tretín pacientov s GPP sa stretávame s akútnym rekurentným priebehom charakterizovaným náhlym vznikom erytematóznych plakov s difúznym výsevom pľuzgierov veľkosti špendlíkovej hlavičky, ktoré môžu splývať do rozsiahlych, hnisom vyplnených ložísk, označovaných aj ako „jazerá hnisu“. Postihnuté môžu byť aj nechty (subunguálne pustuly), jazyk (fisúry, geografický jazyk) a sliznica oči a úst [9, 14, 15]. Pri tomto subtype GPP, známom aj ako von Zumbuschova choroba, je postihnutá koža citlivá až bolestivá na dotyk a kožné prejavy bývajú sprevádzané systémovými prejavmi zápalu, ako je vysoká horúčka, zimnica, vyčerpanie, bolesť hlavy, nevoľnosť či nechutenstvo [15, 16]. V najťažších prípadoch sa môžu objaviť aj život ohrozujúce infekčné, zápalové, metabolické, hemodynamické a termoregulačné poruchy a komplikácie v dôsledku narušenia epidermovej bariéry, ako napr. sepsa, akútne renálne zlyhanie, akútne kongestívne zlyhanie srdca či syndróm akútnej respiračnej tiesne. K ďalším možným prejavom a komplikáciám patria artralgia, myalgia, intersticiálna pneumonitída, uveitída, tetánia, delírium, príznaky podráždenia tráviaceho traktu a cholestatická žltačka v dôsledku neutrofilovej cholangitídy [9, 10, 12, 14, 15].
Akútna GPP vzniká prevažne v tretej až piatej dekáde života, ale môže sa objaviť aj v detskom či dokonca dojčenskom veku [9, 12, 13, 17]. Infantilná/juvenilná GPP máva často miernejší priebeh so spontánnym odznením prejavov, dlhodobou remisiou a prejavmi pripomínajúcimi anulárnu GPP, čo je subakútna forma choroby charakterizovaná chýbajúcimi alebo len miernymi systémovými prejavmi zápalu a progredujúcimi erytematóznymi ložiskami s tvorbou pustúl na ich okrajoch [9, 15]. Akútny priebeh so systémovými prejavmi má aj GPP vznikajúca počas tehotenstva, ktorá je známa pod starším názvom impetigo herpetiformis (IH) a spája sa so zvýšeným rizikom insuficiencie placenty, predčasného pôrodu, potratu či fetálnych abnormalít [18].
Okrem GPP sa stretávame aj s lokalizovanými formami pustulárnej psoriázy, ktoré zahŕňajú palmoplantárnu pustulárnu psoriázu (PPP) charakterizovanú výsevom pustúl na dlaniach a chodidlách, a acrodermatitis continua (AC), čo je extrémne vzácna forma choroby vyznačujúca sa tvorbou pustúl na prstoch rúk a nôh a na nechtových lôžkach [10, 19, 20]. Oba menované typy pustulárnej psoriázy sa síce nespájajú so systémovými prejavmi zápalu a rozsah postihnutia kože je pri nich pomerne malý, napriek tomu ale ide aj vzhľadom na umiestnenie lézií o závažné choroby s výrazným negatívnym dopadom na kvalitu života pacientov, porovnateľným so stredne závažnými až ťažkými formami chronickej plakovej psoriázy [21, 22].
V histopatologickom obraze GPP dominujú známky intenzívnej zápalovej odpovede s výraznou infiltráciou papilárnej dermy a epidermy neutrofilmi, ktoré vytvárajú charakteristické subkorneálne spongiformné (Kogojove) pustuly. Prítomné bývajú aj Munroove mikroabscesy, papilárny a epidermový edém, hyperplázia suprapapilárnych kapilár, perivaskulárna infiltrácia dermy mononukleárnymi leukocytmi a známky abnormálnej proliferácie a diferenciácie keratinocytov, ako je akantóza, hyperkeratóza, parakeratóza a redukcia stratum granulosum [10, 12, 15, 23]. V laboratórnom obraze GPP možno pozorovať známky systémového zápalu, ako je zvýšená sedimentácia erytrocyov, zvýšené hladiny C-reaktívneho proteínu a leukocytóza s neutrofíliou, ďalej hypoalbuminémiu, hypokalciémiu či hypofosfatémiu, prípadne aj abnormálne výsledky pečeňových a renálnych testov a zmeny v lipidovom profile [10, 15].
IMUNITNÝ SYSTÉM V PATOGENÉZE GPP
Etiopatogenéza pustulárnych foriem psoriázy zostáva aj napriek značným pokrokom dosiahnutým v poslednej dekáde stále nedostatočne objasnená. Približne v polovici prípadov GPP a AC a u menej ako pätiny pacientov s PPP sa stretávame aj s prejavmi chronickej plakovej psoriázy, čo naznačuje, že niektoré imunopatogenetické mechanizmy sú spoločné pre rôzne formy a subtypy choroby [9, 10, 12, 13]. Hoci väčšina prípadov GPP je idiopatická, u niektorých pacientov sa dajú vystopovať faktory, ktoré pravdepodobne spúšťajú ataky choroby alebo exacerbujú jej priebeh. K nim patria najmä vírusové, baktériové a mykotické infekcie (cytomegalovírus, Epsteinov-Barrovej vírus, varicella-zoster vírus, streptokoky a iné), niektoré lieky (aspirín, sulfónamidy, lítium, propranolol, ramipril, amoxycilín, penicilín, fenylbutazón, terbinafín, interferón-alfa, morfín a iné), vakcíny (BCG, H1N1), psychoemočný stres, UV-žiarenie, menštruácia, hormonálne a iné zmeny počas tehotenstva a hypokalciémia. Z terapeutického hľadiska je tiež zaujímavá spojitosť medzi vznikom akútnej GPP a náhlym ukončením systémovej liečby kortikosteroidmi alebo cyklosporínom či paradoxný vplyv inhibítorov TNF (napr. infliximabu) a IL-12/23 (ustekinumabu) na indukciu choroby u niektorých pacientov liečených napr. na plakovú psoriázu alebo inú autoimunitnú chorobu [9, 10, 12, 15, 24].
Podobne ako v prípade chronickej plakovej psoriázy je aj pri GPP možné pozorovať zvýšenú expresiu viacerých cytokínov produkovaných Th17 a Th1 lymfocytmi, vrátane IL-17A, IL-23, TNF a interferónu (IFN)-γ. V porovnaní s prvou menovanou je však u GPP zjavná výraznejšia úloha mechanizmov prirodzenej imunity, ktoré sú sprostredkované najmä cytokínmi IL-1β a IL-36 a chemokínmi CXCL8 (IL-8), CXCL1 a CXCL2 [3, 8, 9, 25]. V imunopatogenéze GPP, ale aj lokálnych foriem pustulárnej psoriázy, tak dominuje autozápalový proces s abnormálnou aktiváciou prozápalových signalizačných kaskád [25]. Dnes je už zrejmé, že kľúčovými hráčmi pri vzniku choroby sú samotné keratinocyty. Hoci ich primárnou funkciou je vytvárať mechanickú bariéru proti agensom z vonkajšieho prostredia, o nič menší význam nemá ani ich úloha pri obranných reakciách prirodzenej imunity a rozvoji zápalu. Pre tieto účely keratinocyty exprimujú viaceré vzorkové receptory (pattern recognition receptors – PRR), ktoré dokážu zachytiť prítomnosť ligandov pochádzajúcich z patogénnych mikroorganizmov a poškodených buniek, ako aj receptory pre cytokíny produkované bunkami imunitného systému (IL-17, IL-22, TNF, IFN-γ, IL-36) [26]. Výsledkom stimulácie vzorkových a cytokínových receptorov je popri indukcii tvorby antimikrobiálnych peptidov (katelicidínov, β-defenzínov, S100 proteínov) aj aktivácia signalizačných dráh zodpovedných za indukciu tvorby prozápalových cytokínov a chemokínov, ako sú IL-1β, IL-6, TNF, IL-36, CXCL8, CXCL1, CXCL2, CXCL10, CCL2, CCL3, CCL5 a CCL20. Tieto sú potrebné pre spustenie a udržiavanie lokálnej (a prípadne i systémovej) zápalovej reakcie a prísun leukocytov do postihnutého ložiska (obr. 1) [3, 24, 27].
Image 1. Úloha IL-36 a ďalších cytokínov v imunopatogenéze generalizovanej pustulárnej psoriázy
Figure 1. The role of IL-36 and other cytokines in the immunopathogenesis of generalized pustular psoriasis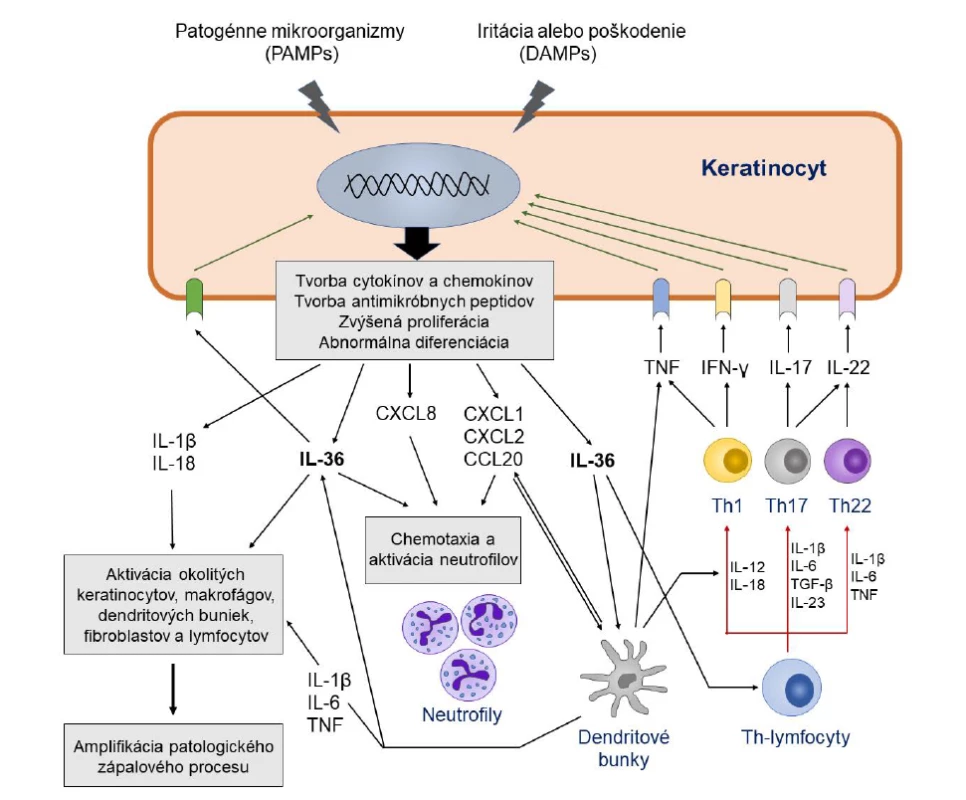
IL-36 produkovaný stimulovanými keratinocytmi sa po väzbe na svoj receptor IL-36R podieľa na ďalšej aktivácii keratinocytov, neutrofilov, dendritových buniek, T-lymfocytov a iných buniek. Pod vplyvom IL-36 a ďalších cytokínov a chemokínov tvorených týmito bunkami vznikajú charakteristické patologické zmeny v koži, ako sú nadmerná proliferácia a abnormálna diferenciácia keratinocytov, vznik zápalového infiltrátu, zvýšená angiogenéza a tvorba mikroabscesov a pustúl.
PAMPs – pathogen-associated molecular patterns (molekulové vzory patogénnych mikroorganizmov); DAMPs – damage- associated molecular patterns (molekulové vzory vznikajúce pri poškodení tkaniva)
IL-36 produced by stimulated keratinocytes, upon binding to its IL-36R receptor, is involved in the further activation of keratinocytes, neutrophils, dendritic cells, T-lymphocytes and other cells. Under the influence of IL-36 and other cytokines and chemokines produced by these cells, characteristic pathological changes in the skin occur, such as excessive proliferation and abnormal differentiation of keratinocytes, formation of inflammatory infiltrate, increased angiogenesis, and the formation of microabscesses and pustules.
PAMPs – pathogen-associated molecular patterns; DAMPs – damage-associated molecular patternsJedným z kľúčových cytokínov produkovaným keratinocytmi, fibroblastmi, endotelovými bunkami, makrofágmi, lymfocytmi, Langerhansovými bunkami a dendritovými bunkami v koži v odpovedi na rôzne exo - aj endogénne stresové stimuly a prozápalové signály je interleukín 36 [27, 28]. V skutočnosti ide o skupinu cytokínov, ktorej štyria existujúci zástupcovia IL-36α, IL-36β, IL-36γ a receptorový antagonista IL-36Ra sú kódovaní génmi nachádzajúcimi sa v tesnej blízkosti na chromozóme 2 [27]. Jednotlivé izoformy IL-36 sú členmi IL-1 cytokínovej rodiny a podobne ako jej najznámejší člen IL-1β sa tiež syntetizujú ako prekurzorové proteíny s minimálnou funkčnou aktivitou, ktoré sa na svoju premenu na plne aktívnu biologickú formu musia rozštiepiť pôsobením špecifických proteáz [3, 29]. V prípade IL-36 sa tak deje v extracelulárnom priestore pôsobením proteáz produkovaných neutrofilmi (elastáza, proteáza, katepsín S a G) alebo samotnými keratinocytmi (katepsín S), vďaka čomu sa aktivita IL-36 zvýši sto až tisícnásobne [30]. Proteázy schopné štiepiť IL-36 sa môžu vyskytovať vo voľnej forme alebo ako súčasť neutrofilových extracelulárnych pascí (neutrophil extracellular traps – NET), ktorých kostru tvoria vlákna nukleových kyselín pochádzajúcich z neutrofilov (obr. 2) [31].
Image 2. Mechanizmus pôsobenia IL-36 na keratinocyty
Figure 2. Mechanism of action of IL-36 on keratinocytes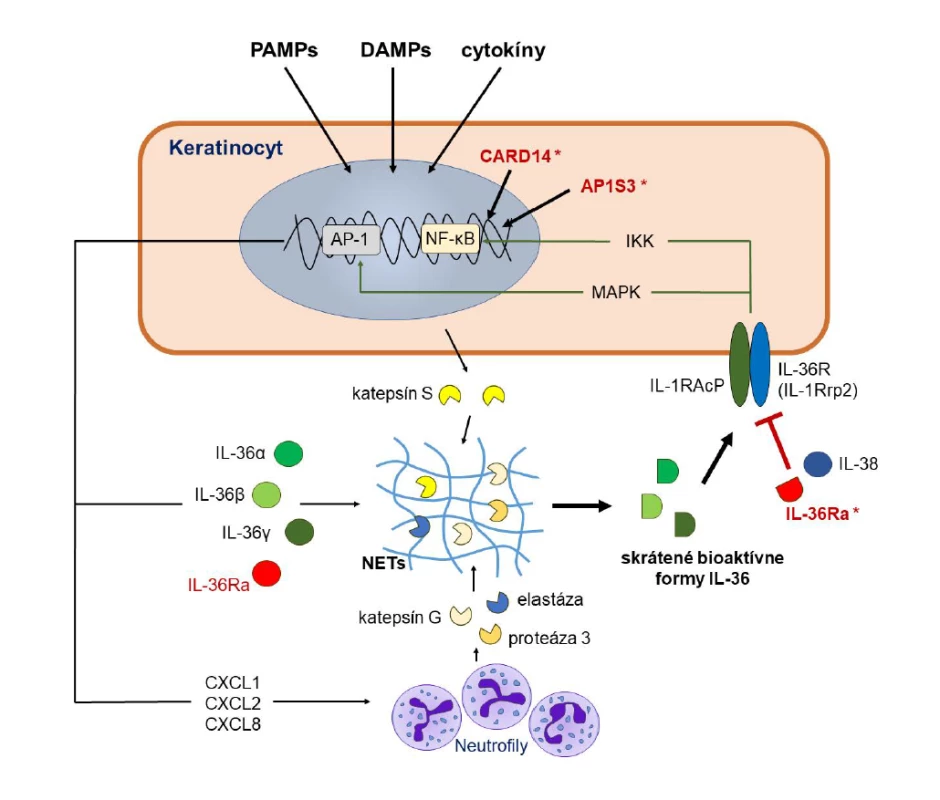
Aktivácia keratinocytov zvyšuje tvorbu štyroch členov rodiny IL-36 (IL-36α, IL-36β, IL-36γ a IL-36Ra), ktoré majú len minimálnu biologickú aktivitu. Ak však dôjde k ich vystaveniu pôsobeniu proteáz uvoľnených z keratinocytov alebo neutrofilov, ich aktivita sa mnohonásobne zvýši. Skrátené formy IL-36 sa následne viažu na receptor IL-36R (IL-1Rrp2), ktorý po svojej heterodimerizácii s IL-1RAcP indukuje vnútrobunkové signalizačné dráhy sprostredkované NF-κB a MAPK. Výsledkom je indukcia expresie viacerých zápalových cytokínov, chemokínov a rastových faktorov, vrátane samotného IL-36. Pôsobenie IL-36 regulujú jeho prirodzení antagonisti IL-36Ra a IL-38. Mutácie v géne IL36RN vedú k strate schopnosti IL-36Ra blokovať pôsobenie IL-36 a teda aj k nadmernej aktivácii zápalových signalizačných kaskád. Výsledkom je indukcia patologického autozápalového procesu vedúceho ku GPP. Podobný efekt majú aj niektoré mutácie v génoch CARD14 a AP1S3, ktoré spôsobujú nadmernú aktivitu NF-κB.
MAPK – mitogen-activated protein kinase; NET – neutrophil extracellular traps (neutrofilové extracelulárne pasce); NF-κB – nuclear factor kappa-light-chain-enhancer of activated B cells
Keratinocyte activation enhances the release of four members of the IL-36 family (IL-36α, IL-36β, IL-36γ and IL-36Rα), which have only minimal biological activity. However, if they are exposed to proteases released from keratinocytes or neutrophils, their activity is multiplied. Truncated forms of IL-36 subsequently bind to the IL-36R receptor (IL-1Rrp2), which upon its heterodimerization with IL-1RAcP induces intracellular signaling pathways mediated by NF-κB and MAPK. The result is the induction of the expression of several inflammatory cytokines, chemokines and growth factors, including IL-36 itself. The action of IL-36 is regulated by its natural antagonists IL-36Rα and IL-38. Mutations in the IL36RN gene lead to the loss of the ability of IL-36Ra to block the action of IL-36 and thus to the over-activation of inflammatory signaling cascades. The result is the induction of a pathological autoinflammatory process leading to GPP. Some mutations in the CARD14 and AP1S3 genes that cause NF-κB overactivity have a similar effect.
MAPK – mitogen-activated protein kinase; NET – neutrophil extracellular traps; NF-κB – nuclear factor kappa-light-chain-enhancer of activated B cellsCytokíny IL-36 sa po svojej aktivácii následne viažu na receptor IL-36R (IL-1Rrp2) v membránach terčových buniek, pričom môžu pôsobiť autokrinne (na keratinocyty, ktoré ich vytvorili) a parakrinne (na iné keratinocyty, makrofágy a dendritové bunky v okolí) [26]. Väzba IL-36α, IL-36β a IL-36γ na receptor vedie k jeho heterodimerizácii s akcesórnym proteínom receptora pre IL-1 (IL-1RAcP) a k následnej indukcii špecifických vnútrobunkových signalizačných dráh sprostredkovaných NF-κB (nuclear factor kappa-light-chain-enhancer of activated B cells) a MAPK (mitogen-activated protein kinase) [32, 33]. Tieto sú priamo zodpovedné za indukciu expresie génov pre viaceré vyššie spomínané zápalové cytokíny, chemokíny a rastové faktory [3, 29, 34, 35]. Pod ich vplyvom, ako aj pod vplyvom samotného IL-36 migrujú do ložiska neutrofily, monocyty, dendritové bunky a lymfocyty a dochádza k ich aktivácii. Neutrofily zodpovedajú za vznik mikroabscesov, pustúl a tvorbu IL-17A, zatiaľ čo makrofágy a dendritové bunky tvoria cytokíny (IL-1β, TNF, IL-6, IL-36) a chemokíny, ktoré sa podieľajú na ďalšej amplifikácii zápalového procesu. Na ňom sa do určitej miery zúčastňujú aj aktivované pomocné T lymfocyty (Th17, Th22, Th1), γδ T-lymfocyty a prirodzené lymfoidné bunky (ILC3), ktoré vznikajú pod vplyvom IL-12, IL-23, IL-1β a IL-36 tvorených aktivovanými dendritovými bunkami, makrofágmi a keratinocytmi. Cytokíny IL-17A, IL-22 a IFN-γ sa následne ako produkty aktivovaných T lymfocytov, ILC-buniek, neutrofilov a mastocytov viažu na svoje receptory v membráne keratinocytov a spolu s IL-36 navodzujú ich nadmernú proliferáciu, abnormálnu diferenciáciu a ďalšiu tvorbu zápalových cytokínov, vrátane samotného IL-36, čím sa vytvára akýsi bludný kruh (obr. 1) [3, 9, 27–29, 36, 37]. Väzba IL-36 na svoje receptory na endotelových bunkách a fibroblastoch tiež prispieva k angiogenéze a transmigrácii leukocytov do postihnutej kože [3].
Pôsobenie IL-36 je regulované ďalšími dvoma členmi IL-1 rodiny, ktorí sa dokážu viazať na rovnaký receptor IL-36R, a to prirodzeným antagonistom IL-36Ra a cytokínom IL-38. Ich väzba na IL-36R bráni pripojeniu IL-1RAcP k receptoru a tak vedie k potlačeniu horeuvedených prozápalových signalizačných dráh (viď obr. 2) [28, 33, 38]. Bez dostatočného protizápalového pôsobenia IL-36Ra či IL-38 alebo pri poruchách regulácie vnútrobunkových signalizačných dráh sa aktivita IL-36 vymyká spod kontroly a jeho schopnosť zvyšovať tvorbu zápalových cytokínov sa stáva hlavným mechanizmom zodpovedným za vznik GPP a iných foriem pustulárnej psoriázy [3].
GENETICKÉ DEFEKTY VEDÚCE K VZNIKU GPP
Významnú úlohu pri vzniku abnormalít v signalizácii sprostredkovanej IL-36 a tak aj pri vzniku pustulárnej psoriázy zohrávajú určité genetické faktory, pričom ich identitu sa podarilo čiastočne odhaliť až v poslednom desaťročí. Nadmerná a nekontrolovaná aktivita IL-36 sa u približne tretiny až polovice pacientov s familiárnou aj sporadickou GPP spája s tzv. loss-of-function mutáciami v géne IL36RN, ktorý kóduje prirodzeného antagonistu receptora pre IL-36 (IL-36Ra) [8, 9, 13, 39–44]. Vo väčšine prípadov ide o bodové mutácie, ktoré sa nachádzajú v kódujúcich alebo regulačných oblastiach génu a vedú k čiastočnej (hypomorfné mutácie) alebo úplnej (amorfné mutácie) strate tvorby alebo funkcie IL-36Ra. V dôsledku toho dochádza k nedostatočnej regulácii signalizácie sprostredkovanej IL-36 a následne k zvýšenej tvorbe prozápalových cytokínov a chemokínov v keratinocytoch a makrofágoch [14, 39, 43]. Dedičnosť choroby je autozómovo recesívna (AR), pričom u väčšiny pacientov sa stretávame s homozygotnými mutáciami, t. j. rovnakými mutáciami na oboch chromozómoch. Za menšiu časť prípadov zodpovedajú tzv. zložené heterozygotné mutácie, kedy postihnutý jedinec má na každom z páru chromozómov inú mutáciu [41]. Akútnu GPP spôsobenú genetickými defektami IL36RN s monogénovou AR dedičnosťou označujeme ako syndróm DITRA (deficiency of interleukin-36 receptor antagonist), ktorý podľa najnovšej klasifikácie Medzinárodnej únie imunologických spoločností (IUIS) zaraďujeme medzi primárne imunodeficiencie, a to do skupiny tzv. autozápalových chorôb [45]. V niektorých prípadoch sa podarilo identifikovať aj pacientov s mutáciou IL36RN len na jednom chromozóme, ale aj zdravých jedincov s homozygotnými či zloženými heterozygotnými mutáciami. To naznačuje, že choroba môže mať aj oligogénový základ, kedy pacienti budú mať ešte ďalšiu mutáciu v inom géne alebo génoch, prípadne budú k jej vzniku potrebné aj epigenetické a environmentálne faktory [13, 14, 43, 46].
Geneticky podmienená deficiencia IL-36Ra sa spája so skorším nástupom GPP (niekedy už v rannom detstve a adolescencii), pričom sa dá pozorovať tzv. efekt dávky, t. j. homozygoti a zložení heterozygoti zväčša vyvíjajú chorobu skôr ako heterozygoti a tí zase skôr ako pacienti bez mutácií v IL36RN [12, 13, 43]. Stojí tiež za zmienku, že mutácie v IL36RN sú časté najmä u GPP pacientov bez súbežného výskytu plakovej psoriázy, kým u pacientov s oboma formami psoriázy sú zriedkavejšie [47, 48]. Hoci sa s mutáciami v IL36RN najčastejšie stretávame u pacientov s GPP, postupne pribúdajú aj poznatky o ich úlohe pri vzniku lokalizovaných foriem pustulárnej psoriázy, najmä AC [13, 14, 43].
U pacientov s GPP sa častejšie ako v bežnej populácii vyskytujú aj heterozygotné mutácie v géne CARD14, ktorý kóduje molekulu caspase recruitment domain-containing protein 14 [41, 49, 50]. CARD14 patrí do rodiny proteínov pôsobiacich ako akési molekulové „lešenia“ potrebné na zostavovanie cytoplazmových multiproteínových komplexov, ktoré sú súčasťou vnútrobunkových signalizačných kaskád. Komplex vznikajúci za pomoci CARD14 pôsobí v keratinocytoch ako pozitívny regulátor apoptózy a prozápalovej signalizácie sprostredkovanej NF-κB [12]. Gain-of-function (hypermorfné) mutácie v CARD14 géne spôsobujú abnormálne zvýšenú aktivitu CARD14 a teda aj nadmernú aktivitu NF-κB v keratinocytoch. Keďže tento transkripčný faktor sa podieľa na expresii viacerých zápalových cytokínov a chemokínov a na modulácii diferenciácie a proliferácie keratinocytov, geneticky podmienená porucha pôsobenia CARD14 takto vedie k indukcii zápalovej reakcie a ďalších patologických zmien pozorovaných pri GPP [4, 12, 41]. Podobne, ako tomu bolo v prípade DITRA, aj deficienciu CARD14 zaraďujeme medzi monogénové autozápalové choroby a označujeme názvom CAMPS (CARD14-mediated psoriasis) [45]. Okrem generalizovanej formy choroby sa môžeme s mutáciami v CARD14 stretnúť aj u niektorých pacientov s PPP a pityriasis rubra pilaris, ale aj u zriedkavej familiárnej formy plakovej psoriázy s autozómovo dominantnou formou dedičnosti [14].
Tretí gén, pri ktorom sa našli mutácie spájajúce sa so vznikom nielen GPP, ale aj AC a PPP, je AP1S3. Kóduje adaptorový proteín AP-1 complex subunit s1C, ktorý je v keratinocytoch súčasťou komplexu podieľajúceho sa na cytoplazmovom vezikulárnom transporte proteínov medzi Golgiho aparátom a endozómami [51]. Loss-of-function mutácie v AP1S3 vedú k abnormalitám v transporte vzorkového receptoru TLR3, poruchám autofagocytózy a zvýšenej aktivácii NF-κB a transkripcii génu pre IL-36α [14, 51, 52]. Nedávne pomerne rozsiahle štúdie ukázali, že celkový vplyv AP1S3 a CARD14 mutácií na vznik GPP je v porovnaní s IL36RN mutáciami menej významný [13, 43].
KONVENČNÁ A CIELENÁ LIEČBA GPP
Zriedkavý výskyt GPP, pretrvávajúce medzery v poznatkoch o jej imunopatogenéze, ako aj relatívny nedostatok kvalitných objektívnych údajov o účinnosti jednotlivých preparátov zatiaľ sťažujú zavedenie štandardných postupov pre liečbu tejto zriedkavej dermatitídy. V Spojených štátoch ani v Európe momentálne nie sú dispozícii látky schválené špecificky pre liečbu GPP, a pri jej zvládaní sa tak často riadime usmerneniami platnými pre plakovú psoriázu [16, 53]. Odlišná situácia je v Japonsku, kde boli pomerne nedávno vypracované usmernenia pre diagnostiku a liečbu GPP, vrátane použitia niektorých biologických liečiv [23]. Voľba liečebného postupu by každopádne mala reflektovať stupeň závažnosti choroby a prítomnosť prípadných komplikácií. V rámci komplexnej starostlivosti o pacienta sa v systémovej liečbe akútnej GPP najčastejšie uplatňujú re - tinoid acitretín, cyklosporín A, metotrexát a monoklonová anti-TNF protilátka infliximab [10, 12, 23, 53]. Pri ich nedostupnosti je možné zvážiť aj použitie orálnych kortikosteroidov, ich podávanie by sa však malo riadiť zvýšenou opatrnosťou z dôvodu rizika exacerbácie choroby pri ich rýchlom vysadení [16]. Ako liečivá druhej línie pripadajú do úvahy ďalšie TNF inhibítory (adalimumab, etanercept), ako aj lokálne kortikosteroidy, retinoidy (kalcipotrién), tacrolimus a fototerapia UVA žiarením v kombinácii s psoralénom (PUVA), resp. UVB fototerapia u detí a tehotných žien [10, 12, 18, 53]. Ďalšou možnosťou použiteľnou vo všetkých skupinách pacientov je aj granulocytová/monocytová adsorbčná aferéza [23].
Keďže pri rozvoji GPP zohrávajú centrálnu úlohu narušené mechanizmy prirodzenej imunity s nadmernou aktiváciou zápalovej kaskády, v jej off-label liečbe sa uplatňujú aj ďalšie biologické liečivá neutralizujúce pôsobenie cytokínov IL-1β (anakinra, canakinumab, gevokizumab), IL-6 (tocilizumab), IL-17A (secukinumab, ixekizumab, brodalumab), IL-12/23 (ustekinumab) a IL - -23A (guselkumab) [10, 12, 16]. Nedávne práce, ktoré analyzovali dostupnú literatúru o prípadoch cielenej biologickej liečby GPP a vyhodnocovali jej účinnosť ukázali, že biologické preparáty sa môžu skutočne efektívne používať v liečbe GPP v dospelom veku [9] aj u detí s DITRA [44]. Je zaujímavé, že v oboch vekových skupinách sa ako najúčinnejšie javili monoklonové protilátky proti IL-12/23 a IL-17, kým naopak inhibítory IL-1 sa ukazovali ako menej efektívne [9, 44]. Pozitívne výsledky liečby s niektorými biologickými preparátmi priniesli aj menšie open-label klinické štúdie u japonských pacientov s GPP, konkrétne išlo o adalimumab [54], guselkumab [55], secukinumab [56], ixekizumab [57, 58] a brodalumab [59]. Aj vďaka týmto štúdiám sa dostali v Japonsku uvedené biologiká medzi liečivá odporúčané k liečbe GPP [23].
Ďalšími atraktívnymi terčmi biologickej liečby GPP sa vzhľadom na ich kľúčovú úlohu pri indukcii patologických zmien pochopiteľne stali aj IL-36, resp. ich receptor IL-36R [3]. Prvé fázy klinických skúšok s dvoma takýmito preparátmi už priniesli sľubné výsledky. Spesolimab (BI 655130) je humanizovaná monoklonová protilátka proti IL-36R, ktorá sa v klinickej štúdii fázy 1 na overenie konceptu aplikovala intravenózne siedmim pacientom s GPP v jedinej dávke 10 mg/kg [60]. Závažnosť choroby (tvorba pustúl, erytému a ošupovanie lézií) sa na začiatku štúdie u každého z pacientov kvantifikovala pomocou tzv. Generalized Pustular Psoriasis Physician Global Assessment (GPPGA) skóre v stupnici od 0 do 4, pričom priemerné skóre u pacientov bolo 3 (stredne závažná choroba). Po prvom týždni od podania monoklonovej protilátky dosiahlo skóre 0 alebo 1 (čistá alebo takmer čistá koža) päť pacientov a po štyroch týždňoch všetci siedmi. Pacienti sa hodnotili aj pomocou Generalized Pustular Psoriasis Area and Severity Index (GPPASI) skóre v stupnici od 0 po 72, pričom do konca prvého týždňa došlo k jeho zlepšeniu v priemere o 59 % a po štyroch týždňoch o 80 %. Efekt liečby pretrvával aj po dvadsiatich týždňoch, pričom nezávisel od prítomnosti mutácií v IL36RN. U žiadneho z pacientov sa neobjavili závažnejšie vedľajšie účinky liečby [60, 61]. Spesolimab sa ako perspektívny preparát pre liečbu GPP momentálne testuje v dvoch multicentrických, dvojito zaslepených, randomizovaných, placebom kontrolovaných štúdiách fázy 2, ktoré vyhodnocujú jeho účinnosť, bezpečnosť a tolerovateľnosť po jednorazovej intravenóznej dávke u pacientov s akútnymi prejavmi GPP [62], respektíve jeho bezpečnosť a účinnosť pri prevencii opätovného vzplanutia choroby v závislosti od rôznych dávok liečiva [63]. Treťou štúdiou je open-label nerandomizovaná štúdia fázy 3, ktorá vyhodnocuje dlhodobú bezpečnosť a účinnosť spesolimabu pri intravenóznej, resp. subkutánnej aplikácii každých šesť týždňov a subkutánnej aplikácii každých dvanásť týždňov [64]. Ako perspektívne sa javí aj použitie spesolimabu v liečbe PPP; momentálne prebiehajú alebo už prebehli multicentrické, dvojito zaslepené, randomizované, placebom kontrolované štúdie fázy 2 s cieľom vyhodnotiť jeho účinnosť a bezpečnosť pri rôznych subkutánnych [65], resp. intravenóznych dávkach liečiva [66]. Ďalšou humanizovanou monoklonovou protilátkou proti IL-36R je ANB019, ktorej účinnosť a bezpečnosť pri subkutánnej aplikácii každé štyri týždne sa aktuálne testuje v open-label štúdii fázy 2 s pacientmi s GPP [67] a v dvojito zaslepenej, randomizovanej, placebom kontrolovanej štúdii fázy 2 s pacientmi s PPP [68].
Ďalším spôsobom inhibície IL-36 by mohlo byť použitie nízkomolekulových inhibítorov neutrofilových a keratinocytových proteáz (katepsínov S a G, elastázy, proteinázy 3), ktoré sú potrebné na premenu IL-36 na jeho bioaktívne formy. Vo fáze predklinických skúšok sa ako sľubné ukázali viaceré takéto látky, ktoré by perspektívne pripadali do úvahy ako lokálne preparáty nielen pre cielenú liečbu pustulárnej psoriázy, ale aj chronickej plakovej psoriázy, pri ktorej sú hladiny IL-36 tiež zvýšené a podieľajú sa na rozvoji zápalového procesu [8, 69, 70].
ZÁVER
Zápalový proces, ktorý sa vymkol spod kontroly, zohráva významnú úlohu pri rozvoji chronickej plakovej psoriázy a je dokonca hlavným patogenetickým mechanizmom pri vzniku pustulárnych foriem choroby. Poznatky o úlohe zápalových cytokínov v tomto procese našli svoje uplatnenie aj v biologickej liečbe týchto zriedkavých podtypov psoriázy, pričom ako najúčinnejšie sa ukazujú monoklonové protilátky neutralizujúce pôsobenie cytokínov IL-12/IL-23, IL-17A a TNF. Identifikácia IL-36 a geneticky podmienenej deficiencie receptorového antagonistu IL-36Ra ako kľúčových faktorov pri rozvoji pustulárnych foriem psoriázy viedla k vývoju nových biologík a preparátov na báze malých molekúl, ktoré by sa v prípade úspešného absolvovania klinických skúšok mohli v nasledujúcich rokoch stať základom novej cielenej liečby GPP a ďalších foriem psoriázy.
Do redakce došlo dne 20. 7. 2020.
Adresa pre korešpondenciu:
MUDr. Juraj Javor, PhD.
Imunologický ústav
Lekárska fakulta Univerzity Komenského v Bratislave
Odborárske námestie 14
813 72 Bratislava
Slovenská republika
e-mail: juraj.javor@fmed.uniba.sk
Sources
1. Hedrich CM. Shaping the spectrum – From autoinflammation to autoimmunity. Clin Immunol, 2016;165 : 21–28.
2. Liang Y, Sarkar MK, Tsoi LC et al. Psoriasis: a mixed autoimmune and autoinflammatory disease. Curr Opin Immunol, 2017;49 : 1–8.
3. Madonna S, Girolomoni G, Dinarello CA et al. The Significance of IL-36 Hyperactivation and IL-36R Targeting in Psoriasis. Int J Mol Sci, 2019;20(13):3318.
4. Akiyama M, Takeichi T, McGrath JA et al. Autoinflammatory keratinization diseases: An emerging concept encompassing various inflammatory keratinization disorders of the skin. J Dermatol Sci, 2018;90(2):105–111.
5. Boehncke WH, Schön MP. Psoriasis. Lancet, 2015;386(9997):983–994.
6. Lowes MA, Suárez-Fariñas M, Krueger JG. Immunology of Psoriasis. Annu Rev Immunol, 2014;32 : 227–255.
7. Hawkes JE, Chan TC, Krueger JG. Psoriasis pathogenesis and the development of novel targeted immune therapies. J Allergy Clin Immunol, 2017;140(3):645–653.
8. Furue K, Yamamura K, Tsuji G et al. Highlighting Interleukin-36 Signalling in Plaque Psoriasis and Pustular Psoriasis. Acta Derm Venereol, 2018;98(1):5–13.
9. Boehner A, Navarini AA, Eyerich K. Generalized pustular psoriasis - a model disease for specific targeted immunotherapy, systematic review. Exp Dermatol, 2018;27(10):1067–1077.
10. Benjegerdes KE, Hyde K, Kivelevitch D et al. Pustular psoriasis: pathophysiology and current treatment perspectives. Psoriasis (Auckl), 2016;6 : 131–144.
11. Navarini AA, Burden AD, Capon F et al. European consensus statement on phenotypes of pustular psoriasis. J Eur Acad Dermatol Venereol, 2017;31(11):1792–1799.
12. Hoegler KM, John AM, Handler MZ et al. Generalized pustular psoriasis: a review and update on treatment. J Eur Acad Dermatol Venereol, 2018;32(10):1645–1651.
13. Twelves S, Mostafa A, Dand N et al. Clinical and genetic differences between pustular psoriasis subtypes. J Allergy Clin Immunol, 2019;143(3):1021–1026.
14. Bachelez H. Pustular psoriasis and related pustular skin diseases. Br J Dermatol, 2018;178(3):614–618.
15. Ly K, Beck KM, Smith MP et al. Diagnosis and screening of patients with generalized pustular psoriasis. Psoriasis (Auckl), 2019;9 : 37–42.
16. Gooderham MJ, Van Voorhees AS, Lebwohl MG. An Update on Generalized Pustular Psoriasis. Expert Rev Clin Immunol, 2019;15(9):907–919.
17. Popadic S, Nikolic M. Pustular psoriasis in childhood and adolescence: a 20-year single-center experience. Pediatr Dermatol, 2014;31(5):575–579.
18. Trivedi MK, Vaughn AR, Murase JE. Pustular psoriasis of pregnancy: current perspectives. Int J Womens Health, 2018;10 : 109–115.
19. Sehgal VN, Verma P, Sharma S et al. Acrodermatitis continua of Hallopeau: evolution of treatment options. Int J Dermatol, 2011;50(10):1195–1211.
20. Misiak-Galazka M, Wolska H, Rudnicka L. What do we know about palmoplantar pustulosis? J Eur Acad Dermatol Venereol, 2017;31(1):38–44.
21. Chung J, Callis Duffin K, Takeshita J et al. Palmoplantar psoriasis is associated with greater impairment of health-related quality of life compared with moderate to severe plaque psoriasis. J Am Acad Dermatol, 2014;71(4):623–632.
22. Trattner H, Blüml S, Steiner I et al. Quality of life and comorbidities in palmoplantar pustulosis - a cross-sectional study on 102 patients. J Eur Acad Dermatol Venereol, 2017;31(10):1681–1685.
23. Fujita H, Terui T, Hayama K et al. Japanese guidelines for the management and treatment of generalized pustular psoriasis: The new pathogenesis and treatment of GPP. J Dermatol, 2018;45(11):1235–1270.
24. Choon SE, Lai NM, Mohammad NA et al. Clinical profile, morbidity, and outcome of adult-onset generalized pustular psoriasis: analysis of 102 cases seen in a tertiary hospital in Johor, Malaysia. Int J Dermatol, 2014;53(6):676–684.
25. Johnston A, Xing X, Wolterink L et al. IL-1 and IL-36 are dominant cytokines in generalized pustular psoriasis. J Allergy Clin Immunol, 2017;140(1):109–120.
26. Bassoy EY, Towne JE, Gabay C. Regulation and function of interleukin - 36 cytokines. Immunol Rev, 2018;281(1):169–178.
27. Buhl AL, Wenzel J. Interleukin-36 in Infectious and Inflammatory Skin Diseases. Front Immunol, 2019;10 : 1162.
28. Boutet MA, Nerviani A, Pitzalis C. IL-36, IL-37, and IL-38 Cytokines in Skin and Joint Inflammation: A Comprehensive Review of Their Therapeutic Potential. Int J Mol Sci, 2019;20(6):1257.
29. Walsh PT, Fallon PG. The emergence of the IL-36 cytokine family as novel targets for inflammatory diseases. Ann N Y Acad Sci, 2018;1417(1):23–34.
30. Towne JE, Renshaw BR, Douangpanya J et al. Interleukin-36 (IL-36) ligands require processing for full agonist (IL-36α, IL-36β, and IL-36γ) or antagonist (IL-36Ra) activity. J Biol Chem, 2011;286(49):42594–42602.
31. Clancy DM, Henry CM, Sullivan GP et al. Neutrophil extracellular traps can serve as platforms for processing and activation of IL-1 family cytokines. FEBS J, 2017;284(11):1712–1725.
32. Towne JE, Garka KE, Renshaw BR et al. Interleukin (IL)-1F6, IL-1F8, and IL-1F9 signal through IL-1Rrp2 and IL-1RAcP to activate the pathway leading to NF-kappaB and MAPKs. J Biol Chem, 2004;279(14):13677–13688.
33. Zhou L, Todorovic V, Kakavas S et al. Quantitative ligand and receptor binding studies reveal the mechanism of interleukin-36 (IL-36) pathway activation. J Biol Chem, 2018;293(2):403–411.
34. Dietrich D, Gabay C. Inflammation: IL-36 has proinflammatory effects in skin but not in joints. Nat Rev Rheumatol, 2014;10(11):639–640.
35. Dietrich D, Martin P, Flacher V et al. Interleukin-36 potently stimulates human M2 macrophages, Langerhans cells and keratinocytes to produce pro-inflammatory cytokines. Cytokine, 2016;84 : 88–98.
36. Kakeda M, Schlapbach C, Danelon G et al. Innate immune cells express IL-17A/F in acute generalized exanthematous pustulosis and generalized pustular psoriasis. Arch Dermatol Res, 2014;306(10):933–938.
37. Arakawa A, Vollmer S, Besgen P et al. Unopposed IL-36 Activity Promotes Clonal CD4+ T-Cell Responses with IL-17A Production in Generalized Pustular Psoriasis. J Invest Dermatol, 2018;138(6):1338–1347.
38. van de Veerdonk FL, Stoeckman AK, Wu G et al. IL-38 binds to the IL-36 receptor and has biological effects on immune cells similar to IL-36 receptor antagonist. Proc Natl Acad Sci U S A, 2012;109(8):3001–3005.
39. Marrakchi S, Guigue P, Renshaw BR et al. Interleukin-36-receptor antagonist deficiency and generalized pustular psoriasis. N Engl J Med, 2011;365(7):620–628.
40. Onoufriadis A, Simpson MA, Pink AE et al. Mutations in IL36RN/ IL1F5 are associated with the severe episodic inflammatory skin disease known as generalized pustular psoriasis. Am J Hum Genet, 2011;89(3):432–437.
41. Sugiura K. The genetic background of generalized pustular psoriasis: IL36RN mutations and CARD14 gain-of-function variants. J Dermatol Sci, 2014;74(3):187–192.
42. Hussain S, Berki DM, Choon SE et al. IL36RN mutations define a severe autoinflammatory phenotype of generalized pustular psoriasis. J Allergy Clin Immunol, 2015;135(4):1067–1070.e9.
43. Mössner R, Wilsmann-Theis D, Oji V et al. The genetic basis for most patients with pustular skin disease remains elusive. Br J Dermatol, 2018;178(3):740–748.
44. Hospach T, Glowatzki F, Blankenburg F et al. Scoping review of biological treatment of deficiency of interleukin-36 receptor antagonist (DITRA) in children and adolescents. Pediatr Rheumatol Online J, 2019;17(1):37.
45. Picard C, Bobby Gaspar H, Al-Herz W et al. International Union of Immunological Societies: 2017 Primary Immunodeficiency Diseases Committee Report on Inborn Errors of Immunity. J Clin Immunol, 2018;38(1):96–128.
46. Capon F. IL36RN mutations in generalized pustular psoriasis: just the tip of the iceberg? J Invest Dermatol, 2013;133(11):2503–2504.
47. Sugiura K, Takemoto A, Yamaguchi M et al. The majority of generalized pustular psoriasis without psoriasis vulgaris is caused by deficiency of interleukin-36 receptor antagonist. J Invest Dermatol, 2013;133(11):2514–2521.
48. Akiyama M. Early-onset generalized pustular psoriasis is representative of autoinflammatory keratinization diseases. J Allergy Clin Immunol, 2019;143(2):809–810.
49. Berki DM, Liu L, Choon SE et al. Activating CARD14 Mutations Are Associated with Generalized Pustular Psoriasis but Rarely Account for Familial Recurrence in Psoriasis Vulgaris. J Invest Dermatol, 2015;135(12):2964–2970.
50. Takeichi T, Akiyama M. Generalized Pustular Psoriasis: Clinical Management and Update on Autoinflammatory Aspects. Am J Clin Dermatol, 2020;21(2):227–236.
51. Setta-Kaffetzi N, Simpson MA, Navarini AA et al. AP1S3 mutations are associated with pustular psoriasis and impaired Toll-like receptor 3 trafficking. Am J Hum Genet, 2014;94(5):790–797.
52. Mahil SK, Twelves S, Farkas K et al. AP1S3 Mutations Cause Skin Autoinflammation by Disrupting Keratinocyte Autophagy and Up-Regulating IL-36 Production. J Invest Dermatol, 2016;136(11):2251–2259.
53. Robinson A, Van Voorhees AS, Hsu S et al. Treatment of pustular psoriasis: from the Medical Board of the National Psoriasis Foundation. J Am Acad Dermatol, 2012;67(2):279–288.
54. Morita A, Yamazaki F, Matsuyama T et al. Adalimumab treatment in Japanese patients with generalized pustular psoriasis: Results of an open-label phase 3 study. J Dermatol, 2018;45(12):1371 – 1380.
55. Sano S, Kubo H, Morishima H et al. Guselkumab, a human interleukin - 23 monoclonal antibody in Japanese patients with generalized pustular psoriasis and erythrodermic psoriasis: Efficacy and safety analyses of a 52-week, phase 3, multicenter, open-label study. J Dermatol, 2018;45(5):529–539.
56. Imafuku S, Honma M, Okubo Y et al. Efficacy and safety of secukinumab in patients with generalized pustular psoriasis: A 52 - week analysis from phase III open-label multicenter Japanese study. J Dermatol, 2016;43(9):1011–1017.
57. Saeki H, Nakagawa H, Nakajo K et al. Efficacy and safety of ixekizumab treatment for Japanese patients with moderate to severe plaque psoriasis, erythrodermic psoriasis and generalized pustular psoriasis: Results from a 52-week, open-label, phase 3 study (UNCOVER-J). J Dermatol, 2017;44(4):355–362.
58. Okubo Y, Mabuchi T, Iwatsuki K et al. Long-term efficacy and safety of ixekizumab in Japanese patients with erythrodermic or generalized pustular psoriasis: subgroup analyses of an open-label, phase 3 study (UNCOVER-J). J Eur Acad Dermatol Venereol, 2019;33(2):325–332.
59. Yamasaki K, Nakagawa H, Kubo Y et al. Efficacy and safety of brodalumab in patients with generalized pustular psoriasis and psoriatic erythroderma: results from a 52-week, open-label study. Br J Dermatol, 2017;176(3):741–751.
60. Bachelez H, Choon SE, Marrakchi S et al. Inhibition of the Interleukin - 36 Pathway for the Treatment of Generalized Pustular Psoriasis. N Engl J Med, 2019;380(10):981–983.
61. BI655130 Single Dose in Generalized Pustular Psoriasis [online]. 2018-01-17 [cit. 2020-07-03]. Dostupný na: https://clinicaltrials. gov/ct2/show/NCT02978690
62. A Study to Test BI 655130 in Patients With a Flare-up of a Skin Disease Called Generalized Pustular Psoriasis [online]. 2020-07-01 [cit. 2020-07-03]. Dostupný na: https://clinicaltrials.gov/ct2/show/ NCT03782792
63. A Study to Test Whether BI 655130 (Spesolimab) Prevents Flare-ups in Patients With Generalized Pustular Psoriasis [online]. 2020-07 - 01 [cit. 2020-07-03]. Dostupný na: https://clinicaltrials.gov/ct2/ show/NCT04399837
64. A 5-year Study to Test BI 655130 in Patients With Generalized Pustular Psoriasis Who Took Part in Previous Studies With BI 655130 [online]. 2020-06-16 [cit. 2020-07-03]. Dostupný na: https://clinicaltrials. gov/ct2/show/NCT03886246
65. A Study to Test How Effective and Safe Different Doses of BI 655130 Are in Patients With a Moderate to Severe Form of the Skin Disease Palmoplantar Pustulosis [online]. 2020-07-02 [cit. 2020-07-03]. Dostupný na: https://clinicaltrials.gov/ct2/show/NCT04015518
66. Initial Dosing of BI 655130 in Palmoplantar Pustulosis Patients [online]. 2019-11-26 [cit. 2020-07-03]. Dostupný na: https://clinicaltrials. gov/ct2/show/NCT03135548
67. A Study to Evaluate the Efficacy and Safety of ANB019 in Subjects With Generalized Pustular Psoriasis (GPP) [online]. 2019-07-02 [cit. 2020-07-03]. Dostupný na: https://clinicaltrials.gov/ct2/ show/NCT03619902
68. A Study to Evaluate the Efficacy and Safety of ANB019 in Subjects With Palmoplantar Pustulosis (PPP) [online]. 2019-07-10 [cit. 2020-07-03]. Dostupný na: https://clinicaltrials.gov/ct2/show/NCT03633396
69. Sullivan GP, Henry CM, Clancy DM et al. Suppressing IL-36-driven inflammation using peptide pseudosubstrates for neutrophil proteases. Cell Death Dis, 2018;9(3):378.
70. Sullivan GP, Davidovich PB, Sura-Trueba S et al. Identification of small-molecule elastase inhibitors as antagonists of IL-36 cytokine activation. FEBS Open Bio, 2018;8(5):751–763.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2021 Issue 3-
All articles in this issue
- Detailed molecular characterization of Neisseria meningitidis isolates by whole genome sequencing (WGS), Czech Republic, 2010–2019
- Diagnostic options for human polyomaviruses in clinical practice
- What we know and still do not know about tick-borne encephalitis?
- Autoinflammatory process in the pathogenesis of generalized pustular psoriasis and perspectives of its targeted therapy
- Epidemiology, risk factors and possibilities for the prevention of acute leukaemia
- If a vaccine against COVID-19 was available, would you like to be vaccinated? And are you vaccinated against flu and other diseases? A survey among university students during state of emergency
- The sensitivity of SARS-CoV-2 antigen tests in the view of large-scale testing
- Evaluation of tuberculosis diagnostic tools, with extending MODS assay use to second line susceptibility testing
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Epidemiology, risk factors and possibilities for the prevention of acute leukaemia
- What we know and still do not know about tick-borne encephalitis?
- Diagnostic options for human polyomaviruses in clinical practice
- Autoinflammatory process in the pathogenesis of generalized pustular psoriasis and perspectives of its targeted therapy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

