-
Medical journals
- Career
Možnosti terapeutického ovlivnění stafylokokových infekcí prostřednictvím bakteriofágů a vybrané metody testování citlivosti stafylokoků in vitro
Authors: M. Dvořáčková 1; F. Růžička 1; M. Dvořáková Heroldová 1; L. Vacek 1; D. Bezděková 2; M. Benešík 2; P. Petráš 3; R. Pantůček 2
Authors‘ workplace: Mikrobiologický ústav Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice u sv. Anny v Brně 1; Ústav experimentální biologie Přírodovědecké fakulty Masarykovy univerzity, Brno 2; Národní referenční laboratoř pro stafylokoky SZÚ, Praha 3
Published in: Epidemiol. Mikrobiol. Imunol. 69, 2020, č. 1, s. 10-18
Category: Original Papers
Overview
Cíl práce: Kmeny Staphylococcus aureus patří mezi obávané bakteriální původce nozokomiálních i komunitních infekcí, a to hlavně tehdy, jsou-li rezistentní k antibiotikům, či mají-li významné faktory patogenity, nebo jsou schopny tvořit odolný biofilm. Hledání nových terapeutik, účinných na takové kmeny, je jednou z hlavních priorit medicíny a vědeckého výzkumu.
Cílem studie bylo popsat výskyt S. aureus a podíl kmenů rezistentních k methicilinu (MRSA) diagnostikovaných v laboratořích Mikrobiologického ústavu Lékařské fakulty Masarykovy univerzity (LF MU) a Fakultní nemocnice (FN) u sv. Anny v Brně v letech 2011–2018. U vybraných kmenů S. aureus byla studována schopnost tvorby biofilmu, testována citlivost k antibiotikům a k fágovému přípravku Stafal®. Podmínkou bylo navrhnout metodu vhodnou pro jednoduché rutinní testování citlivosti bakterií k fágům.
Materiál a metody: U 867 klinických izolátů S. aureus a u 132 kmenů náležících k dalším druhům rodu Staphylococcus (izolovaných v letech 2011–2017) byla testována citlivost k fágovému preparátu Stafal® za použití metody dvouvrstevného agaru. U všech kmenů S. aureus byla testována schopnost tvorby biofilmu modifikovanou Christensenovou metodou využívající mikrotitrační destičky a citlivost k protistafylokokovým antibiotikům (Diskovým difuzním testem). U 95 kmenů S. aureus byla metoda dvouvrstevného agaru (MDA) porovnána s námi navrženou metodou, která je založena na úbytku optické denzity (MOZ) bakteriální suspenze.
Výsledky: Ve sledovaném období bylo v laboratořích LF MU a FN u sv. Anny v Brně diagnostikováno průměrně 2 900 kmenů S. aureus ročně. V hemokulturách a venózních katetrech s nálezem S. aureus byl podíl kmenů MRSA 8,8–15,2 %.
Bylo potvrzeno, že kmeny S. aureus izolované z venózních katetrů a hemokultur byly silnějšími producenty biofilmu než kmeny z jiných klinických materiálů. Kmeny MRSA produkovaly biofilm silněji než kmeny methicilin citlivé (MSSA).
K preparátu Stafal® bylo citlivých 90,4 % kmenů S. aureus. V souboru MRSA to bylo dokonce 99,0 % citlivých kmenů. Nebyla prokázána souvislost mezi citlivostí ke Stafalu® a schopností tvořit biofilm. Přesto, že jde o preparát zaměřený na S. aureus, byla určitá citlivost (26,5 %) prokázána i u dalších druhů stafylokoků.
Nová jednoduchá metoda navržená pro rutinní testování citlivosti k fágovým preparátům pomocí MOZ byla srovnatelně citlivá a spolehlivá jako běžně používaná metoda MDA, kromě jednoduchosti a časové nenáročnosti přináší výhodu také v tom, že po prodloužení kultivace suspenze a frekvence měření můžeme sledovat i dynamiku působení fágů.
Závěry: Ukázalo se, že podíl diagnostikovaných kmenů MRSA odpovídá výskytu kmenů v celé České republice a že zjištění týkající se produkce biofilmu jsou v souladu s dosavadními vědeckými poznatky.
Hostitelské spektrum přípravku Stafal® je relativně široké a zahrnuje většinu kmenů S. aureus i některé koaguláza-negativní stafylokoky. Nejvyšší účinnost vykazuje na kmeny MRSA s další přidruženou rezistencí k antibiotikům (99,4 %).
Na základě testování 867 kmenů S. aureus a 132 jiných druhů stafylokoků in vitro bylo prokázáno, že fágový preparát Stafal® je vhodným kandidátem pro léčbu stafylokokových infekcí i tam, kde klasická antibiotika selhávají. Navíc byla navržena jednoduchá metoda, jak rutinně testovat citlivost k fágům u klinických bakteriálních izolátů, což je nezbytným předpokladem terapeutické aplikace.
Klíčová slova:
fágová terapie – Staphylococcus – biofilm – MRSA – Stafal®
ÚVOD
Obávanými původci nozokomiálních infekcí bývají často bakteriální kmeny rezistentní k antibiotikům [1] či kmeny, které disponují významnými faktory patogenity. Může se jednat o produkci různých druhů toxinů [2] nebo o schopnost tvořit odolný biofilm [3]. Typickým původcem výše popsaných nákaz je Staphylococcus aureus, oportunní patogen, který často kolonizuje člověka [4, 5].
Terapeutické problémy způsobené rezistencí S. aureus na používaná protistafylokoková antibiotika vyvolávají potřebu hledat nová léčiva. V rámci racionální antibiotické terapie jsou lékem volby nekomplikovaných stafylokokových infekcí stále betalaktamová antibiotika (u nás registrovaný oxacilin). Běžně se však vyskytují kmeny k oxacilinu rezistentní, jsou označované akronymem MRSA. Tyto kmeny bývají rezistentní i k dalším antibiotikům [6], jako je např. rezistence typu MLSB (makrolidy, linkosamidy a streptogramin B). V současnosti se objevily i kmeny s intermediální [7] nebo dokonce s úplnou rezistencí k vankomycinu [8].
Na tuto situaci reagují vědci i farmaceutické firmy hledáním a zaváděním nových antibiotik do klinické praxe. Jejich vývoj je však nákladný a zdlouhavý a tento fakt se odráží i v ceně nového produktu. Z preparátů, které byly uvedeny na trh po roce 2000, lze jmenovat linezolid [9], ceftarolin [10], daptomycin [11], dalbavancin a solithromycin [12].
Kromě antibiotické terapie existují i další alternativy léčby, ale není jich mnoho. Mohou to být přírodní antimikrobiální látky bakteriálního (lyzostafin nebo lantibiotika), rostlinného (např. flavonoidy) nebo živočišného (např. propolis nebo defenziny) původu [13]. Řada látek již dříve používaných v lékařství má kromě primárních účinků také sekundární antibakteriální účinky, a našly tak nové uplatnění, např. stříbro či selen v podobě nanočástic [14]. K léčbě stafylokokových infekcí může být použita i fotodynamická terapie, známá především jako nástroj léčby nádorových onemocnění [15]. Další možný terapeutický přístup představuje využití protistafylokokových vakcín [13, 16].
Jednou z nadějných možností je fágová terapie, která využívá k léčbě bakteriálních infekcí bakteriofágy, tedy viry přirozeně a specificky napadající bakterie. Jde o známá antimikrobiální agens, která byla poprvé úspěšně použita k léčbě bacilární úplavice již v roce 1919 ve Francii [17]. Následně se objevila celá řada dalších fágových terapeutik proti řadě dalších infekčních agens [18]. Přes počáteční úspěchy a optimismus byla fágová terapie postupně opuštěna. Důvodem bylo jednak zavedení antibiotik do klinické praxe a dále také chyby způsobené nedostatečným poznáním biologie fágů, nestandardní přípravou a skladováním léčiv a v neposlední řadě také podceněním úlohy vrozené imunitní odpovědi pacientů při léčbě [19].
Vysoký výskyt a šíření rezistence bakterií k antibiotikům obnovil zájem o tuto alternativní terapii. K jejímu rozvoji též přispívají nové technologie a s tím spojený rychlý nárůst poznání v oblasti biologie a fyziologie fágů [20, 21, 22]. Použití fágů pro léčbu infekčních onemocnění totiž přináší v porovnání s antibiotiky řadu výhod. Mezi ně patří především fakt, že nové fágy lze poměrně snadno získat, dále že se po aplikaci množí v místě infekce, účinkují na bakterie v biofilmu a minimálně ovlivňují přirozený mikrobiom člověka. Fágy jsou účinné i k bakteriím rezistentním ke konvenční antibiotické léčbě [23]. Navíc mají nízkou toxicitu, což dokazují experimenty na zvířatech [24] i experimenty klinické [25].
V poslední době je věnována pozornost také lytickým proteinům odvozeným od fágů a kombinacím fágové terapie s jinými léčivy. Na podkladě studií odpovídajících současným vědeckým standardům se tedy rýsuje možnost širšího využití fágů, jako nové skupiny antibakteriálních léčiv [20].
Velký důraz se klade na bezpečnost terapie. Obavy z možného napadení pacienta bakteriofágy rozptyluje skutečnost, že nebylo dosud popsáno začlenění fágové DNA do humánního genomu ani do genomu dalších savců, naopak jsou-li fágy v těle distribuovány, mají imunomodulační účinky [26]. Aby nedošlo k přenosu genů mezi bakteriemi, a to včetně genů kódujících rezistenci či faktory virulence, jsou pro léčebné účely důsledně vybírány lytické fágy, které se nezačleňují do bakteriálního genomu [27]. Stejně pečlivě je třeba volit bakteriální kmeny určené k pomnožování fágů. U těchto kmenů je žádoucí vyloučit přítomnost genů pro rezistenci, toxiny aj., a to na základě celogenomové sekvenace [28]. Přínosem pro zavedení bakteriofágů pro léčbu je několik nedávno zahájených i probíhajících klinických studií, včetně vysoce požadovaných dvojitě zaslepených kontrolovaných randomizovaných klinických studií [27].
V českých zemích pochází první zmínka o léčbě fágy již z 20. let minulého století. V laboratořích Státního zdravotního ústavu byly zkoumány léčebné účinky fágů na úplavici. Od 70. let minulého století pak probíhal vývoj fágových preparátů pod vedením Jiřího Pillicha v Biofyzikálním ústavu ČSAV v Brně [29]. Dnes je na trhu dostupný proti-stafylokokový preparát Stafal®, na jehož inovacích se stále pracuje [30].
Stafal® (Bohemia Pharmaceuticals, CZ) je v současné době registrován jako léčivý přípravek na Slovensku [31]. V České republice byl využíván v rámci specifického léčebného programu [32]. Podrobně jsou dokumentovány kazuistiky hojení chronických ran přípravkem Stafal® při chronické venózní insuficienci s infekcemi vyvolanými S. aureus včetně MRSA [33]. Při modelování reálných nákladů na léčbu jsou náklady při léčbě přípravkem Stafal® nižší než náklady při léčbě antibiotiky [34]. Mikrobiologický ústav LF MU a FN u sv. Anny v Brně provádí testování tohoto fágového preparátu in vitro na klinických izolátech bakterií.
Cílem této práce je popsat výskyt S. aureus v různých klinických materiálech diagnostikovaných v Mikro-biologickém ústavu LF MU a FN u sv. Anny v Brně, posoudit míru rezistence kmenů, zejména rezistence typu MRSA, a schopnost tvořit biofilm. U izolovaných kmenů porovnat citlivost ke klasickým antibiotikům s citlivostí k fágovému přípravku Stafal®, a dále navrhnout jednoduchou metodu vhodnou pro rutinní testování fágových preparátů. Na souboru dalších druhů stafylokoků pak zjistit hostitelské spektrum tohoto preparátu.
MATERIÁL A METODY
Sledování výskytu S. aureus v klinických materiálech diagnostikovaných v Mikrobiologickém ústavu LF MUa FN u sv. Anny v Brně
Vyšetřované vzorky pocházely především z Fakultní nemocnice u sv. Anny v Brně, ale také z Nemocnice Milosrdných bratří, Masarykova onkologického ústavu, v menší míře pak z jiných brněnských zdravotnických zařízení. Vzorky byly zpracovány podle standardních operačních postupů v rámci rutinní diagnostiky. Data týkající se klinické laboratorní diagnostiky byla získána z LIS FONS Open LIMS (Stapro, CZ) a Amis (CNS a.s., CZ). Do studie byl zařazen vždy jeden kmen od jednoho pacienta.
Bakteriální kmeny
Kmeny S. aureus byly sbírány v letech 2011–2018 tak, aby byla zajištěna jejich heterogenita. Do studie byly zahrnuty, vedle kmenů dobře citlivých k antibiotikům, také kmeny rezistentní a byla snaha vybrat kmeny s různě vyjádřenou schopností tvořit biofilm.
Celkem bylo testováno 867 kmenů S. aureus (MSSA 671, MRSA 196) izolovaných z klinického materiálu od pacientů z výše uvedených zdravotnických zařízení. Původním klinickým materiálem, ze kterého byly kmeny izolovány, byly nejčastěji materiály z dýchacích cest – horních (MSSA 296, MRSA 75), dolních (MSSA 30, MRSA 11), dále z infekcí ran (MSSA 203, MRSA 72), hemokultur a cévních katetrů (MSSA 114, MRSA 28), ojediněle z ostatních materiálů (MSSA 28, MRSA 9) a jeden kmen MRSA ze stěru na oddělení. Kmeny byly uchovávány v glycerolovém sérovém bujonu (Tryptone Soya Broth Oxoid, UK a koňské sérum Zoo servis, CZ) při -76 °C.
Hostitelské spektrum přípravku Stafal® bylo testováno i na dalších 15 druzích stafylokoků (non-S. aureus) celkem na 132 kmenech. 96 kmenů pocházelo z NRL pro stafylokoky a 36 kmenů z klinických vzorků vyšetřených v laboratoři Mikrobiologického ústavu LF MU a FN u sv. Anny v Brně identifikovaných prostřednictvím MALDI--TOF (Bruker Daltonics).
Stafal® (Bohemia Pharmaceuticals, Praha, dříve Imuna CZ) je protistafylokokový lyzát s obsahem vysoce účinných virulentních a polyvalentních fágových částic z čeledi Myoviridae, rodu Kayvirus v minimálním množství 1×107 PFU (plaque forming unit)/ml, vyznačující se silným a rychlým účinkem proti infekcím způsobeným S. aureus včetně kmenů MRSA, s účinky i na další druhy rodu Staphylococcus [35].
Zásobní roztok účinné látky Stafalu® v masopeptonovém bujonu (Himedia laboratoires, IND) o výsledné koncentraci 109 PFU/ml byl uchováván v temnu při teplotě 2–8 oC.Před každým experimentem byl preparát ředěn na různé koncentrace (108, 107, 106, 105, 104, 103, 102 PFU/ml) masopeptonovým bujonem nebo fyziologickým roztokem (Kulich, CZ), viz níže. Do média byla vždy před aplikací fágů přidána 1/10 objemu 20 mM roztoku CaCl2 (Penta, CZ).
Testování citlivosti k antibiotikům
Citlivost k antibiotikům byla zjišťována v souladu s aktuálními doporučeními The European Committee on Antimicrobial Susceptibility Testing – EUCAST (www.eucast.com), pomocí diskového difuzního testu na Mueller--Hintonové agaru (MHA) (Oxoid, UK) s antibiotickými disky (Oxoid, UK): cefoxitin CXT 30 μg, erytromycin ERY 15 μg, klindamycin CLI 2 μg, sulfametoxazol s trimetoprimem COT 25 μg, tetracyklin TET 30 μg, chloramfenikol CMP 30 μg, gentamicin GEN 10 μg, teikoplanin TEI 30 μg, rifampicin RIF 5 μg, linezolid LZD 10 μg, tigecyklin TGC 15 μg, ciprofloxacin CIP 5 μg. Rezistence S. aureusk oxacilinu typu MRSA byla diagnostikována podle citlivosti k cefoxitinu zjišťované na základě diskového difuzního testu a podle růstu na chromogenní půdě Brilliance MRSA 2 agar (Oxoid, UK). V případě nejasností byly výsledky potvrzeny latexovou aglutinací MRSA Latex Test (Denka Seiken, J). Rezistence MLSB byla testována D-testem a interpretována podle doporučených postupů.
Testování citlivosti fágového přípravku Stafal® pomocí dvouvrstevného agaru (MDA)
Citlivost byla testována modifikovanou metodou podle Drilling et al. [36]. Do zkumavky s 2,5 ml 0,7% masopeptonového agaru (rozvařeného a vytemperovaného na 45 °C) byla přidána 1/10 objemu 20 mM roztoku CaCl2 (250 ml) a 100 ml suspenze stafylokoka odpovídající 1–2 stupni McFarlandovy zákalové stupnice (McF). Následně byla tato suspenze nalita na misku s 1,5% masopeptonovým agarem a ponechána ztuhnout ve vodorovné poloze. Po zatuhnutí byl na povrch nakapán Stafal® ředěný fyziologickým roztokem o různých koncentracích (108, 107, 106, 105, 104, 103, 102 PFU/ml). Misky byly kultivovány přes noc, poté byl podle přítomnosti lyze vyhodnocen výsledek. Kmeny s plaky, konfluentní a semikonfluentní lyzí byly hodnoceny jako citlivé. Kmeny, které vykazovaly při terapeutické koncentraci lyzi z vnějšku, nebo byly bez lyze, byly hodnoceny jako rezistentní (obr. 1).
Image 1. Hodnocení účinnosti Stafalu® metodou dvouvrstevného agaru
Figure 1. Stafal® activity testing by the double-layer agar method
Testování účinku fágového přípravku Stafal® pomocí měření stupně zákalu suspenze (MOZ)
V polystyrenové zkumavce (Dispolab, CZ) byla z izolovaného kmene vytvořena suspenze (1,7 ml) v masopeptonovém bujonu o optické denzitě OD = 2,7 McF. K této suspenzi byl přidán roztok CaCl2 (200 μl) a preparát Stafal® (100 μl) o koncentraci 108 PFU/ml v masopeptonovém bujonu. Stupeň zákalu byl změřen pomocí Densi-La-Meter® (Erba Lachema, CZ), poté byla suspenze inkubována při teplotě 37 °C. Následně bylo měření provedeno po 5hodinnové inkubaci. Před každým měřením byla suspenze intenzivně roztřepána pomocí vortexu. Jako citlivé byly hodnoceny kmeny stafylokoků, které byly přípravkem Stafal® lyzovány, což se projevilo snížením optické denzity po 5 h inkubace (øOD5h − 3×SD5h) < (øOD0h − 3×SD0h). Kmeny bez úbytku OD byly vyhodnoceny jako rezistentní. Jako kontrola růstu byla použita suspenze bez fágů.
Metoda testování schopnosti stafylokoků tvořit biofilm využívající mikrotitrační destičky (MTD)
Všechny kmeny S. aureus byly testovány na schopnost tvořit biofilm modifikovanou metodou podle Stepanović et al. (2007) [37]. V polystyrenové 96jamkové mikrotitrační destičce P pro tkáňové kultury (Gamma, CZ) byl vypěstován 24hodinnový biofilm. Nejprve byly stafylokoky rozsuspendovány v BHI (Oxoid, UK) se 4 % glukózy (Fagron, NL) výchozí hustota 1,5 × 106 CFU (colony forming unit)/ml). Do jamek destičky bylo napipetováno 200 μl bakteriální suspense, kultivace probíhala 24 h při 37 °C. Následně byly jamky vyprázdněny a třikrát promyty PBS (Lékárna FN u sv. Anny v Brně, CZ) pufrem (pH 7). Vzniklý biofilm byl fixován sušením při 37 °C po dobu 24 h a následně obarven krystalovou violetí – Lékárna FN u sv. Anny v Brně, CZ (250 μl, 15 min), poté byly jamky propláchnuty vodou, krystalová violeť byla eluována etanolem – Lékárna FN u sv. Anny v Brně, CZ (15 min). Výsledek byl detekován spektrofotometricky při vlnové délce 595 nm přístrojem Multiskan EX (Thermo Fisher Scientific, FIN) a kmeny byly rozděleny do kategorií podle Stepanović [37]. Pro statistickou analýzu byla použita výsledná hodnota optické denzity kmenů.
Statistická analýza
Ke statistickému hodnocení sloužil program Statistica (verze 12, StatSoft, CZ). Všechna testování byla provedena ve třech nezávislých opakováních. Pro hledání souvislostí mezi charakteristikami kmenů (věk pacientů, pohlaví, klinický materiál, rezistence k antibiotikům, citlivost k fágovému preparátu) a tvorbou biofilmu byla před analýzou použita Box-Cox transformace. Pro analýzu dvou kategorií dat (pohlaví, citlivost ke Stafalu®, citlivost k oxacilinu) byl použit nezávislý T-test a pro více kategorií (věk pacientů, klinický materiál) byla použita jednofaktorová ANOVA. Pro analýzu kategorií navzájem byla použita Post-hoc analýza (Fisherův LSD test). Pro porovnání dvou diagnostických metod MDA a MOZ byl použit Fisherův test. Všechny hypotézy byly testovány na hladině významnosti α = 0,05.
VÝSLEDKY
Výskyt kmenů MRSA diagnostikovaných v laboratoři Mikrobiologického ústavu LF MU a FN u sv. Anny v Brně
Nálezy S. aureus a podíl kmenů MRSA v letech 2011–2018 ve všech klinických materiálech popisuje tabulka 1, kde je patrné, že se podíl kmenů MRSA během sledovaného období mírně snižuje. Pro srovnání s evropskou databází byla vyselektována data týkající se izolátů od pacientů s infekcemi krevního řečiště (tab. 2).Podíl námi diagnostikovaných kmenů MRSA byl za sledované období průměrně 13,2 %, v tabulce 2 jsou pro srovnání uvedena i data popisující výskyt kmenů v celé České republice.
Table 1. Výskyt kmenů S. aureus a podíl kmenů MRSA v letech 2011–2018 izolovaných z různých klinických materiálů v laboratořích Mikrobiologického ústavu LF MU a FN u sv. Anny v Brně
Table 1. Detection of S. aureus strains and proportion of MRSA strains in various clinical specimens, 2011–2018, data from laboratories of the Microbiological Institute, Faculty of Medicine, Masaryk University and St. Anne’s University Hospital
Table 2. Výskyt kmenů S. aureus a podíl kmenů MRSA v letech 2011–2018 izolovaných z hemokultur a venózních katetrů
Table 2. Detection of S. aureus strains and proportion of MRSA strains from blood culture and venous catheters, 2011–2018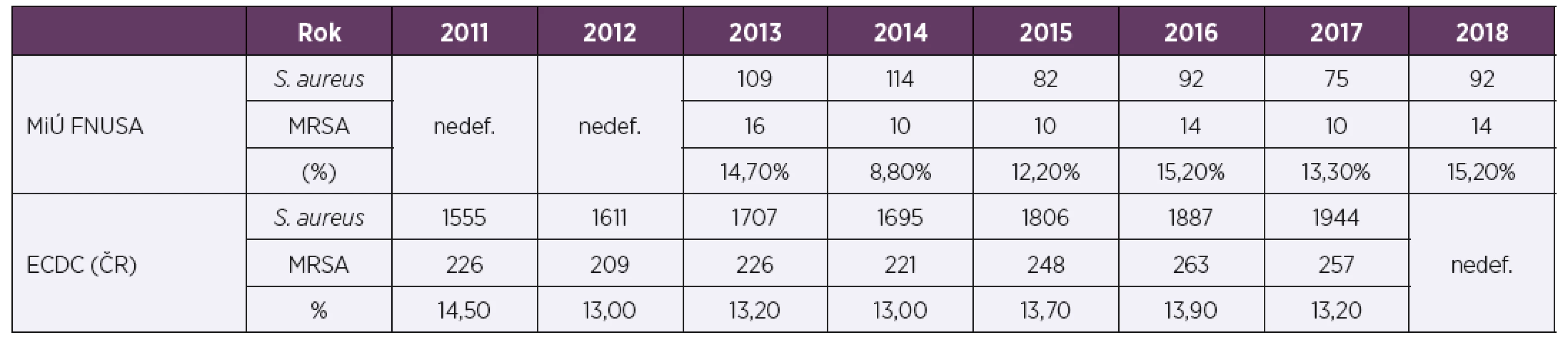
Tvorba biofilmu kmenů S. aureus
U všech 867 kmenů S. aureus byl testován důležitý faktor patogenity, a to schopnost tvořit biofilm. Ukázalo se, že většina kmenů S. aureus silně produkuje biofilm (797; 91,9 %) středně silných producentů (52; 6,0 %), slabých producentů (13; 1,5 %) a kmenů bez produkce biofilmu (5; 0,6 %) bylo výrazně méně.
Byly testovány vztahy mezi tvorbou biofilmu a původem izolátů. V tvorbě biofilmu nebyly zaznamenány statisticky významné rozdíly u izolátů od pacientů různých věkových kategorií (p = 0,670), od pacientů s rozdílným pohlavím (p = 0,197), ani u kmenů citlivých a rezistentních ke Stafalu® (p = 0,405). Bylo zjištěno, že kmeny izolované z různých klinických materiálů disponují odlišnou schopností tvořit biofilm (p < 0,01). Kmeny z centrálních venózních katetrů, ale také z hemokultur produkovaly biofilm silněji než kmeny ze všech ostatních materiálů (graf 1). Kmeny MRSA byly silnějšími producenty biofilmu než kmeny MSSA (p = 0,049) – graf 2.
Graph 1. Schopnost S. aureus (n = 867) tvořit biofilm (klinický materiál)
Graph 1. Biofilm production ability of S. aureus (n = 867), clinical specimens
Graph 2. Schopnost S. aureus (n = 867) tvořit biofilm (MRSA × MSSA)
Graph 2. Biofilm production ability of S. aureus (n = 867), MRSA × MSSA
Citlivost kmenů S. aureus k antimikrobiálním látkám
U klinických izolátů S. aureus byla zjišťována citlivost k antibiotikům a preparátu Stafal®. Zvlášť byly analyzovány kmeny MSSA (n = 671) a kmeny MRSA (n = 196). Většina kmenů MSSA byla k testovaným antibiotikům, které se používají k léčbě nekomplikovaných stafylokokových infekcí citlivá (564; 84,1 %), u početné skupiny kmenů MSSA (96; 14,3 %) byla zjištěna rezistence typu MLSB. Citlivost ke Stafalu® byla zjištěna u 590 kmenů (87,9 %) – tabulka 3. U všech kmenů MRSA byla zjištěna i rezistence k ciprofloxacinu a velmi často rezistence typu MLSB (177; 90,3 %) – tabulka 4.
Table 3. Citlivost kmenů MSSA k antibakteriálním látkám (n = 671)
Table 3. Antimicrobial susceptibility of MSSA strains (n = 671)
Table 4. Citlivost kmenů MRSA k antibakteriálním látkám (n = 196)
Table 4. Antimicrobial susceptibility of MRSA strains (n = 196)
Testované klinické izoláty S. aureus byly rozděleny do skupin podle dvou běžných typů rezistence (MRSA a MLSB) – tabulka 5. Podle analýzy výsledků citlivosti ke Stafalu® u jednotlivých skupin kmenů vykazovaly kmeny MSSA citlivost 87,9 % a kmeny MRSA více – 99,0 %(p << 0,01). Kmeny MSSA + MLSB vykazovaly citlivost 88,0 %, ale citlivější byly kmeny s oběma typy rezistencí MRSA + MLSB – 99,4 % (p = 0,006). Kmeny MSSA non-MLSB měly citlivost 86,5 % srovnatelnou s kmeny MSSA + MLSB 88,0 % (p = 0,641). Kmenů MRSA non-MLSB bylo nesrovnatelně méně, rozdíly napříč skupinami nebyly v tomto případě statisticky významné.
Table 5. Citlivost kmenů S. aureus ke Stafalu® dle typů rezistence k antibiotikům
Table 5. Stafal® susceptibility of S. aureus strains by type of antibiotic resistance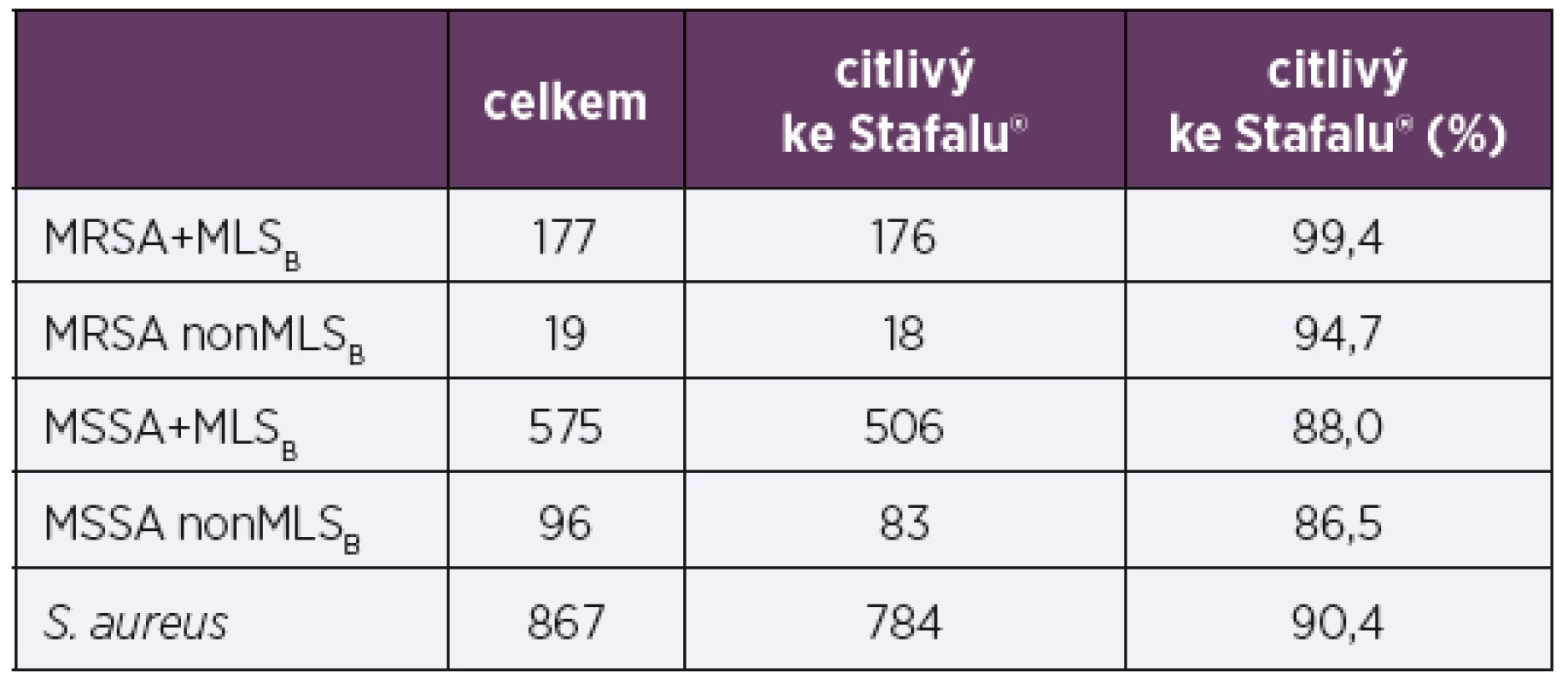
Porovnání klasické metody testování citlivosti k fágům pomocí dvouvrstevného agaru a metodyzaložené na měření úbytku optické denzitysuspenze bakterií
Hodnocení testování účinku fágových preparátů může být subjektivní a lyze způsobená fágy může být nejasná, proto byla použita metoda, která detekuje účinek na základě úbytku optické denzity suspenze bakterií po přidání Stafalu®. Testování bylo provedeno paralelně na 95 kmenech S. aureus (76 kmenech MRSA a 19 kmenech MSSA). Oběma metodami bylo citlivých 69 kmenů a rezistentních 21 kmenů. Ojediněle se však vyskytly disktrepantní výsledky, kde byl MDA kmen hodnocen jako rezistentní a MOZ jako citlivý a naopak (tab. 6), nicméně metody se shodovaly v 94,7 % případů. Pomocí Fisherova testu bylo prokázáno, že metody mají srovnatelnou spolehlivost (p = 0,132).
Table 6. Porovnání metod detekce citlivosti k fágovému preparátu (MDA × MOZ)
Table 6. Comparison of the Stafal® susceptibility detection methods (MDA × MOZ)
Citlivost k preparátu Stafal® u ostatních stafylokoků (non-S. aureus)
Klasickou metodou MDA byl testován účinek preparátu Stafal® na další druhy stafylokoků, aby bylo zjištěno, jaké je hostitelské spektrum preparátu. Z klinicky významných vzorků (hemokultur) bylo testováno 36 kmenů (S. epidermidis, S. hominis a S. haemolyticus) citlivost u nich byla 8,3 %, ostatní stafylokoky byly testovány ve spolupráci s NRL pro stafylokoky. Celkem bylo otestováno 15 non-S. aureus druhů stafylokoků, jejichž citlivost byla 26,5 % (tab. 7).
Table 7. Účinek preparátu Stafal® na ostatní (non-S. aureus) stafylokoky
Table 7. Activity of Stafal® against other (non-S. aureus) staphylococci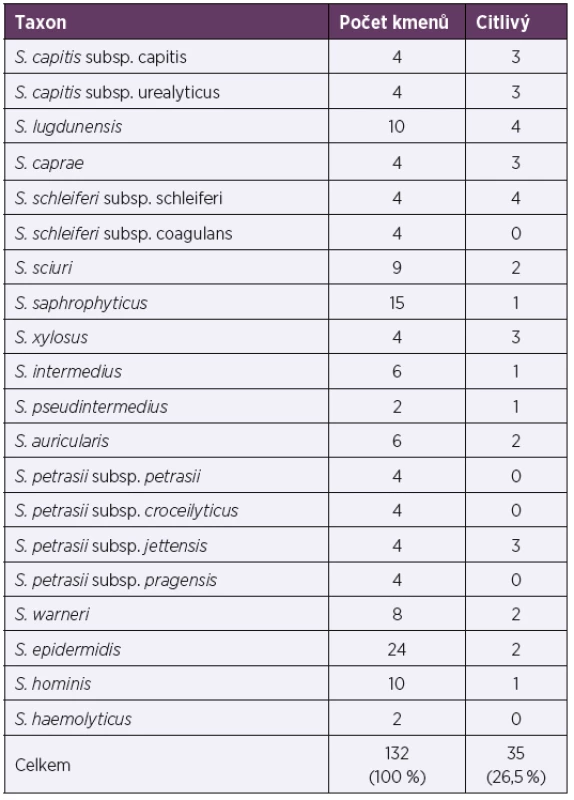
DISKUSE
Ve sledovaném období bylo v laboratořích Mikrobiologického ústavu LF MU a FN u sv. Anny v Brně z různých klinických materiálů a ze stěrů z nemocničního prostředí diagnostikováno průměrně 2 900 kmenů S. aureus ročně. Podíl kmenů MRSA byl za posledních 8 let mezi 4,5–7,0 %. Pro srovnání s evropskou databází byly vybrány pouze kmeny izolované z hemokultur a venózních katetrů. Podle projektu European Antimicrobial Resistance Surveillance Network (EARS-Net) je v Evropě patrný severo-jižní gradient výskytu kmenů MRSA. Pro Českou republiku je pro rok 2017 uveden podíl kmenů MRSA 13,2 %, pro sousední Polsko 15,2 %, Slovensko 29,2 %, Německo 9,1 % a Rakousko 5,9 % [38]. Podíl rezistentních bakteriálních kmenů bezesporu souvisí s ekonomickou situací v zemi, se spotřebou [39] a spektrem používaných antibiotik. Pokud byly hodnoceny jen kmeny od pacientů s infekcí krevního řečiště, byl podíl MRSA kmenů identifikovaných v naší laboratoři za posledních 8 let 8,8–15,2 %, v roce 2017 pak 13,3 %, což jsou čísla srovnatelná s celou Českou republikou. Z dlouhodobého hlediska (od roku 2000) výskyt kmenů MRSA v ČR stoupá a v posledních letech však naštěstí spíše stagnuje. Naše výsledky tomuto trendu odpovídají.
Při testování citlivosti kmenů S. aureus k antimikrobiálním látkám byl potvrzen fakt, že kmeny rezistentní k oxacilinu jsou často rezistentní i k dalším antibiotikům [40], což potvrzují i naše výsledky. V našem souboru bylo 196 kmenů MRSA a 177 (90,3 %) z nich vykazovalo i rezistenci MLSB. Citlivost kmenů MRSA byla k dalším testovaným antibiotikům kromě ciprofloxacinu většinou zachována.
U 867 kmenů S. aureus byla testována schopnost tvořit biofilm. Při sledování souvislostí mezi původem, vlastnostmi kmenů a tvorbou biofilmu byla zjištěna větší schopnost tvorby u kmenů pocházejících z venózních katetrů a hemokultur, což je ve shodě i s dalšími publikacemi [41, 42]. Podle našich výsledků kmeny MRSA vykazovaly větší schopnost tvořit biofilm než MSSA kmeny. Podobné výsledky, tj. vyšší schopnost tvorby biofilmu u kmenů MRSA, byly zjištěny u řady dalších autorů [43, 44, 45]. Publikovány byly i práce, které tuto skutečnost nepotvrdily [46] nebo dosáhly dokonce opačných výsledků [47]. Rozdíly mohou být způsobeny různým počtem testovaných kmenů, ale také zastoupením komunitních a nemocničních kmenů MRSA, nicméně u stafylokoků bývá popisována souvislost mezi rezistencí k antibiotikům a vyšší tvorbou biofilmu [45, 48]. Podobná situace byla popsána u dalšího nozokomiálního patogena Acinetobacter baumannii [49].
Zajímavé je, že v produkci biofilmu nebyl rozdíl mezi Stafal®-citlivými a rezistentními kmeny. Silná schopnost bakterií tvořit biofilm tedy nepředurčuje rezistenci ke Stafalu®. Předpokládá se, že pokud fágy dokáží díky enzymům ničit extracelulární polymerní substance, adherovat na povrch bakterií a lyzovat je, mají výhodu proti jiným léčivům v tom, že se díky mechanismu působení dobře dostávají i do spodních vrstev biofilmu. Zde bývají metabolicky méně aktivní buňky, které jsou nuceny k aktivitě. Účinek Stafalu® na stafylokoky rostoucí v biofilmu byl prokázán v našich dřívějších studiích [35]. Lepší účinek kombinované terapie antibiotik a fágů je možné vysvětlit tím, že jsou buňky hlubších vrstev biofilmu obnaženy a nuceny metabolizovat, následně se pak stávají k antibiotikům vnímavé [50].
U kmenů S. aureus obecně byla zaznamenána výborná citlivost k fágům preparátu Stafal® (90,4 %). Citlivost jiných stafylokokových fágů čeledi Myoviridae uváděná v literatuře bývá často nižší a pohybuje se okolo 70 % [51, 52, 53, 54]. Hsieh et al. (2011) uvádí dokonce jen 47 % citlivých kmenů k fágu K [55], Freyberger et al. (2018) k němu uvádí citlivost 83 % [56]. V literatuře se uvádí, že bývá obtížné izolovat fágy s širším účinkem na kmeny MRSA [57], výsledky citlivostí k fágům čeledi Myoviridae pro kmeny MRSA bývají různé od 30 % [58] po 95 % [30, 59]. Velkou výhodou fágového koktejlu Stafal® je tedy široké hostitelské spektrum a především výborný efekt na kmeny MRSA (99,0 %). Nejlépe působil Stafal® na kmeny s oběma typy rezistence MRSA i MLSB (99,4 %),a to proti statisticky srovnatelným skupinám MSSA + MLSB (88,0 %) (p = 0,006) a MSSA non-MLSB (86,5 %) (p = 0,001). Lze předpokládat, že fitness bakterií může být sníženo rezistencí k antibiotikům [60] natolik, že se nemohou účinně bránit invazi fágů, důležitou roli hraje jistě klonalita kmenů MRSA a jejich obdobná reakce na fágový preparát.
Aby bylo detailněji poznáno hostitelské spektrum Stafalu®, byly otestovány i další druhy stafylokoků, citlivost byla zaznamenaná u 26,5 % izolátů. Hsieh et. al. (2011) uvádí pro fága K, příbuzného fágům obsaženým v preparátu Stafal®, podobnou citlivost u koaguláza negativních stafylokoků 22,5 % [55]. Tato relativně nízká účinnost není překvapivá, neboť viry obsažené v preparátu byly izolovány na kmenech S. aureus a bakteriofágy jsou obvykle druhově specifické [20].
Přestože citlivost k fágovým preparátům je dobrá, vyskytují se rezistentní kmeny, ale velkou předností fágové terapie je, že se rezistence k části kmenů příslušné bakterie dá snadno vyřešit změnou fágového koktejlu, a léčbu tak zaměřením na konkrétního původce infekce personalizovat [61]. Při hledání nových adeptů do koktejlů se osvědčilo hledat fágy v odpadních vodách nemocnic, kde se vyskytují fágy, jejichž hostitelské spektrum zahrnuje nozokomiální mikroby nebo izolací fágových mutant [30].
Při testování citlivosti stafylokoků k fágům pomocí dvouvrstevného agaru (MDA) byl zaznamenán problém se spolehlivou interpretací výsledků. Pozorované plaky mohou být matné nebo příliš drobné [62], v některých případech především u vyšších koncentrací fágů byla pozorována lyze z vnějšku (angl. lysis from without). Je to jev, projevující se zřejmě spíš v podmínkách in vitro, když se adsorbuje na jedinou bakterii příliš mnoho fágů současně. Poškození buněčné stěny je potom tak rozsáhlé, že bakterie hyne, nikoliv však lytickým účinkem fága [63]. Fágy jsou vázané ireverzibilně a často uvolňují svůj genom, ačkoli není žádná šance pro jejich replikaci [64]. V takových případech je obtížné rozhodnout o citlivosti kmene a jediným spolehlivým indikátorem citlivosti je výskyt plak. Navíc je metoda MDA kvůli rozvařování agaru pracnější než testování citlivosti k běžným antibiotikům např. difuzní diskovou metodou. Někteří autoři ověřují citlivost fágů pomocí snížení optické denzity suspenze bakterií léčených fágy [65]. Na tomto principu byla proto navržena jednoduchá metoda MOZ. Tato metoda je snadno proveditelná i v běžných diagnostických laboratořích vybavených rutinně denzitometrem, který se využije k měření optické denzity suspenze bakterií s fágem. O citlivosti je rozhodnuto již po 5hodinnové kultivaci.
Metoda MOZ byla porovnána s MDA na souboru 95 kmenů. Obě metody se shodovaly v 94,7 % případů. Spolehlivost MOZ se jeví jako srovnatelná s MDA (p = 0,132) a navíc po prodloužení kultivace a zvýšení frekvence měření může přinést informace o dynamice růstu bakterií v suspenzi, a můžeme tak pozorovat stresovou reakci či adaptaci bakterií vystavených působení fágů v reálném čase.
ZÁVĚRY
Z provedené analýzy výskytu kmenů MRSA stejně jako podle výročních zpráv projektu EARSS-net z roku 2017 vyplývá, že tyto kmeny tvoří nezanedbatelný podíl mezi původci závažných stafylokokových infekcí. Surveillance těchto nozokomiálních nákaz i hledání nových terapeutik by mělo patřit mezi priority medicíny a vědeckého výzkumu. V naší studii byl testován široký soubor kmenů S. aureus (867) na citlivost k preparátu Stafal®, který je k terapeutickému použití registrovaný v rámci Evropské unie na Slovensku. In vitro bylo prokázáno, že funguje jako alternativa k antibiotikům, zvláště u rezistentních kmenů stafylokoků. Preparát Stafal® měl účinnost na S. aureus 90,4 %. Při podrobnější analýze se ukázalo, že dokonce lépe účinkoval na kmeny MRSA než na kmeny MSSA. Nejlépe pak působil na multirezistentní kmeny s kombinací rezistence typu MRSA a MLSB (99,4 %). Preparát navíc vykazoval účinnost i na některé jiné druhy stafylokoků. Stafal® byl účinný jak na kmeny se silnou produkcí biofilmu, efekt byl srovnatelný, tak na kmeny, které produkovaly biofilm slaběji. Zjištěná asi 11% rezistence kmenů S. aureus může být důvodem k dalším inovacím preparátu Stafal®. Naše výsledky potvrzují možnosti využití bakteriofágové terapie, a to s výhodou tam, kde běžná antibiotika nepůsobí, nicméně zlatým standardem při boji proti nozokomiálním infekcím stále zůstává především dodržování hygieny a provádění správné ošetřovatelské péče.
Poděkování
Práce byla podpořena z programového projektu Ministerstva zdravotnictví ČR č. 16-29916A a projektu Ministerstva vnitra ČR č. VI20172020069.
Do redakce došlo dne 17. 5. 2019.
doc. MUDr. Filip Růžička, Ph.D.
Mikrobiologický ústav LF MU a FN
Pekařská 53, 656 91 Brno
e-mail: fruzic@fnusa.cz
Sources
1. Hormozi SF, Vasei N, Aminianfar M, et al. Antibiotic resistance in patients suffering from nosocomial infections in Besat Hospital. Eur J Transl Myol, 2018;28(3):7594.
2. Miller MA, Hyland M, Ofner-Agostini M, et al. Canadian Hospital Epidemiology Committee. Morbidity, Mortality, and Healthcare Burden of Nosocomial Clostridium Difficile-Associated Diarrhea in Canadian Hospitals. Infect Control Hosp Epidemiol, 2002;23(03):137–140.
3. Ziebuhr W, Hennig S, Eckart M, et al. Nosocomial infections by Staphylococcus epidermidis: how a commensal bacterium turns into a pathogen. J Antimicrob Agents, 2006;28 : 14–20.
4. Liu GY. Molecular Pathogenesis of Staphylococcus aureus Infection. Pediatric Research, 2009;65(5 Part 2):71R–77R.
5. Wertheim HF, Melles DC, Vos MC, et al. The role of nasal carriage in Staphylococcus aureus infections. Lancet Infect Dis, 2005;5(12):751–762.
6. Grundmann H, Aires-de-Sousa M, Boyce J, et al. Emergence and resurgence of meticillin-resistant Staphylococcus aureus as a public-health threat. Lancet, 2006;368(9538):874–885.
7. Lowy FD. Antimicrobial resistance: the example of Staphylococcus aureus. J Clin Invest, 2003;111(9):1265–1273.
8. Perichon B, Courvalin P. Heterologous Expression of the Enterococcal vanA Operon in Methicillin-Resistant Staphylococcus aureus. Antimicrob. Agents Chemother, 2004;48(11):4281–4285.
9. Mitka M. Seeking Medicare Audit. JAMA, 2010;303(6):499.
10. Otero LH, Rojas-Altuve A, Llarrull LI, et al. How allosteric control of Staphylococcus aureus penicillin binding protein 2a enables methicillin resistance and physiological function. Proc Natl Acad Sci U S A, 2013;110(42):16808–16813.
11. Alder JD. Daptomycin, a new drug class for the treatment of Gram-positive infections. Drugs Today, 2005;41(2):81.
12. Nyč O. Novinky a trendy v antibiotické léčbě. Interní Medicína pro Praxi, 2017;19(3):142–144.
13. Kurlenda J, Grinholc M. Alternative therapies in Staphylococcus aureus diseases. Acta Biochim Pol, 2012;59(2):171–184.
14. Chudobova D, Cihalova K, Dostalova S, et al. Comparison of the effects of silver phosphate and selenium nanoparticles on Staphylococcus aureus growth reveals potential for selenium particles to prevent infection. FEMS Microbiol Lett, 2014;351(2):195–201.
15. Grinholc M, Kawiak A, Kurlenda J, et al. Photodynamic effect of protoporphyrin diarginate (PPArg2) on methicillin-resistant Staphylococcus aureus and human dermal fibroblasts. Acta Biochim Pol, 2008;55(1):85–90.
16. Senna JPM, Roth DM, Oliveira JS, et al. Protective immune response against methicillin resistant Staphylococcus aureus in a murine model using a DNA vaccine approach. Vaccine, 2003;21(19–20):2661–2666.
17. Summers WC. The strange history of phage therapy. Bacteriophage, 2012;2(2):130–133.
18. Furfaro LL, Payne MS, Chang BJ. Bacteriophage Therapy: Clinical Trials and Regulatory Hurdles. Front Cell Infect Microbiol, 2018;8 : 376.
19. Hodyra-Stefaniak K, Miernikiewicz P, Drapała J, et al. Mammalian Host-Versus-Phage immune response determines phage fate in vivo. Scientific Reports, 2015;5 : 14802.
20. Lin DM, Koskella B, Lin HC. Phage therapy: An alternative to antibiotics in the age of multi-drug resistance. World J Gastrointest Pharmacol Ther, 2017;8(3):162–173.
21. Sulakvelidze A, Alavidze Z, Morris JG. Bacteriophage Therapy. Antimicrob. Agents Chemother, 2001;45(3):649–659.
22. Wittebole X, De Roock S, Opal SM. A historical overview of bacteriophage therapy as an alternative to antibiotics for the treatment of bacterial pathogens. Virulence, 2014;5(1):226–235.
23. Loc-Carrillo C, Abedon ST. Pros and cons of phage therapy. Bacteriophage, 2011;1(2):111–114.
24. Merril CR, Biswas B, Carlton R, et al. Long-circulating bacteriophage as antibacterial agents. Proc Natl Acad Sci, 1996;93(8):3188–3192.
25. Chhibber S, Kumari S. Application of Therapeutic Phages in Medicine. In: Kurtbke pek, ed. Bacteriophages, InTech; 2012 : 141–158.
26. Górski A, Jończyk-Matysiak E, Międzybrodzki R, et al. Phage Therapy: Beyond Antibacterial Action. Front Med, 2018;5 : 146.
27. Expert round table on acceptance and re-implementation of bacteriophage therapy. Silk route to the acceptance and re-implementa-tion of bacteriophage therapy. Biotechnol J, 2016;11(5):595–600.
28. Rohde C, Resch G, Pirnay JP, et al. Expert Opinion on Three Phage Therapy Related Topics: Bacterial Phage Resistance, Phage Training and Prophages in Bacterial Production Strains. Viruses, 2018;10(4):178.
29. Pillich J, Výmola F. Antistafylokokový fágový lyzát pro místní použití, PV-1156-79. Patent 203719, A61K39/12. Úřad pro vynálezy a objevy, Praha 1979.
30. Botka T, Pantůček R, Mašlaňová I, et al. Lytic and genomic properties of spontaneous host-range Kayvirus mutants prove their suitability for upgrading phage therapeutics against staphylococci. Sci Rep, 2019;9(1):5475.
31. ŠÚKL-Stafal, Detail lieku [online]. 2018-02-20 [cit. 2019-02-11]. Dostupné na www: <https://www.sukl.sk/hlavna-stranka/slovenska-verzia/pomocne-stranky/detail-lieku?page_id=386&lie_id=24546>
32. SÚKL-Stafal, sol 1×10, SPC [online]. 2014-01-01 [cit. 2019-02-11]. Dostupné na www: <http://www.sukl.cz/modules/medication/detail.php?code=0185891&tab=texts>
33. Zelenková H. Antistafylokokový fágový lyzát v liečbe chronických rán predkolenia na podklade chronickej venóznej insuficiencie a diabetes mellitus. Kazuistiky v diabetologii, 2014;12(2):15–19.
34. Jarčuška P. Ekonomické aspekty liečby stafylokokových infekcií kože a mäkkých tkanív protistafylokokovým fágovým lyzátom. Slovenská Chirurgia, 2015;12(1):15–18.
35. Dvořáčková M, Růžička F, Benešík M, et al. Antimicrobial effect of commercial phage preparation Stafal® on biofilm and planktonic forms of methicillin-resistant Staphylococcus aureus. Folia Microbiol, 2019;64(1):121–126.
36. Drilling A, Morales S, Jardeleza C, et al. Bacteriophage Reduces Biofilm of Staphylococcus aureus Ex Vivo Isolates from Chronic Rhinosinusitis Patients. American Journal of Rhinology & Allergy, 2014;28(1):3–11.
37. Stepanović S, Vuković D, Hola V, et al. Quantification of biofilm in microtiter plates: overview of testing conditions and practical recom-mendations for assessment of biofilm production by staphylococci. APMIS, 2007;115(8):891–899.
38. Surveillance Atlas of Infectious Diseases – MRSA, European Centre for Disease Prevention and Control [online]. 2018-11-15 [cit. 2019-02-11]. Dostupné na www: <https://atlas.ecdc.europa.eu/public/index.aspx?Dataset=27&HealthTopic=4&Indicator=299444&GeoResolution=2&TimeResolution=Year&StartTime=2000&EndTime=2017>
39. Factsheet for experts, European Centre for Disease Prevention and Control [online]. 2018-11-15 [cit. 2019-02-11]. Dostupné na www: <https://antibiotic.ecdc.europa.eu/en/get-informed/factsheets/factsheet-experts>
40. Ackermann G. Drugs of the 21st century: telithromycin (HMR 3647) – The first ketolide. J Antimicrob Chemother, 2003;51(3):497–511.
41. Revdiwala S, Rajdev BM, Mulla S. Characterization of Bacterial Etiologic Agents of Biofilm Formation in Medical Devices in Critical Care Setup. Crit Care Res Pract, 2012;2012 : 1–6.
42. Patel F, Goswami P, Khara R. Detection of Biofilm formation in device associated clinical bacterial isolates in cancer patients. SLJID, 2016;6(1):43.
43. Hassan A, Usman J, Kaleem F, et al. Evaluation of different detection methods of biofilm formation in the clinical isolates. Braz J Infect Dis, 2011;15(4):305–311.
44. Manandhar S, Singh A, Varma A, et al. Biofilm Producing Clinical Staphylococcus aureus Isolates Augmented Prevalence of Antibiotic Resistant Cases in Tertiary Care Hospitals of Nepal. Front Med, 2018;9 : 2749.
45. Stewart PS, Costerton JW. Antibiotic resistance of bacteria in biofilms. Lancet, 2001;358(9276):135–138.
46. Ghasemian A, Najar Peerayeh S, Bakhshi B, et al. Comparison of Biofilm Formation between Methicillin-Resistant and Methicillin--Susceptible Isolates of Staphylococcus aureus. Iran Biomed J, 2016;20(3):175–181.
47. Sugimoto S, Sato F, Miyakawa R, et al. Broad impact of extracellular DNA on biofilm formation by clinically isolated Methicillin-resistant and -sensitive strains of Staphylococcus aureus. Scientific Reports, 2018;8(1):2254.
48. Donlan RM. Biofilm Formation: A Clinically Relevant Microbiological Process. Clin Infect Dis, 2001;33(8):1387–1392.
49. Rao RS, Karthika RU, Singh SP, et al. Correlation between biofilm production and multiple drug resistance in imipenem resistant clinical isolates of Acinetobacter baumannii. Indian J Med Microbiol, 2008;26(4):333–337.
50. Chaudhry WN, Concepción-Acevedo J, Park T, Andleeb S, Bull JJ, Levin BR. Synergy and Order Effects of Antibiotics and Phages in Killing Pseudomonas aeruginosa Biofilms. PLoS One, 2017;12(1):e0168615.
51. Pantůček R, Rosypalová A, Doškař J, et al. The Polyvalent Staphylococcal Phage 812:Its Host-Range Mutants and Related Phages. Virology, 1998;246(2):241–252.
52. Vandersteegen K, Kropinski AM, Nash JHE, et al. Two Phage Isolates Representing a Distinct Clade within the Twortlikevirus Genus, Display Suitable Properties for Phage Therapy Applications. J Virol, 2013;87(6):3237–3247.
53. O’Flaherty S, Coffey A, Meaney W, et al. The Recombinant Phage Lysin LysK Has a Broad Spectrum of Lytic Activity against Clinically Relevant Staphylococci, Including Methicillin-Resistant Staphylococcus aureus. J Bacteriol, 2005;187(20):7161–7164.
54. Alves DR, Gaudion A, Bean JE, et al. Combined Use of Bacteriophage K and a Novel Bacteriophage To Reduce Staphylococcus aureus Biofilm Formation. J Appl Environ Microbiol, 2014;80(21):6694–6703.
55. Hsieh SE, Lo HH, Chen ST, et al. Wide Host Range and Strong Lytic Activity of Staphylococcus aureus Lytic Phage Stau2. J Appl Environ Microbiol, 2011;77(3):756–761.
56. Freyberger H, He Y, Roth A, et al. A. Effects of Staphylococcus aureus Bacteriophage K on Expression of Cytokines and Activation Markers by Human Dendritic Cells in vitro. Viruses, 2018;10(11):617.
57. Mattila S, Ruotsalainen P, Jalasvuori M. On-Demand Isolation of Bacteriophages Against Drug-Resistant Bacteria for Personalized Phage Therapy. Front Med, 2015;6 : 1271.
58. Sahin F, Karasartova D, Ozsan TM, et al. Identification of a novel lytic bacteriophage obtained from clinical MRSA isolates and evaluation of its antibacterial activity. Mikrobiol Bul, 2013;47(1):27–34.
59. Lehman S, Mearns G, Rankin D, et al. Design and Preclinical Development of a Phage Product for the Treatment of Antibiotic-Resistant Staphylococcus aureus Infections. Viruses, 2019;11(1):88.
60. Maharjan R, Ferenci T. The fitness costs and benefits of antibiotic resistance in drug-free microenvironments encountered in the human body: Fitness costs of antibiotic resistance. Environ Microbiol Rep, 2017;9(5):635–641.
61. Pirnay J-P, Blasdel BG, Bretaudeau L, et al. Quality and Safety Requirements for Sustainable Phage Therapy Products. Pharm Res, 2015;32(7):2173–2179.
62. Kaur S, Harjai K, Chhibber S. Methicillin-Resistant Staphylococcus aureus Phage Plaque Size Enhancement Using Sublethal Concentrations of Antibiotics. J Appl Environ Microbiol, 2012;78(23):8227–8233.
63. Delbrück M. The Growth of Bacteriophage and Lysis of the Host. J Gen Physiol, 1940;23(5):643–660.
64. Rodríguez-Rubio L, Martínez B, Donovan DM, et al. Bacteriophage virion-associated peptidoglycan hydrolases: potential new enzybiotics. Crit Rev Microbiol, 2013;39(4):427–434.
65. Xie Y, Wahab L, Gill J. Development and Validation of a Microtiter Plate-Based Assay for Determination of Bacteriophage Host Range and Virulence. Viruses, 2018;10(4):189.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2020 Issue 1-
All articles in this issue
- Tvorba biofilmu močovými patogénmi izolovanými z chronických a rekurentných infekcií močových ciest a vplyv biofilmu na in vitro účinok gentamicínu a kolistínu
- Možnosti terapeutického ovlivnění stafylokokových infekcí prostřednictvím bakteriofágů a vybrané metody testování citlivosti stafylokoků in vitro
- Klonální charakterizace kmenů Streptococcus pneumoniae metodami MLST a MLVA – může metoda MLVA charakterizaci zkvalitnit?
- Využití nízkoteplotního plazmatu v mikrobiologii a medicíně
- Biologická agens bioterorismu – připravenost je nezbytná
- První potvrzený záchyt kmene Staphylococcus argenteus v České republice
- Vzpomínka na MUDr. Martinu Havlíčkovou, CSc.
- Zemřel doc. MUDr. Zdeněk Ježek, DrSc., Rytíř českého lékařského stavu
- Preexpoziční profylaxe jako novinka v prevenci HIV infekce: zkušenosti HIV centra Ústřední vojenské nemocnice Praha
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Možnosti terapeutického ovlivnění stafylokokových infekcí prostřednictvím bakteriofágů a vybrané metody testování citlivosti stafylokoků in vitro
- Biologická agens bioterorismu – připravenost je nezbytná
- První potvrzený záchyt kmene Staphylococcus argenteus v České republice
- Preexpoziční profylaxe jako novinka v prevenci HIV infekce: zkušenosti HIV centra Ústřední vojenské nemocnice Praha
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

