-
Medical journals
- Career
Epidemiologie vybraných zástupců komplexu Mycobacterium tuberculosis v České republice v letech 2000–2016
Authors: V. Ulmann 1; H. Modrá 2; M. Bartoš 3; J. Caha 2; D. Hübelová 2; O. Konečný 2; I. Pavlík 2
Authors‘ workplace: Centrum klinických laboratoří, Oddělení bakteriologie a mykologie, Zdravotní ústav se sídlem v Ostravě 1; Ústav teritoriálních studií, Fakulta regionálního rozvoje a mezinárodních studií, Mendelova univerzita v Brně 2; Ústav experimentální biologie, Přírodovědecká fakulta, Masarykova univerzita v Brně 3
Published in: Epidemiol. Mikrobiol. Imunol. 67, 2018, č. 4, s. 184-190
Category: Review Article
Overview
Článek se zabývá epidemiologií zástupců komplexu Mycobacterium tuberculosis (MTBC) v České republice v letech 2000–2016 s výjimkou původce M. tuberculosis. M. bovis bylo prokázáno u 18 pacientů. M. caprae bylo diagnostikováno u 2 pacientů v letech 2001 a 2016 a M. microti u 1 pacienta v roce 2007. M. africanum bylo prokázáno v roce 2011 u HIV pozitivní ženy z Nigérie. U zvířat bylo izolováno M. pinnipedii v roce 2009 u lachtana hřivnatého (Otaria flavescens) importovaného z Německa. M. caprae bylo izolováno v roce 2002 od 2 velbloudů dvouhrbých (Camelus ferus) chovaných v zoologické zahradě. M. tuberculosis bylo izolováno v roce 2004 od psa a v roce 2007 od 2 prasat domácích. V obou případech byl zdrojem M. tuberculosis infikovaný pacient. Při vyšetření 3 727 vzorků vod a sedimentů z prostředí nebyl ve sledovaném období prokázán žádný ze zástupců MTBC. Za současné rizikové faktory šíření původců MTBC je možné považovat infikované osoby pocházející z oblasti výskytu M. africanum (zejména západní Afriky) a infikovaná zvířata. Při zachování stávající epidemiologické situace nehrozí riziko přenosu MTBC syrovým mlékem ani tepelně neopracovanými mléčnými výrobky.
Klíčová slova:
ekologie mykobakterií – domácí a volně žijící zvířata – bezpečnost potravin
ÚVOD
Komplex Mycobacterium tuberculosis (MTBC) zahrnuje obligátně patogenní druhy mykobakterií, které způsobují závažná onemocnění lidí a zvířat. Chronologicky podle doby objevení jsou do tohoto komplexu zařazeny druhy: M. tuberculosis (1882), M. bovis (1896), M. microti (1937), M. africanum (1969), M. canettii (1997), M. caprae (1999), M. pinnipedii (2003), M. mungi (2010), M. orygis (2012) a M. suricattae (2013). Do skupiny MTBC byl zařazen také tzv. „Dassie bacillus“ popsaný v roce 1960 [36, 59]. Vyjma vlastního původce humánní tuberkulózy (M. tuberculosis), byl výskyt jednotlivých zástupců komplexu MTBC v lidské a zvířecí populaci České republiky (ČR) publikován v několika publikacích [29, 30, 44, 45]. V období počínajícím rokem 2000 však byly publikovány pouze ojedinělé práce zabývající se diagnostikou M. bovis nebo jiných jednotlivých zástupců MTBC [6, 31, 62]. Komplexní epidemiologická analýza výskytu bovinní tuberkulózy a jiných zástupců MTBC v České republice (ČR) nebyla za toto období provedena. Přitom i ostatní zástupci MTBC než M. tuberculosis stále představují v zahraničí u lidí a zvířat závažný zdravotní a ekonomický problém [5, 37, 55]. Cílem této práce je proto podat souhrnný přehled všech evidovaných nebo publikovaných případů tuberkulózy pacientů způsobených jinými zástupci MTBC než vlastním druhem M. tuberculosis v ČR za období let 2000–2016. Dalším cílem je souhrn výsledků vyšetření prostředí a výsledků izolace MTBC u domácích a divokých zvířat za stejné období.
TUBERKULÓZNÍ KOMPLEX
Evoluční strom MTBC byl sestaven na základě genetických studií, které vycházejí z analýzy oblastí ztrát (delecí) úseků na bakteriálním chromozómu a specifických nukleotidových záměn [36]. Z tohoto pohledu se s největší pravděpodobností jako vývojově nejstarší druh jeví M. canettii. Z něho se vyvinul „předchůdce“ dnešního M. tuberculosis označovaný jako „Ancestral“ M. tuberculosis. Delece specifické části genomu pak vedla k vývoji „moderního“ M. tuberculosis („Modern“ M. tuberculosis) a delece jiné části pak k vývoji druhu M. africanum. Při adaptacích tohoto druhu na malá zvířata a hlodavce docházelo k dalším ztrátám úseků DNA na chromozomu a záměnám nukleotidů. Tento vývoj vedl ke vzniku druhů M. mungi, „Dasssie bacillus“, M. suricattae a M. microti. Adaptací na velká zvířata pak vznikají druhy M. orygis, M. pinnipedii, M. caprae a M. bovis. Podstata genetických změn při těchto adaptacích zůstává stejná jako v předchozích případech. Druh M. bovis BCG (Bacillus Calmette-Guérin), vyvinutý pro vakcinaci proti humánní tuberkulóze, je potom vývojově posledním stupněm. Tento druh byl připraven „uměle“ opakovaným pasážováním „divokého“ kmene M. bovis izolovaného z vemene krávy postižené tuberkulózní mastitidou. Nejvýraznějším rysem této uměle navozené evoluce jsou opět delece částí genomu.
U člověka bylo zatím prokázáno 7 zástupců MTBC: M. tuberculosis, M. bovis, M. microti, M. africanum, M. canettii, M. caprae a M. pinnipedii. V ČR byla popsána ve sledovaném období let 2000–2016 infekce způsobená 5 druhy. Celkem se jednalo o 14 623 pacientů, u kterých převládaly infekce vyvolané M. tuberculosis (14 601 pacientů). Prokázáno bylo i M. bovis (18 pacientů), M. caprae (2 pacienti), M. microti (1 pacient) a M. africanum (1 pacient) – tabulka 1.
Table 1. Incidence infekcí vyvolaných zástupci komplexu M. tuberculosis (MTBC) v ČR v letech 2001–2016 Table 1. Incidence of infections caused by representatives of the M. tuberculosis complex (MTBC) in the Czech Republic in 2001–2016 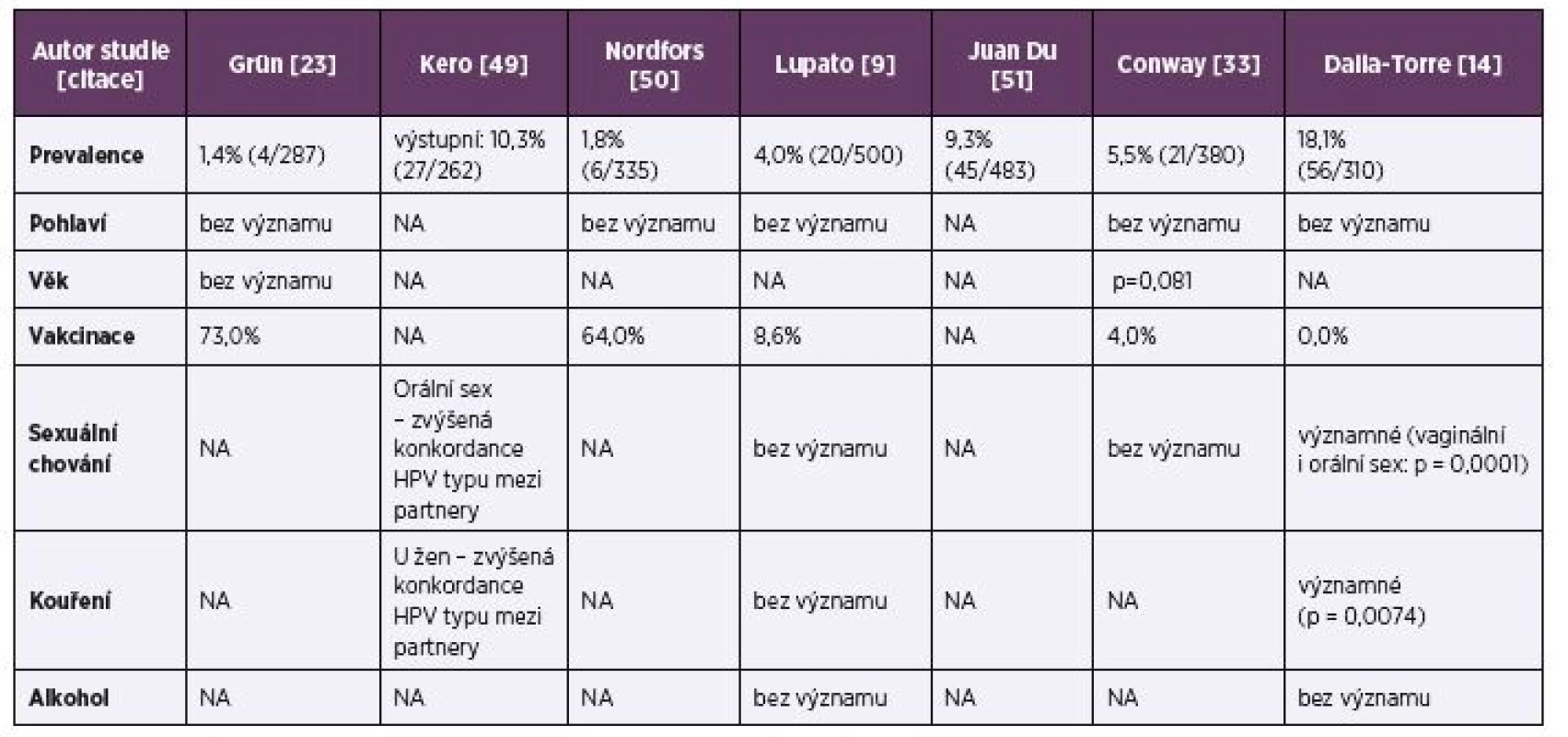
Zdroj: [73].
+Jako M. caprae identifikován jeden izolát v roce 2001 a jeden izolát v roce 2016 (ZÚ Ostrava).
++Jeden izolát identifikován jako M. microti (ZÚ Ostrava).
&Izoláty popsány: [62].
*Jeden izolát identifikován jako M. bovis subsp. bovis: [6].
Source [73]
+One isolate in 2001 and one isolate in 2016 were identified as M. caprae (Health Institute Ostrava).
++One isolate identified as M. microti (Health Institute Ostrava).
&Isolates described: [62].
*One isolate identified as M. bovis subsp. bovis: [6].Humánní tuberkulóza
Původci humánní tuberkulózy jsou M. tuberculosis, M. africanum a M. canettii. V ČR, stejně jako i v jiných zemích, je jednoznačně nejvýznamnější druh M. tuberculosis. Přes trvalý každoroční pokles nově evidovaných případů přetrvává v ČR humánní tuberkulóza ve vyloučených komunitách u rodinných příslušníků formou mikroepidemií. Nejvyšší počet hlášených případů onemocnění je nadále zaznamenáván ve věkových kategoriích nad 60 let. Progresivní onemocnění je často spjato s nižším socioekonomickým standardem a užíváním návykových látek. Tato progresivní forma onemocnění však byla evidována v ČR také u zdravotnických pracovníků. Tuberkulóza dětí do 18 let věku je nadále vzácná. Cizinci pobývající na území ČR tvořili ve sledovaném období 21 % všech případů diagnostikované tuberkulózy.
Další zástupci MTBC, M. africanum a M. canettii, jsou izolováni sporadicky a vyskytují se především u pacientů pocházejících z Afriky [72]. V současnosti je M. africanum izolováno především u pacientů žijících ve státech západní a subsaharské Afriky, např. v Mali [67].
V ČR bylo ve sledovaném období M. africanum zachyceno ze sputa a hrudního punktátu pouze v roce 2011 na Infekční klinice Nemocnice Na Bulovce u 29leté pacientky pocházející z Nigérie, která byla současně infikována virem HIV (viz tab. 1, [15, cit. podle [62]). V roce 2017, tedy již mimo námi sledované období, byl evidován další případ infekce způsobené M. africanum u 44letého pacienta s plicním postižením v Moravskoslezském kraji, který pocházel z Gambie (izolát byl identifikován v ZÚ se sídlem v Ostravě; nepublikovaná data). Podobné případy jsou popisovány v poslední dekádě v Evropě u imigrantů pocházejících z regionu států Západní Afriky [1, 22]. U zvířat je M. africanum prokazováno rovněž především v Africe, a to u skotu, který se nakazil od infikovaných farmářů a dalších osob [42, 71]. Infikované krávy mohou následně vylučovat M. africanum mlékem. Výrobky pocházející z takového mléka jsou bez tepelné úpravy rovněž infekční [2]. V Evropě se M. africanum u zvířat vyskytuje zcela ojediněle. Například v Chorvatsku byl tento původce prokázán v zoologické zahradě u damana kapského (Procavia capensis), nejbližšího příbuzného slona [25].
M. canettii nebylo dosud v ČR izolováno. Od objevu a popisu tohoto druhu v roce 1997 bylo zatím celosvětově prokázáno méně než 100 izolátů od pacientů, kteří mají vztah k regionu Východní Afrika, tedy k zemím v tzv. Africkém rohu [61].
M. tuberculosis bylo v roce 2004 zjištěno u 5leté feny dobrmana, která se infikovala od svého 42letého majitele, který později zemřel na otevřenou plicní formu tuberkulózy. Metodou DNA fingerprintingu (IS6110 RFLP analýza) byl zjištěn identický DNA typ izolátu M. tuberculosis u feny, u jejího majitele a u přítele majitele, který byl s největší pravděpodobností zdrojem infekce [Pavlik et al., 2005; Moravkova et al., 2011]. M. tuberculosis bylo izolováno také v roce 2007 od dvou poražených prasat z tuberkulózně změněných podčelistních mízních uzlin [43]. Tato prasata byla s největší pravděpodobností infikována od ošetřovatele pocházejícího z Ukrajiny, u kterého byla zjištěna otevřená plicní tuberkulóza [28].
Bovinní tuberkulóza
Za původce bovinní tuberkulózy jsou považovány 2 dosud popsané druhy: M. bovis a M. caprae. V ČR bylo ve sledovaném období prokázáno M. bovis u 18 a M. caprae u 2 pa - cientů (viz tab. 1). V roce 2001 bylo M. caprae prokázáno na Frýdecko-Místecku ve sputu 75leté ženy s plicní formou onemocnění. Pacientka se podrobila standardní antituberkulózní léčbě v sanatoriu a poté byla propuštěna do domácí péče. Druhý záchyt M. caprae byl zaznamenán v roce 2016 v postižené tkáni pleury u 65leté ženy z Krnova, která byla dlouhodobě upoutána na lůžko. V obou případech nebyl primární zdroj infekce dohledáván. Je vysoce pravděpodobné, že se jednalo o reaktivaci dřívějšího onemocnění a k jejich infekci došlo při konzumaci tepelně neošetřených infikovaných potravin, nebo při kontaktu s infikovanými hospodářskými zvířaty v období ještě před utlumením bovinní tuberkulózy u skotu (před rokem 1968) nebo před eradikací tohoto onemocnění v roce 1995 [33, 47].
V ČR bylo před rokem 2000 M. caprae prokázáno jak u zvířat, tak u člověka. V molekulárně epidemiologické studii byl pomocí spoligotypizace potvrzen výskyt M. caprae u skotu v letech 1966, 1991 a 1995, a u faremně chovaného jelena evropského (Cervus elaphus) a u člověka v roce 1999 [16, 48].
Přestože jsou záchyty M. caprae v porovnání s M. bovis méně časté, v lidské populaci se vyskytuje prakticky po celém světě. Nejčastěji je M. caprae prokazováno u pa - cientů, kteří pocházejí z území, které historicky náleželo do habsburské monarchie [51, 52]. Bylo rovněž zjištěno, že M. caprae se vyskytuje u skotu ve stejných oblastech (střední Evropa, Švýcarsko, Španělsko a další státy), ve kterých žili infikovaní pacienti [16]. Příčinou šíření M. caprae byli pravděpodobně infikovaní býci, se kterými bylo obchodováno pro jejich vhodné genetické vlastnosti v rámci habsburské monarchie i Švýcarska, odkud rod Habsburků pocházel. Následně se po druhé světové válce M. caprae šířilo do tehdejšího Sovětského svazu infikovaným skotem, který se stal válečnou kořistí. Při sledování výskytu M. caprae u skotu v jiných mimoevropských zemích nebyl například v Kanadě v letech 1985–2015 tento druh prokázán v žádném ze 137 izolátů pocházejících od domácích zvířat [4].
M. caprae se na člověka přenáší přímým nebo nepřímým kontaktem. Nejčastěji byly zdrojem původce onemocnění tepelně neupravené potraviny (zejména syrové mléko a mléčné výrobky z něj pocházející). V Německu bylo pomocí biologického pokusu na morčatech experimentálně prokázáno, že při výrobě sýru ementál z uměle kontaminovaného mléka, přežívá virulentní M. bovis ještě 3 měsíce po zahájení zrání sýru [27]. Při experimentální inokulaci jogurtů bylo zjištěno, že pokud během fermentace klesá pH, k devitalizaci M. tuberculosis, M. bovis a M. bovis BCG dochází za 18–24 hod. V neutralizovaném jogurtu naproti tomu M. tuberculosis (kmen H37Rv) přežívalo po celou dobu šestidenního sledování [64].
V podhorských alpských oblastech Rakouska a Německa bylo M. caprae s největší pravděpodobností přeneseno od pastevně chovaného skotu na volně žijící jeleny evropské (Cervus elaphus). Výskyt bovinní tuberkulózy je u těchto jelenů v současné době významným zdravotním i ekonomickým problémem [18]. Podobně nepříznivá situace je dnes zjišťována rovněž v populaci jelenů evropských v Itálii [13]. Od nich se predací uhynulých infikovaných těl přeneslo M. caprae na lišky obecné (Vulpes vulpes), což se potvrdilo v roce 2015 [54]. Podobným způsobem se M. caprae zřejmě rozšířilo i ve Španělku mezi volně žijící prasata divoká (Sus scrofa) a jeleny iberské (Cervus elaphus hispanicus) [21].
U nás bylo M. caprae izolováno v roce 2002 od 2 velbloudů dvouhrbých (Camelus ferus) chovaných v zoologické zahradě, kam byli importováni v roce 1985 z Blízkého východu [16, 49].
Ostatní zástupci tuberkulózního komplexu
Ve sledovaném období bylo prokázáno M. microti v roce 2007 ve sputu 50letého muže (tab. 1). Tento pacient žil osaměle v lesní lokalitě na Šumpersku a neměl trvalé bydliště. Uváděl, že v místě jeho pobytu, tedy v improvizovaném přístřešku v lese, pozoroval zvýšený pohyb drobných zemních savců. Další osud pacienta již není znám. Z dostupných statistik a publikovaných výsledků vyplývá, že se jedná o první záchyt druhu M. microti u člověka v ČR.
Tento původce tuberkulózy u volně žijících drobných zemních savců byl původně popsán ve Velké Británii jako M. tuberculosis subsp. muris [70] a následně přejmenován na M. microti [53]. Identifikace původce je dnes snadnější díky molekulárně biologickým metodám, pomocí kterých bylo zjištěno, že kromě drobných zemních savců se M. microti vyskytuje také v lidské populaci [12, 68]. V posledních dvou dekádách byly popsány případy infekce plic způsobené M. microti především u pacientů s HIV/AIDS [32, 41]. Jsou ovšem dokumentovány i případy infekce imunokompetentních jedinců [20, 23].
Primárním rezervoárem M. microti jsou drobní zemní savci. Ve Velké Británii jevilo příznaky klinické tuberkulózy 101 (2 %) ze 4 852 odchycených drobných zemních savců. U 24 z nich bylo potvrzeno M. microti metodou spoligotypizace a analýzou RFLP [12]. M. microti bylo prokázáno také u predátorů drobných zemních savců: ze 159 mykobakteriemi infikovaných koček domácích bylo M. microti prokázáno u 39,6 % z nich [26].
Ve srovnání s Velkou Británií je na území kontinentální Evropy výskyt M. microti u drobných zemních savců nižší. Výskyt na tomto území dokumentují především průkazy u jejich predátorů. M. microti bylo např. prokázáno u prasat divokých ve Švýcarsku a Lichtenštejnsku [56], v Itálii [9] a ve Francii [38]. Výsledky zatím nejrozsáhlejšího monitorování M. microti na území kontinentální Evropy pochází z let 2002–2014 z Francie, kde bylo popsáno 35 případů infikovaných zvířat. Tento původce byl prokázán u 19 koček domácích (54 %), 7 prasat divokých (20 %), 3 psů domácích (8 %), 2 kosmanů bělovousých (Callithrix jacchus) 6 %, 1 lamy krotké (Lama glama) 3 %, 1 lamy alpaky (Vicugna pacos) 3 %, 1 vydry říční (Lutra lutra) 3 % a 1 prasete domácího 3 % [38].
V ČR se při vyšetření 3 904 drobných zemních savců podařilo izolovat pouze podmíněně patogenní netuberkulózní mykobakterie (NTM) u 77 (2,0 %) z nich. Žádný izolát nepatřil do komplexu MTBC včetně M. microti (nepublikovaná data). Další podrobné informace o M. microti jsou uvedeny v přehledných článcích [35, 57].
Do skupiny zástupců MTBC patří také M. pinnipedii, které bylo popsáno u vodních savců na jižní polokouli [14, 65]. V roce 1988 byla prokázána infekce M. pinnipedii poprvé také u ošetřovatele lachtanů šedých (Neophoca cinerea) a lachtanů Forsterových (Arctocephalus forsteri), kteří byli primárně infikováni tímto původcem [19, 68]. M. pinnipedii se šíří mezi vodními savci přímým kontaktem. V zoologických zahradách, ve kterých byl tento původce diagnostikován nejčastěji, se šíří především vodním aerosolem, který vzniká při pravidelném čištění bazénů tlakovou vodou [66].
V ČR bylo dosud M. pinnipedii diagnostikováno pouze v roce 2009 v zoologické zahradě u jednoho uhynulého ploutvonožce lachtana hřivnatého (Otaria flavescens), který pocházel z Německa. Při pitvě tohoto sedmiletého samce byly na plicích, mezenteriálních mízních uzlinách a pleuře nalezeny četné granulomatózní uzlíky [34].
Ekologie zástupců tuberkulózního komplexu
V prostředí mimo hostitelský organismus není žádný ze zástupců MTBC schopný se množit. Tento nedostatek je však nahrazen jejich velkou odolností ve vnějším prostředí. Experimenty v současné době tyto předpoklady potvrzují. Druhy M. tuberculosis, M. bovis a M. canettii přežívaly v experimentálně infikované zemině 12 měsíců při zachování virulence pro laboratorní myši [24].
Odpadní vody
Hlavním zdrojem kontaminace prostředí v zemích s vysokou prevalencí infekcí způsobovaných zástupci MTBC jsou odpadní vody, které se dělí na tři hlavní typy:
- Komunální odpadní vody z měst a vesnic, které jsou kontaminovány především v oblastech bez čistíren odpadních vod.
- Průmyslové odpadní vody z jatek a provozoven zpracovávajících maso a další živočišné produkty, které představují v některých oblastech (především v rozvojových zemích) největší zdroj kontaminace MTBC a dalšími druhy zdravotně významných mykobakterií (NTM).
- Odpadní vody ze zemědělství, které jsou složeny především z exkrementů zvířat, odpadních vod ze zemědělských provozů apod. [17].
Komunální odpadní vody
Plně virulentní M. tuberculosis bylo např. v Polsku izolováno ze sedimentů odpadních vod v hloubce 20 cm. Při následujících experimentech byla v těchto sedimentech plná virulence u morčete prokázána ještě po 9 měsících. K devitalizaci M. tuberculosis docházelo až v hloubce 7 m. Bylo proto následně doporučeno používat tento sediment z odpadních vod na hnojení okopanin, obilovin nebo květin a nikoli na hnojení zeleniny k přímé spotřebě [7].
Výskyt zástupců MTBC v prostředí byl největším problémem v období po druhé světové válce, kdy se tito původci onemocnění šířili z nemocnic a léčeben s infikovanými pacienty. Zajímavé výsledky byly publikovány z Polska, Rumunska a dalších států. Půl kilometru od vyústění odpadů ze tří nemocnic a jednoho sanatoria v Polsku bylo po proudu vyšetřením 131 vzorků získáno 21 (16,0 %) izolátů M. tuberculosis a 11 (8,4 %) izolátů M. bovis [10]. V jiné oblasti Polska byla záchytnost MTBC z odpadních vod z měst a tuberkulózních sanatorií ještě vyšší. Vyšetřením 13 vzorků bylo získáno 9 (69,3 %) izolátů patřících do MTBC [11].
V Rumunsku bylo prokázáno M. tuberculosis v odpadní vodě odebrané 5 km po proudu od zdroje, kterým bylo tuberkulózní sanatorium [3]. V Kazachstánu bylo vyšetřeno 1 400 vzorků odpadních vod vzdálených až několika kilometrů po proudu řek od tuberkulózních sanatorií. Celkem bylo získáno 22 (1,6 %) mykobakteriálních izolátů: 15 M. tuberculosis, 5 M. bovis a 2 izoláty podmíněně patogenních mykobakterií (NTM) [8]. V Rusku bylo z 1 210 vzorků šedé odpadní vody (po mytí nádobí, praní prádla apod.) pocházející ze 188 domácností s pacienty s různými formami tuberkulózy izolováno M. tuberculosis z 15,2 % domácností [50].
V rozvojových zemích, kde jsou časté infekce u lidí způsobené zástupci MTBC, není z dostupné literatury o výskytu M. tuberculosis a M. africanum v odpadních vodách a v prostředí mnoho informací. Výjimkou je údaj o odpadních vodách z nemocnic v Kamerunu, kde bylo izolováno M. africanum [40].
Průmyslové odpadní vody
Z průmyslových odpadů jsou nejvýznamnějším zdrojem MTBC odpadní vody z jatek. Například v Polsku bylo ze 36 vzorků těchto odpadních vod izolováno jak M. bovis (4 izoláty), tak i M. tuberculosis (2 izoláty). Zdrojem M. bovis byl s největší pravděpodobností porážený skot s bovinní tuberkulózou [10]. Pravděpodobným zdrojem M. tuberculosis bylo sputum, stolice a moč infikovaných pracovníků na jatkách. Je tomu tak proto, že skot a ostatní zvířata jsou k infekci M. tuberculosis odolnější a vylučování M. tuberculosis z jejich organismu bylo prokázáno zcela ojediněle [69].
Odpady v zemědělství
V rozvojových zemích jsou na hnojení rostlin včetně zeleniny často používány exkrementy lidí a zvířat. Riziko přenosu zástupců MTBC je zde reálné zejména tepelně neupravenou zeleninou, případně i čerstvým nedostatečně omytým ovocem nebo ovocnými tepelně neošetřenými džusy. M. tuberculosis a M. bovis bylo zjištěno v odpadních vodách jak v tekutém sloupci, tak i v sedimentu [3, 8, 10, 11]. V Polsku bylo v letech 1965–1966 M. bovis a M. tuberculosis identifikováno u 12 (16,0 %) ze 75 mykobakteriálních izolátů z odpadních vod, které pocházely od infikovaných stád skotu a byly vyváženy na pastviny [58, 63]. Zdrojem zástupců MTBC mohly v té době být současně i městské odpadní vody, které se používaly na zavlažování [60]. Není vyloučena ani infekce z aerosolu obsahujícího mykobakterie, který může být aspirován při manipulaci s kontaminovanými surovinami [11].
V infikovaném stádu skotu se původce bovinní tuberkulózy šíří různými cestami včetně kontaminovaného stájového prostředí. To bylo prokázáno i u skotu v ČR v posledním ohnisku bovinní tuberkulózy vyvolaném M. caprae v roce 1995. Onemocnění se v tomto případě rozšířilo z jediného infikovaného kusu skotu na celé stádo (celkem bylo chováno 29 kusů) a na pět společně chovaných prasat domácích. V mléce a v moči zvířat a v krmivu M. caprae prokázáno nebylo. Původce však byl kultivačně prokázán ve třech vzorcích z prostředí stáje. Konverze na humánní tuberkulin byla zjištěna u 50letého farmáře, který byl denně v kontaktu s těmito zvířaty. U farmářovy 45leté manželky a u 20leté dcery, které byly v kontaktu s infikovanými zvířaty zcela výjimečně, nebyla konverze zjištěna [46, 47].
Vyšetření vzorků prostředí na přítomnost mykobakterií
V letech 2001–2016 bylo v Centru klinických laboratoří (Oddělení bakteriologie a mykologie, Zdravotní ústav se sídlem v Ostravě) vyšetřeno celkem 2 572 vzorků pitné a užitkové vody ze severní Moravy. Podmíněně patogenní NTM byly izolovány u 1 319 (51,3 %) vzorků. V letech 2016–2017 bylo vyšetřeno celkem 1 155 vzorků říčních sedimentů a dalších vzorků prostředí z Moravy. Podmíněně patogenní NTM byly prokázány ve 355 (30,7 %) vzorcích. Žádného zástupce MTBC se nepodařilo ani v jednom z těchto celkem 3 727 vzorcích prokázat (nepublikovaná data).
ZÁVĚR
V České republice bylo v letech 2000–2016 prokázáno u pacientů s tuberkulózou 5 zástupců komplexu M. tuberculosis. Celkem u 14 623 pacientů byla většina infekcí vyvolaná M. tuberculosis (99,9 %). U 18 pacientů (0,1 %) bylo v 7 letech (2000–2003, 2008, 2011–2012) prokázáno M. bovis, u 2 pacientů (0,01 %) bylo v letech 2001 a 2019 diagnostikováno M. caprae. Z ostatních dvou druhů komplexu M. tuberculosis bylo u 1 pacienta (0,01 %) v roce 2007 prokázáno M. microti, což je první záchyt tohoto druhu u člověka v ČR a u 1 pacienta (0,01 %) bylo v roce 2011 izolováno M. africanum. U domácích a divokých zvířat byli ve stejném období kultivačně prokázáni následující zástupci komplexu MTBC: M. caprae bylo izolováno v roce 2002 od 2 velbloudů dvouhrbých (Camelus ferus) pocházejících ze zoologické zahrady. M. tuberculosis bylo izolováno v roce 2004 od 1 psa a v roce 2007 od 2 prasat domácích. V obou případech byl zdrojem M. tuberculosis infikovaný pacient. M. pinnipedii bylo izolováno v roce 2009 u lachtana hřivnatého (Otaria flavescens). Incidence a prevalence je v ČR v lidské populaci příznivá jak v případě humánní, tak i zvířecí tuberkulózy. Kultivační vyšetření vzorků prostředí (voda, sedimenty aj. matrice) neprokázalo žádného zástupce komplexu M. tuberculosis.
Poděkování
Projekt vznikl za podpory grantu GAČR 16-13231S. Autoři děkují Mgr. Vlastě Zatloukalové, DiS. (Informační centrum, Mendelova univerzita v Brně) za získání četných publikací, které byly použity při psaní tohoto souhrnného sdělení.
Do redakce došlo dne 28. 2. 2018.
Adresa pro korespondenci:
prof. MVDr. Ivo Pavlík, CSc.
Ústav teritoriálních studií
Fakulta regionálního rozvoje a mezinárodních studií
Mendelova univerzita v Brně
tř. Generála Píky 7
613 00 Brno
e-mail: ivo.pavlik@mendelu.cz
Sources
1. Abascal E, Herrera DM, Herranz M, Santantón S, Martínez-Lirola M, Tudó G, Gonzalez J, Bouza E, Pérez-Lago L, García-de-Viedma D. A deletion hampering appropriate typing of Mycobacterium africanum. Tuberculosis, 2017;103 : 24–27.
2. Agada CA, Adesokan HK, Igwe D, Cadmus SI. Mycobacterium africanum and nontuberculous mycobacteria from fresh milk of pastoral cattle and soft cheese in Oyo State implications for public health. Afr J Med Med Sci, 2014;43 : 13–20.
3. Ancusa M, Terbancea W. Vorkommen von Tuberkulosebakterien in Vorflutern. Z. Gesamte Hyg, 1970;16 : 913–916.
4. Andrievskaia O, Turcotte C, Berlie-Surujballi G, Battaion H, Lloyd D. Genotypes of Mycobacterium bovis strains isolated from domestic animals and wildlife in Canada in 1985–2015. Vet Microbiol, 2018;214 : 44–50.
5. Ayele WY, Neill SD, Zinsstag J, Weiss MG, Pavlik I. Bovine tuberculosis: an old disease but a new threat to Africa. Int J Tuberc Lung Dis, 2004;8(8):924–937.
6. Bártů V, Müllerová M, Kalina P, Kubín M, Poupětová V. Tuberkulóza vyvolaná Mycobacteriem bovis. Stud Pneumol Phthiseol, 2009;69(1):5–7.
7. Bedrynska-Dobek M. Investigations of sewage sediment and water from the pond Starorzecze-Naramowice for the presence of tubercle bacilli. Pol Med J, 1966;5 : 1058–1064.
8. Blagodarnyi I, Vaksov VM. Epidemiological and epizootiological significance of effluents coming from antituberculous establishments (rusky). Probl Tuberk,1972;50 : 8–12.
9. Boniotti MB, Gaffuri A, Gelmetti D, Tagliabue S, Chiari M, Mangeli A, Spisani M, Nassuato C, Gibelli L, Sacchi C, Zanoni M, Pacciarini ML. Detection and molecular characterization of Mycobacterium microti isolates in wild boar from northern Italy. J Clin Microbiol, 2014;52(8):2834–2843.
10. Buczowska Z. Tubercle bacilli in the sewage and in sewage-receiving waters. Biul Inst Med Morsk Gdansk, 1965;16 : 49–56.
11. Buraczewski O, Osinski J. Acid-fast bacilli in sewage. Pol Med J, 1966;5 : 1065–1072.
12. Cavanagh R, Begon M, Bennett M, Ergon T, Graham IM, de Haas PEW, Hart CA, Koedam M, Kremer K, Lambin X, Roholl P, van Soolingen D. Mycobacterium microti infection (vole tuberculosis) in wild rodent populations. J Clin Microbiol, 2002;40 : 3281–3285.
13. Chiari M, Zanoni M, Alborali LG, Zanardi G, Avisani D, Tagliabue S, Gaffuri A, Pacciarini ML, Boniotti MB. Isolation of Mycobacterium caprae (Lechtal genotype) from red deer (Cervus elaphus) in Italy. J Wildl Dis, 2014;50(2):330–333.
14. Cousins DV, Bastida R, Cataldi A, Quse V, Redrobe S, Dow S, Duignan P, Murray A, Dupont C, Ahmed N, Collins DM, Butler WR, Dawson D, Rodríguez D, Loureiro J, Romano MI, Alito A, Zumarraga M, Bernardelli A. Tuberculosis in seals caused by a novel member of the Mycobacterium tuberculosis complex: Mycobacterium pinnipedii sp. nov. Int J Syst Evol Microbiol, 2003;53(5):1305–1314.
15. Dryák P. osobní sdělení, dosud nepublikováno, 2012 (cit. dle Svobodová, 2013).
16. Erler W, Martin G, Sachse K, Naumann L, Kahlau D, Beer J, Bartos M, Nagy G, Cvetnic Z, Zolnir-Dovc M, Pavlik I. Molecular fingerprinting of Mycobacterium bovis subsp. caprae isolates from Central Europe. J Clin Microbiol, 2004;42(5): 2234–2238.
17. Falkinham J, Kazda J, Pavlik I. Environments providing favourable conditions for the multiplication and transmission of mycobacteria. In: Kazda J, Pavlik I, Falkinham J, Hruska K (eds.). The ecology of mycobacteria: Impact on animal’s and human’s health. Dordrecht: Springer, 2009. s. 89–198.
18. Fink M, Schleicher C, Gonano M, Prodinger WM, Pacciarini M, Glawischnig W, Ryser-Degiorgis MP, Walzer C, Stalder GL, Lombardo D, Schobesberger H, Winter P, Büttner M. Red deer as maintenance host for bovine tuberculosis, Alpine region. Emerg Infect Dis, 2015;21(3):464–467.
19. Forshaw D, Phelps GR. Tuberculosis in a captive colony of pinnipeds. J Wildl Dis, 1991;27 : 288–295.
20. Frota CC, Hunt DM, Buxton RS, Rickman L, Hinds J, Kremer K, van Soolingen D, Colston MJ. Genome structure in the vole bacillus, Mycobacterium microti, a member of the Mycobacterium tuberculosis complex with a low virulence for humans. Microbiology, 2004;1510 : 1519–1527.
21. García-Jiménez WL, Cortés M, Benítez-Medina JM, Hurtado I, Martínez R, García-Sánchez A, Risco D, Cerrato R, Sanz C, Hermoso-de-Mendoza M, Fernández-Llario P, Hermoso-de-Mendoza J. Spoligotype diversity and 5-year trends of bovine tuberculosis in Extremadura, southern Spain. Trop Anim Health Prod, 2016;48(8):1533–1540.
22. Garzelli C, Lari N, Cuccu B, Tortoli E, Rindi L. Impact of immigration on tuberculosis in a low-incidence area of Italy: a molecular epidemiological approach. Clin Microbiol Infect, 2010;16(11):1691–1697.
23. Geiss HK, Feldhues R, Niemann S, Nolte O, Rieker R. Landouzy septicemia (sepsis tuberculosa acutissima) due to Mycobacterium microti in an immunocompetent man. Infection, 2005;33 : 393–396.
24. Ghodbane R, Mba Medie F, Lepidi H, Nappez C, Drancourt M. Long-term survival of tuberculosis complex mycobacteria in soil. Microbiology, 2014;160(3):496–501.
25. Gudan A, Artuković B, Cvetnić Z, Spicić S, Beck A, Hohsteter M, Naglić T, Bata I, Grabarević Z. Disseminated tuberculosis in hyrax (Procavia capensis) caused by Mycobacterium africanum. J Zoo Wildl Med, 2008;39(3):386–391.
26. Gunn-Moore DA, McFarland SE, Brewer JI, Crawshaw TR, Clifton-Hadley RS, Kovalik M, Shaw DJ. Mycobacterial disease in cats in Great Britain: I. Culture results, geographical distribution and clinical pre-sentation of 339 cases. J Feline Med Surg, 2011;13(12):934–944.
27. Hahn H. Ist die Herstellung von Emmentaler Markenkäse aus Rohmilch vom Standpunkt des Lebensmittelhygienikers vertretbar? Tierartl Umsch, 1959;14 : 254–256.
28. Havelková M. osobní sdělení. Státní zdravotní ústav, Praha, dosud nepublikováno, 2007.
29. Havelkova M, Sulova M, Kubin M. Problems of infections caused by Mycobacterium bovis in the human population of the CSR in the post-elimination period (in Czech). Stud Pneumol Phtiseol Cechoslov, 1987; 47 : 174–183.
30. Havelková M, Kubín M, Bartl J, Pavlík I. Tuberkulóza v lidské populaci České republiky. Veterinářství, 1998;48(4):158–160.
31. Homolka J, Šterclová M, Vašáková M, Bláha K. Katétrová infekce vyvolaná Mycobacterium bovis. Čas Lék Čes, 2010;149 : 297–299.
32. Horstkotte MA, Sobottka I, Schewe CK, Schäfer P, Laufs R, Rüsch--Gerdes S, Niemann S. Mycobacterium microti llama-type infection presenting as pulmonary tuberculosis in a human immunodeficiency virus-positive patient. J Clin Microbiol, 2001;39 : 406–407.
33. Kouba V. Historie eliminace bovinní tuberkulózy v České republice. Čas Lék Čes, 1999;138 : 456–459.
34. Kriz P, Kralik P, Slany M, Slana I, Svobodova J, Parmova I, Barnet V, Jurek V, Pavlik I. Mycobacterium pinnipedii in a captive Southern sea lion (Otaria flavescens): a case report. Vet Med-Czech, 2011;56(6):307–313.
35. Kubín M. Mycobacterium microti redivivum. Stud Pneumol Phthiseol, 2009;69(1):21–25.
36. Malone KM, Gordon SV. Mycobacterium tuberculosis complex members adapted to wild and domestic animals. Adv Exp Med Biol, 2017;1019 : 135–154.
37. Michel AL, Müller B, van Helden PD. Mycobacterium bovis at the animal-human interface: a problem, or not? Vet Microbiol, 2010;140(3–4):371–381.
38. Michelet L, de Cruz K, Zanella G, Aaziz R, Bulach T, Karoui C, Hénault S, Joncour G, Boschiroli ML. Infection with Mycobacterium microti in animals in France. J Clin Microbiol, 2015;53(3):981–985.
39. Moravkova M, Slany M, Trcka I, Havelkova M, Svobodova J, Skoric M, Heinigeova B, Pavlik I. Human–to-human and human-to-dog Mycobacterium tuberculosis transmission studied by IS6110 RFLP analysis: a case report. Vet Med-Czech, 2011;56(6):314–317.
40. Nguematcha R, Le NP. Detection of pathogenic mycobacteria in the environment of the medical units and of the slaughter-house of an African town (author’s transl). Med Trop (Mars), 1978;38(1):59–63.
41. Niemann S, Richter E, Dalügge-Tamm H, Schlesinger H, Graupner D, Königstein B, Gurath G, Greinert U, Rüsch-Gerdes S. Two cases of Mycobacterium microti – derived tuberculosis in HIV-negative immunocompetent patients. Emerg Inf Dis, 2000;6 : 539–542.
42. Nuru A, Mamo G, Zewude A, Mulat Y, Yitayew G, Admasu A, Medhin G, Pieper R, Ameni G. Preliminary investigation of the transmission of tuberculosis between farmers and their cattle in smallholder farms in northwestern Ethiopia: a cross-sectional study. BMC Res Notes, 2017 Jan 7;10(1):31.
43. Parmová I. osobní sdělení, Státní veterinární ústav, Praha, dosud nepublikováno, 2007.
44. Pavlik I, Ayele WY, Havelkova M, Svejnochova M, Katalinic-Jankovic V, Zolnir-Dovc M. Mycobacterium bovis in human population in four Central European countries during 1990–1999. Vet Med-Czech, 2003;48(4):90–98.
45. Pavlik I, Bartl J, Parmova I, Havelkova M, Kubin M, Bazant J. Occurrence of bovine tuberculosis in animals and humans in the Czech Republic in the years 1969 to 1996. Vet Med-Czech, 1998;43(7):221–231.
46. Pavlik I, Bures F, Janovsky P, Pecinka P, Bartos M, Dvorska L, Matlova L, Kremer K, Van Soolingen D. The last outbreak of bovine tuberculosis in cattle in the Czech Republic in 1995 was caused by Mycobacterium bovis subspecies caprae. Vet Med-Czech, 2002;47(9):251–263.
47. Pavlík I, Bureš F, Janovský P, Pečínka P, Fischer O, Bartoš M, Dvorská L, Kremer K, Van Soolingen, D. Poslední ohnisko bovinní tuberkulózy u skotu v České republice v roce 1995. Veterinářství, 2001;51(1):19–23.
48. Pavlik I, Dvorska L, Bartos M, Parmova I, Melicharek I, Jesenska A, Havelkova M, Slosarek M, Putova I, Martin G, Erler W, Kremer K, Van Soolingen D. Molecular epidemiology of bovine tuberculosis in the Czech Republic and Slovakia in the period 1965–2001 studied by spoligotyping. Vet Med-Czech, 2002;47(7):181–194.
49. Pavlik I, Trcka I, Parmova I, Svobodova J, Melicharek I, Nagy G, Cvetnic Z, Ocepek M, Pate M, Lipiec M. Detection of bovine and human tuberculosis in cattle and other animals in six Central European countries during the years 2000-2004. Vet Med-Czech, 2005;50(7):291–299.
50. Poptsova NV. Contamination with Mycobacterium tuberculosis of certain environmental objects within the foci of tuberculosis (rusky). Probl Tuberk, 1974;8 : 17–20.
51. Prodinger WM, Indra A, Koksalan OK, Kilicaslan Z, Richter E. Mycobacterium caprae infection in humans. Expert Rev Anti Infect Ther, 2014;12(12):1501–1513.
52. Prodinger WM, Brandstatter A, Naumann L, Pacciarini M, Kubica T, Boschiroli ML, Aranaz A, Nagy G, Cvetnic Z, Ocepek M, Skrypnyk A, Erler W, Niemann S, Pavlik I, Moser I. Characterization of Mycobacterium caprae isolates from Europe by mycobacterial interspersed repetitive units genotyping. J Clin Microbiol, 2005;43(10):4984–4992.
53. Reed GB. Genus Mycobacterium (species affecting warm-blooded animals except those causing leprosy). In: Breed RS, Murray EGD, Smith NR (eds). Bergey’s Manual of Determinative Bacteriology, Baltimore: The Williams & Wilkins Co; 1957. s. 703–704.
54. Rettinger A, Broeckl S, Fink M, Prodinger WM, Blum H, Krebs S, Domogalla J, Just F, Gellert S, Straubinger RK, Büttner M. The region of difference four is a robust genetic marker for subtyping Mycobacterium caprae isolates and is linked to spatial distribution of three subtypes. Transbound Emerg Dis, 2015;64(3):782–792.
55. Schiller I, Oesch B, Vordermeier HM, Palmer MV, Harris BN, Orloski KA, Buddle BM, Thacker TC, Lyashchenko KP, Waters WR. Bovine tuberculosis: a review of current and emerging diagnostic techniques in view of their relevance for disease control and eradication. Transbound Emerg Dis, 2010;57(4):205–220.
56. Schöning JM, Cerny N, Prohaska S, Wittenbrink MM, Smith NH, Bloemberg G, Pewsner M, Schiller I, Origgi FC, Ryser-Degiorgis MP. Surveillance of bovine tuberculosis and risk estimation of a future reservoir formation in wildlife in Switzerland and Liechtenstein. PLoS One, 2013;8(1):e54253.
57. Skoric M, Shitaye JE, Halouzka R, Fictum P, Trcka I, Heroldova M, Tkadlec E, Pavlik I. Tuberculous and tuberculoid lesions in free living small terrestrial mammals and the risk of infection to humans and animals: a review. Vet Med-Czech, 2007;52(4):144–161.
58. Skurski A, Szulga T, Wachnik Z, Madra J, Kowalczyk H. Classification of acid-fast bacilli isolated from the milk of cows and from sewage used for fertilizing pastures. I. Pathogenic and saprophytic bacilli. Arch Immunol Ther Exp (Warsz), 1965;13 : 189–196.
59. Smith N. The ‘Dassie’ bacillus. Tubercle, 1960; 41 : 203–212.
60. Sobiech T, Wachnik Z. Allergic and serologic studies of cattle from areas supplied with city sewage by means of the use of tuberculins from atypical mycobacteria (německy). Arch Exp Veterinarmed, 1966;20 : 901–908.
61. Supply P, Brosch R. The Biology and epidemiology of Mycobacterium canettii. Adv Exp Med Biol, 2017;1019 : 27–41.
62. Svobodová J. Případy tuberkulózy v ČR v letech 2009–2012 vyvolané neobvyklými druhy komplexu Mycobacterium tuberculosis. Zprávy Centra epidemiologie a mikrobiologie, 2013;22(1):12–14.
63. Szulga T, Wieczorek Z, Madra J, Kowalczyk H. Classification of acid-fast bacilli isolated from the milk of cows and from sewage used for fertilizing pastures. 3. Identification of atypical bacilli (2nd and 3rd groups). Arch Immunol Ther Exp (Warsz), 1965;13 : 336–343.
64. Tacquet A, Tison F, Devulder B. Bactericidal action of yoghurt on mycobacteria. Ann Inst Pasteur (Paris), 1961;100 : 581–587.
65. Thompson PJ, Cousins DV, Gow BL, Collins DM, Williamson BH, Dagnia HT. Seals, seal trainers, and mycobacterial infection. Am Rev Respir Dis, 1993;147 : 164–167.
66. Thorel MF, Karoui C, Varnerot A, Fleury C, Vincent V. Isolation of Mycobacterium bovis from baboons, leopards and a sea-lion. Vet Res, 1998;29 : 207–212.
67. Togo ACG, Kodio O, Diarra B, Sanogo M, Coulibaly G, Bane S, Diallo F, Somboro AM, Cisse AB, Baya B, Goita D, Diabate S, Kone B, Sarro YDS, Maiga M, Toloba Y, Belson M, Orsega S, Dao S, Murphy RL, Siddiqui S, Doumbia S, Diallo S. The most frequent Mycobacterium tuberculosis complex families in Mali (2006–2016) based on spoligotyping. Int J Mycobacteriol, 2017;6(4):379–386.
68. van Soolingen D, van der Zanden AGM, de Haas PEW, Noordhoek GT, Kiers A, Foudraine NA, Portaels F, Kolk AHJ, Kremer K, van Embden JDA. Diagnosis of Mycobacterium microti infections among humans by using novel genetic markers. J Clin Microbiol, 1998;36 : 1840–1845.
69. Villarreal-Ramos B, Berg S, Whelan A, Holbert S, Carreras F, Salguero FJ, Khatri BL, Malone K, Rue-Albrecht K, Shaughnessy R, Smyth A, Ameni G, Aseffa A, Sarradin P, Winter N, Vordermeier M, Gordon SV. Experimental infection of cattle with Mycobacterium tuberculosis isolates shows the attenuation of the human tubercle bacillus for cattle. Sci Rep, 2018;8(1):894.
70. Wells AQ, Oxon DM. Tuberculosis in wild voles. Lancet, 1937;229(5934):1221.
71. Yahyaoui-Azami H, Aboukhassib H, Bouslikhane M, Berrada J, Rami S, Reinhard M, Gagneux S, Feldmann J, Borrell S, Zinsstag J. Molecular characterization of bovine tuberculosis strains in two slaughterhouses in Morocco. BMC Vet Res, 2017;13(1):272.
72. Yeboah-Manu D, de Jong BC, Gehre F. The biology and epidemio-logy of Mycobacterium africanum. Adv Exp Med Biol, 2017;1019 : 117–133.
73. Zdravotnická statistika České republiky: Tuberkulóza a respirační nemoci. Praha: Ústav zdravotnických informací a statistiky; 2001–2017.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2018 Issue 4-
All articles in this issue
- Prionová onemocnění se zaměřením na Creutzfeldtovu-Jakobovu nemoc – přehled a výskyt nemoci za uplynulých 17 let (2000–2017) v České republice
- Vlastnosti kmenů Staphylococcus aureus u pracovníků potravinářských podniků
- Výskyt orální HPV infekce u zdravé populace – systematický přehled se zaměřením na evropskou populaci
- Epidemiologie vybraných zástupců komplexu Mycobacterium tuberculosis v České republice v letech 2000–2016
- Cerebrospinal Fluid Pleocytosis following Meningococcal B vaccination in an Infant
- Geografické názvy v mikrobiológii, mikroorganizmy pomenované podľa českých a slovenských mikrobiológov
- Antimikrobiální účinek nové hydrogelové matrice na bázi přírodního polysacharidu Sterculia urens
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prionová onemocnění se zaměřením na Creutzfeldtovu-Jakobovu nemoc – přehled a výskyt nemoci za uplynulých 17 let (2000–2017) v České republice
- Výskyt orální HPV infekce u zdravé populace – systematický přehled se zaměřením na evropskou populaci
- Vlastnosti kmenů Staphylococcus aureus u pracovníků potravinářských podniků
- Epidemiologie vybraných zástupců komplexu Mycobacterium tuberculosis v České republice v letech 2000–2016
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

