-
Medical journals
- Career
Úspěšná léčba rituximabem pro granulomatózně-lymfocytární intersticiální plicní nemoc provázející běžnou variabilní imunodeficienci
: P. Králíčková 1; Š. Kubcová 1; E. Kočová 2; V. Bartoš 3; O. Souček 1; P. Rozsíval 4; Hubert Vaníček 4; I. Krčmová 1; B. Ravčuková 5; H. Grombiříková 5; T. Freiberger 5,6
: Ústav klinické imunologie a alergologie, Fakultní nemocnice Hradec Králové a Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové 1; Radiologická klinika, Fakultní nemocnice Hradec Králové a Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové 2; Plicní klinika, Fakultní nemocnice Hradec Králové a Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové 3; Dětská klinika, Fakultní nemocnice Hradec Králové a Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové 4; Centrum kardiovaskulární a transplantační chirurgie Brno 5; Ústav klinické imunologie a alergologie, Fakultní nemocnice u sv. Anny a Masarykova univerzita v Brně 6
: Epidemiol. Mikrobiol. Imunol. 67, 2018, č. 3, s. 142-148
: Short Communication
Běžná variabilní imunodeficience je tvořena heterogenní skupinou onemocnění představující klinicky významnou protilátkovou imu-nodeficienci. Granulomatózní forma onemocnění s postižením plic ve formě granulomatózně-lymfocytární intersticiální plicní nemoci patří mezi závažné komplikace.
V článku prezentujeme případ mladé ženy se závažným postižením plic a splenomegalií provázenou pancytopenií. Léčba rituximabem v monoterapii v dávce 375 mg/m2/infuzi 4 týdny za sebou zopakovaná po 6 měsících vedla k významnému zlepšení nejen klinického stavu, ale i morfologického a funkčního nálezu plic, zmírnění pancytopenie, významné redukci hodnoty alkalické fosfatázy a vymizení granulomů ve slezině. Léčba byla dobře tolerována a nebyla provázena žádnými nežádoucími účinky.
Námi prezentovaný případ ukazuje na možnou efektivitu a bezpečnost podání rituximabu v monoterapii u pacientů s kompli-kovanou formou běžné variabilní imunodeficience.
KLÍČOVÁ SLOVA:
rituximab – protilátková imunodeficience – plicní nemoc – léčba
ÚVOD
Primární imunodeficience představují skupinu více než 300 geneticky dobře definovaných vrozených poruch imunitního systému. Dlouho byly pokládány za vzácná onemocnění. Recentní studie prokazují, že se jedná o jednotky významně častější. S rozvojem diagnostických možností počet klinických jednotek každoročně narůstá. Hlavními fenotypovými znaky jsou infekce, malignity, alergie, autoimunity a autoinflamatorní komplikace [1].
Běžná variabilní imunodeficience je tvořena heterogenní skupinou onemocnění představující klinicky významnou formu protilátkových imunodeficiencí. V klinickém obrazu dominují bakteriální infekce, zejména dolních cest dýchacích, a široké spektrum autoimunitních/dysregulačních komplikací. Granulomatózní forma onemocnění s postižením plic patří mezi nejzávažnější komplikace, které významným způsobem zvyšují morbiditu i mortalitu nemocných [2].
Genetická podstata onemocnění není ve většině případů známa. Díky stále se rozvíjejícím možnostem genetického testování, především možnosti celoexomového sekvenování, narůstá počet diagnostikovaných monogenních forem, i když jen pozvolna (zatím pouze 2–10 % případů CVID má jasnou monogenní příčinu) [3, 4]. Mutace (varianty) v některých genech jsou považovány za příčinné, v jiných genech za modifikující průběh onemocnění (např. TNFRSF13B – TACI). V manifestaci hrají roli i změny v dalších genech či faktory epigenetické. Některé mutace lze nalézt i u zcela zdravých rodinných příslušníků, nebo se postižení se stejným typem mutace mohou projevovat zcela odlišnými klinickými obrazy co do pestrosti i závažnosti onemocnění. Jako monogenní onemocnění jsou nyní vydělovány: ICOS, TNFRSF13C (BAFF-R), TNFSF12 (TWEAK), CD19, CD81, CR2 (CD21), MS4A1 (CD20), TNFRSF7 (CD27), IL21, IL21R, LRBA, CTLA4, PRKCD, PLCG2, NFKB1, NFKB2, PIK3CD, PIK3R1, VAV1, RAC2, BLK, IKZF1 (IKAROS) a IRF2BP2 [4].
KAZUISTIKA
Dvacetiletá pacientka sledovaná pro běžnou variabilní imunodeficienci (CVID) byla po dovršení plnoletosti převzata do péče naší kliniky. V rodině pacientky se vyskytovalo bronchiální astma. U žádného blízkého příbuzného nebyla zaznamenána významně zvýšená nemocnost. Nejednalo se o dítě z příbuzenského sňatku.
Pacientka narozená z druhé fyziologické gravidity nebyla do 3 let věku nadměrně nemocná. Poté došlo k nárůstu respiračních infekcí a byla doporučena do péče spádového alergologa. Alergologickým vyšetřením byla v kožních testech zjištěna pozitivita na srst psa, kočky a peří a současně stanovena diagnóza bronchiálního astmatu. Následná léčba vedla ke stabilizaci stavu. V 7 letech však došlo ke zhoršení dýchacích obtíží vyžadujících znovunasazení inhalační léčby kortikoidy a od 11 let k dalšímu nárůstu nemocnosti. Pro četné otitidy byla provedena adenotomie. Ve 12 letech prodělala první ataku pneumonie.
V rámci dalšího vyšetřovacího procesu spádovým alergologem byla při spirometrii zjištěna středně těžká obstrukční ventilační porucha a na skiagramu plic byla přítomna vícečetná zastínění plicního parenchymu, zejména v dolních plicních polích bilaterálně, bazálně intersticiální linie. V krevních odběrech byla nově zjištěna hypogamaglobulinémie a dívka byla předána do péče dětské kliniky. Vysokorozlišovací počítačová tomografie (high resolution computed tomography HRCT) plic prokázala mnohočetné denzity mléčného skla splývající do rozsáhlých konzolidací s maximem bazálně a ventrálně se splývající bilaterální hilovou a mediastinální lymfadenopatií (obr. 1).
1. HRCT plic, transverzální sken, plicní okno: bilaterálně denzity mléčného skla a konsolidace s maximem peribronchiálně, spíše ventrálně
Figure 1. HRCT of the lungs, transverse scan, lung window: bilateral ground glass opacifications and consolidations most pronounced in the peribronchial areas, predominantly in the ventral areas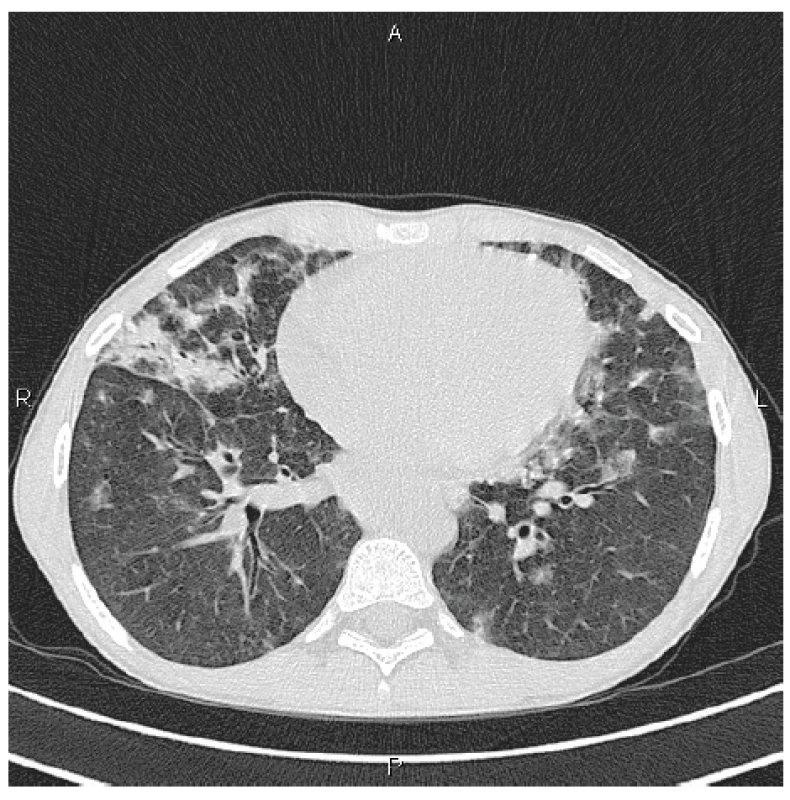
Na základě snížených koncentrací sérových imunoglobulinů (Ig) IgG 3,6 g/l (referenční rozmezí 8,4–22,4 g/l), IgA 0,13 g/l (0,56–3,08) a IgM 0,35 g/l (0,43–3,27) s nízkou, neprotektivní hladinou postvakcinačních protilátek proti tetanickému toxoidu 0,08 IU/ml (méně než 0,1 IU/ml nutné přeočkování 3 dávkami) a proti pneumokokovému kapsulárnímu antigenu 2,52 mg/l (20–200) byla stanovena diagnóza těžké protilátkové imunodeficience. Současně byly vyloučeny možné sekundární příčiny hypogamaglobulinémie. Indikovaná substituční léčba imunoglobuliny byla zahájena až o 9 měsíců později pro opakovaný nesouhlas rodičů. Další došetření plicního nálezu a případnou imunosupresivní léčbu rodina odmítla.
Pro progresi plicního nálezu a lymfadenopatie podstoupila nemocná v 15 letech otevřenou plicní biopsii. Podle hodnocení patologa svědčil nález spíše pro protrahovanou intersticiální pneumonii infekční, nejspíše virové etiologie. Zvažovaná diagnóza granulomatózně-lymfocytární intersticiální plicní nemoci (GLILD) při CVID nebyla jednoznačně potvrzena. Endobronchiální nález při bronchoskopii byl normální, vyjma zahlenění. V bronchoalveolární laváži (BAL) bylo průtokovou cytometrií zjištěno zvýšené zastoupení lymfocytů (62,4 %) s převahou CD4+ buněk (85 %), neprokázána klonalita lymfocytů. V endobronchiální biopsii byly přítomny četnější hlenotvorné buňky, bez patrných granulomů. Následná transbronchiální biopsie byla nevýtěžná. Virová infekce nebyla prokázána. Za 11 měsíců byla při vyšetření PET/CT (fluorodeoxyglukózová pozitronová tomografie s výpočetní tomografií) zjištěna progrese lymfadenopatie a plicních konsolidací. Diferenciálně diagnosticky byla opět zvažována možnost chronických neinfekčních plicních postižení typu GLILD, sarkoidózy, lymfocytární intersticiální pneumonitidy či lymfomatoidní granulomatózy. Pro zvažovanou diagnózu sarkoidózy bylo doplněno oftalmologické a neurologické vyšetření, včetně magnetické rezonance (MRI) mozku s normálním nálezem. Autoimunní lymfoproliferativní syndrom byl hematologem vyloučen. Doporučení kortikoidní terapie opět rodina odmítla s tím, že je dívka zcela klinicky asymptomatická (bez dušnosti či kašle).
V 16 letech prodělala druhou ataku pneumonie s nutností hospitalizace, kdy bylo zjištěno další zhoršení plicních funkcí, nově hepatosplenomegalie a v krevním obraze se objevila bicytopenie – leukocyty 2,62 x 109/l (3,9–9,4), trombocyty 119 x 109/l (154–386). Dívce byla doporučena kontrolní otevřená plicní biopsie, která byla rodinou opět odmítnuta. Bylo proto provedeno kontrolní bronchoskopické vyšetření, kde byla prokázána opět retence hlenů v bronších, v bronchoalveolární laváži trvající lymfocytární alveolitida a nově v odebraných vzorcích bronchiálních sliznic prokázán granulomatózní zánět. Též byla provedena exstirpace tříselných uzlin, ve kterých byla zjištěna granulomatózní reakce, bez nekrotizace granulomů, bez záchytu malignity. Provedena byla též speciální barvení na infekce z histologických vzorků (bakteriální, mykobakteriální, mykotických hyf a virových inkluzí – CMV, SV40, EBV) s negativním výsledkem.
V 18 letech, kdy se poprvé objevila námahová dušnost, dívka konečně souhlasila se zahájením imunosupresivní terapie prednisonem v dávce 30 mg/den po dobu 6 měsíců se subjektivním zlepšením. Zároveň došlo k mírné regresi hepatosplenomegalie (pravý lalok jaterní v medioklavikulární čáře podle ultrazvuku UZ ze 17 cm na 15 cm, slezina z 20 cm na 19 cm, s vymizením popisovaných granulomů) a k signifikantnímu zlepšení plicních funkcí (FVC 38 % náležitých hodnot n. h. před léčbou vs. 56 % n. h. po léčbě, FEV1 35 % n. h. vs. 48 % n. h., TLco 27 % n. h. vs. 43 % n. h.).
Ve 20 letech, v době převzetí do naší péče, v krevním obrazu dominovala leukopenie 2,55 x 109/l (referenční rozmezí 4,0 až 10,0 x 109/l), trombocytopenie 62 x 109/l (150,0–400,0 x 109/l), elevace jaterních enzymů ALP 3,62 μkat/l (0,58–1,75), AST 0,76 μkat/l (0,17 – 0,6) a GMT 1,21 μkat/l (0–0,67). Vyšetření buněčných subpopulací prokázalo zvýšení procentuálního zastoupení CD4+ T lymfocytů 86,2 % (35–50), snížení CD8+ T lymfocytů 5,4 % (19–39), snížení CD19+ B lymfocytů 3,9 % (5-15), CD3-CD16+CD56+ buněk 3,1 % (5–23) a dále snížení izotopově-přesmyknutých paměťových B lymfocytů CD19+IgD-IgM-CD27+ 1,6 % (6,5–29,5) se zvýšeným podílem CD19+CD38+CDCD21low B lymfocytů 12,4 % (1,1–6,9). Při intravenózní substituci imunoglobuliny v dávce 450 mg/kg/měsíc byly zjištěny předinfuzní sérové koncentrace imunoglobulinů IgG 6,5 g/l (7,3–19,5), IgA 0,07 g/l (0,8–4,8 g/l) a IgM 0,19 g/l (0,4–3). Podle kompletního funkčního vyšetření plic byla prokázána kombinovaná ventilační porucha s převahou restrikce a s těžkým omezením plicní difuze pro CO (FEV1 46 % n. h., VC 52 % n. h., TLC 68 % n. h. a TLco 38 % n. h.). Na HRCT plic byla popsána stacionární splývající lymfadenopatie v mediastinu a plicních hilech, stacionární axilární lymfadenopatie, avšak progrese bilaterálních mnohočetných konsolidací plicního parenchymu, které se nově objevily i v horních lalocích (obr. 2). Podle doplněného UZ vyšetření břicha byla zjištěna splenomegalie 20 cm, slezina s mnohočetnými hypoechogenními uzlíky, zmnožené mezenteriální uzliny – v krátké ose velikosti do 8 mm, oboustranně uzliny v tříslech v krátké ose do 12 mm, mnohočetné uzliny submandibulárně do 16 mm v krátké ose. Kromě substituční léčby imunoglobuliny užívala v trvalé medikaci sulfamethoxazol/trimethoprim 800/160 mg 1krát denně, salmeterol/fluticason 50/250 µg 2krát denně a salbutamol v případě dušnosti. Vzhledem ke klinickým projevům, laboratorním a histologickým nálezům a výsledkům provedených zobrazovacích vyšetření byla verifikována diagnóza CVID komplikovaná granulomatózně-lymfocytární intersticiální plicní nemocí s generalizovanou lymfadenopatií a hepatosplenomegalií s projevy hypersplenismu.
2. HRCT plic, transverzální sken, plicní okno: nově v horních plicních lalocích bilaterálně chomáčkovité denzity mléčného skla až konsolidací
Figure 2. HRCT of the lungs, transverse scan, lung window: bilateral fluffy ground glass opacities to consolidations newly visible in the upper lung lobes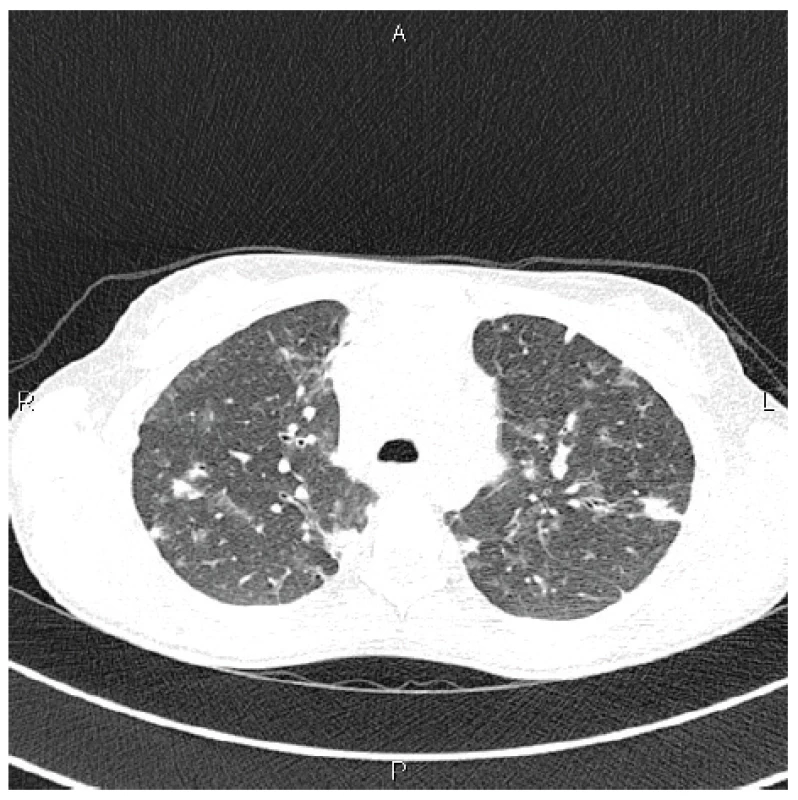
V té době plnoletá dívka se rozhodla začít plně spolupracovat. Znovuzahájená léčba prednisonem v dávce 0,5 mg/kg/den však nevedla k pozitivnímu efektu na plicní funkce. Navíc se objevovaly stále častější epizody úporného suchého dráždivého kašle a došlo k rozvoji nechutenství s hmotnostním úbytkem 5 kg za 6 měsíců, progresi únavy, laboratorně k vzestupu ALP na hodnotu 6,68 μkat/l. Progresi plicního nálezu zobrazuje obrázek 3.
3. HRCT plic, transverzální sken, plicní okno: nově v horních plicních lalocích bilaterálně chomáčkovité denzity mléčného skla až konsolidací
Figure 2. HRCT of the lungs, transverse scan, lung window: bilateral fluffy ground glass opacities to consolidations newly visible in the upper lung lobes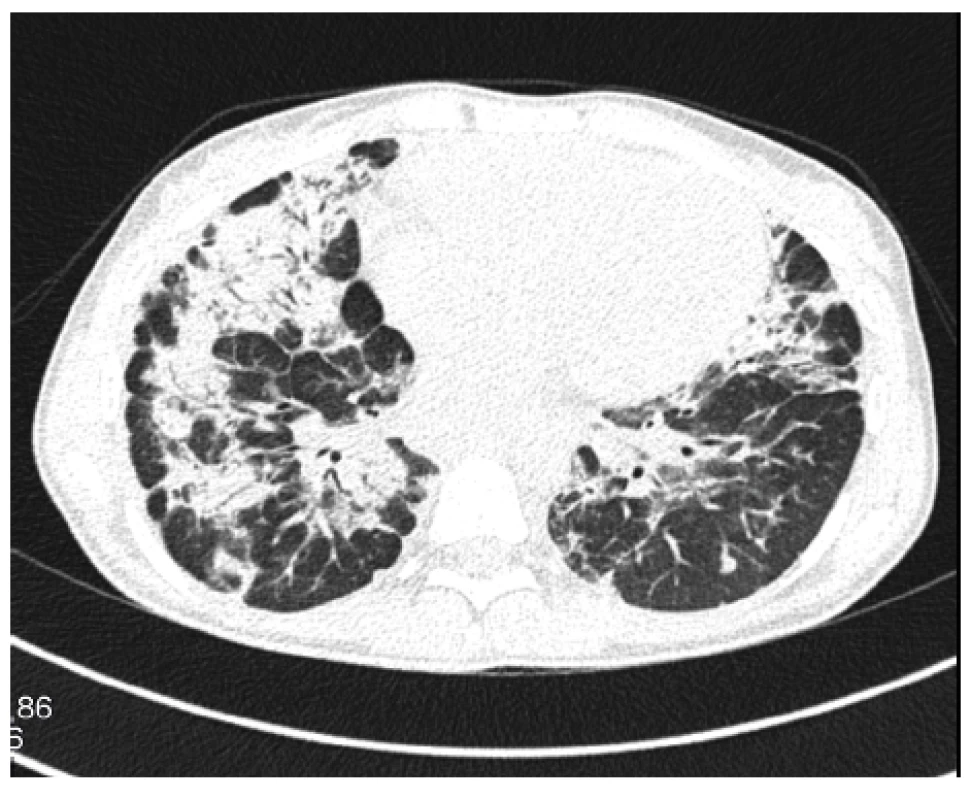
Na základě zvážení všech možností bylo rozhodnuto o podání biologické léčby. Po schválení revizním lékařem byla zahájena imunosupresivní léčba rituximabem (RTX) v dávce 375 mg/m2, celkem 4krát v týdenních intervalech, pro přítomnou hepatopatii pouze v monoterapii, s vizí tento cyklus v průběhu kalendářního roku 3krát zopakovat. První cyklus tolerovala nemocná bez obtíží, nedošlo k navýšení frekvence infekcí. Po přechodném zhoršení kašle v následujících čtyřech týdnech docházelo postupně ke zlepšování celkového klinického stavu. Pacientka přestala kašlat, postupně se vrátila k původní hmotnosti. Míru dušnosti bylo obtížené hodnotit, protože ji dívka nikdy neakcentovala. I když parametry celkového funkčního vyšetření plic zůstaly beze změny, na kontrolním HRCT plic byla patrna mírná regrese plicních konsolidací a regrese velikosti uzlin v obou axilách. V krevním obraze došlo k částečné úpravě počtu leukocytů (3,01 x 109/l) a trombocytů (127 x 109/l), hodnota ALP poklesla na 2,8 μkat/l. Při pravidelné substituční léčbě Ig byla i nadále předinfuzní koncentrace sérového IgG v normě (9,5 g/l). Infekcemi netrpěla ve vyšší míře. Po 6 měsících byla kúra zopakována s dalším radiologickým a mírným funkčním zlepšením. (Radiografické změny před zahájením biologické léčby a jejich následný vývoj ukazují obrázky 3, 4 a 5.) Pro sníženou sílu dýchacích svalů byla zahájena intenzivní rehabilitace. Následně provedená spiroergometrie potvrdila pouze lehkou limitaci aerobní pracovní kapacity (80 % náležitých hodnot), v maximu nižší ventilace byla kompenzována vyšším využitím kyslíku. Léčebně byl proveden pokus o nasazení azathioprinu, který pro rozvoj polékové leukopenie nebyl úspěšný.
4. HRCT plic, transverzální sken, plicní okno – kontrolní vyšetření (6 měsíců po 1. cyklu rituximabu): jasně patrná regrese bilaterálních mnohočetných konsolidací
Figure 4. HRCT of the lungs, transverse scan, lung window: control examination (6 months after 1st cycle of rituximab): clearly evident regression of bilateral multiple consolidation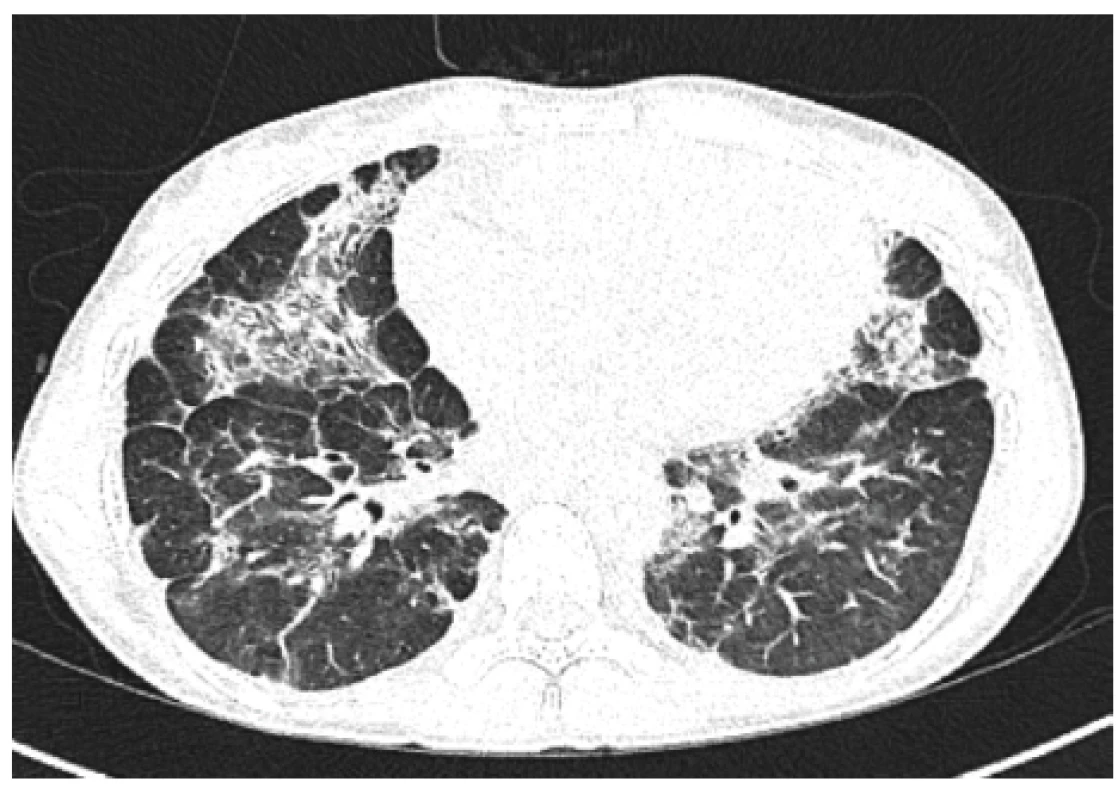
5. HRCT plic, transverzální sken, plicní okno – kontrolní vyšetření (6 měsíců po 2. cyklu): další regrese konsolidací, dnes spíše cárovité změny bilaterálně, denzity mléčného skla, bez výraznějších plicních konsolidací
Figure 5. HRCT of the lungs, transverse scan, lung window: control examination (6 months after 2nd cycle): further consolidation regression, nowadays rather cvaric changes bilaterally, density of milk glass, no more significant pulmonary consolidation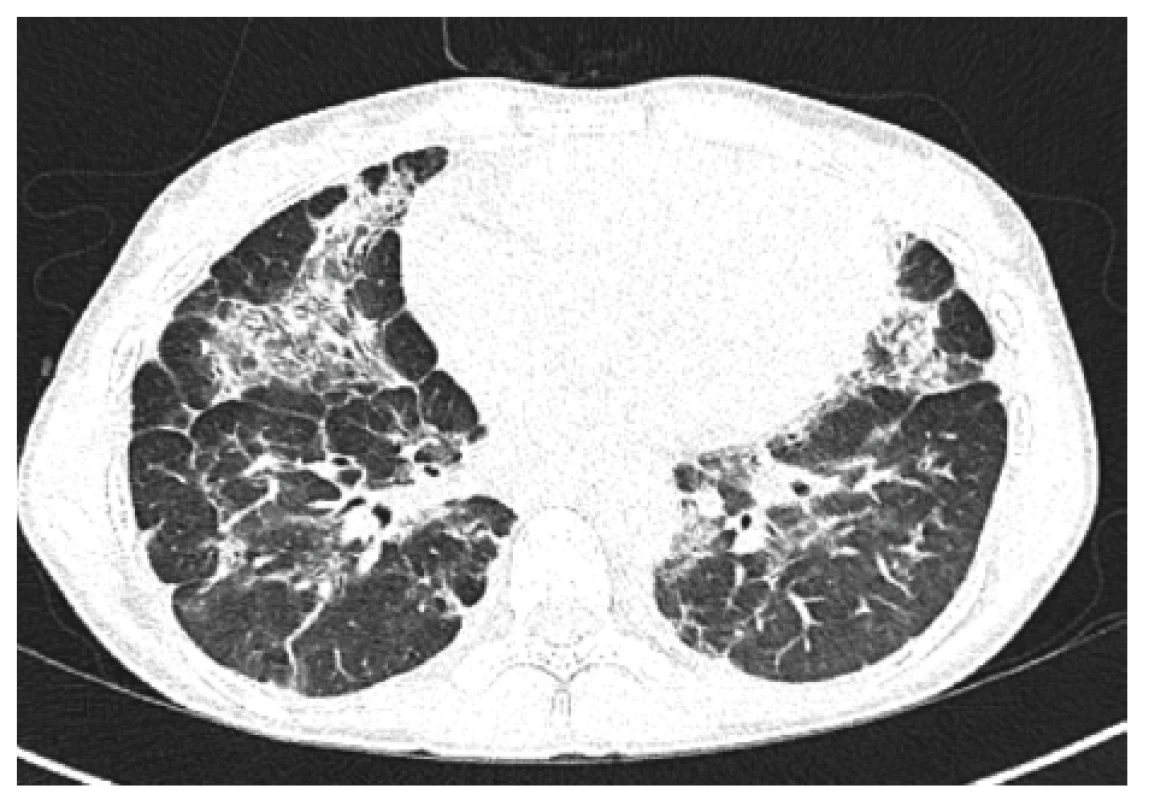
Pro závažnost komplikací bylo uskutečněno genetické vyšetření. Cílená analýza genů pro TACI, CTLA4 a katalytickou podjednotku delta (p100δ) PI3kinázy, ani následně provedené celoexomové sekvenování nepřinesly zatím objasnění genetické podstaty onemocnění.
V současné době, rok po druhém cyklu léčby, se pacientce daří dobře. Dívka nevnímá omezení v běžném životě, studuje vysokou školu. Kortikoterapie byla vysazena. Nicméně podle dalších vyšetření dochází k mírné progresi některých sledovaných parametrů, proto výhledově uvažujeme o zopakování daného léčebného režimu, eventuál-ně s pokusem kombinace s mykofenolátem mofetilem.
DISKUSE
Postižení plic u nemocných s CVID lze rozdělit na dvě základní skupiny: infekční a neinfekční či lépe dysregulační. Mezi infekční komplikace lze počítat bronchitidy a pneumonie. Nejčastějšími původci jsou Streptococcus pneumoniae a Haemophilus influenzae [5, 6]. Závažné virové a oportunní infekce byly sice popsány, ale nejsou typické. Vyskytují se zejména u nemocných podstupujících dlouhodobou imunosupresivní léčbu či se závažnějším morfologickým plicním postižením [6, 7]. Při řádně vedené substituční léčbě imunoglobuliny dochází k významnému poklesu výskytu bakteriálních infekcí. V případě nedostatečného efektu substituční léčby je na místě zvážit dlouhodobou antibiotickou profylaxi [8].
Neinfekční/dysregulační změny představují závažnou komplikaci, která vyžaduje dlouhodobou imunosupresivní léčbu se všemi důsledky. Přesný patofyziologický mechanismus vedoucí k jejich rozvoji nebyl doposud jednoznačně objasněn. Četnější výskyt byl popsán u nemocných s významným snížením izotypově přesmyknutých paměťových B lymfocytů [9, 10] a expanzí CD21low B lymfocytů [11] v periferní krvi, což je v souladu s nálezy naší nemocné. Dysregulační změny bývají provázeny zvýšením počtu paměťových CD4 T lymfocytů s Th1 fenotypem a folikulárních pomocných T lymfocytů (TFH) v periferní krvi [12, 13]. Stejně tak byl popsán vztah ke zvýšeným koncentracím IFN-γ [14, 15].V tomto kontextu byly jako možné zdroje produkce IFN-γ identifikovány periferní paměťové CD4 T lymfocyty, TFH, či některé typy ILC (innate lymphoid cells) [12, 15, 16]. Zvýšené koncentrace IFN-γ byly spojeny s akumulací B lymfocytů exprimujících T-bet transkripční faktor v uzlinách a CD21low B lymfocytů v periferní krvi [12].
Závažnou formu komplikací představuje granulomatózní/lymfocytární intersticiální plicní nemoc. Incidence je udávána různě, nejčastěji kolem 10 % [2, 6, 17, 18]. Radiograficky jsou typické difuzní retikulární změny, často typu denzit mléčného skla (groung-glass opacities) s predominancí v dolních plicních lalocích. Histologicky se jedná o nekaseifikující granulomy, lymfocytární intersticiální pneumonitidu a folikulární bronchiolitidu. Lymfocytární hyperplazie vykazuje predominanci T-lymfocytů, poměr CD4+ a CD8+ T-lymfocytů různé studie udávají variabilně [17, 19, 20]. Granulomy se četně vyskytují i extrapulmonálně (játra, slezina, uzliny, kůže, CNS). Pacienti frekventně trpí splenomegalií a lymfadenopatií [2]. Klinicky bývají přidruženy další autoimunitní komplikace, zejména autoimunitní cytopenie. Laboratorně, především u nemocných se splenomegalií a postižením jater ve formě nodulární regenerativní hyperplazie dominuje elevace alkalické fosfatázy s relativně fyziologickými či jen lehce zvýšenými hodnotami ALT a AST. V pokročilejších stadiích se můžeme setkat se známkami hypersplenismu a rozvojem portální hypertenze [21]. Vyšší pravděpodobnost progrese GLILD mají nemocní s vyšší sérovou koncentrací IgM a trombocytopenií [22].
U naší nemocné se výše popsané komplikace objevily, pouze při histologickém vyšetření nebyl v úvodních fázích obraz typický, další biopsie z periferní uzliny a kontrolní endobronchiální biopsie již byly kompatibilní s GLILD. Podle britského doporučení má bioptické vyšetření sloužit zejména k vyloučení infekce a klonální expanze, což bylo naplněno [23]. Byla taktéž přítomna trombocytopenie a zajímavostí je, že z hlediska časové osy sérové koncentrace IgM klesaly nejpomaleji.
V diferenciální diagnostice obdobných případů je dále nutné vyloučit sarkoidózu. Rozhodující je hladina sérových imunoglobulinů, i když bylo popsáno, že obraz GLILD může předcházet řadu let rozvoji CVID. Francouzská studie u nemocných s GLILD zjistila vyšší počet poslechových nálezů ve formě krepitací (47 % vs. 1,7 %) a častější přítomnost bronchiektazií (65 % vs. 23 %), zásadní ovšem bylo zjištění zvýšené mortality (30 % vs. 0 %) po 4 letech [19]. Na HRCT plic je diferenciální diagnostika sarkoidózy a GLILD založena na rozdílné distribuci dominantních morf – u GLILD převažuje postižení v podobě konsolidací, denzit mléčného skla a nodulů peribronchiálně zejména v dolních lalocích [24]. Naproti tomu u sarkoidózy je dominantní nodulární postižení v perilymfatické distribuci zejména v horních lalocích a perihilózně. U obou onemocnění je typická mediastinální lymfadenopatie, která je u sarkoidózy typicky symetrická [25].
Obecně lze říci, že u více než 90 % nemocných s CVID je nález na HRCT netypický [26, 27]. Většinou se jedná o nezávažný nález a může být přítomen i u zcela asymptomatických jedinců [28]. Postupné zhoršování morfologického nálezu můžeme zaznamenat i přes řádně vedenou substituční léčbu [29].
Typickým nálezem jsou bronchiektazie, které jsou popisovány variabilně ve 30–65 % [27, 30]. Nejčastěji jsou přítomné ve středním laloku, následované dolními laloky a lingulou. Při vyšetření se dále zaměřujeme na přítomnost nodulací (do velikosti 5 mm bývají difuzně v parenchymu, uzlíky větších rozměrů pak centrálně), zesílení stěny bronchů, morf tree-in-bud, tvorbu hlenových zátek, přítomnost atelektázy, konsolidací plicní tkáně, eventuálně exspirační air-trapping [26, 27, 29, 31]. Pro GLILD jsou však typické difuzní retikulární změny, často typu denzit mléčného skla [32]. K posouzení aktivity onemocnění i efektivity léčby je možné využít kromě funkčního vyšetření plic i PET/CT [33].
Pro snížení radiační zátěže je možné ve sledování využít i plicní magnetickou rezonanci, doposud však chybí širší klinické zkušenosti. Zdá se, že by mohla být využitelná spíše ve sledování aktivity onemocnění [34, 35].
Při funkčním vyšetření plic u nemocných s CVID byla popsána patologie ve formě ventilační obstrukční poruchy ve 40 %, restrikční poruchy v 34 % a snížení plicní difuze v 21 % [26]. K poklesu FEV1 dochází jednoznačně rychleji, než je tomu u zdravé populace [36]. Nicméně diagnózu astmatu splňuje jen 14 % pacientů, častěji u nemocných s prokázaným alergickým terénem předcházejícím rozvoji imunodeficitu [37]. Pro GLILD je typická restrikční ventilační porucha se snížením difuze [32].
Doposud nepanuje jednotný konsenzus s ohledem na rozsah a frekvenci screeningových vyšetření u nemocných s CVID [38]. Mezi pravidelně doporučované metody k odhalení poškození plic jsou zařazeny jak HRCT plic, tak i celkové funkční vyšetření včetně difuze. Jejich frekvence je otázkou diskuse a zvyklostí jednotlivých pracovišť. V našem ústavu se u dospělých pacientů kloníme ke vstupnímu vyšetření HRCT plic a celkovému funkčnímu vyšetření včetně difuze, které opakujeme v ročních intervalech. Ke kontrolnímu HRCT přistupujeme individuálně podle nálezu, vždy však při zjištění či progresi ventilační poruchy.
Kauzální léčba GLILD zatím neexistuje. Progrese onemocnění je velmi individuální. Neexistují jednotná doporučení, kdy léčbu zahájit a jakým způsobem ji dále vést. Rizika z nadměrné kumulace imunosupresivní léčby v čase, především ve formě oportunních infekcí, nelze opomíjet [7]. Nejucelenější pohled na diagnostiku a management předkládá britský konsenzus z roku 2017, který doporučuje léčbu zahájit bez ohledu na přítomnost symptomů při prokázaných poklesech funkčních parametrů. V první linii mají být použity kortikoidy v monoterapii. Pro sekundární léčbu byly doporučeny ať již s či bez p. o. kortikoidů: azathioprin, RTX, mykofenolát mofetil. Ke shodě expertů nedošlo v případě abataceptu (kromě případů s jasně prokázanou genetickou mutací), anti-TNF léčby, cyklosporinu, hydroxychlorochinu, metotrexátu, sirolimu či takrolimu [23].
RTX představuje chimérickou myší monoklonální protilátku anti CD20. Molekula CD20 je fyziologicky exprimována na B lymfocytech od stadia pre-B lymfocytu až do fáze plazmablastu. Možný mechanismus účinku této protilátky u nemocných s poruchami tvorby protilátek vychází ze skutečnosti, že obecně způsobuje nejen depleci buněk potenciálně produkujících autoprotilátky (u nemocných s CVID díky podstatě onemocnění nejsou obvykle přítomny), ale zasahuje také do regulací zánětlivých dějů. Na myších modelech revmatoidní artritidy bylo prokázáno, že odstranění B lymfocytů vede ke vzestupu počtu T regulačních lymfocytů (diferencovaných z naivních CD4 T lymfocytů) s následným utlumením aktivity onemocnění. Důležitou úlohu může hrát i eliminace subsetu B lymfocytů produkujících IFN-γ, neboť geneticky upravené myší modely bez schopnosti produkce IFN-γ B lymfocyty nebyly schopné rozvinout proteoglykanem indukovanou revmatoidní artritidu [39]. Podání RTX vedlo u nemocných s revmatoidní artritidou k poklesu CD4 T lymfocytů [40] a u nemocných léčených pro Sjögrenův syndrom byla léčbou normalizována expanze TFH buněk [41]. Jiným mechanismem tlumení autoimunitního zánětu může být i snížení B lymfocytů produkujících IL-6 [42]. Jeho význam však nebyl v podskupině nemocných s dysregulačními komplikacemi v rámci CVID dostatečně objasněn [43].
Dobrou efektivitu RTX u nemocných s CVID podporují i klinické práce [33, 44, 45]. Nejrozsáhlejší publikací je práce Nicole Chase a kolektivu z roku 2013, která popisuje celkem 7 pacientů. Ti obdrželi intravenózně RTX v dávce 375 mg/m2/infuzi 4 týdny za sebou v kombinaci s azathioprinem 1–2 mg/kg/den po dobu 18 měsíců. Infuze RTX byly opakovány po 4–6 měsících, celkem 3–4 krát. Pro intoleranci azathioprinu pro zažívací obtíže dostávali 2 nemocní 6-merkaptopurin (aktivní metabolit azathioprinu) a jeden mykofenolát mofetil 1 g 2krát denně. Ve všech případech došlo ke zlepšení HRCT obrazu i funkčních parametrů plic a u 3/7 pacientů ke zmenšení splenomegalie [44]. V popisovaném případu nastalo jednoznačné rentgenologické a laboratorní zlepšení (zmírnění pancytopenie a snížení hodnoty alkalické fosfatázy) a dále signifikantní zlepšení ventilačních parametrů (FVC i FEV1) a nesignifikantní zlepšení plicní difuze (tab. 1). Podstatné pro nemocnou bylo vymizení úporného dráždivého kašle a zastavení hmotnostního úbytku. Stupeň únavy hodnotila jako s mírným zlepšením. Před léčbou netrpěla dušností. Nedošlo sice ke zmenšení velikosti sleziny, ale vymizely popisované granulomy v jejím parenchymu. Léčba byla nemocnou dobře tolerována, nevyskytly se žádné nežádoucí účinky, infekční komplikace nebyly navýšeny. Efekt léčby nyní přetrvává více než rok od druhého podání.
1. Porovnání vybraných laboratorních parametrů a funkčních charakteristik před léčbou, v jejím průběhu a po ukončení
Table 1. Comparison of selected laboratory parameters and functional characteristics pre-, peri-, and post-treatment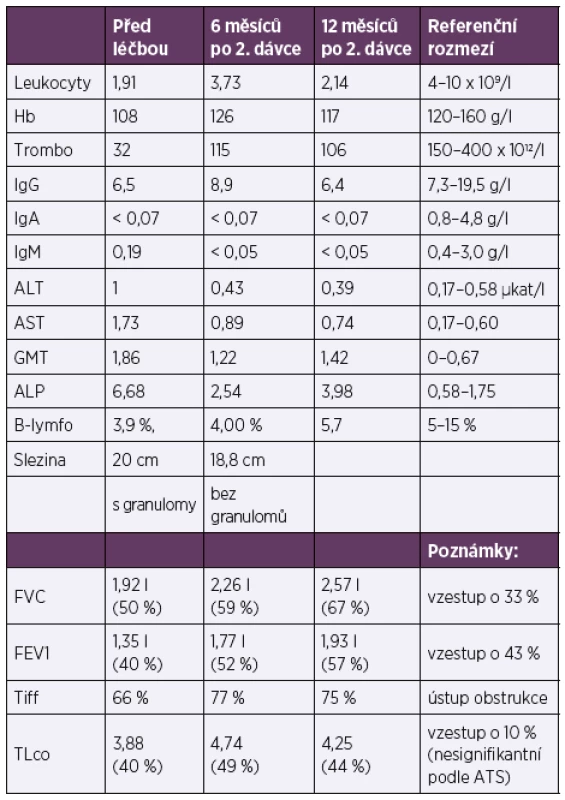
Pozn. Podle hodnocení ATS/ERS je hodnocena jako signifikantní změna FVC nad 10 % absolutních hodnot a nad 15 % absolutních hodnot v případě difuze.
Note: Based on the ATS/ERS consensus, an absolute decline in FVC of 10 % or more or of 15 % or more in case of diffusion is regarded as a significant change.)ZÁVĚR
Námi prezentovaný případ ukazuje na možnost efektivity, tolerance a bezpečnosti podání rituximabu v monoterapii u nemocných s CVID provázeného mnohočetnými komplikacemi.
Do redakce došlo dne 18. 4. 2018.
Adresa pro korespondenci:
MUDr. Pavlína Králíčková, Ph.D.
Ústav klinické imunologie a alergologie FN
Sokolská 581
500 05 Hradec Králové
Sources
1. Picard C, Gaspar B, Al-Herz W, et al. International Union of Immunological Societies: 2017 Primary Immunodeficiency Diseases Committee Report on Inborn Errors of Immunity. J Clin Immunol, 2018;38(1):96–128.
2. Resnick ES, Moshier EL, Godbold JH, Cunningham-Rundles C. Morbidity and mortality in common variable immune deficiency over 4 decades. Blood, 2012;119(7):1650–1657.
3. Maffucci P, Filion CA, Boisson B, et al. Genetic Diagnosis Using Whole Exome Sequencing in Common Variable Immunodeficiency. Front Immunol, 2016;7 : 220.
4. Bogaert DJA, Dullaers M, Lambrecht BN, et al. Genes associated with common variable immunodeficiency: one diagnosis to rule them all? J Med Genet, 2016;53(9):575–590.
5. Kainulainen L, Nikoskelainen J, Vuorinen T, et al. Viruses and bacteria in bronchial samples from patients with primary hypogammaglobulinemia. Am J Respir Crit Care Med, 1999;159(4):1199–1204.
6. Oksenhendler E, Gérard L, Fieschi C, et al. Infections in 252 patients with common variable immunodeficiency. Clin Infect Dis, 2008;46(10):1547–1554.
7. Kralickova P, Mala E, Vokurkova D, et al. Cytomegalovirus disease in patients with common variable immunodeficiency: three case reports. Int Arch Allergy Immunol, 2014; 163(1):69–74.
8. Jolles S, Chapel H, Litzman J. When to initiate immunoglobulin replacement therapy (IGRT) in antibody deficiency: a practical approach. Clin Exp Immunol, 2017;188(3):333–341.
9. Wehr C, Kivioja T, Schmitt C, et al. The EUROclass trial: defining subgroups in common variable immunodeficiency. Blood, 2008;111(1):77–85.
10. Sánchez-Ramón S, Radigan L, Yu JE, et al. Memory B cells in common variable immunodeficiency: clinical associations and sex differences. Clin Immunol Orlando Fla, 2008;128(3):314–321.
11. Warnatz K, Wehr C, Dräger R, et al. Expansion of CD19(hi)CD21(lo/neg) B cells in common variable immunodeficiency (CVID) patients with autoimmune cytopenia. Immunobiology, 2002;206(5):502–13.
12. Unger S, Seidl M, van Schouwenburg P, et al. The TH1 phenotype of follicular helper T cells indicates an IFN-γ-associated immune dysregulation in patients with CD21low common variable immunodeficiency. J Allergy Clin Immunol, 2018;141(2):730–740.
13. Coraglia A, Galassi N, Fernández Romero DS, et al. Common Variable Immunodeficiency and Circulating TFH. J Immunol Res, 2016;2016 : 4951587.
14. Park J, Munagala I, Xu H, et al. Interferon signature in the blood in inflammatory common variable immune deficiency. PloS One, 2013;8(9):e74893.
15. Cols M, Rahman A, Maglione PJ, et al. Expansion of inflammatory innate lymphoid cells in patients with common variable immune deficiency. J Allergy Clin Immunol, 2016;137(4):1206–1215.
16. Myles A, Gearhart PJ, Cancro MP. Signals that drive T-bet expression in B cells. Cell Immunol, 2017;321 : 3–7.
17. Boursiquot JN, Gérard L, Malphettes M, et al. Granulomatous disease in CVID: retrospective analysis of clinical characteristics and treatment efficacy in a cohort of 59 patients. J Clin Immunol, 2013;33(1):84–95.
18. Gathmann B, Mahlaoui N, CEREDIH, et al. Clinical picture and treatment of 2212 patients with common variable immunodeficiency. J Allergy Clin Immunol, 2014;134(1):116–126.
19. Bouvry D, Mouthon L, Brillet PY, et al. Granulomatosis-associated common variable immunodeficiency disorder: a case-control study versus sarcoidosis. Eur Respir J, 2013;41(1):115–122.
20. Kollert F, Venhoff N, Goldacker S, et al. Bronchoalveolar lavage cytology resembles sarcoidosis in a subgroup of granulomatous CVID. Eur Respir J, 2014;43(3):922–924.
21. Verbsky JW, Routes JM. Sarcoidosis and common variable immunodeficiency: similarities and differences. Semin Respir Crit Care Med, 2014;35(3):330–335.
22. Maglione PJ, Overbey JR, Cunningham-Rundles C. Progression of Common Variable Immunodeficiency Interstitial Lung Disease Accompanies Distinct Pulmonary and Laboratory Findings. J Allergy Clin Immunol Pract, 2015;3(6):941–950.
23. Hurst JR, Verma N, Lowe D, et al. British Lung Foundation/United Kingdom Primary Immunodeficiency Network Consensus Statement on the Definition, Diagnosis, and Management of Granulomatous-Lymphocytic Interstitial Lung Disease in Common Variable Immunodeficiency Disorders. J Allergy Clin Immunol Pract, 2017;5(4):938–945.
24. Mannina A, Chung JH, Swigris JJ, et al. Clinical Predictors of a Diagnosis of Common Variable Immunodeficiency-related Granulomatous-Lymphocytic Interstitial Lung Disease. Ann Am Thorac Soc, 2016;13(7):1042–1049.
25. Criado E, Sánchez M, Ramírez J, et al. Pulmonary sarcoidosis: typical and atypical manifestations at high-resolution CT with pathologic correlation. Radiogr Rev, 2010;30(6):1567–1586.
26. Gregersen S, Aaløkken TM, Mynarek G, et al. High resolution computed tomography and pulmonary function in common variable immunodeficiency. Respir Med, 2009;103(6):873–880.
27. van de Ven AAJM, van Montfrans JM, Terheggen-Lagro SWJ, et al. A CT scan score for the assessment of lung disease in children with common variable immunodeficiency disorders. Chest, 2010;138(2):371–379.
28. Detková D, de Gracia J, Lopes-da-Silva S, et al. Common variable immunodeficiency: association between memory B cells and lung diseases. Chest, 2007;131(6):1883–1889.
29. Gregersen S, Aaløkken TM, Mynarek G, et al. Development of pulmonary abnormalities in patients with common variable immunodeficiency: associations with clinical and immunologic factors. Ann Allergy Asthma Immunol, 2010;104(6):503–510.
30. Bondioni MP, Soresina A, Lougaris V, et al. Common variable immunodeficiency: computed tomography evaluation of bronchopulmonary changes including nodular lesions in 40 patients. Correlation with clinical and immunological data. J Comput Assist Tomogr, 2010;34(3):395–401.
31. Touw CML, van de Ven AA, de Jong PA, et al. Detection of pulmonary complications in common variable immunodeficiency. Pediatr Allergy Immunol, 2010;21(5):793–805.
32. Verma N, Grimbacher B, Hurst JR. Lung disease in primary antibody deficiency. Lancet Respir Med, 2015;3(8):651–660.
33. Jolles S, Carne E, Brouns M, et al. FDG PET-CT imaging of therapeutic response in granulomatous lymphocytic interstitial lung disease (GLILD) in common variable immunodeficiency (CVID). Clin Exp Immunol, 2017;187(1):138–145.
34. Serra G, Milito C, Mitrevski M, et al. Lung MRI as a possible alternative to CT scan for patients with primary immune deficiencies and increased radiosensitivity. Chest, 2011;140(6):1581–1589.
35. Milito C, Pulvirenti F, Serra G, et al. Lung magnetic resonance imaging with diffusion weighted imaging provides regional structural as well as functional information without radiation exposure in primary antibody deficiencies. J Clin Immunol, 2015;35(5):491–500.
36. Chen Y, Stirling RG, Paul E, et al. Longitudinal decline in lung function in patients with primary immunoglobulin deficiencies. J Allergy Clin Immunol, 2011;127(6):1414–1417.
37. Agondi RC, Barros MT, Rizzo LV, et al. Allergic asthma in patients with common variable immunodeficiency. Allergy, 2010;65(4):510–515.
38. Jolles S, Sánchez-Ramón S, Quinti I, et al. Screening protocols to monitor respiratory status in primary immunodeficiency disease: findings from a European survey and subclinical infection working group. Clin Exp Immunol, 2017;190(2):226–234.
39. Olalekan SA, Cao Y, Hamel KM, et al. B cells expressing IFN-γ suppress Treg-cell differentiation and promote autoimmune experimental arthritis. Eur J Immunol, 2015;45(4):988–998.
40. Mélet J, Mulleman D, Goupille P, et al. Rituximab-induced T cell depletion in patients with rheumatoid arthritis: association with clinical response. Arthritis Rheum, 2013;65(11):2783–2790.
41. Verstappen GM, Kroese FGM, Meiners PM, et al. B Cell Depletion Therapy Normalizes Circulating Follicular Th Cells in Primary Sjögren Syndrome. J Rheumatol, 2017;44(1):49–58.
42. Barr TA, Shen P, Brown S, et al. B cell depletion therapy ameliorates autoimmune disease through ablation of IL-6-producing B cells. J Exp Med, 2012;209(5):1001–1010.
43. Varzaneh FN, Keller B, Unger S, et al. Cytokines in common variable immunodeficiency as signs of immune dysregulation and potential therapeutic targets – a review of the current knowledge. J Clin Immunol, 2014;34(5):524–543.
44. Chase NM, Verbsky JW, Hintermeyer MK, et al. Use of combination chemotherapy for treatment of granulomatous and lymphocytic interstitial lung disease (GLILD) in patients with common variable immunodeficiency (CVID). J Clin Immunol, 2013;33(1):30–39.
45. Pathria M, Urbine D, Zumberg MS, Guarderas J. Management of granulomatous lymphocytic interstitial lung disease in a patient with common variable immune deficiency. BMJ Case Rep, 2016; 215624.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2018 Issue 3-
All articles in this issue
- Molecular characterization of Streptococcus pneumoniae isolates recovered from cases of pneumococcal vaccine failure in children under five years of age in the Czech Republic in 2012–2014
- Fecal bacteriotherapy in the treatment of Clostridium difficile infection
- Successful rituximab treatment of granulomatous/lymphocytic interstitial lung disease in common variable immunodeficiency
- Human rotavirus A detection: Comparison of enzymatic immunoassay and rapid chromatographic test with two quantitative RT-PCR assays
- Human Mozdok leptospirosis first diagnosed by serum agglutinin-absorption tests in the Slovak Republic
- Susceptibility of clinical isolates of Bordetella pertussis to chemicals
- Laboratory evaluation of repellency of traditional Czech homemade repellents against Aedes aegypti
- Comparison of the epidemiological patterns of Lyme borreliosis and tick-borne encephalitis in the Czech Republic in 2007–2016
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Comparison of the epidemiological patterns of Lyme borreliosis and tick-borne encephalitis in the Czech Republic in 2007–2016
- Fecal bacteriotherapy in the treatment of Clostridium difficile infection
- Successful rituximab treatment of granulomatous/lymphocytic interstitial lung disease in common variable immunodeficiency
- Susceptibility of clinical isolates of Bordetella pertussis to chemicals
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

