-
Medical journals
- Career
Bakteriémie vyvolaná Staphylococcus aureus – význam správného přístupu k diagnostice a léčbě
Authors: S. Arientová 1; O. Beran 1; M. Štefan 1; M. Čurdová 2; M. Holub 1
Authors‘ workplace: Klinika infekčních nemocí, 1. lékařská fakulta, Univerzita Karlova a Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha 1; Oddělení klinické mikrobiologie, Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha 2
Published in: Epidemiol. Mikrobiol. Imunol. 67, 2018, č. 2, s. 88-91
Category: Short Communication
Overview
Bakteriémie vyvolaná Staphylococcus aureus (SAB) je nejčastější infekcí krevního řečiště s vysokou incidencí a letalitou. Při zjištění SAB je velmi důležité dodržet správný vyšetřovací a léčebný postup. Záměrem studie bylo posoudit klinické a epidemiologické charakteristiky případů SAB zachycených v ÚVN Praha a zhodnotit dodržení doporučených postupů v diagnostice a léčbě. Celkem bylo do retrospektivní studie zařazeno 65 pacientů, u nichž byl zachycen S. aureus v hemokultuře. V 60 případech (92 %) byla SAB vyvolána kmeny MSSA a u 5 pacientů (8 %) byly detekovány kmeny MRSA. Zdroj infekce se podařilo prokázat v 83 % případů. Průměrná smrtnost v analyzovaném souboru byla 28 %. Výsledky analýzy indikátorů kvality péče naznačily nedostatky v diagnostickém i léčebném postupu u 65 % pacientů. Studie podpořila nutnost konziliárních vyšetření odborníkem na infekční choroby u lůžka.
Klíčová slova:
Staphylococcus aureus – stafylokokové infekce –bakteriémieÚVOD
Bakteriémie vyvolaná Staphylococcus aureus (SAB) je nejčastější infekcí krevního řečiště s výskytem 10–30 případů na 100 000 osob za rok [1]. SAB je velmi závažná infekce, která je asociována se signifikantní letalitou pohybující se mezi 10–30 % [2]. Bylo rovněž prokázáno, že SAB má vyšší smrtnost, vede k významně delší hospitalizaci oproti bakteriémiím jiné etiologie, a stejně tak náklady na její léčbu jsou signifikantně vyšší [3]. Je také dobře známo, že smrtnost SAB je ovlivněna vlastnostmi kmene S. aureus, který infekci vyvolal. Pokud je vyvolavatelem S. aureus citlivý k methicilinu (MSSA), smrtnost je významně nižší než v případě SAB způsobené rezistentním S. aureus (MRSA) [4]. Významnou roli v nepříznivé prognóze SAB hraje vedle etiologie i vyšší věk pacienta, přidružené komorbidity a komplikace, mezi něž patří sepse, hospitalizace na jednotce intenzivní péče, jaterní selhání, HIV infekce a přítomnost maligního tumoru s metastázemi [1, 5].
Z hlediska správného managementu SAB je zásadní odhalit primární zdroj infekce, kterým může být infekce kůže a měkkých tkání, katetrová infekce, infekční endokarditida, osteomyelitida, pneumonie či absces s hematogenním šířením [6]. Pro správný klinický přístup je rovněž důležité zvážit rizikové faktory pro vznik SAB, které zahrnují vyšší věk, mužské pohlaví, intravenózní užívání drog, z chronických onemocnění zejména diabetes mellitus, chronické renální selhání s nutností dialyzační terapie a probíhající imunosupresivní léčbu [1, 5]. Po zjištění SAB je pak klíčové určit správný vyšetřovací a léčebný postup v těsné spolupráci s mikrobiologem a infektologem [1, 5]. Z literatury vyplývá, že správně vedené infektologické konzilium musí pomoci naplnit následující cíle. Na prvním místě je určení zdroje SAB, který se následně odstraní, pokud je to možné. Dále je nezbytné časné zahájení cílené antibiotické terapie a odběr kontrolních hemokultur 48–96 hodin po nasazení antibiotické terapie. Nedílnou součástí diagnostického procesu je i provedení echokardiografického vyšetření [1]. Výsledky provedených metaanalýz jednoznačně dokumentují, že pokud je pacient vyšetřen infektologem a ošetřující lékař respektuje jeho doporučení, nemocný je významně častěji správně diagnostikován, léčen a kromě kratší hospitalizace má i celkově lepší prognózu [7].
Z uvedených důvodů byla provedena retrospektivní analýza souboru pacientů se SAB v Ústřední vojenské nemocnici – Vojenské fakultní nemocnici Praha (ÚVN). Hlavním cílem studie bylo zjistit aktuální epidemiologickou situaci, vyhodnotit klinické ukazatele průběhu SAB a pomocí nejdůležitějších indikátorů kvality péče identifikovat problémy v diagnostice a terapii SAB jako podklad pro zlepšení managementu této závažné diagnózy.
MATERIÁL A METODIKA
Ve studii byly retrospektivně vyhodnoceny případy pacientů s prokázanou SAB hospitalizovaných v ÚVN v letech 2015–2016. Do studie byli zařazeni všichni pacienti starší 18 let hospitalizovaní s různými základními diagnózami na klinikách a odděleních v ÚVN, u nichž byl zachycen S. aureus v hemokultuře. Všechna kultivační vyšetření byla provedena na Oddělení klinické mikrobiologie ÚVN. K vyšetřování hemokultur laboratoř využívá přístroje BacT/Alert (bioMérieux SA, Marcy L’Etoile, Francie) a hemokultivační lahvičky od stejného výrobce. Ke kultivaci pozitivních vzorků a určení citlivosti k antibiotikům využívá laboratoř již hotová média (Bio-Rad, California, USA). Identifikace narostlých kultur probíhá buď v hmotnostním spektrometru (Bruker, Massachusetts, USA), nebo v analyzátoru Vitek 2 (bioMérieux SA, Marcy L'Etoile, Francie).
VÝSLEDKY
Celkem bylo do studie zařazeno 65 pacientů, jejichž charakteristika včetně přidružených onemocnění je uvedena v tabulce 1. U 60 pacientů (92 %) byla SAB vyvolána kmeny MSSA a u 5 pacientů (8 %) byl detekován kmen MRSA. Zdroj infekce se podařilo prokázat v 83 % případů. Celkový přehled zjištěných zdrojů SAB je uveden na obrázku 1.
Table 1. Demografické a klinické údaje pacientů se SAB
Table 1. Demographic and clinical characteristics of patients with SAB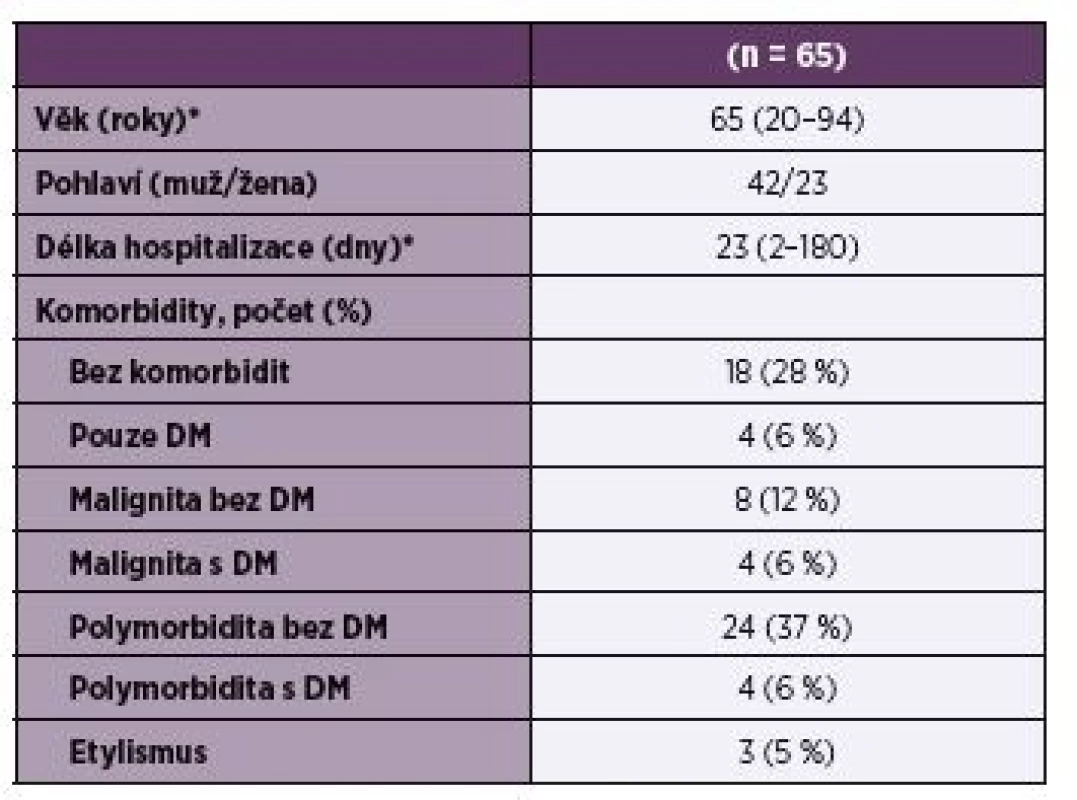
*Data jsou vyjádřena jako průměr (rozptyl); polymorbiditou je míněno 2 a více přidružených onemocnění pacienta, kdy není započítána malignita, DM a ethylismus; DM – diabetes mellitus
* Data is expressed as mean (scattering); polymorbidity refers to 2 or more associated diseases of the patient, when malignancy is not counted, DM and ethylismImage 1. Zdroj SAB
Figure 1. Source of SAB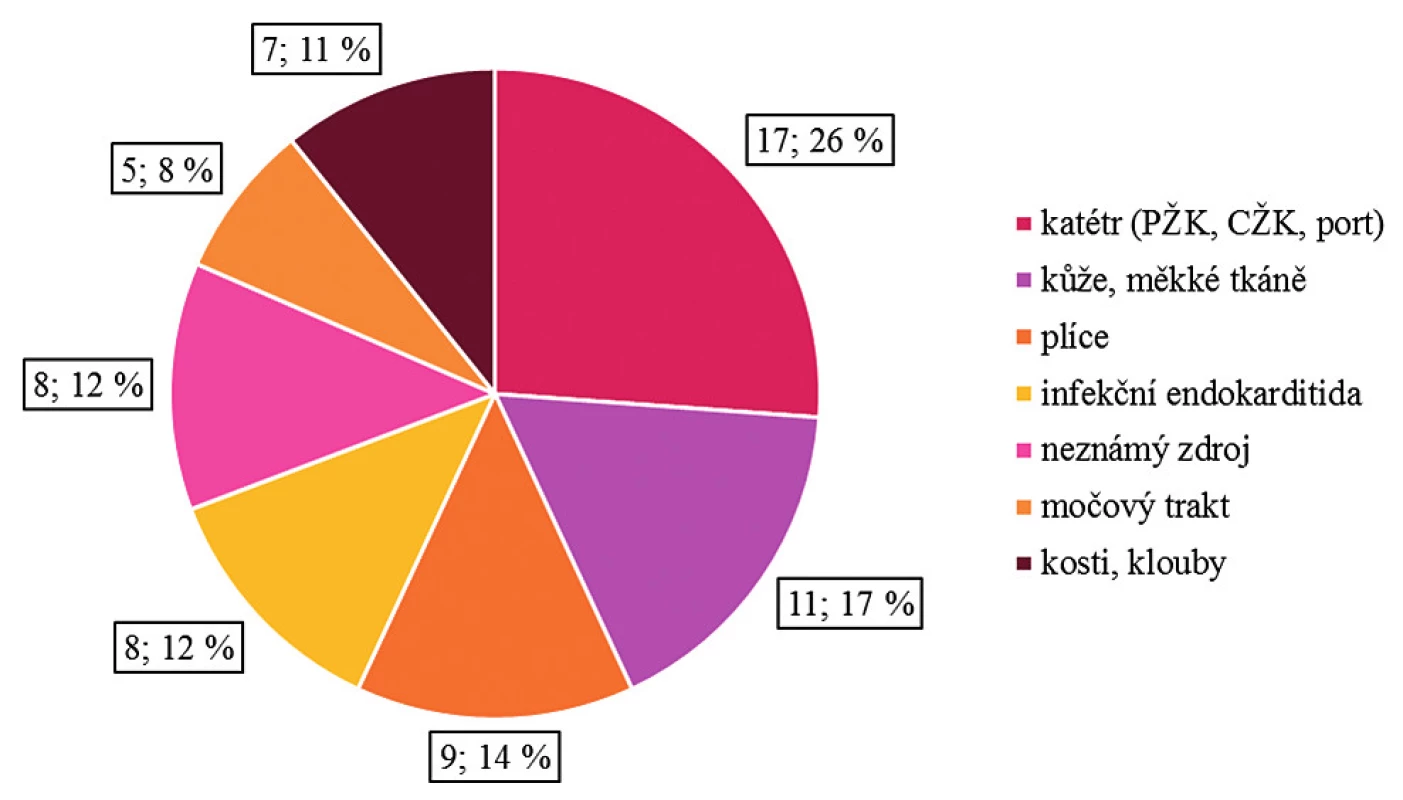
Průměrná smrtnost v našem souboru byla 28 %. V případě SAB vyvolané MSSA se jednalo o 23 %, zatímco při infekci vyvolané MRSA 80 %. Nejvyšší smrtnost byla zaznamenána u pacientů s infekční endokarditidou (63 %), dále následovalo onemocnění plic (56 %), případy s neznámým zdrojem infekce (25 %), infekce močových cest (20 %), katetrové infekce (18 %), infekce kůže a měkkých tkání (18 %). U pacientů s infekcemi kostí a kloubů k žádnému úmrtí nedošlo.
Průměrný věk zemřelých pacientů (n = 18) byl 65 let (medián 70 let, rozptyl 32–88) a průměrná délka hospitalizace byla 23 dnů (medián 16 dnů). Jednalo se o 11 mužů (61 %) a 7 žen (39 %). Z této skupiny bylo 9 pacientů (50 %) polymorbidních a naopak dva pacienti byli zcela bez komorbidit. Kultivačně byl u 4 pacientů (22 %) zachycen MRSA kmen.
Co se týče antibiotické terapie, empiricky byla nejčastěji nasazována aminopenicilinová antibiotika s inhibitory beta-laktamáz (49 % pacientů) následována cefalosporiny 3. generace (23 % pacientů). Při zjištění SAB bylo na cílenou a adekvátní antibiotickou terapii oxacilinem převedeno pouze 45 % pacientů s etiologií MSSA, naopak v případě SAB vyvolané MRSA byla antibiotická terapie vankomycinem správně zvolena u všech nemocných. Z celkového počtu bylo 28 pacientů (43 %) léčeno antibiotiky kratší dobu než 14 dnů. Kontrolní hemokultury byly odebrány jen u 42 % pacientů a echokardiografické vyšetření bylo provedeno u 57 % pacientů. Celkem byly určité nedostatky ve vyšetřovacím a léčebném postupu zjištěny u 42 (65 %) pacientů.
Infektologické konzilium bylo provedeno u 35 % pacientů, postup u dalších 23 % pacientů byl konzultován telefonicky s mikrobiology a u 22 % pacientů byly nálezy mezioborově zhodnoceny v rámci pravidelné vizity na Klinice anesteziologie, resuscitace a intenzivní medicíny (KARIM). Překvapivým zjištěním bylo, že u 20 % pacientů nebyla provedena jakákoliv konzultace výsledků s mikrobiologem či infektologem. Na druhou stranu ve 23 % případech i po realizovaném infektologickém konziliu u lůžka nebyly následně dodrženy všechny atributy správného managementu pacientů se SAB.
V případě skupiny 18 zemřelých pacientů bylo kontrolní hemokultivační vyšetření provedeno u 9 pacientů (50 %) a echokardiografické vyšetření pouze u 10 pacientů (56 %). Celkem 10 pacientů (56 %) zemřelo do 14 dnů od nasazení antibiotické terapie. Nejčastější volbou empirické antibiotické terapie byl ceftriaxon (9 pacientů), ko-amoxicilin (3 pacienti), oxacilin (2 pacienti), meropenem (2 pacienti) a taktéž 2 pacienti byli léčeni klindamycinem pro erysipel. Na cílenou antibiotickou terapii oxacilinem bylo převedeno 7 pacientů (39 %) a v případě MRSA vankomycinem všichni 4 pacienti. U 3 pacientů byl ponechán ceftriaxon, u jednoho ko-amoxicilin a u 3 pacientů byl ponechán meropenem.
DISKUSE
V předložené retrospektivní studii jsme potvrdili, že SAB je oprávněně spojována s vysokou morbiditou a letalitou. Průměrná smrtnost i délka hospitalizace zjištěné v našem souboru odpovídají literárním údajům zhruba na úrovni horní hranice udávaného rozpětí [1]. Podobně jako jiní autoři jsme pozorovali podstatně závažnější prognózu SAB vyvolanou kmeny MRSA, nicméně počet těchto pacientů byl ve studované kohortě relativně nízký (8 % případů) [2, 4]. Oproti tomu ve studii autorů z Kanady se jednalo o 20 % případů [8]. Námi zjištěná incidence je rovněž nižší než 13,7% výskyt infekcí vyvolaných MRSA v českých nemocnicích zaznamenaný v roce 2015 [9]. Co se týče zdroje SAB, jednalo se nejčastěji podobně jako v předchozích studiích o infikovaný žilní katetr, dále infekce kůže a měkkých tkání, plic, infekční endokarditidu, močové infekce a infekce kostí a kloubů [1].
Velmi důležitý je správný výběr antibiotické terapie SAB, kdy lékem volby pro infekce vyvolané MSSA je oxacilin a v případě MRSA vankomycin. Klíčové je také odpovídající dávkování antibiotika, které je v ÚVN v případě vankomycinu vždy průběžně konzultováno s klinickým farmaceutem. V případě oxacilinu je celková denní dávka 12 g, rozdělená do 4–6 dávek za den (u těžkých infekcí je jednoznačně preferován interval mezi jednotlivými dávkami 4 hodiny). Neméně významné je však taktéž určit odpovídající délku antibiotické terapie, která se odvíjí podle toho, zda se jedná o infekci komplikovanou či nekomplikovanou. Jako komplikovaná je SAB označována, pokud je přítomna infekční endokarditida, metastatický rozsev či protézy a cizí materiály a rovněž v situaci, kdy jsou pozitivní kontrolní hemokultury odebrané 48–96 hodin po zahájení cílené antibiotické terapie. Komplikovanou SAB je pak nutné léčit antibiotiky minimálně 28 dnů (6 týdnů v případě infekční endokarditidy), nekomplikovaná infekce se léčí zpravidla 14 dnů [1]. V této souvislosti je nutné zmínit, že v našem souboru byla téměř polovina nemocných léčena antibiotiky méně než 14 dnů a kontrolní hemokultura byla odebrána pouze u 42 % pacientů, což mohlo nepříznivě ovlivnit celkový terapeutický výsledek. Podobně nedostatečný je počet pacientů vyšetřených echokardiografií, která byla provedena jen u lehce nadpolovičního počtu nemocných. Bakteriální endokarditida přitom patří k možným zdrojům SAB nebo případně může být i její možnou metastatickou komplikací [1, 6]. Jelikož nebyly dodrženy všechny náležitosti správného managementu SAB, nebylo možné u většiny pacientů určit, zda se jednalo o infekci komplikovanou či nekomplikovanou. Vzhledem k charakteru studie a nedostatečnému sledování pacientů po propuštění nelze určit, do jaké míry nedostatky v kvalitě péče ovlivnili budoucí komplikace a prognózu pacientů.
V odborné literatuře bylo opakovaně zdůrazněno, že v případě SAB je vhodné provést správně vedené infektologické konzilium u lůžka, které zásadním způsobem může zlepšit prognózu SAB. Vogel et al. [7] v metaanalýze popsali průměrnou 26% smrtnost SAB, která v případě infektologického konzilia u lůžka pacienta poklesla na 12 %. V naší retrospektivní studii bylo infektologické konzilium provedeno zhruba u třetiny pacientů, přičemž téměř u čtvrtiny případů nebyla následně dodržena všechna doporučení. Nelze tedy srovnávat skupinu pacientů, kteří toto konzilium měli, s těmi, které infektolog nevyšetřil, a není možné hodnotit pokles smrtnosti v našem souboru. Navíc je nutné zdůraznit, že konzilia byla v uvedeném období prováděna jen v případech, kdy si je vyžádal ošetřující lékař (a to spíše u pacientů s těžším průběhem onemocnění).
Jak již bylo uvedeno, odběr kontrolní hemokultury je velmi důležitý a v naší studii nebyl u většiny pacientů realizován. Ukazuje se, že perzistentní bakteriémie 72–96 hodin od nasazení cílené antibiotické terapie je nejen jednou ze známek komplikované SAB, ale je asociována i s vyšší smrtností [2].
Ve studii z 12 velkých španělských nemocnic se velmi pozitivně projevilo zavedení závazného doporučeného postupu diagnostiky a léčby SAB, což vedlo oproti období před implementací k významnému snížení 14denní a 30denní smrtnosti [10]. Ve zmíněné studii vedlo zavedení standardizovaného postupu ke zvýšenému dodržování základních principů péče o nemocné se SAB. Jednalo se zejména o časné odstranění fokusu infekce, odběr kontrolních hemokultur a léčbu protistafylokokovým penicilinem při SAB vyvolané MSSA. Nicméně i při zavedení standardizovaného postupu pro diagnostiku a léčbu SAB je infektologické konzilium u lůžka nemocného významné, a to zejména pro časnou identifikaci zdroje infekce, doporučení a kontrolu adekvátní délky cílené antibiotické terapie a včasné odhalení komplikací.
ZÁVĚR
Výsledky studie potvrzují význam problematiky SAB a rovněž dokumentují nedostatky při vyšetřovacím a léčebném postupu, který by měl v optimálním případě zahrnovat správně vedené infektologické konzilium u lůžka pacienta. V současné době se proto zaměřujeme na zásadní změnu managementu SAB v naší nemocnici. Jejím základem je velmi úzká spolupráce mikrobiologa s infektologem a rovněž mandatorní infektologické konzilium vedoucí k zajištění a dodržování správného postupu diagnostiky a léčby SAB.
Poděkování
Práce je podpořena projekty UNCE 204022, MO1012 a SVV260369.
Do redakce došlo dne 30. 7. 2017.
Adresa pro korespondenci:
MUDr. Simona Arientová, Ph.D.
Klinika infekčních nemocí 1. LF a ÚVN
Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha (ÚVN)
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: simona.arientova@lf1.cuni.cz
Sources
1. Tong SY, Davis JS, Eichenberger E, et al. Staphylococcus aureus infections: epidemiology, pathophysiology, clinical manifestations, and management. Clin Microbiol Rev, 2015;28(3):603–661.
2. van Hal SJ, Jensen SO, Vaska VL, et al. Predictors of mortality in Staphylococcus aureus Bacteremia. Clin Microbiol Rev, 2012;25(2):362–386.
3. Naber CK. Staphylococcus aureus bacteremia: epidemiology, pathophysiology, and management strategies. Clin Infect Dis, 2009;48 Suppl 4:S231–237.
4. Cosgrove SE, Sakoulas G, Perencevich EN, et al. Comparison of mortality associated with methicillin-resistant and methicillin-susceptible Staphylococcus aureus bacteremia: a meta-analysis. Clin Infect Dis, 2003;36(1):53–59.
5. Anantha RV, Jegatheswaran J, Pepe DL, et al. Risk factors for mortality among patients with Staphylococcus aureus bacteremia: a single-centre retrospective cohort study. CMAJ Open, 2014;2:E352–359.
6. Le Moing V, Alla F, Doco-Lecompte T, et al. Staphylococcus aureus Bloodstream Infection and Endocarditis-A Prospective Cohort Study. PLoS One, 2015;10(5):e0127385.
7. Vogel M, Schmitz RP, Hagel S, et al. Infectious disease consultation for Staphylococcus aureus bacteremia – A systematic review and meta-analysis. J Infect, 2016;72(1):19–28.
8. Martin L, Harris MT, Brooks A, et al. Management and outcomes in patients with Staphylococcus aureus bacteremia after implementation of mandatory infectious diseases consult: a before/after study. BMC Infect Dis, 2015;15 : 568.
9. European Centre for Disease Prevention and Control (ECDC) [online]. Antimicrobial resistance surveillance in Europe 2015. Stockholm: 2017. Dostupný na www: <http://ecdc.europa.eu/en/healthtopics/antimicrobial-resistance-and-consumption/antimicrobial_resistance/EARS-Net/Pages/EARS-Net.aspx>. ISBN 978-92-9498-029-8.
10. Lopez-Cortes LE, Del Toro MD, Galvez-Acebal J, et al. Impact of an evidence-based bundle intervention in the quality-of-care management and outcome of Staphylococcus aureus bacteremia. Clin Infect Dis, 2013;57(9):1225–1233.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2018 Issue 2-
All articles in this issue
- Stav imunitního systému u pacientů se subklinickou formou urogenitální tuberkulózy
- Molekulární epidemiologie tuberkulózy v hlavním městě Praha v letech 2013 a 2014
- Surveillance invazivního meningokokového onemocnění založená na sekvenaci celého genomu (WGS), Česká republika, 2015
- Boj s rezistencí mikroorganismů na antibiotika
- Streptokokový syndrom toxického šoku – život ohrožující stav vyvolaný různými druhy streptokoků
- Bakteriémie vyvolaná Staphylococcus aureus – význam správného přístupu k diagnostice a léčbě
- Aktualizace českých doporučených postupů pro laboratorní diagnostiku infekcí vyvolaných Clostridium difficile
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Streptokokový syndrom toxického šoku – život ohrožující stav vyvolaný různými druhy streptokoků
- Bakteriémie vyvolaná Staphylococcus aureus – význam správného přístupu k diagnostice a léčbě
- Boj s rezistencí mikroorganismů na antibiotika
- Aktualizace českých doporučených postupů pro laboratorní diagnostiku infekcí vyvolaných Clostridium difficile
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

