-
Medical journals
- Career
Faktory modifikujúce koncentráciu IgE v pupočníkovej krvi – pilotná štúdia
Authors: O. Petrovičová 1; Peter Bánovčin 1; E. Babušíková 2; M. Jeseňák 1
Authors‘ workplace: Univerzita Komenského v Bratislave, Jesseniova lekárska fakulta v Martine, Univerzitná nemocnica Martin Klinika detí a dorastu, Martin, Slovenská republika 1; Univerzita Komenského v Bratislave, Jesseniova lekárska fakulta v Martine, Ústav lekárskej biochémie, Martin Slovenská republika 2
Published in: Epidemiol. Mikrobiol. Imunol. 65, 2016, č. 4, s. 226-231
Category: Original Papers
Overview
Cieľ práce:
Komplexný vplyv faktorov vnútorného a vonkajšieho prostredia na jedinca, jeho imunitný systém a nedostatok vhodných markerov na posúdenie a zníženie rizika vzniku alergie počas života vedú ku kontinuálnemu nárastu počtu ľudí postihnutých niektorou formou alergie. Podľa výsledkov niektorých štúdií by stanovenie koncentrácie IgE v pupočníkovej krvi mohlo byť vhodným skorým markerom na posúdenie rizika vzniku atopických chorôb, ale štúdie priniesli kontroverzné výsledky. Navyše, viacerí autori diskutujú o ich originálnom pôvode (syntéza in utero, placentárny prenos, peripartálna kontaminácia z materskej krvi). Cieľom našej pilotnej štúdie bolo vyhodnotiť možný vplyv modifikujúcich faktorov na koncentráciu pupočníkových IgE.Materiál a metodika:
Náš súbor tvorila retrospektívne vyhľadaná skupina 184 novorodencov (98 chlapcov, 53,3 % a 86 dievčat, 46,7 %), ktorým bola pred 25 rokmi odobratá pupočníková krv, v ktorej bola v tom čase stanovená koncentrácia IgE (metódou PRIST). V našej práci bol spätne vyhodnotený vplyv vybraných modifikujúcich faktorov (pohlavie, spôsob pôrodu, mesiac narodenia) na nameranú koncentráciu IgE v pupočníkovej krvi.Výsledky:
U chlapcov v porovnaní s dievčatami, u detí narodených cisárskym rezom oproti deťom narodených prirodzenou cestou a u novorodencov narodených počas zimných mesiacov v porovnaní s ostatnými ročnými obdobiami sa zistila zvýšená koncentrácia IgE v pupočníkovej krvi. Naše výsledky sú v zhode s väčšinou zahraničných štúdií.Záver:
Na základe našich výsledkov ako aj výsledkov iných autorov predpokladáme, že sledované vybrané faktory ovplyvňujú koncentráciu IgE v pupočníkovej krvi v rôznej miere. Zistené súvislosti by mali byť zohľadnené pri interpretácii hodnôt IgE v pupočníkovej krvi.KĽÚČOVÉ SLOVÁ:
imunoglobulín E – hygienická hypotéza – pupočníková krv – modifikujúce faktory – prevenciaÚVOD
Alergické choroby predstavujú najväčšiu skupinu civilizačných chorôb s každoročne narastajúcou incidenciou a prevalenciou. V priebehu desaťročí vzniklo viacero teórií, ktoré sa snažili objasniť dramatický nárast alergických chorôb, pričom najznámejšou z nich je hygienická hypotéza. Prvýkrát bola opísaná profesorom epidemiológie, Davidom Strachanom v roku 1989, vyslovením hypotézy, že znížená expozícia infekciám v detskom veku vedie k nerovnováhe medzi TH1 a TH2 lymfocytmi v prospech TH2 imunitnej odpovede s následným rozvojom hyperreaktivity imunitného systému voči v zásade neškodným antigénom z prostredia [31]. Nižšie riziko vzniku alergií je v rodinách s väčším počtom detí a tiež u jedincov, ktorí vyrastajú na vidieku v blízkom kontakte s dobytkom, čo je pripisované fekálnej kontaminácii prostredia. Diskutovaným ochranným faktorom bol aj zvýšený príjem nepasterizovaného mlieka, ktoré by mohlo byť zdrojom niektorých bakteriálnych infekcií [25]. Vysoký obrat a rozmanitosť príslušných baktérií, v jednotlivých slizničných imunitných systémoch v porovnaní so stabilným osídlením len určitým typom patogénov, poskytuje kontinuálnu stimuláciu imunitného systému nevyhnutnú pre prevenciu pred alergickými chorobami [18]. V hypotéze o „starých kamarátoch“, za ktorých sa považovali baktérie, s ktorými sa organizmus stretol v priebehu rokov (rod Lactobacillus, saprofytické environmentálne mykobaktérie, črevné parazity), boli zmeny v imunitnej regulácií pripisované poruche rovnováhy medzi T-regulačnými lymfocytmi (Treg) a T-efektorovými lymfocytmi. Jedným z najvýznamnejších faktorov prispievajúcich k vzniku tejto nerovnováhy, a teda k rozvoju imunopatologických stavov (alergií alebo autoimunity), je vzniknutá dysmikróbia v črevnom mikrobióme v zmysle narušenie vzorca zastúpenia jednotlivých komenzálnych baktérií či už navzájom voči sebe, alebo na úkor patogénnych mikroorganizmov [29]. Ďalej bolo pozorované, že respiračné alergie sú menej frekventné u ľudí, ktorí boli vo významnej miere vystavení fekálne-orálnym či alimentárnym nákazám (najmä vírus hepatitídy A, Toxoplasma gondii, Helicobacter pylori). Súvislosť atopie s prekonaním ostatných infekcií (osýpky, mumps, ovčie kiahne, herpes simplex vírus 1 a 2, cytomegalovírus) sa nepotvrdila [17, 19, 33]. Pri súčasnej pandémií alergických a autoimunitných chorôb podstúpila hygienická hypotéza viaceré revízie a dnes je založená na zložitých mechanizmoch interakcií človeka s rôznymi mikroorganizmami v jeho ekosystéme. V rámci revidovanej verzie hygienickej hypotézy sa predpokladá, že zmeny v črevnom mikrobióme zásadne ovplyvňujú rozvoj rôznych imunopatologických stavov, ako napríklad alergií [20]. V nadväznosti na hygienickú hypotézu bola sformulovaná teória biodiverzity, ktorá poukazuje na mikrobiálnu depriváciu v dôsledku industrializácie a znečisťovania prostredia chemickými látkami, čo má celosvetovo negatívny dopad na ľudstvo [11]. Aktuálne objasňuje vznik alergických a autoimunitných chorôb epigenetika, ktorá vo svojej podstate doplňuje a vysvetľuje pôvodnú hygienickú hypotézu. Vývoj imunitného systému, konkrétne diferenciácia T-lymfocytov je pod epigenetickou reguláciou prostredníctvom napr. metylácie DNA a histónov, acetylácie histónov či zmien štruktúry chromatínu. Uvedená modifikácia determinuje kompaktnosť DNA a jej náchylnosť k zmenám v génovej transkripcii, génovej expresii a následne v rozvoji alergického fenotypu [16].
Desaťročia sa hľadajú a skúmajú vhodné markery predikcie rozvoja alergických ochorení v neskoršom živote. Jedným z nich je aj stanovenie koncentrácie IgE v pupočníkovej krvi. Cieľom našej pilotnej štúdie bolo analyzovať vplyv pohlavia, spôsobu pôrodu ako aj ročného obdobia narodenia na koncentráciu IgE v pupočníkovej krvi stanovenej v retrospektívne vyhľadanom súbore 184 novorodencov.
MATERIÁL A METODIKA
V priebehu rokov 1989–1990 bol zrealizovaný odber pupočníkovej krvi na Klinike detí a dorastu Univerzitnej nemocnice Martin za účelom stanovenia koncentrácie pupočníkových IgE (CB-IgE) v skupine 184 novorodencov, ktorých sme retrospektívne vyhľadali. Koncentrácia IgE v pupočníkovej krvi bola stanovená hneď po odbere prostredníctvom metódy PRIST (paper-disc radioimmunoassay technique), ktorá spočíva v imunochemickej reakcii antigénu (molekula IgE) so špecifickou anti-IgE protilátkou naviazanou na papierových platničkách označenou rádionuklidom. Výsledky boli analyzované pomocou štatistického programu SPSS. Jednotlivé parametre boli porovnané prostredníctvom nepárového Studentovho t-testu a Kruskal-Wallisovho neparametrického testu. Za štatisticky významné rozdiely boli považované hodnoty p < 0,05.
Table 1. Všeobecná charakteristika súboru Table 1. General characteristics of the study group 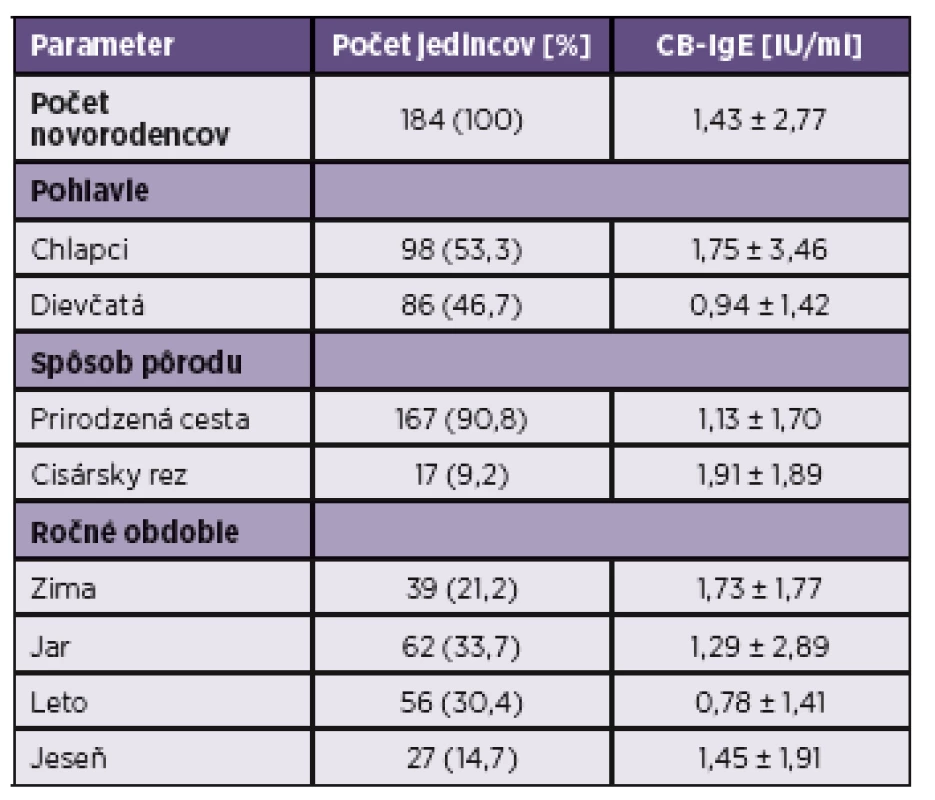
VÝSLEDKY
Do našej štúdie bolo zahrnutých 184 novorodencov, z toho 98 chlapcov (53,3 %) a 86 dievčat (46,7 %). Všeobecná charakteristika súboru ako aj namerané koncentrácie pupočníkových IgE v jednotlivých podskupinách sú uvedené v tabuľke 1. Celkové hodnoty koncentrácií CB-IgE v súbore boli v rozsahu od 0 do 24 IU/ml s priemernou hodnotou 1,43 ± 2,77 IU/ml. Chlapci mali štatisticky vyššiu koncentráciu CB-IgE v porovnaní s dievčatami (1,75 ± 3,46 IU/ml vs. 0,94 ± 1,42 IU/ml, p = 0,036; graf 1). Prirodzenou cestou sa narodilo 167 detí (90,8 %) a 17 detí (9,2 %, 9 chlapcov a 8 dievčat) sa narodilo cisárskym rezom. Deti narodené cisárskym rezom mali signifikantne vyššiu koncentráciu CB-IgE v porovnaní s deťmi narodenými prirodzenou cestou (1,91 ± 1,89 IU/ml vs. 1,13 ± 1,70 IU/ml, p = 0,050) – graf 2. V zime (december, január, február) sa narodilo 39 detí (21,2 %), na jar (marec, apríl, máj) sa narodilo 62 detí (33,7 %), v lete (jún, júl, august) 56 detí (30,4 %) a na jeseň (september, október, november) 27 detí (14,7 %). Koncentrácia CB-IgE bola najvyššia u detí narodených v zime (1,73 ± 1,77 IU/ml) a v porovnaní s koncentráciami CB-IgE v ostatných ročných obdobiach bol tento rozdiel štatisticky významný (p < 0,01, p < 0,05; graf 3). Deti narodené na jeseň (1,45 ± 1,91 IU/ml) mali nižšiu koncentráciu v porovnaní k deťom narodeným v zime (p < 0,01), ale vyššiu ako deti narodené na jar (1,29 ± 2,89 IU/ml, p < 0,05). U detí narodených počas leta bola koncentrácia CB-IgE najnižšia (0,78 ± 1,41 IU/ml).
Graph 1. Vplyv pohlavia na koncentráciu pupočníkových IgE (*p < 0,05) Fig 1. Variation of cord blood IgE levels by sex (*p < 005) 
Graph 2. Vplyv spôsobu pôrodu na koncentráciu pupočníkových IgE (*p < 0,05) Fig 2. Variation of cord blood IgE levels by type of delivery (*p < 0.05) 
Graph 3. Vplyv ročného obdobia narodenia dieťaťa na koncentráciu pupočníkových IgE (*p < 0,05; **p < 0,01) Fig 3. Figure 3. Variation of cord blood IgE levels by the season of birth (*p < 0.05; **p < 0.01) 
DISKUSIA
Pupočníkové IgE boli skúmané od 70-tych rokov minulého storočia v súvislosti s ich možným významom v predikcii atopických chorôb, pričom diskutovanou skutočnosťou bol aj originálny pôvod CB-IgE. Navyše, výpovedná hodnota sérovej koncentrácie celkových IgE v bežnej klinickej praxi je pomerne nízka. Vo viacerých štúdiách bola preukázaná významná asociácia medzi koncentráciou celkových IgE matky a koncentráciou CB-IgE. Otázkou je, či je uvedená asociácia spôsobená transportom IgE cez placentárnu bariéru alebo samostatnou fetálnou produkciou IgE, ktorá však môže byť ovplyvnená materskými faktormi [5, 6, 15]. Syntéza IgE v embryonálnom štádiu bola preukázaná od 11. gestačného týždňa [22]. Produkciu imunoglobulínov E in utero podporuje aj zistenie, že vzťah medzi materskými IgE a CB-IgE závisí od špecifickosti protilátok IgE. Zatiaľ čo špecifické potravinové IgE vykazovali podobný profil s materskými špecifickými potravinovými IgE, u špecifických inhalačných IgE tento vzťah nebol preukázaný [27]. Pfefferle et al. (2008) objavili alergén-špecifické IgE u novorodencov, pričom u ich matiek nebola pozorovaná podobná špecifickosť [27]. Na druhej strane iní autori tvrdia, že senzibilizačný profil v materskej plazme a pupočníkovej krvi je porovnateľný [5]. Navyše, aj pomer medzi alergén-špecifickými IgE a celkovými IgE matky je porovnateľný s pomerom v pupočníkovej krvi [6]. Existuje však už aj prvá štúdia, ktorá poukazuje na možný prechod IgE protilátok z matky na plod cez placentárnu bariéru prostredníctvom IgG autoprotilátok namierených proti IgE vo forme komplexov IgG anti-IgE/IgE [7]. Berúc do úvahy, že koncentrácia CB-IgE je veľmi nízka (obvykle až nedetekovateľná) a ich najpravdepodobnejší pôvod je tvorba samotným plodom, tak na rozdiel od stanovenia celkových IgE v sére by táto metóda mohla nájsť svoje klinické uplatnenie.
Okrem hľadania významu pupočníkových IgE v predikcii atopických chorôb je zaujímavý aj vplyv rôznych faktorov na výšku koncentrácie CB-IgE. V našej štúdií sme v retrospektívne vyhľadanej skupine 184 novorodencov zaznamenali signifikantne vyššiu koncentráciu CB-IgE u chlapcov, u novorodencov narodených cisárskym rezom a novorodencov narodených v zimných mesiacoch.
Vyššiu koncentráciu CB-IgE u novorodencov mužského pohlavia zistili aj iní autori [3, 15, 30], hoci v niektorých štúdiách nebol tento rozdiel pozorovaný [21, 23]. Vyššia koncentrácia CB-IgE u chlapcov koreluje aj s vyšším výskytom alergických chorôb u mužského pohlavia, zatiaľ čo pre ženské pohlavie je typický skôr výskyt autoimunitných chorôb. Na základe týchto rozdielov niektorí autori odporúčajú, aby sa pre chlapcov používali vyššie fyziologické hodnoty koncentrácie CB-IgE ako u dievčat [15].
Z hľadiska typu pôrodu sa v našej štúdií zaznamenali signifikantne vyššie koncentrácie CB-IgE u novorodencov narodených cisárskym rezom v porovnaní s deťmi narodenými prirodzenou cestou, čo pozorovali aj Nabavi et al. (2013). Iní autori nezaznamenali rozdiel v koncentrácií CB-IgE v závislosti od typu pôrodu [15, 30]. Riziká cisárskeho rezu boli opísané v niektorých štúdiách v súvislosti so zvýšeným rozvojom atopických chorôb v detskom veku [9, 24], a to najmä bronchiálnej astmy a alergickej rinitídy [32]. Deti narodené cisárskym rezom nie sú dostatočne vystavené materskej črevnej mikroflóre a vaginálnej flóre, čo čiastočne vysvetľuje zmeny v črevnom mikrobióme novorodenca [1]. Cisársky rez negatívne ovplyvňuje vývoj črevného mikrobiómu v zmysle vzniku dysbiózy, ku ktorej prispieva napríklad aj užívanie antibiotík či oneskorenie dojčenia po tomto spôsobe pôrodu [28]. Gastrointestinálny trakt (GIT) plodu bol podľa prvotných štúdií údajne sterilný a k jeho kolonizácií mikroorganizmami z matkinho organizmu a vonkajšieho prostredia dochádzalo až počas pôrodu a včasne po ňom [4]. Podľa najnovších poznatkov však mekónium novorodenca sterilné nie je a môže byť osídlené najmä gram-pozitívnymi baktériami (rod Lactobacillus, rod Streptococcus) [2]. Naopak, pri pôrode cisárskym rezom je GIT novorodenca kolonizovaný hlavne baktériami z vonkajšieho prostredia a kože matky (rod Staphylococcus, rod Acinetobacter) [4]. U detí narodených cisárskym rezom môže byť častá bakteriálna infekcia Clostridium difficile, ktorá bola následne v niektorých štúdiách asociovaná so zvýšeným riziko rozvoja bronchiálnej astmy, pričom presný patomechanizmus je zatiaľ neznámy [35]. U novorodencov narodených cisárskym rezom bola preukázaná zvýšená metylácia DNA v bunkách pupočníkovej krvi, čo môže byť tiež jednou z príčin zmien v regulácií a vývoji imunitného systému, okrem už spomínaných zmien v črevnom mikrobióme [8]. Dochádza k potlačeniu protektívneho účinku Treg-lymfocytov a narušeniu imunitnej rovnováhy v prospech TH2-mediovanej alergickej odpovede, čo podporuje revidovanú koncepciu hygienickej hypotézy [28]. Navyše bolo dokázané, že prenatálne zvýšený psychický stres, ktorý môže súvisieť okrem iného aj s komplikáciami gravidity ústiacim do pôrodu cisárskym rezom, vedie k zvýšeniu koncentrácie IgE ako aj k zmenám v cytokínovom profile v pupočníkovej krvi, pričom vplyv stresu bol modulovaný aj atopickým statusom matky [26, 36]. Na druhej strane môže dôjsť pri pôrode cisárskym rezom aj ku kontaminácii pupočníkovej IgE krvou matky, čo môže falošne zvýšiť koncentráciu CB-IgE [10]. V súčasnosti je vplyv cisárskeho rezu na koncentráciu CB-IgE a následný rozvoj atopických chorôb naďalej v štádiu skúmania, a to najmä z hľadiska uplatnenia možných epigenetických mechanizmov kontroly expresie génov podieľajúcich sa na rozvoji alergickej hyperreaktivity [8].
V rámci ročného obdobia sme zistili najvyššie koncentrácie pupočníkových IgE u novorodencov narodených v zime s poklesom CB-IgE v poradí jeseň, jar a leto. Autori zahraničných štúdií opisujú cyklický vzostup CB-IgE v závislosti od ročného obdobia s vrcholom na jar. Kimpen et al. (2009) zistili vzostup CB-IgE s vrcholom sínusoidnej krivky na jar a jej pokles na konci októbra [13]. Českí autori Liška et al. (2012) pozorovali sezónnosť výskytu zvýšených hodnôt pupočníkových IgE s významným vzostupom na jar, ďalej na prelome leta a jesene a pokles v zimných mesiacoch [14]. Hernandéz et al. (2013) vo svojej štúdii opisujú vzostup CB-IgE najmä v jarných mesiacoch [12]. Nabavi et al. (2015) zaznamenali najvyššiu koncentráciu CB-IgE na jar a v zime a najnižšiu na jeseň [23]. Uvedená sezónna variácia koncentrácie IgE v pupočníkovej krvi môže byť spôsobená viacerými faktormi, ako napr. variáciami v intenzite peľovej alergénovej sezóny v rôznych rokoch, rôznou geografickou lokalizáciou realizácie štúdie či rôznym spektrom zastúpených environmentálnych alergénov.
Stanovenie koncentrácie protilátok triedy IgE v pupočníkovej krvi by mohlo predstavovať jednoduchú diagnostickú metódu, ktorá by mohla priniesť uplatnenie v predikcii rozvoja atopických chorôb už v ranom detskom veku. Je ale potrebné podrobnejšie objasniť celkový mechanizmus vzniku týchto chorôb, ako aj spolupôsobenie rôznych faktorov, ktoré spúšťajú epigenetické procesy. Aj na základe našej retrospektívnej štúdie je zrejmé, že koncentráciu CB-IgE ovplyvňuje viacero faktorov, čo je potrené zohľadniť pri interpretácii získaných hodnôt CB-IgE. Na druhej strane novšie štúdie detegovali v pupočníkovej krvi aj iné prediktívne markery pre rozvoj alergénnej hypersenzitivity v neskoršom živote, napr. interleukín 13, ktorý ako jeden z TH2 cytokínov, môže okrem iného zvyšovať koncentráciu IgE [34]. V inej recentnej štúdii autori zaznamenali v pupočníkovej krvi detí s následným rozvojom potravinovej alergie znížený počet T regulačných lymfocytov, pokles CD4+ T pomocných lymfocytov a zvýšený počet monocytov produkujúcich pro-zápalové cytokíny (IL-1β, TNF-α) po stimulácii lipopolysacharidom [37]. Z hľadiska aktuálnych vedomostí je potrebné zrealizovať ďalšie štúdie, ktoré by okrem analýzy modifikujúcich faktorov ukázali aj reálnu prediktívnu kapacitu CB-IgE z hľadiska rozvoja skorých ako aj neskorých atopických prejavov. Na základe toho by bolo možné identifikovať skupinu jedincov, ktorí by mohli profitovať zo skorých preventívnych protialergických intervencií.
Poďakovanie
Táto štúdia bolo podporená grantom VEGA 1/0252/14 a Grantom UK/41/2015.
Do redakce došlo dne 14. 12. 2015.
Adresa pro korespondenci:
doc. MUDr. Miloš Jeseňák, PhD., MBA, Dott.Ric., MHA
Klinika detí a dorastu UK JLF a UNM
Kollárova 2
036 59 Martin
Slovenská republika
e-mail: jesenak@gmail.com
Sources
1. Adlerberth I, Strachan DP, Matricardi PM et al. Gut microbiota and development of atopic eczema in 3 European birth cohorts. J Allergy Clin Immunol, 2007; 120(2): 343–350.
2. Ardissone AN, De La Cruz DM, Davis-Richardson AG, et al. Meconium microbiome analysis identifies bacteria correlated with premature birth. PLoS One, 2014; 9: e90784.
3. Bergmann RL, Schulz J, Gunther S, et al. Determinants of cord – blood IgE concentrations in 6401 German neonates. Allergy,1995; 50 : 65–71.
4. Biasucci G, Benenati B, Morelli L, et al. Cesarean delivery may affect the early biodiversity of intestinal bacteria. J Nutr, 2008; 138(9): 1796S–1800S.
5. Bønnelykke K, Pipper CB, Bisgaard H. Sensitization does not develop in utero. J Allergy Clin Immunol, 2008; 121 : 646–651.
6. Bønnelykke K, Pipper CB, Bisgaard H. Transfer of maternal IgE can be a common cause of increased IgE levels in cord blood. J Allergy Clin Immunol, 2010; 126 : 657–663.
7. Bundhoo A, Paveglio S, Rafti E, et al. Evidence that FcRn mediates the transplacental passage of maternal IgE in the form of IgG anti-IgE/IgE immune complexes. Clin Exp Allergy, 2015; 45 : 1085–1098.
8. Cho CE, Norman M. Caesarean section and development of the immune system in the offspring. Am J Obstet Gynecol, 2013; 208 : 249–254.
9. Debley JS, Smith JM, Redding GJ, et al. Childhood asthma hospitalization risk after caesarean delivery in former term and premature infants. Ann Allergy Asthma Immunol, 2005; 94(2): 228–233.
10. Eiriksson TH, Sigurgeirsson B, Ardal B, et al. Cord blood IgE levels are influenced by gestational age but do not predict allergic manifestation in infants. Pediatr Allergy Immunol, 1994; 5(1): 5–10.
11. Haahtela T, Holgate S, Pawankar R, et al. The biodiversity hypothesis and allergic disease: world allergy organization position statement. World Allergy Organ J, 2013; 31, 6(1): 3.
12. Hernandez E, Barraza-Villarreal A, Escamilla-Numez MC, et al. Prenatal determinants of cord blood total immunoglobulin E levels in Mexican newborns. Allergy Asthma Proc, 2013; 34: e27–34.
13. Kimpen J, Callaert H, Embrechts P, et al. Influence of sex and gestational age on cord blood IgE. Acta Paediatr Scand, 1989; 78 : 233–238.
14. Liška J, Holeček V, Kepková M, et al. Význam stanovení pupečníkového imunoglobulinu E ve vztahu k rodinné anamnéze alergie. Alergie, 2012; 1 : 25–32.
15. Liu CA, Wang CL, Chuang H, et al. Prediction of elevated cord blood levels by maternal IgE levels, and the neonate's gender and gestational age. Chang Gung Med J, 2003; 23 : 561–569.
16. Martino DJ, Prescott SL. Silent mysteries: epigenetic paradigms could hold the key to conquering the epidemic of allergy and immune disease. Allergy, 2010; 65 : 7–15.
17. Matricardi PM, Rosmini F, Ferrigno L, et al. Cross-sectional retrospective study of prevalence of atopy among Italian military students with antibodies against hepatitis A virus. BMJ, 1997; 314 : 999–1003.
18. Matricardi PM, Bonini S. High microbial turnover rate preventing atopy: a solution to inconsistencies impinging on the hygiene hypothesis? Clin Exp Allergy, 2000; 30 : 1506–1510.
19. Matricardi PM, Rosmini F, Riondino S, et al. Exposure to foodborne and orofaecal microbes versus airborne viruses in relation to atopy and allergic asthma: epidemiological study. BMJ, 2000; 320 : 412–417.
20. Matricardi PM. 99th Dahlem conference on infection, inflammation and chronic inflammatory disorders: controversial aspects of the 'hygiene hypothesis'. Clin Exp Immunol, 2010; 160(1): 98–105.
21. Mikler J, Nosáľ S, Danko J, et al. Pupočníkové IgE a ich prognostická hodnota. In: Bánovčin P, Zibolen M, Nosáľ S. Diagnostika a terapia v pediatrii VII. Martin: Jesseniova lekárska fakulta UK; 1999. s. 122–127.
22. Miller DL, Hiravonen T. Synthesis of IgE by the human conceptus. J Allergy Clin Immunol, 1973; 52 : 182–188.
23. Nabavi M, Ghorbani R, Asadi AM, et al. Factors associated with cord blood IgE levels. Asian Pac J Allergy Immunol, 2013; 21 : 157–162.
24. Negele K, Heinrich J, Borte M, et al. Mode of delivery and development of atopic disease during the first 2 years of life. Pediatr Allergy Immunol, 2004; 15(1): 48–54.
25. Perkin MR, Strachan DP. Which aspects of the farming lifestyle explain the inverse association with childhood allergy? J Allergy Clin Immunol, 2006; 117 : 1374–1381.
26. Peters JL, Cohen S, Staudenmayer J, et al. Prenatal negative life events increases cord blood IgE: interactions with dust mite allergen and maternal atopy. Pediatr Allergy Immunol, 2012; 67 : 545–551.
27. Pfefferle PI, Sel S, Ege MJ, et al. Cord blood allergen-specific IgE is associated with reduced IFN-gamma production by cord blood cells: the Protection against Allergy-Study in Rural Environments (PASTURE) Study. J Allergy Clin Immunol, 2008; 122 : 711–716.
28. Prior E, Santhakumaran S, Gale C, et al. Breastfeeding after cesarean delivery: a systematic review and meta-analysis of world literature. Am J Clin Nutr, 2012; 95 : 1113–1135.
29. Rook GA, Brunet LR. Old friends for breakfast. Clin Exp Allergy, 2005; 35 : 841–842.
30. Scirica CV, Gold DR, Ryan L, et al. Predictors of cord blood IgE levels in children at risk for asthma and atopy. J Allergy Clin Immunol, 2007; 119 : 81–88.
31. Strachan DP. Family size, infection and atopy: the first decade of the “hygiene hypothesis”. Thorax, 2000; 55(Suppl 1): S2–10.
32. Thavagnanam S, Fleming J, Bromley A, et al. A meta-analysis of the association between Caesarean section and childhood asthma. Clin Exp Allergy, 2008; 38(4): 629–633.
33. Umetsu DT, DeKruyff RH. 99th Dahlem Conference on Infection, Inflammation and Chronic Inflammatory Disorders: Microbes, apoptosis and TIM-1 in the development of asthma. Clin Exp Immunol, 2010; 160 : 125–129.
34. Uzuner N, Hocaoglu AB, Erge DO, et al. Raised interleukin-13 levels in cord blood increases the risk of allergic sensitization at 5 years of age. Iran J Allergy Asthma Immunol, 2013; 12(2): 107–114.
35. Van Nimwegen FA, Penders J, Stobberingh EE, et al. Mode and place of delivery, gastrointestinal microbiota, and their influence on asthma and atopy. J Allergy Clin Immunol, 2011; 128 : 948–55 [e1-3].
36. Wright RJ, Visness CM, Calatroni A, et al. Prenatal maternal stress and cord blood innate and adaptive cytokine responses in an inner-city cohort. Am J Respir Crit Care Med, 2010; 182(1): 25–33.
37. Zhan Y, Collier F, Naselli G, et al. Cord blood monocyte-derived inflammatory cytokines suppress IL-2 and induce nonclassic "TH2-type" immunity associated with development of food allergy. Sci Transl Med, 2016; 8(321): 321ra8.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2016 Issue 4-
All articles in this issue
- Incidence, mortalita a rizikové faktory karcinomu prostaty
- Epidemiologický význam metabolického syndromu
- Diferenciální diagnostika virové etiologie suspektních příušnic ve vysoce proočkované populaci
- Faktory modifikujúce koncentráciu IgE v pupočníkovej krvi – pilotná štúdia
- Recidivující meningitidy a vrozený deficit komplementového systému
- IGRA metody v rutinním provozu – QuantiFERON®-TB Gold nebo T-SPOT®.TB?
- Výskyt Mycoplasma hominis a Ureaplasma urealyticum u žen s poruchou fertility
- Novinky v přístupu k virové hepatitidě E
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Výskyt Mycoplasma hominis a Ureaplasma urealyticum u žen s poruchou fertility
- IGRA metody v rutinním provozu – QuantiFERON®-TB Gold nebo T-SPOT®.TB?
- Epidemiologický význam metabolického syndromu
- Diferenciální diagnostika virové etiologie suspektních příušnic ve vysoce proočkované populaci
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

