-
Medical journals
- Career
Identifikace izolátů Mycobacterium spp. pomocí MALDI-TOF hmotnostní spektrometrie
Authors: J. Amlerová; V. Študentová; J. Hrabák
Authors‘ workplace: Ústav mikrobiologie, Lékařská fakulta a Fakultní nemocnice v Plzni, Univerzita Karlova
Published in: Epidemiol. Mikrobiol. Imunol. 63, 2014, č. 3, s. 195-198
Category: Review articles, original papers, case report
Overview
Cíl práce:
MALDI-TOF hmotnostní spektrometrie je v posledních letech široce zaváděna do diagnostických mikrobiologických laboratoří. Poskytuje levnou a rychlou metodu pro taxonomickou identifikaci bakterií a mikromycet. Kromě těchto aplikací je používána i pro detekci mechanismů antibiotické rezistence. V budoucnu lze očekávat další rozšíření i pro jiné aplikace v mikrobiologii. Cílem této studie bylo validovat MALDI-TOF hmotnostní spektrometrii pro identifikaci mykobakterií.Materiál a metody:
Do studie bylo zařazeno 30 izolátů Mycobacterium spp. izolovaných v laboratoři mykobakteriologie Fakultní nemocnice v Plzni. Druhová identifikace izolátů byla provedena biochemickými testy, genovými sondami a sekvenací genu pro 16S rRNA. Identifikace MALDI-TOF hmotnostní spektrometrií probíhala s využitím extrakce pomocí silikonových kuliček. Identifikace kmene sekvenací genu pro 16S rRNA byla považována za referenční metodu.Výsledky:
Pomocí MALDI-TOF hmotnostní spektrometrie byly správně identifikovány všechny izoláty Mycobacterium spp. (hodnota skóre 1,461–2,168). Jednalo se o druhy Mycobacterium tuberculosis (n = 5), Mycobacterium kansasii (n = 5), Mycobacterium avium (n = 6), Mycobacterium intracelullare (n = 3), Mycobacterium xenopi (n = 3), Mycobacterium gordonae (n=1), Mycobacterium abscessus (n=1), Mycobacterium kumamotonense (n=2), Mycobacterium mantenii (n = 1), Mycobacterium lentiflavum (n = 1), Mycobacterium fortuitum (n = 1), Mycobacterium scrofulaceum (n = 1).Závěr:
Identifikace hmotnostní spektrometrií je tedy vhodná k rutinní identifikaci Mycobacterium spp. v laboratořích, kde již je tato metoda zavedena pro konvenční identifikaci mikrobů.Klíčová slova:
MALDI-TOF MS – Mycobacterium tuberculosis – 16S rRNA – sekvenaceÚVOD
Česká republika patří v současné době mezi země s nízkým výskytem tuberkulózy. V roce 2012 bylo hlášeno do registru tuberkulózy 611 onemocnění tuberkulózou všech forem, lokalizací a recidiv, tj. incidence 5,8/100 000 obyvatel. Mykobakterióz bylo hlášeno 108, tj. incidence 0,1/100 000 obyvatel. Jako příčina mykobakterióz byl identifikován M. avium komplex (52 případů), M. xenopii (21) a M. kansasii (19) [1]. Přes tyto velmi příznivé údaje zůstává problematika tuberkulózy a onemocnění způsobených mykobakteriemi jiných druhů než Mycobacterium tuberculosis komplex (MOTT) stále aktuální. Tuberkulózní pacient představuje významné epidemiologické riziko, mykobakteriózy nabývají význam u imunokompromitovaných nemocných [2]. Zásadní součástí diagnostiky těchto onemocnění je laboratorní průkaz agens, identifikace kmene a stanovení citlivosti k antituberkulotikům.
Identifikace mykobakteriálních izolátů prodělala v poslední době velký vývoj. Klasické konvenční metody identifikace – morfologie, pigmentace, biochemické a další testy mají v diagnostice stále svoje nezastupitelné místo. Genetické metody hybridizační i amplifikační našly široké uplatnění pro svoji specificitu a senzitivitu a při použití komerčních souprav i pro svoje poměrně snadné provedení [3]. Při identifikaci vzácných nebo „problematických“ druhů je s dobrým úspěchem používána sekvenace genu pro 16S ribozomální RNA a následné porovnání sekvencí nukleotidů s databází NCBI (National Center for Biotechnology Information) [4]. V poslední době jsou zaváděny další metody, principiálně odlišné. Jednou z těchto metod je hmotnostní spektrometrie [5].
Hmotnostní spektrometrie je fyzikálně-chemická metoda, která umožní stanovit molekulovou hmotnost studovaných látek ve velkém rozsahu (cca 50 ≥ 50 000). V mikrobiologické diagnostice se využívá systém MALDI-TOF (Matrix-Assisted Laser Desorption/Ionization Time-of-Flight) hmotnostní spektrometrie (MALDI-TOF MS) [6].
Ionizace molekul ve vzorku probíhá pomocí laseru za přítomnosti matrice. V klinické mikrobiologii je tento systém využíván k identifikaci bakteriálních izolátů, dále k identifikaci kvasinek a vláknitých hub. Nově jsou zaváděny aplikace k detekci antibiotické rezistence [7]. Nabízí se také možnost použití pro identifikaci mykobakterií, zejména tam, kde je vhodné co nejširší využití tohoto přístrojového vybavení [8, 9].
MATERIÁL A METODY
Izoláty Mycobacterium spp.
Do studie bylo zařazeno 30 izolátů rodu Mycobacterium spp. deponovaných v Ústavu mikrobiologie LF UK a FN v Plzni (tab. 1). Vzorky byly uchovány v kryozkumavkách (ITEST Plus, Hradec Králové, Česká republika) a očkovány na pevné vaječné půdy (Löwenstein-Jensen a Ogawa; TRIOS, Olomouc, Česká republika) a do tekutého média (Middlebrook 7H12B) v lahvičkách pro detekční systém BACTECÒ MGITÔ 960.
Table 1. Druhy klinického materiálu Table 1. Types of clinical specimens 
Identifikace klasickými metodami
Mezi konvenční metody identifikace byly zahrnuty mikroskopická morfologie, makroskopická morfologie, pigmentace, test fotochromogenity, růst v různých teplotách, biochemické testy (produkce niacinu, redukce nitrátu, citlivost na hydrazid kyseliny thiofen-2-karbonové (TCH), hydrolýza Tweenu 80, průkaz arylsulfatázy, průkaz kyselé fosfatázy) [11].
Identifikace pomocí genových sond
Identifikace byla provedena podle návodu výrobce (genové sondy – GenProbe, San Diego, CA, USA). Genové sondy byly použity pouze pro dostupné druhy – komplex Mycobacterium tuberculosis, M. avium, M. intracellulare, M. kansasii a M. gordonae.
Identifikace pomocí sekvenace genu pro 16S rRNA
Mykobakteriální izoláty byly inaktivovány teplem (95 °C, 10 min). DNA byla izolována kitem PathogenFree DNA Isolation Kit (GeneProof, Brno, Česká republika). PCR amplifikace genu pro 16S RNA a sekvenace PCR produktů byla provedena podle Marchesi et al. [10]. Výsledné sekvence byly srovnány s databází GenBank (http://www.ncbi.nlm.nih.gov).
Identifikace pomocí MALDI-TOF hmotnostní spektrometrie
Pro identifikaci metodou MALDI-TOF MS byl použit postup doporučovaný výrobcem (Bruker Daltonik, Brémy, Německo). Byla použita 1 plná klička kmene z pevné vaječné půdy nebo 1 ml suspenze z tekuté půdy. Kultura byla inaktivována pomocí 1 ml 75% ethanolu s následnou centrifugací 5 min při 12 000xg. Peleta byla resuspendována v 500 µl sterilní destilované vody, směs byla centrifugována (5 min při 12 000×g) a výsledná peleta byla resuspendována v 50 µl sterilní destilované vody. Vzorky byly inkubovány 30 minut při 95 °C. K inaktivovaným vzorkům bylo přidáno 1,2 ml vychlazeného ethanolu (-20 °C), peleta byla vysušena při otevřené zkumavce při 35 °C (cca 10 minut). Následně byla suchá peleta resuspendována v 50 µl acetonitrilu. Poté bylo přidáno malé množství silikonových kuliček (průměru 0,5 mm) a intenzivně vortexováno po dobu 1 minuty. Po promíchání bylo přidáno 50 µl 70% kyseliny mravenčí a ihned centrifugováno (5 min při 12 000×g). 1 µl supernatantu byl nanesen na destičku pro hmotnostní spektrometrii a po usušení byl převrstven 1 µl matrice (roztok kyseliny skořicové). Naměřená spektra byla vyhodnocena pomocí MALDI Biotyper, verze 3.0 s databází Mycobacteria Library 1.0 (bead method).
Interpretace výsledků byla provedena podle hodnotových skóre a srovnáním pravděpodobnosti pořadí jednotlivých identifikovaných druhů.
VÝSLEDKY A DISKUSE
Výsledky identifikací u jednotlivých izolátů a různých metod jsou uvedeny v tabulce 2. Kromě druhů Mycobacterium tuberculosis komplex, M. avium, M. intracellulare, M. kansasii a M. gordonae se podařilo identifikovat i druhy, které nebylo možné určit biochemickými testy nebo genovou sondou (M. xenopi, M. gordonae, M. abscessus, M. kumamotonense, M. mantenii, M. lentiflavum, M. fortuitum, M. scrofulaceum).
Table 2. Výsledky identifikace (ID) Table 2. Identification results (ID) 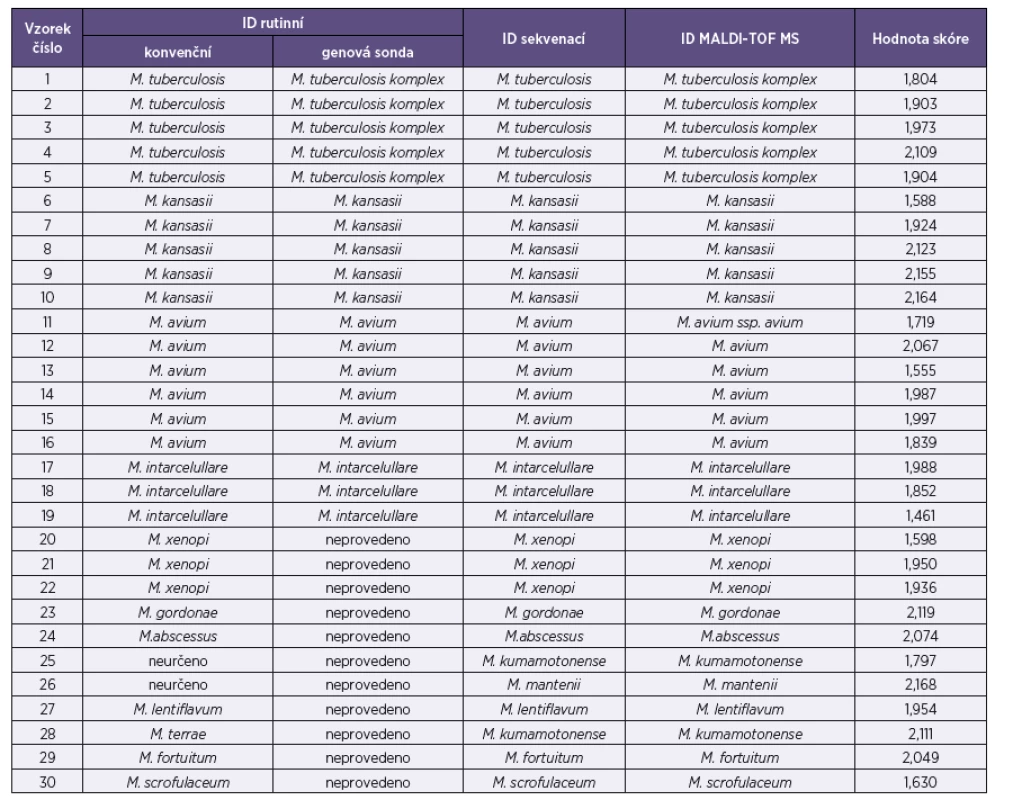
Hodnocení výsledků MALDI-TOF MS probíhalo v souladu s doporučením výrobce podle hodnotových skóre (tab. 3). Výsledky byly interpretovány v souvislosti s dalšími vlastnostmi izolátů a z hodnocení kvality spektra (charakter jednotlivých vrcholů spektra). Zásadní pro identifikace metodou MALDI-TOF MS se ukázala příprava izolátů. Bylo potřeba dostatečné množství mykobakteriální kultury. Druh kultivační půdy (vaječné nebo tekuté) neměl na kvalitu výsledných spekter vliv. Je nutné přesné dodržení množství reagencií a reakčních časů. Klíčovým problémem se ukázal druh silikonových kuliček, které při přípravě vzorku slouží jako inertní mechanický prostředek k narušení buněk. Při použití doporučeného druhu o průměru 0,5 mm byla lýza kultury dostatečná a získaná spektra kvalitní pro provedení identifikace. Další důležitou fází přípravy je úplné vysušení pelety před přidáním acetonitrilu. Vlastní měření spekter probíhalo až na výjimky manuálně s výběrem vhodných míst pro měření na pozici terčíku.
Table 3. Význam hodnot skóre výsledku metody MALDI-TOF MS Table 3. The significance of the MALDI-TOF MS score 
Srovnáním s identifikací pomocí sekvenace genu pro 16S rRNA se identifikace metodou MALDI-TOF MS ukázala být velmi spolehlivá, srovnatelná s ostatními, molekulárně-genetickými metodami. Přestože byly skóre u některých izolátů nižší, než doporučuje výrobce, bylo možné identifikaci uzavřít v kontextu s ostatními výsledky (např. pořadí a pravděpodobnost identifikovaných druhů) a ostatními diagnostickými znaky (např. morfologie kolonií). V případě nižších hodnot identifikačního skóre je nutné výsledky MALDI-TOF MS identifikace hodnotit vždy v kontextu s ostatními identifikačními technikami (morfologie kolonií, biochemické testy atp.). Výhodou této metody je bezesporu možnost identifikovat izoláty i jednotlivě, bez rizika exspirace diagnostických kitů. Časová náročnost je nízká (cca 2 hod). Materiálové náklady na vyšetření jednoho vzorku se pohybují cca 30 Kč (cena reagencií). Cenové náklady na přístrojové vybavení jsou ovšem vysoké. Tato metoda je proto vhodná zejména na pracovištích, která mají MALDI-TOF MS analyzátor již k dispozici i k jiným účelům.
Identifikace pomocí sekvenace genu pro 16S ribozomální RNA je metodou vysoce spolehlivou, ale velmi ekonomicky i časově nákladnou. Na většině pracovišť proto zůstává jako metoda specializovaná pro případy, u nichž jednodušší metody selhávají.
ZÁVĚR
Identifikace Mycobacterium spp. pomocí MALDI-TOF MS „klasickou“ extrakční metodou s využitím kyseliny mravenčí selhává. Výsledná spektra nejsou vhodná pro identifikaci. K rozrušení buněk je nezbytně nutné využít metodu se silikonovými kuličkami, které umožní optimální extrakci ribosomálních proteinů. Nezbytnou pro identifikaci je i využití speciální databáze určené pro Mycobacterium spp. V této konfiguraci lze dosáhnout výsledky srovnatelné se sekvenací genu pro 16S rRNA. MALDI-TOF MS je tedy spolehlivou metodou pro identifikaci Mycobacterium spp. využitelnou v rutinních diagnostických laboratořích i referenčních centrech.
Poděkování
Práce byla podpořena projektem PRVOUK P36 – Náhrada, podpora a regenerace funkce některých životně důležitých tkání a orgánů.
Do redakce došlo dne 22. 1. 2014.
Adresa pro korespondenci:
MUDr. Jana Amlerová
Ústav mikrobiologie
Fakultní nemocnice v Plzni
Dr. E. Beneše 13
306 05 Plzeň
e-mail: amlerova@fnplzen.cz
Sources
1. Ústav zdravotnických informací. Tuberkulóza a respirační nemoci 2012. Praha: ÚZIS, 2013. Available on: http://www.uzis.cz.
2. Tortoli E. Clinical manifestations of nontuberculous mycobacteria infections.Clin Microbiol Infect, 2009;15 : 906–910.
3. Drobniewski FA, Caws M, Gibson A, Young D. Modern laboratory diagnosis of tuberculosis. Lancet Infect Dis; 2003;3 : 141–147.
4. Slany M, Pavlik I. Molecular detection of nontuberculous mycobacteria: advantages and limits of a broad-range sequencing approach. J Mol Microbiol Biotechnol, 2012;22 : 268–276.
5. Seng P, et al. MALDI-TOF-mass spectrometry applications in clinical microbiology. Future Microbiol, 2010;5 : 1733–1754.
6. Shah HN, Gharbia SE. Mass Spectrometry for Microbial Proteomics, London: Wiley, 2010. ISBN 978-0-470-68199-2.
7. Hrabák J, Chudackova E, Walkova R. Matrix-Assisted Laser Desorption Ionization–Time of Flight (MALDI-TOF) Mass Spectrometry for Detection of Antibiotic Resistance Mechanisms: from Research to Routine Diagnosis. Clin Microb Rev, 2013;26 : 103–114.
8. Saleeb PG, Drake SK, Murray PR, Zelazny AM. Identification of Mycobacteria in Solid-Culture Media by Matrix-Assisted Laser Desorption Ionization–Time of Flight Mass Spectrometry. J Clin Microbiol, 2011;49 : 1790–1794.
9. Lotz A, et al. Rapid Identification of Mycobacterial Whole Cells in Solid and Liquid Culture Media by Matrix-Assisted Laser Desorption Ionization-Time of Flight Mass Spectrometry. J Clin Microbiol, 2010;48 : 4481–4486.
10. Marchesi JR, et al. Design and Evaluation of Useful Bacterium-Specific PCR Primers That Amplify Genes Coding for Bacterial 16S rRNA. Appl Environ Microbiol, 1997;64 : 795 – 799.
11. Havelková M, et al. Doporučené standardní metody v mikrobiologii mykobakteriálních infekcí. 1. vyd. Praha: SZÚ Praha ve spolupráci s firmou Trios s.r.o., 1998.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2014 Issue 3-
All articles in this issue
- Infekce vyvoláné lidskými alfa herpetickými viry
- Protikladný vývoj trendů incidence kapavky a syfilis ve východočeském regionu – 30 let surveillance
- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Výskyt a charakteristika termotolerantních kampylobakterů v potravinovém řetězci člověka
- Význam očkování proti chřipce u osob s kardiovaskulárním onemocněním
- Zhodnocení významu ready-made spaceru s gentamicinem ve vztahu k bakteriologickým nálezům u pacientů s infekcí kloubní náhrady
- Q-horečka jako profesionální onemocnění vedoucí k invaliditě – kazuistika
- Návrat spalniček do Ústeckého kraje
- Klinická a mikrobiologická charakteristika závažných infekcií spôsobených streptokokmi skupiny A
- Vplyv prípravkov určených na dezinfekciu kože, slizníc a rán na životaschopnosť biofilmovej formy rastu mikroorganizmov izolovaných od pacientov s katétrovými infekciami
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Rezistence k erytromycinu, ciprofloxacinu a k tetracyklinu u humánních izolátů Campylobacter spp. v České republice, vyšetřená standardní metodou EUCAST
- Výskyt a vlastnosti baktérií Staphylococcus aureus ve vepřovém mase
- Identifikace izolátů Mycobacterium spp. pomocí MALDI-TOF hmotnostní spektrometrie
- Profesionálna TBC na Slovensku a v Českej republike
- Avidita antifosfolipidových protilátek – naše současné znalosti
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Infekce vyvoláné lidskými alfa herpetickými viry
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

