-
Medical journals
- Career
Diagnostika černého kašle sérologickými technikami a metodou real-time PCR
: Mikešová Romana; Stiborová Ivana; Richter Josef; Rajnohová Dobiášová Lucie; Král Vlastimil
: Epidemiol. Mikrobiol. Imunol. 62, 2013, č. 3, s. 106-111
Cílem předkládané práce je shrnutí výsledků průkazu Bordetella pertussis (BP) a Bordetella parapertussis (BPP) metodou real-time PCR a sérologickými testy. V letech 2008–2010 bylo vyšetřeno na možnou přítomnost onemocnění pertusí 73 pacientů Oddělení klinické imunologie a alergologie Centra imunologie a mikrobiologie ZÚ Ústí nad Labem, vybraných podle kritérií WHO a ECDC, tj. s perzistencí kašle déle než 2 týdny.
Přímý průkaz DNA BP a BPP byl proveden soupravou pro real-time PCR z výplachu nosohltanu. Sérologická odpověď byla sledována metodou přímé aglutinace celkových protilátek a stanovením protilátek proti pertusovému toxinu ve třídách IgG, IgA a IgM metodou ELISA. Do souboru pacientů s prokázanou infekcí BP a/nebo BPP bylo zařazeno 42 jedinců rozdělených do dvou skupin: průkaz onemocnění metodou PCR (skupina A, n = 19), průkaz onemocnění pouze sérologickými metodami (skupina B, n = 23), přičemž pacienti ze skupiny A v 10 případech (52,6 %) vykazovali rovněž pozitivitu protilátkové odpovědi. Z našich výsledků je zřejmé, že pertuse by neměla být opomíjenou infekcí. Věříme, že zvýšená informovanost zdravotnické veřejnosti spolu se zkvalitněním laboratorních postupů pomohou v budoucnu odhalit vyšší procento případů nakažených touto, pro řadu lékařů stále ještě vnímanou jako „dětskou“, infekcí.Klíčová slova:
pertuse – perzistující kašel – černý kašelÚvod
Navzdory plošnému účinnému očkování proti černému kašli dochází v posledních letech ke stále častějšímu výskytu tohoto onemocnění i v naší republice, a to zejména v populaci adolescentů a dospělých jedinců [17, 22, 26]. Ti se stávají zdrojem infekce pro jedince nedostatečně proočkované, především děti ve věku do jednoho roku života a pro populaci s poklesem postvakcinační imunitní odpovědi. Řada studií prokázala, že velká část dospívajících a dospělých jedinců s perzistujícím kašlem je infikována některým z kmenů Bordetella [2, 8, 12, 13, 24, 25, 26]. Postvakcinační imunita po aplikaci acelulárních vakcín je poměrně krátká, nepřesahuje více než 5–8 let [3, 9, 17, 22, 26].
Světová zdravotnická organizace a rovněž tak Evropské centrum pro prevenci a kontrolu nemocí definuje onemocnění černým kašlem s použitím kritérií klinických příznaků perzistujícího dráždivého kašle s délkou trvání minimálně dva týdny spolu s potvrzením diagnózy laboratorními metodami [2, 8, 11, 22, 29]. Průběh onemocnění u vakcinovaných jedinců je odlišný, mírnější, často netypický [5, 13, 21, 26,]. Studie v USA prokázaly, že prevalence infekce může být v dospělé populaci s perzistujícím kašlem až 20% [13]. Nemocní pacienti s diagnózou perzistujícího kašle přicházejí v poslední době stále častěji i do ambulance klinického imunologa a alergologa [22]. Diferenciální diagnostika je obtížná, často je udáváno jako základní onemocnění postižení dýchacích cest, především astma, inhalační alergie a chronické plicní onemocnění [2, 9, 17, 24]. Ke správné diagnóze onemocnění přispívá znalost epidemiologické situace, sledování výskytu sezonních onemocnění a dobrá anamnéza. K potvrzení diagnózy je doporučeno laboratorní vyšetření pacienta [17].
Ačkoliv je kultivační průkaz černého kašle vysoce specifický, jeho senzitivita je nízká, a to i přes neustálé zlepšování kvality kultivačních médií. Citlivost záchytu se snižuje nejenom s délkou onemocnění, způsobem odběru materiálu a jeho transportem, ale i kvalitou zpracování biologického materiálu [2, 17, 24].
Sérologické metody vyžadují optimálně odběr dvou vzorků krve, vyšetření párových vzorků zkvalitňuje specifitu i senzitivitu průkazu [2, 14, 16, 17, 24, 27]. K dispozici je široké spektrum diagnostických souprav, jsou snahy o diagnostiku onemocnění z jednoho vzorku materiálu, např. i ze slin [18]. Jsou zkoumány možnosti odlišení postvakcinační protilátkové odpovědi od nálezů indukovaných onemocněním [3, 15].
Snahou překonat výše uvedené problémy v diagnostice pertuse je vývoj PCR souprav, které se stávají pro svoji senzitivitu i specificitu akceptovatelné a mohou být při zajištění vysoké úrovně standardizace optimálním řešením [1, 2, 10].
Před pěti lety jsme se rozhodli pro zkvalitnění diagnostiky pertuse a na našem pracovišti zavedli metodu PCR průkazu Bordetella pertussis a současně jsme rozšířili i diagnostiku sérologickou.
SOUBOR A METODIKA
V letech 2008–2010 jsme na našem pracovišti vyšetřili na možnou přítomnost pertuse 73 pacientů, vybraných podle kritéria WHO, tj. s perzistencí kašle déle než 2 týdny (graf 1), a to jak sérologickými technikami, tak rovněž metodou real-time PCR. Do souboru prokázaných onemocnění pertusí jsme zařadili celkem 42 vyšetřených jedinců (19 mužů a 23 žen) ve věkovém rozmezí 4–75 let (tab. 1). Pacienti s pozitivitou PCR průkazu byli zařazeni do skupiny A, u dalších pacientů tvořících skupina B, pak byla pertuse diagnostikována metodami sérologickými. Skupinu A tvoří 19 jedinců a skupinu B 23 vyšetřených. Z celkového počtu 42 námi vyšetřených pacientů s pozitivním nálezem byla u 12 zjištěna epidemiologická souvislost (rodinný výskyt).
1. Podíl záchytů v jednotlivých skupinách (n = 73) Fig. 1. Proportion of positive results by group (n = 73) 
1. Rozdělení souboru podle věku Table 1. Distribution of the study cohort according to age 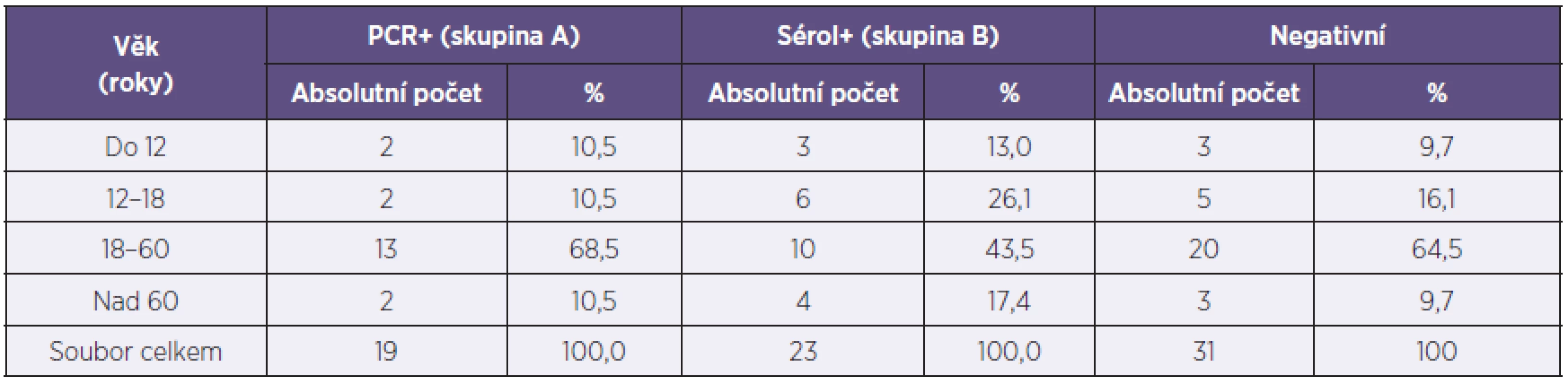
Sérologický průkaz byl proveden soupravou Toxin černého kašle ELISA testovací kit firmy Virotech a byla sledována kvantitativní protilátková odpověď v IgG, IgA a IgM pomocí jednotek Virotech podle návodu výrobce. Průkaz aglutinačních protilátek byl stanoven soupravou firmy Test-Line Bordetella pertussis-AR-Ag a Bordetella parapertussis-AR-Ag. Za signifikantní byl považován minimálně čtyřnásobný vzestup/pokles titru protilátek.
Průkaz DNA BP a BPP byl proveden metodou PCR s použitím soupravy pro real-time PCR na zařízení SmartCycler II (Cepheid) B.pertussis/B. parapertussis Primer and Probe Set, Cepheid, doplněné SmartMix HM bead, Cepheid. Výchozím materiálem byl výplach z nosohltanu získaný kloktáním 10 ml sterilního fyziologického roztoku po dobu cca 10 s. Materiál byl odebrán do sterilní zkumavky, centrifugován při 5 000 ot/min po dobu 15 minut. Následně byl odstraněn supernatant a ponecháno cca 0,5 ml sedimentu pro izolaci nukleové kyseliny soupravou firmy Qigen QIAamp MinElute Virus Spin Kit. Kit je primárně určen pro izolaci virové DNA či RNA z bezbuněčných tělních tekutin, lze ho však jako alternativu použít i pro izolaci bakteriální DNA.
U všech vyšetřených jedinců bylo provedeno celkové imunologické vyšetření v rozsahu odpovídajícím požadavkům žadatelem uvedené diagnózy a námi zjištěné anamnézy. U jedinců s perzistujícím kašlem jsme se ve vyšetření orientovali na spektrum ukazatelů uváděných v dostupné literatuře s ohledem na diferenciální diagnózu možných dalších příčin perzistujícího kašle [2, 22, 24].
VÝSLEDKY
Z celkového počtu 42 prokázaných onemocnění jsme potvrdili diagnózu pertuse metodou PCR u 19 jedinců (45,2 %) a pozitivitu průkazu protilátkové odpovědi u dalších 23 sledovaných (54,8 %). Ve skupině A PCR pozitivních, jsme nalezli pozitivitu BP u 17 jedinců (89,5 %), u 2 sledovaných (10,5 %) pak pozitivní nález jak BP tak BPP. V této skupině byly zjištěny aglutinační protilátky u 5 sledovaných (26,3 %) a protilátky proti pertusovému toxinu u 10 pacientů (52,6 %). Skupina A vykázala pozitivitu protilátkové odpovědi u 10 osob (52,6 %) – graf 2.
Ve skupině B byly zjištěny prokazatelné nálezy aglutininů u 17 sledovaných (73,9 %), pozitivní nález protilátek proti pertusovému toxinu u 14 sledovaných (60,9 %). Pozitivní nález pouze proti pertusovému toxinu byl zjištěn v této skupině u 6 vyšetřených (26,1 %) – viz graf 2.
2. Vzájemné vztahy diagnostiky infekce metodou PCR a sérologickými testy (absolutní počty) Fig. 2. Correlation between PCR and serological diagnosis of disease (abs. numbers) 
Z celkového počtu 42 vyšetřených pacientů s pozitivním nálezem byla u 12 osob zjištěna epidemiologická souvislost. Výsledky jednotlivých vyšetření a rodinné vztahy dokumentuje tabulka 2.
2. Výsledky jednotlivých testů (rodinný výskyt) Table 2. Results of the individual methods (families) 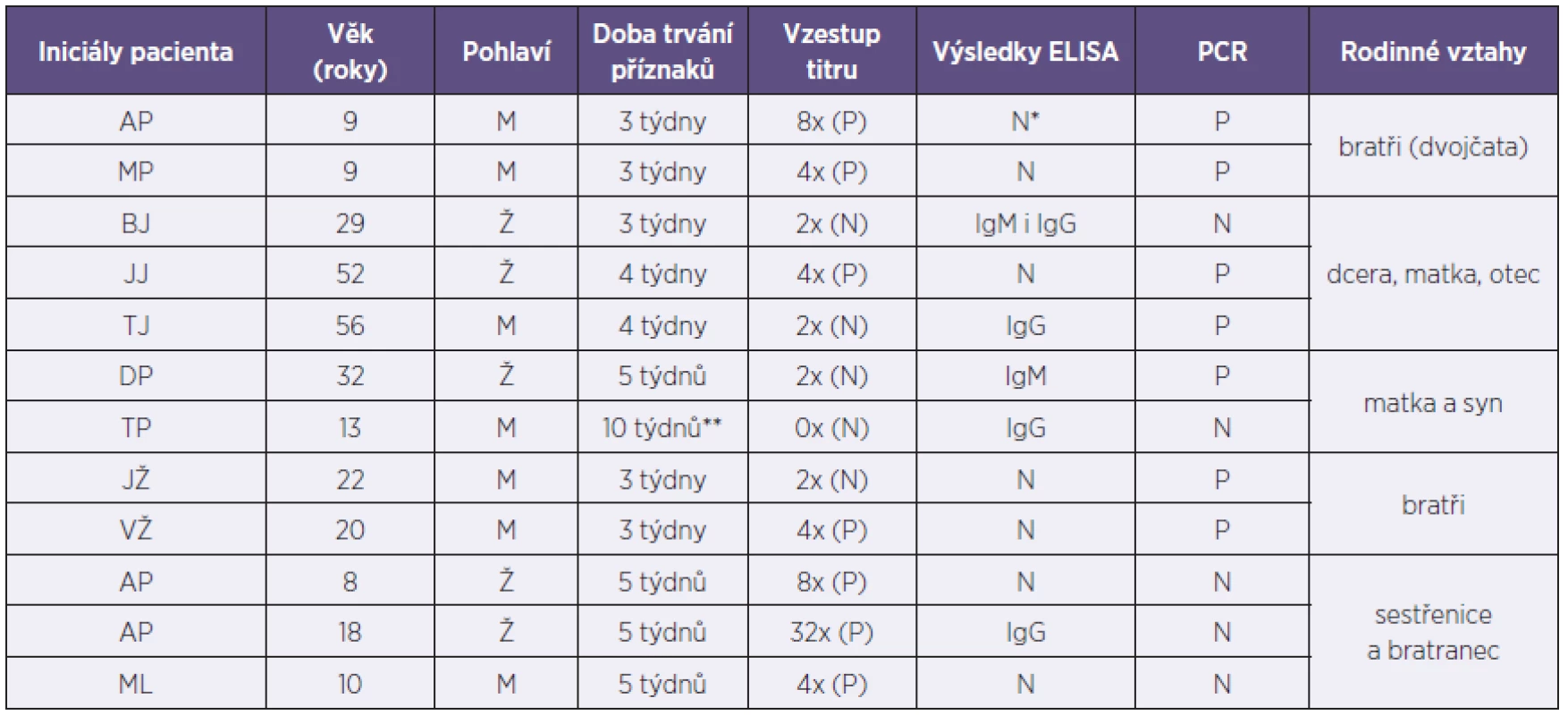
* při dalším vyšetření s odstupem cca 1 roku AP IgG+ (protilátky přetrvávají i při dalších odběrech min. cca 3 roky), bratr dvojče IgG neg. ** vyšetřeno retrospektivně pro kašel i matky Kliniky uváděná doplňující laboratorní kritéria nevykazují významný přínos pro diagnostiku onemocnění – ve skupině A i B byla leukocytóza u 21,1 %, respektive 17,4 % sledovaných a lymfocytóza pouze u 31,6 %, resp. 34,8 %, sledovaných.
Zánětlivá iritace dýchacích cest byla prokázána v obou skupinách vysokými hodnotami salivárního albuminu (85,7 %, respektive 60 %) a salivárního IgM (ve 100 %, respektive 90 % sledovaných).
Perzistující kašel v délce více jak 14 dnů byl kritériem pro volbu laboratorního průkazu pertuse a byl přítomen u 100 % sledovaných. V diferenciální diagnostice alergie byly nálezy specifických IgE proti inhalačním alergenům ve 31,6 %, respektive 34,8 % sledovaných, což odpovídá prevalenci výskytu alergických onemocnění. Chronický kašel, jako jeden z možných projevů alergického onemocnění, je proto třeba v našem regionu brát rovněž v diferenciální diagnostice v úvahu.
DISKUSE
Klinická diagnostika onemocnění černým kašlem je u vakcinované populace často obtížná. Dominujícím klinickým projevem zůstávají příznaky perzistujícího kašle s charakterem nespecifických zánětů horních cest dýchacích, či bronchitidy bez klasických projevů záchvatů kašle s apnoe, cyanózou, hypoxií a dalších projevů pro onemocnění dříve charakteristických [5, 8, 9, 14, 24]. Z výše zmiňovaných důvodů je pro diagnostiku onemocnění pertuse doporučováno kritérium přítomnosti perzistujícího kašle v délce trvání minimálně 14 dnů, jako jednoho z rozhodujících diagnostických měřítek, které by mělo vést k iniciaci cíleného laboratorního vyšetření [2, 5, 8, 11, 18, 21, 24, 29]. Přitom je nezbytné kalkulovat samozřejmě s řadou dalších onemocnění s obdobnými klinickými projevy, a tudíž vždy vycházet i z dobré informovanosti o aktuální epidemiologické situaci výskytu onemocnění, která přicházejí v úvahu [5, 8, 14, 17, 24, 25]. V ambulanci klinického imunologa je nezbytné odlišit rovněž onemocnění v této praxi se běžně vyskytující – alergická onemocnění, astma, CHOPN [8, 22, 25]. V naší ambulanci tvoří tyto diagnózy podstatnou část vyšetřovaných onemocnění, a jak ukazují naše nálezy, mohou i pacienti s výše uvedenými diagnózami tvořit významnou část jedinců infikovaných agens rodu Bordetella. V obou našich skupinách tvoří tito jedinci 1/3 všech pozitivních nálezů, což odpovídá prevalenci alergických onemocnění v naší republice.
V této studii jsme neměli zajištěny možnosti kultivačního průkazu onemocnění, což považujeme za nedostatek především proto, že dochází ke snížení záchytu onemocnění vyvolaných jinými druhy bordetel (např. B. holmesii, B. bronchiseptica, B. avium, B. hinzii aj.), u kterých se můžeme setkat se stejným klinickým průběhem [9, 27]. Význam kultivace potvrzují i nálezy záchytu různých kmenů BP jako etiologického agens onemocnění [7]. I když je dostupnost výsledků kultivace časově náročná, považujeme je za nezbytné. Podle našeho názoru je vhodné iniciovat nejenom kvalitní provedení odběru pro kultivační vyšetření, ale i další nezbytné předpoklady pro úspěšný záchyt všech mikrobiálních agens podílejících se na klinických projevech onemocnění pertusí [5, 6, 17].
Význam PCR diagnostiky onemocnění pertusí neustále roste, především pro rychlost a dostupnost výsledku, pro její značnou specificitu i senzitivitu [1, 4, 10, 27, 28]. Z tohoto důvodu považuje WHO i ECDC hodnocení pozitivní PCR nálezů jako měřítko definice onemocnění [2]. Real-time PCR je mnohem citlivější diagnostický postup pro BP, respektive BPP než kultivační nález, ale nezachytí další možná mikrobiální agens, která by se na klinických projevech typických pro onemocnění pertusí mohla podílet. Identifikace BP technikou PCR je udávána 4krát citlivější než průkaz kultivací [2]. V našem souboru jsme se pokusili využít zmiňované vysoké citlivosti molekulárně biologické metody a pro nižší nároky na zkušenosti odebírajícího a pro pacienty nesporně komfortnější formy odběru (v porovnání s výtěrem z nosohltanu) zavedli výplach nosohltanu popsanou technikou. V našich nálezech jsme zjistili u 2 pacientů koinfekci BP i BPP. Jsou popisovány i koinfekce různými kmeny BP [7]. Rovněž přichází v úvahu i koinfekce s dalšími druhy bordetel, a to opět zdůrazňuje význam kultivačního vyšetření. Real-time PCR metoda prokazuje perzistenci agens v průběhu onemocnění i po ATB léčbě [4]. Rovněž u našich pacientů jsme tyto nálezy mohli potvrdit [22]. V našem souboru jsme nalezli perzistenci pozitivních nálezu průkazu BP, respektive BPP metodu PCR po dobu delší než 6 týdnů od prvních potíží perzistujícího kašle. V literatuře jsme nenalezli obdobné výsledky. Nelze rovněž vyloučit opakovanou infekci v rámci rodu Bordetella. Je známo, že stanovení inzerční sekvence IS481 metodou PCR není přísně specifické pro druh Bordetella pertussis. Zmiňovaná sekvence se nachází i u druhu B. holmesii a může být přítomna i u některých kmenů B. bronchiseptica [10]. Podle našeho názoru nejsou tyto nálezy překážkou pro diagnózu klinické jednotky bordetelózy, jejíž projevy jsou v rámci různých druhů bordetel s velkou pravděpodobností podobné. V kvalitně vakcinované populaci dochází k lehčím a netypickým projevům onemocnění a to se výrazně neliší od průběhu onemocnění dalšími bordetelami [2, 5, 8, 9, 18, 24].
Sérologické metody mají i přes níže uvedené výhrady stále svá opodstatnění. Jednou z nejčastěji diskutovaných je časová náročnost diagnostiky vyplývající z nezbytnosti hodnocení dvou vzorků séra vyšetřovaného pacienta v odstupu minimálně 2 týdnů. Dále je v literatuře zmiňována poměrně nízká specificita a senzitivita těchto metod a v neposlední řadě je stále konstatována možnost zkreslení nálezu, především u vakcinovaných jedinců [2, 3, 8, 9, 15, 19, 20, 27]. Úvahy o využití jednoho vzorku pro diagnózu tohoto onemocnění (protilátky proti pertusovému toxinu) jsou stále otázkou diskusí, a ani v našem souboru jsme nenalezli pro hodnocení jednoznačnou odpověď [20]. Za perspektivní považujeme spíše stanovení avidity protilátek proti pertusovému toxinu [23]. Rovněž průkaz protilátek v jiných tělních tekutinách, např. ve slinách, nevykazuje dostatečnou specificitu i senzitivitu [18]. Považujeme však ve shodě s Bambergerem za významný diagnostický přínos sérologický průkaz v pozdní fázi onemocnění, kdy již mohou být metody přímého průkazu negativní (včetně PCR). Tyto nálezy jsme zjistili i u našich pacientů [2].
Sérologické metody mají stejně jako přímý průkaz agens (PCR, kultivace) svá omezení. Protilátková odpověď u vakcinovaných a nevakcinovaných jedinců je odlišná. V poslední době je snahou některých týmů odlišit postvakcinační protilátkovou odpověď od postinfekční [15]. To by znamenalo významné zlepšení specificity i senzitivity průkazu onemocnění sérologickými metodami. Vývoj a zlepšování kvality a rozšiřování spektra použitých antigenů ukazuje neustálý vzestup záchytu onemocnění u klinicky definované populace [9].
V našem souboru prezentujeme nálezy jak průkazu aglutinačních protilátek, tak průkazu specifických protilátek proti pertusovému toxinu. Obě metody mají svůj význam a zvyšují možnost specifické diagnostiky onemocnění.
ZÁVĚR
Další rozvoj metod průkazu pertuse přispěje k poznání skutečné incidence onemocnění v populaci a k dalším efektivním preventivním zásahům. Pertuse nemůže být opomíjenou infekcí a její časná a správná diagnostika může přispět k účelným epidemiologickým opatřením. Za vhodné považujeme posílení informovanosti odborné zdravotnické veřejnosti o problému tak, aby byla dodržována kritéria Evropské unie pro definování potvrzeného případu onemocnění zprostředkovaná cestou NRL SZÚ Praha.
Do redakce došlo dne 11. 6. 2013.
Adresa pro korespondenci:
Mgr. Romana Mikešová
Centrum imunologie a mikrobiologie
Zdravotní ústav se sídlem v Ústí nad Labem
Na Kabátě 229
400 11 Ústí nad Labem
email: romana.mikesova@zuusti.cz
Sources
1. André, P., Caro, V., Njamkepo, E., Wendelboe, A. M. et al. Comparison of Serological and Real-Time PCR Assays To Diagnose Bordetella pertussis Infection in 2007. J. Clin. Microbiol., 2008, 46, 5, p. 1672–1677.
2. Bamberger, E. S., Srugo, I. What is new in pertussis? Eur. J. Pediatr., 2008, 167, p. 133–139.
3. Baughman, A. L., Bisgard, K. M., Edwards, K. M., Guris, D. et al. Establishment of Diagnostic Cutoff Points for Level of Serum Antibodies to Pertussis Toxin, Filamentous Hemagglutinin, and Fimbriae in Adolescents and Adults in the United States. Clin. Diagn. Lab. Immunol., 2004, 11, 6, p. 1045–1053.
4. Bidet, P., Liquori, S., De Lauzanne, A., Caro, V. et al. Real--Time PCR Measurement of Persistence of Bordetella pertussis DNA in Nasopharyngeal Secretions during Antibiotic Treatment of Young Children with Pertussis. J. Clin. Microbiol., 2008, 46, 11, p. 3636–3638.
5. Blechová, Z. Opomíjená infekce – pertuse. Pediatr. pro Praxi, 2008, 9, 4, s. 223–226.
6. Caro, V., Guiso, N., Alberti, C., Liguori, S. et al. Proficiency Program for Real-Time PCR Diagnosis of Bordetella pertussis Infection in French Hospital Laboratories and at the French National Reference Center for Whooping Cough and other Bordetelloses. J. Clin. Microbiol., 2009, 47, 10, p. 3197–3203.
7. Cassiday, P. K., Tobin-D’Angelo, M., Watson, J. R., Wu, K. H. et al. Co-infection with two different strains of Bordetella pertussis in an infant. J. Med. Microbiol., 2008, 57, p. 388–391.
8. Cornia, P. B., Hersh, A. L., Lipsky, B. A., Newman, T. B. et al. Does This Coughing Adolescent or Adult Patient Have Pertussis? JAMA, 2010, 304, 8, p. 890–896.
9. Dalby, T., Harboe, Z. B., Krogfelt, K. A. Seroprevalence of Pertussis among Danish Patient with Cough of Unknown Etiology. Clin. Vaccine. Immunol., 2010, 17, 12, p. 2016–2033.
10. Fry, N. K., Duncan, J., Wagner, K., Tzivra, O. et al. Role of PCR in the diagnosis of pertussis infection in infants: 5 years´experience of provision of a same-day real-time PCR service in England and Wales from 2002 to 2007. J. Med. Microbiol., 2009, 58, p. 1023–1029.
11. Guiso, N., Berbers, G., Fry, N. K., He, Q. et al. What to do and what not to do in serological diagnosis of pertussis: recommendations from EU reference laboratories. Eur. J. Clin. Microbial. Infect. Dis., 2011, 30, p. 307–312.
12. Harnden, A., Grant, C., Harrison, T., Perera, R. et al. Whooping cough in school age children with persistent cough: prospective cohort study in primary care. BMJ, 2006, 333, p. 174–177.
13. Harnden, A. Easily Missed?: Whooping cough. BMJ, 2009, 338, p. 1772.
14. Holčíková, A., Štroblová, H., Jirsenská, Z. Může být v diagnostice pertuse přínosné stanovení IgG protilátek k pertusovému toxinu? Klin. Mikrobiol. Inf. Lék., 2006, 12, 5, s. 184–188.
15. Cherry, J. D., Heininger, U., Richards, D. M., Storsaeter, J. et al. Antibody Response Patterns to Bordetella pertussis Antigens in Vaccinated (Primed) and Unvaccinated (Unprimed) Young Children with Pertussis. Clin. Vaccine. Immunol., 2010, 17, 5, p. 741–747.
16. Kösters, K., Riffelmann, M., Dohrn, B., von König, C. H. Comparison of Five Commercial Enzyme-Linked Immunosorbent Assay for Detection of Antibodies to Bordetella pertussis. Clin. Diagn. Lab. Immunol., 2000, 7, 3, p. 422–426.
17. Kříž, B., Fabiánová, K., Maixnerová, M., Beneš, Č. et al. Pertuse – navracející se infekce? Epidemiol. Mikrobiol. Imunol., 2007, 56, 2, s. 51–65.
18. Litt, D. J., Samuel, D., Duncan, J., Harnden, A. et al. Detection of anti-pertussis toxin IgG in oral fluids for use in diagnosis and surveillance of Bordetella pertussis infection in children and young adults. J. Med. Microbiol., 2006, 55, p. 1223–1228.
19. Menzies, S. L., Kadwad, V., Pawloski, L. C., Lin, T. L. et al. Development and Analytical Validation of an Immunoassay for Quantifying Serum Anti-Pertussis Toxin Antibodies Resulting from Bordetella pertussis Infection. Clin. Vaccine. Immunol., 2009, 16, 12, p. 1781–1788.
20. Mertens, P. L., Stals, F. S., Steyerberg, E. W., Richardus, J. H. Sensitivity and specificity of single IgA and IgG antibody concentrations for early diagnosis of pertussis in adults: an evaluation for outbreak management in public health practise. BMC, Infectious Diseases, 2007, 7, p. 53.
21. Poláková, M. Chronický kašel v dětském věku. Problematika pertuse – Disertační práce. Masarykova univerzita – Lékařská fakulta, 2009.
22. Richter, J., Mikešová, R., Stiborová, I., Pohořská, J. et al. Onemocnění dávivým kašlem je časté i v praxi klinického imunologa. Alergie Supplement, 2012, 1, s. 43–46.
23. Stenger, R. M., Smits, M., Kuipers, B., Kessen, S. F. M. et al. Fast, Antigen-Saving Multiplex Immunoassay To Determine Levels and Avidity of Mouse Serum Antibodies to Pertussis, Diphtheria, and Tetanus Antigens. Clin Vaccine Immunol., 2011, 18, 4, p. 595–603.
24. Tozzi, A. E., Celentano, L. P., degli Atti, M. L. C., Salmaso, S. Diagnosis and management of pertussis. CMAJ, 2005, 172, p. 509–515.
25. Turner, S. An asthmatic child with a troublesome cough. BMJ, 2011, 342, p. c6846.
26. Vospělová, J., Zapletalová, J. Stále aktuální pertuse. Pediatr. pro Praxi, 2004, 4, s. 204–206.
27. Watanabe, M., Connelly, B., Weiss, A. A. Characterization of Serological Response to Pertussis. Clin. Vaccine. Immunol., 2006, 13, 3, p. 341–348.
28. Recommended standards for surveillance of selected vaccine-preventable disease. WHO/VB/03.01., 2003, p. 28–30.
29. Vyhláška č. 473/2008 Sb., o systému epidemiologické bdělosti pro vybrané infekce (Příloha č. 3 – Systém epidemiologické bdělosti dávivého kašle), s. 8015–8016.
Labels
Hygiene and epidemiology Medical virology Clinical microbiology
Article was published inEpidemiology, Microbiology, Immunology

2013 Issue 3-
All articles in this issue
- Treponema pallidum subspecies pallidum – the Causative Agent of Neurosyphilis
- Dengue Fever Cases in Czech Workers Returning from the Maldives
- Diagnosis of Whooping Cough by Serology and Real-Time PCR
- Prevalence of selected congenital anomalies in the Czech Republic: renal and cardiac anomalies and congenital chromosomal aberrations
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnosis of Whooping Cough by Serology and Real-Time PCR
- Treponema pallidum subspecies pallidum – the Causative Agent of Neurosyphilis
- Prevalence of selected congenital anomalies in the Czech Republic: renal and cardiac anomalies and congenital chromosomal aberrations
- Dengue Fever Cases in Czech Workers Returning from the Maldives
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

