-
Medical journals
- Career
Nesúlad medzi glykémiami a HbA1c – je možné vysvetlenie podľa biokinetického modelu glykácie?
Authors: Oliver Rácz 1; Peter Dombrovský 1; Vladimír Heriban 2; Marek Brenišin 1; Katarína Muriová 3
Authors‘ workplace: Ústav patologickej fyziológie LF UPJŠ v Košiciach 1; Všeobecná zdravotná poisťovňa, a. s., Bratislava 2; Nemocnica Poprad, a. s., Poprad 3
Published in: Diab Obez 2021; 21(41): 16-22
Category: Reviews
Overview
Podľa biokinetického modelu glykácie hemoglobínu nedávne hyperglykemické epizódy majú väčší vplyv na hladinu HbA1c ako tie, ktoré boli dávnejšie. V prvej časti práce sú prezentované výpočty pre modely sa stálou glykémiou a pre 24 a 60 dní trvajúce hyperglykemické epizódy, ktoré sa odohrali v rôznom období pred stanovením HbA1c. V druhej časti je analýza nesúladu medzi glykémiami a HbA1c vyjadreného glykačnou medzerou a glykačným indexom u 158 chorých s diabetes mellitus. Rozdiely v hladine HbA1c počítané podľa časového rozloženia hyperglykemických epizód podľa biokinetického modelu môžu byť v pozadí nesúladu medzi glykémiami a HbA1c.
Klíčová slova:
biokinetický model – diabetes mellitus – glykačný index – glykačná medzera – HbA1c
Úvod
Nesúlad medzi glykémiami a hodnotou HbA1c je v praktickej diabetológii častý problém a my sme sa tomu venovali už v období, keď neboli k dispozícii moderné validované metódy na stanovenie glykovaného hemoglobínu [1,2] a ani domáce monitorovanie glykémií nebolo bežné (Continuous Glucose Monitoring System – CGMS a flash monitoring v tomto období neexistoval). Aj dnes platnou základnou myšlienkou bolo, že HbA1c odráža glykémie posledných týždňov v integrovanej podobe a jeho hodnota nemusí byť v súlade s aktuálnou, rýchlo sa meniacou glykémiou. Náš názor sme potvrdili korelačnou analýzou medzi jednotlivými glykémiami, priemerom z glykemických profilov a údajov chorých, u ktorých sme mali k dispozícii viac hodnôt glykémií (tab. 1). Druhým závažným zistením bolo, že chronickými komplikáciami boli najviac ohrození tí diabetici, ktorí mali relatívne dobré glykémie (merané v diabetologickej ambulancii) a vysoký HbA1c. To znamená, že pri nesúlade treba viac veriť hodnote HbA1c a menej glykémiám. Na tom nič nemení ani to, že kritériá dobrej a zlej kompenzácie boli v tom období menej prísne ako teraz. Ak sa však nesúlad opakuje a nezodpovedá klinickému stavu vyšetreného, je potrebné komunikovať s odborníkom a vylúčiť rušivé momenty, ktoré môžu skresliť hodnotu HbA1c [3], tab. 2. Napriek tomu ostáva pomerne veľký počet chorých, u ktorých nesúlad glykémie a HbA1c nemá žiadne logické vysvetlenie. Nesúlad medzi očakávanou a skutočnou hodnotou HbA1c sa môže vyjadriť ako glykačná medzera v mmol/mol (glycation gap) alebo ako glykačný index (Glycation Index – GI), čo je pomer týchto dvoch hodnôt [4–9].
Table 1. Korelácia medzi HbA1c a aktuálnymi glykémiami, glykemickým profilom a priemerom glykémií počítaných z väčšieho počtu meraní 
Table 2. Rušivé momenty, ktoré môžu skresliť koncentráciu HbA1c 
Ciele práce
V prvej časti práce sú uvedené teoretické výpočty hodnôt HbA1c podľa biokinetického modelu pre stále glykémie a pre hyperglykemické epizódy, ktoré sa odohrali v rôznom čase pred meraním HbA1c.
Cieľom druhej časti našej práce bolo hodnotenie nesúladu medzi glykémiami a HbA1c pomocou „glykačného indexu“ (GI) u chorých s diabetes mellitus liečených a vyšetrených v bežných ambulantných podmienkach a analýza glykačného indexu na základe biokinetického modelu glykácie.
Metódy (časť 1) - biokinetický model klykácie hemoglobínu
Zmenu v názore, že HbA1c odráža glykémie za uplynulých 4 mesiacov rovnomerne, priniesla modelová štúdia Beacha z roku 1979 [10]. Biokinetický model vychádza z toho, že kinetika väzby glukózy na hemoglobín je reakcia prvého rádu (závisí od glykémie) a kinetika prežívania červených krviniek je reakcia nultého rádu (jej rýchlosť je stála). Na základe týchto údajov Beach vytvoril rovnice medzi stálou glykémiou a HbA1c {1} a medzi rôznymi hyperglykemickými epizódami, ktoré sa odohrali v rôznom časovom období pred meraním HbA1c {2}. Validita modelu bola neskôr potvrdená s úpravou rýchlostnej konštanty väzby glukózy na hemoglobín [11–14].
Rovnice biokinetického modelu
e – základ prirodzeného logaritmu (2.718) k – kinetická konštanta glykácie (podľa [4] 1,86.10-4 mmol/l.deň-1) g – glykémia v mmol/l t – doba života červených krviniek (120 dní)
A – nárast glykémie počas glykemickej epizódy oproti stabilnej X = e-k g. (120-t1) Y = e-k.g.A. (t1-t0) Z = e-k.g.t0; kde t0 a t1 – deň začiatku a konca hyperglykemickej epizódy![e – základ prirodzeného logaritmu (2.718) k – kinetická konštanta
glykácie (podľa [4] 1,86.10-4 mmol/l.deň-1) g – glykémia v mmol/l
t – doba života červených krviniek (120 dní)<br>
A – nárast glykémie počas glykemickej epizódy oproti stabilnej
X = e-k g. (120-t1) Y = e-k.g.A. (t1-t0) Z = e-k.g.t0; kde t0 a t1 – deň začiatku
a konca hyperglykemickej
epizódy](https://pl-master.mdcdn.cz/media/image_pdf/16b47867623f9679c80010d9fb65e2ef.png?version=1622134576)
Výsledky (časť 1)
Na grafe 1 je znázornená závislosť HbA1c od stálej glykémie v rozmedzí 5–25 mmol/l a v tab. 3 sú výpočty podľa rovnice {1} pre stále glykémie 6–8 mmol/l a pre modely 24-dňových hyperglykemických epizód, ktoré sa odohrali tesne pred meraním HbA1c a dávnejšie (glykémie 10, 15 a 20 mmol/l oproti 5 mmol/l (obr. 1).
Graph 1. Teoretická závislosť medzi stálou glykémiou a koncentráciou HbA1c podľa rovnice {1} 
Table 3. Výpočty podľa rovnice {1} pre stále glykémie 6–8 mmol/l a pre modely 24-dňových hyperglykemických epizód 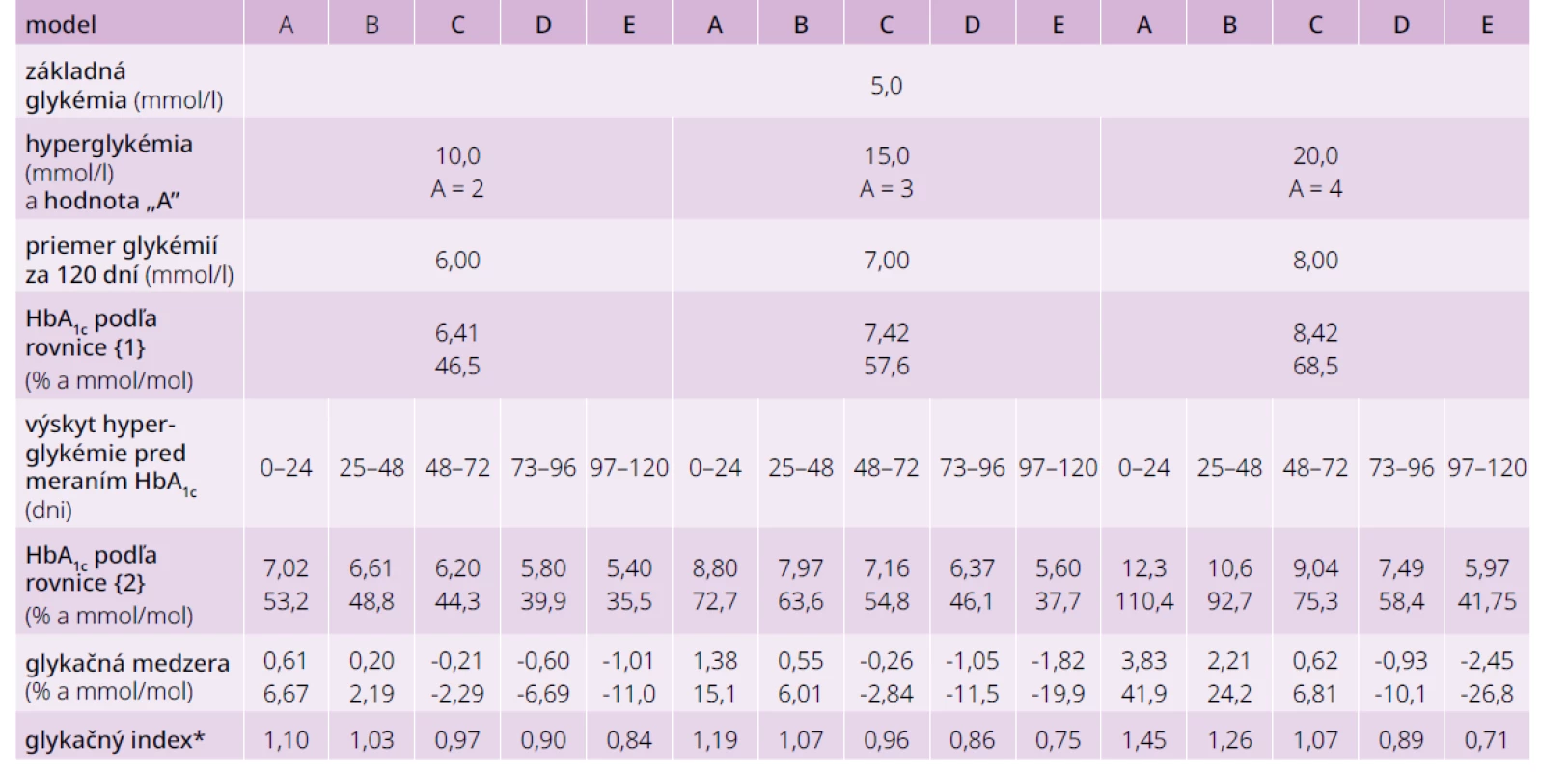
*identické hodnoty pre DCCT a IFCC jednotky Image 1. Modely 24-dňových hyperglykemických epizód, ktoré sa odohrali v rôznom časovom období pred meraním HbA1c 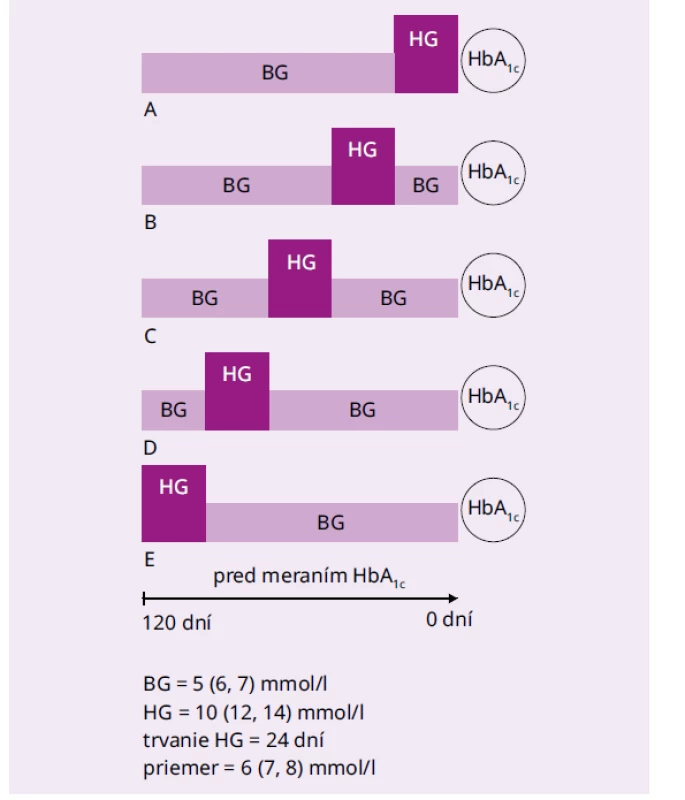
24-dňové hyperglykemické epizódy, ktoré sa odohrali tesne pred meraním HbA1c a dávnejšie. V tab. 3 sú výpočty HbA1c podľa biokinetického modelu pre bazálne glykémie (BG) 5, 6, a 7 mmol/l a zvýšenie glykémie (HG) počas epizódy o 5, 6, a 7 mmol/l. Na obr. 2 sú zrkadlové modely. Obidva modelovaní chorí mali dlho vysoké glykémie (60 dní 10 mmol/l) a 60 dní polovicu (5 mmol/l), len u jedného to bolo nedávno, u druhého dávno. V prvom prípade je hladina HbA1c podľa rovnice {2} 9,19 % (77,0 mmol/mol) a v druhom 6,63 (49,0 mmol/mol) Rozdiel medzi nimi je 2,56 % (28 mmol/mol) a glykačný index oproti HbA1c počítaného z priemernej glykémie 7,5 mol/l (7,92 %; 63,1 mmol/mol) 1,16 a 0,84.
Image 2. Modely zrkadlových hyperglykemických epizód 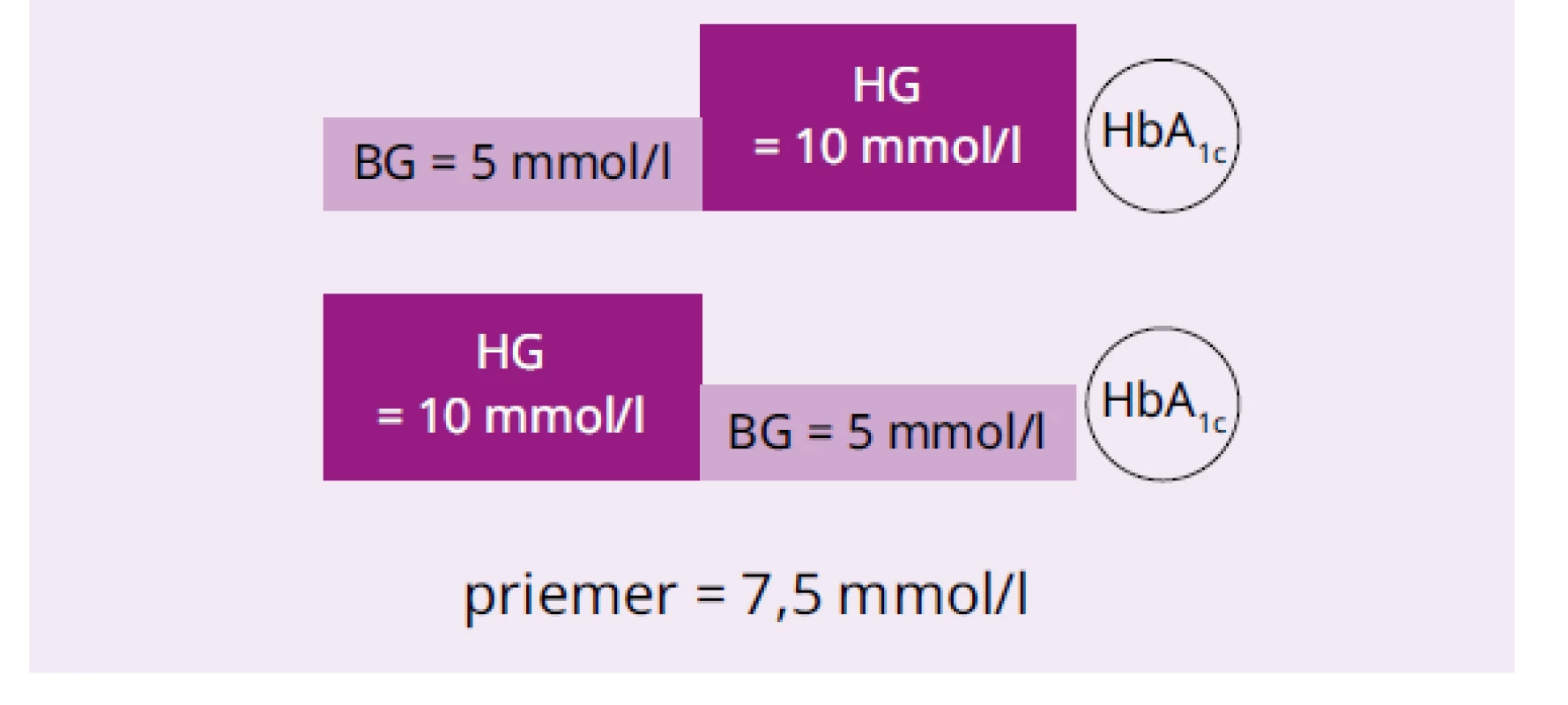
Súbor vyšetrených a metódy (časť 2)
Súbor tvorilo 158 chorých s diabetes mellitus liečených v diabetologickej ambulancii (67 mužov, 91 žien) vo veku 20–89 rokov (priemer 65 rokov). 37 z nich malo diabetes mellitus 1. typu a 121 diabetes mellitus 2. typu. Údaje pochádzajú z doby sledovania jednotlivcov od 1 do 4,2 roka (v priemere 2,57 roka). Pri prepočte na jeden rok sledovania pacientov bolo vykonaných v priemere 4,2 stanovení glykémie u jedného pacienta (min. 1; max. 9). Priemerná hodnota glykémie vypočítaná z priemerov glykémií u jednotlivcov počas ich sledovania bola 8,70 ± 2,25 mmol/l (min. 4,56; max. 19,03). Pri prepočte na 1 rok sledovania pacientov bolo vykonaných v priemere 1,51 meraní hladiny HbA1c u jedného pacienta (min. 0,25; max. 4,81). Priemerná hodnota HbA1c vypočítaná z priemerov jednotlivcov počas ich sledovania bola 8,30 ± 1,45 % (min. 4,75; max. 12,44) v jednotkách DCCT a 67,2 ± 15,9 mmol/mol (min. 28,7 mmol/mol; max. 112,5 mmol/mol) v jednotkách IFCC.
HbA1c bol počítaný z hodnôt glykémií na základe rovnice {1} a glykačný index (GI) ako pomer počítanej a skutočnej hodnoty HbA1c. Za „súlad“ sme považovali hodnotu GI medzi 0,95–1,05, hodnoty < 0,95 sme nazvali ako „nízke“ a > 1,05 ako „vysoké“.
Výsledky (časť 2)
Väčšina výsledkov (viac ako polovica) GI bola v oblasti „nízky GI“, menej bolo vo oblastiach „súlad“ a „vysoký GI“ (tab. 4). Následne sme analyzovali hodnoty glykémie a merané hodnoty HbA1c v jednotlivých skupinách podľa hodnoty glykačného indexu podľa priemernej glykémie vyšetrených (graf 2). Najvyššie hodnoty glykémie mali chorí s nízkym GI, najnižšie s vysokým GI. Rozdiely sú signifikantné na úrovni p < 0,001 medzi vysokým GI a nízkym GI a na úrovni p = 0,151 medzi „súladom“ a „vysokým GI“.
Table 4. Glykačný index u 158 chorých s diabetes mellitus 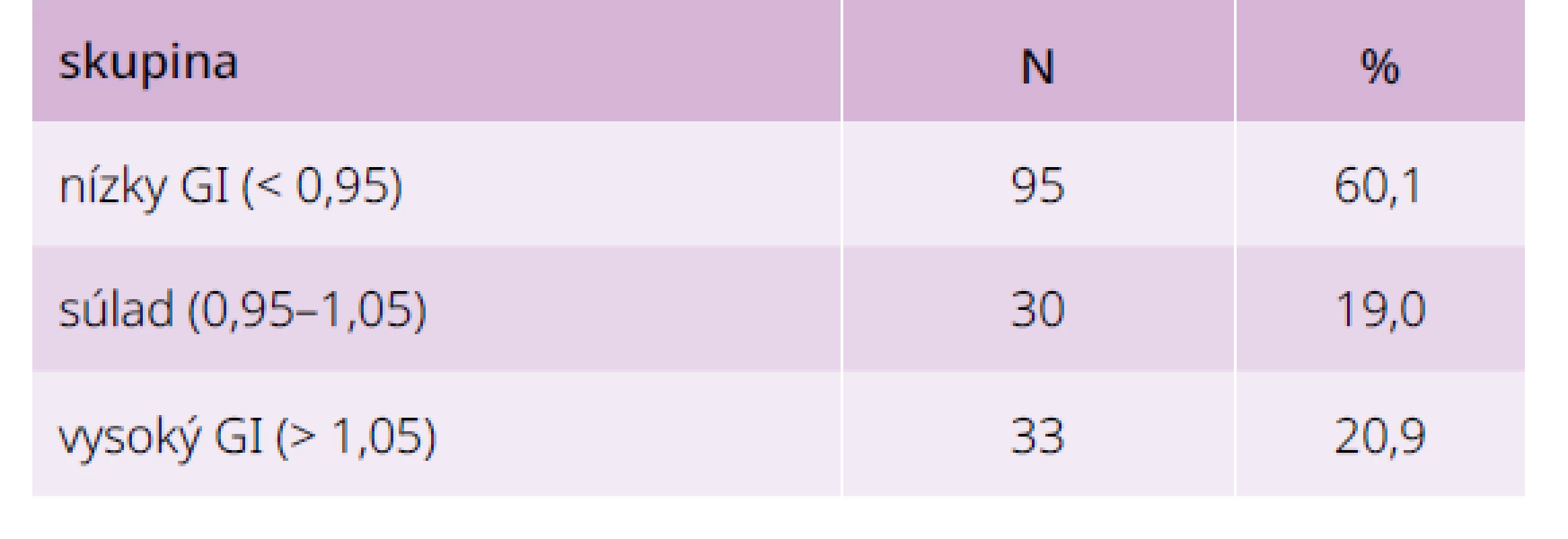
Graph 2. Priemerné glykémie chorých podľa hodnoty glykačného indexu 
Rozloženie hodnôt GI podľa priemernej glykémie vyšetrených uvádza tab. 5. Z výsledkov je zrejmé, že nesúlad medzi glykémiami a hodnotou HbA1c vyjadrený ako glykačný index (GI) je výrazný pri glykémiách > 7 mmol/l. Rozptyl hodnôt je však široký aj v tejto skupine a len menej ako jedna tretina má súlad medzi počítanou a skutočnou hodnotou HbA1c. Pri vyšších glykémiách je výrazný posun smerom k nízkemu GI.
Table 5. Glykačný index vyšetrených podľa ich priemernej glykémie 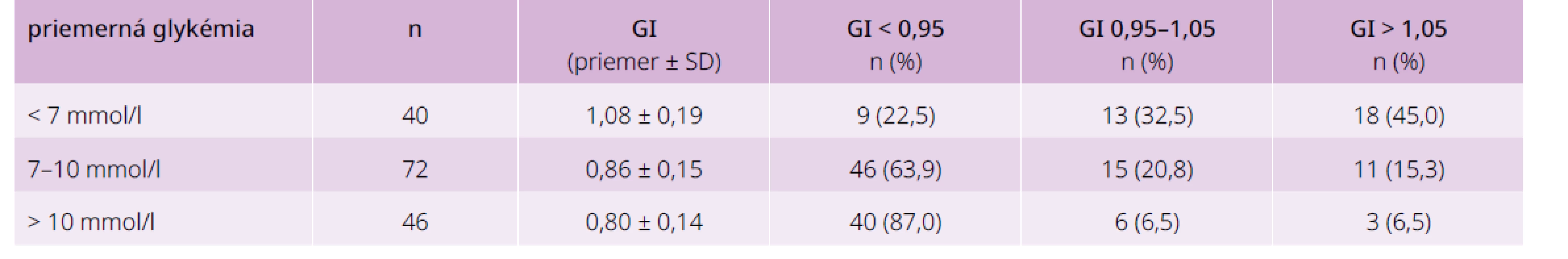
GI – glykemický index SD – smerodajná odchýlka Korelačná analýza súvislostí medzi počítanou a skutočnou hodnotou HbA1c je uvedená v tab. 6 a na grafe 3. Priebeh regresnej priamky pre skupinu so súladom GI je prakticky totožný s teoretickou, priamka pre nízky, resp. vysoký GI sa od teoretickej výrazne líši.
Table 6. Korelačná analýza súvislosti medzi priemernou glykémiou a HbA1c podľa biokinetického modelu a u vyšetrených v závislosti od ich glykačného indexu 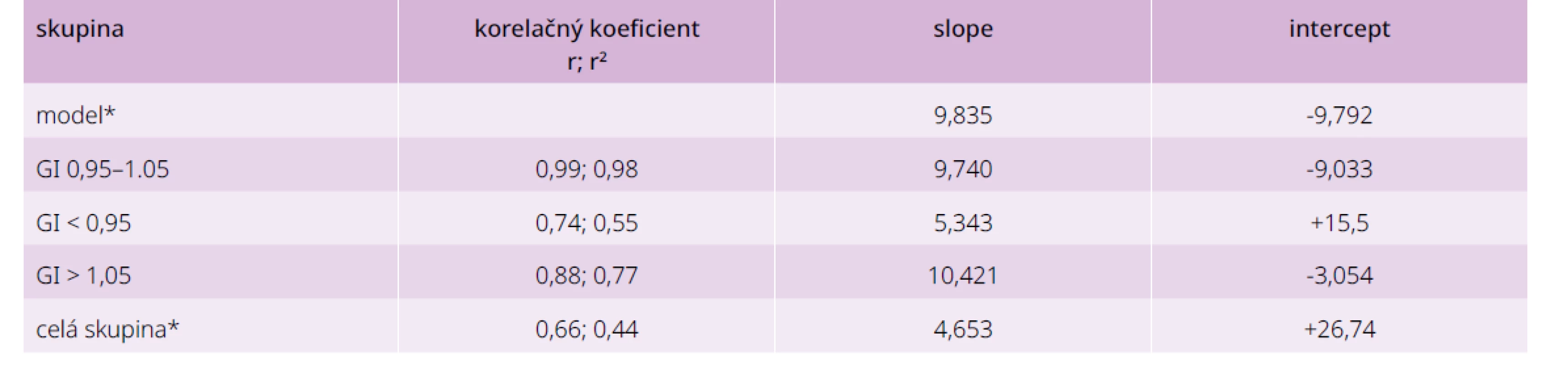
* nie sú znázornené na grafe 3 Graph 3. Regresné priamky medzi priemernou glykémiou a HbA1c pre jednotlivé skupiny glykačného indexu 
Číselné hodnoty rovníc pre regresné priamky viď tab. 6
(a) – nízky GI (b) – model a žiadny GI (c) – vysoký GIDiskusia a záver
Ukazovatele ako glykačná medzera a glykačný index a ich súvislosť s rozvojom chronických komplikácii diabetes mellitus sú užitočné z praktického hľadiska, ale nedávajú žiadne vysvetlenie podstaty diskordancie medzi glykémiami a HbA1c. V minulosti bolo možné nesúlad interpretovať tak, že glykémie sú len momentky a HbA1c poskytuje retrospektívny integrovaný obraz o glykemickej kompenzovanosti chorého s diabetes mellitus. Zavedením kontinuálneho monitorovania glykémie a ukazovateľov ako sú time in range (TIR), time above range (TAR) a time below range (TBR) sa situácia zmenila [15]. Návrat k biokinetickému modelu glykémie, ktorý v zjednodušenej forme tvrdí, že nedávne hyperglykémie majú na hladinu HbA1c väčší vplyv ako tie, ktoré sa odohrali dávnejšie, je preto opodstatnený (obr. 3).
Image 3. Jednoduché vysvetlenie biokinetického modelu glykácie hemoglobínu 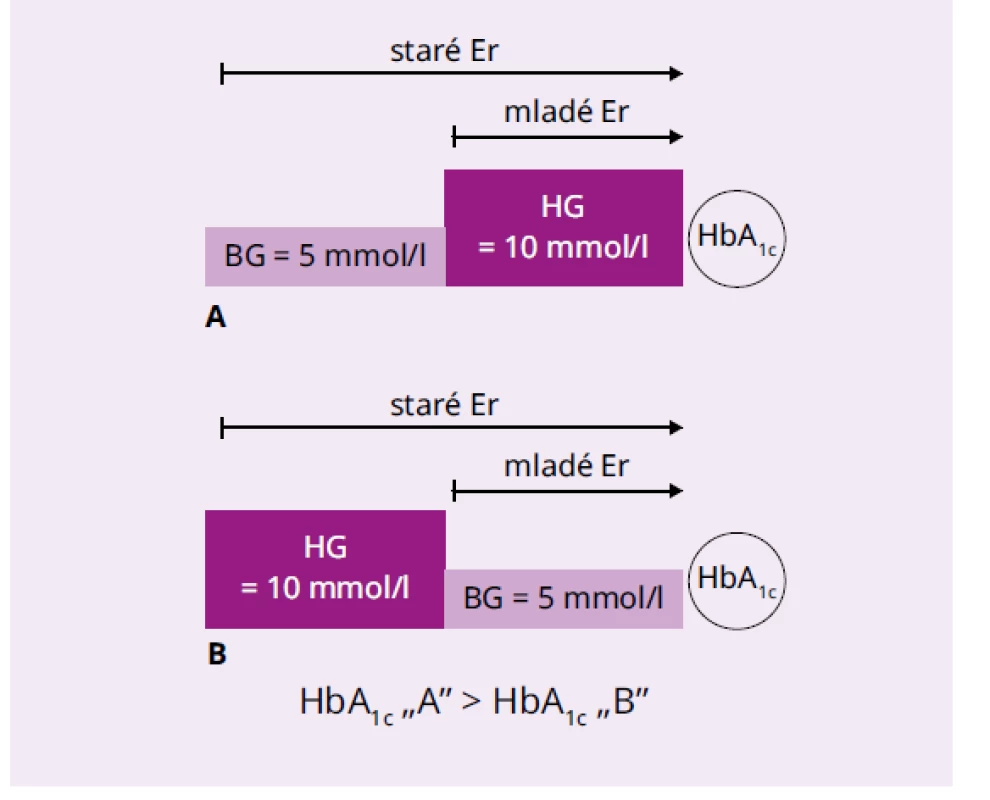
Staré červené krvinky kolovali v krvi počas celej doby ich života a „videli“ v obidvoch prípadoch (A,B) obdobie s hyperglykémiou a normálnou glykémiou. Hodnota HbA1c v nich zodpovedá priemernej glykémii 7,5 mmol/l. Mladé krvinky kolujú v krvi len nedávno a „videli“ len hyperglykémiu (A) alebo normálnu glykémiu nedávneho obdobia (B). Je v nich odlišná koncentrácia HbA1c. V odobratej krvi na 120. deň od sledovaného obdobia je zmes starých a mladých krviniek, a preto hodnota HbA1c bude vyššia v prípade nedávnej hyperglykémie ako dávnej. V prvej polovici našej práce sme ukázali možné modelované rozdiely v hladine HbA1c pri dlhodobých (24 a 60 dní) hyperglykemických epizódach v rôznom období pred meraním HbA1c. Rozdiely sú pomerne veľké, čo potvrdzuje náš názor, že vzťah glykémií a HbA1c nie je lineárny. Na druhej strane tieto modely sú vzdialené od skutočných situácií u chorých s diabetes mellitus. Preto sme analyzovali glykačnú medzeru a glykačný index na základe údajov z bežnej diabetologickej praxe a zistili sme, že pri pomerne prísnych kritériách (GI 0,95–1,00) len 19 % chorých má súlad medzi glykémiami a HbA1c, o niečo viac má vyšší HbA1c, ako by sme očakávali z výpočtu priemeru glykémií, a až 60 % má nižší HbA1c, ako by sa dalo očakávať z glykémií. Z aspektu biokinetického modelu to môže znamenať to, že chorí s vysokým GI mali nedávne hyperglykémie a s nízkym dávne. Rozbor hodnôt GI podľa glykémie a korelačná analýza závislosti HbA1c od glykémií však tento teoretický predpoklad nepotvrdzuje. Pri nižších glykémiách je pomer GI > 1,05 a < 0,95 opačný ako pri vyšších a hodnoty regresných rovníc pri nízkych a vysokých hodnotách GI sa líšia od modelu pri stálych glykémiách a od regresnej rovnice pri súladu medzi glykémiami a HbA1c.
Biokinetický model je založený na údajoch, ktoré predpokladajú konštantnú kinetickú konštantu väzby glukózy na hemoglobín a stálu životnosť červených krviniek a je pri splnení týchto atribútov správny. Model však nepočíta s rušivými faktormi (skupina „nie celkom objasnených činiteľov“, tab. 2), ktoré pri hyperglykémii môžu skresliť vzťah glykémií a HbA1c. Patrí sem enzýmová deglykácia hemoglobínu, skrátená životnosť červených krviniek pri zle kompenzovanom diabete, odstránenie vezikul zo starších červených krviniek, a tým strata HbA1c a iné [16–21]. Naše pozorovania nevylučujú tieto hypotetické možnosti, a preto na odpoveď otvorených otázok pripravujeme medzinárodný projekt s analýzou relevantných údajov veľkého počtu chorých s diabetes mellitus.
Prácu venujeme pamiatke RNDr. Eugena Futáša, CSc. (1943 – 2003), ktorý pred mnohými rokmi vypracoval počítačový program pre aplikáciu biokinetického modelu. Takisto ďakujeme jeho synovi Tomášovi za pomoc pri obnovení počítačového programu biokinetického modelu glykácie hemoglobínu. Poďakovanie patrí aj MUDr. Daniele Kuzmovej, ktorá nám pred mnohými rokmi výrazne pomáhala pochopiť správnu interpretáciu HbA1c v diabetologickej praxi.
doc. MUDr. Oliver Rácz, CSc.
www.patfyz.medic.upjs.sk
Doručené do redakcie | Received 29. 3. 2021
Prijaté po recenzii | Accepted 14. 4. 2021
Sources
- Rácz O, Futáš E, Kuzmová D, Reiter et al. Význam matematického modelu glykácie hemoglobínu pre diabetologickú prax. In: Zborník súhrnov IX. patofyziologického kongresu. Košice 1987 : 27.
- Rácz O, Vícha T, Pačin J. Glykohemoglobín, glykácia bielkovín a diabetes mellitus. Osveta: Martin 1989. ISBN 80–217–0072–6.
- Campbell L, Pepper T, Shipman K. HbA1c: a review of non-glycaemic variables. J Clin Pathol 2019; 72(1): 12–19. Dostupné z DOI: <http://dx.doi.org/10.1136/jclinpath-2017–204755>.
- Soros AA, Chalew SA, McCarter RJ et al. Hemoglobin glycation index: a robust measure of hemoglobin A1c in pediatric type 1 diabetes patients. Pediatric Diabetes 2010; 11(7): 455–461. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1399–5448.2009.00630.x>.
- Rodriguez-Segade S, Rodríguez J, García Lopez JM et al. Estimation of the glycation gap in diabetic patients with stable glycemic control Diabetes Care 2012; 35(12): 2447–2450. Dostupné z DOI: <http://dx.doi.org/10.2337/dc11–2450>.
- van Steen SC, Schrieks IC, Hoekstra JB et al. The haemoglobin glycation index as predictor of diabetes-related complications in the AleCardio trial. Prevent Cardiol 2017; 24(8): 858–866. Dostupné z DOI: <http://dx.doi.org/10.1177/2047487317692664>.
- Hempe JM, Liu S, Myers L et al. The hemoglobin glycation index identifies subpopulations with harms or benefits from intensive treatment in the ACCORD trial. Diabetes Care 2015; 38(6): 1067–1074. Dostupné z DOI: <http://dx.doi.org/10.2337/dc14–1844>.
- Feng L, Nian S, Zhao Y et al. Higher HbA1c and/or glucose levels alter the association patterns between glycated hemoglobin and fasting glucose levels. Diab Res Clin Pract 2018; 142 : 353–362. Dostupné z DOI: <http://dx.doi.org/10.1016/j.diabres.2018.06.011>.
- Nayak AU, Singh BM, Dunmore SJ. Potential clinical error arising from use of HbA1c in diabetes: effects of the glycation gap. Endocrine Rev 2019; 40(4): 988–999. Dostupné z DOI: <http://dx.doi.org/10.1210/er.2018–00284>.
- Beach KW. A theoretical model to predict the behaviour of glycosylated hemoglobin levels. J Theor Biol 1979; 81(3): 547–561. Dostupné z DOI: <http://dx.doi.org/10.1016/0022–5193(79)90052–3>.
- Mortensen HB, Volund A. Application of a biokinetic model for prediction and assessment of glycated hemoglobins in diabetic patients. Scand J Clin Lab Invest 1988; 48(6): 595–602. Dostupné z DOI: <http://dx.doi.org/10.3109/00365518809085778>.
- Ladyzynski P, Wójcicki JM, Bak M et al. Validation of hemoglobin glycation models using glycemia monitoring in vivo and culturing of erythrocytes in vitro. Ann Biomed Eng 2008; 36(7): 1188–1202. Dostupné z DOI: <http://dx.doi.org/10.1007/s10439–008–9508-x>.
- Ladyzynski P, Wójcicki JM, Bak M et al. Hemoglobin glycation rate constant in non-diabetic individuals. Ann Biomed Eng 2011; 39(11):2721–34. Dostupné z DOI: >http://dx.doi.org/10.1007/s10439–011–0366–6>.
- Ladyzynski P, Foltyński P, Sabalińska S et al. An analysis of the hemoglobin glycation rate in the A1C-derived average glucose study population applying a Monte Carlo method. In: 6th European Conference of the International Federation for Medical and Biological Engineering. IFMBE Proceedings book series (IFMBE) 2015; 45 : 435–438. Dostupné z DOI: <https://doi.org/10.1007/978–3-319–11128–5_109>.
- Advani A. Positioning time in range in diabetes management. Diabetologia 2020; 63(2): 242–252. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–019–05027–0>.
- Virtue MA, Furne JK, Nuttall FQ et al. Relationship between GHb concentration and erythrocyte survival determined from breath carbon monoxide concentration. Diab Care 2004; 27(4): 931–935. Dostupné z DOI: <http://dx.doi.org/10.2337/diacare.27.4.931>.
- Cohen RM, Franco RS, Joiner CH. Is poor glycemic control associated with reduced red blood cell lifespan? Diabetes Care 2004; 27 : 1013–1014. Dostupné z DOI: <http://dx.doi.org/10.2337/diacare.27.4.1013>.
- Cohen RM, Franco RS, Khera PK et al. Red cell life span heterogeneity in hematologically normal people is sufficient to alter HbA1c. Blood 2008; 112(10): 4284–4291. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2008–04–154112>.
- Willekens FL, Roerdinkholder-Stoelwinder YA, Groenen-Döpp HJ et al. Hemoglobin loss from erythrocytes in vivo results from spleen facilitated vesiculation. Blood 2003; 101(2): 747–751. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2002–02–0500>.
- Delpierre GD, Vertommen D, Communi MH et al. Identification of fructosamine residues deglycated by fructosamine-3-kinase in human hemoglobin. J Biol Chem 2004; 279(26): 27613–27620. Dostupné z DOI: <http://dx.doi.org/10.1074/jbc.M402091200>.
- Dunmore SJ, Al-Derawi AS, Nayak AU et al. Evidence that differences in fructosamine-3-kinase activity may be associated with the glycation gap in human diabetes. Diabetes 2018; 67(1): 131–136. Dostupné z DOI: <http://dx.doi.org/10.2337/db17–0441>.
Labels
Diabetology Obesitology
Article was published inDiabetes and obesity

2021 Issue 41-
All articles in this issue
- Diabetologie – obor spolupráce českých a slovenských zdravotníků
- The potential of induced pluripotent stem cells in the study and treatment of monogenic diabetes
- Discordance between blood glucose and HbA1c – is an explanation possible according to the biokinetic model of glycation?
- News in the field of 2nd generation of basal insulin analogs in type 1 diabetes and data from continuous glucose monitoring
- Specifics of choosing antidiabetic treatment for elderly patients with type 2 diabetes mellitus
- Studies with SGLT2 inhibitors primarily focused on renal parameters in patients with chronic kidney disease with/without type 2 diabetes mellitus
- What helps us in deciding on antidiabetic treatment for individual patients – case reports from routine clinical practice
- Familial chylomicronemia – pathogenesis, clinical manifestations and a case report
- A improving adherence to treatment – metformin XR
- What new antidiabetic drugs can do in present clinical practice
- Today we can influence overweight and obesity – and thus prevent their consequences, as is the development of diabetes or cardiovascular disease
- Education of diabetic patients during the COVID-19 pandemic
-
Spomienka na primára
MUDr. Jindřicha Šimurdu - Viatris Inc. vstupuje aj na slovenský trh ako farmaceutická spoločnosť nového druhu pripravená uspokojovať vyvíjajúce sa potreby zdravotnej starostlivosti na celom svete
- Diabetes and obesity
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Discordance between blood glucose and HbA1c – is an explanation possible according to the biokinetic model of glycation?
- The potential of induced pluripotent stem cells in the study and treatment of monogenic diabetes
- Today we can influence overweight and obesity – and thus prevent their consequences, as is the development of diabetes or cardiovascular disease
- News in the field of 2nd generation of basal insulin analogs in type 1 diabetes and data from continuous glucose monitoring
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

