-
Medical journals
- Career
Cytologické vyšetření mozkomíšního moku
Authors: Jaroslava Dušková 1,2; Ondřej Sobek 2
Authors‘ workplace: Ústav patologie 1. LF UK a VFN 1; Laboratoř pro likvorologii, neuroimunologii, patologii a speciální diagnostiku, Topelex s. r. o., Praha 2
Published in: Čes.-slov. Patol., 55, 2019, No. 3, p. 145-157
Category: Reviews Article
Overview
Cytologické vyšetření mozkomíšního moku (MM) má určitá specifika. V preanalytické fázi vzhledem k odběru do zkumavky bez fixace a hypoonkotické povaze s rychlou degradací buněk vzniká nutnost zpracování do 2-3 hodin. V analytické fázi je třeba počítat s kvantitativním limitem při pravidelném paralelním zpracování cytologickém a metodami nemorfologickými. Pravidelným vstupním krokem cytologického vyšetření je zjištění celularity. I oligocytární vzorky mohou vykazovat závažné cytologické nálezy.
V kategorii zánětlivých procesů má cytologická diagnóza hnisavé meningitis stanovená v řádu několika málo hodin zásadní vliv na prognózu onemocnění. Nehnisavé záněty jsou v širší diferenciální diagnóze specifikovány nejen cytologickým obrazem, nýbrž i paralelními nemorfologickými vyšetřeními cílenými na průkaz infekčního agens nebo autoimunní povahy zánětu. Nádorové procesy v intermeningeálním prostoru vyžadují zpravidla imunocytochemickou verifikaci. Minimální množství MM pro imunocytochemická došetření je 3-5 ml, požadavek na tato vyšetření vzniklý základním zhodnocením může znamenat nutnost odběru dalšího vzorku.
Při dodržení odpovídajících postupů a interpretaci v kontextu paralelních nemorfologických vyšetření může cytologické vyšetření MM zásadním způsobem přispět k diagnóze patologických stavů v likvorových prostorech.
Klíčová slova:
cytologie mozkomíšního moku – Meningitis – roztroušená skleróza – intrakraniální krvácení – karcinóza mening
Mozkomíšní mok představuje ve spektru cytologických vyšetření velmi specifický materiál z hlediska přístupu. Propojení morfologických a nemorfologických vyšetření se zde uplatňovalo od počátku. Prosazuje se v poslední době větší měrou i do jiných typů vzorků (výpotky, obsahy pankreatických cyst). To, co činí mozkomíšní mok (MM) výjimečně cenným v diagnostice širokého spektra onemocnění likvorových prostor, resp. mozku a míchy, je relativně obtížnější získávání a skoro vždy přítomné omezení dané aktuálně získaným množstvím MM ve vztahu k potřebám komplexního vyšetření.
Anatomie a fyziologie: MM je čirá bezbarvá tekutina v množství přibližně 150 ml produkovaná v choroidálních plexech (malou měrou i v ependymu a endotelu) postranních mozkových komor o objemu 25ml; z nich se cestou třetí a čtvrté komory mozkové dostává skrz foramen Magendie a foramina Luschkae do subarachnoidálního prostoru - zde se nachází zbylých 125 ml. Je resorbována ve villi duroarachnoidales podél sinus sagitalis superior.
Úloha MM se neomezuje pouze na mechanickou ochranu a nadlehčení mozku. Plní i významné funkce metabolické. Během 24 hodin se obmění čtyřikrát. Normální tlak MM vleže u dospělého se pohybuje mezi 10-15 mm Hg, 3-4 mm Hg u dětí (1).
Historická poznámka
Přítomnost tekutiny v mozku byla sice známa již Hippokratovi a Galénovi, považovali ji však za jev patologický. První skutečně vědecké pojednání o MM napsal mezi roky 1741-1744 švédský důlní inženýr Emanuel Swedenborg, který se rozhodl, inspirován hledáním zdrojů podzemních vod i svou teologickou orientací, nalézt sídlo duše. Po důkladném studiu anatomie mozku u nejlepších anatomů ve Francii, Německu a Itálii napsal vědecké pojednání o MM. Vzhledem k odlišné profesi však pro ně nenalezl důvěru u oslovených nakladatelů. Jeho dílo bylo nalezeno, po právu oceněno a publikováno v překladu až o 150 let později v roce 1887 (2). Další vývoj poznání anatomických detailů nám připomínají jména, která jsou zvěčněna v anatomické terminologii: foramen Magendie (francouzský fyziolog Francois Magendie -1783-1855), foramina Luschkae (německý anatom Hubert von Luschka - 1820-1875).
Lumbální punkce byly prováděny již koncem 19. století (3,4). Ve dvacátém století vznikají několikasetstránkové monografie o MM (5,6).
Vývoj našeho písemnictví o MM je smutně poznamenán osudem profesora české části Karlovy university Leo Taussiga ( 1884-1944), rodáka z Tlustic na Hořovicku. Jeho pozoruhodně komplexní monografie o mozkomíšním moku o 440 stranách psaná česky a publikovaná v Praze již v roce 1926 (7) je ve světových databázích prakticky nevyhledatelná. Taussigův osud se tragicky podobá osudu dr. Oskara Fischera – krátce patologa, později profesora psychiatrie a neurologie německé části pražské lékařské fakulty Karlovy university. Tento autor průlomových prací o nemoci pojmenované později po mnichovském vědci Alzheimerovi zahynul v roce 1942 v Terezíně. Jeho studie o demenci zvané dnes Alzheimerova byly doceněny mnohem později (8). Leo Taussig byl do Terezína deportován v roce 1942, zahynul v roce 1944 v Osvětimi.
Výzkum likvorového prostoru pokračuje; recentně např. studiem signálních kaskád a vztahů mozkomíšního moku a intersticiální tekutiny (1,9).
Jaká je současná úloha likvorové cytologie?
Vzhledem k intimnímu vztahu MM k nervové tkáni a patologickým procesům v ní a poměrně malému objemu (cca 150 ml) odráží MM biochemické, energeticko-metabolické, imunologické a celulární procesy v CNS mnohem citlivěji a specifičtěji než případné vyšetření krve. Je zcela běžnou klinickou situací, kdy při hrubě patologickém likvorovém nálezu nejsou přítomny žádné patologické alterace krevních laboratorních parametrů.
Přehled indikací k vyšetření MM podává schéma č. 1.
Kontraindikací odběru MM je nitrolební hypertenze, kterou vyloučí vyšetření očního pozadí před odběrem, popř. CT / MRI mozku. Před provedením odběru MM je nutné též korigovat případné poruchy krevní srážlivosti (např. závažnou trombocytopenii).
Technika odběru MM a transport
MM se získává rutinně z páteřního kanálu lumbální punkcí v prostoru L3/4, L4/5, popř. L5/S1 v množství zpravidla 10-15 ml u dospělého pacienta. Používá se sterilní odběrový materiál (zkumavky bez protisrážlivých aditiv!). Atraumatická jehla minimalizuje postpunkční únik likvoru odpovědný za likvorovou hypotenzi a související obtíže (bolesti hlavy, závratě, nauzeu). Paralelně (tj. do cca 30 min.) s odběrem MM je odebírána i plná - srážlivá krev (opět 10-15 ml), neboť pro výpočet a interpretaci řady laboratorních likvorologických parametrů je nutné znát jejich paralelní sérové hodnoty.
Méně obvyklou a nyní již rutinně prakticky nepoužívanou metodou odběru MM je subokcipitální punkce cisterna magna prováděná pod os occipitale mediálně přes atlantookcipitální membránu; rizikem je nabodnutí aberantně probíhajících cév (a. vertebralis, a. cerebelli inf. post.) s potenciálně fatálním intrakraniálním krvácením. Odběr MM přímo z mozkových komor (komorová punkce) je již řazen mezi neurochirurgické výkony.
Akreditovaná laboratoř vyšetřující MM má požadavky na odběrové nádobky, množství MM a zejména nutnost rychlého transportu do laboratoře popsánu v požadavcích na preanalytickou fázi vyšetření. MM je výjimečně citlivým materiálem pro svou hypoonkotickou povahu vedoucí k rychlé degradaci buněk a limitovaný objem vzorku, který je po odběru dělen pro vyšetření nemorfologická a vyšetření cytologické; jím se bude převážně zabývat následující text. Zpracování MM pro cytologické vyšetření by mělo být provedeno do dvou, maximálně tří hodin po odběru – je tedy nanejvýš žádoucí, aby byl požadavek klinického pracoviště na zpracování MM do laboratoře hlášen s předstihem s ohledem na skutečnost, že se zpravidla nejedná o pracoviště s nepřetržitou pracovní dobou a hrozí znehodnocení vzorku.
Zpracování MM pro cytologické vyšetření
Kvantitativní hodnocení - stanovení buněčnosti
Provádí se ve Fuchsově-Rosenthalově komůrce o obsahu 3,1 ul.:
K 100 µl MM přidat do zkumavky 10 µl barvicího roztoku.
Složení barvicího roztoku: metylenová modř 0,1g, ledová kyselina octová 2,02 ml, čištěná voda ad 50 ml (vydrží 1 rok)
Postup stanovení počtu jaderných elementů:
- Ve zkumavce smícháme 100 µl MM a 10 µl barvicího roztoku, opatrně protřepeme.
- Pipetou směs opatrně naneseme do Fuchsovy-Rosenthalovy počítací komůrky pod umístěné krycí sklíčko. Vhodná doba k počítání je asi 5 až 10 minut po opatrném promíchání (při vyšší krevní příměsi se doporučuje čas prodloužit, aby došlo k dokonalé hemolýze erytrocytů). Jaderné elementy lze počítat i z nativního materiálu – barvení je doporučováno hlavně při vyšší arteficiální krevní příměsi, nebo při zvýšeném množství nečistot.
Stanovení počtu erytrocytů se provádí z nativního vzorku.
Kvalitativní hodnocení
Cytologický preparát MM je vytvořen nejčastěji cytocentrifugací (s nižším počtem otáček 1100/min.), případně cytosedimentací. Trvalý preparát je pro základní hodnocení standardně barven dle Giemsy, hematoxylinem-eozinem případně polychromem. Laboratoř cytopatologie provede na likvorový vzorek podle klinického zadání a diferenciálně diagnostické rozvahy diagnostika i speciální barvení k identifikaci předpokládaných substrátů fagocytózy (barvení na železo, olejová červeň), barvení bakterioskopická a k vyšetření kvasinek (Gram, Ziehl - Neelsen, PAS) a imunocytochemické průkazy v souladu s diferenciálně diagnostickým zadáním. Omezení představuje výše zmíněná nutnost dělení vzorku pro vyšetření cytologická a nemorfologická. V současné realitě narůstajících nároků na detailní vyšetření je způsob krokového postupu se šetřením vzorku limitovaného rozsahu i ekonomických vstupů nezbytností nejen cytologických, ale i bioptických vyšetření. Praktickým krokem při vyšetření MM je proto zajištění dostatečného počtu rezervních preparátů pro speciální došetření; zejména při diferenciálně diagnostické úvaze o možném nádorovém postižení likvorového prostoru pak rezervních preparátů na adhezivní podložní skla pro imunocytochemické postupy.
Fyziologický nález
MM je čirá tekutina s malým obsahem buněk – normální celularita nepřesahuje 4 elementy /1 ul. Z tohoto množství 65-80 % tvoří malé lymfocyty, zbytek monocyty. Nejsou přítomny aktivované formy (plasmatické buňky, makrofágy s projevy fagocytární aktivity). Další krevní elementy včetně erytrocytů mohou být přítomny v důsledku traumatické kontaminace při odběru, nebo jsou nálezem patologickým – viz dále. Ve vztahu k přítomným erytrocytům (bez známek úklidové reakce) lze jako kontaminaci interpretovat ojedinělé neutrofilní a eozinofilní granulocyty, buňky ependymální výstelky přítomné někdy v drobných můstky propojených skupinkách. Další možné kontaminanty s ojedinělým výskytem představují metachromatické elementy chrupavky, dlaždicové epitelie, cylindrické buňky – vesměs s pravidelnými cytologickými charakteristikami usnadňujícími jejich správné zařazení (obr. 1 A-D).
Image 1. (A) Kontaminantní meningotelie. MGG, 400x. (B) Kontaminantní meningotelie. Kohezivní skupinka lehce narušených buněk s mírnou anizokaryózou. Zprava přiléhají větší měrou narušené buňky monocytoidní. MGG, 400x. (C) Kontaminantní chondrocyty. Metachromatická cytoplazma. MGG, 1000x. (D) Kontaminantní chondrocyty. Metachromatická cytoplazma. MGG, 400x. 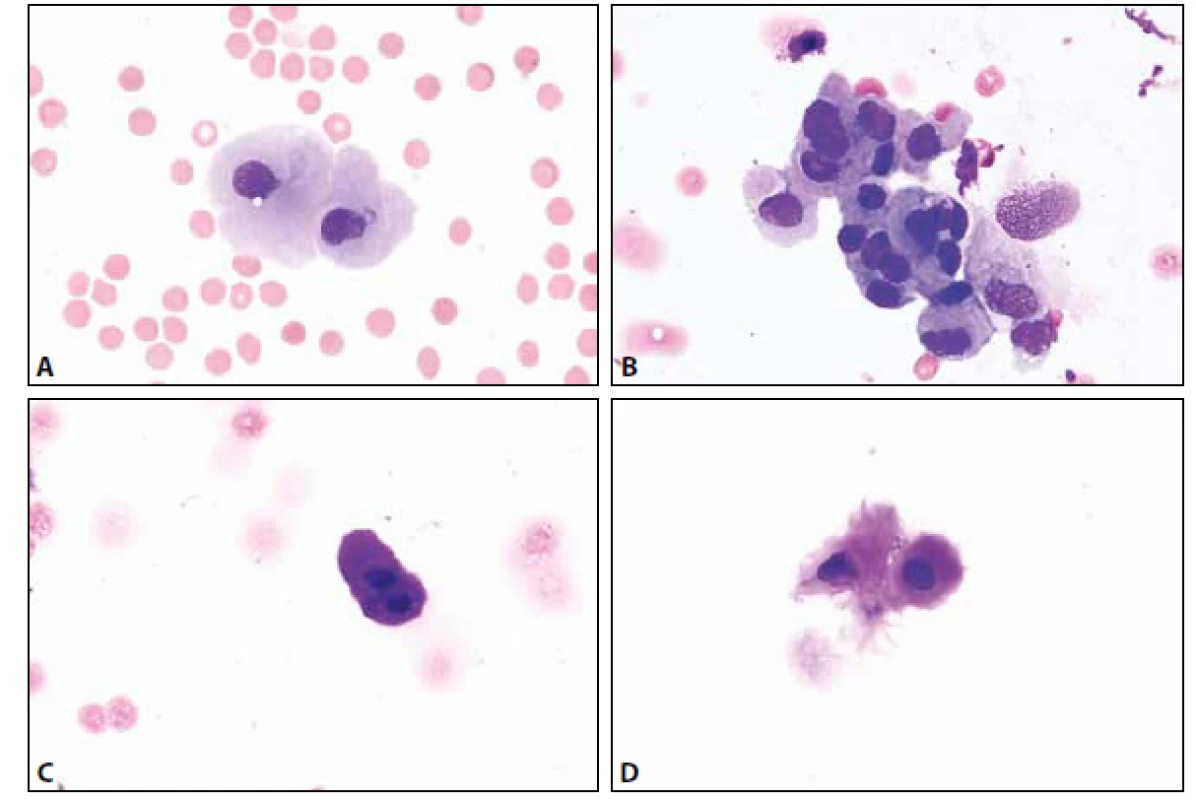
Nejčastější patologické stavy a ilustrační kazuistiky
Převážná většina patologických cytologických nálezů v MM vykazuje zvýšený počet buněk – pleocytózu, patologické buněčné složení však může mít i MM oligocytární. Podle převažující buněčné řady klasifikujeme jak pleocytární, tak oligocytární MM dále jako lymfocytární, monocytární, granulocytární nebo tumorózní.
Obrazy úklidové reakce posthemoragické, lipofagické spolu s klasickými metodami jejich ověření i fagocytóza neutrofilních granulocytů v hojení hnisavého zánětu jsou patologům dobře známé z mnoha jiných běžně vyšetřovaných lokalit (obr. 2A-C).
Image 2. (A) Erytrofygocytóza v rámci tkáňové léze. V cytoplazmě makrofága zčásti odbarvené erytrocyty. Neutrofilní granulocyt jako známka tkáňové léze ve fázi iniciálního pohlcení. (B) Úklidová reakce v barvení olejovou červení. Dystrofické steatóza neutrofilních granulocytů, pozitivita lipidů v cytoplazmě makrofágů. (C) Úklidová reakce posthemoragická. Makrofágy s železitým pigmentem. MGG, 400. 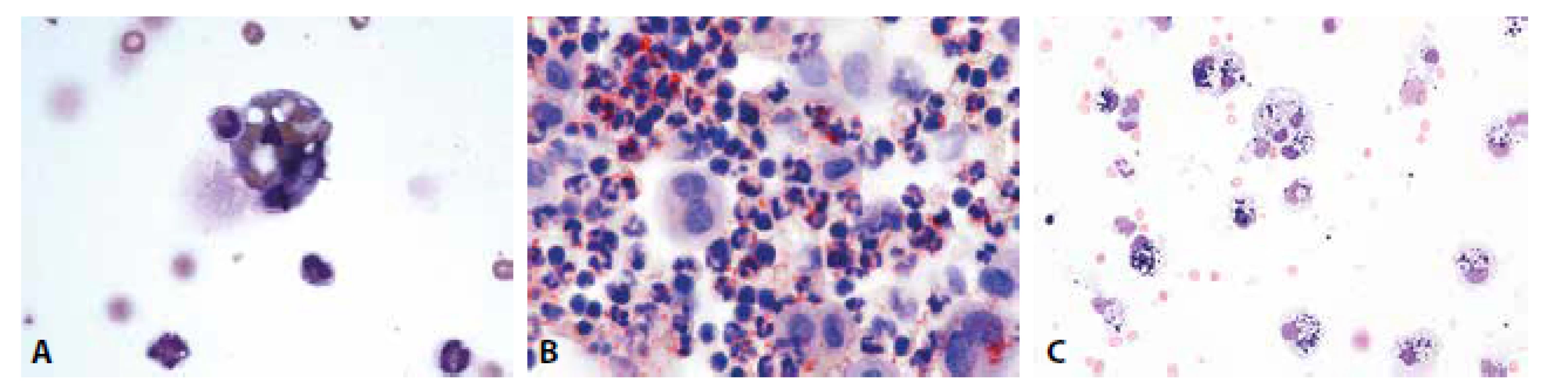
Záněty v likvorovém prostoru vykazují rovněž společné znaky s cytologickými obrazy např. v coelomových dutinách. Určitým specifikem při vyšetření MM je nezbytnost diferenciálně diagnostického pohledu zahrnujícího neuropatologické diagnostické jednotky (např. autoimunní demyelinizace, systémové degenerace, neuroinfekce). Zde představuje zřejmý přínos úzká spolupráce patologa a klinického neurologa pro mezioborovou interpretaci nálezů cytopatologických a výsledků (ilustrační kazuistiky 1-3).
Ilustrační případ 1 – hnisavá meningitida
19letá žena. Náhlý vzniklá nauzea, zvracení, během 12 hodin rozvoj poruchy vědomí.
Příjem materiálu do laboratoře (15 : 33h)
Základní likvorologický nález: (16 : 31h)
- jaderné elementy: 9130 /µl , Erytrocyty: 1109 /ul
- granulocytární pleocytóza v cytologickém obraze s přítomností extra - a intracelulárních bakterií (obr. 3A,B)
- výrazně zvýšená permeabilita hematolikvorové bariery (celková bílkovina v MM 6,9 g/l),
- anaerobní metabolismus v likvorovém kompartmentu (glukóza v MM <0,01 mmol/l, laktát MM 11,69 mmol/l, KEB -21004).
Image 3. Ilustrační případ 1. Hnisavá meningitis. (A) Neutrofilně granulocytární pleocytóza. MGG, 400x. (B) Extra- i intracelulární přítomnost diplokoků. Gram. 400x. 
Laboratorní nález zhodnocen jako purulentní bakteriální zánět.
PCR detekována přítomnost Neisseria meningitidis v MM (19 : 47h)
Definitivní laboratorní závěr: meningokoková neuroinfekce
Komentář: Časové údaje uvedené v této kazuistice dokumentují zásadní význam rychlé diagnózy hnisavé meningitidy pro prognózu onemocnění. Vlastní cytopatologický nález neutrofilní pleocytózy není náročný na rozpoznání. Diagnózu doplní základní a rozšířené laboratorní parametry neuroinfekce (tab. 1A, B).
Tab. č. 1a. Základní laboratorní parametry v MM u hnisavé neuroinfekce. 
GP - Granulocytární pleocytóza Tab. č. 1b. Rozšířené likvorologické parametry u hnisavého zánětu. 
Hrubě alterované jsou základní biochemické parametry - výrazné zvýšení celkové bílkoviny
v likvoru, dané extrémně zvýšenou permeabilitou hemato-likvorové bariery při tomto typu zánětu. Dochází rovněž k výrazným metabolicko - energetickým změnám s rozvojem anaerobního metabolismu, daným vysokou energetickou náročností zánětlivého procesu – zejména oxidativním vzplanutím neutrofilních granulocytů při fagocytóze bakterií. Jako funkční parametr intenzity fagocytární aktivity slouží výpočet tzv. koeficientu energetické bilance (KEB), vycházející z metabolismu aerobní vs. anaerobní glykolýzy:
Výpočet udává de facto průměrný počet molekµl ATP vyprodukovaných za aktuálních energetických poměrů v likvoru z jedné molekuly glukózy. Jeho hodnoty se za fyziologických okolností pohybují v rozmezí 28 – 38. U bakteriálních neuroinfekcí (a zpravidla i u nádorových infiltrací) jsou jeho hodnoty velmi nízké až záporné a informují nás o oxidačním vzplanutí profesionálních fagocytů (neutrofilní granulocyty, makrofágy). U serózních neuroinfekcí jsou hodnoty KEB snížené podstatně méně či vůbec (10)
K identifikaci bakteriálního původce slouží primárně bakterioskopický nález – Gramovo barvení. Rychlý, citlivý a specifický je průkaz PCR. Následuje kultivace a zjištění citlivosti na antibiotika.
Ilustrační případ 2 – neuroborelióza
Pacient 60 let. Klinická symptomatologie atypického lumboischiadického syndromu, artralgie, subfebrilie. Udává klíště s erytémem v anamnéze. Pro podezření na neuroboreliózu indikována lumbální punkce a laboratorní vyšetření MM.
Cytologický obraz lymfocytární pleocytózy 118/µl s četnými lymfoplazmocyty, zralými plazmatickými buňkami a monocyty. Příměs neutrofilních granulocytů a kontaminantně erytrocytů. (obr. 4 A, B). Výsledky komplementárních vyšetření (biochemického, imunoglobulinů, hematolikvorové bariéry, zánětlivých markerů a zejména identifikace borelií) podávají tabulky č. 2 A-E.
Image 4. Ilustrační případ 2. Neuroborelióza. (A) Lymfocytární pleocytóza s účastí aktivovaných lymfoplazmocytárních forem a zralých plazmocytů, monocytů. Malá příměs neutrofilních granulocytů (v centru obrázku). (B) Lymfocytární pleocytóza s účastí aktivovaných lymfoplazmocytárních forem a zralých plazmocytů, monocytů. V centru pravidelná mitóza. 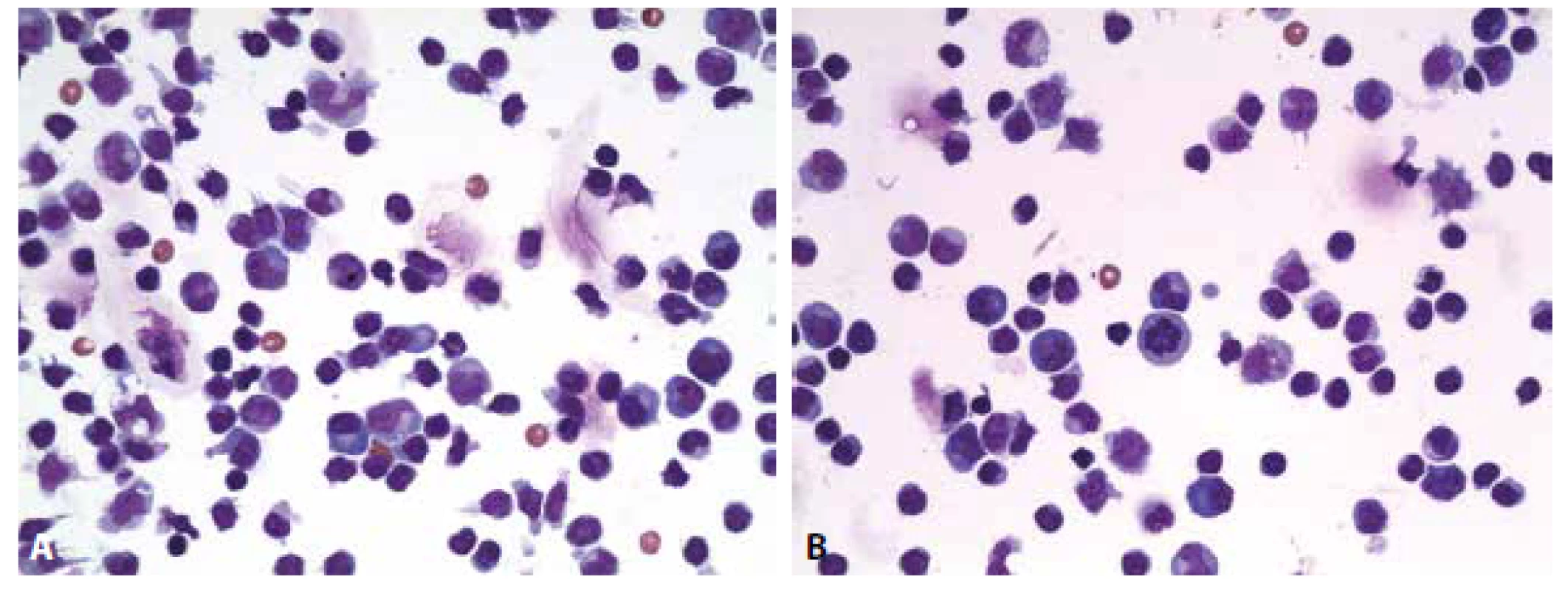
Tab. 2a. Ilustrační kazuistika 2 – neuroborelióza. Základní biochemie MM. 
Tab. 2b. Ilustrační kazuistika 2 – neuroborelióza. Vyšetření imunoglobulinů 
Image 5. Tab. 2c. Ilustrační kazuistika 2 – neuroborelióza. Hemato-likvorová bariéra. 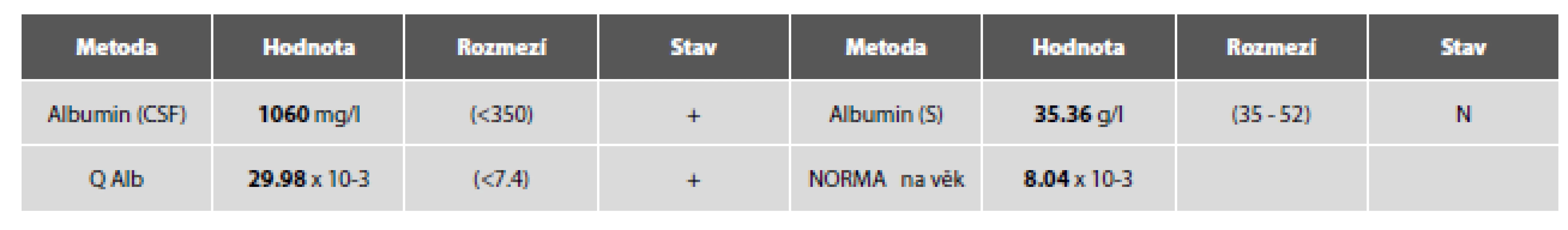
Tab. 2d. Ilustrační kazuistika 2 – neuroborelióza. Zánětlivé markery. 
Tab. 2e. Ilustrační kazuistika 2 – neuroborelióza. Stanovení protilátek proti Borrelia burgdorferi sensu lato, přímý průkaz boreliové DNA. 
Komentář: Laboratorní nález serózně zánětlivého obrazu v mozkomíšním moku má velmi širokou diferenciální diagnózu. Od tzv. serózních neuroinfekcí způsobených viry a některými bakteriemi (borelie, treponemy a leptospiry) popř. i mykotickými agens (kandida, kryptokok, aspergilus…) po záněty autoimunitní etiologie jako roztroušená skleróza, neuromyelitis optica, autoimunitní paraneoplastické encefalitidy aj.
Neuroborelióza, jako typický představitel serózní bakteriální neuroinfekce vykazuje v likvoru oproti virovým neuroinfekcím výraznější zánětlivé změny - vyšší stupeň celulizace se zralými plazmocyty, energetika s jasně sníženým KEB v pásmu serózního zánětu, elevací humorálních zánětlivých markerů, zvýšenou permeabilitou hematolikvorové bariéry. Za zmínku stojí zejména vysoké hodnoty chemokinu CXCL13, pro floridní zánět boreliové etiologie typické (nikoliv však patognomonické!). V tomto případě byl kromě vysokých titrů specifických protilátek také pozitivní i přímý průkaz boreliové DNA s. l. (11) metodou PCR.
Ilustrační případ 3 – roztroušená mozkomíšní skleróza (RS)
Pacient 28 let. Klinicky levostranná spastická hemiparéza. Na MRI mozku a cervikální páteře mnohočetná vs. demyelinizační ložiska v bílé hmotě. Pro podezření na RS indikována lumbální punkce a laboratorní vyšetření MM.
Cytologicky obraz mírné pleocytózy – 8/ul, převaha lymfocytů se známkami aktivace a nečetnými zralými plazmocyty. V monocytární řadě vakuolizace cytoplazmy, v barvení olejovou červení lipofagická úklidová reakce (obr. 5A,B).
Image 6. Ilustrační případ 3. Roztroušená skleróza. (A) Mírná lymfocytární pleocytóza, v centru zralá plazmatická buňka. MGG, 200x. (B) Lipofagická reakce je u RS většinou diskrétní, omezená na akutní fázi onemocnění. Olejová červeň, 400x. 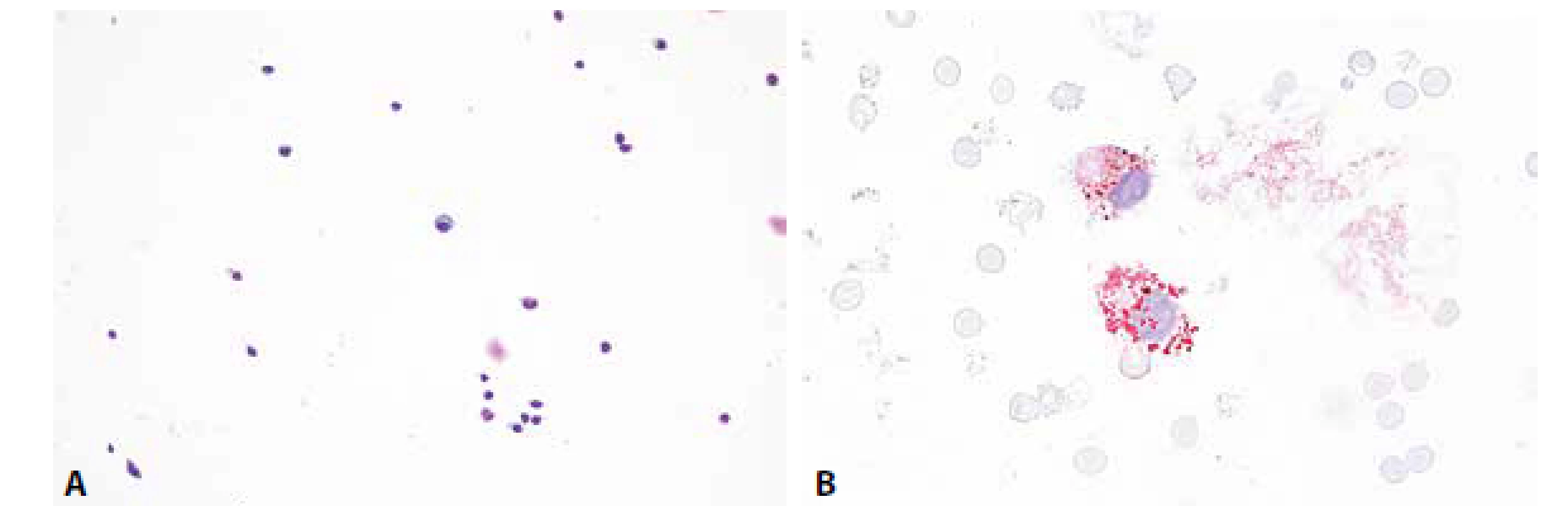
Vyšetření laboratorních parametrů paralelně v MM a séru podávají tabulky 3a-g.
Tab. 3a. Ilustrační kazuistika 3 – RS. Základní biochemie . 
Tab. 3b. Ilustrační kazuistika 3 – RS. Imunoglobuliny. 
Image 7. Tab. 3c. Ilustrační kazuistika 3 – RS. Hemato-likvorová bariéra. 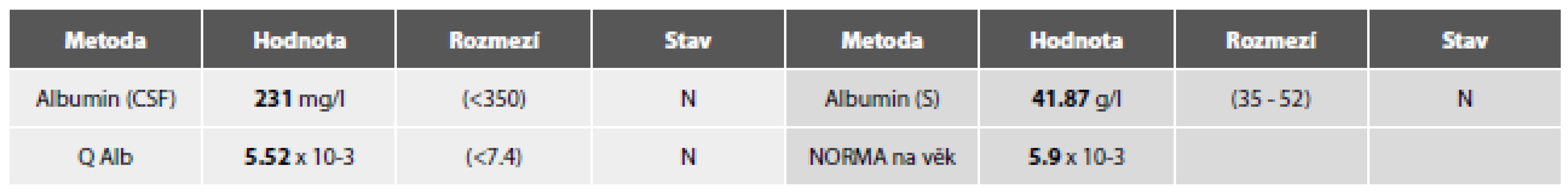
Tab. 3d. Ilustrační kazuistika 3 – RS. Zánětlivé markery. 
Tab. 3e. Ilustrační kazuistika 3 – RS. MRZ reakce. 
Tab. 3f. Ilustrační kazuistika 3 – RS. Autoprotilátky. 
Tab. 3g. Ilustrační kazuistika 3 – RS. Destrukční markery. 
Komentář: RS jakožto autoimunitní demyelinizační onemocnění vykazuje zpravidla v MM spíše diskrétní zánětlivé změny - nízký stupeň zánětlivé celulizace, normální permeabilitu hematolikvorové bariéry. Rovněž lipofagická úklidová reakce bývá v porovnání s destrukčními tkáňovými procesy méně výrazná. Typická je přítomnost oligoklonální intratekální syntézy imunoglobulinů.
Nádorové postižení intermeningeálního prostoru představuje jednoznačně nejnáročnější diagnostickou problematiku cytologie MM. Klinické projevy, které vedou k odběru MM, mohou skrývat široké spektrum diferenciálně diagnostických situací. Jen zdánlivě přímočará je úvaha u recentně léčené malignity s předpokládaným postižením likvorových prostor. Jsou-li v MM zjištěny atypické buňky, jejichž základní morfologie připouští původ v léčeném procesu, lze zúžit panel protilátek pro potvrzující imunocytochemické vyšetření (obr. 6 A, B). Přínosná je v takové situaci znalost imunoprofilu anamnestické malignity.
Image 8. Muž, 73 let anamnéza plicního karcinomu. Zhoršení stavu, febrilie, k vyloučení zánětu. (A) Mírná suspektně nádorová pleocytóza v barvení MGG. Atypické buňky jednotlivě i v kohezivních skupinkách. 600x. (B) Jaderná pozitivita TTF1 v nádorových buňkách. 600x. 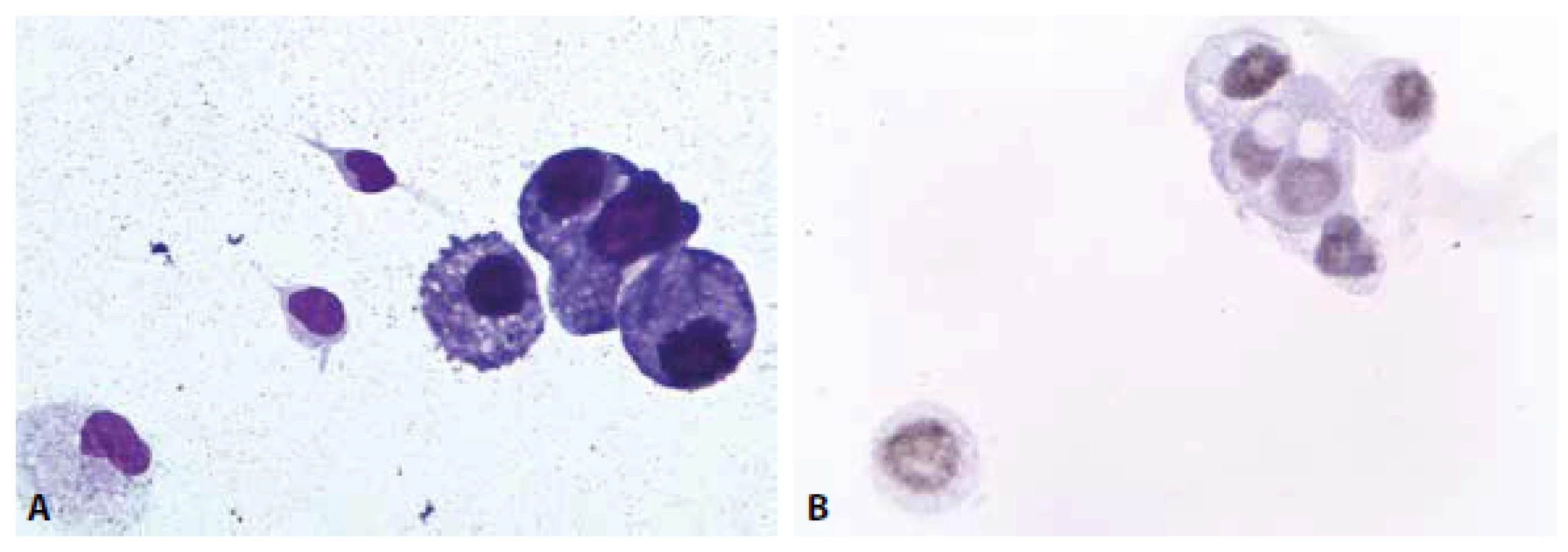
I zde je však třeba počítat s těžkostmi – imunoreaktivita nádorových buněk v MM bývá často oslabená, postupy nejsou zatím standardizované, chybí odpovídající kontrola. Potvrzení nádorové buněčné populace pro následnou léčbu je přitom zásadní, a to i v oligocytárním vzorku. Diferenciální diagnózu patologického nálezu v MM představují stále častěji se vyskytující nádorové duplicity a multiplicity u imunokompromitovaných pacientů. Ze stejné příčiny je nutno uvažovat procesy zánětlivé a opominout nelze v úvaze ani paraneoplastickou encefalitis. Nádorová anamnéza vyšetřovaného pacienta s nálezem atypických buněk v MM může být němá – buď skutečně, je-li neurologické postižení prvním projevem nádorového procesu, nebo zdánlivě, kdy informace o nádorovém procesu v minulosti (někdy před řadou let) úspěšně léčeném není součástí recentní zdravotnické dokumentace.
Ilustrační případ 4 – pozdní diseminace nádorového procesu
Žena 53 let. Bez anamnestických údajů o nádorovém onemocnění. Instabilita a dekompenzace arteriální hypertenze. Cervikokraniální syndrom nejprve bez známek meningeální iritace, později nauzea, zvracení. Porucha okohybných nervů. Zhoršení v průběhu posledních 14 dnů.
Cytologický nález: nádorová pleocytóza. Atypické buňky jednotlivě i ve skupinkách s kohezí.
Imunocytochemicky vykázaly atypické buňky pozitivitu v průkazu cytokeratinů (CKAE), estrogenních receptorů, slabě sporně pozitivní byl průkaz TTF-1. Cytokeratin CK 20 negativní (obr. 7A-D).
Image 9. Ilustrační případ 4. (A) Nádorová pleocytóza. MGG 200x. (B) Pozitivita cytokeratinů. CKAE, 400x. (C) Pozitivita estrogenních receptorů. 600x. (D) Slabá pozitivita TTF1. 400x. 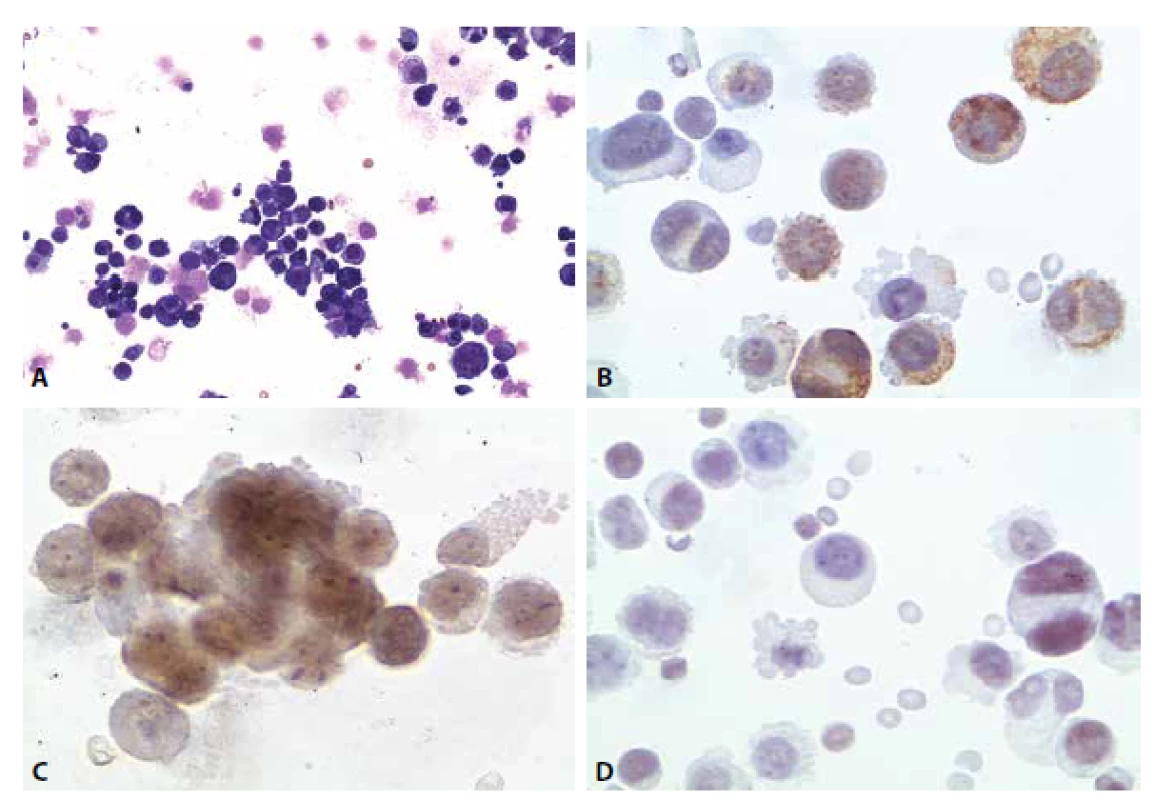
Pacientka zemřela o měsíc později. Pitva prokázala generalizaci duktálního karcinomu s víceletou latencí.
V případě negativní nádorové anamnézy s nálezem suspektních buněk v MM nezbývá než použít rozřazovací imunocytochemický „minipanel“ (tab. č. 4). Nejsou-li k dispozici rezervní preparáty z primárního vzorku MM, je opodstatněné požadovat paralelně s rozšířeným vyšetřováním klinickými zobrazovacími metodami odběr dalšího vzorku navzdory skutečnosti, že lumbální punkce představuje invazivní zákrok (12). V souladu s publikovanými postupy jsme využili i postupy „recyklace“ buněk – opakovaného imunocytochemického testu na negativních preparátech (13).
Tab. č. 4. Immunocytochemický minipanel u pacientů s němou anamnézou a suspektně nádorovými buňkami v MM. 
Vysloveně slabým místem diagnostiky je oligocytární vzorek s účastí suspektních buněk u pacienta s hematologickou malignitou. Poněkud snazší je situace u vzorku s předpokládaně nádorovou pleocytózou.
Ilustrační případ 5
Pacientka 72 let. Difuzní velkobuněčný lymfom ( DLBCL) léčený chemoterapií. Podezření na nádorové postižení CNS.
Cytologický nález: Monomorfní infiltrace dyskohezivními elementy, jejichž morfologie je konsistentní s anamnesticky udaným DLBCL. Imunocytochemicky v nádorových buňkách negativní CD20 a PAX 5, pozitivní CD 79a. CD3 řídce dispersně pozitivní na malých lymfocytech, nádorové buňky negativní (obr. 8A-C). Nález podporuje předpokládané postižení likvorových prostor anamnesticky udaným lymfomem.
Image 10. (A) Monomorfní infiltrace dyskohezivními elementy , jejichž morfologie je konsistentní s anamnesticky udaným DLBCL. (B) Pozitivita CD79a v nádorových buňkách. 400x. (C) Pozitivita CD3 v nenádorových malých lymfocytech. Nádorové buňky negativní. 400x. 
Spolehlivější identifikaci nádorové populace hematologické však představuje průtoková cytometrie (14-17).
Primární mozkové tumory představují pouze přibližně 10% nádorového postižení mening. Vzhledem k jejich hlubokému uložení v tkáni CNS je nález v MM často negativní i při prokázané lézi mozkové.
Podrobnější popis konkrétních diagnostických situací je předmětem obsáhlejších kapitol o cytologii MM (18, 19). Pro denní praxi považujeme za užitečný přehled oligocytárních a pleocytárních likvorových nálezů s diferenciálně diagnostickou interpretací (tab. 5). Pracoviště patologie je schopno poskytnout kvalitní cytopatologický nález. Ten se stává součástí komplexního diagnostického postupu, v němž další části vzorku děleného po odběru jsou předmětem specializovaných nemorfologických vyšetření (20). Základní biochemické a energetické parametry: celková bílkovina, glykorhachie, koncentrace laktátu, spektrofotometrické vyšetření hematogenních pigmentů (oxyhemoglobin, bilirubin) při podezření na intrakraniální krvácení, resp. SAK.
Tab. č. 5. Základní klasifikace cytologických nálezů v MM. 

AIDP - akutní zánětlivá demyelinizující polyneuropatie, CIDP - chronická zánětlivá demyelinizující polyneuropatie Stanovení kvocientu albuminu (Q Alb) jako parametru permeability hemato-likvorové bariéry:
Věkově vázané referenční hodnoty Qalb (orientační hodnoty).
Od 5 let věku lze použít rovnici pro horní hranici referenčního rozmezí podle Reibera:
(21) Stanovení koncentrace imunoglobulinů (vč. kvantifikace volných lehkých řetězců – FLC kappa a lambda) se stanovením jejich intratekální oligoklonální syntézy (OCB) metodou izoelektrické fokusace (IEF) - minimálně ve třídě IgG; k dispozici jsou i metodiky pro stanovení OCB ve třídách IgM, IgA a volných lehkých řetězců (FLC) kappa a lambda.
Stanovení protilátek proti mikrobiálním patogenním agens nebo stanovení přítomnosti mikrobiální DNA či RNA v likvoru metodou PCR (polymerase chain reaction).
Detekce neurálních autoprotilátek, kam patří např. onkoneurální - paraneoplastické protilátky, protilátky proti NMDA či AMPA receptorům, iontovým kanálům (LGI-1, caspr-2) a proti dalším buněčným strukturám jako AQP-4, MOG, MBP atd.
Stanovení koncentrací markerů zánětu (IL 1,6, 8, 10, CXCL13, proteiny akutní fáze, složky komplementu aj.)
Stanovení markerů tkáňové destrukce (protein S100B, NSE – neuron-specifická enoláza, NF - neurofilamenta atd.).
Vyšetření specifických markerů CNS: např. tau - protein, fosforylovaný tau - protein a beta - amyloid (tzv. likvorový triplet u Alzheimerovy choroby), protein 14-3-3 (rozsáhlá destrukce CNS, Jakob-Creutzfeldtova choroba), beta-trace protein (detekce likvorey).
Formulace cytologického nálezu
Rychlý rozvoj mezinárodně standardizovaných cytologických klasifikací (22-26) se zatím vyšetření MM nedotkl. Je tedy žádoucí postupovat podle obecných pravidel přehlednosti cytologického nálezu:
- Zařazení kvantitativní – oligo/ pleocytární MM spolu s uvedením případných kvalitativních limitů pro hodnocení buněčného složení vzorku
- Popis zastoupených buněk ze základní morfologie
- Výsledky speciálních barvení a případně imunocytochemických průkazů
- Interpretace ve vztahu k poskytnutým anamnestickým datům a zadání na žádance k vyšetření
- Případné doporučení dalšího vyšetřovacího postupu – pokud plyne z cytologického nálezu.
ZÁVĚR
Cytologické vyšetření MM má určitá specifika ve fázi preanalytické (nutnost rychlého zpracování nefixovaného vzorku) i analytické (limitovaný objem vzorku, oligocytární nálezy nádorových buněk). Při dodržení odpovídajících postupů a interpretaci v kontextu paralelních nemorfologických vyšetření může zásadním způsobem přispět k diagnóze patologických stavů v likvorových prostorech, potažmo CNS.
PODĚKOVÁNÍ
Autoři děkují Mgr. Blance Veselé a Miloslavě Milerové za pomoc se zpracováním fotodokumentace.
Podpořeno Univerzitou Karlovou - projekt Progres Q28/LF1 Podpořeno MZ ČR – projekt RVO VFN64165
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Prof. MUDr. Jaroslava Dušková, CSc., FIAC,
Ústav patologie 1. LF UK a VFN
Studničkova 2, 128 00 Praha 2
tel.: +420224968688
fax: +420224911715
e-mail: jaroslava.duskova@lf1.cuni.cz
Sources
1. Sakka L, Coll G, Chazal J. Anatomy and physiology of cerebrospinal fluid. Eur Ann Otorhinolaryngol Head Neck Dis 2011; 128(6): 309-316.
2. Hajdu SI. A note from history: Discovery of the cerebrospinal fluid. Ann Clin Lab Sci 2003; 33(3): 334-336.
3. Wynter W. Four cases of tubercular meningitis in which paracentesis of the theca vertebralis was performed for the relief of fluid pressure. Lancet 1891; 137(3531): 981-982.
4. Quincke H. Die Lumbalpunction des Hydrocephalus. Berl klin Wochenschr 1891; 28(929-933; 965-968.
5. Merritt HH, Fremont-Smith F. The cerebrospinal fluid ed.). Philadelphia, London,: W. B. Saunders Company; 1937:
6. Herndon RM, Brumback RA. The cerebrospinal fluid ed.). Boston: Kluwer Academic Publishers; 1989:
7. Taussig L. Liquor cerebrospinalis: Lumbální punkce v diagnostice, prognostice a terapii. Praha: Mladá Generace Lékařů; 1926 : 440.
8. Goedert M. Oskar Fischer and the study of dementia. Brain 2009; 132(Pt 4): 1102-1111.
9. Abbott NJ, Pizzo ME, Preston JE, Janigro D, Thorne RG. The role of brain barriers in fluid movement in the cns: Is there a ‘glymphatic’ system? Acta Neuropathol 2018; 135(3): 387-407.
10. Kelbich P, Hejčl A, Selke Krulichová I, Et Al. Coefficient of energy balance, a new parameter for basic investigation of the cerebrospinal fluid. Clin Chem Lab Med 2014; 52(7): 1009-1017.
11. Kybicová K, Lukavská A, Balátová P. Lymeská borrelióza – kultivace Borrelia burgdorferi sensu lato. Zprávy CEM (SZÚ, Praha) 2018; 27(5): 113-115.
12. Duskova J, Sobek O. Assisting the neurologist in diagnosis of cns malignancies - current possibilities and limits of cerebrospinal fluid cytology and immunocytochemistry. Brain Behav 2017; 7(10): e 00805 https://doi.org/00810.01002/brb00803.00805.
13. Chivukula M, Dabbs DJ. Immunocytology. In: Dabbs DJ, eds. Diagnostic immunohistochemistry. Theranostic and genomic applications ed). Philadelphia: Saunders - Elsevier; 2010 : 901-922.
14. Chamberlain MC, Glantz M, Groves MD, Wilson WH. Diagnostic tools for neoplastic meningitis: Detecting disease, identifying patient risk, and determining benefit of treatment. Semin Oncol 2009; 36(4 Suppl 2): S35-45.
15. Chandra A, Cross P, Denton K, et al. The BSCC code of practice--exfoliative cytopathology (excluding gynaecological cytopathology). Cytopathology 2009; 20(4): 211-223.
16. Weston CL, Glantz MJ, Connor JR. Detection of cancer cells in the cerebrospinal fluid: Current methods and future directions. Fluids Barriers CNS 2011; 8(1): 14.
17. Zhao H, Ma M, Zhang L, et al. Diagnosis of central nervous system lymphoma via cerebrospinal fluid cytology: A case report. BMC Neurol 2019; 19(1): 90.
18. De May RM. The art and science of cytopathology (1st ed.). Chicago: ASCP Press; 1995 : 427-462.
19. Spieler P, Rössle M. Nongynecologic cytopathology (1st ed.). Berlin - Heidelberg: Springer; 2012 : 491-513.
20. Sobek O, Adam P, Koudelková M, Štourač P, Mareš J. Algoritmus vyšetření likvoru v návaznosti na doporučení sekce neuroimunologie a likvorologie české neurologické společnosti jep. Cesk Slov Neurol N 2012; 75/108 (2): 159-163.
21. Reiber H. Flow rate of cerebrospinal fluid (csf) - a concept common to normal blood-csf barrier function and to dysfunction in neurological diseases. J Neurol Sci 1994; 122 : 189-203.
22. Ali SZ, Cibas ES. The Bethesda system for reporting thyroid cytopathology. Definition, criteria, and explanatory notes. (2nd ed.). Springer; 2018 : 236.
23. Nayar R, Wilbur DC. The Bethesda system for reporting cervical cytology (3rd ed.). Cham, Heidelberg, New York, Dordrecht, London: Springer; 2015:
24. Pitman MB, Leyfield LJ. The Papanicolaou society of cytopathology system for reporting pancreaticobiliary cytology (1st ed.). Cham Heidelberg, New York, London: Springer; 2015:
25. Rosenthal DL, Wojcik EM, Kurtycz DFI. The Paris system for reporting urinary cytology (1st ed.). Cham, Heidelberg, New York, Dordrecht, London: Springer 2016:
26. Faquin WC, Rossi ED. The Milan system for reporting salivary gland cytopathology (1st ed.). New York, NY: Springer 2018:
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2019 Issue 3-
All articles in this issue
- Monitor aneb nemělo by vám uniknout, že...
- Adenómy hypofýzy – praktický prístup k histopatologickej diagnostike a zmeny v poslednej WHO klasifikácii z roku 2017
- Cytologické vyšetření mozkomíšního moku
- Histopatologické hodnocení intenzity a aktivity zánětu u zánětlivých střevních onemocnění: Důležitý doplněk endoskopie nebo marná snaha?
- Změny angiogeneze a imunitních regulací ve stromálním mikroprostředí kožních melanomů
- Neuronálna ceroidná lipofuscinóza s postihnutím srdca
- Metanefrický adenóm. Kazuistika a prehľad literatúry
- Atypický fibroxantóm, zriedkavý a často nerozpoznaný kožný mäkko-tkanivový nádor – kazuistika a prehľad literatúry
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cytologické vyšetření mozkomíšního moku
- Neuronálna ceroidná lipofuscinóza s postihnutím srdca
- Adenómy hypofýzy – praktický prístup k histopatologickej diagnostike a zmeny v poslednej WHO klasifikácii z roku 2017
- Atypický fibroxantóm, zriedkavý a často nerozpoznaný kožný mäkko-tkanivový nádor – kazuistika a prehľad literatúry
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career





