-
Medical journals
- Career
Cytologie výpotků v coelomových dutinách
: Jaroslava Dušková
: Ústav patologie 1. LF UK a VFN, Praha
: Čes.-slov. Patol., 63, 2018, No. 4, p. 175-189
: Review
Coelomové dutiny (pleura, perikard, peritoneum, tunica vaginalis testis) vystlané mezoteliální výstelkou derivující z mezodermu jsou častým místem propagace patologických procesů z okolí i primárně zde vzniklých. Ty se nejčastěji projeví výpotkem, jehož cytologické vyšetření významně přispívá k diagnóze. Každé větší množství tekutiny v coelomových prostorech je patologické. Zásadním úkolem je zpravidla identifikace nádorových buněk, podstatně častěji metastatického původu (s klesající frekvencí (adeno)karcinomy, melanom, sarkomy), než primárních (mezoteliomy, primární lymfomy coelomových dutin). Odlišení karcinózy nebo jiné nádorové populace od mezoteliálních buněk vyžaduje často po pečlivém morfologickém zhodnocení indikaci doplňujících metod barvicích, imunocytochemických (u hematologických malignit s výhodou v kombinaci s průtokovou cytometrií), případně molekulárně biologických. Standardizace zatím není v této diagnostické oblasti povšechně pokročilá, nicméně existuje konsensus pro panel k rozlišení karcinózy a mezoteliomu. Diagnóza vzniká vždy sumací znaků. Kvalitní výsledek vyžaduje odpovídající zajištění všech tří fází diagnostického procesu a přehlednou a jednoznačnou formulaci diagnózy, případně diferenciálně diagnostické rozvahy.
Klíčová slova:
cytologické vyšetření výpotků – výpotky – coelomové dutiny – karcinóza – reaktivní mezotelie – mezoteliom
OBSAH
Definice coelomových dutin: embryologie, anatomie, normální obsah
Historická poznámka o vyšetřování výpotků
Současné využití
Metody:
- fixace
- nátěry
- centrifugace
- cytoblok
- barvení základní a doplňující
- speciální metody
Patologické obsahy coelomových dutin:
- transudát
- hemothorax
- chylothorax
- výpotky
- bez přítomnosti nádorových buněk
- s přítomností nádorových buněk
Formulace cytologického nálezu
Závěr
Dodatek 1: Mikroskopické zhodnocení elementů kvantitativně. PP31 – Topelex s.r.o.
Dodatek 2: Zpracování materiálu do cytobloku. PP-Pat-CYT-04 – VFN.
DEFINICE COELOMOVÝCH DUTIN
Coelomové dutiny (pleura, perikard, peritoneum, tunica vaginalis testis) jsou výsledkem diferenciace intraembryonálního coelomu probíhající již od druhého gestačního týdne (1-3). V definitivním tvaru představují uzavřené prostory s přechody viscerálního a parietálního listu. Jedinou komunikační výjimkou jsou vejcovody (vysvětlující občasné nálezy nádorových buněk přítomných v peritoneální dutině při vyšetřování cervikálních cytologií (4, 5)).
Všechny coelomové dutiny jsou shodně vystlány mezoteliemi, buňkami derivujícími z mezodermu. Vykazují současně charakteristiky epitelové i mesenchymové s možnými přechody (6-8). Nejde pouze o „výstelku“. Mezotelie jsou velice aktivní buňky. Produkují pleurální surfaktant, účastní se prezentace antigenů, tvorby zánětlivých mediátorů, koagulace i fibrinolýzy. V klidovém stavu je mezoteliální výstelka jednovrstevná, tvořená plochými „dlaždicovitými“ mezoteliemi s desmosomy, avšak především s bohatým ciliárním povrchem, jehož hlavní funkcí je zadržovat na povrchu surfaktant, který plní funkci lubrikantu snižujícího tření (9). Reaktivní mezotelie jsou značně polymorfní a proto představují zásadní úskalí cytologie coelomových dutin, zejména pro nesnadné odlišení jak od metastatických nádorových buněk, tak mezotelií nádorových.
Submesoteliální buňky jsou v klidovém stavu elementy fibroblastické nebo myofibroblastické řídce uložené v submesoteliální pojivové vrstvě (10, 11) s výlučnou expresí vimentinu. V reaktivních situacích se však projeví jejich transdiferenciační potenciál s koexpresí nízkomolekulárních cytokeratinů; posléze dojde ke ztrátě exprese vimentinu a objeví se pozitivita vysokomolekulárních cytokeratinů. (12).
Prostory mezi parietálními a viscerálními listy serózních membrán jsou za fyziologických poměrů virtuální s šíří 5-10 um. Lze je chápat jako extenze lymfatických prostorů, s nimiž prostorově souvisí. (13-16). U zdravých jedinců obsahují pouze několik málo mililitrů viskózní tekutiny – surfaktantu (17). Tvorba výpotků v coelomových dutinách se řídí Starlingovými zákony hydrostatického a osmotického tlaku v cévách a intersticiu a je významně ovlivněna propustností kapilár (16, 18).
Historická poznámka
Mezotel byl dle současných sdělení popsán poprvé francouzským lékařem - anatomem Bichatem v roce 1827 (19), muselo to však být dříve (Marie-Francois Xavier Bichat 1771 – 1802 byl totiž v uvedeném roce dle jiných zdrojů již čtvrt století mrtev (20). Termín mesothelium zdůrazňující epitelovou povahu byl navržen bostonským lékařem a embryologem Francisem Minotem Weldem, 1840-1894 (8). První práce týkající se diagnostického využití cytologických obrazů v coelomových dutinách se však objevují až v 60. letech 20. století s prudkým nárůstem počtu publikací od 70. let až do dnešních dnů.
Současné indikace evakuace výpotků a následného cytologického vyšetření
Trvají indikace tradiční – terapeutické dekomprese, ozřejmění povahy výpotku a tím i patologického procesu, zejména rozlišení obrazů nádorových a nenádorových. Přistupují jednak možnosti zpřesněné diagnostiky, ale nověji i vyšetření cílená na určení klinického stádia gynekologických malignit, vyšetření peritoneální tekutiny k včasné diagnóze infekce při abdominální dialýze, stanovení prediktivních markerů – např. EGFR u plicních karcinomů se šířením do pleurální dutiny, pokud není k dispozici vzorek z primárního tumoru.
Patologické obsahy coelomových dutin
Přehled patologických obsahů coelomových dutin, nejčastějších příčin výpotků, diagnostických termínů, makroskopické morfologie a očekávaných buněčných populací v cytologickém vyšetření podává Tab. 1. Jejich podrobnějším popisem se zabývá následující text.
1. Patologické obsahy coelomových dutin. 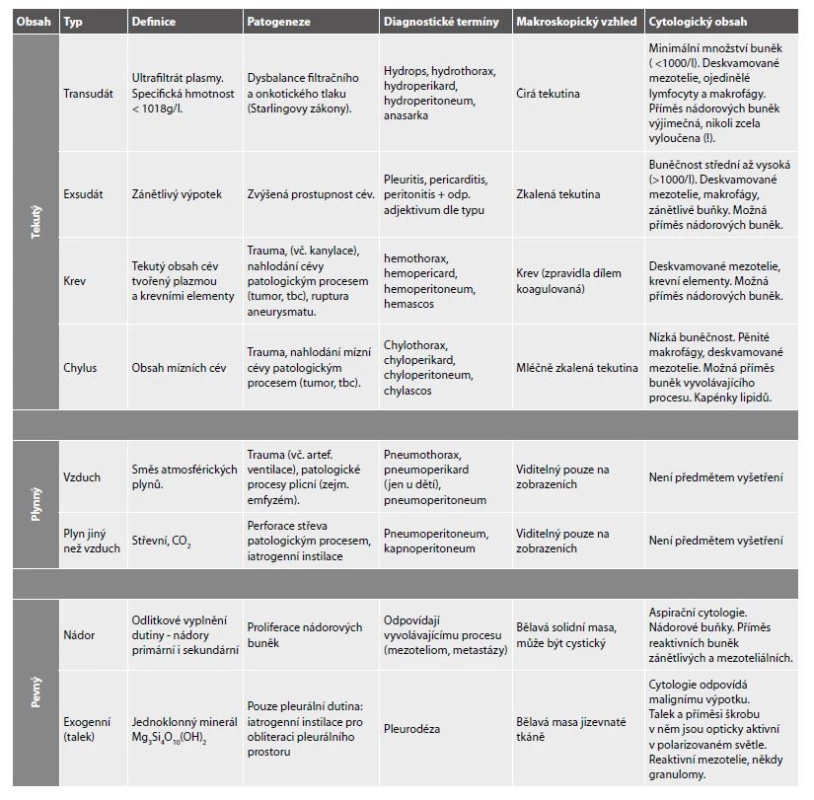
METODY ZPRACOVÁNÍ VÝPOTKŮ
Získání vzorku a jeho transport do laboratoře představují první a velmi důležitý krok preanalytické fáze vyšetření, který může zásadně ovlivnit výsledek. Akreditovaná laboratoř musí klinické specialisty dodávající vzorky informovat o požadavcích na vzorky - zpravidla cestou laboratorní příručky zveřejněné na webových stránkách laboratoře. Požadavky na vstupní parametry vzorku jsou zároveň součástí standardního operačního postupu pro zpracování a kontrolovány laborantkami při příjmu materiálu.
Výpotky jsou získávány drenáží tělesných dutin s nejčastějším diferenciálně diagnostickým zadáním rozlišit nádorovou a zánětlivou etiologii. V peritoneální dutině je pak laváž součastí stážovaní gynekologických malignit, popřídě je vyšetřována tekutina z peritoneální dialýzy.
Fixace a příprava preparátů. Doporučené množství výpotku dodaného do laboratoře je 20 ml. Zpracovány jsou samozřejmě i vzorky jiného objemu. Po evakuaci tekutiny není třeba fixovat. Vzorek by však měl být v chladu. (Nesmí být zvolna zmražen! Tuto skutečnost není třeba zdůrazňovat morfologům, avšak z naší osobní zkušenosti je rozhodně dobré ji explicitně formulovat v laboratorní příručce). Za popsaných podmínek jsou buňky ve výpotcích hodnotitelné i při zpracování do 48 hodin. Vlastní zpracování vzorku lze provést více způsoby, od prostých nátěrů, přes cytocentrifugaci či cytosedimentaci eventuelně využívající metod gynekologické cytologie z tekutého média (LBC) k cytobloku, jehož přínos pro diagnostickou výtěžnost je nesporný. Obecně platí, že kombinace metod jak v úrovni zpracování do preparátu, tak barvení a rozšíření rozsahu vyšetření (v rámci jedné i více technik) posilují diagnostickou výtěžnost. Samozřejmě je nutno paralelně uvažovat i otázky ekonomické. Při zpracování tekutých vzorků je reziduální vzorek v laboratoři uchováván do vyřešení diagnózy s použitím fixace – v laboratoři VFN alikvotním množstvím pufrovaného 10% formalinu. Stejně jako u bioptického materiálu je však nutno i v cytologických vzorcích počítat se sníženou imunoreaktivitou formolem déle fixovaných vzorků a prodloužit případně časy reakčních kroků pro odhalení antigenů (21).
Některé laboratoře stanovují před zpracováním vzorku jeho buněčnost postupem obdobným jako v mozkomíšním moku ve Fuchsově-Rosenthalově komůrce (Dodatek 1: Mikroskopické zhodnocení elementů ve výpotku kvantitativně).
Úprava vzorku před zpracováním cytocentrifugou i vkládaný objem jsou závislé na typu přístroje a součástí provozní dokumentace ke konkrétnímu přístroji. Z viskózních a silně krevnatých vzorků může být přínosné paralelní zhotovení prostého nátěru. Z tekutého vzorku je s výhodou zhotovit 4 cytocentrifugované preparáty.
Cytoblok by měl být zhotoven vždy, pokud jsou v dodaném vzorku makroskopicky patrny částky. S ohledem na pokročilejší stav standardizace imunohistochemických postupů lze cytoblokové zpracování doporučit vždy, kdy přichází v úvahu typizace nádorových buněk. Pokud tekutina makroskopicky patrné mikročástky neobsahuje, lze cytoblok vytvořit z centrifugátu s použitím HistoGelu popř. agaru (Dodatek 2: Zpracování materiálu do cytobloku).
Barvení. Na rozdíl od cytologií gynekologických, kde došlo k celosvětové unifikaci ve prospěch polychromatického barvení, lze postupy při zpracování ostatních typů cytologických vzorků volit s ohledem na preference hodnotícího patologa a detekční záměry.
Dva ze čtyř preparátů standardně zhotovovaných v naší laboratoři jsou po zaschnutí barveny technikou May-Grünwald-Giemsa-Romanowsky (MGG), jeden hematoxylinem-eozínem (HE) s užitím Harrisova hematoxylinu, jeden polychromatickou metodou dle Papanicolaoua (Pap). Každé z těchto barvení má celou řadu modifikací, roztoky jsou často dodávány v podobě firemních kitů. Obecným zdůvodněním kombinace barvení již v rámci vstupního hodnocení je okolnost, že optimalizují viditelnost různých struktur a informace se tím zvyšuje. Preparáty barvené MGG pro primární hodnocení nemontujeme, což usnadňuje jejich použitelnost pro případná imunocytochemická došetření – s ohledem na tuto možnost je výhodné použít silanizovaná podložní skla. Pro doplňující barvení popřípadě imunocytochemická vyšetření lze rovněž zhotovit další preparáty z fixovaného vzorku, případně pokračovat v cytoblokových řezech. K imunocytochemickým testům je však nutno přistupovat s vědomím, že:
reaktivita buněk v cytologickém vzorku ( a o takový jde samozřejmě i v cytoblokovém řezu) nemusí být shodná se vzorkem histologickým
ne vždy jsou k dispozici vnitřní kontrolní struktury
Interpretace výsledků doplňujících metod musí být (jako ostatně i v histopatologii) nanejvýš kritická.
Uplatnění imunocytochemických postupů ve výpotcích se objevilo již koncem 80. let minulého století (22-24). Imunocytochemické pracovní postupy se neliší od imunohistochemických. S ohledem na překryv imunoreaktivit mezi mezoteliemi (zejména reaktivními) a buňkami karcinomů často přítomných v coelomových dutinách jsou standardně používány a kontinuálně upravovány detekční panely (25-29). Liší se složením jak podle pohlaví, tak v situacích anamnézy zcela němé, nebo částečně zacílené na anamnesticky udanou malignitu, s vědomím narůstajícího výskytu metachronních nádorových duplicit (30-32). Pro obtížnost odlišení mezoteliomu byly formulovány cytologické standardní postupy obdobné histologickým, zatím však neumožňují diagnostiku sarkomatoidní a dezmoplastické varianty (33, 34). I poslední verze WHO klasifikace nádorů plic a pleury pojednává úskalí odlišení karcinomů a mezoteliomu širokou škálou použitelných markerů v závislosti na uvažované diferenciální diagnóze (35).
Přehled imunoreaktivit mezotelií ve vztahu k mnohem častějším metastatickým karcinomům odvozený z citovaných publikací udává tab. 2. Pro odlišení reaktivních a nádorových mezotelií je rovněž zapotřebí panelu, protože žádný z užívaných markerů není zcela spolehlivý (tab. 3).
2. Imunoreaktivita mezotelií. 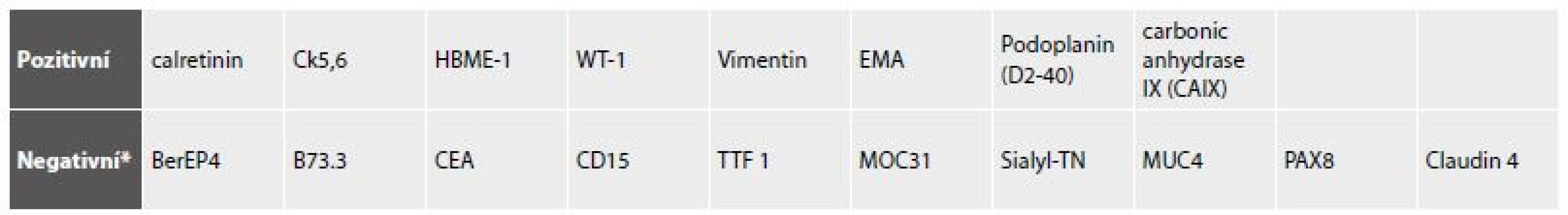
* Pozn. Uvedené negativní markery (s ojediněle popsanou možnou pozitivitou - např. BerEP4 v reaktivním mezotelu- jsou spolu s mnoha dalšími markery využívány v rozhodovacích panelech při karcinózách). 3. Reaktivní versus nádorové mezotelie. 
PATOLOGICKÉ OBSAHY COELOMOVÝCH DUTIN – NENÁDOROVÉ OBRAZY
Z předchozího popisu mezotelií je zřejmé, že jedna z nejdůležitějších úloh coelomové diagnostiky, odlišení nenádorových a nádorových obrazů, je často výrazně ztížena ze dvou objektivních důvodů. Tím prvním je neobyčejná morfologická plasticita reaktivních mezotelií. Tím druhým potom pravidelná koincidence procesů nenádorových a nádorových.
„Normální“ cytologický nález v coelomových prostorech
Normální cytologické obrazy vzhledem k výše popsané virtuální povaze a minimálnímu obsahu tekutin nejsou známy. Každé větší množství tekutiny, které je evakuováno, je patologické. Buněčným složením se normálním poměrům nejvíce blíží transudáty.
Transudáty
Vzhledem k patogenezi jsou zpravidla přítomné ve všech coelomových prostorech současně a diagnostickou úvahu usnadňuje anamnestický údaj některé z možných vyvolávajících příčin. Makroskopicky čirá tekutina transudátu je buněčně chudá, s obsahem deskvamovaných mezotelií, makrofágů a ojedinělých lymfocytů (obr. 1,2). Rozlišení mezotelií a makrofágů v tekutém prostředí nemusí být vždy úplně jednoduché a při nízkém početním zastoupení klidových forem obou buněčných typů v transudátech není ani potřebné. Významu nabývá v exsudátech. Přehled shodných a rozlišujících znaků mezotelií a makrofágů podává tabulka 4. (Shodné jsou připomenuty proto, aby nebyly mylně uvažovány jako rozlišující.) Nad rámec popsaného obrazu je nutno zvážit narůstající buněčnost a přítomnost mírně aktivovaných forem u transudátů déle trvajících, avšak také okolnost, že infekce existujícího transudátu, a tedy přeměna v exsudát, je běžným jevem.
4. Shodné a rozlišující znaky mezotelií a makrofágů. 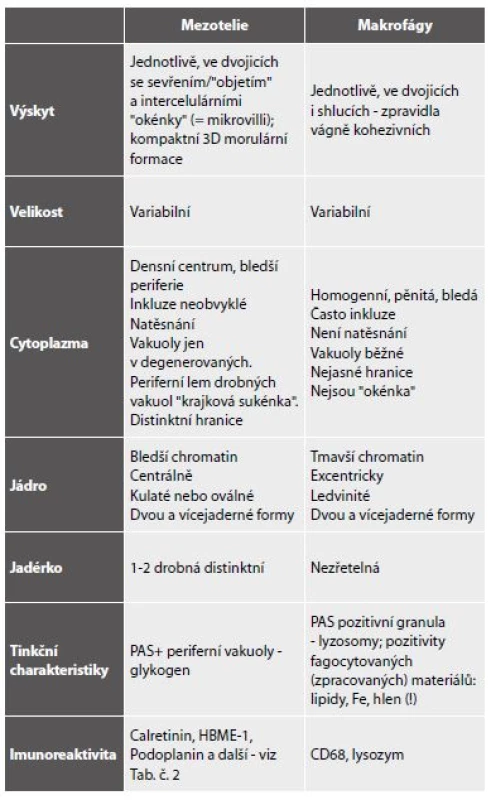
1. Klidové mezotelie. 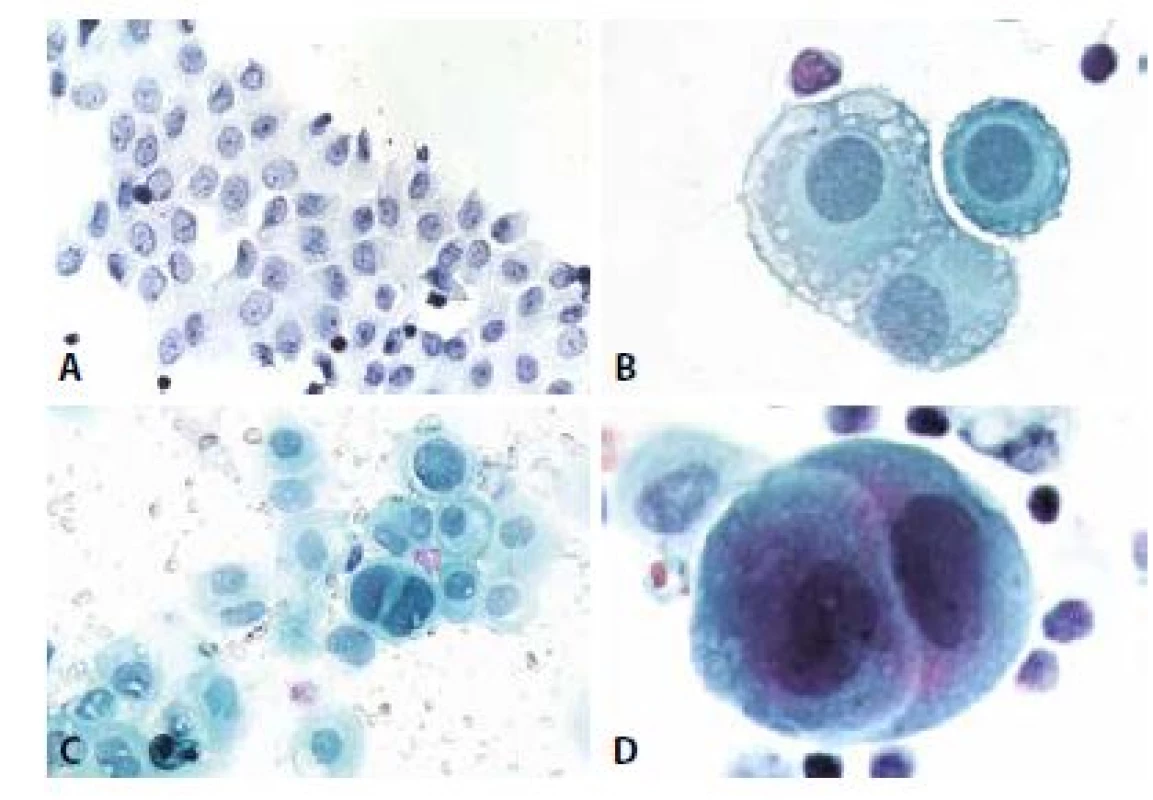
A - Peritoneální výplach. Jednovrstevná plošná formace s ojedinělými lymfocyty. Polygonální buňky, střední velikost, intercelulární prostory. Jádra s jemným chromatinem a solitárními drobnými nukleoly. (polychrom, 200x)
B - Trojice mezotelií se zbytky mikrovilózních struktur. Pro jejich přítomnost jsou mezi mezoteliemi časti tzv. „okénka“ – úzké opticky prázdné prostory. Jádra s jemným středně denzním chromatinem, cytoplazma perinukleárně světlejší, na periferii počínající degenerativní mikrovakuolizace. (polychrom, 400x)
C - Skupinka mezotelií s výraznější anizocytózou, anizokaryózou, v centru dvoujaderná mezotelie s mírně hyperchromními jádry. U popisky dvě silně hyperchromní regresivně změněné mezotelie. (polychrom 200x)
D - Objetí mezotelií. Častý, ale nikoli patognomonický rys. Vyskytuje se i u nádorových buněk. (polychrom, 400x)2. Mezotelie a makrofágy. 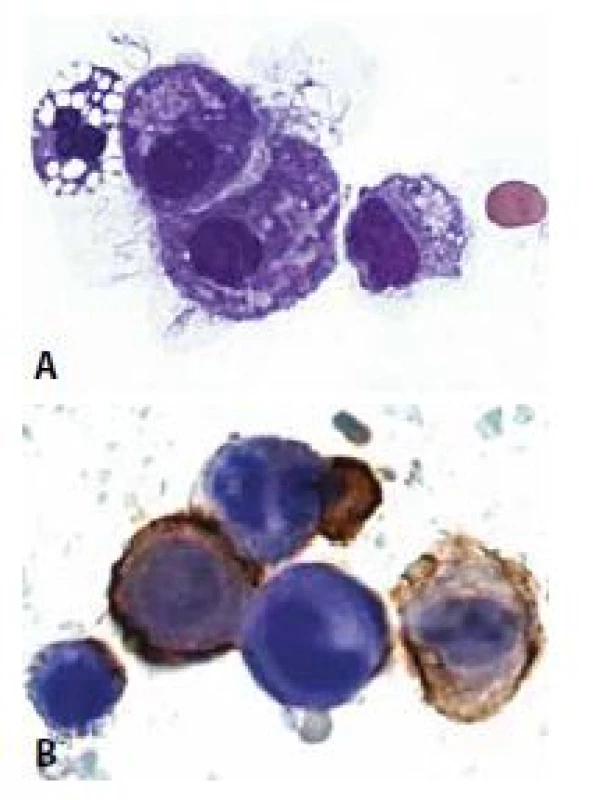
změněným neutrofilním granulocytem a erytrocyt. Makrofágy jsou zpravidla menší, jejich jádro je ledvinité. Cytoplazma může vykazovat známky fagocytární aktivity. (MGG, 400x)
B - Mezotelie a makrofágy imunocytochemicky HBME1 pozitivní v mezoteliích. Makrofág negativní.S ohledem na skutečnost, že transudáty biochemicky definované pomocí tzv. Lightových kritérií (tab. 5) (36) s nízkým obsahem proteinů a laktátu mají zpravidla cytologický obraz chudý a nepřínosný, nejsou někdy těkutiny s těmito charakteristikami zasílány na cytologické vyšetření. Nicméně nádorové exsudáty s biochemickými vlastnostmi transudátů existují (37-39) a představují i cytologicky diagnostické úskalí – viz nádorové výpotky.
5. Lightova kritéria biochemického rozlišení transudátu a exsudátu. 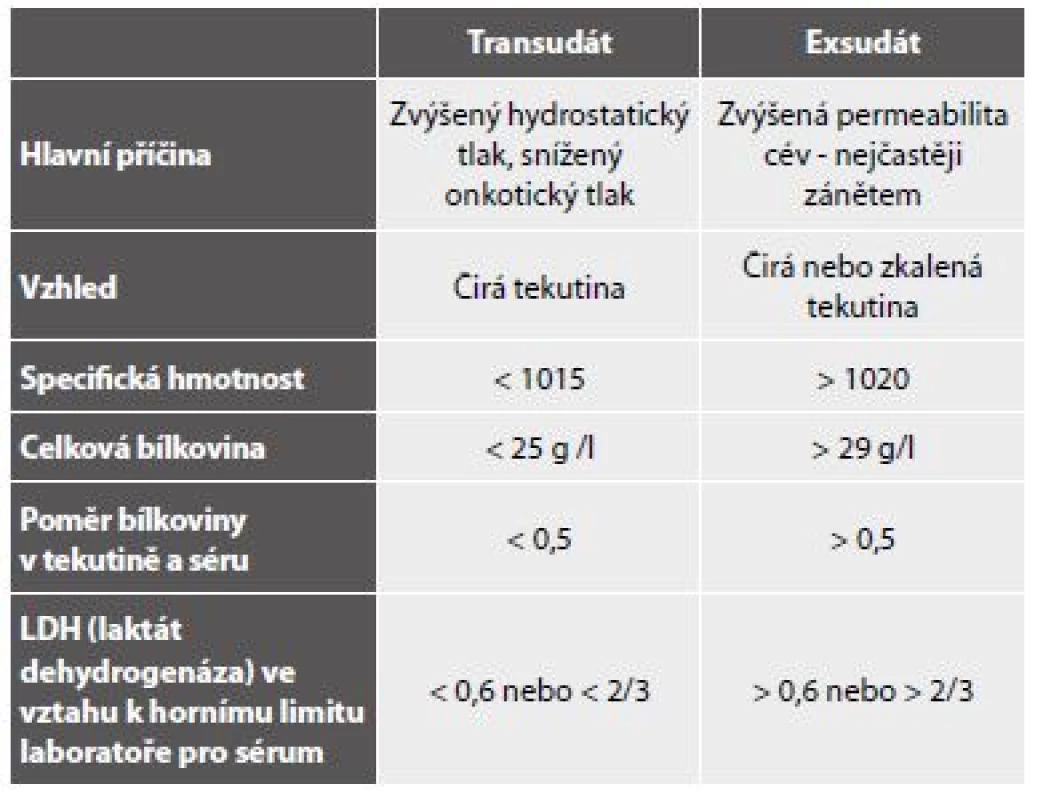
Krev v coelomových dutinách
Zatímco v perikardiálním vaku vede tato situace rychle k tamponádě při všech příčinách (penetrující trauma, ruptura transmurálního infarktu myokardu, disekující aneurysma aorty s rupturou do perikardu) a stav není indikací k cytologickému vyšetření, stavy s pozvolnějším rozvojem imponující jako hemoperikard jsou prakticky vždy silně hemoragické výpotky (viz dále). Hemothorax a hemoperitoneum budou mít často traumatickou anamnézu, případně i iatrogenní. Z naší zkušenosti můžeme uvést hemothorax po kanylaci jugulární žíly a hemoperitoneum po tlustojehlové biopsii předpokládané metastázy v játrech, která se ukázala být kavernózním hemangiomem. Ve všech coelomových dutinách je nutno počítat s možností endometriózy, v dutině hrudní ji popisují Augoulea se spoluautory (40) Zdrojem hemoperitonea s ne vždy jasnou anamnézou může být ruptura sleziny, trauma jater při resuscitaci (41), případně mimoděložní těhotenství. U novorozenců pak ruptura subkapsulárního hematomu jater jak časně poporodní, tak pozdní (42). Makroskopický vzhled evakuované tekutiny vzhledu krve potvrdí v protrahovaných stavech cytologický obraz, v němž oproti hemoragickým exsudátům bude reaktivně zánětlivá složka vyjádřena nanejvýš přítomností erytrofagické úklidové reakce s příměsí hemosiderofágů (obr. 3).
3. Hemothorax u pacienta s malobuněčným plicním karcinomem. Nádor ve výpotku a posléze ani při pitvě v pleurální dutině zjištěn nebyl. Masivní erytrocytofagická reakce. (HE, 200x) 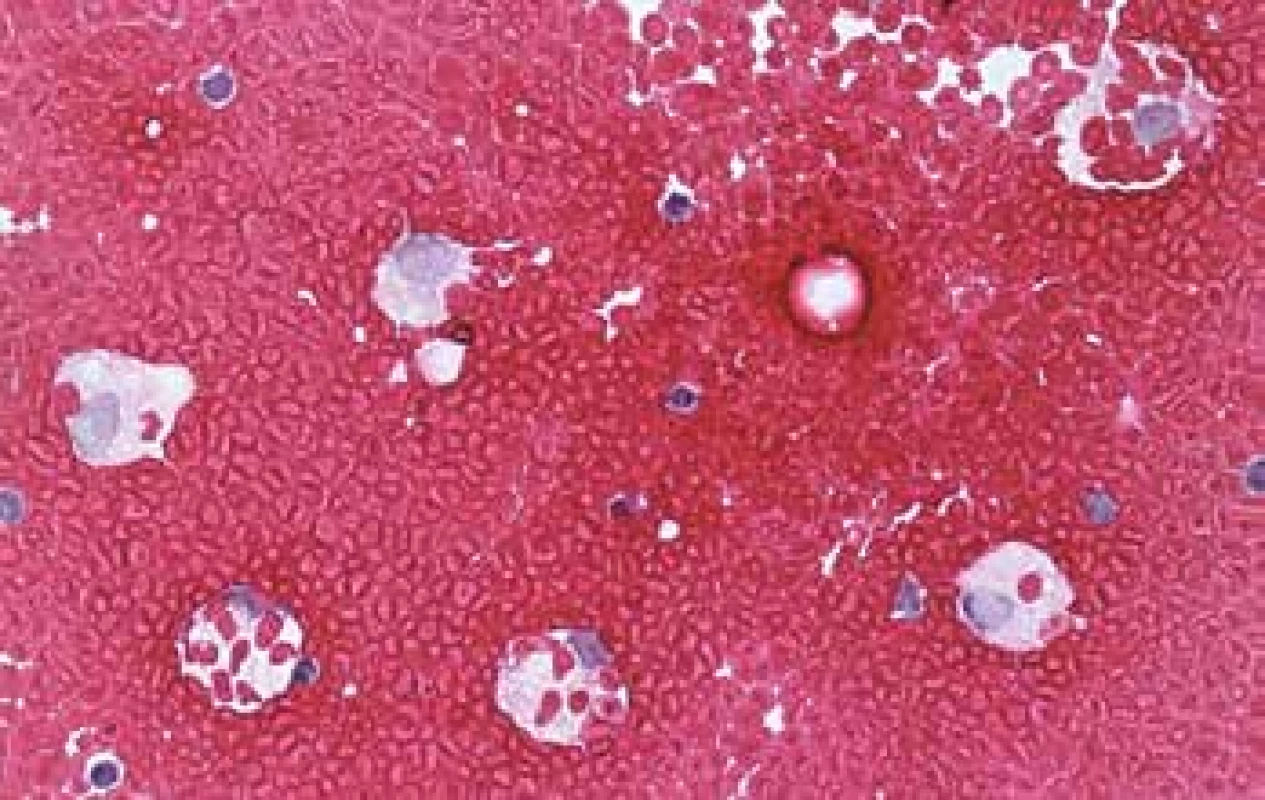
Chylus je nejčastěji evakuován z dutiny hrudní. I v perikardu a peritoneu se však chylus může objevit jakožto komplikace traumatická nebo pooperační, méně často v důsledku nenádorového (tbc, malformace) (43), nebo nádorového onemocnění. Některá z těchto onemocnění zůstávají klinicky němá a pak se chylózní obsah dutin nezřídka popisuje jako idopatický (44-50).
Diagnózu zpravidla indikuje makroskopický vzhled tekutiny - bělavý opaleskující s vysokým obsahem triglyceridů (>500 mg/dL) a poměrem cholesterolu a triglyceridů menším než 1. Posledně zmíněná nemorfologická analýza může napomoci odlišení od pseudochylózních výpotků s vysokým obsahem cholesterolu. Mikroskopicky dominují pěnité makrofágy, pozitivní v barvení olejovou červení a mezotelie, v nichž rovněž mohou být kapénky lipidů přítomny. Pseudochylózní (často zvané i „cholesterolové“) výpotky představují nebližší diferenciální diagnózu. Mají vedle těchto součástí i složku zánětlivých buněk a často také cholesterolových krystalů s typickým vzhledem „skleněných tabulek“ (obr. 4). Není-li patogeneze zřejmá, je vždy nutno vyloučit příměs nádorových buněk .
4. Cholesterolová perikarditis. 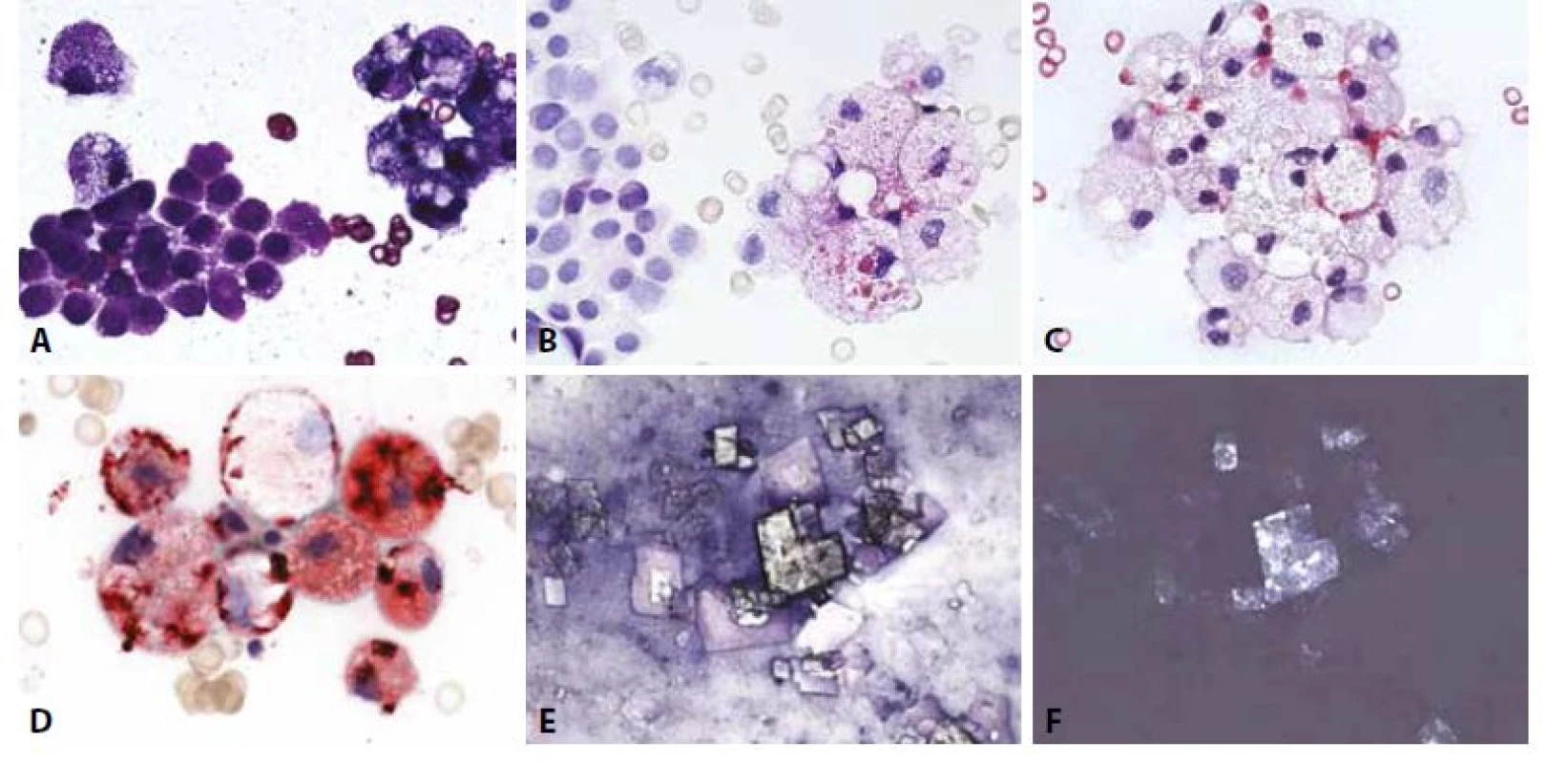
B - Mezotelie (vlevo) a pěnité makrofágy PAS téměř zcela negativní. (PAS 400x)
C - Skupinky pěnitých makrofágů. V dolní části skupinky jednojaderná a dvoujaderná mezotelie. (HE, 400x)
D - Pěnité makrofágy s pozitivním obsahem lipidů a dvě prstencově degenerované mezotelie. (olejová červeň O, 400x)
E - Cholesterolové krystaly. (MGG 200x)
F - Cholesterolové krystaly – optická aktivita. (polarizované světlo, 200x)Zánětlivé výpotky bez přítomnosti nádorových buněk
Zánětlivé výpotky bez přítomnosti nádorových buněk mohou mít jak infekční, tak neinfekční etiologii. V infekční etilogii se uplatní všechny kategorie mikroorganismů, viry bakterie, plísně. Často jde o šíření z okolí a někdy je v tomto smyslu pozitivní anamnéza. Makroskopický vzhled zkalené tekutiny může nabývat až charakteru empyému, případně napodobovat chylus nebo imponovat jako krev. Nehnisavý exsudát však nemusí být makroskopicky odlišitelný od transudátu.
Mikroskopický obraz je zpravidla bohatě buněčný. V akutních bakteriálních zánětech seróz dominují neutrofilní granulocyty, které jsou většinou morfologicky narušené a procesem dystrofické steatózy se rozpadají na hnis (obr. 5). V subakutních výpotcích se objevuje příměs lymfoplasmocelulární a makrofágy, posledně zmíněné obvykle se známkami fagocytární aktivity. Virové záněty mají od počátku celulizaci lymfocytární. V diferenciální diagnóze však zde stojí výpotky tuberkulózní, které mohou bohatou populací relativně monomorfních lymfocytů spolu s téměř úplným chyběním mezotelií napodobovat i lymfom. Je-li obraz neobvykle buněčný a monomorfní,napomůže typizace s průkazem T-lymfocytární příslušnosti zastoupených buněk. Etiologické agens infekčních výpotků se podaří identifikovat pouze zřídka, podle povahy zánětlivé celulizace však stojí za to bakterioskopické barvení (Gram, Ziehl-Neelsen, PAS, Grocott) provést. Virové cytopatické změny popsané v jiných lokalizacích pro cytomegalovirus nebo herpetické viry lze pozorovat i ve výpotcích (51). Při této zvažované etiologii jsou k dispozici i protilátky pro imunocytochemické postupy a laboratoře vyšetřující vyšší podíl imunokompromitovaných pacientů jimi nezřídka disponují. Zánětlivé procesy vedou často k regresivním změnám buněk – jak zánětlivého infiltrátu, tak mezotelií. Tuto okolnost je třeba si uvědomit jako možnou součást cytologického obrazu i u vzorků s dobře zajištěnou preanalytickou fází vyšetření. Regresivně změněné buňky vykazují často setřelou strukturu a hyperchromázii, nebo naopak vyblednutí jaderného chromatinu spolu s eozinofilií cytoplasmy a v případě mezotelií pravidelně i výraznou hydropickou degenerací a vakuolizací cytoplazmy, někdy až do obrazu buněk prstencových (obr. 5). Tyto buňky je nutno vyloučit z hodnocení směrem k uvažované příměsi nádorových buněk! Mohou a mají být samozřejmě jako projev zánětlivý součástí cytologického popisu. Vedle regresivních změn je však nutno zvážit i okolnost, že zánětlivé elementy i mezotelie (a také buňky nádorové, o nich však později) se ve výpotku do jisté míry chovají jako ve tkáňové kultuře – proliferují a pravidelné mitózy proto nejsou nikterak výjimečným nálezem.
5. Hnisavý zánět. 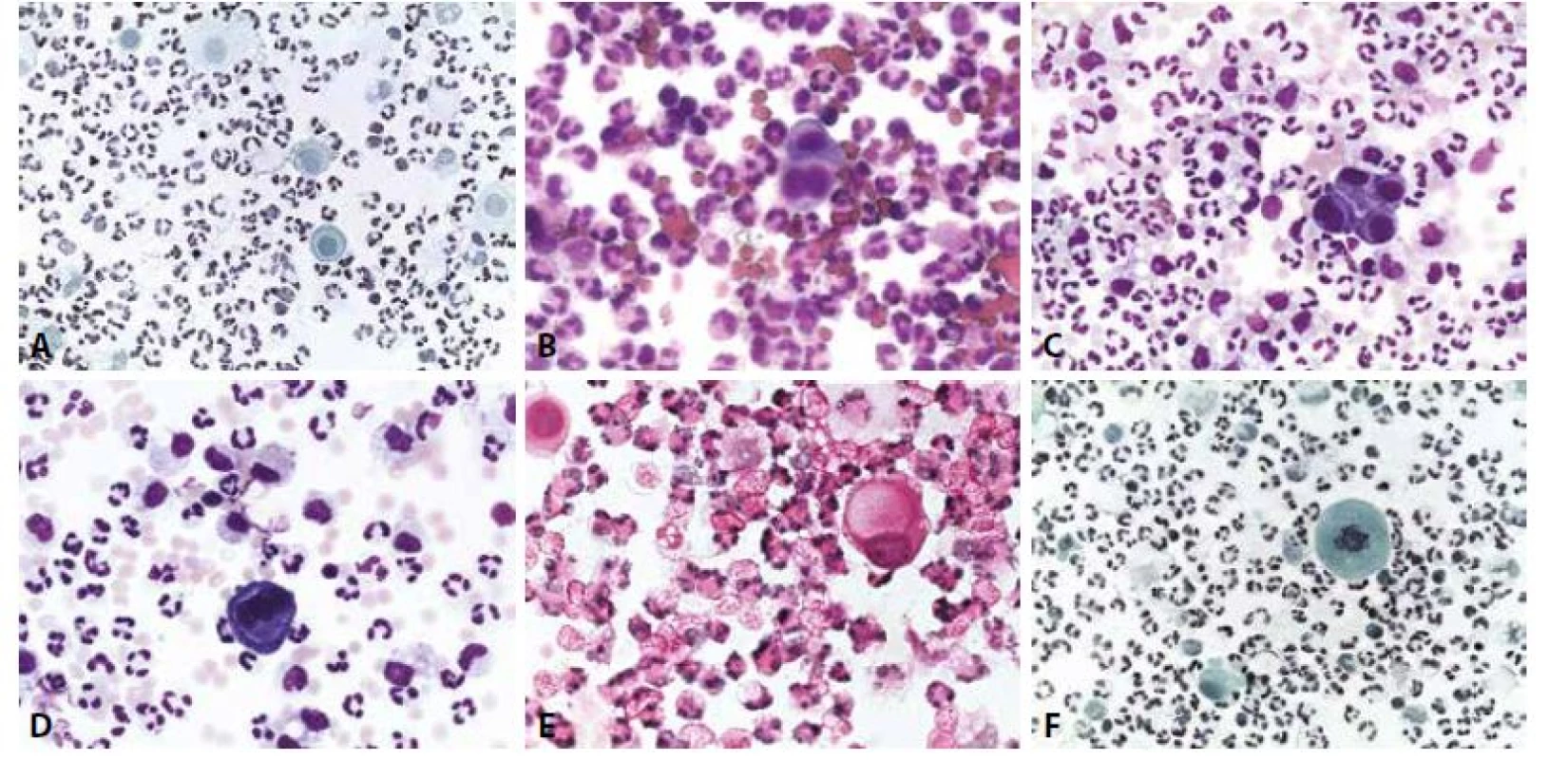
A - Akutní peritonitis. Neutrofilní granulocyty, ojediněle makrofágy, mezotelie dobře zachovalé (centrum) a s mírnými regresivními změnami (od středu nahoru). (polychrom, 400x)
B - Akutní pleuritis. Neutrofilní granulocyty, erytrocyty i mezotelie (jedna dvoujaderná) výrazněji narušené. (MGG, 400x)
C - Akutní pleuritis. Mezotelie v kohezivní formaci s „okénky“. Vedle neutrofilních granulocytů i poměrně hojné makrofágy. Příměs erytrocytů. (MGG, 400x)
D - Akutní pleuritis. Trojjaderná mezotelie. Vedle neutrofilních granulocytů i poměrně hojné makrofágy. Příměs erytrocytů. (MGG, 400x)
E - Akutní peritonitis. Mezotelie degenerovaná do obrazu prstencové buňky. (HE, 400x)
F - Akutní peritonitis. Mezotelie v mitóze. (polychrom, 400x)Nález atypické mitózy je alarmující ve smyslu uvažované příměsi nádorových elementů, nikoli však absolutním důkazem. V diagnóze infekčních výpotků indukovaných z klinicky zřejmých zánětů v okolí (pneumonie, appendicitis, salpingitis, cholecystitis, diverticulitis…) napomohou anamnestické údaje. Podobně se vyskytují výpotky i u řady neinfekčních procesů s akutním (infarkty plic a myokardu - pericarditis epistenocardiaca; akutní pankreatitis s pleurálním výpotkem) i chronickým průběhem (jaterní cirhózy, urémie, systémový lupus, revmatoidní artritis, endometrióza). V souvislosti s léčbou (dlouhodobá dialýza s výpotky v pleurální a perikardiální dutině, radiace, chemoterapie) dochází k tvorbě recidivujících a chronických výpotků. V nich se pravidelně objevují výrazné reaktivní změny mezotelií s proliferací, často v podobě dvou - a vícejaderných forem, kompaktních morulárních formací sestávajících z méně zralých forem (obr. 6,7). Ty nezřídka vyžadují k odlišení koincidující malignity pečlivou analýzu architektonických a cytomorfologických znaků (tab. 6). Teprve poté je na místě indikovat speciální metodiky a s rozmyslem také imunocytochemická došetření. V interpretaci je nutno vzít v úvahu i skutečnost, že recidivující výpotky s protrahovanou iritací mohou v nádorový proces (v popsaných kazuistikách vždy typu lymfomu) vyústit (52-54).
6. Podobnosti mezotelií s nádorovými buňkami a cesty řešení (volně dle R. De Maye, 1996). 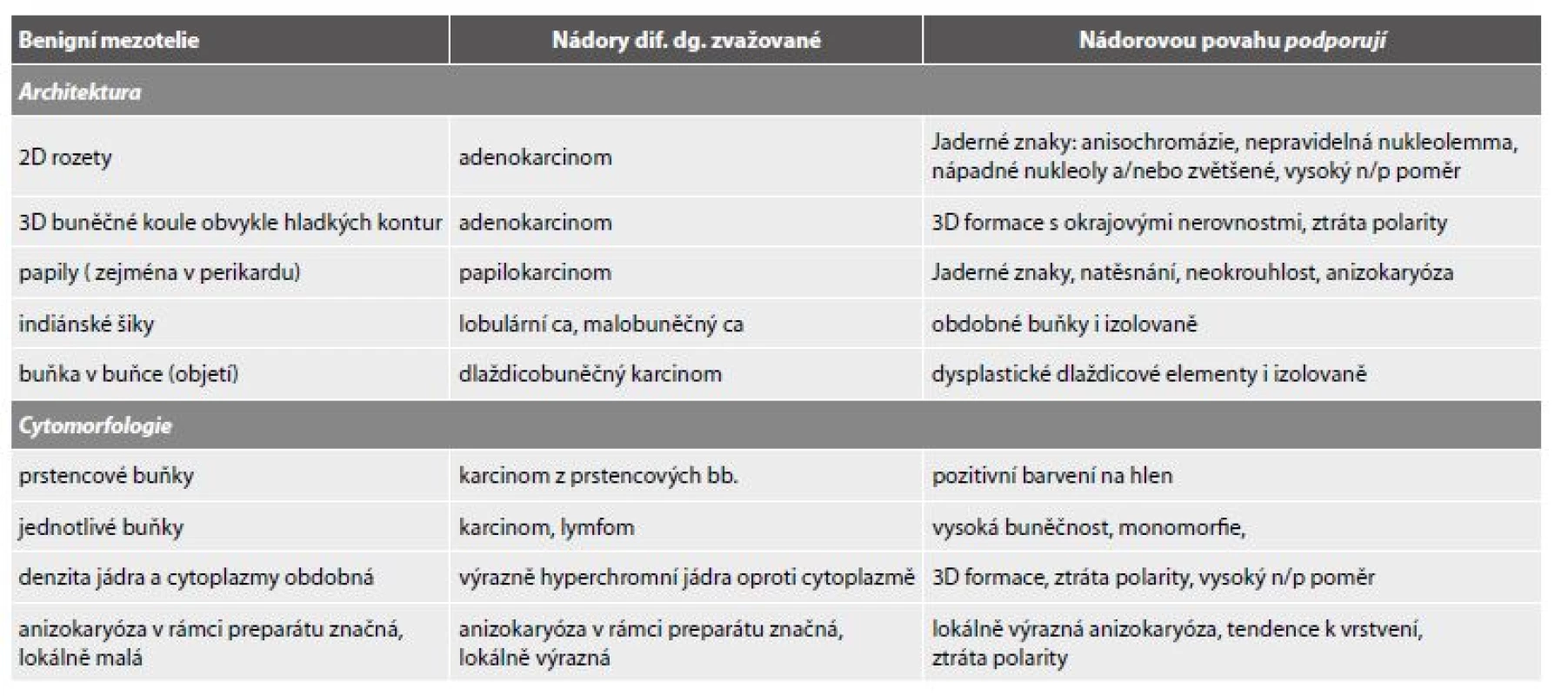
6. Nehnisavý zánět. 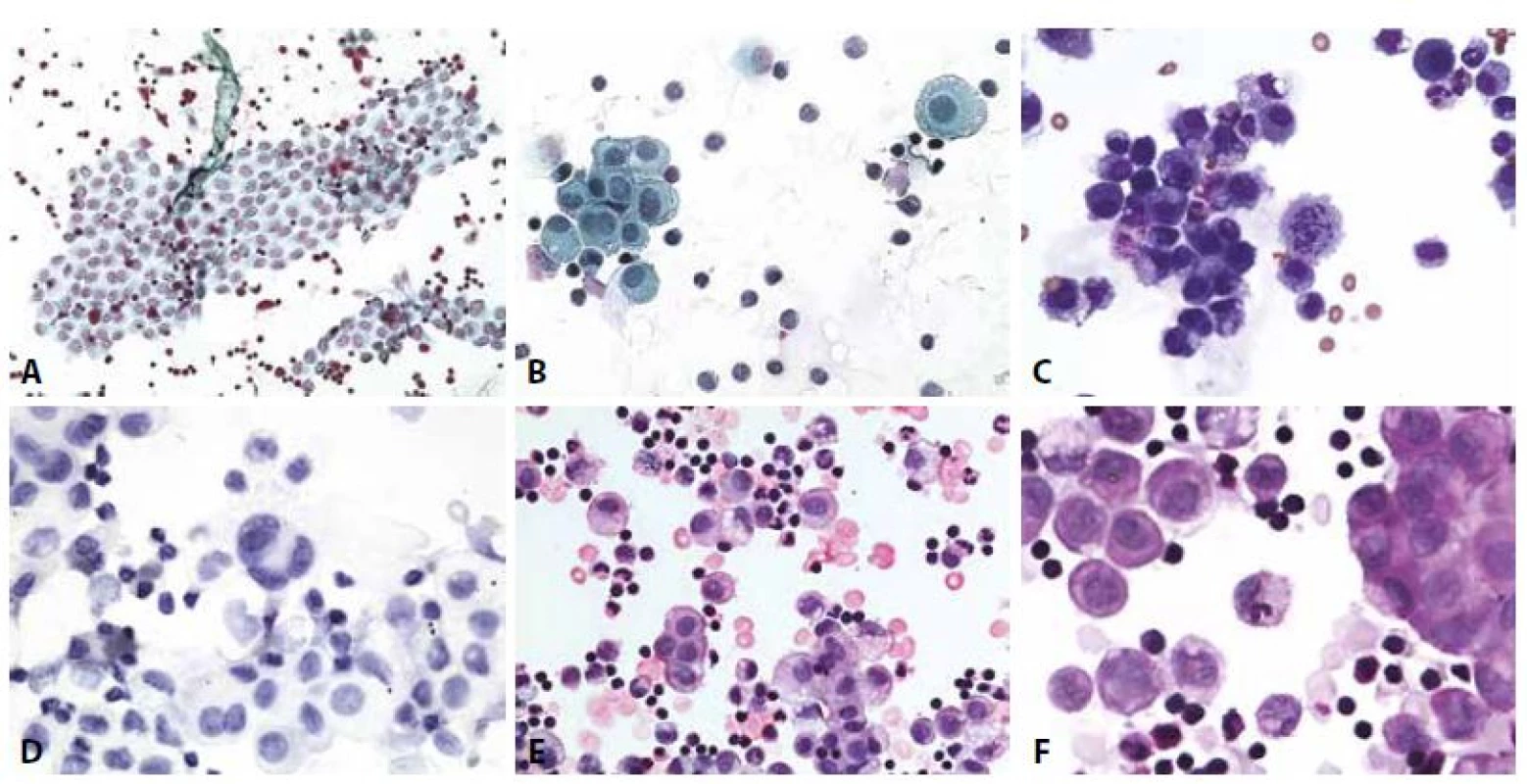
A - Mírná nehnisavá peritonitis. Plošná mezoteliální formace s kulatobuněčnou celulizací. (polychrom, 200x)
B - Nehnisavá peritonitis. Mezotelie s anizokaryózou, jedna dvoujaderná, počínající periferní mikrovakuolizace. (polychrom, 400x)
C - Nehnisavá pleuritis. Lymfocyty a makrofágy obklopující mezotelie. Vlevo erytrofág. V centru mitóza makrofága. (MGG, 400x)
D - Nehnisavá pleuritis. Mezotelie, v centru čtyřjaderná, kulatobuněčný infiltrát. Imunocytochemie – BerEP4 negativní. (400x)
E - Subakutní až chronická pleuritis. Mezotelie s regresivními změnami erytrocyty, smíšená zánětlivá celulizace. (HE, 400x)
F - Subakutní až chronická pleuritis. Mezotelie v plošné i morulární (vpravo) formaci. V centru neutrofilní granulocyt v makrofágu. (HE, 600x)7. Reaktivní mezotelie. 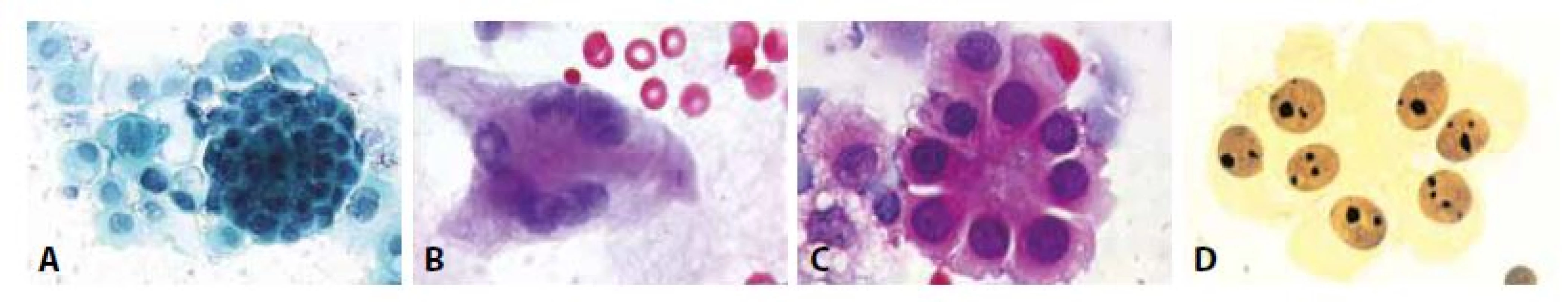
A - Morulární formace proliferujících mezotelií. Jádra pravidelná, mírně hyperchromní, nukleoplazmový poměr zvýšen. (polychrom, 400x)
B - Vícejaderná reaktivní mezotelie. Fibrin. (HE 400x)
C - Rozetovitá formace mezotelií. (HE, 400x)
D - V impregnaci AgNOR mají mezotelie 1-2 nukleoly, mohou být polyploidní. (impregnace, 400x)VÝPOTKY S PŘÍTOMNOSTÍ NÁDOROVÝCH BUNĚK
Tak jako ve všech jiných lokalitách je třeba i v coelomových prostorách zvažovat nádory primární a metastatické. I při určité dynamice zastoupení zmíněných procesů dané omezeným užitím azbestu jakožto významného kancerogenu, a naopak nárůstu imunokompromitovaných jedinců v populaci s vyšší incidencí primárních lymfomů, zůstávají zdaleka nejčastějšími nádorovými procesy v coelomových dutinách nádory metastatické. Z hlediska incidence převažují (adeno)karcinomy, sledovány melanomem a dalšími histogeneticky odlišnými maligními tumory. Problematika benigních nádorových procesů je zde poměrně okrajová, může však být zdrojem velmi překvapivých obrazů, popisovaných nejčastěji v souvislosti se zralými teratomy - nejen v dutině peritoneální (55-61).
Následující text je řazen s ohledem na incidenci cílen zejména na rozpoznání karcinóz a jejich diferenciální diagnózu. Ve snaze formulovat obecné rysy maligních výpotků, jejichž rozpoznání je nejdůležitějším a nejčastějším zadáním, je třeba hned v úvodu zdůraznit to, co činí diagnostiku výpotků tak obtížnou. Žádný z dále popsaných znaků není patognomonický, diagnóza je stanovována sumací. Specializovaná došetření mohou být velmi přínosná – za předpokladu promyšlené indikace a kritické interpretace.
Obecné rysy maligních výpotků
Maligní výpotky jsou zpravidla chronické nebo recidivující exsudáty. Zánětlivý infiltrát je tedy nejčastěji chronický, méně často smíšený, i když příměs neutrofilních granulocytů se ve skupinkách nádorových buněk může objevit. Literárně až 20 % nádorových výpotků mohou být (biochemicky, nikoli cytologicky) transudáty. Naše zkušenost hovoří pro incidenci podstatně nižší, tím je však nález zrádnější. Nádorové buňky s podobností mezoteliím (s možným původem např. v ovariu, nebo plíci) mohou být při úplné absenci celulární zánětlivé odezvy podhodnoceny.
Karcinózy coelomových prostorů
Často udávaným a nesporně užitečným rysem je identifikace takzvané druhé/ cizorodé populace buněk (obr. 8,9). Po zhodnocení zpravidla přítomného zánětlivého infiltrátu a účasti nepochybně mezoteliálních buněk zůstává k zařazení populace buněk nejisté povahy. Pro jejich nádorovou povahu mohou svědčit na mikroarchitektonické úrovni objemné trojrozměrné kulovité formace („cell balls“), které historicky vedly k prvním diagnostickým odhalením metastatických karcinomů – zejména mammárního (62, 63). Vyskytují se však i u celé řady jiných adenokarcinomů. Obecně jsou velké buněčné agregáty, nejen cell balls (obr. 8-13,15), ale i jinak strukturované mikrofragmenty suspektní z malignity a to jak karcinózy, tak případně mezoteliomu, i jiné. Je však nutno si uvědomit, že řada malignit uvedené formace netvoří (lobulární karcinom prsu, malobuněčný karcinom, lymfom, melanom, sarkomy). Na tuto možnost je nutno aktivně pomýšlet zejména v situaci, kdy je negativní anamnéza. Jednotlivě, ale někdy i ve skupinkách přítomné buňky nemusí nutně imponovat jako cizorodá populace. Při známé polymorfii mezotelu se jim mohou podobat (obr. 10,15). Vroubkované okraje trojrozměrných buněčných formací jsou častější u mezotelií (nádorových i nenádorových) u karcinomů je obvod častěji kompaktně hladký. Nádorové buňky ve výpotcích mohou proliferovat, lze pozorovat typické i atypické mitózy.
8. Příklady nejběžnějších karcinóz coelomových dutin: Žena 52 let triple - negativní karcinom prsu. Pleurální punktát. 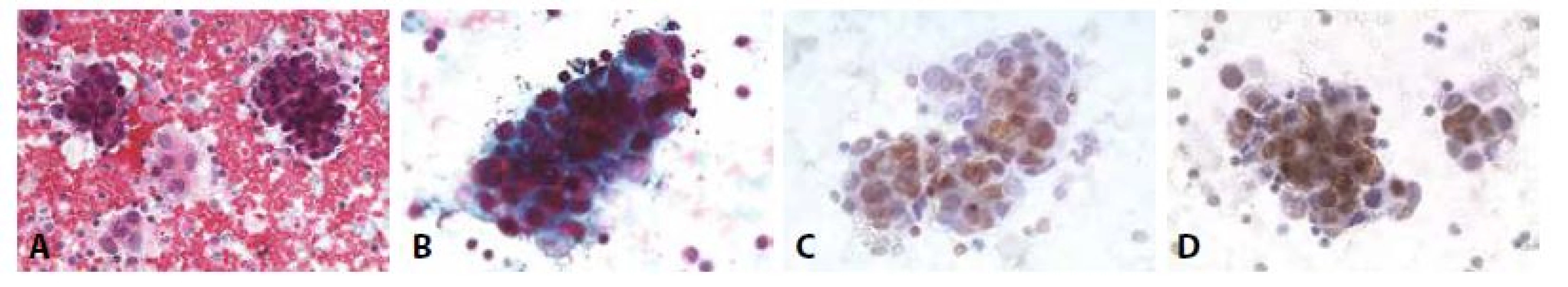
A - Dvojí buněčná populace – dvě skupinky nádorových buněk, mezi nimi skupinky mezotelií. (HE, 200x)
B - Kompaktní formace karcinomových buněk. ztráta polarity. Anizokaryóza. Neokrouhlá hyperchromní jádra. (polychrom, 400x)
C - Cytospin. (GATA3, 400x)
D - Cytospin. (GCDFP, 400x)9. Příklady nejběžnějších karcinóz coelomových dutin: Žena 73 let, ablace prsu pro karcinom před 10 lety, chemo- a radioterapie. Pleurální punktát. 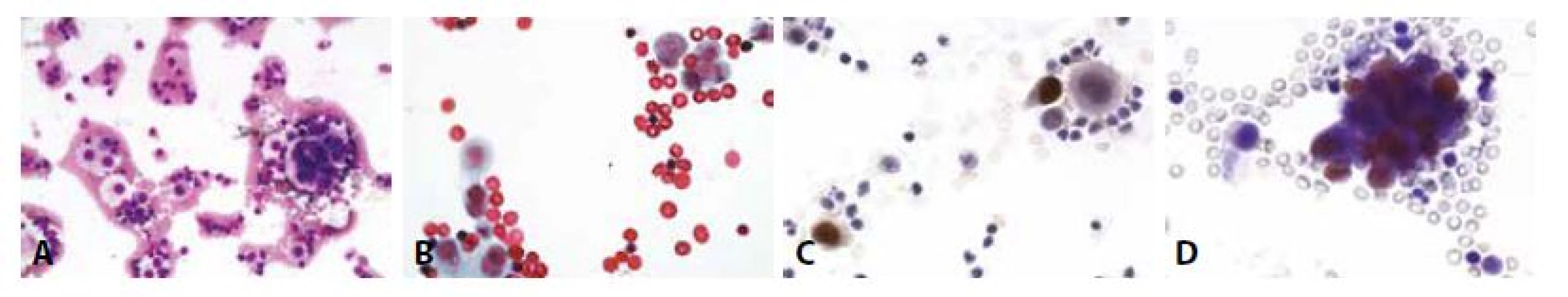
A - Dvě populace buněk- vlevo mezotelie, vpravo skupinka nádorových buněk. (MGG, 400x)
B - Jednotlivé suspektně nádorové buňky vpravo nahoře, vlevo dole mezotelie. (polychrom, 400x)
C - Cytospin, estrogenové receptory. (400x)
D - Cytospin, progesteronové receptory. Jednotlivé nádorové buňky s pozitivními jádry, mezotelie negativní. (400x)10. Příklady nejběžnějších karcinóz coelomových dutin: Žena 73 let, serózní borderline tumor ovaria před rokem. Peritoneální výpotek. 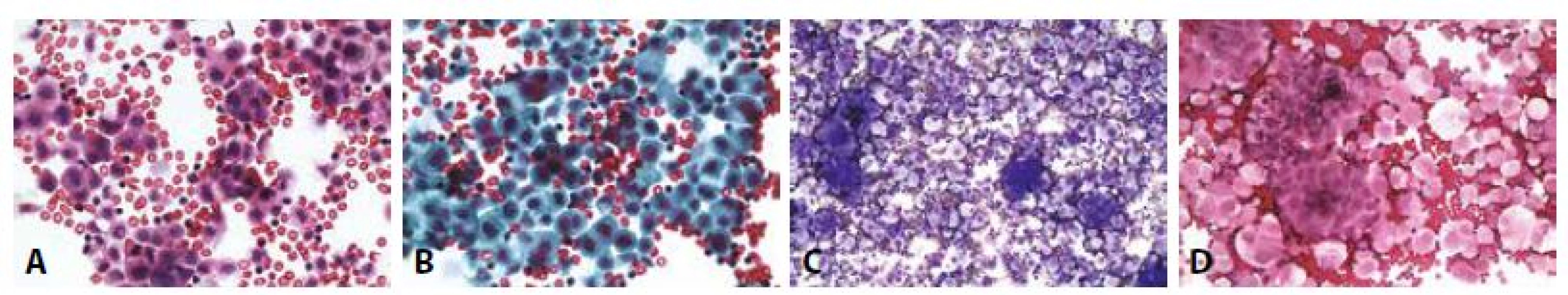
A - Jedna buněčná populace – nádorová. Povrchní podobnost s mezoteliemi. Jádra hyperchromní, neokrouhlá, vakuolizace cytoplazmy převahou perineukleární. Atypické mitózy v centru. (HE, 400x)
B - Totéž polychrom.
Žena 65 let serózní papilární karcinom ovaria high grade. Peritoneální výpotek.
C - Papilární mikrofragmenty s psammomatózními tělísky. (MGG, 100x)
D - Totéž v barvení HE. (100x)11. Příklady nejběžnějších karcinóz coelomových dutin: Muž 53 let, pokročilý karcinom slinivky. Karcinomatózní peritonitis. 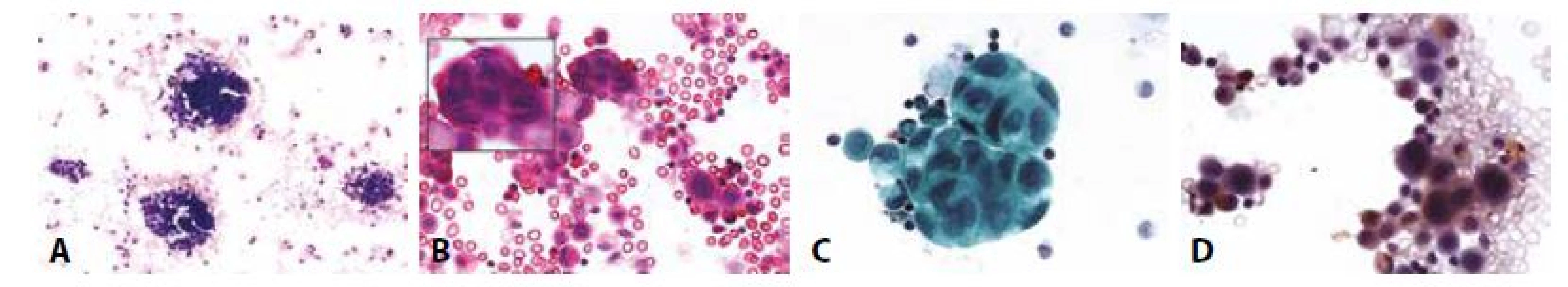
A - Trojrozměrné kompaktní buněčné formace. (MGG, 100x)
B - V proostřování patrna mitotická aktivita – šipka ve vloženém obrázku. (HE, 400x)
C - Buňky s rysy high grade dysplazie. Anizokaryóza, neokrouhlá jádra. Ztráta polarity. (polychrom, 400x)
D - BerEP4 pozitivní, mezotelie (dvě vpravo nahoře, dvě vpravo dole) negativní. (400x)12. Příklady nejběžnějších karcinóz coelomových dutin: Muž 55 let adenokarcinom plic. Karcinomatózní pleuritis. 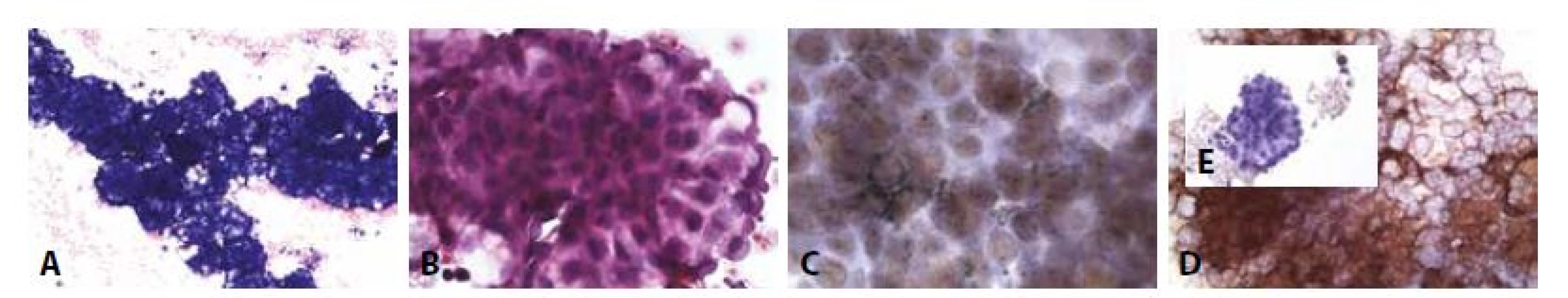
A - Objemné trojrozměrné formace buněk s náznaky rozetovité úpravy. (MGG, 100x)
B - Náznaky papilárních formací. Morfologie připouští jak karcinom, tak mezoteliom. (HE, 400x)
C - TTF1 pozitivní v jádrech nádorových buněk. (400x)
D - BerEP4 silně pozitivní. (400x)
E - Vložený obrázek. HBME1 negativní v nádorových buňkách, vpravo nahoře pozitivní mezotelie. (400x)13. Příklady nejběžnějších karcinóz coelomových dutin: Muž 69 let. Karcinomatózní perikarditis. Spinocelulární karcinom plíce. 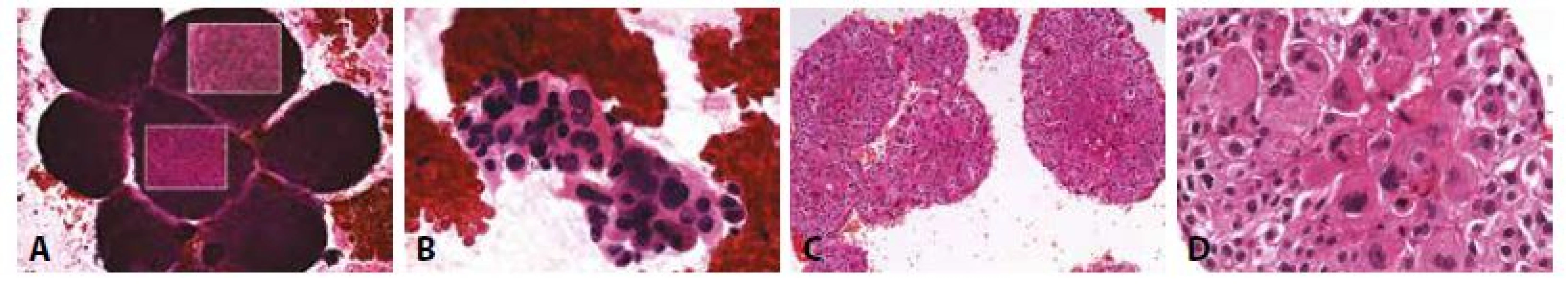
A - V krevním pozadí objemné vrstvené formace, jen velmi omezeně hodnotitelné i v proostřování (vložené obrázky). (HE, 100x)
B - Prohledáním nátěru lze najít i menší lépe hodnotitelná uskupení buněk s náznaky dlaždicové diferenciace. (HE 400x)
C - Zpracování do cytobloku učiní z nepřehledné mikročástky vysoce informativní část vzorku. Cytoblok. (HE, 100x).
D - V řezu z cytobloku je zřejmá dlaždicová diferenciace karcinomu. (HE, 400x)Lymfomy šířící se do coelomových prostorů byly vždy (stejně jako melanom a sarkomy) méně častým postižením ve srovnání s karcinózami. Zpravidla se rozvíjejí při již klinicky manifestním onemocnění blokádou lymfatik. Primární lymfomy coelomových dutin byly v minulosti raritní (64). V souvislosti s HIV epidemií se vzápětí objevují popisy primárních high grade lymfomů u pacientů s pokročilým AIDS, typizovány imunocytochemicky a molekulárně biologicky vykazují souvislost s viry Ebsteina - Barrové a herpesviry Kaposiho sarkomu (65-67). Diagnóza je obtížná, high grade lymfomy často napodobují diagnosticky preferenčně zvažovanou karcinózu (68). Identifikace vyžaduje více než u jiných obrazů širší spektrum metod a interdisciplinární spolupráci. Narůstající zkušenost s těmito obrazy zároveň umožnila diagnózu lymfomů i u dalších imunokompromitovaných stavů mimo AIDS (69-72). Vysoce přínosná je v kombinaci s cytologií v diagnostice maligních lymfoproliferací průtoková cytometrie (73).
Monomorfní infiltrace je v cytologickém obraze lymfomů zpravidla prvním nálezem (74) (obr. 14), k němuž nejbližší diferenciální diagnózu představují reaktivní výpotky a nekohezivní typy karcinóz. V základním cytomorfologickém hodnocení nesporně přispěje zkušenost hematopatologicky orientovaného patologa, protože se v coelomovém prostoru vyskytují lymfomy non Hodgkinovy B i T řady, malo - i velkobuněčné, i lymfomy Hodgkinovy. V imunotypizaci je vodítkem profil anamnesticky udaného tumoru, pokud je k dispozici. Je nutno zvážit i případnou zavádějící imunocytochemickou pozitivitu cytokeratinů (75).
14. Leukémie v coelomové dutině: Muž 91 let. Anamnéza CLL. 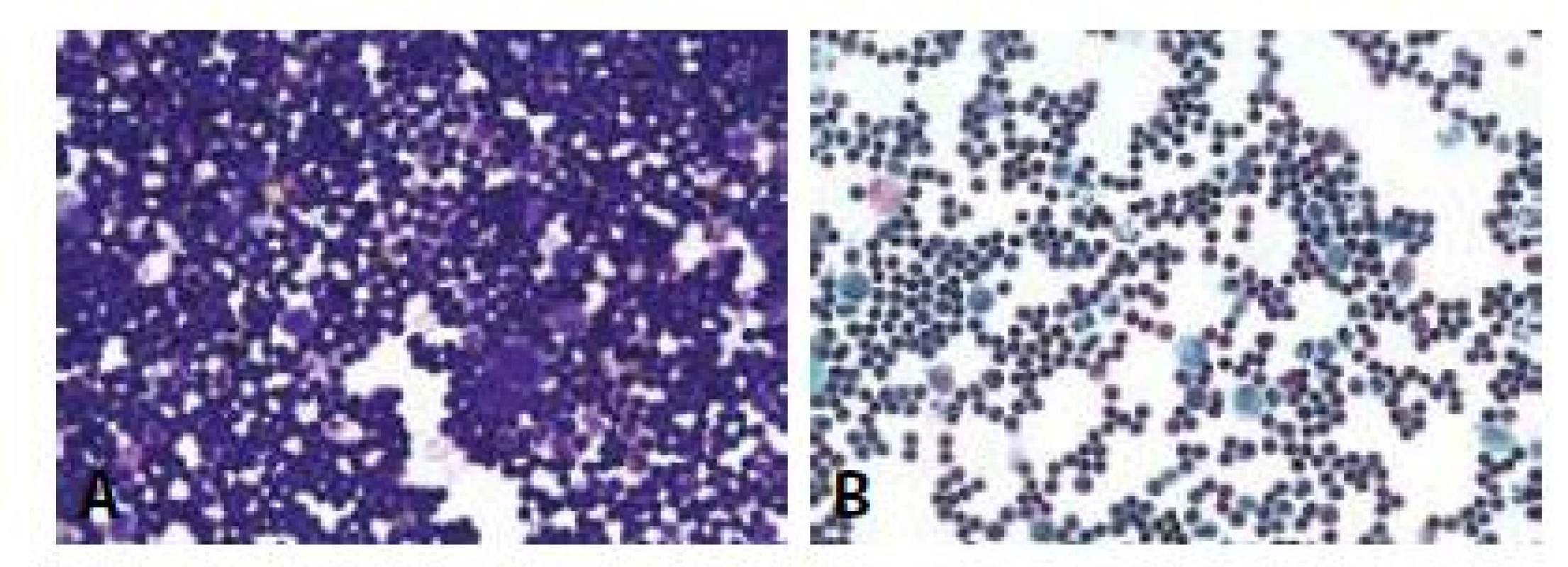
A - Monomorfní vysoce buněčný infiltrát malými lymfocyty bez známek imunitní transformace. Ojedinělé mezotelie. (MGG, 400x)
B - Ojediněle patrna příměs neutrofilních granulocytů a plasmocytů. (polychrom, 400x)U malých dětí vstupují do diferenciální diagnózy kulatobuněčné sarkomy (Ewingův, dezmoplastický sarkom z malých kulatých buněk), neuroblastom, Wilmsův tumor. Bohatě buněčný obraz poskytuje možnost imunotypizace v cytoblokovém materiálu. Dětské intrathorakální tumory mohou imponovat jako empyém (76).
Mezoteliomy jsou zpravidla nádory dospělého věku, jen výjimečně se objevují v dětství (77-81). Souvisí to nepochybně s dlouhou latencí kancerogenního účinku asbestu. U dospělých představují většinu mezoteliomy pleurální dutiny s poměrem k peritoneální a perikardiální lokalizaci přibližně 6 : 2:1 (82). Histologicky převažují varianty s epiteliální složkou - buď samotnou, nebo v kombinaci - mezoteliomy bifázické. Sarkomatoidní formy představují méně než čtvrtinu případů. Klinicky se mezoteliomy zpravidla manifestují (stejně jako plicní a jiné karcinomy) objemnými rychle se obnovujícími výpotky. Vzhledem k obvyklému makroskopickému obrazu mezoteliomu a jeho relativní vzácnosti je záhodno k diagnóze mezoteliomu bez radiologicky prokázané pleurální masy přistupovat krajně zdrženlivě. V cytologickém vyšetření v obou histologických subtypech s epiteliální komponentou dominují velké vrstvené formace i izolované buňky, u nichž je základním úkolem, vzhledem k značné polymorfii, odlišení, zda jde o mezoteliální, nebo karcinomové buňky (obr. 15). Protože zánět doprovází obě nádorové situace a navíc chronický zánět může být zdrojem iritativní mezoteliální proliferace nenádorové povahy, bývá diagnóza mezoteliomů nesarkomatoidního typu zpravidla stanovována z těchto tří diferenciálních diagnóz pomocí speciálních došetření. Na podkladě konsensu mezoteliomové skupiny je nutno standardně použít panel minimálně čtyř protilátek – dvou markerů mezotelu a dvou epitelových (tab. č. 2 a 3). Sarkomatoidní varianty zůstávají až dosud cytologicky spolehlivě nediagnostikovatelné (83, 84).
15. Mezoteliom: Muž, 73 let, anamnéza karcinomu prostaty léčeného prostatektomií před jedním rokem. Pleurální výpotek. Paralelně dodán bioptický vzorek z pleury. 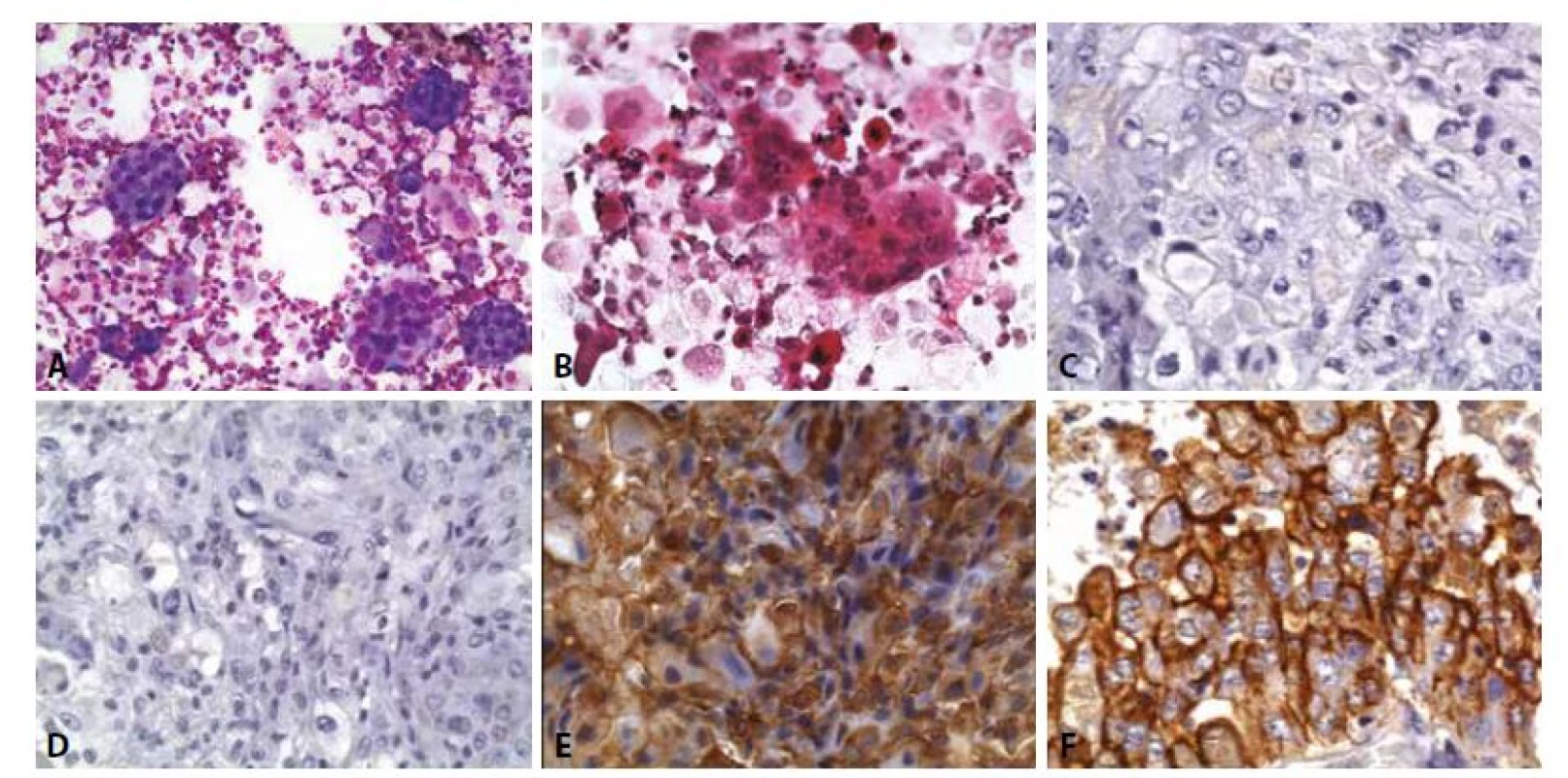
A - Objemné kompaktní formace atypických buněk s hladkými nebo lehce vroubkovanými okraji. V pozadí smíšená zánětlivá celulizace, erytrocyty poměrně hojné makrofágy se známkaami fagocytární aktivity, erytrofágy. (MGG, 200x)
B - Atypické buňky připouštějí jak dg. adenokarcinomu, tak mezoteliomu. Eozinofilní degenerované buňky jednotlivě v pozadí.
C - Biopsie z pleury – imunohistochemický průkaz BerEP4 negativní. (400x)
D - Biopsie z pleury – imunohistochemický průkaz CEA negativní. (400x)
E - Biopsie z pleury – imunohistochemický průkaz calretininu pozitivní. (400x)
F - Biopsie z pleury – imunohistochemický průkaz HBME-1 pozitivní. (400x)
Zemřel v následujícím roce. Autopsie potvrdila generalizovaný mezoteliom, karcinom prostaty byl prostatektomií vyléčen.FORMULACE CYTOLOGICKÉHO ZÁVĚRU
Formulace cytologického nálezu představuje velmi důležitý závěrečný krok cytologického vyšetření výpotku.
Významným úvodním krokem je makroskopický popis množství a kvality dodané tekutiny. Následuje údaj o vstupním zpracování – pro informaci o extenzitě vyšetření jsme zvyklí uvádět počet a typ primárně vyšetřených preparátů.
Následuje popis celkové buněčnosti vzorku, jednotlivých subpopulací a zachovalosti buněk, podrobný morfologický popis reziduální cytoarchitektoniky (buněčná uskupení, polarizace buněk, případný vztah k účasti fibrinu, zánětlivá celulizace ve skupinách…) a cytologických charakteristik zastoupených buněk. Z tohoto popisu by měla logicky vycházet indikace k specializovaným došetřením. Jejich výsledky interpretované v návaznosti na morfologický nález vedou k závěru. Tím je cytologický nález: buď jednoznačná diagnóza, nebo diferenciálně diagnostická rozvaha s případným návrhem dalších vyšetření jak za rámec cytomorfologický, tak případně doporučení opakovat cytologické vyšetření ze stejné lokality. Ve formulaci se zásadně snažíme přiblížit co nejvíce terminologii histopatologické.
Závěrečné kódování topickým kódem a kódem Mezinárodní klasifikace nemocí doplňuje informaci a usnadňuje vyhledávání v databázi.
7. Pomůcka k rozhodování o případné maligní povaze výpotku (volně dle Kosse, Bedrosjana, De Maye). 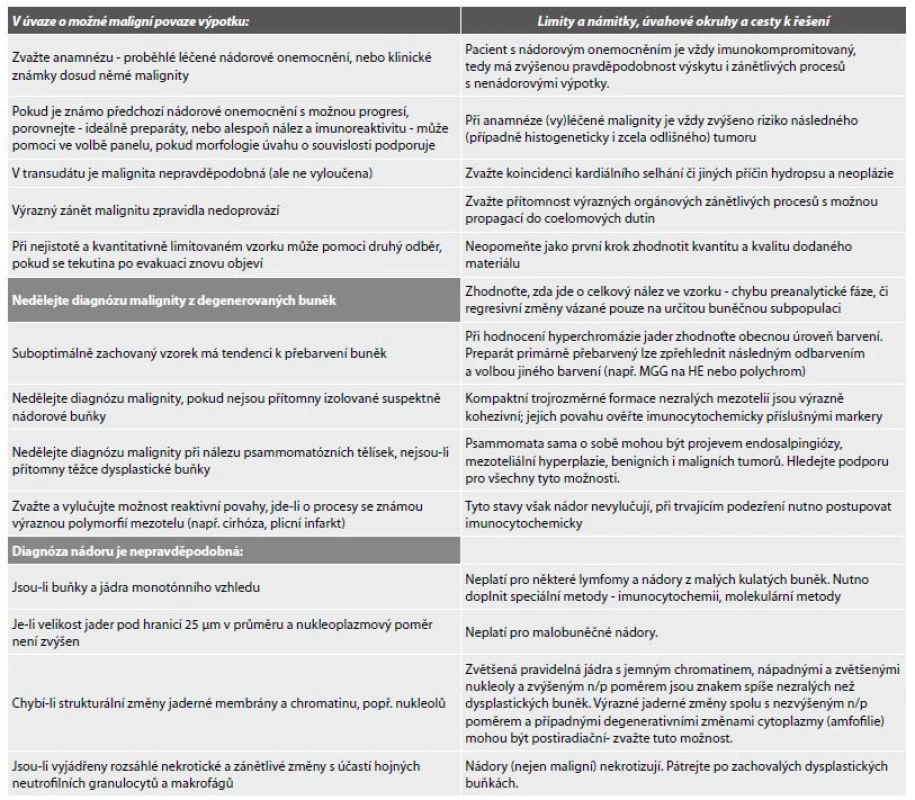
ZÁVĚR
Cytologická hodnocení výpotků v coelomových dutinách se opírají o širokou znalost patologických procesů, které se manifestují jejich tvorbou. V procesu vyšetření a zejména v úvahách diferenciálně diagnostických lze použít mnoho ze zkušeností bioptické diagnostiky. Při dodržení pravidel preanalytické, analytické a postanalytické fáze je diagnostika výpotků užitečným nástrojem vstupního hodnocení patologického procesu, případně i sledování průběhu léčby.
DODATEK 1
Metoda: Mikroskopické zhodnocení elementů kvantitativně
Postup:
Stanovení počtu jaderných elementů:
- Ve zkumavce smícháme 100 µl vzorku a 10 µl barvicího roztoku, opatrně protřepeme
- Pipetou směs opatrně naneseme do Fuchsovy-Rosenthalovy počítací komůrky pod umístěné krycí sklíčko. Vhodná doba k počítání je asi 5 až 10 minut po opatrném promíchání (při vyšší krevní příměsi se doporučuje čas prodloužit, aby došlo k dokonalé hemolýze erytrocytů.). Jaderné elementy lze počítat i z nativního materiálu – barvení je doporučováno hlavně při vyšší arteficiální krevní příměsi, nebo při zvýšeném množství nečistot.
Příprava barvicího roztoku:
- Acidi acetici glacialis (ledová kyselina octová) 90,0 ml
- Acidi carbolici (fenol) 6,0 ml
- Solutionis fuchsini saturatae (nasycený roztok fuchsinu) 6,0 ml
Alternativně:
- Viol.methyleni 0.1g
- Ac.acetici 2.02 ml
- H20 purif. Ad 50.0 ml (vydrží 1 rok)
Stanovení počtu erytrocytů:
Provádí se z nativního vzorku. Zevní stěny F-R komůrky navlhčíme jemně destilovanou vodou a opatrně přiložíme krycí sklíčko. Dobře promíchanou tekutinu opatrně pipetou naneseme do komůrky.
Mikroskopický odečet:
Stanovení počtu elementů se provádí mikroskopicky, Stanovuje se počet buněčných elementů v definovaném objemu komůrky (3.1 ul), který je vizuálně ohraničen vyrytou mřížkou na skle komůrky. Počet elementů se zapisuje do LIS ve formátu: počet elementů/ mikrolitr objemu vzorku - výsledný počet elementů (ery) / 3.
DODATEK 2
Postup zpracování vzorku do cytobloku
- Zkontrolujeme, zda je dodaný materiál fixovaný.
- Pokud není fixovaný, přidáme k cca 6 ml vzorku odebraným do zkumavky určené pro cytocentrifugaci 1,5 ml 10% pufrovaného formolu, protřepeme a ponecháme při pokojové teplotě fixovat 15 minut.
- Stočit při 4000 U/min (4000 rcf/min) po dobu 10 minut.
- Oddělit vzniklý supernatant od sedimentu. Supernatant slít do původní nádobky.
- Do zkumavky se sedimentem pomalu přidat 2-4 kapky bezvodého glycerínu p. a. a 1,5 ml 96% alkoholu.
- Protřepat do vzniku drobných vloček.
- Stočit při 4000 U/min (4000 rcf/min) po dobu 5 minut.
- Slít supernatant. Vzniklý vzorek pevnější konzistence ihned vyjmout a vložit do kazetky, s modrou bioptickou filtrační vložkou, označené číslem vyšetřovaného vzorku, rokem a pracovníkem, který zpracování provedl. V případě, že výsledný vzorek není dostatečně viditelný (bezbarvý, lehce nažloutlý) je možné jej zakápnout 2% vodným roztokem eozinu. Pokud není vzniklý sediment dostatečně kompaktní pro vložení do kazetky, je nutné použít ještě techniku zalévání do histogelu.
- Sediment přeneseme do vhodné nádobky s předehřátým histogelem.
- Centrifugovat v histogelu 4000U/min po dobu 2 min.
- Po ztuhnutí histogelu přemístíme do kazetky, s modrou bioptickou filtrační vložkou, označené číslem vyšetřovaného vzorku, rokem a pracovníkem, který zpracování provedl.
- Další zpracování probíhá v tkáňovém procesoru.
- Při krájení cytobloku může být užitečné vytvoření číslované série řezů pro střídavé imunocytochemické průkazy a barvení. Na nebarvené rezervy pro případné imunocytochemické průkazy je žádoucí použít silanizovaná skla.
PODĚKOVÁNÍ
Podpořeno Univerzitou Karlovou - projekt Progres Q28/LF1 Podpořeno MZ ČR – projekt RVO VFN64165
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Adresa pro korespondenci:
Prof. MUDr. Jaroslava Dušková, CSc., FIAC
Ústav patologie 1. LF UK a VFN
Studničkova 2, 128 00 Praha 2
tel: +420224968688
fax: +420224911715
e-mail: jaroslava.duskova@lf1.cuni.cz
Sources
1. Lee KF, Olak J. Anatomy and physiology of the pleural space. Chest Surg Clin N Am 1994; 4(3): 391-403.
2. Collins P. Embryogenesis. Cell populations at the start of organogenesis. In: Standring S, editor. Gray’s anatomy: the anatomical basis of clinical practice. Forty-first edition. ed. New York: Elsevier Limited; 2016 : 29.
3. Wigley C. Integrating cells into tissues. In: Standring S, editor. Gray’s anatomy: the anatomical basis of clinical practice. Forty-first edition. ed. New York: Elsevier Limited; 2016 : 192.
4. Parsons L, Taymor ML. Carcinoma of the breast metastatic to the peritoneum as a source of positive vaginal smears. Am J Obstet Gynecol 1953; 66(1): 194-196.
5. Ng AB, Teeple D, Lindner EA, Reagan JW. The cellular manifestations of extrauterine cancer. Acta Cytol 1974; 18(2): 108-117.
6. Herrick SE, Mutsaers SE. Mesothelial progenitor cells and their potential in tissue engineering. Int J Biochem Cell Biol 2004; 36(4): 621-642.
7. Mutsaers SE, Prele CM, Pengelly S, Herrick SE. Mesothelial cells and peritoneal homeostasis. Fertil Steril 2016; 106(5): 1018-24.
8. Mutsaers SE, Wilkosz S. Structure and function of mesothelial cells. Cancer Treat Res 2007; 134 : 1-19.
9. DeMay RM. The art and science of cytopathology. Chicago: ASCP Press; 1995. 2 bd.: 258.
10. Ishihara T, Ferrans VJ, Jones M, Boyce SW, Kawanami O, Roberts WC. Histologic and ultrastructural features of normal human parietal pericardium. Am J Cardiol 1980; 46(5): 744-753.
11. Michailova KN, Usunoff KG. Serosal membranes (pleura, pericardium, peritoneum). Normal structure, development and experimental pathology. Adv Anat Embryol Cell Biol 2006; 183 : 1-144.
12. Bolen JW, Hammar SP, McNutt MA. Reactive and neoplastic serosal tissue. A light-microscopic, ultrastructural, and immunocytochemical study. Am J Surg Pathol 1986; 10(1): 34-47.
13. Wang ZB, Li M, Li JC. Recent advances in the research of lymphatic stomata. Anat Rec 2010; 293(5): 754-761.
14. Li J. Ultrastructural study on the pleural stomata in human. Funct Dev Morphol 1993; 3(4): 277-280.
15. Li J, Jiang B. A scanning electron microscopic study on three-dimensional organization of human diaphragmatic lymphatics. Funct Dev Morphol 1993; 3(2): 129-132.
16. Bedrossian CWM. Malignant Effusions: A Multimodal Approach to Cytologic Diagnosis. New York: Igaku-Shoin Medical Publishers, Inc.; 1994 : 1.
17. Noppen M, De Waele M, Li R, Gucht KV, D’Haese J, Gerlo E, et al. Volume and cellular content of normal pleural fluid in humans examined by pleural lavage. Am J Respir Crit Care Med 2000; 162(3 Pt 1): 1023-1026.
18. Zocchi L. Physiology and pathophysiology of pleural fluid turnover. Eur Respir J 2002; 20(6): 1545-1558.
19. Mutsaers SE, Prele CM, Lansley SM, Herrick SE. The origin of regenerating mesothelium: a historical perspective. Int J Artif Organs 2007; 30(6): 484-494.
20. Miranda EA. Marie-Francois Xavier Bichat. In: Clinical anatomy associates 2013; A moment in history series Medical terminology daily. https://clinanat.com/mtd/314-marie-francois-xavier-bichat.
21. Bjonness-Jacobsen EC, Eriksen AK, Hagen VN, Ostbye KM, Witterso A, Pedersen MK, et al. The effect of the small amount of formaldehyde in the SurePath liquid when establishing protocols for immunocytochemistry. Cytojournal 2016; 13 : 27.
22. Silverman JF, Nance K, Phillips B, Norris HT. The use of immunoperoxidase panels for the cytologic diagnosis of malignancy in serous effusions. Diagn Cytopathol 1987; 3(2): 134-140.
23. Redard M, Vassilakos P, Weintraub J. A simple method for estrogen receptor antigen preservation in cytologic specimens containing breast carcinoma cells. Diagn Cytopathol 1989; 5(2): 188-193.
24. Frisman DM, McCarthy WF, Schleiff P, Buckner SB, Nocito JD, Jr., O’Leary TJ. Immunocytochemistry in the differential diagnosis of effusions: use of logistic regression to select a panel of antibodies to distinguish adenocarcinomas from mesothelial proliferations. Mod Pathol 1993; 6(2): 179-184.
25. Grefte JM, de Wilde PC, Salet-van de Pol MR, Tomassen M, Raaymakers-van Geloof WL, Bulten J. Improved identification of malignant cells in serous effusions using a small, robust panel of antibodies on paraffin-embedded cell suspensions. Acta Cytol 2008; 52(1): 35-44.
26. Murugan P, Siddaraju N, Habeebullah S, Basu D. Immunohistochemical distinction between mesothelial and adenocarcinoma cells in serous effusions: a combination panel-based approach with a brief review of the literature. Indian J Pathol Microbiol 2009; 52(2): 175-181.
27. Westfall DE, Fan X, Marchevsky AM. Evidence-based guidelines to optimize the selection of antibody panels in cytopathology: pleural effusions with malignant epithelioid cells. Diagn Cytopathol 2010; 38(1): 9-14.
28. Arora R, Agarwal S, Mathur SR, Verma K, Iyer VK, Aron M. Utility of a limited panel of calretinin and Ber-EP4 immunocytochemistry on cytospin preparation of serous effusions: A cost-effective measure in resource-limited settings. Cytojournal 2011; 8 : 14.
29. Facchetti F, Lonardi S, Gentili F, Bercich L, Falchetti M, Tardanico R, et al. Claudin 4 identifies a wide spectrum of epithelial neoplasms and represents a very useful marker for carcinoma versus mesothelioma diagnosis in pleural and peritoneal biopsies and effusions. Virchows Arch 2007; 451(3): 669-680.
30. Davidson B, Smith Y, Nesland JM, Kaern J, Reich R, Trope CG. Defining a prognostic marker panel for patients with ovarian serous carcinoma effusion. Hum Pathol 2013; 44(11): 2449-2460.
31. Shield PW, Papadimos DJ, Walsh MD. GATA3: a promising marker for metastatic breast carcinoma in serous effusion specimens. Cancer Cytopathol 2014; 122(4): 307-312.
32. Kim NI, Kim GE, Lee JS. Diagnostic Usefulness of Claudin-3 and Claudin-4 for Immunocytochemical Differentiation between Metastatic Adenocarcinoma Cells and Reactive Mesothelial Cells in Effusion Cell Blocks. Acta Cytol 2016; 60(3): 232-239.
33. Hjerpe A, Ascoli V, Bedrossian CW, Boon ME, Creaney J, Davidson B, et al. Guidelines for the Cytopathologic Diagnosis of Epithelioid and Mixed-Type Malignant Mesothelioma: a secondary publication. Cytopathology 2015; 26(3): 142-156.
34. Capkova L, Koubkova L, Kodet R. Expression of carbonic anhydrase IX (CAIX) in malignant mesothelioma. An immunohistochemical and immunocytochemical study. Neoplasma 2014; 61(2): 161-169.
35. Travis WD, Brambilla, E., Burke, A.P., Marx, A., Nicholson, A. G. WHO Classification of Tumours of the Lung, Pleura, Thymus and Heart. Fourth edition. 4th ed. Lyon: IARC; 2015 : 160.
36. Light RW, Macgregor MI, Luchsinger PC, Ball WC, Jr. Pleural effusions: the diagnostic separation of transudates and exudates. Ann Intern Med 1972; 77(4): 507-513.
37. Moltyaner Y, Miletin MS, Grossman RF. Transudative pleural effusions: false reassurance against malignancy. Chest 2000; 118(3): 885.
38. Ryu JS, Ryu ST, Kim YS, Cho JH, Lee HL. What is the clinical significance of transudative malignant pleural effusion? Korean J Intern Med 2003; 18(4): 230-233.
39. Johnson L, Fakih HA, Daouk S, Saleem S, Ataya A. Transudative pleural effusion of malignant etiology: Rare but real. Respir Med Case Rep 2017; 20 : 188-191.
40. Augoulea A, Lambrinoudaki I, Christodoulakos G. Thoracic endometriosis syndrome. Respiration 2008; 75(1):113-119.
41. Lignitz E, Gillner E, May D. Complications of resuscitative measures with special regard to liver damage. Prakt Anaesth 1977; 12(6):523-526.
42. Rubecz I, Nemeth G, Fintics K, Gasztonyi V, Lukacs Z, Sipos J. Subscapular liver hematoma and liver hemorrhage in neonatal age. Orv Hetil 1990; 131(37):2037-2042.
43. Liu J, Yao C, Xu B, Shen W, Zhou C, Duan X, et al. Clinical analysis of 2 cases with chylothorax due to primary lymphatic dysplasia and review of literature. Zhonghua Er Ke Za Zhi 2014; 52(5): 362-367.
44. Hillerdal G. Chylothorax and pseudochylothorax. Eur Respir J 1997; 10(5): 1157-1162.
45. Hauser H, Mischinger HJ, Beham A, Berger A, Cerwenka H, Razmara J, et al. Cystic retroperitoneal lymphangiomas in adults. Eur J Surg Oncol 1997; 23(4): 322-326.
46. Kohler C, Tozzi R, Klemm P, Schneider A. Laparoscopic paraaortic left-sided transperitoneal infrarenal lymphadenectomy in patients with gynecologic malignancies: technique and results. Gynecol Oncol 2003; 91(1): 139-148.
47. Mizushima Y, Yoshida Y, Inoue A, Sugiyama S, Hamazaki T, Kobayashi M. Chylopericardium following right thoracotomy for lung cancer. Tumori 1996; 82(3): 264-5.
48. Akashi H, Tayama K, Ishihara K, Tanaka A, Fujino T, Okazaki T, et al. Isolated primary chylopericardium. Jpn Circ J 1999; 63(1): 59-60.
49. Pongprot Y, Silvilairat S, Cheuratanapong S, Woragidpoonpol S, Sittiwangkul R, Phornphutkul C. Isolated primary chylopericardium: a case report. J Med Assoc Thai 2003; 86(4): 361-364.
50. Yuksel M, Yildizeli B, Zonuzi F, Batirel HF. Isolated primary chylopericardium. Eur J Cardiothorac Surg 1997; 12(2): 319-321.
51. Goodman ZD, Gupta PK, Frost JK, Erozan YS. Cytodiagnosis of viral infections in body cavity fluids. Acta Cytol 1979; 23(3): 204-208.
52. Iuchi K, Aozasa K, Yamamoto S, Mori T, Tajima K, Minato K, et al. Non-Hodgkin’s lymphoma of the pleural cavity developing from long-standing pyothorax. Summary of clinical and pathological findings in thirty-seven cases. Jpn J Clin Oncol 1989; 19(3): 249-257.
53. O’Donovan M, Silva I, Uhlmann V, Bermingham N, Luttich K, Martin C, et al. Expression profile of human herpesvirus 8 (HHV-8) in pyothorax associated lymphoma and in effusion lymphoma. Mol Pathol 2001; 54(2): 80-85.
54. Loddenkemper C, Hoecht S, Anagnostopoulos I, Heine B, Stoltenburg-Didinger G, Stein H. A 62-year-old man with chronic pyothorax. Brain Pathol 2005; 15(4): 371-373.
55. Cobb CJ, Wynn J, Cobb SR, Duane GB. Cytologic findings in an effusion caused by rupture of a benign cystic teratoma of the mediastinum into a serous cavity. Acta Cytol 1985; 29(6): 1015-1020.
56. Wu PS, Lai CR. Ovarian immature teratoma with gliomatosis peritonei and pleural glial implant: a case report. Int J Surg Pathol 2015; 23(4): 336-338.
57. Rempen A. Laparoscopic removal of dermoid cysts. Geburtshilfe Frauenheilkd 1993; 53(10): 700-704.
58. Pothula V, Matseoane S, Godfrey H. Gonadotropin-producing benign cystic teratoma simulating a ruptured ectopic pregnancy. J Natl Med Assoc 1994; 86(3): 221-222.
59. Achtari C, Genolet PM, Bouzourene H, De Grandi P. Chemical peritonitis after iatrogenic rupture of a dermoid cyst of the ovary treated by coelioscopy. Apropos of a case and review of the literature. Gynakol Geburtshilfliche Rundsch 1998; 38(3): 146-150.
60. Kim D, Cho HC, Park JW, Lee WA, Kim YM, Chung PS, et al. Struma ovarii and peritoneal strumosis with thyrotoxicosis. Thyroid 2009; 19(3): 305-308.
61. Murtaza B, Saeed S, Sharif MA, Malik IB, Mahmood A. Ruptured ovarian teratoma presenting as peritonitis. J Coll Physicians Surg Pak 2009; 19(1): 59-61.
62. Ashton PR, Hollingsworth AS, Jr., Johnston WW. The cytopathology of metastatic breast cancer. Acta Cytol 1975; 19(1): 1-6.
63. Domagala W, Woyke S. Transmission and scanning electron microscopic studies of cells in effusions. Acta Cytol 1975; 19(3): 214-224.
64. Ferenczy A. Cytology of metastases of rare tumors in the pleura. Arch Geschwulstforsch 1978; 48(5): 380-386.
65. Ansari MQ, Dawson DB, Nador R, Rutherford C, Schneider NR, Latimer MJ, et al. Primary body cavity-based AIDS-related lymphomas. Am J Clin Pathol 1996; 105(2): 221-229.
66. Jones D, Weinberg DS, Pinkus GS, Renshaw AA. Cytologic diagnosis of primary serous lymphoma. Am J Clin Pathol 1996; 106(3): 359-364.
67. Said W, Chien K, Takeuchi S, Tasaka T, Asou H, Cho SK, et al. Kaposi’s sarcoma-associated herpesvirus (KSHV or HHV8) in primary effusion lymphoma: ultrastructural demonstration of herpesvirus in lymphoma cells. Blood 1996; 87(12): 4937-4943.
68. Dunphy CH, Collins B, Ramos R, Grosso LE. Secondary pleural involvement by an AIDS-related anaplastic large cell (CD30+) lymphoma simulating metastatic adenocarcinoma. Diagn Cytopathol 1998; 18(2): 113-117.
69. Wakely PE, Jr., Menezes G, Nuovo GJ. Primary effusion lymphoma: cytopathologic diagnosis using in situ molecular genetic analysis for human herpesvirus 8. Mod Pathol 2002; 15(9): 944-950.
70. Das DK. Serous effusions in malignant lymphomas: a review. Diagn Cytopathol 2006; 34(5): 335-347.
71. Rossi ED, Bizzarro T, Schmitt F, Longatto-Filho A. The role of liquid-based cytology and ancillary techniques in pleural and pericardic effusions: an institutional experience. Cancer Cytopathol 2015; 123(4): 258-266.
72. Yu GH, Vergara N, Moore EM, King RL. Use of flow cytometry in the diagnosis of lymphoproliferative disorders in fluid specimens. Diagn Cytopathol 2014; 42(8): 664-670.
73. Bode-Lesniewska B. Flow Cytometry and Effusions in Lymphoproliferative Processes and Other Hematologic Neoplasias. Acta Cytol 2016; 60(4): 354-364.
74. Antoniadou F, Dimitrakopoulou A, Voutsinas PM, Vrettou K, Vlahadami I, Voulgarelis M, et al. Monomorphic epitheliotropic intestinal T-cell lymphoma in pleural effusion: A case report. Diagn Cytopathol 2017; 45(11): 1050-1054.
75. Wang HY, Wang L. Diagnostic pitfall: primary effusion lymphoma with rare cytokeratin immunoreactivity. Blood 2016; 127(24): 3102.
76. Sharif K, Alton H, Clarke J, Desai M, Morland B, Parikh D. Paediatric thoracic tumours presenting as empyema. Pediatr Surg Int 2006; 22(12): 1009-1014.
77. Armstrong GR, Raafat F, Ingram L, Mann JR. Malignant peritoneal mesothelioma in childhood. Arch Pathol Lab Med 1988; 112(11): 1159-1162.
78. Gong YS, Rong YT, Han WC, Zhang YC. Peripheral lymphadenopathy as the initial manifestation of malignant mesothelioma in a child. Hum Pathol 2013; 44(4): 664-669.
79. Latief KH, Somers JM, Hewitt M. High-resolution ultrasound in the diagnosis of childhood malignant peritoneal mesothelioma. Pediatr Radiol 1998; 28(3): 173.
80. Goyal M, Swanson KF, Konez O, Patel D, Vyas PK. Malignant pleural mesothelioma in a 13-year-old girl. Pediatr Radiol 2000; 30(11): 776-778.
81. Stojsic Z, Jankovic R, Jovanovic B, Vujovic D, Vucinic B, Bacetic D. Benign cystic mesothelioma of the peritoneum in a male child. J Pediatr Surg 2012; 47(10): e45-9.
82. Antman KH. Clinical presentation and natural history of benign and malignant mesothelioma. Semin Oncol 1981; 8(3): 313-320.
83. Hjerpe A, Ascoli V, Bedrossian C, Boon M, Creaney J, Davidson B, et al. Guidelines for cytopathologic diagnosis of epithelioid and mixed type malignant mesothelioma. Complementary statement from the International Mesothelioma Interest Group, also endorsed by the International Academy of Cytology and the Papanicolaou Society of Cytopathology. Cytojournal 2015; 12 : 26.
84. Husain AN, Colby TV, Ordonez NG, Allen TC, Attanoos RL, Beasley MB, et al. Guidelines for Pathologic Diagnosis of Malignant Mesothelioma 2017 Update of the Consensus Statement From the International Mesothelioma Interest Group. Arch Pathol Lab Med 2018; 142(1): 89-108.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2018 Issue 4
Most read in this issue- Cytology of effusions in the coelom cavities
- Carcinoma of the uterine cervix in Czech Republic and possibilities of its prevence
- Hyalinizing trabecular tumor of the thyroid gland with transcapsular invasion: a case report
- Intravascular fasciitis leading to an aortic dissection. A case report
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

