-
Medical journals
- Career
Neuroendokrinní nádor prsu – metastáza či primární karcinom prsu? Kazuistika
: Markéta Petrová
: Oddělení patologické anatomie, Oblastní nemocnice Náchod a. s.
: Čes.-slov. Patol., 51, 2015, No. 3, p. 128-131
: Original Article
Prezentujeme případ 74-leté ženy s neuroendokrinním nádorem terminálního ilea, u které bylo na screeningové mamografii nalezeno nepravidelné hypoechogenní ložisko v horním zevním kvadrantu levého prsu. V punkční biopsii z ložiska zastižen obraz neuroendokrinního nádoru a bylo vysloveno podezření na jeho metastatický původ z tenkého střeva. Další ložiska byla přítomna v pravém laloku jater. Pacientce byla následně provedena resekce ložiska v prsu a ložisek v játrech. Morfologický a imunohistochemický obraz (pozitivita neuroendokrinních markerů, estrogenových receptorů a negativní průkaz cytokeratinu 7, mammaglobinu, GCDFP-15, cytokeratinu 20 a progesteronových receptorů) v resekátech odpovídal dobře diferencovanému neuroendokrinnímu tumoru, i přes pozitivitu estrogenových receptorů velmi pravděpodobně metastatického původu z tenkého střeva. V předkládaném článku diskutujeme problematiku primárních a metastatických neuroendokrinních nádorů prsu.
Klíčová slova:
neuroendokrinní nádor – karcinom prsu – metastáza
Neuroendokrinní nádory (NETy) představují heterogenní skupinu poměrně vzácných nádorů, které se od běžných epitelových nádorů liší histogenetickým původem, mikroskopickým obrazem i biologickým chováním. Histogeneticky mají tyto nádory blízký vztah k rozptýleným endokrinním buňkám difúzního neuroendokrinního systému, nebo podle dnešních představ spíše k prekurzorům těchto buněk. Často jsou spojeny s hromaděním a uvolňováním biologicky aktivních látek jako je serotonin, somatostatin, gastrin a další. NETy postihují především střední úsek trávicího traktu a bronchopulmonální systém. V prsu patří k raritním nádorům. V této lokalitě tvoří méně jak 0,1 % všech nádorů prsu (1). Jsou reprezentovány neuroendokrinními nádory primárními (tj. dobře diferencované neuroendokrinní tumory, neuroendokrinní karcinomy, nádory s neuroendokrinní diferenciací) a metastatickými. Bez znalosti klinických dat a v málo reprezentativním vzorku není diagnostika těchto lezí snadná. Na metastatický původ NETy z gastrointestinálního traktu by nás měla upozornit nepřítomnost intraduktální složky nádoru, absence mikrokalcifikací a imunohistochemická pozitivita neuroendokrinních markerů při negativitě markerů specifických pro mléčnou žlázu. V prsu se však mnohem častěji setkáme s metastázami jiných nádorů, především s maligním melanomem a karcinomy jakékoliv lokalizace (hlavně plic, ledvin a vnitřního genitálu) (2), u děvčat pak s rhabdomyosarkomem (3).
MATERIÁL A METODIKA
K histologickému vyšetření jsme obdrželi proužky tkáně z jehlové biopsie mléčné žlázy fixované v 10% formalínu. Materiál byl zpracován klasickou parafinovou technikou a preparát byl obarven hematoxylinem eozinem. Následně bylo provedeno imunohistochemické vyšetření, při kterém byly použity tyto protilátky: chromogranin (klon 5H7, 1 : 600, Novocastra), synaptofyzin (klon SY38, 1 : 10, Dako), cytokeratinový kokteil (klon AE1/AE3, 1 : 100, Dako), cytokeratin 7 (CK7) (klon OV-TL12/30, 1 : 100, Dako), cytokeratin 20 (CK20) (klon Ks20.8, 1 : 25, Dako), mammaglobin (klon 304-1A5, 1 : 200, Dako), gross cystic disease fluid protein 15 (GCDFP-15) (klon EP1582Y, cca 1 : 28, Ventana), estrogenový receptor (ER) (klon SP1, 1 : 1000, Ventana), progesteronový receptor (PR) (klon 1E2, 1 : 1000, Ventana ) a Ki-67 (klon 30-9, 1 : 500, Ventana), caudal type homeobox 2 (CDX2) (klon DAK-CDX2, 1 : 50, Dako).
POPIS PŘÍPADU
U 74-leté ženy byla v roce 2010 provedena pravostranná hemikolektomie pro NET terminálního ilea. Histologicky se jednalo o dobře diferencovaný neuroendokrinní tumor maximálního rozměru 25 mm s metastázami ve 4 z 6 vyšetřených lymfatických uzlin (obr. 1). S odstupem 2 let bylo na screeningové mamografii nalezeno nepravidelné hypoechogenní ložisko průměru 5 mm v horním zevním kvadrantu levého prsu. V punkční biopsii ložiska mléčné žlázy byl mikroskopicky zastižen invazivně rostoucí solidně alveolárně uspořádaný maligní nádor tvořený buňkami s drobnými uniformními jádry, jemně zrnitým chromatinem a středním množstvím eozinofilní cytoplazmy (obr. 2A), mitózy nebyly patrny. Vzhledem k anamnéze pacientky bylo vysloveno podezření na metastatický původ z tenkého střeva a nález byl konzultován na pracovišti vyššího typu, kde bylo provedeno imunohistochemické vyšetření. Nádorové buňky exprimovaly chromogranin, synaptofyzin a cytokeratinový koktejl (AE1/AE3). Negativní byl průkaz CK7, CK20, GCDFP-15, mammaglobinu a progesteronových receptorů (obr. 2B-F). Proliferační aktivita stanovená markerem Ki-67 byla nízká (do 1 %). Ve dvou třetinách buněk byla přítomna slabá až středně silná exprese estrogenových receptorů (obr. 2D). Nález byl i přes pozitivitu estrogenových receptorů uzavřen jako dobře diferencovaný neuroendokrinní tumor (NET-G1), velmi pravděpodobně metastazující z tenkého střeva s nutnou klinickou korelací.
1. Dobře diferencovaný neuroendokrinní tumor terminálního ilea, barvení HE (zvětšení 40x). 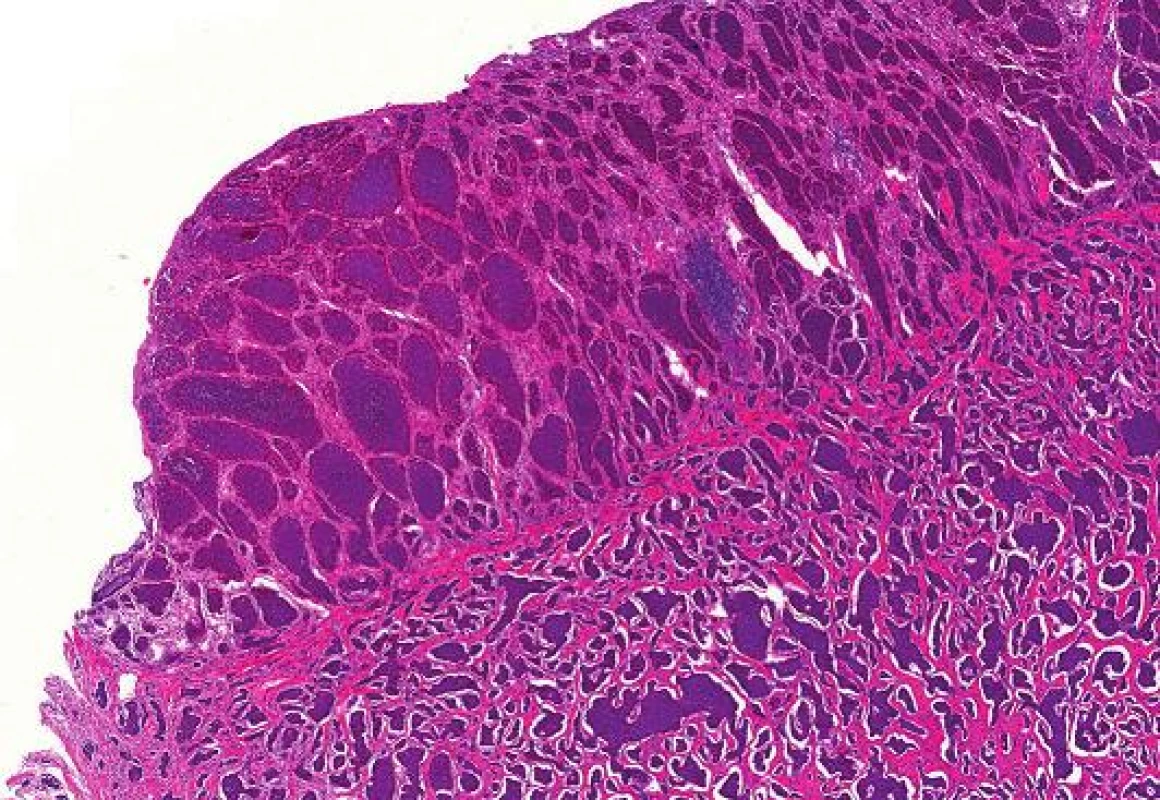
2. Jehlová biopsie mléčné žlázy. A: barvení HE (zvětšení 200x), B: imunohistochemický průkaz chromograninu (zvětšení 100x), C: imunohistochemický průkaz AE1/AE3 (zvětšení 100x), D: imunohistochemický průkaz ER, slabá až středně silná pozitivita v nádoru, pozitivní vnitřní kontrola v lalůčcích mléčné žlázy (zvětšení 100x), E: imunohistochemický průkaz mammaglobinu, negativní exprese v nádoru, pozitivní vnitřní kontrola v lalůčcích mléčné žlázy (zvětšení 100x), F: imunohistochemický průkaz GCDFP-15, negativní exprese v nádoru, pozitivní vnitřní kontrola v lalůčcích mléčné žlázy (zvětšení 100x). 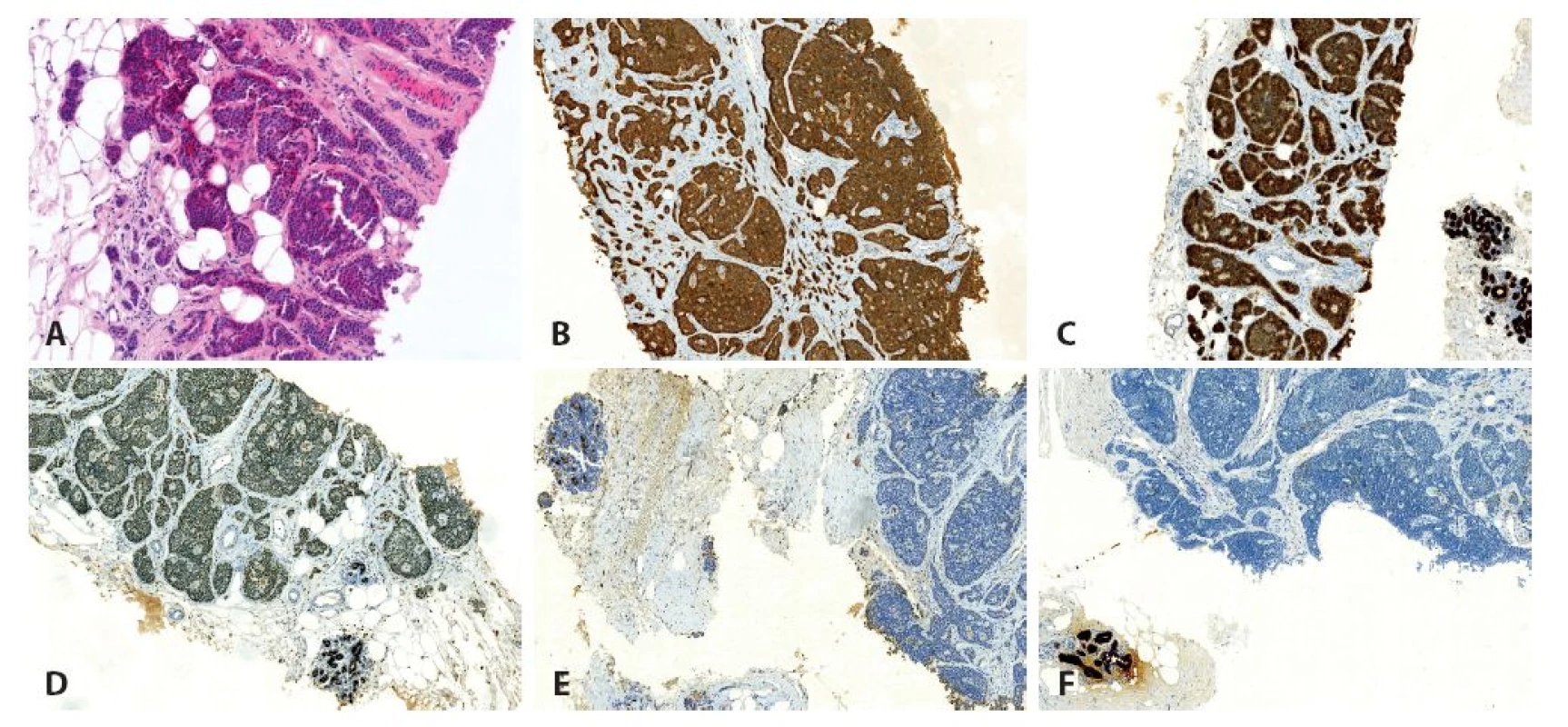
Pacientka podstoupila v jedné době extirpaci ložiska v prsu se sentinelovými uzlinami a resekci suspektních ložisek velikosti 16 mm a 3 mm v játrech. Morfologický obraz nádoru v extirpátu z prsu byl shodný s punkční biopsií. Celkem byly vyšetřeny 4 lymfatické uzliny, které byly zpracovány jako sentinelové. Nádorové struktury v nich prokázány nebyly. V játrech šlo o metastázy NET-G1 obdobného vzhledu jako v ložisku z levého prsu.
DISKUZE
Neuroendokrinní nádory jsou tumory pomalu rostoucí, často se klinicky projevují až generalizací s metastatickým postižením lymfatických uzlin, jater, plic a kostí. K neobvyklým lokalizacím metastáz neuroendokrinních nádorů patří prs, dále měkké tkáně orbity a srdce (4). V prsu se imunohistochemickou analýzou prokáže neuroendokrinní (NE) diferenciace ve více než 30 % invazivních karcinomů prsu, především v mucinózním karcinomu a solidním papilárním karcinomu. Jde většinou o ojedinělou expresi NE markerů v izolovaných buňkách či skupinkách buněk (5). Za primární neuroendokrinní karcinom prsu (PNEC) je považován nádor exprimující NE markery ve více jak 50 % nádorových buněk (6). V poslední WHO klasifikaci nádorů prsu z roku 2012 najdeme nádory neuroendokrinního vzhledu v podskupině málo častých nádorů invazivního karcinomu. Jsou dále členěny na: dobře diferencované neuroendokrinní tumory (neuroendocrine tumors well-differentiated), neuroendokrinní karcinomy (neuroendocrine carcinomas, poorly differentiated/small cell carcinomas) a nádory s neuroendokrinní diferenciací (carcinomas with neuroendocrine differentiation). Pro odlišení primárního a metastatického NETu jsou zásadní relevantní klinická data a imunohistochemické vyšetření.
PNEC je v literatuře popisováno kolem 30 případů (7). Klinicky se neodlišují od ostatních karcinomů prsu. 45 % nádorů je dobře diferencovaných, 40 % středně a 15 % špatně diferencovaných (8). Sapino a kol. popisuje pět morfologických typů - solidní, alveolární, malobuněčný, solidní-papilární a celulární-mucinózní (9). Diagnostická je exprese NE markerů ve více jak 50 % nádorových buněk a přítomnost in situ složky nádoru. Imunohistochemicky obvykle bývá pozitivita CK7, mammaglobinu, GCDFP-15, estrogenových a progesteronových receptorů (10), onkoprotein HER-2 je obvykle negativní (11). Na samotnou imunohistochemii však nelze spoléhat, vždy je nutná klinická korelace. Pozitivita vyšetřovaných markerů s nižší diferenciací nádoru klesá. Exprese GCDFP-15 byla přítomna v 6 z 9 případů PNEC a exprese mammaglobinu ve 4 z 9 případů PNEC (12).
NETy metastazující z gastrointestinálního traktu morfologicky věrně napodobují primární zdroj, tvoří solidně-alveolární, rozetovité či trabekulární formace. Imunohistochemicky je průkaz mammaglobinu a GCDFP-15 vždy negativní. Ojediněle je v literatuře popisována pozitivita ER a PR (12,13). Crona se spolupracovníky uvádí v retrospektivní studii pozitivitu ER v 1/13 případů NET tenkého střeva (13). U NETů metastazujících z plic se s pozitivitou ER a PR setkáme daleko častěji, pozitivita ER je udávána až ve 41/71 (57 %) případů a exprese PR u 22/71 (30 %) případů (14). NET terminálního ilea u naší pacientky exprimoval ER slabě a středně silně ve 2/3 buněk, tedy stejně jako metastatické ložisko v prsu (obr. 3). Z dalších imunohistochemických markerů, který by nás mohl navést na původ NETu z GITu je CDX2. CDX2 je markerem intestinální diferenciace (normální i nádorové střevní tkáně), známá je vysoká míra exprese u kolorektálních karcinomů. Aberantní exprese CDX2 je však Popisována i u adenokarcinomů močového měchýře, prostaty, cervixu, mucinózního karcinomu ovaria a dalších. Lin a kol. popisuje ve studii 60 NETů GITů (primárních i metastatických) pozitivitu CDX2 ve 100 % NETů apendixu, v 86 % NETů tenkého střeva, v 75 % NETů tlustého střeva, v 18 % NETů rekta, v žádném NETu žaludku nebyla Exprese CDX2 zastižena (15). U PNEC prsu doposud nejsou údaje o expresi CDX2 známy, vzhledem k absenci exprese CDX2 u adenokarcinomů prsu (16) se však předpokládá jejich negativita.Vyšetření CDX2 v našem případu ukázalo difúzní silnou pozitivitu jak v nádoru střeva tak v ložisku v prsu. Demonstrovaný případ neuroendokrinního nádoru v prsu je tedy díky klinicko-patologické korelaci ukázkou vzácné metastázy NETu střeva. Tabulka č. 1 shrnuje hlavní vyšetřované markery našeho případu ve srovnání s PNEC. Kontrolní octreoscany provedené po resekci prsu byly bez patologické kumulace somatostatinových receptorů. V současné době (poslední kontrola v září 2014) je pacientka bez dalšího klinicky zjevného metastatického postižení.
3. Imunohistochemický průkaz ER v NETu terminálního ilea, slabá až středně silná pozitivita (zvětšení 200x). 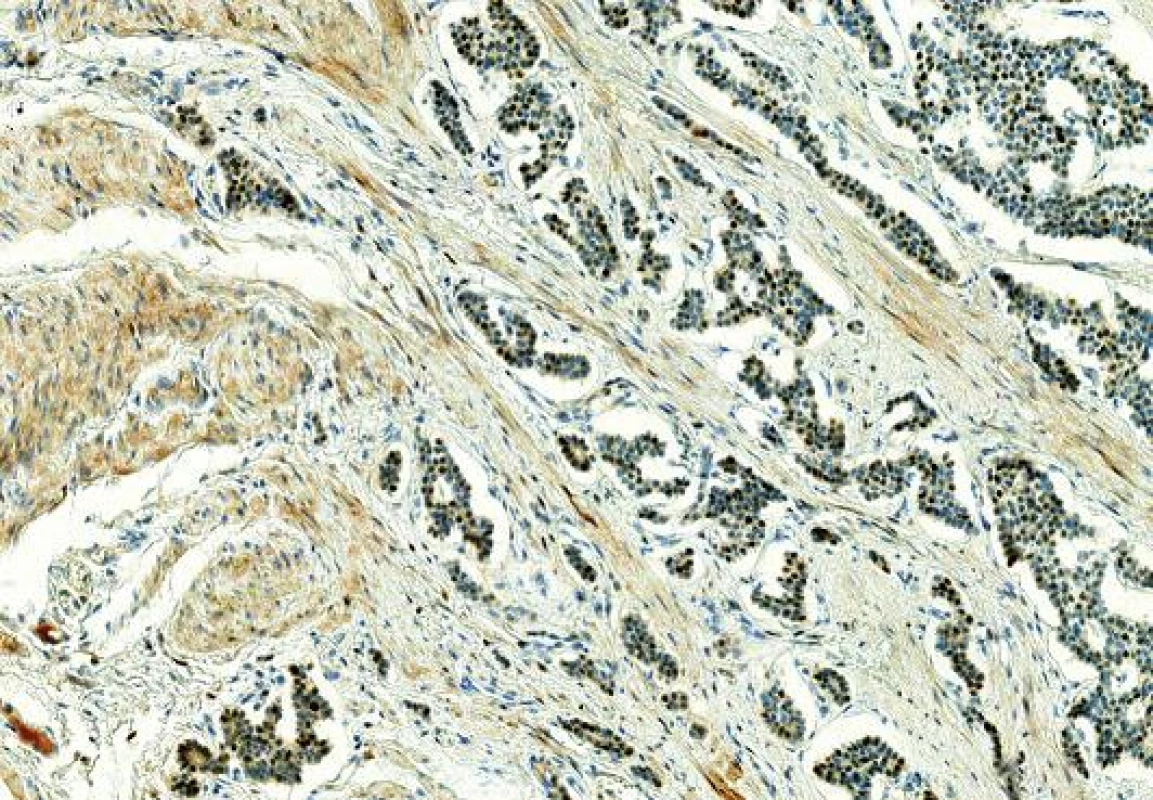
1. Souhrn vyšetřovaných markerů u NET GIT v porovnání s PNEC. 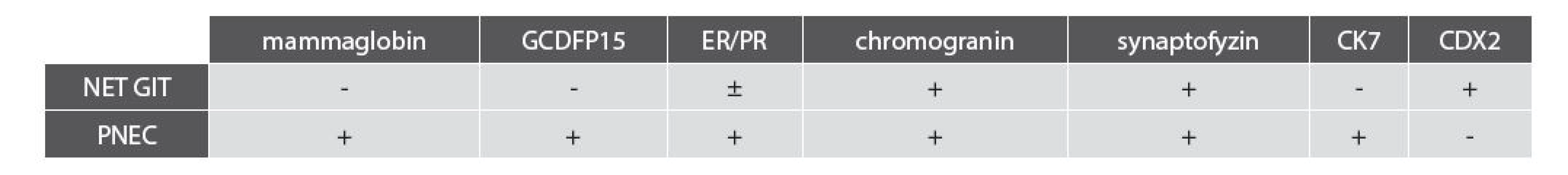
NET GIT, neuroendokrinní nádor gastrointestinálního traktu; PNEC, primární neuroendokrinní karcinom prsu; GCDFP15, gross cystic disease fluid protein 15; ER/PR, estrogenové a progesteronové receptory; CK7, cytokeratin 7; CDX2, caudal type homeobox 2. PODĚKOVÁNÍ
MUDr. E. Hovorkové za konzultační vyšetření. MUDr. T. Rozkošovi za laskavé zhotovení fotodokumentace a poskytnutí metodiky imunohistochemického vyšetření.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Markéta Petrová
Oddělení patologické anatomie
Purkyňova 446, Náchod 547 69
tel.: +420 491 601 251
e-mail: petrova.marketa@nemocnicenachod.cz
Sources
1. Ogawa H, Nishio A, Satake H, et al. Neuroendocrine tumor in the breast. Radiat Med 2008; 26(1): 28–32.
2. Kinkor Z, Mečiarová I. Metastázy epitelových neuroendokrinních tumorů do prsu – omyl není nutný. Breast Cancer News 2013; 3(2): 4-7.
3. Vizcaino I, Torregrosa A, Higueras V, et al. Metastasis to the breast from extramammary malignancies: a report of four cases and a review of literature. Eur Radiol 2001; 11(9): 1659-1665.
4. Srirajaskanthan R, Desai K, Jayaratnam A, Carras E, Toumpanakis C, Meyer T, Caplin M. Uncommon sites for metastasis of neuroendocrine tumor in adults. J Clin Oncol 2009; 27(15S): e15683.
5. Lakhani SR, Ellis IO, Schnitt SJ, et al. WHO Classification of Tumours of the Breast (4th ed.).Lyon: IARC; 2012 : 62-63.
6. Hanby AM, Brannan R. Neuroendocrine Tumours of the Breast. In: Khan A. Surgical Pathology of Endocrine and Neuroendocrine Tumours. New York, NY: Humana Press; 2009 : 165-172.
7. Akhtar K, Zaheer S, Ahmad SS, Hassan MJ. Primary neuroendocrine carcinoma of the breast. Indian J Pathol Microbiol 2009; 52(1): 71–73.
8. Tavassoli FA, Devilee P. WHO Pathology and Genetics of Tumours of the Breast and Female Genital Organs. Lyon: IARC; 2003 : 32-34.
9. Sapino A, Righi L, Cassoni P, Papotti M, Pietribiasi F, Bussolati G. Expression of the neuroendocrine phenotype in carcinomas of the breast. Semin Diagn Pathol 2000; 17(2): 127–37.
10. Fritzsche FR, Thomas A, Winzer KJ, et al. Co-expression and prognostic value of gross cystic disease fluid protein 15 and mammaglobin in primary breast cancer. Histol Histopathol 2007; 22(11): 1221-1230.
11. Ghanem S, Kabaj H, Naciri S, Glaoui M, Ismaili N, Benjaafar N, Errihani H. Primary neuroendocrine carcinoma of the breast: A rare and distinct entity. J Canc Res Exp Oncol 2011; 3(5): 50-54.
12. Richter-Ehrenstein CH, Arndt J, Buchendahl ACH, et al. Solid neuroendocrine carcinoma of the breast. Metastases or primary tumors? Breast Canc Res Treat 2010; 124(2): 413-417.
13. Crona J, Granberg D, Norlen O, Wärnberg F, Stålberg P, Hellman P, Björklund P. Metastases from Neuroendocrine Tumors to the Breast Are More Common than Previously Thought. A Diagnostic Pitfall? World J Surg 2013; 37(7): 1701-6.
14. Sica G, Wagner PL, Altorki N et al. Immunohistochemical expression of estrogen and progesterone receptors in primary pulmonary neuroendocrine tumors. Arch Pathol Lab Med 2008; 132(12): 1889–1895.
15. Lin X, Saad RS, Luckasevic TM, Silverman JF, Liu Y. Diagnostic value of CDX-2 and TTF-1 expressions in separating metastatic neuroendocrine neoplasms of unknown origin. Appl Immunohistochem Mol Morphol 2007; 15(4): 407-414.
16. O’Connell FP, Wang HH, Odze RD. Utility of immunohistochemistry in distinguishing primary adenocarcinomas from metastatic breast carcinomas in the gastrointestinal tract. Arch Pathol Lab Med 2005; 129(3): 338-347.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2015 Issue 3-
All articles in this issue
- Tubulointerstitial rejection of renal allografts
- Antibody-mediated rejection of renal allograft and the update Banff classification 2013
- Infections after kidney transplantation
- Neuroendocrine tumor of the breast - metastasis or primary breast carcinoma? Case report
- Melanocytic matricoma - a case report
- WHAT IS YOUR DIAGNOSIS? Answer
- What si your diagnosis?
- Shadow cell differentiation in endometrioid carcinomas of the uterus. Its frequent occurrence and beta-catenin expression
- Pyloric gland adenoma: a histologic, immunohistochemical and molecular genetic study of 23 cases
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pyloric gland adenoma: a histologic, immunohistochemical and molecular genetic study of 23 cases
- Infections after kidney transplantation
- Neuroendocrine tumor of the breast - metastasis or primary breast carcinoma? Case report
- Antibody-mediated rejection of renal allograft and the update Banff classification 2013
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

