-
Medical journals
- Career
Nediagnostikovaná Whippleova choroba s letálnym koncom
Authors: Daniel Farkaš 1; Marián Švajdler ml. 2; Silvia Farkašová Iannaccone 3; Peter Labaj 1
Authors‘ workplace: Úrad pre dohľad nad zdravotnou starostlivosťou, SLaPA pracovisko, Košice 1; Oddelenie patológie UN LP Košice, Košice 2; Ústav súdneho lekárstva UPJŠ LF, Košice 3
Published in: Čes.-slov. Patol., 49, 2013, No. 2, p. 95-98
Category: Original Article
Overview
Whippleova choroba je vzácne multisystémové ochorenie vyvolané tyčinkovitou baktériou Tropheryma whipplei. Aj keď postihuje všetky vekové skupiny, typickým pacientom je biely mladý muž. Klinické príznaky sú pestré a závisia od štádia ochorenia. Najčastejšia je klasická abdominálna manifestácia sprevádzaná stratou hmotnosti, slabosťou, chronickými hnačkami a abdominálnymi bolesťami. Neliečená Whippleova choroba sa takmer bez výnimky končí letálne. Popisujeme najpravdepodobnejšie prvý publikovaný prípad nediagnostikovanej Whippleovej choroby s letálnym koncom na Slovensku, u 33-ročného muža bielej rasy s postihnutím gastrointestinálneho traktu, brušných lymfatických uzlín a mozgu, ktorý zomrel na zápal pľúc.
Kľúčové slová:
Whippleova choroba – Tropheryma whipplei – neuropatológia
Whippleova choroba je vzácne multisystémové ochorenie vyvolané baktériou Tropheryma whipplei. Klinické príznaky sú značne variabilné a častokrát predstavujú diagnostickú výzvu. Okrem prejavov malabsorpcie (hnačky, chudnutie, steatorhea, bolesti brucha) sa môžu objaviť febrílie, artritída, pleuritída, ascites a polyneuritída (1,2). Nediagnostikovaná Whippleova choroba sa končí takmer bez výnimky fatálne. V kazuistike popisujeme najpravdepodobnejšie prvý publikovaný prípad nediagnostikovanej Whippleovej choroby s letálnym koncom na Slovensku.
POPIS PRÍPADU
Jednalo sa o muža bielej rasy s ľahkou duševnou zaostalosťou, ktorý zomrel v 33. roku života. V posledných troch rokoch života bol každý rok opakovane dlhodobo hospitalizovaný na viacerých nemocničných oddeleniach. Z anamnézy vyplýva, že po ťažkom pôrode (v roku 1978) s hospitalizáciou na novorodeneckom oddelení bola u neho diagnostikovaná perinatálna encefalopatia. Ukončil základnú školu a dvojročné učilište, následne pracoval ako záhradník. V roku 2001 sa u pacienta rozvinula schizofrenická symptomatika. Otec pacienta sa taktiež liečil na schizofréniu. Začiatok schizofrénie nebol sprevádzaný žiadnymi somatickými zmenami alebo abnormálnymi biochemickými parametrami. Pôvodne mal pacient hmotnosť 130 kg pri výške 174 cm (body mass index, BMI = 42,9).
V jeseni roku 2008 bola u pacienta zistená slabosť, nechutenstvo, opakované zvracanie a anemizácia, pričom jeho hmotnosť klesla na 79 kg. Gastrofibroskopickým vyšetrením bola zistená zápalovo zmenená sliznica bulbu a postbulbárnej časti duodéna. U pacienta bola klinicky diagnostikovaná Crohnova choroba, tá však nebola bioptickým vyšetrením vzoriek duodéna potvrdená. Pacient bol následne kratší čas liečený kortikosteroidmi. V decembri 2008 sa pridružili bolesti v podrebrí, časté stolice, progredovala anemizácia s nutnosťou opakovanej hemosubstitúcie a bola suponovaná pľúcna fibróza.
V septembri 2009 boli psychiatrom diagnostikované halucinácie a neprimerané správanie, pričom bolo vyslovené podozrenie na organické poškodenie mozgu. V novembri 2009 bol hospitalizovaný na infekčnom oddelení s febrilitami do 40 °C, pričom stav bol uzavretý ako status febrilis nejasnej etiológie s protrahovanou kvantitatívnou poruchou vedomia. Psychiatrickým vyšetrením sa zistil bradypsychizmus s progredujúcim pravdepodobným organickým poškodením mozgu.
V januári 2010 bola u pacienta zistená hypersomnia a triaška, opakovane absolvoval interné, psychiatrické a neurologické vyšetrenia. Na neurologickom oddelení mu bola diagnostikovaná bilaterálna porucha okohybných nervov s kvadruhyperreflexiou, bez lateralizácie a intrakraniálnej hypertenzie. Vyšetrenia na herpetickú encefalitídu boli negatívne. V júni 2010 bol prijatý pre opuch a začervenanie pravého lýtka so záverom suspektného nodózneho erytému. Gastroskopický a kolonoskopický makroskopický nález bol v porovnaní s predchádzajúcimi vyšetreniami bez výraznejšej dynamiky, pričom bioptické vyšetrenie pri týchto zákrokoch nebolo realizované. V októbri 2010 bola diagnostikovaná alárna pneumónia s febrilitami a mediastinálnou lymfadenopatiou.
Pacient bol naposledy hospitalizovaný v októbri 2011 na pľúcnom oddelení pre pravostrannú bronchopneumóniu. TBC bola vylúčená a po výraznej regresii RTG nálezu bol pacient prepustený do domáceho liečenia s doporučenou antibiotickou liečbou. Pacient zomrel doma v skorých ranných hodinách, 2 dni po prepustení z nemocnice. Prehliadajúci lekár nariadil súdnolekársku pitvu, ktorá bola vykonaná v deň úmrtia.
Pri pitve bola zistená výška 174 cm, hmotnosť 53 kg (BMI = 17,5), pričom svalstvo bolo výrazne atrofické a nápadný bol obraz ťažkej kachexie. Koža v celom rozsahu bola bez zjavnejších patologických eflorescencií. V mozgu neboli prítomné evidentné, voľným okom viditeľné zmeny v zmysle klinicky udaných pseudocýst alebo ložísk demyelinizácie. V pohrudnicových dutinách boli obojstranne splývavé zrasty. Pľúca boli celkovo výrazne zníženej vzdušnosti s obrazom hnisavej pneumónie (pravé pľúca 1020 g, ľavé pľúca 850 g). Na aorte a veľkých tepnách boli prítomné sklerotické zmeny ľahkého stupňa. Vrstva tuku na prednej brušnej stene dosahovala hrúbku 0,5 cm. Kľučky tenkého čreva a samotné hrubé črevo boli makroskopicky bez nápadnějších zmien, bez zúžení. Brušné lymfatické uzliny boli zväčšené, na reze s obrazom pripomínajúcim špongiu. Ostatné orgány boli bez nápadnejších zmien. Toxikologické vyšetrenia na prítomnosť prchavých látok a bežne užívaných liekov boli negatívne.
Mikroskopickým vyšetrením sme v pľúcach zistili splývajúci fibrinózne-hnisavý až abscedujúci zápal, ktorý bol aj bezprostrednou príčinou smrti. Ložiskovo boli prítomné mnohojadrové bunky s fagocytovaným svetlolomným cudzorodým materiálom, nález bol konzistentný s diagnózou aspiračnej pneumónie. Farbením podľa van Giesona sme nezistili fibrózu a farbením podľa Grama sme nezistili prítomnosť grampozitívnych baktérií v pľúcach. Vyšetrením mozgu (gyrus parahippocampalis, gyrus cinguli s priľahlým corpus callosum) sme zistili reaktívnu gliózu s gemistocytárnou premenou astrocytov a ložiskovo výraznú perivaskulárnu lymfocytárnu infiltráciu. V makrofágoch lokalizovaných perivaskulárne ako aj voľne v parenchýme sme zistili prítomnosť veľkého množstva bezfarebných amorfných hmôt, ktoré boli PAS, PAS s diastázou ako aj Gram pozitívne (obr. 1). Gram pozitívne baktérie boli v mozgu masívne prítomné aj v cievnych stenách, voľne v sivej hmote, a sporadicky intracytoplazmaticky aj v ependýme. V brušnej paraaortálnej lymfatickej uzline boli prítomné početné epiteloidné bunky, ložiskovo formujúce granulómy a typické chylektázie (obr. 2). Špeciálnymi farbeniami (PAS, PAS s diastázou a Gram) sme aj tu dokázali výraznú pozitivitu v epiteloidných bunkách. V hrubom čreve sme nezistili zmeny vyskytujúce sa pri chronických zápalových ochoreniach, nález bol v limitoch histologickej normy. V spätne prezretých vzorkách odobraných z duodéna pri prvom endoskopickom vyšetrení sme našli typický obraz rozšírených klkov s kolekciami makrofágov s ružovou penovitou až jemne zrnitou cytoplazmou (obr. 3). Pokus o potvrdenie infekcie T. whipplei pomocou PCR z formolového materiálu (abdominálna lymfatická uzlina) bol neúspešný pre nízku kvalitu DNA.
Image 1. (A) Gyrus parahippocampalis. Je zachytená reaktívna glióza a výrazný perivaskulárny zápalový infiltrát, hematoxylín-eozín, zväčšenie 100 krát. (B) Reaktívna glióza a perivaskulárne zápalové infiltráty, hematoxylín-eozín, zväčšenie 200 krát. (C) Perivaskulárne penovité makrofágy, hematoxylín-eozín, zväčšenie 400 krát. (D) PAS pozitívne makrofágy prítomné nielen perivaskulárne ale aj voľne v parenchýme, PAS, zväčšenie 400krát. 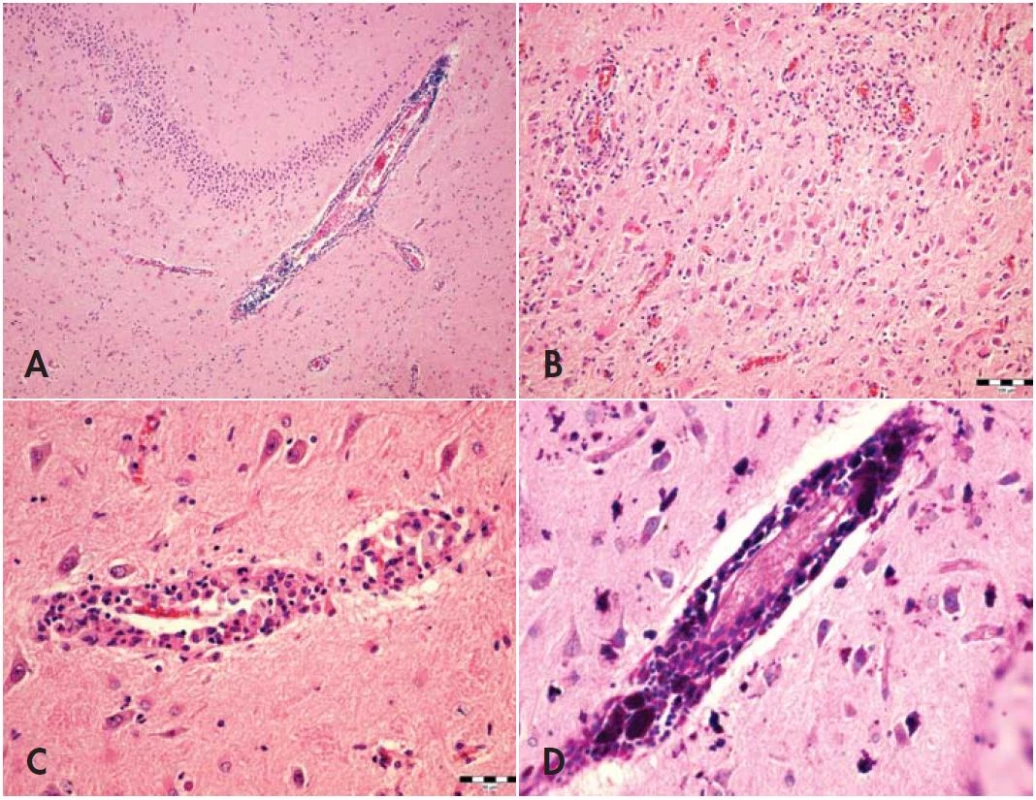
Image 2. (A) Abdominálna lymfatická uzlina na reze. Je zachytená špongiovitá až cystická štruktúra spôsobená chylektáziami. (B) Histotopogram rezu lymfatickou uzlinou. (C) Histologický obraz pri veľkom zvätšení. Sú zachytené epiteloidné bunky s penovitou ružovou cytoplazmou obsahujúce mikroorganizmy a charakteristické chylektázie, hematoxylín-eozín, zvätšenie 200krát. 
Image 3. Biopsia duodéna. Kolekcie makrofágov v lamina propria spôsobujúce rozšírenie a otupenie klkov. Hematoxylín-eozín, zvätšenie 100 krát (A) 400 krát (B). 
Na základe histologického nálezu (postihnutie mozgu a paraaortálnej lymfatickej uzliny, vzorky z duodéna) a klinického obrazu (časté stolice, strata hmotnosti, slabosť, bilaterálna porucha okohybných svalov, kvadruhyperreflexia, nechutenstvo, anemizácia, febrility, halucinácie, bradypsychizmus s progredujúcou organicitou, hypersomnia a mediastinálna lymfadenopatia) sme prípad uzavreli ako nediagnostikovanú, približne tri roky trvajúcu Whippleovu chorobu. Bezprostrednou príčinou smrti bol obojstranný splývajúci fibrinózne-hnisavý až abscedujúci zápal pľúc pri celkovej kachexii ťažkého stupňa.
DISKUSIA
Whippleova choroba je vzácne multisystémové ochorenie vyvolané tyčinkovitou grampozitívnou baktériou Tropheryma whipplei. Klinické príznaky sú pestré a závisia od štádia ochorenia. Okrem prejavov malabsorpcie (hnačky, chudnutie, steatorhea, bolesti brucha) sa môžu objaviť febrílie, artritída, pleuritída, ascites, polyneuritída a postihnutie centrálneho nervového systému (1,2). Diagnostika je vďaka pestrosti a nešpecifickosti príznakov komplikovaná a často trvá dlhšiu dobu. Podľa jednej z recentný prác rozpoznanie choroby trvalo vo všetkých prípadoch najmenej jeden rok a v jednom z prípadov dokonca viac ako 10 rokov (3). Ochorenie prvýkrát popísal George Hoyt Whipple v roku 1907. Jednalo sa o 36-ročného zdravotníckeho zamestnanca. U nebohého zistil prítomnosť penovitých buniek v sliznici duodéna, ako aj prítomnosť tukových látok v lamina propria mucosae duodeni. Predpokladal vzťah medzi spirochétami a ochorenie popísal ako „intestinálnu lipodystrofiu“ (4). V roku 1949 Black-Schaffer uverejnil významné pozorovanie, podľa ktorého je na diagnostiku tohoto ochorenia vhodné PAS-farbenie (5). Začiatkom 60-tych rokov bola pomocou elektrónovej mikroskopie v postihnutých tkanivách zistená prítomnosť baktériálnych organizmov (6-8). V bývalom Československu bola už v roku 1964 publikovaná kazuistika podrobne popisujúca Whippleovu chorobu, pričom bol opakovane zaznamenaný elektronoptický a bakterioskopický popis nálezu u 37-ročného pacienta s ochorením trvajúcim 20 mesiacov (9). V tomto prípade bol popísaný dôkaz mikroorganizmu (veľkosť, tvar, rozmery) ako aj histopatologické regresívne zmeny v intestinálnej sliznici a lymfatických uzlinách v rozličných intervaloch počas liečby. Samotný mikroorganizmus spôsobujúci Whippleovu chorobu bol identifikovaný pomocou PCR analýzy až v roku 1992 (10). V roku 2003 bola Tropheryma whipplei identifikovaná aj v pôvodných tkanivových preparátoch u pacienta opísaného v práci samotným Whippleom (11).
T. whipplei patrí medzi aktinomycéty a je vzdialeným príbuzným Mycobacterium avium-intracellulare a Mycobacterium paratuberculosis, čo čiastočne vysvetľuje prečo sa Whippleova choroba podobá ochoreniam spôsobených týmito baktériami (12). Ochorenie je časté u farmárov a osôb, ktoré sú vystavené pôde a zvieratám, čo poukazuje na možný zdroj baktérií, aj keď presný zdroj a spôsob prenosu neboli doposiaľ spoľahlivo objasnené (13). Pacient v našej kazuistike pracoval ako záhradník. Medzi najvnímavejších k tomuto ochoreniu sa zaraďujú ľudia so zníženou schopnosťou intracelulárnej degradácie pohlteného patogénu, hlavne v makrofágoch. Niekoľko štúdií poukazuje na defektné T-lymfocyty (obzvlášť TH1 populácia), ktorých poškodená funkcia môže byť významným predispozičným faktorom k rozvoju tohoto ochorenia (14). U ľudí so zvýšenou vnímavosťou voči ochoreniu bol zistený znížený počet cirkulujúcich buniek, ktoré vykazujú expresiu CD11b (alpha integrin). CD11b má vitálnu úlohu pri aktivácii makrofágov na deštrukciu intracelulárne pohltenej baktérie T. whipplei (12).
Ochorenie je považované za extrémne zriedkavé, s incidenciou jeden prípad na milión ľudí/rok. Pacientmi sú predominantne muži, hoci v niektorých krajinách pomer žien s diagnózou Whippleovej choroby v posledných rokoch stúpa. Ochorenie sa vyskytuje hlavne u belochov, čo poukazuje na možnú genetickú predispozíciu u tejto populácie (14). Zvyčajne sa objavuje medzi 4. a 7. dekádou života. Neliečená Whippleova choroba sa takmer v 100 % končí letálne, pričom neliečená cerebrálna forma Whippleovej choroby sa môže skončiť smrťou už za 6 až 12 mesiacov (15,16).
Whippleova choroba môže postihnúť ktorýkoľvek orgán a klinický priebeh neliečeného ochorenia sa môže rozdeliť do troch štádií: 1. nešpecifické prodromálne štádium, ktoré môže zahrňovať migrujúce polyartralgie, 2. klasická abdominálna manifestácia sprevádzaná stratou hmotnosti, slabosťou, chronickými hnačkami a abdominálnymi bolesťami a 3. generalizované štádium charakterizované steatoreou, kachexiou, lymfadenopatiou, hyperpigmentáciou a poruchami funkcií kardiovaskulárneho, pulmonálneho a nervového systému (17). Na podklade tohto rozdelenia sa v našom prípade jednoznačne jednalo o tretie štádium ochorenia.
Vďaka veľmi variabilnej prezentácii a nešpecificite jednotlivých príznakov je Whippleova choroba klinicky suponovaná iba zriedkavo (3). Diagnóza je väčšinou stanovená biopsiou, zvyčajne z endoskopickej vzorky duodéna. V sliznici sa zistí prítomnosť makrofágov s PAS pozitívnymi mikroorganizmami, ktoré sa na rozdiel od mykobaktérií nefarbia Ziehl-Neelsenovým farbením. Je dôležité vedieť, že v makrofágoch sa mikroorganizmy nevyskytujú iba vo forme tyčiniek, ale aj vo forme hrubých zŕn a globulárnych inklúzií. Podľa Arnoldovej a spol. bolo vylúčenie diagnózy Whippleovej choroby na základe prítomnosti iba globulárnej PAS pozitivity príčinou oddialenia správnej diagnózy u dvoch z 13 pacientov, u ktorých bol k dispozícii bioptický materiál (3). Charakteristické chylektázie a depozity tukových substancií taktiež pomáhajú odlíšiť iné infekcie a stavy s výskytom PAS pozitívnych makrofágov. Typické histologické zmeny sú však prítomné iba približne v 90% prípadov a PAS pozitivita može byť redukovaná alebo dokonca vymiznúť po antibiotickej liečbe (obr. 4) (3,18).
Image 4. (A) Ilustratívna biopsia duodéna u pacienta s PCR potvrdenou Whippleovou chorobou. V lamina propria sú prítomné iba ojedinelé penovité makrofágy, hematoxylín-eozín, zvätšenie 400 krát. (B) PAS pozitivita makrofágov vo farbení Alcian/PAS, zvätšenie 400 krát. Mikrofotografie prípadu láskavo poskytol MUDr. Ondrej Ondič, Šiklův ústav patologie, Plzeň. 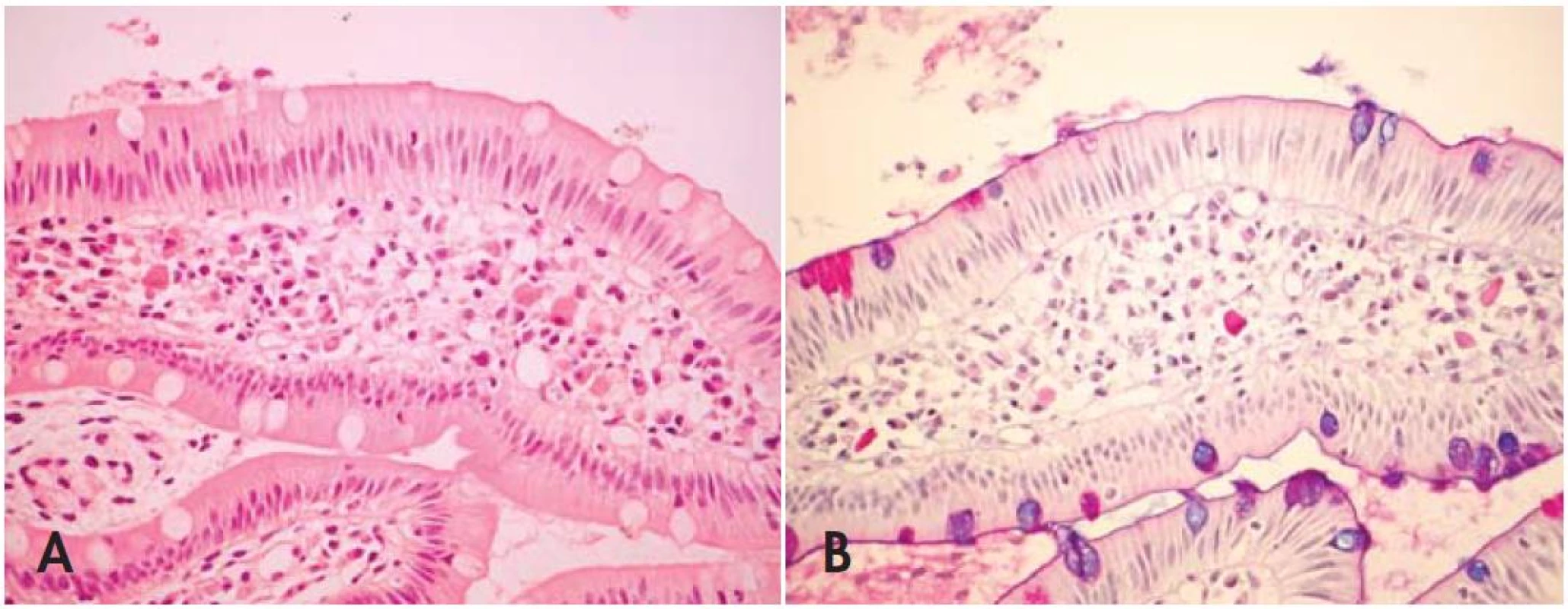
Histologický nález v mozgu zahŕňa perivaskulárne nakopenia makrofágov, lymfoplazmocytárne infiltráty a gliózu. Podobne ako v duodéne, makrofágy v mozgu obsahujú tukové látky a sú naplnené mikroorganizmami, ktoré sú PAS, Gram a methenamin pozitívne (15).
V diagnostike možno použíť aj imunohistochemické farbenie protilátkami proti T. whipplei (pozitivita zostáva dokonca aj v prípadoch PAS negativity po liečbe, (3)) a PCR detekciu (zlatý štandard diagnostiky v nejasných a atypických prípadoch) (13,19), ako aj elektrónovú mikroskópiu (9, 15, 19).
Z klinického pohľadu sa za významný a jedinečný diagnostický symptóm ochorenia považuje okulomastikatórna myorytmia, pri ktorej by sa mal pacient liečiť vždy, aj keď je duodenálna biopsia negatívna (20). Zo zdravotnej dokumentácie nami popisovaného pacienta vyplýva, že u neho bola prítomná kvadruhyperreflexia a poruchy okohybných nervov, pričom okulomastikatórna myorytmia (na podklade vzájomnej konzultácie) spätne nebola potvrdená, ale ani jednoznačne vylúčená. Medzi najčastejšie neurologické príznaky patrí demencia, oftalmoplegia, myoklonus a hypotalomo-pituitárne poruchy (16).
ZÁVER
V kazuistike sme popísali podľa našich dostupných informácii najpravdepodobnejšie prvý publikovaný prípad nediagnostikovanej Whippleovej choroby s letálnym koncom na Slovensku. Príčinou nediagnostikovania mohol byť raritný výskyt ochorenia s kombinovaným nešpecifickým klinickým obrazom gastrointestinálneho a neurologicko-psychiatrického postihnutia na pozadí miernej mentálnej retardácie a schizofrénie. Hlavnou príčinou však bolo nerozpoznanie histologických známok ochorenia v biopsii sliznice duodéna. Znalosť histomorfologických prejavov ochorenia, vrátane atypických foriem s malým počtom PAS pozitívnych makrofágov a primerané využitie špeciálnych diagnostických metód (imunohistochémia, PCR) sú základnými predpokladmi pre úspešnu liečbu tohoto inak smrteľného ochorenia.
POĎAKOVANIE
Svoju vďaku by sme radi vyslovili prof. MUDr. Michalovi Michalovi zo Šiklovho ústavu patológie v Plzni, za ochotu vykonať PCR analýzu na potvrdenie ochorenia.
Correspondence address:
MUDr. Daniel Farkaš
Úrad pre dohľad nad zdravotnou starostlivosťou
SLaPA pracovisko Košice
Trieda SNP č. 1, 043 35 Košice
tel.: +421552852660, fax: +421552852655
e-mail: farkas.dany@gmail.com
Sources
1. Lauwers G, Mino-Kenudson M,. Kradin RL. Infections of the Gastrointestinal Tract. In: Kradin RL, ed. Diagnostic pathology of infectious disease. Philadelphia, Saunders/Elsevier; 2010 : 215-254.
2. Rusina R, Keller O, Šíma R, Zámečník J. Peripheral neuropathy in Whipples disease: a case report. Cesk Patol 2012; 48(2): 97-99.
3. Arnold CA, Moreira RK, Lam-Himlin D, De Petris G, Montgomery E. Whipple disease a century after the initial description: increased recognition of unusual presentations, autoimmune comorbidities, and therapy effects. Am J Surg Pathol 2012; 36(7): 1066-1073.
4. Whipple GH. A hitherto undescribed disease characterized anatomically by deposits of fat and fatty acids in the intestinal and mesenteric lymphatic tissues. Bulletin of the Johns Hopkins Hospital 1907; 18 : 382–391.
5. Black-Schaffer B. Tinctorial demonstration of a glycoprotein in Whippleęs disease. Proc Soc Exp Biol Med 1949; 72 : 225-227.
6. Cohen AS, Schimmel EM, Holt PR, Isselbacher KJ. Ultrastructural abnormalities in Whippleęs disease. Proc Soc Exp Biol Med 1960; 105 : 411-414.
7. Chears WC Jr, Ashworth CT. Electron microscopic study of the intestinal mucosa in Whipple’s disease. Demonstration of encapsulated bacilliform bodies in the lesion. Gastroenterology 1961; 41 : 129-138.
8. Yardley JH, Hendrix TR. Combined electron and light microscopy in Whipple’s disease-demonstration of “bacillary bodies” in the intestine. John Hopkins Hosp Bull 1961; 109 : 80-98.
9. Kojecký Z, Malinský J, Koďousek R, Maršálek E. Frequence of occurence of microbes in the intestinal mucosa and in the lymph nodes during a long term observation of a patient suffering from Whippleęs disease. Gastroenterologia 1964; 101 : 163-172.
10. Relman DA, Schmidt TM, MacDermott RP, Falkow S. Identification of the uncultured bacillus of Whipple’s disease. N Engl J Med 1992; 327(5): 293–301.
11. Dumler JS, Baisden BL, Yardley JH, Raoult D. Immunodetection of Tropheryma whipplei in intestinal tissues from Dr. Whipple’s 1907 patient. N Engl J Med 2003; 348(14): 1411–1412.
12. Strayer DL, Rubin R, Rubin E. Rubin’s pathology: clinicopathologic foundations of medicine. Wolters Kluwer/Lippincott Williams & Wilkins: Philadelphia; 2008 : 583.
13. Schneider T, Moos V, Loddenkemper C, Marth T, Fenollar F, Raoult D. Whipple’s disease: new aspects of pathogenesis and treatment. Lancet Infect Dis 2008; 8(3): 179–190.
14. Marth T. The diagnosis and treatment of Whipple’s disease. Curr Allergy Asthma Rep 2001; 1(6): 566–571.
15. Prayson AR. Neuropathology. Elsevier, Churchil Livingstone: Philadelphia; 2005 : 296-297.
16. Graham DI, Lantos PL. Greenfieldęs Neuropathology, Volume 2 (6th edn). Oxford University Press, Arnold: London; 1997 : 135-137.
17. Jackuliak P, Koller T, Baqi L, et al. Whipple’s disease-generalized stage. Digestive Diseases and Sciences 2008; 53(12): 3250-3258.
18. Marth T, Raoult D: Whipple’s disease. Lancet 2003; 361(9353): 239-246.
19. La Scola B, Fenollar F, Fournier PE, Altwegg M, Mallet MN, Raoult D. Description of Tropheryma whipplei gen. nov., sp. nov., the Whipple’s disease bacillus. Int J Syst Evol Microbiol 2001; 51(Pt 4): 1471–1479.
20. Schwartz MA, Selhorst JB, Ochs AL, et al. Oculomasticatory myorhythmia: a unique movement disorder occurring in Whipple’s disease. Ann Neurol 1986; 20(6): 677-683.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2013 Issue 2-
All articles in this issue
-
Cytopatologie 2012: screening – vzdělávání – diagnostika
Hlavní témata 37. evropského cytologického kongresu:
Dubrovník – Cavtat, Chorvatsko 30. 9. – 3. 10. 2012 - Primární velkobuněčný neuroendokrinní karcinom močového měchýře
- Nediagnostikovaná Whippleova choroba s letálnym koncom
- Lidské papilomaviry se neúčastní v etiopatogeneze nádorů slinných žláz
- Subependymálny obrovskobunkový astrocytóm s atypickými klinickými a patologickými črtami: diagnostická pasca
- Perineurióm podobný angiofibrómu. Kazuistika
- Nová zárodečná mutace v CYLD genu u slovenského pacienta s Brookeovým-Spieglerovým syndromem
- Difuzní idiopatická hyperplázie neuroendokrinních buněk: popis případu a přehled literatury
-
Cytopatologie 2012: screening – vzdělávání – diagnostika
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nediagnostikovaná Whippleova choroba s letálnym koncom
- Primární velkobuněčný neuroendokrinní karcinom močového měchýře
- Difuzní idiopatická hyperplázie neuroendokrinních buněk: popis případu a přehled literatury
- Nová zárodečná mutace v CYLD genu u slovenského pacienta s Brookeovým-Spieglerovým syndromem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

