-
Medical journals
- Career
Sarkomatoidní (metaplastický) vřetenobuněčný karcinom prsu vznikající ve fyloidním tumoru s rozsáhlou skvamózní metaplázií – kazuistika a přehled literatury
: Z. Kinkor 1; E. Sticová 2; J. Šach 2; J. Rychtera 3; A. Skálová 1
: Bioptická laboratoř, s. r. o. a Šiklův ústav patologie, LF UK, Plzeň 1; Ústav patologie, FN a 3. LF UK, Královské Vinohrady, Praha 2; RTG-U, s. r. o., Jičín 3
: Čes.-slov. Patol., 48, 2012, No. 3, p. 156-160
: Original Articles
U sedmdesátišestileté ženy byla provedena parciální mastektomie, kde byl diagnostikován 45 mm veliký low-grade maligní homologní fyloidní tumor s rozsáhlou intraduktální skvamózní metaplázií. V jedné třetině rozsahu nádoru se domnělé původní stroma strukturálně a cytologicky měnilo a přerůstalo epitelovou složku. Výsledné rozvolněné storiformní uspořádání s většími oválnými elementy s hojnější cytoplazmou, jadernou atypií a mitotickou aktivitou doplňovaly buď disperzní objemné, abruptně vložené skvamózní moruly nebo jen známky abortivní perlovité skvamózní diferenciace. Konvenční duktální in situ či invazívní karcinom nebyl zastižen. Exprese nízko - a vysokomolekulárních cytokeratinů společně s p63, CD10, S100 proteinem a GFAP prokázala neúplný basálně/myoepiteliální fenotyp a vedla k diagnóze dosud nepopsaného, vřetenobuněčného metaplastického karcinomu v rámci fyloidního tumoru. Literární přehled vzácné maligní transformace epitelové komponenty fyloidního tumoru doplňuje diskuze o možné patogenezi tohoto jedinečného pozorování.
Klíčová slova:
prs – fyloidní tumor – fylodes tumor – sarkomatoidní/metaplastický vřetenobuněčný karcinom – skvamózní metaplázieFyloidní tumor (FT) prsu je relativně vzácná fibroepitelová léze, kde intimní strukturální koexistence epitelové a mezenchymální složky neustále vzbuzuje histogenetické rozpaky. Stejně tak grading a předpověď biologického chování konkrétního nádoru jsou zdrojem mnohých rozporů, nejasností a nejistoty (1–3). Proč právě mezenchymová součást FT disponuje dominantním morfologickým a klinicko-biologickým maligním potenciálem též zůstává velkou neznámou. Přesto histologicky evidentní maligní formy FT vesměs nečiní diagnostické obtíže, neboť původní stroma nabývá charakteru jasného low - či high-grade sarkomu, navíc s kapacitou variabilní heterologní diferenciace. Původní epitelová komponenta pak může být potlačena do té míry, že nádor určující příznačná bifázičnost úplně vymizí. Následná eventuelní záměna za primární sarkom prsu (dříve též tzv. „stromální“) je pak ale v principu biologicky nepodstatná.
Opačnou možnost přestavuje vznik invazivního karcinomu (IK) z epitelových formací FT, což je fenomén mimořádně vzácný a dokumentovaný v anglicky psané literatuře pouze jednotlivými kazuistikami (1,4–22).
Předkládáme vlastní pozorování zajímavého případu vzniku metaplastického vřetenobuněčného karcinomu (MVK) v preexistujícím FT s rozsáhlou skvamózní metaplázií (SM), který v písemnictví zatím zveřejněn nebyl.
MATERIÁL A METODIKA
Materiál byl fixován v 10% formolu; pro barvení hematoxylinem eozinem byly krájeny řezy silné 4 μm, pro imunohistochemické vyšetření silné 2 μm.
Imunohistochemické vyšetření bylo prováděno elektronicky nastaveným protokolem v automatu BenchMark ULTRA, VENTANA/Roche. K vizualizaci reakce byl použit diaminobenzidin tetrahydrochlorid, k dobarvení jader metylénová modř. Seznam použitých protilátek, výrobce, klon a ředění jsou uvedeny v tab. 1.
1. Seznam použitých protilátek - výsledky 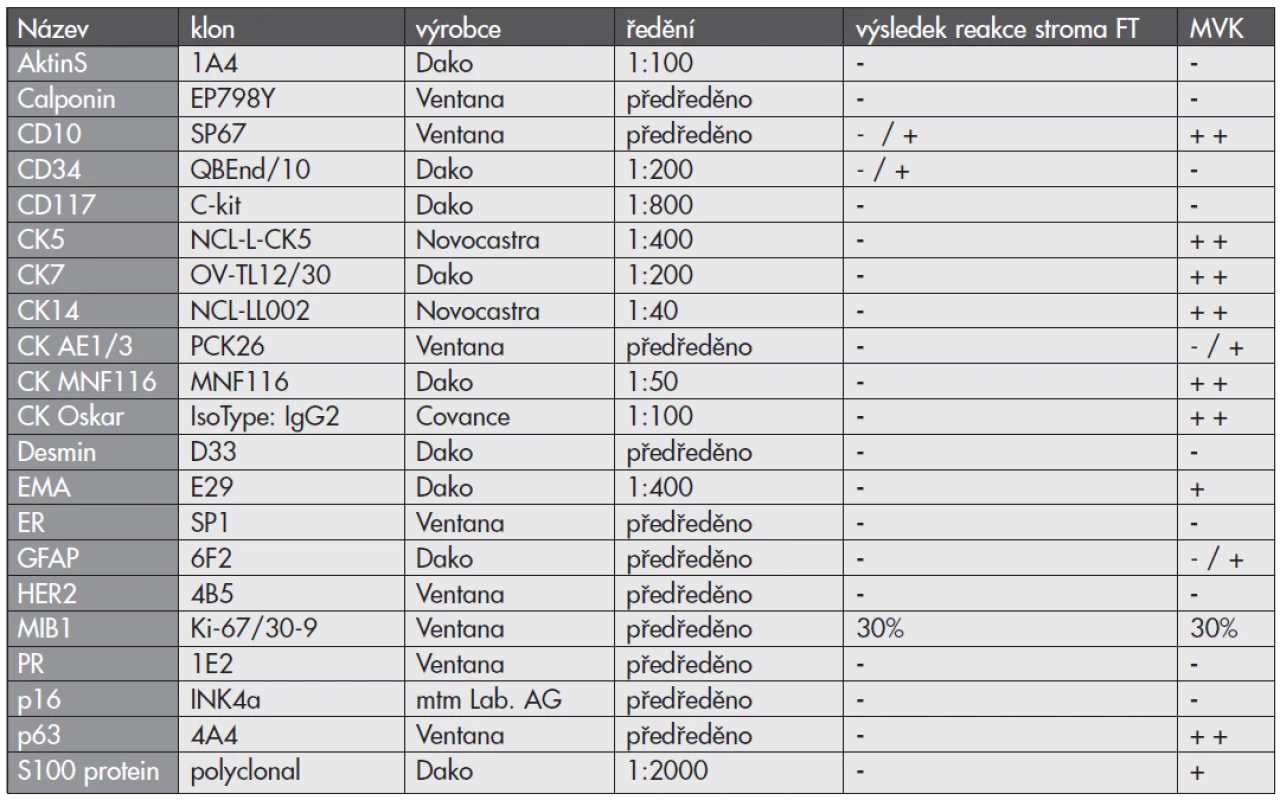
CD - cluster of differentiation, CK - cytokeratin, ER - estrogenový receptor, PR - progesteronový receptor, EMA - epitelový membránový antigen, GFAP - gliální fibrilární acidický protein. Výsledek reakce: difúzně silně pozitivní ++ pozitivní + ložiskově slabě pozitivní +/- negativní -, FT - fyloidní tumor, MVK - metaplastický vřetenobuněčný karcinom POPIS PŘÍPADU
U sedmdesátišestileté ženy s palpační rezistencí levého prsu prokázalo mamografické a sonografické vyšetření nejasnou ohraničenou denzní lézi (BI-RADS 4B – Breast Imaging Reporting And Data System; obr. 1) a následovala punkční biopsie (CNB). Závěr patologa nebyl jednoznačný; z limitovaného vzorku bylo vysloveno podezření na možný FT s tím, že vzhledem k diskrepanci morfologického obrazu a zdánlivě kontroverzní expresi cytokeratinových markerů nelze vyloučit ani možnost eventuelní MVK. V materiálu z parciální mastektomie byl přítomen, ostře ohraničený, šedobělavý, 45 mm veliký tumor, který na řezu obsahoval místy štěrbinovité prostory a drobné cystičky; zpracován byl celý. Operační preparát neobsahoval tkáň axily s lymfatickými uzlinami (LU).
1. <em>Mastogram</em>. V transparentním žlázovém tělese prsu je evidentní, ostře ohraničené, denzní zastínění podezřelé z neoplázie. 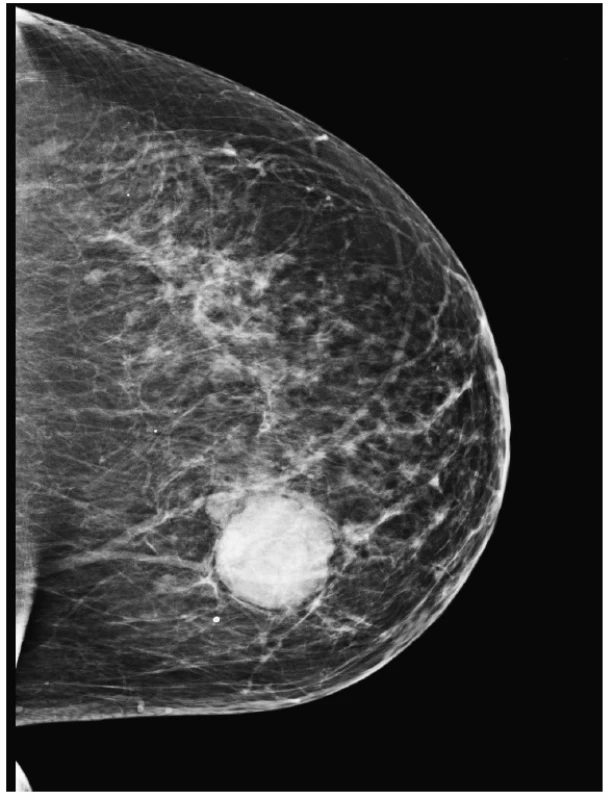
V mikroskopickém obraze převládalo duální uspořádání fyloidního tumoru s typickými stromálními luminálními projekcemi (obr. 2A) nebo jen nahloučenými rozšířenými dukty. V okolním monomorfním vřetenobuněčném stromatu se zřetelnou místní periduktální kondenzací (obr. 2B) se výraznější atypie nenacházely a mitotická aktivita nepřesahovala 5 mitóz na 10 velkých zorných polí. Heterologní diferenciace nebyla přítomna, naopak pravidelný duktální epitel disperzně vykazoval známky rozsáhlé SM, mnohdy až s téměř úplnou obliterací lumen (obr. 2C). Nález odpovídal low-grade (G2/intermediární) malignímu FT. Přibližně v jedné třetině bloků epitelová komponenta významně ustupovala do pozadí a výsledný obraz připomínal fenomén tzv. sarkomatózního stromálního přerůstání „stromal overgrowth“. Do tohoto prostředí byly na četných místech abruptně vsazeny různě veliké morulovité skvamózní formace, kde žlázový epitel úplně chyběl (obr. 2D). Intimně sousedící vřetenitá populace se však při bližším pohledu jevila poněkud odlišně, i když přechod do původního stromatu FT byl velmi nenápadný a plynulý. Dřívější kompaktní uspořádání zde u domnělých stromálních elementů vystřídalo plsťovité rozvolnění až myxoidní prosáknutí, kde jádra byla oválnější a doprovázená objemnější, eozinofilní cytoplazmou (obr. 2E). Výsledný dojem primitivně epiteloidní morfologie fokálně vyústil vznikem abortivní skvamózní perly (obr. 2F). Dřívější uniformitu stromatu FT nahradila anizokaryóza, jaderná hyperchromázie, zjevné buněčné atypie a ztráta fascikulární polarity. Zvýšenou mitotickou aktivitu doplňovaly i atypické figury. Kompletní zpracování vzorku neprokázalo konvenční duktální in situ karcinom či IK.
2. <em>Morfologie</em>. A – Typická úprava FT s lístkovitou projekcí stromatu do štěrbinovitých duktálních prostor; B – Kondenzace monotónního vřetenobuněčného stromatu s mitotickou aktivitou kolem rozšířených duktů s pravidelnou cylindrickou výstelkou; C – Rozsáhlá skvamózní metaplázie nahrazující původní výstelku epitelových štěrbin FT; D – Objemné skvamózní moruly zasazené do okolního stromatu jako výsledek obliterace původních vývodů; E – Sarkomatoidní, rozvolněná, plsťovitá struktura metaplastického karcinomu klamnû napodobující „stromal overgrowth“ původního FT. Ojedinělé objemnější epiteloidní elementy a atypické mitózy; F – Fibromatózu připomínající vřetenobuněčná populace metaplastického karcinomu s ložiskovou tvorbou abortivních skvamózní perel. Vše barveno hematoxylinem eozinem (zvětšení 200x; pouze F zvětšení 400x). 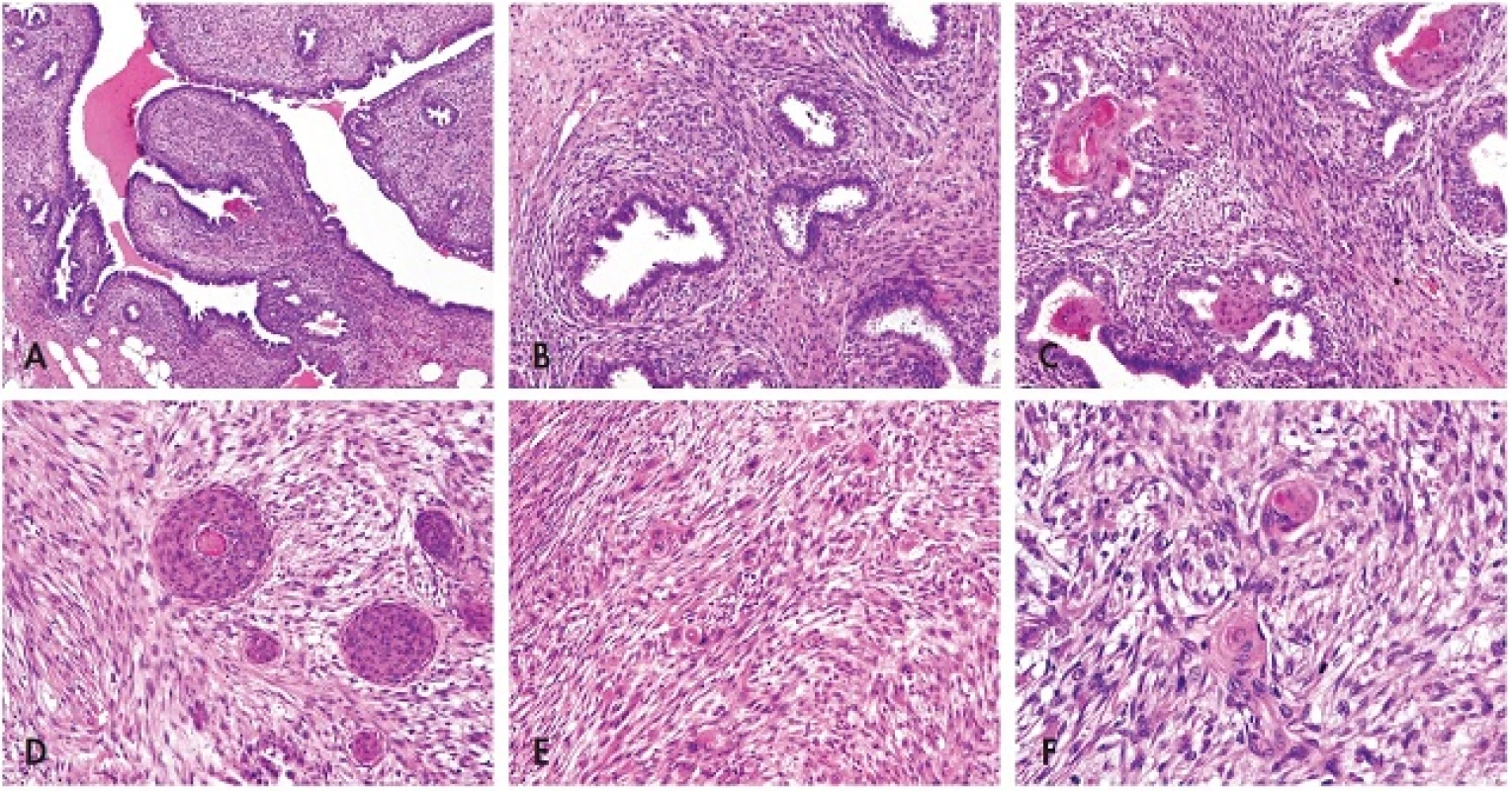
Výsledky širokého panelu imunohistochemie jsou uvedeny v tabulce (tab. 1). Stroma jasného FT kromě fokální a slabé exprese markerů CD10 a CD34 reagovalo negativně s celou paletou protilátek. Naproti tomu v oblastech zdánlivé přerůstající sarkomatoidní stromální komponenty FT byla zjištěna disperzní, ale silná pozitivita různých vysoko - i nízkomolekulárních cytokeratinů, p63, S100 proteinu, CD10 a fokálně též GFAP (obr. 3A–F). MIB1 proliferační index byl srovnatelný v obou rozdílných zónách a činil přibližně 30%.
3. <em>Imunohistochemie</em>. A – Imunohistochemický průkaz cytokeratinu 7 v metaplastickém vřetenobuněčném karcinomu; B – Imunohistochemický průkaz CD10 proteinu v metaplastickém vřetenobuněčném karcinomu; C – Imunohistochemický průkaz cytokeratinu 14 v myoepiteliích vývodů FT, stroma je negativní; D – Imunohistochemický průkaz cytokeratinu 14 v metaplastickém vřetenobuněčném karcinomu; E – Imunohistochemický průkaz p63 v myoepiteliích vývodů FT, stroma je negativní; F – Imunohistochemický průkaz p63 v metaplastickém vřetenobuněčném karcinomu (vše zvětšení 200x). 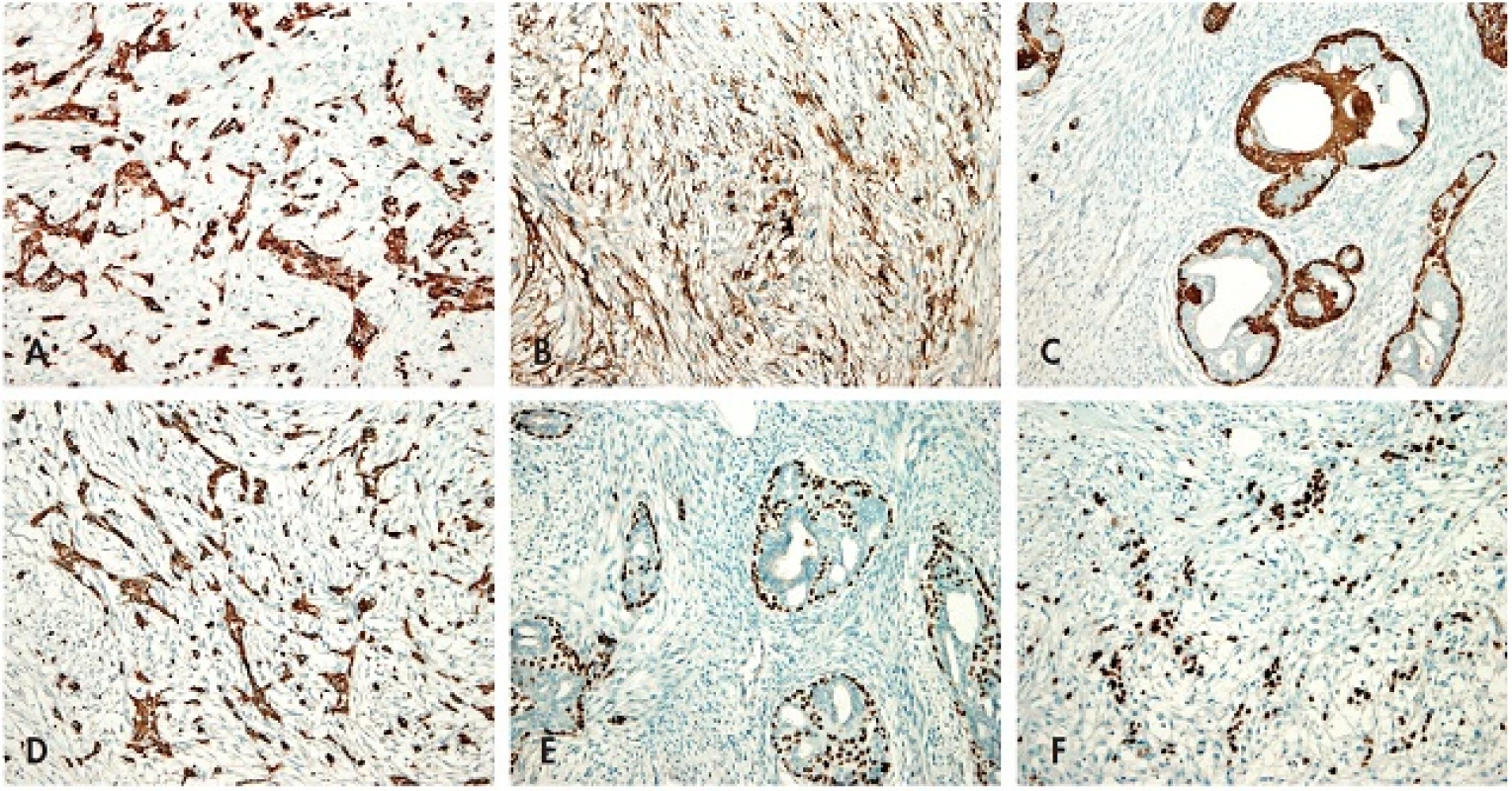
Proces byl nakonec uzavírán jako MVK vznikající v low-grade maligním FT.
DISKUZE
Problematika maligního (low-/high-grade) FT se v naprosté většině omezuje na mezenchymální složku, která mívá vzhled různě diferencovaného vřetenobuněčného sarkomu se schopností heterologní orientace a zřetelně přerůstá původní epitelovou součást (stromal overgrowth). Následné potlačení charakteristické strukturální duality léze pak ztěžuje diagnostiku, především v punkční biopsii (CNB). Maligní FT definují histologická kriteria (grading), která však jen velmi nepřesně kopírují následnou biologii (1). High-grade FT představuje přibližně 20 % morfologického spektra a je přibližně ve 25 % případů důvodem opakovaných místních recidiv (2,3). K metastázování high-grade FT dochází zhruba u pětiny z nich, avšak vysloveně letální průběh přitom zůstává neočekávaně vzácným projevem (2,3). Skutečný maligní potenciál high-grade FT je zjevně nižší v porovnání s primárními měkkotkáňovými sarkomy obdobného gradu (1).
Maligní zvrat epitelové komponenty FT je naproti tomu jev velmi ojedinělý. Literárně doloženo je přibližně 27 případů vzniku karcinomu v terénu FT, z toho 20 invazívních (2 lobulární a 18 duktálních) (4–30). Převažující konvenční duktální morfotyp u 13 z nich doplňuje u ostatních 5 pozorování různě rozsáhlá skvamózní diferenciace (5,8,18,19,21). Metastázování do regionálních axilárních LU bylo zjištěno ve 3 pozorováních; v jednom z nich se skvamózní diferenciací i v metastáze (13,14,17). V žádném z těchto 20 IK nemělo stroma FT vzhled high-grade sarkomu, nebyl patrný „stromal overgrowth“ ani heterologní struktury. Vedle různě rozsáhlých karcinomových úseků bylo vždy zastiženo původní bifázické uspořádání FT, kde žlázový epitel vypadal naprosto pravidelně; pouze ve 4 pozorováních je explicitně zmíněn doprovodný duktální in situ karcinom (DCIS) (4,13,17,23). Vznik metaplastického karcinomu (MK) ve spojitosti s FT literatura neuvádí.
Námi předkládaný ojedinělý případ MVK vznikajícího v rámci low-grade FT se SM je pro své dokonalé histologické mimikry záludným diagnostickým oříškem. Tato neobvyklá kombinace morfologických obrazů navíc automaticky navozuje některé podstatné otázky: Jaká je histopatogeneze epitelové malignity? Jaká je její reálná biologie? Jaký volit optimální léčebný postup?
Složitost a zrádnost diagnostiky low-grade (fibromatóze podobného) MVK prsu je všeobecně známá. Nejlepší strategií, jak se vyhnout nepříjemnému omylu, je vždy zahrnout tuto jednotku do diferenciálně diagnostického algoritmu vřetenobuněčných lézí, kam přirozeně patří i stromální součást FT. Netřeba zdůrazňovat, jak celou situaci znesnadňuje limitovaná CNB. Naprosto neočekávaný simultánní výskyt těchto dvou, na první pohled téměř nerozeznatelných, proliferací, vytvářejících zdánlivě uniformní kompozici v rámci jednoho tumoru, je rafinovanou pastí i pro zkušeného patologa. V našem pozorování vedly ke správnému závěru jednak paradoxně „nejasný“ obraz v CNB, jednak pečlivá interpretace jemných strukturálních a cytologických detailů proměnlivého zdánlivého stroma FT v kontextu s výsledky širokého panelu imunohistochemie. V neposlední řadě, skvamózní diferenciace jako možné histopatogenetické pojítko usnadnila rozpoznání dvou rozdílných lézí.
I když o přesné histopatogeneze MVK na pozadí FT lze jen spekulovat, domníváme se, že se apriori nejedná o kolizní neoplázii a že luminální SM epitelové složky FT by mohla být ve skutečnosti prekurzorem výsledného invazívního karcinomu. Pro tuto eventualitu, zdá se, svědčí hned několik argumentů - zaprvé, nakolik je duktální SM ve FT vzácná, je asi jen málo pravděpodobné, že asociovaný raritní MVK vykazující známky SM by byl nezávislým kolizním tumorem. Zadruhé, makroskopicky se jednalo o jedinou lézi, kde se formace FT a MVK vzájemně plynule mísily. Zatřetí, skvamózní moruly místy kompletně obliterovaly původní lumen vývodů a vedle lehké jaderné atypie vykazovaly i mitotickou aktivitu; konvenční DCIS však přítomen nebyl. Vřetenobuněčná populace infiltrujícího karcinomu pak navíc mnohde plynule přecházela ve skvamózní perly. Začtvrté, z 18 dosud publikovaných konvenčních duktálních IK vycházejících z FT mělo 5 skvamózní charakter. Konečně, imunofenotyp našeho MVK ukazoval na neúplnou basálně/myoepiteliální orientaci, která sice neodliší buněčný původ od diferenciačního směru, nicméně je se skvamózním morfotypem vysoce homologní.
Lze předpokládat, že klinicko-biologické chování bude u tohoto případu spíše určovat MVK a existuje tedy reálná možnost vzniku metastáz - regionálních i vzdálených. I přesto, že obecně MK zasahuje LU axily méně často, bylo by vhodné provést alespoň vyšetření sentinelové LU. Na rozdíl od běžného léčebného protokolu low-grade FT (kompletní odstranění s čistou resekční linií a event. zajištující lokální radiací) by měla v tomto případě následovat adekvátní adjuvantní chemoterapie. MVK se při absenci zjevného monomorfního high-grade sarkomového vzhledu či heterologní diferenciace a při plně zachovaném epitelovém imunofenotypu totiž stále chová více jako běžný karcinom než FT, což platí zejména pro topografii případné diseminace.
Demonstrovaný případ, byť nesmírně vzácný, se zdá být reálným dokladem principiálně možného vzniku MK v rámci fyloidního tumoru. Rozpoznání pravé podstaty dvojí, morfologicky splývající, avšak odchylné histogenetické diferenciace/orientace, umožňuje optimalizovat následný léčebný přístup.
PODĚKOVÁNÍ
Děkujeme prim. MUDr. Mukenšnáblovi za zhotovení fotodokumentace.
Adresa pro korespondenci:
Doc. MUDr. Zdeněk Kinkor, PhD.
Bioptická laboratoř s.r.o., Mikulášské nám. 4
326 00 P L Z E Ň
tel: +420 737 220 449
email: kinkor@medima.cz
Sources
1. Carter BA, Page DL. Phyllodes tumor of the breast: local recurrence versus metastatic capacity Hum Pathol 2004; 35(9): 1051–1052.
2. Rosen PP. Fibroepithelial neoplasms. In: Rosen PP, Hoda SA. Breast pathology. Diagnosis by needle core biopsy (2nd edn). Philadelphia, PA: Lippincott Williams & Wilkins; 2006 : 69–84.
3. Tavassoli FA. Tumours of the breast. Fibroepithelial tumours. In: Tavassoli FA, Devilee P. WHO classification of tumours. Pathology and genetics of tumours of the breast and female genital organs. IARC Press: Lyon; 2003 : 99–103.
4. Abdul Aziz M, Sullivan F, Kerin MJ, Callagy G. Malignant phyllodes tumour with liposarcomatous differentiation, invasive tubular carcinoma, and ductal and lobular carcinoma in situ: case report and review of the literature. Patholog Res Int 2010; 2010 : 501274.
5. De Rosa G, Ferrara G, Goglia P, Ghicas C, Zeppa P. In situ and microinvasive carcinoma with squamoid differentiation arising in a phyllodes tumor: report of a case. Tumori 1989; 75(5): 514–517.
6. Deodhar KK, Baraniya JB, Naresh KN, Shinde SR, Chinoy RF. Cancerization of phyllodes tumour. Histopathology 1997; 30(1): 98–99.
7. Gilks B, Tavassoli FA. Coexistence of intracytoplasmic lumens and membrane-bound vesicles in an invasive carcinoma arising in cystosarcoma phyllodes. Ultrastruct Pathol 1988; 12(6): 631–642.
8. Hunger E, Türk R, Wurster K. Malignant cystosarcoma phylloides and squamous cell carcinoma of the breast. A rare tumor combination. Geburtshilfe Frauenheilkd 1984; 44(10): 640–642.
9. Christensen L, Nielsen M, Madsen PM. Cystosarcoma phyllodes. A review of 19 cases with emphasis on the occurrence of associated breast carcinoma. Acta Pathol Microbiol Immunol Scand A 1986; 94(1): 35–41.
10. Ishida T, Izuo M, Kawai T. Breast carcinoma arising in cystosarcom phyllodes: report of a case with a review of the literature. Jpn J Clin Oncol 1984; 14(1): 99–106.
11. Klausner JM, Lelcuk S, Ilia B, et al. Breast carcinoma originating in cystosarcoma phyllodes. Clin Oncol 1983; 9(1): 71–74.
12. Kodama T, Kameyama K, Mukai M, Sugiura H, Ikeda T, Okada Y. Invasive lobular carcinoma arising in phyllodes tumor of the breast. Virchows Arch 2003; 442(6): 614–616.
13. Korula A, Varghese J, Thomas M, Vyas F, Korula A. Malignant phyllodes tumour with intraductal and invasive carcinoma and lymph node metastasis. Singapore Med J 2008; 49(11): e318–321.
14. Kuo YJ, Ho DM, Tsai YF, Hsu CY. Invasive ductal carcinoma arising in phyllodes tumor with isolated tumor cells in sentinel lymph node. J Chin Med Assoc 2010; 73(11): 602–604.
15. Leong AS, Meredith DJ. Tubular carcinoma developing within a recurring cystosarcoma phyllodes of the breast. Cancer 1980; 46(8): 1863–1867.
16. Macher-Goeppinger S, Marme F, Goeppert B, et al. Invasive ductal breast cancer within a malignant phyllodes tumor: case report and assessment of clonality. Hum Pathol 2010; 41(2): 293–296.
17. Parfitt JR, Armstrong C, O’malley F, Ross J, Tuck AB. In-situ and invasive carcinoma within a phyllodes tumor associated with lymph node metastases. World J Surg Oncol 2004; 2 : 46.
18. Ramdass MJ, Dindyal S. Phyllodes breast tumour showing invasive squamous-cell carcinoma with invasive ductal, clear-cell, secretory, and squamous components. Lancet Oncol 2006; 7(10): 880
19. Sharma R, Usmani S, Siegel R. Primary squamous cell carcinoma of breast in background of phyllodes tumor - a case report. Conn Med 2009; 73(6): 341–343.
20. Shirah GR, Lau SK, Jayaram L, Bouton ME, Patel PN, Komenaka IK. Invasive lobular carcinoma and lobular carcinoma in situ in a phyllodes tumor. Breast J 2011; 17(3): 307–309.
21. Sugie T, Takeuchi E, Kunishima F, Yotsumoto F, Kono Y. A case of ductal carcinoma with squamous differentiation in malignant phyllodes tumor. Breast Cancer 2007; 14(3): 327–332.
22. Yasumura T, Matsui S, Hamajima T, et al. Infiltrating ductal carcinoma developing within cystosarcoma phyllodes - a case report. Jpn J Surg 1988; 18(3): 326–329.
23. Alė PL, Andreano T, Monaco S, Sebastiani V, Eleuteri Serpieri D. Malignant phyllodes tumor of the breast with features of intraductal carcinoma. Pathologica 2001; 93(2): 124–127.
24. Brochard-Le-Douarin LA, Laboisse C, Potet F, SenŹze J. Phyllodes tumor associated with in-situ lobular carcinoma. Rev Fr Gynecol Obstet 1989; 84(1): 41–43.
25. Grove A, Deibjerg Kristensen L. Intraductal carcinoma within a phyllodes tumor of the breast: a case report. Tumori 1986; 72(2): 187–190.
26. Knudsen PJ, Ostergaard J. Cystosarcoma phylloides with lobular and ductal carcinoma in situ. Arch Pathol Lab Med 1987; 111(9): 873–875.
27. Lim SM, Tan PH. Ductal carcinoma in situ within phyllodes tumour: a rare occurrence. Pathology 2005; 37(5): 393–396.
28. Nishimura R, Hasebe T, Imoto S, Mukai K. Malignant phyllodes tumour with a noninvasive ductal carcinoma component. Virchows Arch 1998; 432(1): 89–93.
29. Nomura M, Inoue Y, Fujita S, et al. A case of noninvasive ductal carcinoma arising in malignant phyllodes tumor. Breast Cancer 2006; 13(1): 89–94.
30. Yamaguchi R, Tanaka M, Kishimoto Y, Ohkuma K, Ishida M, Kojiro M. Ductal carcinoma in situ arising in a benign phyllodes tumor: report of a case. Surg Today 2008; 38(1): 42–45.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2012 Issue 3-
All articles in this issue
- Melanocytic pseudotumors
- Differential diagnosis of the chronic pancreatitis and the pancreatic ductal adenocarcinoma
- Giant-cell lesions of bone and their differential diagnosis
- Pseudotumors of the testis and testicular adnexa
- Sarcomatoid (metaplastic) spindle cell carcinoma arising in a phylloid tumor with massive squamous metaplasia – a case report and review of the literature
- Primary vaginal squamous cell carcinoma arising in a squamous inclusion cyst: Case report
- Histopathological autoptic findings in 8 patients with pandemic influenza A (H1N1) pneumonia
- Immunoexpression of type-1 adiponectin receptor in the human intestine
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Giant-cell lesions of bone and their differential diagnosis
- Differential diagnosis of the chronic pancreatitis and the pancreatic ductal adenocarcinoma
- Sarcomatoid (metaplastic) spindle cell carcinoma arising in a phylloid tumor with massive squamous metaplasia – a case report and review of the literature
- Melanocytic pseudotumors
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

