-
Medical journals
- Career
Naše skúsenosti s vyšetrovaním JAK2 mutácií pacientov s myeloproliferatívnymi ochoreniami z trepanobioptického materiálu kostnej drene
: T. Burjanivová 1*; J. Marcinek 2,3*; G. Minárik 4; Z. Lasabová 1; P. Szépe 2,3; T. Balhárek 2,3; A. Vaňochová 1; L. Plank 2,3*
: T. B, J. M a L. P prispeli k tejto práci rovnako *; Ústav molekulovej biológie JLF UK v Martine 1; Ústav patologickej anatómie a Konzultačné centrum bioptickej diagnostiky ochorení krvotvorby JLF UK a UNM v Martine 2; Martinské bioptické centrum, s. r. o. v Martine 3; Ústav molekulárnej biomedicíny LF UK v Bratislave 4
: Čes.-slov. Patol., 47, 2011, No. 3, p. 115-117
: Original Article
Polycythemia vera (PV), esenciálna trombocytóza (ET) a primárna myelofibróza (PMF) patria do skupiny Ph1 negatívnych myeloproliferatívnych neoplázii (MPN), pri ktorých sa často vyskytuje mutácia JAK2V617F. Táto mutácia sa vyskytuje u takmer všetkých pacientov s PV a u približne 60 % pacientov s ET a PMF. V diferenciálnej diagnostike MPN však význam tejto mutácie stále nie je dosť objasnený, preto tu má dôležitú úlohu aj bioptické vyšetrenie kostnej drene. Na našom pracovisku sme sa rozhodli vyšetrovať JAK2V617F mutáciu v DNA izolovanej z parafínovych blokov od pacientov s PV, ET a PMF, keďže túto mutáciu nedávno SZO odporučila využívať ako jeden z markerov v diagnostike uvedených klinických jednotiek. Mutácie V617F sme detekovali pomocou alelovo-špecifickej hot start multiplex PCR. U JAK2V617F negatívnych pacientov s PV sme vyšetrovali sekvenovaním prítomnosť mutácií v exóne 12 JAK2 génu. Dosiaľ sme na našom pracovisku vyšetrili približne 200 pacientov s klinicky verifikovanou diagnózou PV, ET a PMF. Naše výsledky sú u všetkých troch ochorení (ET, PV, PMF) zhodné s dosiaľ publikovanými prácami. Nami implementovaná metodika detekcie mutácie JAK2 z parafínových blokov umožňuje analýzu veľkého množstva archívneho materiálu pre retrospektívne štúdie, a súčasne aj implementáciu analýzy statusu JAK2 ako súčasti bioptického vyšetrenia kostnej drene všetkých pacientov s podozrením na PV, ET alebo PMF.
Kľúčové slová:
myeloproliferatívne neoplázie – JAK2 mutácie – parafínové blokyMyeloproliferatívne neoplázie (MPN), predtým nazývané aj chronické myeloproliferatívne ochorenia predstavujú skupinu nádorových ochorení, ktoré vznikajú klonálnou proliferáciou kmeňových hemopoetických buniek v kostnej dreni. Rozdeľujú sa na chronickú myelocytovú leukémiu (s pozitivitou Philadelphia 1 chromozómu /Ph1/, resp. bcr/abl génu) a na ochorenia bez pozitivity tohto chromozómu, tzv. Ph1- MPN. Medzi ne patria tri najčastejšie ochorenia: pravá polycytémia (PV), esenciálna trombocytémia (ET) a primárna myelofibróza (PMF). Dnes, po viac ako 5 rokov od objavu novej bodovej mutácie Janusovej tyrozínovej kinázy 2 typu V617F (ďalej len JAK2 mutácia) v skupine Ph1- myeloproliferatívnych neoplázií (MPN) je už zrejmý význam tohoto objavu pre diagnostiku, poznanie biológie a klinického priebehu a liečbu Ph1- MPN. JAK2 mutácia sa vyskytuje u 95 % pacientov s PV a pribl. 60 % pacientov s ET a PMF (1–4). Mutácia spôsobuje na ligande nezávislú fosforyláciu JAK2 kinázy s následnou aktiváciou STAT3 signálnej dráhy a transkripčných faktorov a prispieva tak k nekontrolovanej klonovej proliferácii kmeňových buniek krvotvorby (5). Ako súčasť tzv. veľkých a malých kritérií všetkých Ph1- MPN sa jej identifikácia stala spolu s črtami morfológie kostnej drene a ďalšími parametrami súčasťou diagnostických algoritmov podľa klasifikácie SZO (6). Vzhľadom ku koncentrácii biopsií kostnej drene pacientov s Ph1- MPN v našom pracovisku v pozícii Konzultačného centra bioptickej diagnostiky ochorení krvotvorby v SR sme preto mali ambíciu zaviesť novú metódu detekcie JAKV617F a komplementárnu detekciu mutácie v exóne 12 JAK2 génu, a to z DNA izolovanej z (trepano-)bioptických vzoriek KD.
MATERIÁL A METODIKA
Materiálom pre vyšetrovanie uvedených mutácií boli trepanobioptické vzorky KD, fixované pomocou štandardnej formolovej fixácie. Tieto boli vyšetrované v rámci retrospektívnej, ako aj prospektívnej časti analýzy prípadov z registrov oboch zainteresovaných patologických pracovísk. Podrobnejšie údaje pre výber materiálu uvádzame v časti výsledky.
Nami používaný postup možno stručne charakterizovať nasledovne:
- a) izolácia DNA: Bioptické vzorky fixované vo formole sú dekalcifikované v EDTA, odvodnené v alkoholovo-xylénovej rade a zalievané do parafínových blokov. Parafínové rezy sa deparafinizujú v xyléne a alkoholovej rade. DNA zo získaných buniek je izolovaná pomocou kitu QIAamp DNA Micro Kit (Qiagen Inc., USA).
- b) detekcia V617 mutácie: Mutáciu detekujeme pomocou alelovo-špecifickej hot start multiplex PCR s použitím primerov forward kontrola (5’ATC TAT AGT CAT GCT GAA AGT AGG AGA AAG-3’), forward V617F (5’-AGC ATT TGG TTT TAA ATT ATG GAG TAT ATT-3’) a reverse (5’-CTG AAT AGT CCT ACA GTG TTT TCA GTT TCA-3’) (7). PCR produkty sú separované v 3% agarózovom géli. V prítomnosti V617F mutácie vzniknú dva PCR fragmenty, pri jej chýbaní sa amplifikuje len jeden fragment (obr. 1). Na rozlíšenie heterozygótnej a homozygótnej formy JAK2V617F mutácie u pacientov s PV bola použitá restrikčná analýza pomocou enzýmu Bsa XI (7). Špecifickosť zavádzanej metódy bola u časti pacientov potvrdená sekvenáciou.
- c) detekcia mutácie v exóne 12 JAK2 pri PV: DNA pacientov s PV a bez JAK2V617F mutácie vyšetrujeme ďalej na prítomnosť mutácií v exóne 12 JAK2 génu. Pre amplifikáciu exónu 12 JAK2 génu sme použili JAK2 ex12 F primer (5’-CTC CTC TTT GGA GCA ATT CA-3’) a JAK2 ex12 R primer (5’-CCA ATG TCA CAT GAA TGT AAA TCA A-3’). 25 ml reakčná zmes pozostávala z 1,5 mmol/L MgCl2, 10 pmol/L z každého forward a reverse primeru, 2 mmol/L dNTPs, 2,5 mmol/L 10xPCR pufru (ABgene®, United Kingdom). PCR reakcia prebiehala podľa teplotného programu uvedeného v tabuľke 1.
1. Výsledky alelovo-špecifickej hot start multiplex PCR na detekciu JAK2 V617F mutácie. Dráhy 1,2,4 a 5 predstavujú pacientov s JAK2V617F mutáciou. Dráha 3 je pacient bez JAK2V617F mutácie. Dráha 6 je negatívna kontrola a dráha M je 50 bp ladder. 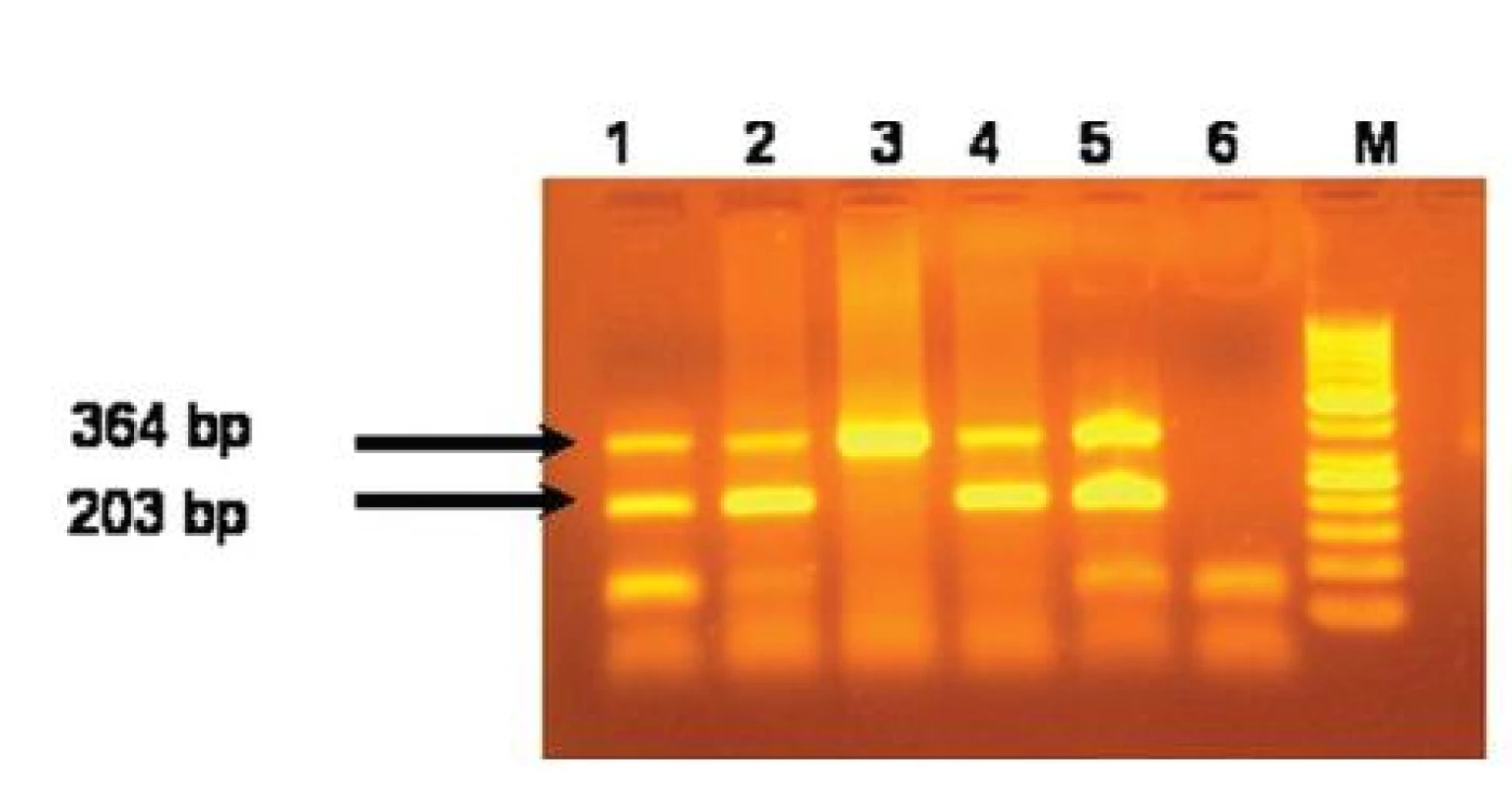
1. Teplotný programu PCR reakcie. 
Po PCR amplifikácii a purifikácii sme produkt sekvenovali pomocou kapilárnej elektroforézy ABI PRISM Genetic Analyser a BigDyeTMPrimer v3.0 Sequencing Kit (Applied Biosystem, USA). Získané sekvencie sa analyzujú s použitím softwaru Chromas 1.5 (Technelysium, Austrália). Identifikácia mutácií bola prevedená pomocou softwaru BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi) (8).
VÝSLEDKY
V úvodnej fáze implementácie metódy sme vyšetrovali mutáciu JAK2V617F retrospektívne v archívnom materiáli pribl. 200 pacientov s klinickou dg. PV, ET a PMF, u ktorých bol konkrétny typ Ph1- MPN verifikovaný aj biopticky. Mutáciu JAKV617F sme potvrdili v 90 % prípadoch PV, 64 % pacientov s ET a 60 % pacientov s PMF, čo sú hodnoty porovnateľné s výstupmi iných (1–4,9). Potom sme metodiku implementovali prospektívne do rutinnej diagnostickej praxe, pričom do momentu spracovania predloženého prehľadu sme vyšetrili vzorky ďalších 50 pacientov.
Mutáciu v exóne 12 sme doteraz potvrdili u troch pacientov s PV bez JAK2V617 mutácie, pričom u jedného z nich sme zachytili nový, doteraz neznámy typ bodovej mutácie (8).
DISKUSIA
Dnes metodiku analýzy mutácie JAKV617F používame ako súčasť bioptického vyšetrenia kostnej drene najmä:
- a) ak morfologický obraz vyžaduje diferenciálnu diagnostiku reaktívnej myeloproliferácie versus MPN, resp. ak je klinicky suponovaná Ph1- MPN, ale morfologický obraz drene nie je celkom charakteristický,
- b) v prípadoch málo objemnej hranične reprezentatívnej, alebo kvalitatívne arteficiálne (obyčajne odberom) poškodenej bioptickej vzorky kostnej drene,
- c) pri rebiopsiách, ak je žiadúce vyšetriť mutáciu v predošlom archívnom materiáli,
- d) na žiadosť hematológov najmä z ambulantných pracovísk, ktoré majú obmedzenú možnosť molekulovo-genetických analýz a pod.
Vo všeobecnosti význam detekcie JAK2V617mutácie, resp. exónu 12 možno zhrnúť nasledovne:
- je diagnostický - potvrdenie klonality ochorenia podporuje diagnózu Ph1- MPN tak pri neistote morfologického obrazu, ako aj pri kvantitatívnych a kvalitatívnych limitoch biopsie.
- umožní pochopiť manifestáciu MPN – napr. mutácia JAKV617F ovplyvňuje klinickú a laboratórnu manifestáciu MPN (častejšie trombotické komplikácie, zvýšené hodnoty erytrocytov a pod. (10–12), alebo dreň pacientov s PV bez mutácie JAKV617F a s mutáciou v exóne 12 vykazuje častejšie izolované zmeny erytropoézy bez výraznejšej aktivácie ostatných dvoch radov a preto jej morfológia môže byť iná než „klasická“,
- je čiastočne aj prognostický – najmä u pacientov s PMF, najmä v zmysle tendencie k progresu fibrózy a lepších výsledkov po transplantácii kostnej drene (13).
- v rámci indikovania postupne prichádzajúcej cielenej liečby Ph1- MPN môže byť aj prediktívny.
Záverom je vhodné dodať dve poznámky:
- a) Napriek značnej degradácii DNA izolovanej z parafínových bioptických blokov je technicky možné z nej vyšetriť JAK2 mutáciu (najmä v uvedených prípadoch). Napriek tomu prednosť má mať vždy, keď je to možné, test prítomnosti mutácie z „čerstvých“ buniek periférnej krvi alebo kostnej drene, a to podľa možnosti metódou RT-PCR (real-time PCR) - jednak pre vyššiu senzitivitu, ako aj pre možnosť kvantifikácie tejto mutácie. To umožňuje (analogicky k vyšetrovaniu bcr/abl génu pri CML) sledovať vývoj ochorenia a kontrolovať úspešnosť cielenej biologickej liečby (10). Tento fakt predstavuje istú výzvu aj pre našu prácu. Mutácie exónu 12 z DNA izolovanej z parafínového materiálu sú limitované jeho kvalitou (citlivosť sekvenačnej analýzy je nižšia než PCR) a tým, že pri veľkom množstve bodových mutácií (14) je jej uplatnenie v dennej praxi problematické. Vylúčením JAKV617F mutácie u pacientov s biopticky verifikovanou PV však možno selektovať prípady s potenciálnymi mutáciami v exóne 12 a v spolupráci s klinickou praxou prispieť k dokončeniu analýz vo vhodnejšom nefixovanom materiáli.
- b) Okrem relatívne častej JAK2 mutácie sa pri Ph1- MPN stretávame aj s inými zriedkavejšími typmi mutácií. Tu okrem už uvedeného (mutácie v exóne 12 JAK2 v prípadoch JAK2V617F negatívnej PV) možno uviesť napr. mutácie trombopoetínového receptora (MPL) postihujúce cca 10 % pacientov s PMF a cca 3 % prípadov ET (15), ako aj pestrú skupinu ďalších, relatívne vzácnych mutácií vyskytujúcich sa najmä pri blastickej transformácií Ph1- MPN. Nedávno bola identifikovaná aj mutácia TET2, ktorá sa okrem prípadov MPN (cca 20 %), vyskytuje aj pri iných myeloidných nádoroch (16). Možno teda zhrnúť, že aj keď objav JAK2 mutácií zlepšil porozumenie patogenézy Ph1-MPN, tak kauzálne genetické mutácie zodpovedné za vznik týchto ochorení sú stále neznáme a existencia „jednoduchej“ kauzálnej mutácie, ako je tomu pri CML je nepravdepodobná. Nielen preto sa napriek pokroku genetických analýz význam kvalitnej histomorfologickej analýzy bioptickej vzorky pacientov s Ph1- MPN nijako nezmenil.
POĎAKOVANIE
Podporené projektom OPVaV-2008/2.1/01-SORO – Centrum excelentnosti CEPV I. (IMTS kód 26220120016) a CEPV II. (IMTS kód 26220120036) na Jesseniovej lekárskej fakulte Univerzity Komenského v Martine, ktorý je spolufinancovaný z prostriedkov EÚ
Adresa pro korespondenci:
Prof. MUDr. Lukáš Plank, CSc.
Ústav patologickej anatómie JLF UK a UNM
Kollárova 2, 036 01 Martin, Slovenská republika
tel.: (+421)-434133002
fax: (+421) - 43 420 33 70
e-mail: plank@jfmed.uniba.sk
Sources
1. Baxter EJ, Scott LM, Campbell PJ, et al. Acquired mutation of the tyrosine kinase JAK2 in human myeloproliferative disorders. Lancet 2005; 365 : 1054–1061.
2. Kralovics R, Passamonti F, Buser AS, et al. A gain-of-function mutation of JAK2 in myeloproliferative disorders. N Engl JMed 2005; 352 : 1779–1790.
3. Jelinek J, Oki Y, Gharibyan V, et al. JAK2 mutation 1849G >T is rare in acute leukemias but can be found in CMML, Philadelphia chromosome–negative CML, and megakaryocytic leukemia. Blood 2005; 106 : 3370–3373.
4. Zhao R, Xing S, Li Z, et al. Identification of an acquired JAK2 mutation in polycythemia vera. J Biol Chem 2005; 280 : 22788–22792.
5. James C, Ugo V, Le Couedic JP, et al. A unique clonal JAK2 mutation leading to constitutive signalling causes polycythaemia vera. Nature 2005; 434(7037): 1144–1148.
6. Tefferi A, Thiele J, Orazi A, et al. Proposals and rationale for revision of the World Health Organization diagnostic criteria for polycythemia vera, essential thrombocythemia, and primary myelofibrosis: recommendations from an ad hoc international expert panel. Blood 2007; 110 : 1092–1097.
7. Horn T, Kremer M, Dechow T, et al. Detection of the activating JAK2 V617F mutation in paraffin-embedded trephine bone marrow biopsies of patients with chronic myeloproliferative diseases. J Mol Diagn 2006; 8 : 299–304.
8. Burjanivova T, Marcinek J, Lasabova Z, et al. A novel JAK2 exon 12 mutation identified in the retrospective analysis of paraffin-embedded tissues of polycythemia vera patients. Diagn Mol Pathol 2009; 18(2): 108–111.
9. Murugesan G, Aboudola S, Szpurka H, et al. Identification of the JAK2 V617F mutation in chronic myeloproliferative disorders using FRET probes and melting curve analysis. Am J Cin Pathol 2006; 125 : 625–633.
10. Vannucchi AM, Antonioli E, Guglielmelli P, et al. Clinical correlates of JAK2V617F presence or allele burden in myeloproliferative neoplasms: a critical reappraisal. Leukemia 2008; 22 : 1299–1307.
11. Ziakas PD. Effect of JAK2 V617F on thrombotic risk in patients with essential thrombocythemia: measuring the uncertain. Haematologica 2008; 93 : 1412–1414.
12. Dahabreh IJ, Zoi K, Giannouli S, et al. Is JAK2 V617F mutation more than a diagnostic index? A meta-analysis of clinical outcomes in essential thrombocythemia. Leuk Res 2008; 33 : 67–73.
13. Alchalby H, Badbaran A, Zabelina T, et al. Impact of JAK2V617F mutation status, allele burden, and clearance after allogeneic stem cell transplantation for myelofibrosis. Blood 2010; 116(18): 3572–3581.
14. Cazzola M. Somatic mutations of JAK2 exon 12 as a molecular basis of erythrocytosis. Haematologica 2007; 92 : 1585 – –1589.
15. Glembotsky AC, Korin L, Lev PR et al. Screening for MPL mutations in essential thrombocythemia and primary myelofibrosis: normal Mpl expression and absence of constitutive STAT3 and STAT5 activation in MPLW515L-positive platelets. Eur J Haematol 2010; 84(5): 398–405.
16. Tefferi A. Novel mutations and their functional and clinical relevance in myeloproliferative neoplasms: JAK2, MPL, TET2, ASXL1, CBL, IDH and IKZF1. Leukemia 2010; 24, 1128–1138.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2011 Issue 3-
All articles in this issue
- Histological diagnosis of Ph-negative myeloproliferative neoplasia. An overview.
- Malignant lymphomas, or what do clinicians expect from pathologists?
- Importance of cyclin D1 (and CD5) detection in the diagnosis of malignant lymphomas other than mantle cell lymphoma
- Our experience with detection of JAK2 mutations in paraffin-embedded trephine bone marrow biopsies of patients with chronic myeloproliferative disorders
- Quantitative molecular analysis in mantle cell lymphoma
- Burkitt lymphoma (BL): reclassification of 39 lymphomas diagnosed as BL or Burkitt-like lymphoma in the past based on immunohistochemistry and fluorescence in situ hybridization
- Coincidence of chronic lymphocytic leukaemia with Merkel cell carcinoma: deletion of the RB1 gene in both tumors
- Uterine leiomyoma with amianthoid-like fibers
- Glomus tumor of the stomach: A case report and review of the literature
- Mucosal changes after a polyethylene glycol bowel preparation for colonoscopy are less than those after sodium phosphate
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Our experience with detection of JAK2 mutations in paraffin-embedded trephine bone marrow biopsies of patients with chronic myeloproliferative disorders
- Histological diagnosis of Ph-negative myeloproliferative neoplasia. An overview.
- Importance of cyclin D1 (and CD5) detection in the diagnosis of malignant lymphomas other than mantle cell lymphoma
- Glomus tumor of the stomach: A case report and review of the literature
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

