-
Medical journals
- Career
Poranění pankreatu spojené s urologickým výkonem a možnosti řešení pankreatické píštěle
Authors: Vít Paldus 1; Vladimír Šámal 1,2; Jiří Škach 3; Jan Mečl 1
Authors‘ workplace: Urologické oddělení Krajské nemocnice Liberec, a. s., Liberec 1; Urologická klinika Fakultní nemocnice a Lékařské fakulty UK, Hradec Králové 2; Chirurgické oddělení krajské nemocnice Liberec, a. s., Liberec 3
Published in: Ces Urol 2020; 24(2): 141-145
Category: Case reports
Overview
Formou kazuistiky upozorňujeme na riziko poranění pankreatu při urologické operaci a zároveň prezentujeme možnosti řešení těchto komplikací.
Klíčová slova:
Poranění pankreatu – pankreatická píštěl – levostranná nefrektomie a adrenalektomie
ÚVOD
Poranění pankreatu je při urologickém výkonu relativně vzácnou komplikací a s ohledem na anatomickou topografii kaudy pankreatu je spojeno prakticky výhradně s levostrannými výkony. Dle některých autorů může být incidence poranění pankreatu během levostranné nefrektomie až 2,1 %, v případě levostranné adrenalektomie dokonce 8,6 % (1). Obecně zůstává realitou, že až 75 % lézí pankreatu je peroperačně nerozpoznáno (2). V některých případech může být pacient dokonce asymptomatický a známkou poranění může být překvapivě jen histologický nález tkáně pankreatu jako součást urologického preparátu. Z pohledu urologa lze rozdělit poranění pankreatu na „vědomé“, kdy je léze primárně ošetřena – například při extenzivním výkonu u rozsáhlého onkologického nálezu, nebo „nevědomé“, kdy je poranění diagnostikováno až v pooperačním období v důsledku rozvoje komplikací u pacienta. Přes primární ošetření pankreatu je riziko vzniku pankreatické píštěle (Pancreatic Fistula – PF) vysoké 10–30 % (3, 4, 5) a dle závažnosti se dělí do tří stupňů A, B, C (Tab. 1) (6). Zásadní pro definici pankreatické píštěle z roku 2005 dle ISGPS (International Study Group for Pancreatic Surgery) je jakýkoliv měřitelný výdej tekutiny ze zavedených drénů, a to po třetím operačním dnu, přičemž koncentrace amyláz v tekutině je 3× vyšší, než je normální sérová koncentrace (6). Drény mohou být zavedeny jak peroperačně, tak perkutánně pooperačně.
Table 1. Rozdělení klinické závažnosti pankreatické píštěle dle ISGPF
Tab. 1. Grading of clinical severity of pancreatitic fistula according to ISGPF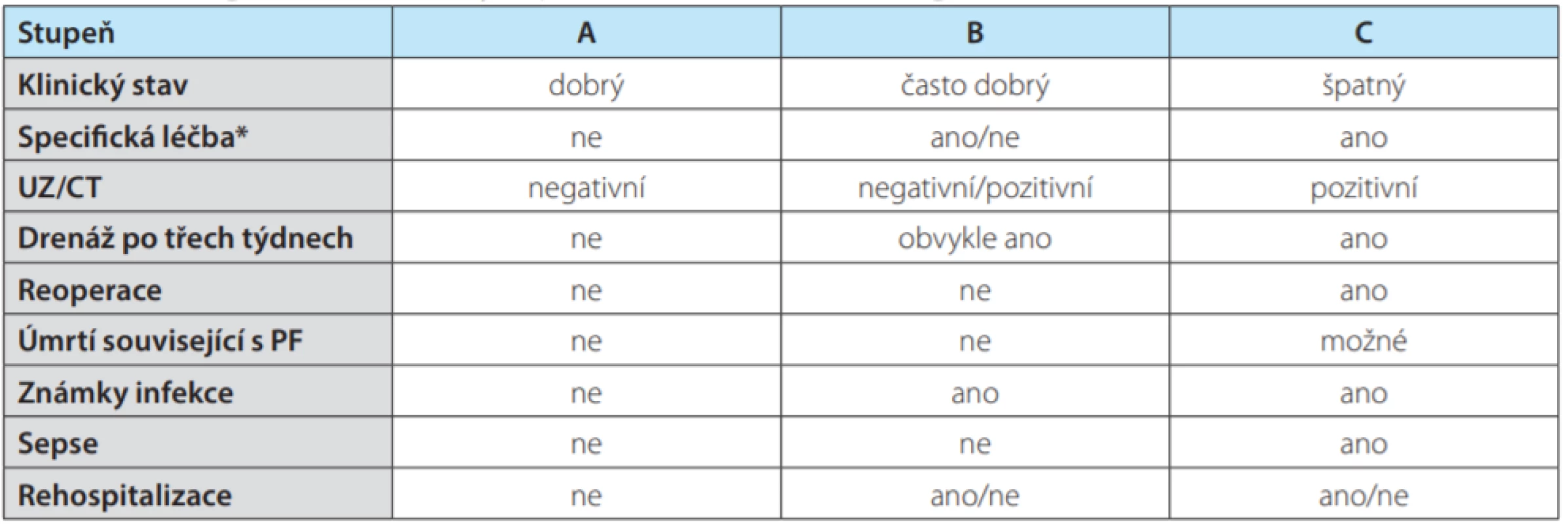
Mezi hlavní příznaky poranění pankreatu v pooperačním období patří trvalá sekrece ze zavedených drénů, v případě absence drénů jsou možnými symptomy bolest, zpomalená obnova pasáže a vyprazdňování žaludku či teplota až možný rozvoj šokového stavu (prakticky stejný klinický obraz jako při pankreatitidě). Ze zobrazovacích metod je zásadní sonografický či CT nález peripankreatických tekutinových kolekcí. Drenáž těchto kolekcí je zásadní pro zabránění vývoje pankreatické tenzní pseudocysty a zejména abscesu. Léčba je ve většině případů konzervativní – zajištění adekvátní drenáže, vynechání perorálního příjmu, parenterální či enterální výživa, případně podání antibiotik či derivátů Somatostatinu. Chirurgická léčba je indikována jen u stupně C, a to nejlépe s odstupem až po vyzrání píštěle na drénu. Metodou volby současnosti je v případě velké či sym ‑ ptomatické pseudocysty vnitřní endoskopická drenáž do žaludku eventuálně do střeva. Pro osud píštěle či pseudocysty je determinující, zda došlo při poranění slinivky k porušení Wirsungova vývodu nebo jen parenchymatózních větví. V případě tangenciálního poranění vývodu je konzervativní postup ještě nadějný, ale v případě jeho transekce je šance na spontánní zhojení nulová. V takovém případě je nutno distální část pankreatu řízeně derivovat (anastomóza na žaludek, střevo) nebo provést kompletní resekci této části.
KAZUISTIKA
Pacient, 47 let, byl indikován k radikální nefrektomii pro nález objemného tumoru levé ledviny s infiltrací zádových svalů, nádorovým trombem expandované renální žíly, postižením nadledviny a regionálních uzlin dle CT (obr. 1). Pro rozsah onemocnění byla prove ‑ dena nefrektomie s trombektomií, adrenalektomií, lymfadenektomií a sutura pankreatu pro perope ‑ rační poranění. Histologicky byl verifikován renální konvenční karcinom 200 × 110 × 120 mm, G3 s metastázou nadledviny. Od sedmého pooperačního dne pacient udával bolesti břicha, jinak byl oběhově stabilní, bez alterace celkového stavu, afebrilní, pasáž obnovena. Dle CT prokázána kolekce tekutiny v bursa omentalis (obr. 2), jinak amylázy a zánětlivé parametry byly jen přechodně zvýšené. Drény po výkonu byly bez nápadnější větší sekrece a sedmý pooperační den byly již odstraněné, proto byla provedena perkutánní drenáž pankreatické kolekce pigtailem, podán Somatostatin a enterální výživa. Následně pro trvalou pokračující pankreatickou sekreci z drénu doplněno ERCP a zaveden pankreatický stent k odlehčení sekrece, nadále konzervativní postup a propuštění pacienta. Za tři měsíce provedeno kontrolní CT s regresí tekutinové kolekce, ale nově diagnostikován metaproces jater a plic. Byla zahájena systémová onkologická léčba Sunitinibem. Jinak sekrece z drénu byla dále minimální a chirurg indikoval jeho odstranění.
Image 1. CT nález tumoru levé ledviny s nádorovým trombem renální žíly a postižením uzlin
Fig. 1. CT finding of the left kidney with tumor, tumor thrombus of the renal vein and nodal involvement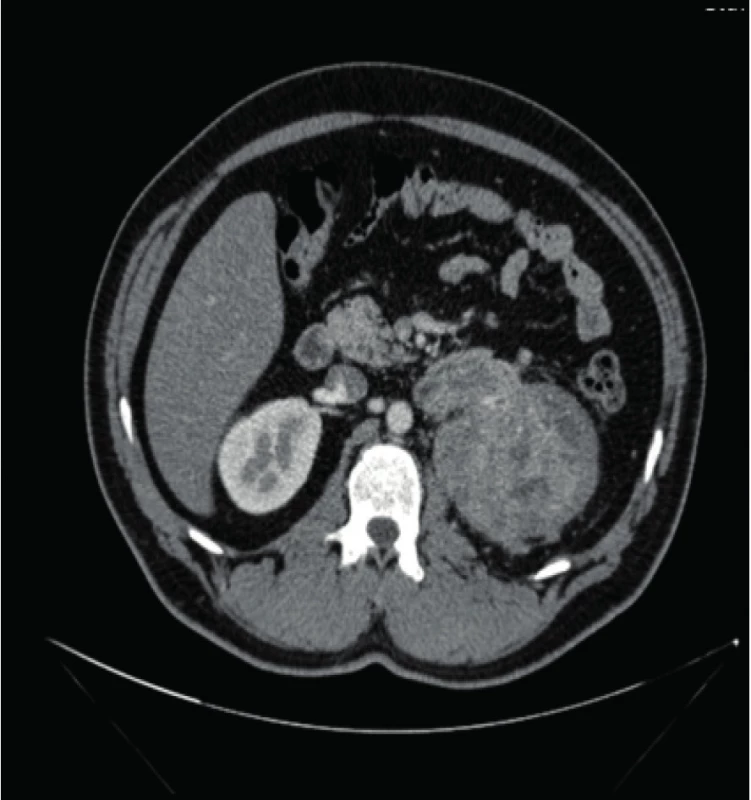
Image 2. CT nález peripankreatické tekutinové kolekce pooperačně
Fig. 2. CT finding of the peripancreatic fluid collection after surgery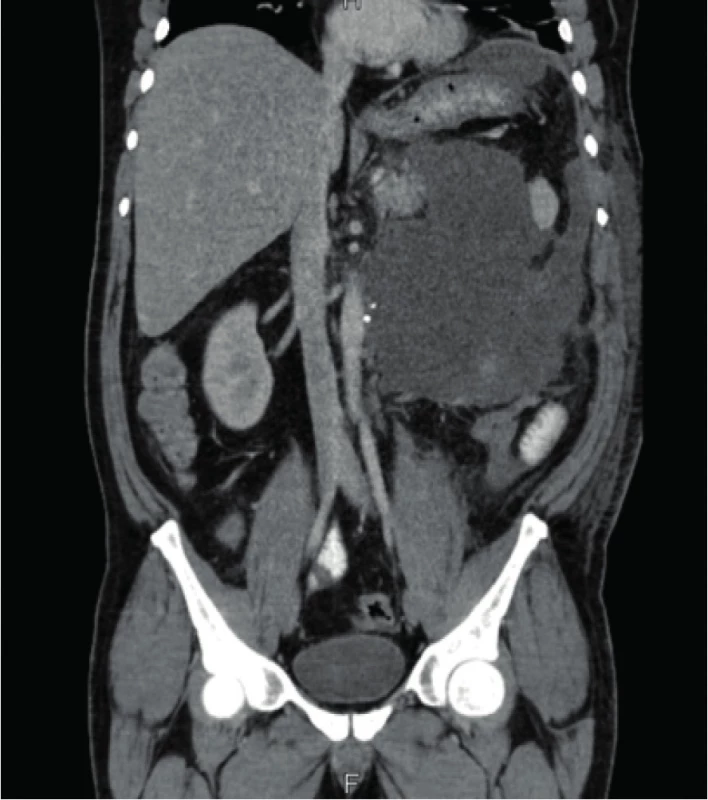
DISKUZE
Relevantními rizikovými faktory vzniku PF jsou v případě urologických výkonů velikost tumoru, možné postižení okolních orgánů, uzlinový proces a eventuálně současný zánět. Samostatnou kapitolou v případě často objemných nádorů by mohla být cytoreduktivní nefrektomie, která je i v době biologické léčby u pacientů v dobrém biologickém stavu zatím stále indikována (7). Obecně je v chirurgii riziko vzniku PF u levostranných resekcí pankreatu vyšší než u parciální pravostranné duodenopankreatektomie. V případě urologických výkonů toto riziko stoupá při současné levostranné adrenalektomii. Další faktor ovlivňující vznik PF je stav pacienta, jeho komorbidity, obezita (8) a věk (9). Důležitý je také vlastní charakter pankreatické tkáně, kdy v případě sutury tzv. „soft pankreatu“ je riziko vzniku PF až 10× vyšší než u pacientů se středním nebo tuhým pankreatem (10). Neméně významným je stav pankreatických vývodů, kdy malý nedilatovaný pankreatický vývod (do 3 mm) je pro rozvoj PF rizikovější.
Možnou prevencí zabránění poranění pankreatu je v případě urologických výkonů úplná mobilizace sleziny, a tím i pankreatu (2) – kompletní přerušení splenokolického ligamenta a maximální uvolnění lineálního ohbí tračníku. V případě poranění pan ‑ kreatu je prevencí vzniku PF technická modifikace ošetření pankreatu a to ručním přešitím pankreatu po jeho ostrém přerušení skalpelem nebo ošetření pahýlu endoskopickým lineárním staplerem (11, 12, 13, 14). Možné je rovněž podání derivátů Somatostatinu před nebo ihned po ošetření pankreatu. Z dostupné literatury toto preventivní podání není ale paušálně doporučováno a jeho preventivní užití je spíše v selektivních případech („soft pankreas“, centra s menší zkušeností ošetření pankreatu).
Konzervativní léčba PF je úspěšná u 90–95 % pacientů (15). Mimo drenáž tekutinových kolekcí bylo u levostranných resekcí pankreatu prokázáno, že zavedení stentu do pankreatického vývodu může přispět k hojení PF (16), ke zlepšení derivace je zmiňována i endoskopická sfinkterotomie Wirsungova duktu.
V případě nutnosti operační revize (stupeň C) je preferována operační drenáž před dokončením resekce či pankreatektomií. Pro technickou náročnost, ztrátu endokrinní funkce pankreatu (následného rozvoje diabetu) a vysokou letalitu není pankreatektomie doporučována mnoha autory. Mezi další operační možnosti řešení PF patří fistulojejunostomie nebo principem Juraszovy operace provedení gastrofistuloanastomózy (obrázek 3). V případě vyzrálé píštěle po 2–3 měsících lze tuto bezpečně vypreparovat, kdekoliv v místě jejího průběhu přerušit a její ústí derivovat anastomózou na žaludek či střevo. Derivace do žaludku se zpravidla provádí na zadní stěnu, kdy přes přední gastrotomii nahmatáme na zadní stěně žaludku výše popsaný kulatý drén, nad kterým provedeme podélnou zadní gastrotomii a našijeme gastrofistuloanastomózu, drén následně extrahujeme. Derivace na střevo se pak provádí nejlépe na exkludovanou kličku tenkého střeva dle Rouxe, nebo na omega kličku s Braun anastomózou.
Image 3. Gastrofistuloanastomóza
Fig. 3. Gastrofistuloanastomosis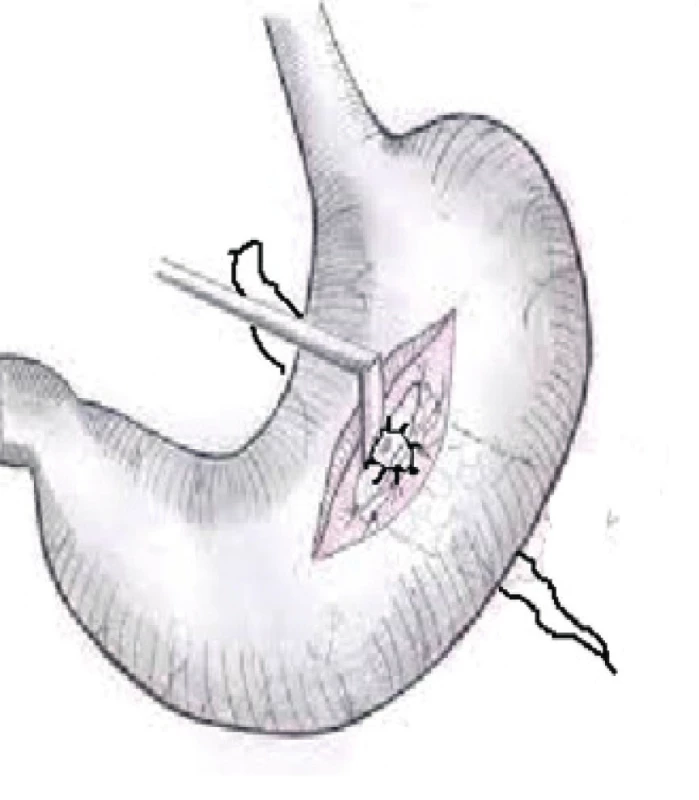
ZÁVĚR
Pankreatická píštěl po urologických výkonech v blízkosti slinivky je možnou komplikací. Jedná se o závažnou, ale řešitelnou komplikaci. Ve většině případů je léčba konzervativní bez nutnosti operace. Prezentovaný případ dokládá možnosti léčby PF stupně B. Důraz je všeobecně kladen na dostatečnou dekompresi Wirsungova vývodu, drenáž pankreatických kolekcí či pseudocyst, přechodná nutriční omezení, podporu útlumu sekrece a v neposlední řadě na pečlivou stomickou péči o ústí píštěle jako prevenci macerace kůže v důsledku agresivity pankreatické sekrece. Před definitivní operační revizí se vyplatí dostatečná časová trpělivost.
Střet zájmů: Žádný.
Prohlášení o podpoře: Autor prohlašuje, že zpraco ‑ vání článku nebylo podpořeno farmaceutickou firmou.
Došlo: 6. 5. 2020
Přijato: 18. 5. 2020
Kontaktní adresa:
MUDr. Vít Paldus
Urologické oddělení, Krajská nemocnice Liberec, a. s.
Husova 10,
460 63 Liberec
e-mail: vit.paldus@nemlib.cz
Sources
1. Varkarakis IM, Allaf ME, Bhayani SB, et al. Pancreatic injuries during laparoscopic urologic surgery. Urology 2004; 64(6): 1089–1093.
2. Bozkurt M, Can O, Altunrende F. A Pancreatic Fistula as a Rare Complication of Laparascopic Radical Nephrectomy: A Case Report. Urology Case Reports 2017; 12 : 20–22.
3. Buchler MW, Wagner M, Schmied BM, et al. Changes in morbidity after pancreatic resection: toward the end of completion pancreatectomy. Arch Surg 2003; 138 : 1310–1314.
4. Butturini G, Daskalaki D, Molinari E, et al. Pancreatic fistula: definition and current problems. J Hepatobiliary Pancreat Surg 2008; 15 : 247–251.
5. Haddad LB, Scatton O, Randone B, et al. Pancreatic fistula after pancreaticoduodenectomy: the conservative treatment of choice. HPB (Oxford) 2009; 11 : 203–209.
6. Bassi C, Dervenis C, Butturini G, et al. Postoperative pancreatic fistula: an international study group (ISGPF) definition. Surgery 2005; 138 : 8–13.
7. Hora M, Stránský P, Eret V, et al. Integrace chirurgické a biologické léčby u pokročilého renálního karcinomu. Ces Urol 2011; 15(3): 149–157.
8. Gaujoux S, Cortes A, Couvelard A, et al. Fatty pancreas and increased body mass index are risk factors of pancreatic fistula after pancreaticoduodenectomy. Surgery 2010; 148 : 15–23.
9. Matsusue S, Takeda H, Nakamura Y, Nishimura S, Koizumi S. A prospective analysis of the factors influencing pancreaticojejunostomy performed using a single method, in 100 consecutive pancreatico-duodenectomies. Surg Today 1998; 28 : 719–726.
10. Yeo CJ, Cameron JL, Lillemoe KD, et al. Does prophylactic octreotide decrease the rates of pancreatic fistula and other complications after pancreaticoduodenectomy? Results of a prospective randomized placebo‑controlled trial. Ann Surg 2000; 232 : 419–429.
11. Kleeff J, Diener MK, Z’graggen K, et al. Distal pancreatectomy: risk factors for surgical failure in 302 consecutive cases. Ann Surg 2007; 245 : 573–582.
12. Ferrone CR, Warshaw AL, Rattner DW, et al. Pancreatic fistula rates after 462 distal pancreatectomies: staplers do not decrease fistula rates. J Gastrointest Surg 2008; 12 : 1691–1697.
13. Nathan H, Cameron JL, Goodwin CR, et al. Risk factors for pancreatic leak after distal pancreatectomy. Ann Surg 2009; 250 : 277–281.
14. Reeh M, Nentwich MF, Bogoevski D, et al. High surgical morbidity following distal pancreatectomy: still an unsolved problem. World J Surg 2011; 35 : 1110–1117.
15. Kazanjian KK, Hines OJ, Eibl G, et al. Management of pancreatic fistulas after pancreaticoduodenectomy: results in 437 consecutive patients. Arch Surg 2005; 140(9): 849–855.
16. Grobmyer SR, Hunt DL, Forsmark CE, et al. Pancreatic stent placement is associated with resolution of refractory grade C pancreatic fistula after left‑sidedpancreatectomy. Am Surg 2009; 75 : 654–657.
Labels
Paediatric urologist Nephrology Urology
Article was published inCzech Urology
2020 Issue 2-
All articles in this issue
- Editorial
- Rekonstrukce bulbární uretry po rozsáhlém zánětlivém abscedujícím procesu v oblasti hráze na podkladě cizího tělesa
- Komentář k práci Drlík P, Čermák M. Rekonstrukce bulbární uretry po rozsáhlém zánětlivém abscedujícím procesu v oblasti hráze na podkladě cizího tělesa (video) Ces Urol 2020; 24(2): 90–93
- Rukou asistovaná laparoskopická adrenalektomie u objemných tumorů nadledvin
- Vyšetření cirkulujících nádorových buněk u karcinomu ledviny
- Biopsie nádorů ledvin – indikace, provedení, výsledky
- Náš přístup k diagnostice a léčbě nehmatného varlete
- Brachyterapie s vysokým dávkovým příkonem jako orgán šetřící léčba u časného karcinomu penisu
- Poranění pankreatu spojené s urologickým výkonem a možnosti řešení pankreatické píštěle
- Konverze kontinentní derivace na konduit retubularizací stěny neoveziky
- Objemný cystický lymfangiom levé nadledviny – diferenciálně diagnostický omyl
- Pandemii navzdory – Komplexní novinky v onkourologii 2020
- Přirozený proces hojení po částečné excizi glandu penisu za použití nové hemostatické náplasti VerisetTM – popis metody a prvotní pohled chirurga
- Czech Urology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Biopsie nádorů ledvin – indikace, provedení, výsledky
- Vyšetření cirkulujících nádorových buněk u karcinomu ledviny
- Přirozený proces hojení po částečné excizi glandu penisu za použití nové hemostatické náplasti VerisetTM – popis metody a prvotní pohled chirurga
- Objemný cystický lymfangiom levé nadledviny – diferenciálně diagnostický omyl
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

